Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Rat placental doğal katil hücre Cytolytic fonksiyon değerlendirilmesi için bir plaka tabanlı sitotoksisite assay
Bu Makalede
Özet
Burada, doğal katil hücrelerin sitotoksisik fonksiyonunu renkmetrik plaka tahlili ile plasenta satıyor 'dan izole etmek ve değerlendirmek için ayrıntılı bir metodoloji sağlıyoruz. Plasental iskemi azaltılmış uterus perfüzyon basınç sıçan modeli antikor aracılı yalıtım ve doğal katil hücrelerin sitotokleş fonksiyonunun değerlendirilmesi göstermek için seçildi.
Özet
Bu desidual doğal katil (NK) hücrelerin kurulması ve normal gebelik bakım kritik bir rol oynarlar bilinmektedir. Son çalışmalar, tekrarlayan düşük ve preeklampsi gibi olumsuz gebelik komplikasyonlarından muzdarip kadınlarda dolaşan ve desidual NK hücrelerinin değiştirilmiş bir nüfusunu göstermiştir. Grubumuzun çalışmaları, gebelikte hipertansiyon, yüzey aktivasyon işaretçileri ifadesine dayalı plasenta aktif NK hücrelerinin artan bir nüfus ile ilişkili olduğunu göstermiştir. Bu makalede, cerrahi olarak indüklenen plasental iskemi preeklampsi benzeri bir hayvan modelinde plasenta satıyor izole NK hücrelerinin sitotokezik fonksiyonunu değerlendirmek için ayrıntılı bir protokol sağlanmaktadır. Aşağıdaki adımlar ayrıntılı olarak açıklanmıştır: tek hücreli süspansiyon üretimi, NK hücre yalıtımı, ex vivo stimülasyon, effector: hedef hücre Co-Culture, ve sitotoksisite tahlil.
Giriş
Preeklampsi fetal büyüme kısıtlaması, son organ hasarı ve kronik bağışıklık aktivasyonu ile karakterize gebelik hipertansif bir hastalıktır. Preeklampsi olan kadınlarda kronik bağışıklık aktivasyonu artan dolaşım ve plasental inflamatuar sitokinlerin yol açar, CD4+ T hücreleri nüfus bir dengesizlik, ve aktif doğal katıl (NK) hücrelerin artan bir nüfus1. Laboratuvarımız tarafından son yayınlanan çalışmalar, preeklampsi azaltılmış uterin perfüzyon basıncı (RUPP) sıçan modelinde preeklampsi ile ilişkili bazı Patofizyoloji neden olan NK hücreleri için bir rol gösteriyor. NK hücrelerinde harekete geçirmek işaretçilerinin yüzey ifadesini ölçmek için Akış sitometrisi kullanarak, normal hamile (NP) farelerine kıyasla Rupp farelerinin dolaşım ve plasenta satıyor aktif NK hücrelerinin artan bir nüfus görüldü2.
Akış sitometri gözlemlerini onaylamak için, NP ve Rupp fareler plasenta satıyor izole NK hücrelerinin sitotokezik aktivitesini değerlendirmek için fonksiyonel çalışmalar yapıldı. Sitotoksisik CD8+ T HÜCRELERININ ve NK hücrelerinin sitotokezik fonksiyonunun değerlendirilmesi için çeşitli yöntemler mevcuttur. Fonksiyonel sitotoksisik analiz için altın standardı krom salınım tahlil3. Kullanılan diğer gelişmiş protokoller arasında akış sitometri4, görüntü sitometri5, calcein sürüm6ve en son biyolüminesans7yer aldı. Bu video, ticari olarak kullanılabilen bir LDH sitotoksisite assay kiti kullanılarak NK hücrelerinin sitotoksisik fonksiyonunu ölçmek için iyi kurulan lakdamak dehidrojenaz (LDH) serbest bırakma tahlil kullanarak ayrıntılı bir protokol sağlayacaktır.
Protokol
Tüm protokoller Mississippi Tıp Merkezi Üniversitesi 'nde kurumsal hayvan bakımı ve kullanım Komitesi tarafından onaylanmıştır. Hayvanların bakımı ve kullanımı, etik Hayvansal tedavi için Ulusal Sağlık Enstitüleri kurallarına uygun idi.
1. Placentas 'tan lenfosit hücre yalıtımı
- Bir plasenta fare uterusundan (gebelik günü 19) çıkarın ve 10 mL buz soğuk PBS8' de yerleştirin.
- Bir 100 μm filtre üzerine bir plasenta yerleştirin ve 13,5 mL RPMı ve 1,5 mL FBS içeren bir petri çanak oturmak (toplam hacmi 15 mL). Plasenta filtreden Petri tabağına itmek için bir şırınga pistonun düz tarafını kullanın.
- Her doku için 3 15 mL konik tüpler hazırlayın. Her tüp için 3 mL yoğunluk degrade Orta ( malzeme tablosunabakın) ekleyin, sonra dikkatle her tüp içine homojenize plasenta 5 ml bindirme.
- 300 x g olarak oda SıCAKLıĞıNDA (RT) frensiz 25 dk Santrifüjü. Bir transfer pipet ile ince beyaz Buffy tabakası toplayın.
Not: Santrifüjleme sonrası 3 kat görülebilir, üstte kırmızı RPMI, ortasında beyaz Buffy katmanı ve altta net yoğunluk degrade orta tabaka. Tüpten beyaz Buffy tabakasını çekmek için bir transfer pipet kullanın. Aynı plasenta tüm tüpleri 1 tüp içine Buffy tabaka birleştirin. - Buffy katmanlarını kombine etmek için 10 mL RPMı ekleyin. Santrifüjü 10 dak, 300 x g, 4 °c ' de ve supernatant atın.
2. doğal katil hücrelerinin izolasyonu
- 50 μL buz-soğuk PBS içinde resuspend hücre Pelet
- Üreticinin protokolüne göre pelleted hücrelere biotin etiketli CD3 antikor ekleyin ve iyi bir pipet ile karıştırın. Tüpü bir Tüp Rotator içine yerleştirin ve 4 °C ' de 20 dakika Inküye yapın.
- RPMı 1 mL, 400 x g ve 4 °c ' de 10 dakika Santrifüjü ekleyin ve supernatant atın.
- 1 mL RPMI içinde resuspend Pelet ve 1,5 mL mikrosantrifüj tüpte 150 μL manyetik boncuk ile birleştirin. Mikrosantrifüjün tüpünü bir Tüp Rotator 'a yerleştirin ve 4 °C ' de 30 dakika boyunca inlerken döndürün.
Not: Şu anda serbest tampon çekin ve biyogüvenlik kabine RT ulaşmak için izin verin. - Mıknatıs içinde 1 dakika için tüpler yerleştirin. süpernatant toplamak ve buz üzerinde 15 ml tüp CD3-hücre nüfusu kaydedin.
Not: Bu hücrelerin CD3- nüfus olduğunu. - Manyetik tüp çıkarın ve RPMı 1 mL ekleyin. Bir pipet ile 5 kez hücreleri ve boncukları karıştırın.
- 2,5 adımı yineleyin.
- 400 x g ve 4 °c ' de 10 dk IÇIN hücrelerin CD3- nüfusu Santrifüjü ve supernatant atın. 50 μL buz-soğuk PBS içinde hücre Pelet resuspend
- Üretici protokole göre CD3 hücrelerine biotin etiketli CD161a antikor ekleyin ve iyi karıştırın. Tüpü bir Tüp Rotator içine yerleştirin ve 4 °C ' de 20 dakika boyunca inküye yapın.
- RPMı 1 mL, 400 x g ve 4 °c ' de 10 dakika Santrifüjü ekleyin ve supernatant atın. 1 mL RPMI içinde resuspend Pelet ve 1,5 mL mikrosantrifüj tüpte 150 μL manyetik boncuk ile birleştirin.
- Mikrosantrifüj tüpünü bir Tüp Rotator içine yerleştirin ve 4 °C ' de 30 dakika boyunca inlerken döndürün.
- Tüpleri 1 dakika boyunca mıknatıslı yerleştirin. süpernatant toplayın ve CD3-/cd161a- hücreleri atın.
- Mıknatıslı tüp çıkarın ve RPMı 1 mL ekleyin. Bir pipet ile 5 kez hücreleri ve boncukları karıştırın.
- 2,12 adımı yineleyin.
- Mıknatıslı mikrosantrifüj tüpleri çıkarın ve 1 mL RT serbest bırakma tamponu ekleyin. Tube Rotator üzerinde tüp yerleştirin ve RT 15 dakika boyunca inkübe ederken döndürün.
- 1 dakika boyunca mıknatıslı yerleştirin. buz üzerinde yeni bir 15 ml konik tüp süpernatant toplayın.
Not: Bu NK hücrelerinin nüfusu. - Mıknatıslı tüpü çıkarın ve 1 mL RT RPMı ekleyin. Pipet ile 5 kez hücreleri ve boncukları karıştırın.
- Aynı tüp içinde süpernatant yerleştirerek, adım 2,16 tekrarlayın. İyi karıştırın ve hücreleri saymak için 20 μL örnek alın
Not: Tüp buz üzerinde tutun. - Santrifüjlü CD3-/Cd161a+ hücreleri 10 dak, 400 x g de 4 °c, sonra supernatant çıkarın. RPMI (% 10 FBS, 1% pen/strep, 2 ng/mL IL-2) ve tohum 3 x 105 hücreler/iyi bir 6-iyi plaka Içinde 2,5 ml NK hücre aktivasyon medya bir konsantrasyonda hücreleri resuspend. 37 °C ' de 48 h için hücreleri kuluçsa,% 5 CO2 nemlendirilmiş bir inkükote.
3. sitotoksisite tahlil: NK hücreleri veya YAC1 kültür veya Passing hücreler alma
Not: Tüm adımlar kaput altında yapılmalıdır. Tüm hücre tüpleri buz üzerinde her zaman tutulmalıdır.
- YAC1 hücre ve medya Flask toplamak için bir cam serolojik pipet kullanın, buz üzerinde bir 50 mL tüp yer, ve iyi karıştırın. Hücreleri saymak için 20 μL alın.
- 300 x g ve 4 °c ' de 10 dakika YAC1 hücrelerini döndürün. Bunlar dönmeye çalışırken hücreleri saymak.
- Her iyi bir NK hücre 6-kuyu plaka Trypsin/EDTA ekleyin. Plakaya dokunun ve inküvatör yerleştirin.
- Hücreler 37 °C ' de ~ 5 dakika için tripsin/EDTA ile inkübe edildikten sonra, plaka/Flask 'ı steril bir plaka sıyırıcı ile kazıyın. Her iyi NK Cell Media 1 mL ekleyin.
- Serolojik pipet ile hücreleri ve medyayı toplayın ve 15 mL santrifüj tüpte toplayın. Hücreleri saymak için 20 μL alın.
- NK hücrelerini 4 °C ' de 10 dakika, 400 x g 'ye döndürün. Bu santrifüjleme sırasında 3,5 adımından gelen hücrelerin örneğini saymak.
Not: Daha fazla hücre kuyuların altına yapışmış olduğundan emin olmak için onları atarak önce bir mikroskop altında kültür plakaları görüntüleyin. Deneme NK hücreleri ve YAC1 hücreleri kullandığından, her birini ayrısaytığınızdan emin olun. - Uygun hedef sayısı için test etmek için optimizasyon denemeleri belirlenen konsantrasyonlarda hücreler ve pelletini Count: effector oranı. Bu, aşağıdaki hücre konsantrasyonlarını yapmak için ilgili medyada Pelet yeniden askıya tarafından elde edilecektir: YAC1 at 4 x 105 hücreler/ml ve NK hücreleri 2 x 107 hücreler/ml.
4. sitotoksisite tahlil: tahlil Protokolü
- Bir yuvarlak alt kullanın, kültür 96-Well plaka Tablo 1' de önerilen plaka kurmak için tedavi. Bu tablo deneysel kontroller ve NK deneysel sütunların 3 setleri gösterir. Bu, 96-Well plakasında toplam 10 NK deneysel sütuna genişletilebilir.
- Test plakasını 250 x g 'de santrifüjle 4 dakika boyunca efektör ve hedef hücrelerin temas halinde olduğundan emin olun. 96-kuyu plakasını, 37 °C ' de,% 5 CO2 ' de nemlendirilmiş bir oda inkükodiye 5 saat boyunca, hedef ve efektör hücreleri ve hedef hücre liziz arasında efektör hücrelerine kadar temas sağlamak için.
Not: Protokol burada duraklatılmış olabilir. - 45 dakika önce hasat Supernatants, 10 μL 10X Lysis solüsyonu hedef hücreye maksimum LDH yayın kuyuları (Wells 1E, 1F, 1G ve 1s) ekleyin ve plaka geri nemlendirilmiş odasına yerleştirin.
- İnkübasyon süresi tamamlandıktan sonra, plakayı 250 x g 'de 4 dakika boyunca santrifüjler, çok kanallı bir pipettor kullanarak, tüm kuyulardan 50 μL plakaya yeni bir 96-iyi düz-alt assay plakaya aktarın.
Not: Hücrelerin taze tahlil plakasına transfer edilmemesi için kuyuların altına dokunmayın. Taze tahlil plaka olarak bir kültürlü tedavi plaka kullanmayın. -
Tahlil Reakajı yapın.
- Assay tampon oda sıcaklığına ulaştı sonra, bir substrat Mix şişe tahlil tampon 12 mL ekleyin. Tamamen çözülene kadar yavaşça ters çevirin ve sallayın. 2 96-kuyu plakaları için 1 şişe yeterlidir.
Not: Tahlil tampon çözülürken ışık korunmalıdır. Kullanımı hemen önce karıştırın.
- Assay tampon oda sıcaklığına ulaştı sonra, bir substrat Mix şişe tahlil tampon 12 mL ekleyin. Tamamen çözülene kadar yavaşça ters çevirin ve sallayın. 2 96-kuyu plakaları için 1 şişe yeterlidir.
- 50 adım 4,6 test plakasında tüm kuyulara assay Reakajının μL ekleyin. Işığı korumak ve oda sıcaklığında 30 dakika boyunca inküye için folyo ile plaka kapak.
Not: Yeni yapılan assay reaktif bir dondurucuda depolanmalıdır. Reakajın yaklaşık 8 hafta boyunca iyidir. - 50 μL dur çözümü her iyi ekleyin. Çözüm durdur eklendikten sonra 1 saat içinde plakayı okuyun ve 490 nm 'de emici kaydedin. Temsili veriler Tablo 2' de gösterilir.
5. sonuçların hesaplanması
- Kültür orta arkaplan kuyularından ortalama emici değerini hesaplayın ve deneysel, hedef hücre spontan LDH serbest bırakılması ve effector Cell spontan LDH Release Wells için tüm emici değerlerden çıkarın.
- Birim düzeltme kontrol kuyuları için Ortalama emici değerlerini hesaplayın ve hedef hücre maksimum LDH serbest bırakma kontrolü kuyuları için elde edilen emici değerlerden çıkarın.
- Her efektör için yüzde sitotoksisite hesaplamak için aşağıdaki formülde Steps 5,1 ve 5,2 düzeltilmiş değerleri kullanın: hedef iyi.
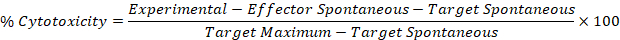
Sonuçlar
NP ve RUPP farelerinden elde edilen placental NK hücreler, 50:1 (NK: Target) oranındaki hedef hücreler ile ilgili Medias 'da 5 h için inkübe edildi. Emici 490 nm 'de kaydedildi ve ham veriler Tablo 2' de gösterilir. Kültür orta arka plan ve hacim düzeltme kontrol kuyuları ortalama absorbans hesaplanmıştır. Bu ortalamalar, üreticinin protokolünde belirtilen uygun kuyulardan çıkarılır ve Tablo 3' te temsil edilir. Düzeltilmiş değerler daha sonra üretici tarafından s...
Tartışmalar
En iyi sonuçlar için dikkate alınması gereken önemli notlar bir dizi vardır. Kullanılan hücrelerin sterilitesi çok önemlidir. Plasentanın toplanması sonrasında, NK hücrelerinin hazırlanması ve yalıtımının Biyogüvenlik kabininde steril koşullarda gerçekleştirilmesi önemlidir. Ayrıca, hücresel hasar üzerine tüm hücreler LDH serbest olduğundan, yalıtım sonra ve Co-Culture sürecinde NK hücrelerinin yüksek bir canlılığı elde etmek için bakım alınmalıdır. NK hücrelerinden çok fazl...
Açıklamalar
Herhangi bir faiz, mali veya başka bir çatışma, yazarlar tarafından ilan edilir.
Teşekkürler
Bu çalışma, Ulusal kalp akciğer ve kan Enstitüsü Sağlık Ulusal Enstitüleri tarafından Grant R00HL130456, Ulusal Sağlık Enstitüsü Genel Tıp Bilimleri Ulusal sağlığı Enstitüleri tarafından ödül P20GM104357 altında, ve tarafından desteklenmektedir Mississippi ıNBRE, bir kurumsal Kalkınma Ödülü tarafından finanse (fikir) genel Tıp Bilimleri Ulusal Enstitüsü Sağlık Ulusal Enstitüleri hibe numarası P20GM103476 altında. İçerik sadece yazarlar sorumluluğundadır ve mutlaka Ulusal Sağlık Enstitüleri resmi görüşlerini temsil etmez.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Fisher | 5408129 | |
| 100 µL Filter | Fisher | 22363549 | Nylon Mesh |
| 15 mL conical tube | Fisher | 0553859A | |
| 3 mL syringe | Fisher | 14823436 | |
| 50 mL conical tube | Fisher | 7203510 | |
| 6-well cell culture plate | Corning | 720083 | |
| 96-well Tissue Culture Plate | CELLTREAT | 229190 | Sterile, Round Bottom |
| AOPI | Nexcelom | CS201065ML | |
| Cell scraper | Fisher | 8100241 | |
| Cellometer Disposable Counting Chambers | Nexcelom | CHT4-SD100 | |
| Cellometer Vision Image Cytometer | Nexcelom | N/A | |
| Cytotox 96 Non-Radioactive Cytotoxicity Assay Kit | Promega | G1780 | |
| Dynabeads Flowcomp Flexi Kit | Invitrogen | 11061D | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| EDTA | Sigma Aldrich | EDS-100G | |
| FBS | Atlanta Biologicals | S11150H | |
| Flow Cytometry Tube | Corning | 352008 | |
| Lymphoprep | Fisher | NC0460539 | Density gradient medium; 4 x 250 mL |
| PBS | Fisher | SH3025801 | 10 x 500 mL |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Petri dishes | Fisher | 9720500 | Without Pad |
| Purified Mouse anti-Rat CD161a | BD Biosciences | 555006 | |
| Purified Mouse anti-Rat CD3 | BD Biosciences | 554829 | |
| Recombinant Rat IL-2 | R&D Systems | 502-RL | |
| RPMI | Gibco | 11875135 | 1640 Medium |
| T25 flask | Corning | 430639 | |
| Trypsin | ThermoFisher | 15090046 | |
| YAC-1 cell | ATCC | TIB-160 |
Referanslar
- Cornelius, D. C., Cottrell, J., Amaral, L. M., LaMarca, B. Inflammatory Mediators: A causal link to hypertension during pregnancy- Studies in Preeclampsia. British Journal of Pharmacology. , (2018).
- Elfarra, J., et al. Natural killer cells mediate pathophysiology in response to reduced uterine perfusion pressure. Clinical Science. 131 (23), 2753-2762 (2017).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14 (2), 181-196 (1968).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. Journal of Immunological Methods. 325 (1-2), 51-66 (2007).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), 0141074 (2015).
- Neri, S., Mariani, E., Meneghetti, A., Cattini, L., Facchini, A. Calcein-acetyoxymethyl cytotoxicity assay: standardization of a method allowing additional analyses on recovered effector cells and supernatants. Clinical and Diagnostic Laboratory Immunology. 8 (6), 1131-1135 (2001).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), 89357 (2014).
- Caporossi, C., Nogueira, P. L., Marques, J. C., Assis, R. M., Aguilar-Nascimento, J. E. Validation of the gastroschisis experimental model and the influence of the mother's diet enriched with glutamine in the fetal morphology. Acta Cirúrgica Brasileira. 29 (3), 158-165 (2014).
- Lv, L. H., et al. Functional distinction of rat liver natural killer cells from spleen natural killer cells under normal and acidic conditions in vitro. Hepatobiliary and Pancreatic Diseases International. 11 (3), 285-293 (2012).
- Flieger, D., et al. A novel non-radioactive cellular cytotoxicity test based on the differential assessment of living and killed target and effector cells. Journal of Immunological Methods. 180 (1), 1-13 (1995).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Annals of Clinical Laboratory Science. 42 (1), 42-49 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır