Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
На основе пластины цитотоксичность анализ для оценки крысы плацентарной естественной клетки убийцы Цитолитические функции
В этой статье
Резюме
Здесь мы предоставляем подробную методологию, чтобы изолировать и оценить цитотоксическую функцию естественных киллеров из плаценты с помощью цветометрического анализа пластины. Снижение маточных перфузионного давления крысы модель плацентарного, был выбран, чтобы продемонстрировать антитело-опосредованной изоляции и оценки цитотоксической функции естественных клеток убийцы.
Аннотация
Хорошо известно, что децидвойные естественные клетки убийцы (НК) играют решающую роль в установлении и поддержании нормальной беременности. Недавние исследования продемонстрировали измененную популяцию циркулирующих и децидуальных НК-клеток у женщин, страдающих от неблагоприятных осложнений беременности, таких как рецидивирующий выкидыш и преэклампсия. Исследования, проведенные нашей группой, показали, что гипертония при беременности связана с увеличением популяции активированных НК-клеток в плаценте на основе экспрессии маркеров поверхностной активации. Данная рукопись представляет собой подробный протокол для оценки цитотоксической функции НК-клеток, изолированных от плаценты в виде животной модели хирургически индуцированной плацентарной иоэклампсии. Ниже описаны следующие этапы: Генерация одноклеточной суспензии, НК-клеточная изоляция, стимуляция в естественных условиях, эффектор: Целевая клеточная сокультура и цитотоксичность.
Введение
Преэклампсия-гипертензивное расстройство беременности, характеризующееся ограничением роста плода, повреждением конечного органа и хронической иммунной активацией. Хроническая иммунная активация у женщин с преэклампсией приводит к увеличению циркулирующих и плацентарных воспалительных цитокинов, дисбаланс в CD4+ т-клеток населения, и увеличение популяции активированных естественных киллеров (НК) клеток1. Исследования, недавно опубликованные нашей лабораторией, демонстрируют роль НК-клеток в возникновении некоторых патофизиологии, ассоциируемых с преэклампсией в «уменьшении давления маточных перфузии» (Рапп), модели преэклампсии. Использование потока цитометрии для измерения поверхностного выражения маркеров активации на НК-клеток, увеличение популяции активированных НК-клеток в обращении и плаценты Рапп крыс по сравнению с нормальным беременных (НП) крысы наблюдались2.
Для подтверждения наблюдений за потоком цитометрии были выполнены функциональные исследования для оценки цитотоксической активности НК-клеток, выделенных из плаценты НП и крыс РУППП. Существует несколько методов оценки цитотоксической функции цитотоксических CD8+ т-клеток и НК-клеток. Золотым стандартом функционального цитотоксического анализа является анализ высвобождения хрома3. Другие разработанные протоколы, используемые включают поток цитометрия4, изображение цитометрии5, calcein релиз6, и совсем недавно биолюминесценции7. Это видео будет предоставлять подробный протокол об использовании хорошо наладившейся лактата дегидрогеназы (LDH) релиз анализа для измерения цитотоксической функции НК-клеток с использованием коммерчески доступных LDH цитотоксичность анализа комплекта.
протокол
Все протоколы были одобрены институциональным Комитетом по уходу и использованию животных в медицинском центре Университета Миссисипи. Уход и обработка животных были в согласии с национальными институтами здоровья руководящие принципы для этичного лечения животных.
1. изоляция клеток лимфоцитов от плаценты
- Удалите одну плаценту от крысиной матки (день беременности 19) и поместите в 10 мл ледяной PBS8.
- Поместите одну плаценту на фильтр 100 мкм и сядьте в чашку Петри, содержащую 13,5 мл RPMI и 1,5 мл ФПС (общий объем 15 мл). Использование плоской стороне шприц поршень, чтобы подтолкнуть плаценту через фильтр в чашку Петри.
- Подготовьте 3 15 mL конические трубы для каждой ткани. Добавьте 3 mL градиент плотности среднего (см. таблицу материалов) к каждой трубке, после этого тщательно наложи 5 мл однородности плаценты в каждую трубку.
- Центрифуга на 25 мин при температуре 300 х г при комнатной температуры (RT) без тормозов. Соберите тонкий белый охристым слоем с передачей пипетки.
Примечание: После центрифугирования, 3 слоя видны, красный RPMI наверху, белый охристые слои в середине, и четкий градиент плотности среднего слоя внизу. Используйте передачу пипетки, чтобы подтянуть белый охристые слой из трубки. Комбинат Баффи слой из всех труб из той же плаценты в 1 трубу. - Добавьте 10 мл RPMI в комбинированные охристые слои. Центрифуга на 10 мин, 300 х г, при температуре 4 °c, и отказаться от супернатант.
2. изоляция естественных клеток убийцы
- Ресуспензируем ячейки гранул в 50 мкл ледяной PBS
- Добавить биотин-маркировку CD3 антитела к гранулированных клеток в соответствии с протоколом производителя и хорошо перемешать с пипетки. Поместите трубку в трубку ротатора и инкубации 20 мин при температуре 4 ° c.
- Добавьте 1 мл RPMI, центрифугу на 10 мин при 400 х г и 4 °c и откажитесь от супернатант.
- Ресуспензируем гранулы в 1 мл RPMI и сочетать с 150 мкл магнитных бусин в 1,5 мл трубки микроцентрифуги. Поместите пробирку микроцентрифуги в трубку ротатора и вращайте при инкубации в течение 30 минут при температуре 4 ° c.
Примечание: В это время вытащите буфер высвобождения и позвольте достичь RT в кабинете биобезопасности. - Поместите трубы в магнит на 1 мин. Соберите супернатант и сохраните населенность CD3-клетки в пробке 15 ml на льдах.
Примечание: Это CD3- популяция клеток. - Снимите трубку с магнита и добавьте 1 мл RPMI. Смешайте клетки и бисер 5 раз с пипетки.
- Повторите шаг 2,5.
- Центрифуга CD3- популяции клеток в течение 10 мин при температуре 400 х г и 4 °c и сбросьте supernatant. Ресуспензируем ячейки гранулы в 50 мкл ледяной PBS
- Добавить биотин-помечены антитела CD161a к CD3- клеток в соответствии с протоколом производителя и хорошо перемешать. Поместите трубку в трубке ротатора и инкубировать в течение 20 минут при температуре 4 ° c.
- Добавьте 1 мл RPMI, центрифугу на 10 мин при 400 х г и 4 °c и откажитесь от супернатант. Ресуспензируем гранулы в 1 мл RPMI и сочетать с 150 мкл магнитных бусин в 1,5 мл трубки микроцентрифуги.
- Место трубки микроцентрифуга в трубке ротатора и вращать при инкубации в течение 30 минут при температуре 4 ° c.
- Поместите трубки в магнит на 1 мин. Соберите супернатант и выбросите CD3-/Cd161a- клетки.
- Снимите трубку с магнита и добавьте 1 мл RPMI. Смешайте клетки и бисер 5 раз с пипетки.
- Повторите шаг 2,12.
- Удалите трубки микроцентрифуг из магнита и добавьте 1 мл буфера выпуска RT. Место трубки на трубе ротатора и вращать при инкубации в течение 15 минут на RT.
- Поместите трубы в магнит на 1 мин. Соберите супернатант в новой 15 мл конической трубки на льду.
Примечание: Это население НК-клеток. - Снимите трубку с магнита и добавьте 1 мл RT RPMI. Смешайте клетки и бисер 5 раз с пипетки.
- Повторите шаг 2,16, поместив супернатант в той же трубе. Хорошо перемешать и взять 20 мкл образец для подсчета клеток
Примечание: Держите трубку на льду. - Центрифуга CD3-/Cd161a+ ячейки для 10 мин, 400 х г при температуре 4 °c, затем удалите supernatant. Ресуспензируем клетки в RPMI (10% ФБС, 1% пен/стрептококк, 2 нг/мл IL-2) и семян при концентрации 3 х 105 клеток/хорошо в 6-хорошо пластины в 2,5 мл НК активации ячейки Media. Инкубировать клетки для 48 h на 37 °C, 5% CO2 в увлажненный инкубатор.
3. цитотоксичность анализ: извлечение НК-клеток или YAC1 от культуры или прохождения клеток
Примечание: Все шаги должны быть проведены под капотом. Все клеточные трубки должны храниться на льду во все времена.
- Используйте стекло серологических пипетки собрать YAC1 клеток и средств массовой информации из колбы, место в 50 ml трубки на льду, и хорошо перемешать. Возьмите 20 мкл для подсчета клеток.
- Спин YAC1 клеток в течение 10 минут при 300 х г и 4 °c. Считайте ячейки, пока они вращаются.
- Добавить трипсин/ЭДТА к каждому хорошо в НК ячейки 6-хорошо пластины. Нажмите на тарелку и поместите в инкубатор.
- После клетки инкубировали с трипсин/ЭДТА для ~ 5 мин при температуре 37 ° c, царапать пластины/фляжка с стерильной пластины скребком. Добавить 1 мл НК ячейки средств массовой информации для каждого хорошо.
- Сбор клеток и средств массовой информации с серологических пипетки и собирать в 15 мл трубки центрифуги. Возьмите 20 мкл для подсчета клеток.
- Спин НК-клеток в течение 10 мин, 400 х г при температуре 4 °c. Подсчитайте образец ячеек из шага 3,5 во время этого центрифугирования.
Примечание: Вид культуры пластин под микроскопом, прежде чем выбросить их, чтобы убедиться, есть не больше клеток, привязаны к нижней части скважин. Так как эксперимент использует НК-клетки и YAC1 клетки, обязательно считайте каждый отдельно. - Подсчитывайте клетки и ресуспензируем на концентрациях, определяем при оптимизации испытаний для проверки соответствующего количества цели: коэффициент эффектора. Это будет достигнуто путем повторного приостановления гранулы в соответствующих средствах массовой информации, чтобы сделать следующую ячейку концентрации: YAC1 на 4 х 105 клеток/мл и НК-клеток при 2 х 107 клеток/мл.
4. цитотоксичность анализ: Протокол анализа
- Использование круглого дна, культуры лечение 96-хорошо пластины для установки пластины, как это предлагается в таблице 1. В этой таблице показаны экспериментальные элементы управления и 3 комплекта экспериментальных колонн НК. Это может быть расширена в общей сложности 10 НК экспериментальных колонн в 96-хорошо пластины.
- Центрифуга Пробирной пластины на 250 x g в течение 4 минут, чтобы быть уверенным, что Эффектор и целевые клетки находятся в контакте. Инкубировать 96-хорошо пластины в течение 5 часов в увлажненный инкубатор камеры при 37 ° c, 5% CO2 для достижения достаточного контакта между целью и эффекторных клеток и лизиза целевой клетки эффекторных клеток.
Примечание: Протокол может быть приостановлен здесь. - 45 мин до уборки supernatants, добавить 10 мкл 10x лизиса решение целевой ячейки максимальная LDH-релиз скважин (Уэллс 1E, 1E, 1E, и 1E) и поместите пластину обратно в увлажненный камеры.
- После завершения инкубации, центрифуга пластины на 250 x g в течение 4 мин. с помощью мультиканально-трубопроводного, передача 50 мкл aliquототы из всех скважин на свежий 96-хорошо плоско-дно Пробирной пластины.
Примечание: Не прикасайтесь к дну скважин так, чтобы клетки не передавались в свежую пластину пробирки. Не используйте культивируемые пластины, как свежие пластины анализа. -
Сделать анализ реагента.
- После анализа буфера достигла комнатной температуры, добавить 12 мл пробирного буфера в один субстрат Mix бутылку. Инвертировать и трясти осторожно, пока полностью не растворится. 1 бутылка достаточно для 2 96-хорошо пластин.
Примечание: Анализ буфера должны быть защищены от света во время оттаивания. Смешайте непосредственно перед использованием.
- После анализа буфера достигла комнатной температуры, добавить 12 мл пробирного буфера в один субстрат Mix бутылку. Инвертировать и трясти осторожно, пока полностью не растворится. 1 бутылка достаточно для 2 96-хорошо пластин.
- Добавить 50 мкл пробирного реагента ко всем скважинами в пластине пробирки от шага 4,6. Обложка пластины с фольгой, чтобы защитить его от света и инкубировать в течение 30 минут при комнатной температуре.
Примечание: Недавно сделанный анализ реагента должен храниться в морозильной камере. Реагент хорошо в течение примерно 8 недель. - Добавьте 50 мкл стоп-решения каждому хорошо. Прочитайте тарелку в течение 1 часа после добавления стоп-решения и запишите всасывающей абсорбту на 490 Нм. Репрезентативные данные отображаются в таблице 2.
5. расчет результатов
- Вычислить среднее значение поглощения от культуры средних фоновых скважин и вычитания из всех значений поглощения для экспериментальных, Целевая ячейка спонтанного релиз LDH и Эффэкторных клеток спонтанных скважин LDH релиз.
- Расчет средних значений абсорбционной для регулировки громкости для управления скважинами и вычитания из значений поглощения, приобретенных для максимального количества LDH-контроля скважин для целевой ячейки.
- Используйте исправленные значения от шагов 5,1 и 5,2 в следующей формуле, чтобы вычислить процент цитотоксичности для каждого эффектора: цель хорошо.
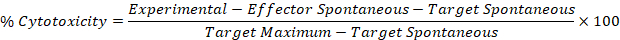
Результаты
Плацентарные НК-клетки, полученные от ПР и РУППА крысы инкубировали в течение 5 ч с целевыми клетками в соответствующих средах в соотношении 50:1 (НК: цель). Абсорбта была записана в 490 Нм, а исходные данные показаны в таблице 2. Рассчитывались средние показатели абсорбцией культур?...
Обсуждение
Существует ряд важных ключевых заметок для рассмотрения для достижения оптимальных результатов. Стерильность используемых клеток очень важна. После сбора плаценты важно, чтобы подготовка и изоляция НК-клеток выполняли в стерильных условиях в кабинете биобезопасности. Кроме того, пос...
Раскрытие информации
Никакие конфликты интересов, финансовые или иные, не объявляются авторами.
Благодарности
Эта работа была поддержана национального института легких и крови Институт национальных институтов здравоохранения в соответствии с грантом R00HL130456, Национальный институт общих медицинских наук национальных институтов здравоохранения под награду P20GM104357, и Миссисипи ИНБРЕ, финансируемых за счет институционального развития премии (идея) из Национального института общих медицинских наук национальных институтов здравоохранения на грант номер P20GM103476. Содержание является исключительно ответственностью авторов и не обязательно представляет официальные взгляды национальных институтов здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Fisher | 5408129 | |
| 100 µL Filter | Fisher | 22363549 | Nylon Mesh |
| 15 mL conical tube | Fisher | 0553859A | |
| 3 mL syringe | Fisher | 14823436 | |
| 50 mL conical tube | Fisher | 7203510 | |
| 6-well cell culture plate | Corning | 720083 | |
| 96-well Tissue Culture Plate | CELLTREAT | 229190 | Sterile, Round Bottom |
| AOPI | Nexcelom | CS201065ML | |
| Cell scraper | Fisher | 8100241 | |
| Cellometer Disposable Counting Chambers | Nexcelom | CHT4-SD100 | |
| Cellometer Vision Image Cytometer | Nexcelom | N/A | |
| Cytotox 96 Non-Radioactive Cytotoxicity Assay Kit | Promega | G1780 | |
| Dynabeads Flowcomp Flexi Kit | Invitrogen | 11061D | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| EDTA | Sigma Aldrich | EDS-100G | |
| FBS | Atlanta Biologicals | S11150H | |
| Flow Cytometry Tube | Corning | 352008 | |
| Lymphoprep | Fisher | NC0460539 | Density gradient medium; 4 x 250 mL |
| PBS | Fisher | SH3025801 | 10 x 500 mL |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Petri dishes | Fisher | 9720500 | Without Pad |
| Purified Mouse anti-Rat CD161a | BD Biosciences | 555006 | |
| Purified Mouse anti-Rat CD3 | BD Biosciences | 554829 | |
| Recombinant Rat IL-2 | R&D Systems | 502-RL | |
| RPMI | Gibco | 11875135 | 1640 Medium |
| T25 flask | Corning | 430639 | |
| Trypsin | ThermoFisher | 15090046 | |
| YAC-1 cell | ATCC | TIB-160 |
Ссылки
- Cornelius, D. C., Cottrell, J., Amaral, L. M., LaMarca, B. Inflammatory Mediators: A causal link to hypertension during pregnancy- Studies in Preeclampsia. British Journal of Pharmacology. , (2018).
- Elfarra, J., et al. Natural killer cells mediate pathophysiology in response to reduced uterine perfusion pressure. Clinical Science. 131 (23), 2753-2762 (2017).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14 (2), 181-196 (1968).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. Journal of Immunological Methods. 325 (1-2), 51-66 (2007).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), 0141074 (2015).
- Neri, S., Mariani, E., Meneghetti, A., Cattini, L., Facchini, A. Calcein-acetyoxymethyl cytotoxicity assay: standardization of a method allowing additional analyses on recovered effector cells and supernatants. Clinical and Diagnostic Laboratory Immunology. 8 (6), 1131-1135 (2001).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), 89357 (2014).
- Caporossi, C., Nogueira, P. L., Marques, J. C., Assis, R. M., Aguilar-Nascimento, J. E. Validation of the gastroschisis experimental model and the influence of the mother's diet enriched with glutamine in the fetal morphology. Acta Cirúrgica Brasileira. 29 (3), 158-165 (2014).
- Lv, L. H., et al. Functional distinction of rat liver natural killer cells from spleen natural killer cells under normal and acidic conditions in vitro. Hepatobiliary and Pancreatic Diseases International. 11 (3), 285-293 (2012).
- Flieger, D., et al. A novel non-radioactive cellular cytotoxicity test based on the differential assessment of living and killed target and effector cells. Journal of Immunological Methods. 180 (1), 1-13 (1995).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Annals of Clinical Laboratory Science. 42 (1), 42-49 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены