É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um ensaio de citotoxicidade à base de placas para a avaliação da função citolítica de células assassinas naturais do rato
Neste Artigo
Resumo
Aqui, nós fornecemos uma metodologia detalhada para isolar e avaliar a função citotóxica de pilhas naturais do assassino das placentas por um ensaio colorimétrico da placa. O modelo reduzido de rato de pressão de perfusão uterina de isquemia placentária foi escolhido para demonstrar o isolamento e a avaliação mediada por anticorpos da função citotóxica de células assassinas naturais.
Resumo
É sabido que as pilhas decidual natural do assassino (NK) jogam um papel crítico no estabelecimento e na manutenção da gravidez normal. Estudos recentes demonstraram uma população alterada de células NK circulantes e decidual em mulheres que sofrem de complicações adversas da gravidez, como aborto espontâneo e pré-eclampsia. Os estudos de nosso grupo mostraram que a hipertensão na gravidez é associada com um aumento da população de pilhas NK ativadas na placenta baseada na expressão de marcadores de ativação de superfície. Este manuscrito fornece um protocolo detalhado para avaliar a função citotóxica de pilhas de NK isoladas das placentas em um preeclampsia-como o modelo animal da isquemia placentária cirùrgica induzida. As seguintes etapas são descritas em detalhe: geração da única suspensão da pilha, isolação da pilha de NK, estimulação ex vivo, Effector: cocultura da pilha de alvo, e o ensaio da citotoxicidade.
Introdução
A pré-eclâmpsia é uma doença hipertensiva da gravidez caracterizada por restrição de crescimento fetal, dano de órgão final e ativação imune crônica. A ativação imune crônica em mulheres com pré-eclampsia leva a aumento das citocinas inflamatórias circulantes e placentárias, um desequilíbrio nas populações de células T CD4+ e uma população aumentada de células de Killer natural (NK) ativadas1. Os estudos publicados recentemente por nosso laboratório demonstram um papel para pilhas de NK em causar alguma da patofisiologia associada com o pré-eclâmpsia no modelo reduzido do rato da pressão de perfusão uterine (Rupp) do pré-eclâmpsia. Utilizando-se a citometria de fluxo para medir a expressão superficial dos marcadores de ativação nas células NK, observou-se aumento da população de células NK ativadas na circulação e placentas de ratos RUPP comparados aos ratos gestantes normais (NP)2.
Para confirmar as observações de citometria de fluxo, foram realizados estudos funcionais para avaliar a atividade citotóxica de células NK isoladas das placentas dos ratos NP e RUPP. Existem vários métodos disponíveis para a avaliação da função citotóxica de células T citotóxicas CD8+ e células NK. O padrão-ouro para análise citotóxica funcional é o ensaio de liberação de cromo3. Outros protocolos desenvolvidos utilizados incluem citometria de fluxo4, citometria de imagem5, liberação de calceina6e, mais recentemente, bioluminescência7. Este vídeo fornecerá um protocolo detalhado em usar o ensaio bem estabelecido da liberação do desidrogenase do lactato (LDH) para medir a função citotóxica de pilhas de NK usando um jogo comercialmente disponível do ensaio da citotoxicidade de LDH.
Protocolo
Todos os protocolos foram aprovados pelo Comitê institucional de cuidados e uso de animais do centro médico da Universidade do Mississippi. O cuidado e manuseio dos animais estavam de acordo com as diretrizes do National Institutes of Health para o tratamento ético dos animais.
1. isolação da pilha do linfócito de placentas
- Remova uma placenta do útero do rato (dia 19 da gestação) e coloc em 10 mL de PBS gelo-frio8.
- Coloque uma placenta num filtro de 100 μm e sente-se numa placa de Petri contendo 13,5 mL de RPMI e 1,5 mL de FBS (o volume total é de 15 mL). Use o lado plano de um êmbolo da seringa para empurrar a placenta através do filtro na placa de Petri.
- Prepare 3 15 mL de tubos cônicos para cada tecido. Adicionar 3 mL de gradiente de densidade médio (ver tabela de materiais) para cada tubo, em seguida, cuidadosamente sobrepor 5 ml de placenta homogeneizada em cada tubo.
- Centrifugador por 25 min a 300 x g à temperatura ambiente (RT) sem travão. Colete a fina camada branca de Buffy com uma pipeta de transferência.
Nota: Após a centrifugação, 3 camadas são visíveis, o RPMI vermelho na parte superior, a camada de Buffy branca no meio, e a camada clara do meio gradiente de densidade na parte inferior. Use uma pipeta de transferência para puxar para cima a camada de Buffy branco do tubo. Combine a camada Buffy de todos os tubos da mesma placenta em 1 tubo. - Adicione 10 mL de RPMI a camadas Buffy combinadas. Centrifugador por 10 min, 300 x g, a 4 ° c e descarte o sobrenadante.
2. isolação de pilhas naturais do assassino
- Reressuscita a pelota da pilha em 50 μL de PBS Ice-Cold
- Adicione o anticorpo CD3 biotina-etiquetado às pilhas peletizadas de acordo com o protocolo do fabricante e misture bem com uma pipeta. Coloc o tubo em um rotator do tubo e incubar 20 minutos em 4 ° c.
- Adicione 1 mL de RPMI, centrifugue por 10 min a 400 x g e 4 ° c e descarte o sobrenadante.
- Resuspend pellet em 1 mL de RPMI e combine com 150 μL de grânulos magnéticos em um tubo de microcentrífuga de 1,5 mL. Coloc o tubo do microcentrifugador em um rotator do tubo e gire-o ao incuar por 30 minutos em 4 ° c.
Nota: Retire o tampão de libertação neste momento e deixe-o chegar ao RT no gabinete de biossegurança. - Coloque os tubos no íman durante 1 min. colete sobrenadante e salve a população de células CD3 em um tubo de 15 mL no gelo.
Nota: Esta é a população CD3 das células. - Retire o tubo do íman e adicione 1 mL de RPMI. Misture as células e os grânulos 5 vezes com uma pipeta.
- Repita o passo 2,5.
- Centrifugue a população CD3 de células por 10 min a 400 x g e 4 ° c e descarte o sobrenadante. Ressuscita a pelota da pilha em 50 μL de PBS Ice-Cold
- Adicione o anticorpo CD161a biotina-etiquetado às células CD3de acordo com o protocolo do fabricante e misture bem. Coloc o tubo em um rotator do tubo e incubar por 20 minutos em 4 ° c.
- Adicione 1 mL de RPMI, centrifugue por 10 min a 400 x g e 4 ° c e descarte o sobrenadante. Resuspend pellet em 1 mL de RPMI e combine com 150 μL de grânulos magnéticos em um tubo de microcentrífuga de 1,5 mL.
- Coloc o tubo do microcentrifugador em um rotator do tubo e gire-o ao incuar por 30 minutos em 4 ° c.
- Coloque os tubos em um ímã por 1 min. colete sobrenadante e descarte células CD3-/Cd161a.
- Retire o tubo do íman e adicione 1 mL de RPMI. Misture as células e os grânulos 5 vezes com uma pipeta.
- Repita o passo 2,12.
- Retire os tubos de microcentrífuga do íman e adicione 1 mL de tampão de libertação RT. Coloc o tubo no rotator do tubo e gire-o ao incuating por 15 minutos em RT.
- Coloque os tubos em ímã por 1 min. colete sobrenadante em um novo tubo cônico de 15 mL no gelo.
Nota: Esta é a população de células NK. - Retire o tubo do íman e adicione 1 mL de RT RPMI. Misture as células e os grânulos 5 vezes com pipeta.
- Repita o passo 2,16, colocando sobrenadante no mesmo tubo. Misture bem e tome uma amostra de 20 μL para contar as células
Nota: Mantenha o tubo no gelo. - Centrifugue CD3-/Cd161a+ Cells para 10 minutos, 400 x g em 4 ° c, a seguir remova o sobrenadante. Ressuscite as células em RPMI (10% FBS, 1% Pen/strep, 2 ng/mL IL-2) e semente em uma concentração de 3 x 105 células/bem em uma placa de 6 poços em 2,5 ml de NK Cell Activation Media. Incubar células para 48 h a 37 ° c, 5% CO2 em uma incubadora humidificada.
3. ensaio de citotoxicidade: Recuperando células NK ou YAC1 de cultura ou células de passagem
Nota: Todos os passos devem ser conduzidos o capô. Todos os tubos de células devem ser mantidos no gelo em todos os momentos.
- Use um Pipet sorológicos de vidro para coletar YAC1 pilhas e meios da garrafa, coloc em um tubo de 50 ml no gelo, e misture bem. Tome 20 μL para contar as células.
- Gire as células YAC1 por 10 min a 300 x g e 4 ° c. Contagem de células enquanto estes estão girando.
- Adicionar Trypsin/EDTA para cada poço em uma célula NK 6-placa bem. Bata a placa e coloc na incubadora.
- Depois que as pilhas incubadas com Trypsin/EDTA para ~ 5 minutos em 37 ° c, raspe a placa/frasco com um raspador estéril da placa. Adicione 1 mL de NK Cell Media a cada poço.
- Colete células e meios de comunicação com Pipet serológico e colete em um tubo de centrífuga de 15 mL. Tome 20 μL para contar as células.
- Gire as células NK por 10 min, 400 x g a 4 ° c. Conte a amostra de células da etapa 3,5 durante esta centrifugação.
Nota: Veja as placas de cultura um microscópio antes de descartá-las para se certificar de que não há mais células aderentes ao fundo dos poços. Uma vez que o experimento usa células NK e células YAC1, certifique-se de contar cada um separadamente. - Contagem de células e ressuscito nas concentrações determinadas em ensaios de otimização para testar o número adequado de alvo: relação Effector. Isto será conseguido resuspendendo a pelota em seus meios correspondentes para fazer as seguintes concentrações da pilha: YAC1 em 4 x 105 pilhas/ml e pilhas de NK em 2 x 107 Cells/ml.
4. ensaio de citotoxicidade: protocolo de ensaio
- Use uma parte inferior redonda, cultura tratou a placa 96-well para ajustar acima a placa como sugerido na tabela 1. Esta tabela mostra os controles experimentais e 3 conjuntos de colunas experimentais NK. Isso pode ser expandido para um total de 10 colunas experimentais NK em uma placa 96-well.
- Centrifugue a placa de ensaio a 250 x g durante 4 min para ter a certeza de que as células efetoras e alvo estão em contacto. Incubar a placa 96-well por 5 horas em uma incubadora umidificada da câmara em 37 ° c, 5% co2 para conseguir o contato amplo entre as pilhas do alvo e do efetoras e o lysis da pilha do alvo por pilhas do efetoras.
Nota: O protocolo pode ser pausado aqui. - 45 min antes da colheita de sobrenadantes, adicione 10 μL de solução de Lise 10x aos poços de liberação máxima LDH da célula alvo (poços 1E, 1F, 1G e 1H) e coloque a placa de volta na câmara humidificada.
- Depois que o tempo de incubação é terminado, centrifugue a placa em 250 x g por 4 minutos usando um pipettor multicanal, transfira 50 μL de alíquotas de todos os poços para uma placa de ensaio de fundo plano de 96 bem fresca.
Nota: Não toque na parte inferior dos poços para que as células não sejam transferidas para a chapa de ensaio fresca. Não use uma placa tratada cultivada como a placa fresca do ensaio. -
Faça o reagente do ensaio.
- Depois que o buffer de ensaio atingiu a temperatura ambiente, adicione 12 mL de tampão de ensaio a um frasco de mistura de substrato. Inverta e agite suavemente até dissolver completamente. 1 garrafa é suficiente para 2 96-bem placas.
Nota: O tampão do ensaio deve ser protegido da luz ao ser thawed. Misture imediatamente antes de usar.
- Depois que o buffer de ensaio atingiu a temperatura ambiente, adicione 12 mL de tampão de ensaio a um frasco de mistura de substrato. Inverta e agite suavemente até dissolver completamente. 1 garrafa é suficiente para 2 96-bem placas.
- Adicionar 50 μL de reagente de ensaio a todos os poços da placa de ensaio a partir do passo 4,6. Cubra a placa com a folha para protegê-la da luz e incubar por 30 minutos na temperatura ambiente.
Nota: O reagente recentemente feito do ensaio deve ser armazenado em um congelador. O reagente é bom por aproximadamente 8 semanas. - Adicionar 50 μL de solução de paragem a cada poço. Leia a placa dentro de 1 hora após ter adicionado a solução da parada e registre a absorbância em 490 nanômetro. Os dados representativos são mostrados na tabela 2.
5. cálculo dos resultados
- Calcule o valor médio da absorvência dos poços do fundo do meio de cultura e subtraia de todos os valores da absorvência para experimental, liberação espontânea do LDH da pilha do alvo e poços espontâneos da liberação do LDH da pilha do effector.
- Calcule os valores médios de absorvância para os poços de controle de correção de volume e subtraia dos valores de absorvência adquiridos para os poços de controle de liberação de LDH de célula de destino máximo.
- Use os valores corrigidos das etapas 5,1 e 5,2 na seguinte fórmula para calcular a porcentagem de citotoxicidade para cada Effector: alvo bem.
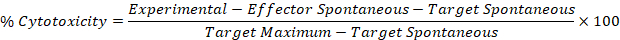
Resultados
Células NK placentárias obtidas de ratos NP e RUPP foram incubadas por 5 h com células-alvo em suas respectivas mídias em uma proporção de 50:1 (NK: Target). A absorbância foi registrada em 490 nm e os dados brutos são mostrados na tabela 2. Calculou-se a absorvência média do fundo do meio de cultura e os poços de controle de correção de volume. Essas médias foram subtraidas dos poços apropriados indicados no protocolo do fabricante e estão representadas na tabela 3. Os v...
Discussão
Há um número de importantes notas-chave a considerar para obter resultados ideais. A esterilidade das células utilizadas é muito importante. Após a coleta da placenta, é importante que a preparação e o isolamento das células NK sejam realizados condições estéreis em um gabinete de biossegurança. Além disso, como todas as células liberam LDH após dano celular, deve-se tomar cuidado para obter uma alta viabilidade das células NK após o isolamento e durante o processo de cocultura. Demasiada liberação es...
Divulgações
Nenhum conflito de interesse, financeiro ou de outra forma, é declarado pelos autores.
Agradecimentos
Este trabalho foi apoiado pelo National Heart Lung e Blood Institute dos institutos nacionais de saúde a subvenção R00HL130456, o Instituto Nacional de ciências médicas gerais dos institutos nacionais de saúde o prêmio P20GM104357, e pelo Mississippi INBRE, financiado por um prêmio de desenvolvimento institucional (IDeA) dos institutos nacionais de ciências médicas gerais dos institutos nacionais de saúde o número de subvenção P20GM103476. O conteúdo é unicamente da responsabilidade dos autores e não representa necessariamente os pontos de vista oficiais dos institutos nacionais de saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Fisher | 5408129 | |
| 100 µL Filter | Fisher | 22363549 | Nylon Mesh |
| 15 mL conical tube | Fisher | 0553859A | |
| 3 mL syringe | Fisher | 14823436 | |
| 50 mL conical tube | Fisher | 7203510 | |
| 6-well cell culture plate | Corning | 720083 | |
| 96-well Tissue Culture Plate | CELLTREAT | 229190 | Sterile, Round Bottom |
| AOPI | Nexcelom | CS201065ML | |
| Cell scraper | Fisher | 8100241 | |
| Cellometer Disposable Counting Chambers | Nexcelom | CHT4-SD100 | |
| Cellometer Vision Image Cytometer | Nexcelom | N/A | |
| Cytotox 96 Non-Radioactive Cytotoxicity Assay Kit | Promega | G1780 | |
| Dynabeads Flowcomp Flexi Kit | Invitrogen | 11061D | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| EDTA | Sigma Aldrich | EDS-100G | |
| FBS | Atlanta Biologicals | S11150H | |
| Flow Cytometry Tube | Corning | 352008 | |
| Lymphoprep | Fisher | NC0460539 | Density gradient medium; 4 x 250 mL |
| PBS | Fisher | SH3025801 | 10 x 500 mL |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Petri dishes | Fisher | 9720500 | Without Pad |
| Purified Mouse anti-Rat CD161a | BD Biosciences | 555006 | |
| Purified Mouse anti-Rat CD3 | BD Biosciences | 554829 | |
| Recombinant Rat IL-2 | R&D Systems | 502-RL | |
| RPMI | Gibco | 11875135 | 1640 Medium |
| T25 flask | Corning | 430639 | |
| Trypsin | ThermoFisher | 15090046 | |
| YAC-1 cell | ATCC | TIB-160 |
Referências
- Cornelius, D. C., Cottrell, J., Amaral, L. M., LaMarca, B. Inflammatory Mediators: A causal link to hypertension during pregnancy- Studies in Preeclampsia. British Journal of Pharmacology. , (2018).
- Elfarra, J., et al. Natural killer cells mediate pathophysiology in response to reduced uterine perfusion pressure. Clinical Science. 131 (23), 2753-2762 (2017).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14 (2), 181-196 (1968).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. Journal of Immunological Methods. 325 (1-2), 51-66 (2007).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), 0141074 (2015).
- Neri, S., Mariani, E., Meneghetti, A., Cattini, L., Facchini, A. Calcein-acetyoxymethyl cytotoxicity assay: standardization of a method allowing additional analyses on recovered effector cells and supernatants. Clinical and Diagnostic Laboratory Immunology. 8 (6), 1131-1135 (2001).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), 89357 (2014).
- Caporossi, C., Nogueira, P. L., Marques, J. C., Assis, R. M., Aguilar-Nascimento, J. E. Validation of the gastroschisis experimental model and the influence of the mother's diet enriched with glutamine in the fetal morphology. Acta Cirúrgica Brasileira. 29 (3), 158-165 (2014).
- Lv, L. H., et al. Functional distinction of rat liver natural killer cells from spleen natural killer cells under normal and acidic conditions in vitro. Hepatobiliary and Pancreatic Diseases International. 11 (3), 285-293 (2012).
- Flieger, D., et al. A novel non-radioactive cellular cytotoxicity test based on the differential assessment of living and killed target and effector cells. Journal of Immunological Methods. 180 (1), 1-13 (1995).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Annals of Clinical Laboratory Science. 42 (1), 42-49 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados