A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הלוח מבוססי ציטורעילות מבוסס על הערכה של עכברוש הרוצח הטבעי בתפקוד התאים Cytolytic
In This Article
Summary
כאן, אנו מספקים מתודולוגיה מפורטת כדי לבודד ולהעריך את הפונקציה ציטוטוקסיות של תאים הרוצח טבעי מפני השמש על ידי שיטת הלוח לצבוע מטרי. הלחץ מופחת זלוף ללחוץ עכברוש מודל של איסכמיה השלתית נבחרה כדי להדגים את הבידוד נוגדן מתווך והערכה של תפקוד ציטוטוקסיים של תאים הרוצח הטבעי.
Abstract
ידוע היטב כי הרוצח טבעי הדציבלים (NK) תאים לשחק תפקיד קריטי בהקמת ותחזוקה של הריון רגיל. מחקרים שנעשו לאחרונה הפגינו אוכלוסייה שונה של במחזור והשמדת התאים NK כפול אצל נשים הסובלות סיבוכים הריון שלילית כגון הפלה חוזרות ו טרום הרעלת. מחקרים של הקבוצה שלנו הראו כי יתר לחץ דם בהריון קשורה לאוכלוסיה מוגברת של תאי NK מופעל השליה מבוסס על הביטוי של סמנים הפעלת פני השטח. כתב יד זה מספק פרוטוקול מפורט כדי להעריך את הפונקציה ציטוטוקסיות של תאי NK מבודדים מפלנטכמו במודל בעלי חיים כמו הרעלת-הזרע של איסכמיה הנגרמת בניתוח. השלבים הבאים מתוארים בפירוט: דור של השעיה תא יחיד, בידוד תא NK, גירוי vivo ex, אפקטור: תא היעד המשותף התרבות, ואת שיטת הרעילות.
Introduction
Preאקלמפסיה היא הפרעה יתר לחץ דם של ההריון מאופיין הגבלת צמיחה עוברית, לסיים איבר נזק הפעלה חיסונית כרונית. הפעלה חיסונית כרונית אצל נשים עם טרום האקלמפסיה מוביל במחזור מוגבר ציטוקינים דלקתיים בנטל, חוסר איזון ב CD4+ T תאים אוכלוסיות, ו מוגברת האוכלוסייה של הרוצח הטבעי המופעל (NK) תאים1. מחקרים שפורסמו לאחרונה על ידי המעבדה שלנו להפגין תפקיד עבור תאים NK בגרימת כמה הפתופסולוגיה הקשורים טרום אקלמפסיה בלחץ רחמי Perfusion (ראפ) מודל החולדה של טרום הרעלת הרחם. באמצעות הזרמת cy, למדוד ביטוי פני השטח של סמנים הפעלה על תאים NK, האוכלוסייה מוגברת של תאים NK מופעל במחזור והפלנטאס של חולדות ראפ לעומת נורמלי בהריון (NP) חולדות נצפתה2.
כדי לאשר את הזרם cy, לבחון את התצפיות, מחקרים פונקציונליים כדי להעריך את הפעילות ציטוטוקסיטים של תאים NK מבודדים מן הפלנטאס של NP וחולדות ראפ בוצעו. ישנן מספר שיטות זמין להערכת תפקוד ציטוטוקסיים של תאים CD8- T ציטוטוקסיים ותאים NK. התקן הזהב עבור ניתוח ציטוטוקסיים פונקציונלי הוא שחרור כרום שיטת3. פרוטוקולים מפותחים אחרים מנוצל כוללים הזרימה cy, לנסות4, התמונה cy, לנסות5, calcein שחרור6, ולאחרונה ביולומינסנציה7. וידאו זה יספק פרוטוקול מפורט על שימוש היטב מבוססת לקטט דהידרוגנאז (ldh) שחרור התפקוד למדוד פונקציה ציטוטוקסיים של תאים NK באמצעות ערכה מסחרית של ldh הרעילות ציטובית.
Protocol
כל הפרוטוקולים אושרו על ידי הוועדה לטיפול בבעלי חיים מוסדיים והשתמש במרכז הרפואי של אוניברסיטת מיסיסיפי. הטיפול והטיפול של בעלי החיים היו בהסכמה עם המוסדות הלאומיים לבריאות הנחיות לטיפול מוסרי בעלי חיים.
1. תא לימפוציט בידוד מפלנטאס
- הסר שליה אחת מן הרחם עכברוש (יום ההיריון 19) ומקום ב 10 מ ל של הקרח קר PBS8.
- המקום שליה אחת על מסנן יקרומטר 100 ולשבת בצלחת פטרי המכילה 13.5 ml של RPMI ו 1.5 mL של fbs (נפח הכולל הוא 15 ml). השתמש בצד השטוח של המזרק כדי לדחוף את השליה דרך המסנן לתוך צלחת פטרי.
- הכינו 3 15 מ"ל שפופרות חרוט עבור כל רקמה. הוסף 3 מ ל של צפיפות בינונית מעבר הצבע (ראה טבלת חומרים) לכל צינור, ולאחר מכן שכבת בזהירות 5 מ ל של השליה המהומוגניים לתוך כל צינור.
- צנטריפוגה עבור 25 דקות ב 300 x g בטמפרטורת החדר (RT) ללא בלם. לאסוף את שכבת באפי לבנה רזה עם פיפטה העברה.
הערה: לאחר צנטריפוגה, 3 שכבות גלויים, RPMI אדום בחלק העליון, שכבת באפי הלבנה באמצע, ואת צפיפות ברורה הדרגתי שכבה בתחתית. השתמש בפיפטה העברה כדי למשוך. את שכבת הבאפי הלבנה מהצינור שילוב שכבת באפי מכל הצינורות של השליה אותה לתוך צינור 1. - הוסף 10 מ ל של RPMI כדי לשלב שכבות באפי. צנטריפוגה עבור 10 דקות, 300 x g, ב 4 ° צ' ולהיפטר supernatant.
2. בידוד של תאים רוצח טבעי
- השהה מחדש את גלולה תא ב 50 μL של הקרח קר PBS
- הוסף נוגדן CD3 התווית ביוטין כדי להתאים את התאים בהתאם לפרוטוקול של היצרן ולערבב היטב עם פיפטה. מניחים את הצינור בתוך מסובבי הצינור ומודעד 20 דקות ב 4 ° c.
- הוסף 1 מ ל של RPMI, צנטריפוגה עבור 10 דקות ב 400 x g ו 4 ° c, ולמחוק supernatant.
- להשעות את הגלולה ב 1 מ ל של RPMI ולשלב עם 150 μL של חרוזים מגנטיים בשפופרת מיקרוצנטריפוגה 1.5 mL. מניחים את צינור המיקרוצנטריפוגה בתוך מסובב צינור ולסובב תוך הדגירה 30 דקות ב 4 ° c.
הערה: משוך את מאגר שחרור בשלב זה ולאפשר להגיע RT בארון בטיחות. - מניחים את הצינורות במגנט 1 דקות. לאסוף supernatant ולשמור CD3-cell האוכלוסייה ב 15 מ ל שפופרת על הקרח.
הערה: . זה האוכלוסיה הCD3 של תאים - הסירו את השפופרת מהמגנט והוסיפו 1 מ ל RPMI. מערבבים תאים וחרוזים 5 פעמים עם פיפטה.
- חזור על שלב 2.5.
- צנטריפוגה את CD3- אוכלוסיה של תאים עבור 10 דקות ב 400 x g ו 4 ° צ' ו להיפטר supernatant. השהה מחדש את הגלולה בתא ב 50 μL של הקרח קר PBS
- הוסף נוגדן CD161a המסומן בביוטין לתאים CD3 בהתאם לפרוטוקול של היצרן וערבב היטב. מניחים את הצינור בתוך מסובבי הצינור ואת הדגירה של 20 דקות ב 4 ° c.
- הוסף 1 מ ל של RPMI, צנטריפוגה עבור 10 דקות ב 400 x g ו 4 ° c, ולמחוק supernatant. להשעות את הגלולה ב 1 מ ל של RPMI ולשלב עם 150 μL של חרוזים מגנטיים בשפופרת מיקרוצנטריפוגה 1.5 mL.
- מניחים צינור מיקרוצנטריפוגה בתוך מסובב צינור ולסובב תוך הדגירה עבור 30 דקות ב 4 ° c.
- מניחים את הצינורות במגנט 1 דקות. לאסוף supernatant ולהיפטר CD3-/Cd161a- תאים.
- להסיר את הצינור ממגנט ולהוסיף 1 מ"ל של RPMI. מערבבים תאים וחרוזים 5 פעמים עם פיפטה.
- חזור על שלב 2.12.
- הסרת צינורות מיקרוצנטריפוגה מן המגנט ולהוסיף 1 מ ל של מאגר שחרור RT. צינור מקום על מסובבי הצינור ולסובב תוך הדגירה עבור 15 דקות ב RT.
- מניחים צינורות במגנט עבור 1 דקות. לאסוף supernatant ב 15 מ"ל חדש של שפופרת חרוט על קרח.
הערה: זוהי האוכלוסייה של תאי NK. - להסיר את הצינור ממגנט ולהוסיף 1 מ ל של RT RPMI. מערבבים תאים וחרוזים 5 פעמים עם פיפטה.
- חזור על שלב 2.16, הצבת סופרנטנט באותה צינורית. מערבבים היטב ולוקחים לדוגמה 20 μL כדי לספור תאים
הערה: . שמור על הקרח - צנטריפוגה CD3-/cd161a+ תאים עבור 10 דקות, 400 x g ב 4 ° c, ולאחר מכן להסיר supernatant. להשעות את התאים ב-RPMI (10% FBS, 1% עט/דלקת, 2 ng/mL IL-2) וזרע בריכוז של 3 x 105 תאים/גם בצלחת 6-באר ב 2.5 mL של מדיה הפעלה תא NK. התאים הדגירה עבור 48 h ב 37 ° צ', 5% CO2 בתוך מחולל לחות.
3. שיטת הרעלת ציטוזה: מאחזר תאים NK או YAC1 מן התרבות או העובר תאים
הערה: כל הצעדים חייבים להתבצע. מתחת למכסה המנוע כל צינורות התאים. חייבים להישמר בקרח כל הזמן
- השתמש זכוכית מלאה סרולוגית לאסוף YAC1 תאים ומדיה מ בקבוקון, מקום בצינור 50 mL על קרח, ומערבבים היטב. קח 20 μL כדי לספור תאים.
- סובב את התאים YAC1 עבור 10 דקות ב 300 x g ו 4 ° c. ספירת תאים בזמן שאלה מסתובבים.
- הוסף את טריפסין/EDTA לכל באר בתא NK 6-צלחת. הקש על צלחת ומקום בחממה.
- לאחר התאים יש מודדים עם טריפסין/EDTA עבור ~ 5 דקות ב 37 ° c, לגרד את הצלחת/בקבוקון עם מגרד צלחת סטרילי. להוסיף 1 מ ל של מדיית התא NK לכל טוב.
- לאסוף תאים ומדיה עם pipet סרולוגית ולאסוף ב 15 מ"ל שפופרת צנטריפוגה. קח 20 μL כדי לספור תאים.
- הספין תאים NK עבור 10 דקות, 400 x g ב 4 ° c. לספור את המדגם של תאים משלב 3.5 במהלך צנטריפוגה זה.
הערה: לראות את לוחיות התרבות תחת מיקרוסקופ לפני השלכת אותם כדי לוודא שאין תאים יותר דבק לתחתית הבארות. מאחר שהניסוי משתמש בתאי NK ובתאים YAC1, הקפד לספור כל אחד בנפרד. - לספור תאים מחדש בריכוזים שנקבעו מבחנים אופטימיזציה כדי לבדוק את המספר המתאים של היעד: היחס אפקטור. זה יהיה מושגת על ידי השעיית מחדש את הגלולה במדיה המקבילה שלהם כדי להפוך את ריכוזי התא הבאים: YAC1 ב 4 x 105 תאים/ml ו-NK תאים ב 2 x 107 תאים/ml.
4. שיטת הרעלת ציטוזה: פרוטוקול שיטת המשך
- השימוש בחלק התחתון עגול, התרבות שטופלו 96-צלחת הבאר כדי להגדיר את הצלחת כפי שהוצע בטבלה 1. טבלה זו מציגה את הפקדים הניסיוניים ו-3 סטים של עמודות ניסויית של NK. זה יכול להיות מורחב לסכום כולל של 10 הטורים הניסיוניים NK בצלחת 96-באר.
- צנטריפוגה את צלחת הספק ב 250 x g עבור 4 דקות להיות בטוח כי האפקטור ותאי היעד הם במגע. מודקת את הצלחת 96-ובכן עבור 5 שעות בחממה קאמרית מחולל לחות ב 37 ° צ', 5% CO2 כדי להשיג קשר מספיק בין היעד ואת התאים היעד לפירוק התא על ידי תאים אפקטור.
הערה: הפרוטוקול יכול להיות מושהה כאן. - 45 דקות לפני קצירת סופרנטנים, להוסיף 10 μL של פתרון 10 x הליזה על תא היעד מקסימום LDH שחרור בארות (ולס 1E, 1E, 1E, ו-1E) ולמקם את הצלחת בחזרה בחדר לחות.
- לאחר הזמן הדגירה הושלמה, צנטריפוגה את הצלחת ב 250 x g עבור 4 דקות. באמצעות פיפטורים רב ערוצית, העברת 50 μl מתוך כל הבארות כדי טרי 96-ובכן שטוח בתחתית הצלחת.
הערה: אין לגעת בתחתית הבארות, כך שתאים לא יועברו לתוך לוחית השיטת החדשה. אין להשתמש בלוחית מטופלת תרבותית כלוחית הטיפול הטרייה. -
בצע הפיכת שיטת מגיב.
- לאחר ש-' מאגר הגישה ' הגיע לטמפרטורת החדר, הוסף 12 מ ל של מאגר הגישה לבקבוקון אחד של מיקס מצע. היפוך וטלטול בעדינות עד התפרקה לחלוטין. 1 בקבוק מספיק עבור 2 96-טוב צלחות.
הערה: יש להגן על מאגר השיטת הזמן מפני אור בעת ההפשאתו. מערבבים מיד לפני השימוש.
- לאחר ש-' מאגר הגישה ' הגיע לטמפרטורת החדר, הוסף 12 מ ל של מאגר הגישה לבקבוקון אחד של מיקס מצע. היפוך וטלטול בעדינות עד התפרקה לחלוטין. 1 בקבוק מספיק עבור 2 96-טוב צלחות.
- הוסף 50 μL של שיטת הפעולה הכימית לכל הבארות בלוח השיטת ההרחבה משלב 4.6. לכסות את הצלחת עם רדיד אלומיניום כדי להגן עליו מפני אור ו דגירה עבור 30 דקות בטמפרטורת החדר.
הערה: יש לאחסן את האפשרות ' מגיב חדש ' במקפיא. הדבר מגיב בטוב ל -8 שבועות בקירוב. - הוסף 50 μL של פתרון Stop לכל באר. לקרוא לוחית בתוך שעה אחת לאחר הוספת פתרון עצור ולהקליט את ספיגת ב 490 nm. נתוני הנציג מוצגים בטבלה 2.
5. חישוב תוצאות
- חשב את ערך הספיגה הממוצע מבארות הרקע של התרבות והפחת מכל ערכי הספיגה של הניסוי, מהדורת LDH ספונטנית של תאי היעד ושחרור התאים הספונטני LDH שחרור בארות.
- חשב את ערכי הספיגה הממוצעים עבור בארות בקרת תיקון אמצעי האחסון והפחת מערכי הספיגה הנרכשים עבור בארות בקרת שחרור מרבי של תא יעד למהדורת LDH.
- השתמש בערכים המתוקן מתוך שלבים 5.1 ו-5.2 בנוסחה הבאה כדי לחשב אחוזי רעילות באחוזים עבור כל אפקטור: המטרה היטב.
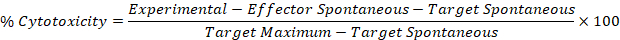
תוצאות
שלנטל התאים שהתקבלו מ NP ו רופ חולדות היו מודבטים עבור 5 h עם תאים היעד ב דיות המתאימים שלהם ביחס של 50:1 (NK: היעד). הקליטה הוקלטה ב490 ננומטר והנתונים הגולמיים מוצגים בטבלה 2. הספיגה הממוצעת של רקע התרבות ובארות השליטה בתיקון אמצעי האחסון חושבו. ממוצעים אלה המופגו מבארות המתאימות המסומנ?...
Discussion
קיימים מספר הערות חשובות שכדאי לשקול לקבלת תוצאות אופטימליות. עקרות התאים מנוצל חשוב מאוד. לאחר אוסף של השליה, חשוב כי הכנה ובידוד של התאים NK מתבצעים בתנאים סטרילי בארון בטיחות ביולוגית. יתר על כן, כי כל התאים לשחרר LDH על הנזק התאי, יש לנקוט כדי להשיג כדאיות גבוהה של תאים NK לאחר בידוד במהלך ת?...
Disclosures
אין קונפליקטים של עניין, פיננסיים או אחרים, מוצהר על ידי המחברים.
Acknowledgements
העבודה הזאת נתמכת על ידי המכון הלאומי לבריאות ובדם של המוסדות הלאומיים של בריאות תחת גרנט R00HL130456, המכון הלאומי למדעי הרפואה הכללית של המכון הלאומי לבריאות תחת הפרס P20GM104357, ועל ידי מיסיסיפי INBRE, ממומן על ידי פרס פיתוח מוסדי (רעיון) מן המוסדות הלאומיים של מדעי הרפואה הכללית של המוסדות הלאומיים לבריאות תחת מספר P20GM103476. התוכן הינו באחריות המחברים בלבד ואינו מייצג בהכרח את ההשקפות הרשמיות של המכון הלאומי לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Fisher | 5408129 | |
| 100 µL Filter | Fisher | 22363549 | Nylon Mesh |
| 15 mL conical tube | Fisher | 0553859A | |
| 3 mL syringe | Fisher | 14823436 | |
| 50 mL conical tube | Fisher | 7203510 | |
| 6-well cell culture plate | Corning | 720083 | |
| 96-well Tissue Culture Plate | CELLTREAT | 229190 | Sterile, Round Bottom |
| AOPI | Nexcelom | CS201065ML | |
| Cell scraper | Fisher | 8100241 | |
| Cellometer Disposable Counting Chambers | Nexcelom | CHT4-SD100 | |
| Cellometer Vision Image Cytometer | Nexcelom | N/A | |
| Cytotox 96 Non-Radioactive Cytotoxicity Assay Kit | Promega | G1780 | |
| Dynabeads Flowcomp Flexi Kit | Invitrogen | 11061D | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| EDTA | Sigma Aldrich | EDS-100G | |
| FBS | Atlanta Biologicals | S11150H | |
| Flow Cytometry Tube | Corning | 352008 | |
| Lymphoprep | Fisher | NC0460539 | Density gradient medium; 4 x 250 mL |
| PBS | Fisher | SH3025801 | 10 x 500 mL |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Petri dishes | Fisher | 9720500 | Without Pad |
| Purified Mouse anti-Rat CD161a | BD Biosciences | 555006 | |
| Purified Mouse anti-Rat CD3 | BD Biosciences | 554829 | |
| Recombinant Rat IL-2 | R&D Systems | 502-RL | |
| RPMI | Gibco | 11875135 | 1640 Medium |
| T25 flask | Corning | 430639 | |
| Trypsin | ThermoFisher | 15090046 | |
| YAC-1 cell | ATCC | TIB-160 |
References
- Cornelius, D. C., Cottrell, J., Amaral, L. M., LaMarca, B. Inflammatory Mediators: A causal link to hypertension during pregnancy- Studies in Preeclampsia. British Journal of Pharmacology. , (2018).
- Elfarra, J., et al. Natural killer cells mediate pathophysiology in response to reduced uterine perfusion pressure. Clinical Science. 131 (23), 2753-2762 (2017).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14 (2), 181-196 (1968).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. Journal of Immunological Methods. 325 (1-2), 51-66 (2007).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), 0141074 (2015).
- Neri, S., Mariani, E., Meneghetti, A., Cattini, L., Facchini, A. Calcein-acetyoxymethyl cytotoxicity assay: standardization of a method allowing additional analyses on recovered effector cells and supernatants. Clinical and Diagnostic Laboratory Immunology. 8 (6), 1131-1135 (2001).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), 89357 (2014).
- Caporossi, C., Nogueira, P. L., Marques, J. C., Assis, R. M., Aguilar-Nascimento, J. E. Validation of the gastroschisis experimental model and the influence of the mother's diet enriched with glutamine in the fetal morphology. Acta Cirúrgica Brasileira. 29 (3), 158-165 (2014).
- Lv, L. H., et al. Functional distinction of rat liver natural killer cells from spleen natural killer cells under normal and acidic conditions in vitro. Hepatobiliary and Pancreatic Diseases International. 11 (3), 285-293 (2012).
- Flieger, D., et al. A novel non-radioactive cellular cytotoxicity test based on the differential assessment of living and killed target and effector cells. Journal of Immunological Methods. 180 (1), 1-13 (1995).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Annals of Clinical Laboratory Science. 42 (1), 42-49 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved