JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
랫 트 태 반 천연 킬러 세포 세포 용 분해 기능의 평가를 위한 플레이트 기반 세포 독성 분석
요약
여기, 우리는 분리 하 고에서 자연 킬러 세포의 세포 독성 기능을 평가 하는 상세한 방법론을 제공 합니다. 비 색 판 분석에 의해. 태 반 허 혈의 감소 된 자 궁 관류 압력 쥐 모형은 천연 킬러 세포의 세포 독성 기능의 항 체 매개 분리 및 평가를 입증 하기 위해 선택 되었다.
초록
의사는 정상적인 임신의 확립과 유지에 중요 한 역할을 하는 것으로 알려져 있습니다. 최근의 연구에의 하면 재발 성 유산 및 자간 전 증과 같은 임신 합병증을 앓고 있는 여성들의 순환 및 의사 이중 NK 세포의 변화 된 인구가 입증 되었다. 우리 그룹의 연구는 임신 중 고혈압이 표면 활성화 마커의 발현을 기반으로 태 반에 활성화 된 NK 세포의 증가 된 인구와 연관 된다는 것을 보여주었습니다. 이 원고는 수술로 유도 된 태 반 허 혈의 자간 전 증 유사 동물 모델에서와 같이, 장소에서 분리 된 NK 세포의 세포 독성 기능을 평가 하기 위한 상세한 프로토콜을 제공 한다. 다음 단계는 상세히 설명 된다: 단일 세포 현 탁 액의 생성, NK 세포 분리, 전 생체 자극, 이펙터: 표적 세포 공동 배양 및 세포 독성 분석 법.
서문
자간 전 증은 태아 성장 제한, 말단 장기 손상 및 만성 면역 활성화를 특징으로 하는 임신의 고혈압 질환 이다. 자간 전 증을 가진 여성에서의 만성 면역 활성화는 증가 된 순환 및 태 반 염증 성 사이토카인, CD4+ T 세포 집단의 불균형 및 활성화 된 천연 킬러 (NK) 세포의 증가 된 인구에 이르게 한다1. 우리 연구실에서 최근에 출판 된 연구는 자간 전 증의 자 궁 내 관류 압력 (파열)을 자간 전 증과 관련 된 일부 병 리 생리학의 원인에서 NK 세포에 대 한 역할을 증명 한다. 유 세포 분석을 이용 하 여 NK 세포에 대 한 활성화 마커의 표면 발현을 측정 하 고, 정상 임신 (NP) 쥐에 비하여 파열 된 랫 트의 순환 및 위치에서 활성화 된 NK 세포의 증가 된 인구가 관찰 되었다2.
유 세포 분석 관찰을 확인 하기 위해, 플 래 트에서 분리 된 NK 세포의 세포 독성 활성을 평가 하는 기능적 연구가 NP 및 파열 쥐의 수행 되었다. CD8+ T 세포 및 NK 세포의 세포 독성 기능에 대 한 평가에 사용할 수 있는 몇 가지 방법이 있다. 기능적 세포 독성 분석을 위한 금 표준은 크롬 방출 검정3이다. 사용 되는 기타 개발 된 프로토콜은 유 세포 분석4, 이미지 분석5, calcein 릴리즈6및 가장 최근의 생물 발광7을 포함 한다. 본 영상은 상업적으로 입수 가능한 LDH 세포 독성 분석 키트를 이용 하 여 잘 확립 된 락 테이 트 탈 수소 효소 (LDH) 방출 분석을 이용 하 여 NK cell의 세포 독성 기능을 측정 하는 자세한 프로토콜을 제공할 것 이다.
프로토콜
모든 프로토콜은 미시시피 대학 의료 센터의 기관 동물 관리 및 사용 위원회에 의해 승인 되었다. 동물의 치료와 취급은 윤리적 동물 치료를 위한 건강 지침의 국가 학회와 일치 했습니다.
1. 림프 구 세포 분리
- 쥐 자 궁 (임신 일 19)에서 태 반을 제거 하 고 얼음 차가운 PBS8의 10ml에 넣습니다.
- 100 µm 필터에 1 개의 태 반을 놓고 RPMI 13.5 mL 및 1.5 mL의 FBS를 함유 하는 페 트리 디쉬에 앉 습니다 (총 부피는 15ml). 주사기 플런저의 평평한 면을 사용 하 여 태 반을 필터를 통해 페 트리 접시에 밀어 넣으십시오.
- 각 조직에 대 한 3 15 mL 원뿔 튜브를 준비 합니다. 각 튜브에 3 mL 밀도 구배 매체 ( 재료 표참조)를 넣고 각 튜브에 5 ml의 균질 한 태 반을 조심 스럽게 겹쳐 놓습니다.
- 브레이크 없이 실 온 (RT)에서 300 x g 에서 25 분 동안 원심 분리기. 전사 파이 펫을 사용 하 여 얇은 흰색 버 레이어 를 수집 합니다.
참고: 원심 분리 후에는 3 층이 보이고, 상단에는 적색 rpmi가, 중간에는 흰색 버 층, 하단에는 투명 한 밀도 그라데이션 매체 레이어가 있습니다. 전사 파이 펫을 사용 하 여 튜브에서 흰색 버 층을 당깁니다. 동일한 태 반의 모든 튜브에서 버 층을 1 튜브로 결합 하십시오. - 결합 된 버 층에 10ml의 rpmi를 추가 합니다. 10 분간 원심 분리기, 300 x g, 4°c에서 상층 액을 버리십시오.
2. 자연 살해 세포의 분리
- 얼음-저온 PBS의 50 μ l에서의 소생 세포 펠 렛
- 비오 틴-표지 된 CD3 항 체를 펠 라이 셀에 추가 하 여 제조업체의 프로토콜에 따라 피 펫과 잘 섞어 줍니다. 튜브를 튜브로 테이터에 넣고 4°c에서 20 분간 배양 한다.
- RPMI 1 mL을 넣고, 400 x g 및 4°c에서 10 분간 원심 분리 하 고 상층 액을 버리십시오.
- RPMI 1 mL의 소생 펠 렛을 1.5 mL 마이크로 원심 분리기 튜브에 150 μ l의 자기 비드와 결합 합니다. 마이크로 원심 분리기 튜브를 튜브 회전자에 놓고 4°c에서 30 분 동안 배양 하 여 회전 시킵니다.
참고: 이 때 방출 버퍼를 꺼내 생물학적 안전 캐비닛에 RT에 도달 할 수 있습니다. - 1 분 동안 자석에 튜브를 놓습니다. 상층 액을 수집 하 고 얼음에 15 mL 튜브에 CD3 세포 집단을 저장 합니다.
참고: 이것은 CD3 세포 의 인구입니다. - 자석에서 튜브를 분리 하 고 RPMI 1 mL을 추가 합니다. 세포와 구슬을 5 회 파이 펫과 섞어 줍니다.
- 2.5 단계를 반복 합니다.
- 400 x g 및 4°c에서 10 분 동안 세포의 CD3를 원심 분리 하 고 상층 액을 버리십시오. 얼음-저온 PBS의 50 μ l에서 세포 펠 렛의 소생
- 비오 틴-라벨링 된 CD161a 항 체 를 제조사의 프로토콜에 따라 CD3 세포에 첨가 하 고 잘 섞어 줍니다. 튜브를 튜브로 테이터에 놓고 4°c에서 20 분 동안 배양 한다.
- RPMI 1 mL을 넣고, 400 x g 및 4°c에서 10 분간 원심 분리 하 고 상층 액을 버리십시오. RPMI 1 mL의 소생 펠 렛을 1.5 mL 마이크로 원심 분리기 튜브에 150 μ l의 자기 비드와 결합 합니다.
- 마이크로 원심 분리기 튜브를 튜브 회전자에 넣고 4°c에서 30 분 동안 배양 하 여 회전 시킵니다.
- 튜브를 자석에 1 분 동안 놓습니다. 상층 액을 모으고 CD3-/Cd161a- 세포를 버리십시오.
- 자석에서 튜브를 제거 하 고 RPMI 1 mL을 추가 합니다. 세포와 구슬을 5 회 파이 펫과 섞어 줍니다.
- 2.12 단계를 반복 합니다.
- 자석에서 마이크로 원심 분리기 튜브를 제거 하 고 1 mL의 RT 방출 완충 제를 추가 하십시오. 튜브 회전자에 튜브를 놓고 RT에서 15 분 동안 배양 하는 동안 회전 합니다.
- 1 분간 자석에 튜브를 놓습니다. 얼음에 새로운 15 mL 원추형 튜브에 상층 액을 수집 합니다.
참고: 이것은 NK 세포의 인구입니다. - 자석에서 튜브를 제거 하 고 RT RPMI 1 mL을 추가 합니다. 세포와 구슬을 5 회 파이 펫과 섞어 줍니다.
- 2.16 단계를 반복 하 여 동일한 튜브에 상층 액을 배치 합니다. 잘 섞어 20 μ l 샘플을 복용 하 여 세포 수를 계산 합니다
참고: 얼음에 튜브를 보관 하십시오. - 원심 분리기 CD3-/cd161a+ 세포를 4°c에서 10 분, 400 x g , 상층 액을 제거 한다. 세포를 RPMI (10% FBS, 1% 펜/Strep, 2ng/mL)로 하 고, 2.5의 NK 세포 활성화 매체에 있는 6 웰 플레이트에서 3 x 105cell/웰의 농도로 종자를 소생 한다. 37 ° c에서 48 h의 세포 배양,가 습 인큐베이터 에서 5% co2.
3. 세포 독성 분석: 배양 또는 전달 세포에서 NK 세포 또는 YAC1 검색
참고: 모든 단계는 내부적으로 수행 되어야 합니다. 모든 세포 관은 항상 얼음에 보관 해야 합니다.
- 유리 혈 청 학적 pipet을 사용 하 여 플라스 크에서 YAC1 세포 및 매체를 수집 하 고 얼음에 50 mL 튜브에 넣고 잘 섞어 줍니다. 셀 수를 계산 하기 위해 20 µ L을 복용 하십시오.
- 300 x g 및 4°c에서 10 분 동안 YAC1 세포를 회전 시킵니다. 회전 하는 동안 셀 수를 계산 합니다.
- NK 셀 6 웰 플레이트에서 각 웰에 트립 신/EDTA를 추가 하십시오. 플레이트를 탭 하 고 인큐베이터에 배치 합니다.
- 세포 후 37 ° c에서 ~ 5 분 동안 트립 신/EDTA로 배양 한 후, 멸 균 플레이트 스 크레이 퍼로 플레이트/플라스 크를 긁어 낸다. 각 웰에 1 mL의 NK 세포 배지를 추가 합니다.
- 혈 청 피 펫으로 세포와 매체를 모으고 15 mL 원심 분리기 튜브에 수집 하십시오. 셀 수를 계산 하기 위해 20 µ L을 복용 하십시오.
- NK 세포를 4°c에서 10 분, 400 x g 로 회전 시켰다. 이 원심 분리 동안 3.5 단계에서 세포의 샘플을 카운트.
참고: 웰의 바닥에 더 이상 부착 된 세포가 없는지 확인 하기 위해이를 폐기 하기 전에 현미경으로 배양 판을 봅니다. 이 실험은 NK 세포와 YAC1 세포를 사용 하기 때문에 각각 따로계산 해야 합니다. - 최적화 실험에서 결정 된 농도의 세포 및 소생을 카운트 하 여 적절 한 개수의 타겟: 이펙터 비율을 시험 한다. 이것은 그들의 상응 하는 매체에서 펠 릿을 재 현 탁 하 여 다음 세포 농도를 확인 함으로써 달성 될 것 이다: YAC1 세포/m l 및 NK 세포에서 2x107 세포/ml에 4 x 10.
4. 세포 독성 분석: 분석 프로토콜
- 표 1에 제시 된 바와 같이 둥근 바닥, 배양 처리 된 96-웰 플레이트를 사용 하 여 플레이트를 설치 한다. 이 표는 실험 대조 군 및 3 개의 NK 실험 칼럼 세트를 보여준다. 이는 96-웰 플레이트에서 총 10 개의 NK 실험 칼럼으로 확장 될 수 있다.
- 상기 분석 판을 250 x g 에서 4 분간 원심 분리 하 여 이펙터와 표적 세포가 접촉 하 고 있는지를 확실 하 게 한다. 37 ° c에서가 습 챔버 인큐베이터에서 5 시간 동안 96-웰 플레이트를 배양 하 고, 5 % co2는 타겟과 이펙터 세포 간의 충분 한 접촉을 달성 하 고 이펙터 세포에의 한 표적 세포 용 해를 실현 하였다.
참고: 여기서 프로토콜을 일시 중지할 수 있습니다. - 45 수확 하기 전에 상층 액, 10 µ L의 용 해 용액을 대상 셀에 최대 LDH 방출 웰 (우물 1E, 1F, 1G 및 1H)을 넣고가 습 챔버에 다시 플레이트를 배치 한다.
- 인큐베이션 시간이 완료 된 후에, 플레이트를 250 x g 에서 4 분간 원심 분리 하 여 µ를 사용 하 여, 모든 웰에서 50을 이송 하 여 새로운 96-웰 플랫 바 텀 분석 플레이트를 이용 한다.
참고: 세포가 신선한 분석 판으로 전달 되지 않도록 우물의 바닥을 만지지 마십시오. 배양 처리 된 플레이트를 신선한 분석 플레이트로 사용 하지 마십시오. -
분석 시 약을 만듭니다.
- 분석 버퍼가 실 온에 도달한 후에는 1 개의 기질 혼합 병에 12 mL의 분석 버퍼를 추가 하십시오. 완전히 녹을 때까지 부드럽게 흔들어 주세요. 1 병은 2 96-웰 플레이트에 충분 합니다.
참고: 분석 완충 액은 해 동 되는 동안 빛 으로부터 보호 되어야 한다. 사용 직전에 섞어 주세요.
- 분석 버퍼가 실 온에 도달한 후에는 1 개의 기질 혼합 병에 12 mL의 분석 버퍼를 추가 하십시오. 완전히 녹을 때까지 부드럽게 흔들어 주세요. 1 병은 2 96-웰 플레이트에 충분 합니다.
- 4.6 단계에서 분석 플레이트의 모든 웰에 50 µ L의 분석 시 약을 추가 하십시오. 빛 으로부터 보호 하 고 실 온에서 30 분 동안 배양 하는 호 일로 플레이트를 덮으 십시오.
참고: 새로 만든 분석 시 약은 냉동 실에 보관 해야 합니다. 약 8 주 동안 시 약이 좋습니다. - 각 웰에 50 µ L 중지 솔루션을 추가 합니다. 중지 용액을 추가 한 후 1 시간 이내에 플레이트를 판독 하 고 490 nm에서 흡 광도를 기록 한다. 대표적인 데이터는 표 2에 나타내 었 다.
5. 결과 계산
- 배양 배지 배경 웰 로부터 평균 흡 광도 값을 계산 하 고, 실험 대상 세포 자발적인 LDH 방출 및 이펙터 세포 자발적인 LDH 방출 웰에 대 한 모든 흡 광도 값 으로부터 감산 한다.
- 볼륨 보정 제어 웰에 대 한 평균 흡 광도 값을 계산 하 고 최대 LDH 방출 제어 웰을 대상 셀에 대해 획득 한 흡 광도 값에서 뺍니다.
- 다음 공식에서 5.1 단계 및 5.2 단계의 수정 된 값을 사용 하 여 각 이펙터에 대 한 세포 독성 퍼센트를 계산 합니다: 대상 웰.
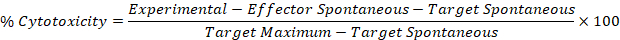
결과
NP 및 파열 된 랫 트에서 얻어진 태 반 NK 세포는 50:1 (NK: target)의 비율로 각각의 매개체에서 표적 세포와 함께 5 시간 동안 인큐베이션 되었다. 흡 광도는 490 nm에서 기록 하였으며, 원시 데이터는 표 2에 나타내 었 다. 배양 배지 배경의 평균 흡 광도와 부피 보정 제어 웰을 계산 하였다. 이러한 평균은 제조자의 프로토콜에 표시 된 적절 한 웰 로부터 감산 되 고 표 3에 표시 ?...
토론
최적의 결과를 위해 고려해 야 할 중요 한 주요 참고 사항이 많이 있습니다. 이용 된 세포의 무 균은 매우 중요 합니다. 태 반의 채취 후, 생물 안전 내각에서 멸 균 조건 하에서 NK 세포의 조제 및 분리가 수행 되는 것이 중요 하다. 더욱이, 모든 세포는 세포 손상 시 LDH를 방출 하기 때문에, 분리 후 및 공동 배양 과정 동안 NK 세포의 높은 생존 능력을 얻기 위해 주의를 기울여야 한다. NK 세포에서 너?...
공개
이해관계의 상충, 재정 또는 기타는 저자에 의해 선언 되지 않습니다.
감사의 말
이 작품은 국립 심장 폐와 보조금 R00HL130456에서 건강의 국립 연구소의 혈액 연구소에 의해 지원 되었다, 국립 의료 과학 연구소의 국가 학회에서 수상 P20GM104357에서, 그리고 미시시피 INBRE는 보조금 번호 P20GM103476 하에서 국립 건강 학회 국립 연구소의 기관 개발 상 (IDeA)에 의해 자금을 지원 했다. 콘텐츠는 전적으로 저자의 책임이 며, 반드시 건강의 국가 학회 공식 견해를 나타내는 것은 아닙니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Fisher | 5408129 | |
| 100 µL Filter | Fisher | 22363549 | Nylon Mesh |
| 15 mL conical tube | Fisher | 0553859A | |
| 3 mL syringe | Fisher | 14823436 | |
| 50 mL conical tube | Fisher | 7203510 | |
| 6-well cell culture plate | Corning | 720083 | |
| 96-well Tissue Culture Plate | CELLTREAT | 229190 | Sterile, Round Bottom |
| AOPI | Nexcelom | CS201065ML | |
| Cell scraper | Fisher | 8100241 | |
| Cellometer Disposable Counting Chambers | Nexcelom | CHT4-SD100 | |
| Cellometer Vision Image Cytometer | Nexcelom | N/A | |
| Cytotox 96 Non-Radioactive Cytotoxicity Assay Kit | Promega | G1780 | |
| Dynabeads Flowcomp Flexi Kit | Invitrogen | 11061D | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| EDTA | Sigma Aldrich | EDS-100G | |
| FBS | Atlanta Biologicals | S11150H | |
| Flow Cytometry Tube | Corning | 352008 | |
| Lymphoprep | Fisher | NC0460539 | Density gradient medium; 4 x 250 mL |
| PBS | Fisher | SH3025801 | 10 x 500 mL |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Petri dishes | Fisher | 9720500 | Without Pad |
| Purified Mouse anti-Rat CD161a | BD Biosciences | 555006 | |
| Purified Mouse anti-Rat CD3 | BD Biosciences | 554829 | |
| Recombinant Rat IL-2 | R&D Systems | 502-RL | |
| RPMI | Gibco | 11875135 | 1640 Medium |
| T25 flask | Corning | 430639 | |
| Trypsin | ThermoFisher | 15090046 | |
| YAC-1 cell | ATCC | TIB-160 |
참고문헌
- Cornelius, D. C., Cottrell, J., Amaral, L. M., LaMarca, B. Inflammatory Mediators: A causal link to hypertension during pregnancy- Studies in Preeclampsia. British Journal of Pharmacology. , (2018).
- Elfarra, J., et al. Natural killer cells mediate pathophysiology in response to reduced uterine perfusion pressure. Clinical Science. 131 (23), 2753-2762 (2017).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14 (2), 181-196 (1968).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. Journal of Immunological Methods. 325 (1-2), 51-66 (2007).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), 0141074 (2015).
- Neri, S., Mariani, E., Meneghetti, A., Cattini, L., Facchini, A. Calcein-acetyoxymethyl cytotoxicity assay: standardization of a method allowing additional analyses on recovered effector cells and supernatants. Clinical and Diagnostic Laboratory Immunology. 8 (6), 1131-1135 (2001).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), 89357 (2014).
- Caporossi, C., Nogueira, P. L., Marques, J. C., Assis, R. M., Aguilar-Nascimento, J. E. Validation of the gastroschisis experimental model and the influence of the mother's diet enriched with glutamine in the fetal morphology. Acta Cirúrgica Brasileira. 29 (3), 158-165 (2014).
- Lv, L. H., et al. Functional distinction of rat liver natural killer cells from spleen natural killer cells under normal and acidic conditions in vitro. Hepatobiliary and Pancreatic Diseases International. 11 (3), 285-293 (2012).
- Flieger, D., et al. A novel non-radioactive cellular cytotoxicity test based on the differential assessment of living and killed target and effector cells. Journal of Immunological Methods. 180 (1), 1-13 (1995).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Annals of Clinical Laboratory Science. 42 (1), 42-49 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유