A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إدخال الجين بالضربة القاضية مباشرة في مرحلة Amastigote من التريبانوسوما كروزي باستخدام نظام CRISPR/Cas9
In This Article
Summary
هنا، ونحن نصف بروتوكول لإدخال ضربة قاضية الجينات في amastigote خارج الخلية من التريبانوسوما كروزي، وذلك باستخدام نظام كريسبر / Cas9. ويمكن متابعة النمط الظاهري للنمو إما عن طريق عد الخلايا من ثقافة الماستيغوت الفأس أو عن طريق انتشار الماستيغوت داخل الخلايا بعد غزو الخلية المضيفة.
Abstract
تريبانوسوما كروزي هو طفيلي بروتوزوان المسبب للأمراض الذي يسبب مرض شاغاس بشكل رئيسي في أمريكا اللاتينية. من أجل تحديد هدف جديد للمخدرات ضد T. cruzi، من المهم التحقق من صحة ضرورة الجينات المستهدفة في مرحلة الثدييات من الطفيلي ، وamastigote. Amastigotes من T. كروزي تكرار داخل الخلية المضيفة; وبالتالي، فإنه من الصعب إجراء تجربة خروج المغلوب دون الذهاب من خلال مراحل التنمية الأخرى. في الآونة الأخيرة، أبلغت مجموعتنا عن حالة نمو يمكن فيها للamastigote تكرار axenically لمدة تصل إلى 10 أيام دون أن تفقد خصائصها الشبيهة بamastigote. باستخدام هذه الثقافة amastigote axenic الزمنية، قدمنا بنجاح gRNAs مباشرة في Amastigote Cas9 التعبير عن التسبب في خروج المغلوب الجينات وتحليل الأنماط الظاهرية الخاصة بهم حصرا في مرحلة amastigote. في هذا التقرير، نقوم بوصف بروتوكول مفصل لإنتاج في المختبر المستمدة من الماستيغوت، والاستفادة من ثقافة الفأس في تجربة خروج المغلوب كريسبر / Cas9 بوساطة. يمكن تقييم النمط الظاهري للنمو من amastigotes بالضربة القاضية إما عن طريق عدد الخلايا من الثقافة axenic، أو عن طريق النسخ المتماثل من amastigote داخل الخلايا بعد غزو الخلية المضيفة. هذا الأسلوب يتجاوز التمايز مرحلة الطفيلي تشارك عادة في إنتاج amastigote المعدلة وراثيا أو بالضربة القاضية. استخدام ثقافة الماستيغوت الفأس الزمنية لديه القدرة على توسيع الحرية التجريبية للدراسات الخاصة بمرحلة محددة في T. cruzi.
Introduction
تريبانوسوما كروزي هو العامل المسبب لمرض شاغاس ، والذي ينتشر بشكل رئيسي في أمريكا اللاتينية1. T. كروزي لديه مراحل دورة حياة مميزة كما أنه يسافر بين ناقلات الحشرات ومضيف الثدييات2. T. كروزي يكرر كما الظهارة في midgut من علة ترياتوميمين مص الدم ويميز في trypomastigote المعدية في الجزء الخلفي قبل أن تودع على الإنسان أو الحيوان المضيف. مرة واحدة في trypomastigote يحصل في الجسم المضيف من خلال موقع لدغة أو من خلال غشاء المخاطية، والطفيلي يغزو خلية المضيف ويتحول إلى شكل جولة فلاجيلا أقل تسمى amastigote. ينسخ ال [أمستجوت] داخل المضيفة خلية و [إينرتيم] أخيرا يميّز داخل [تريبومستغوت], أيّ ينفجر من المضيفة خلية ويدخل الدم مجرى أن يصيب آخر مضيفة خلية.
منذ وكلاء العلاج الكيميائي المتاحة حاليا, benznidazole وnifurtimox, تسبب الآثار الجانبية السلبية وغير فعالة في المرحلة المزمنة من المرض3, فمن مصلحة كبيرة لتحديد أهداف المخدرات جديدة ضد T. كروزي. في السنوات الأخيرة، أصبح نظام CRISPR/Cas9 أداة قوية لأداء الجينات بالضربة القاضية بشكل فعال في T. cruzi، إما عن طريق نقل بلازميد منفصل أو واحد يحتوي على gRNA و Cas94، من خلال التعبير المستقر عن Cas9 واللاحقة إدخال gRNA5،6،7 أو قالب النسخ من gRNA8،أو عن طريق الكهربائي من مجمع gRNA /Cas9 RNP شكلت مسبقا7،9. ومن المتوقع إلى حد كبير أن يسرع هذا التقدم التكنولوجي في البحوث التي تستهدف المخدرات في مرض شاغاس.
للمضي قدما في تطوير المخدرات ، من الأهمية بمكان التحقق من أهمية الجين المستهدف أو فعالية المركبات المرشحة للأدوية في amastigote T. cruzi، كما هو مرحلة النسخ المتماثل للطفيلي في المضيف الثدييات. ومع ذلك، هذه مهمة صعبة، لأنه لا يمكن التلاعب بـ amastigotes مباشرة بسبب وجود خلية مضيف معرقلة. في ليشمانيا، وهو طفيلي بروتوزوان وثيق الصلة إلى T. cruzi، تم تطوير طريقة زراعة الماستيجوت الفأسية واستخدمت في فحص المخدرات الاختبارات10،11،12، 13.على الرغم من أن هناك بعض الاختلافات في قابلية المركبات بين الماستيغوتات الفأسوية وamastigotes داخل الخلايا14،والقدرة على الحفاظ على ثقافة الفأس مع ذلك يوفر أدوات تجريبية قيمة لدراسة البيولوجيا الأساسية للمرحلة ذات الصلة سريريا من الليشمانيا15،16. في حالة T. كروزي، والآداب فيما يتعلق بوجود amastigotes خارج الخلية التي تحدث بشكل طبيعي (EA)17 وفي إنتاج المختبر من EA17،18،19 يعود تاريخها إلى منذ عقود. وبالإضافة إلى ذلك، من المعروف أن EA لديها قدرة معدية20، وإن كان أقل من ذلك من trypomastigote، وقد تم توضيح آلية غزو المضيف amastigote في السنوات الأخيرة (استعرض من قبل Bonfim-Melo وآخرون21). ومع ذلك، على عكس ليشمانيا، لم يتم استخدام EA كأداة تجريبية في T. cruzi، ويرجع ذلك في المقام الأول إلى أن EA كان يعتبر طفيلي داخل الخلايا ملزمة ، وبالتالي لم يكن يعتبر "شكل التكرار" في عملية معني.
في الآونة الأخيرة، اقترحت مجموعتنا للاستفادة من EA من T. كروزي كثقافة axenic الزمنية22. Amastigotes من سلالة T. كروزي تولاهوين يمكن تكرار خالية من الخلايا المضيفة في وسط LIT في 37 درجة مئوية لمدة تصل إلى 10 أيام دون تدهور كبير أو فقدان خصائص تشبه amastigote. خلال فترة النمو الخالية من المضيف، تم استخدام EA بنجاح للتعبير الجيني الخارجي عن طريق الكهربة التقليدية، وفحص معايرة المخدرات مع مركبات التربانوسيدال، وخروج المغلوب كريسبر/كاس9 بوساطة تليها رصد النمط الظاهري للنمو. في هذا التقرير، ونحن نصف البروتوكول التفصيلي لإنتاج في المختبر المستمدة EA واستخدام amastigote axenic في تجارب خروج المغلوب.
Protocol
ملاحظة: ويرد في الشكل 1عرض عام للتدفق التجريبي بأكمله.
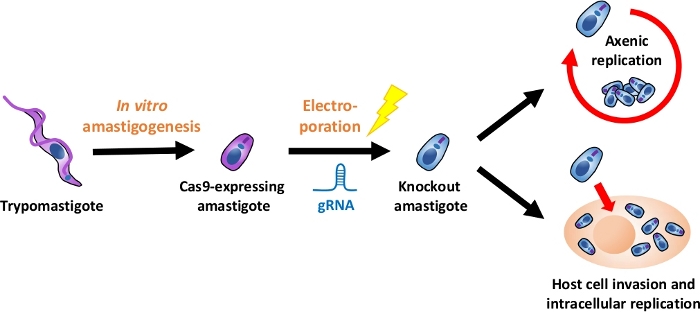
الشكل 1: نظرة عامة على تجربة خروج المغلوب باستخدام EA. يتم حصاد التربومستجوتات المشتقة من زراعة الأنسجة وتمييزها في EA. يتم نقل gRNA إلى amastigotes Cas9-expressing عن طريق الكهربائي، ويتم تقييم النمط الظاهري للنمو من amastigote بالضربة القاضية إما عن طريق النسخ المتماثل axenic أو عن طريق النسخ المتماثل داخل الخلايا بعد غزو الخلية المضيفة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. الاستعدادات الثقافية الطفيلية
- يتم استخدام سلالة تولاهوين من التريبانوسوما كروزي في جميع أنحاء هذا التقرير. الحفاظ على النعوت من T. كروزي في وسط LIT (10٪ FCS، انظر الجدول التكميلي1). أغلق الغطاء بأمان وحافظ على قارورة الثقافة عند درجة حرارة 28 درجة مئوية.
- توليد سلالة المعدلة وراثيا من T. كروزي التي تأوي endonuclease Cas9. يمكن العثور على أمثلة للتعبير بلازميدات التي تحتويعلى تسلسل الترميز Cas9 وG418 (ص الجدد) علامة الاختيار في Lander et al.4 وPeng et al.5
- تحويل البلازميد أعلاه إلى الظهارة عن طريق الكهربائي، وذلك باستخدام مجموعة المدرجة في جدولالمواد. ل1 cuvette, تدور أسفل 2 × 107 الخلايا, تجاهل supernatant, وإعادة تعليق مع 100 € L من العازلة الكهربائي التي تحتوي على الحل الملحق المقدمة.
ملاحظة: يمكن استبدال المخزن المؤقت الكهربائي بالمخزن المؤقت EM24 (خليط 3:1 من السيتوميكس25 والمخزن المؤقت للفوسفات والسكروز). - إضافة 20-40 ميكروغرام من البلازميد ونقل الخليط إلى 2 ملم الفجوة الكهربائي cuvette. تطبيق النبض مع جهاز الكهربائي (انظر جدولالمواد)، وذلك باستخدام X-14 البرنامج26.
- نقل محتويات كوفيت في قارورة T-25 التي تحتوي على 5 مل من وسائل LIT (10٪ FCS). احتضان قارورة في 28 درجة مئوية لمدة 24ساعة.
- إضافة G418 إلى تركيز نهائي من 250 ميكروغرام / مل ومواصلة الحضانة في 28 درجة مئوية. يستغرق حوالي أسبوع واحد لقتل من الماصدات غير المنقولة. بمجرد أن يبدأ السكان المقاومين G418 في التعافي، مرور الثقافة مرة أو مرتين في الأسبوع لتجنب التشبع وتخفيف الخلايا الميتة. إنشاء خط خلية مستقرة عادة ما يستغرق ما مجموعه 4 أسابيع.
ملاحظة: إذا كان التعبير التأسيسي لCas9 هو عبء على الخلية5، وجعل التعبير محددة لمرحلة amastigote عن طريق اقتران 3 '-UTR من الجينات amastin المصب مباشرة من إطار القراءة المفتوحة Cas927. ويمكن الاطلاع على الوصف المفصل لبلازميد التعبير Cas9 الخاص بـ amastigote في Takagi et al.22
- تحويل البلازميد أعلاه إلى الظهارة عن طريق الكهربائي، وذلك باستخدام مجموعة المدرجة في جدولالمواد. ل1 cuvette, تدور أسفل 2 × 107 الخلايا, تجاهل supernatant, وإعادة تعليق مع 100 € L من العازلة الكهربائي التي تحتوي على الحل الملحق المقدمة.
- إنشاء ثقافة مشتركة للطفيلي المضيف للخلايا المضيفة لـ T.cruzi والثدييات. في هذا التقرير، استخدم 3T3-سويس ألبينو خلية الأورام الليفية كمضيف.
- تمييز النعوت T. كروزي في التريبوماسجيت الميتاسيكلية. تحديد كثافة الخلايا من ثقافة الظهارة باستخدام مقياس الهيموجيتومتر وجمع 5 × 107 الخلايا عن طريق الطرد المركزي لمدة 15 دقيقة في 2100 × ز. تجاهل supernatant وإعادة تعليق الخلايا مع 10 مل من وسائل RPMI. حضانة الطفيلي في 28 درجة مئوية لمدة أسبوع واحد28.
- جمع التريبوماستيغوت الميتاسيكلية في متوسط RPMI. إمالة بعناية قارورة وpipet من الحل دون إزعاج الطفيليات انضمت إلى السطح السفلي. نقل المتوسطة إلى أنبوب مخروطي والطرد المركزي لمدة 15 دقيقة في 2100 × ز. تخلص من الـ supernatant وأعيد تعليق الطفيلي مع 5 مل من DMEM (10٪ FCS).
ملاحظة: السكان الطفيلي هو خليط من التريبوماستيغوت اتّصالية، وإبيماستيغوت، وبعض الأشكال الوسيطة. على الرغم من أن ليس من الضروري، يمكنك عزل trypomastigote بواسطة DEAE أيون تبادل اللونية29. بدلا من ذلك ، يمكن القضاء على الظهارة عن طريق احتضان الطفيليات مع المصل النشط لإخضاعها لاستكمال lysis30. - البذور 3T3-السويسرية الالبينو خلية الأورام الليفية إلى 60-70٪ الملاءمة، أو حوالي 1.7-2.0 × 106 خلايا في 5 مل من DMEM (10٪ FCS) في قارورة الثقافة T-25. إزالة متوسط النمو وتطبيق خليط الطفيلي من الخطوة 1.3.2. حضانة لمدة 24 ساعة في 37 درجة مئوية تحت 5٪ CO2 في حاضنة رطبة لإثبات العدوى.
- إزالة الطفيليات المتبقية خارج الخلايا المضيفة 3T3 عن طريق غسل الثقافة المشتركة مع DMEM (10٪ FCS) مرتين.
- مرة واحدة يتم تشبع الثقافة المشتركة، مرور الخلايا المضيفة المصابة amastigote عن طريق التربسيني. يستنشق الوسط ويشطف الثقافة مرة واحدة مع PBS. تطبيق 1 مل من 0.05٪ trypsin الحل لتغطية سطح الثقافة بأكمله، وحضانة لبضع دقائق في درجة حرارة الغرفة حتى تصبح الخلايا المضيفة المرفقة فضفاضة. فصل الخلايا من سطح قارورة عن طريق مسح 3 مل من DMEM (10٪ FCS) على الخلايا.
- نقل الخلايا المضيفة المنفصلة إلى أنبوب مخروطي، والطرد المركزي لمدة 3 دقائق في 300 × ز. يستنشق supernatant وإعادة تعليق الخلايا مع 3 مل من DMEM الطازجة (10٪ FCS). هذه الخطوة تساعد على القضاء على النعوت المتبقية. نقل جميع في قارورة T-75 نظيفة تحتوي على 9 مل من DMEM (10٪ FCS). استمر ّ في التَعَيّة حتّى يُطلق سراح تريبوساتيغوت في الثقافة الخارقة.
- الحفاظ على الثقافة المشتركة عن طريق تمرير مع التربسيين مرتين في الأسبوع. وبمجرد إصابة 70-80% من السكان المضيفين بالعدوى، تضيف بانتظام خلايا المضيف 3T3 غير المصابة بنسبة 5:1 (ترحيل:fresh)، من أجل تجنب تدهور الثقافة. [تربوستيجوت] يتأهّل باستمرار إن التوازن بين مضيفة خلايا و [ت.]. [كروزي] يكون بشكل صحيح حافظت.
2. تمايز التريبوماستيغوت في EA
- في اليوم السابق لهذه التجربة، قم بإزالة متوسط النمو للثقافة المشتركة للطفيلي المضيف وإضافة DMEM جديدة (10٪ FCS) لغسل EA وtrypomastigotes التي تم إصدارها بالفعل من الخلايا المضيفة في الأيام السابقة. تتطلب التجارب المنتظمة قوارير T-75 على الأقل من الثقافة المشتركة المتجانسة.
-
جمع الثقافة الفائقة في أنبوب مخروطي لحصاد ظهرت حديثا trypomastigotes. تحقق من العينة تحت المجهر (10X أو 20X عدسة موضوعية) للحصول على الجودة. إذا كان هناك حطام الخلية المضيفة، طرد مركزي لفترة وجيزة العينة ونقل supernatant إلى أنبوب جديد. إذا كان هناك عدد كبير من EAs، عزل trypomastigotes بواسطة إجراء السباحة التدريجي التالية.
- تدور أسفل خليط من trypomastigotes وamastigotes لمدة 15 دقيقة في 2100 × ز. تجاهل معظم supernatant، وترك 0.5-1.0 مل من المتوسطة في الأنبوب.
ملاحظة: تقليل وحدة التخزين اختياري ولكنه يجعل الخطوة التالية أسهل. - احتضان بيليه في 37 درجة مئوية لمدة 1-2 ساعة، مما يسمح trypomastigotes النشطة للسباحة من بيليه (الشكل2).
- نقل supernatant التي تحتوي على trypomastigotes إلى أنبوب الطرد المركزي الصغير 1.5 مل.
- تدور أسفل خليط من trypomastigotes وamastigotes لمدة 15 دقيقة في 2100 × ز. تجاهل معظم supernatant، وترك 0.5-1.0 مل من المتوسطة في الأنبوب.
- الطرد المركزي أنبوب مخروطي لمدة 15 دقيقة في 2100 × ز لجمع trypomastigotes. إذا تم إجراء السباحة خارج أعلاه، الطرد المركزي أنبوب 1.5 مل لمدة 2 دقيقة في 4000 × ز إلى بيليه trypomastigote. تجاهل الـ supernatant.
- إعادة تعليق بيليه مع 5 مل من DMEM المخزنة مؤقتا مع 20 مل MES (الحموضة 5.0)، تستكمل مع 0.4٪ BSA19. نقل الطفيلي إلى قارورة ثقافة T-25. اترك الغطاء طليقاً يجب أن تكون كثافة الخلية حول أو أقل من 1 × 107 خلايا / مل، لأن التشبع المفرط يزيد من فرصة موت الخلية.
ملاحظة: يجب أن يكون لون DMEM أصفر، وليس برتقالي. إذا كان DMEM الأصلي قدرة التخزين المؤقت عالية، 20 mM MES (درجة الحموضة 5.0) ليست كافية لخفض درجة الحموضة. يجب تعديل درجة الحموضة للوسط بإضافة حمض الهيدروكلوريك في هذه الحالة. يمكن الاحتفاظ المتوسطة الحمضية في 4 درجة مئوية، ولكن لا يزيد عن شهر واحد. - احتضان قارورة الثقافة في 37 درجة مئوية تحت 5٪ CO2 في حاضنة رطبة. حوالي 95٪ من الطفيليات تفرق في الماستيجوت بعد 24 ساعة.
3. الكهربائي من EA
- إعداد gRNA للكهرباء. ويمكن أن يتم ذلك عن طريق النسخ في المختبر، أو ببساطة عن طريق شراء oligonucleotides الحمض النووي الريبي الاصطناعية من الشركة المصنعة. في هذا التقرير، يتم استخدام crRNA وtracrRNA من تقنيات الحمض النووي المتكاملة، وشركة.
- الطرد المركزي ثقافة EAs لمدة 15 دقيقة في 2100 × ز. تجاهل المناوة.
- إعادة تعليق بيليه مع العازلة الكهربائي التي تحتوي على توفير حل الملحق لكثافة الخلية النهائية من 1 × 108 خلايا / مل.
ملاحظة: يؤدي المخزن المؤقت EM المزيد من وفيات الخلايا مقارنة بالمخزن المؤقت الكهربائي المدرج في جدولالمواد; وبالتالي، فإنه لا ينصح لالتغوط amastigote (الشكلالتكميلي1). - Aliquot 100 ميكرولتر من الطفيليات المعلقة (1 × 107 خلايا) في أنابيب الطرد المركزي الدقيقة 1.5 مل. إضافة 5-10 ميكروغرام من gRNA ومزيج بلطف عن طريق الأنابيب.
- نقل الخليط إلى 2 ملم الفجوة الكهربائي cuvette. تطبيق النبض مع جهاز الكهربائي، وذلك باستخدام برنامج X-14.
- نقل محتويات كوفيت في قارورة T-25 التي تحتوي على 5 مل من وسط LIT الدافئة مسبقا (10٪ FCS). اترك الغطاء فضفاضًا واحتضن القارورة عند درجة حرارة 37 درجة مئوية تحت 5% CO2.
- مراقبة نمو الخلايا إما عن طريق استمرار زراعة الفأس (القسم 4) أو كما amastigotes داخل الخلايا بعد عدوى الخلية المضيفة (القسم 5).
4. رصد نمو الخلايا بالضربة القاضية كما Amastigotes أكسيك
- EAs تسوية في الجزء السفلي من وسط الثقافة، حتى يهز بلطف قارورة لإعادة تعليقها في الحل. غسل سطح قارورة عن طريق الأنابيب يساعد، كما يتم الالتزام ببعض الخلايا إلى قارورة.
- مزيج 1 ميكرولتر من محلول يوديد (PI) (20 ميكروغرام/مل) مع 20 ميكرولتر من ثقافة الماستيغوت.
ملاحظة: لا تترك قارورة الثقافة خارج الحاضنة لفترة أطول من اللازم. درجة الحرارة هي واحدة من العوامل التي تمكن انتشار الفأس22. - تطبيق العينة على مقياس الهيموكيتومومتر ومراقبة تحت المجهر الفلوري. والمقصود PI لغشاء الخلية التالفة ولكن يتم استبعادها من الخلايا الحية. عد عدد amastigotes قابلة للحياة التي ليست ملطخة PI (السابقين / م 570 نانومتر / 602 نانومتر).
5. رصد نمو الخلايا خروج المغلوب كما Amastigotes داخل الخلايا
- البذور المضيفة خلايا 3T3 في لوحة 12 جيدا مع DMEM (10٪ FCS). ضبط كثافة الخلية إلى 70-80٪ من الملاءمة، أو حوالي 3 × 105 خلايا في بئر.
ملاحظة: منذ amastigotes ليست motile، وتغطي معظم سطح النمو من قبل الخلايا المضيفة يحسن كفاءة العدوى. - جمع amastigotes بالضربة القاضية من الخطوة 3.6 من قبل الطرد المركزي يوم واحد بعد الكهربائي. تخلص من الـ supernatant، وأعيد تعليق الطفيلي مع 2 مل من DMEM (10٪ FCS).
- إزالة المتوسطة من ثقافة الخلية المضيفة وتطبيق amastigotes resuspended. يجب أن يكون تعدد العدوى 20 أو أعلى. حضانة لوحة في 37 درجة مئوية تحت 5٪ CO2 لمدة 2 أيام للسماح للamastigotes لإثبات العدوى.
ملاحظة: يمكن أن تكون فترة العدوى يوم ًا واحدًا، وفقًا للغرض. - غسل بعيدا [إ] بقي خارج من المضيفة خلايا مرّتين مع [دم] (10% [فكس]).
- إضافة DMEM جديدة (10٪ FCS) إلى الثقافة المشتركة الطفيلي المضيف ومواصلة الحضانة في 37 درجة مئوية لمدة يومين إضافيين.
-
لتقييم كفاءة العدوى، تصور نوى الخلايا المضيفة وamastigote داخل الخلايا.
ملاحظة: النوى تميل إلى أن تتداخل في الثقافة المشتركة المشبعة. إعادة طلاء الخلايا في كثافة الخلية السفلى (مثل تخفيف 1:5) قبل التثبيت وتلطيخ يساعد على حساب النوى بسهولة أكبر.- إزالة وسط الثقافة وتطبيق 1 مل من 10٪ حل رسمي في PBS لإصلاح الخلايا. الحضانة لمدة 10 دقائق في درجة حرارة الغرفة.
- استبدال الحل الرسمي مع 1 مل من PBS تحتوي على 1 ميكروغرام / مل Hoechst 33342 و 0.1٪ تريتون X-100. الحضانة لمدة 5 دقائق في درجة حرارة الغرفة.
- إزالة الحل Hoechst وشطف الخلايا مرة واحدة مع PBS. إضافة 1 مل من PBS الطازجة.
- مراقبة تحت المجهر الفلوري وتحديد نواة الخلية المضيفة التي ترتبط معالنوى الطفيلية أصغر (الشكل 4). وينبغي اعتبار الخلايا المضيفة التي تحتوي على أكثر من 2 من الماستيغوت اتلاف، لا تشمل العدوى الأولية غير المنتجة أو EAs غير المغسولة.
النتائج
عزل التريبوماستيغوت اتّبأ من خلال إجراء السباحة
لحصاد التربومستجوتات الطازجة من تلوث EAs القديمة عن طريق إجراء السباحة التدريجي ، يجب أن يتم احتضان كريات الخلايا لمدة 1 ساعة على الأقل. الشكل 2باء). في هذه التجربة بالذات، كانت النسبة المئوية للtrypomastigot...
Discussion
لقد أثبتنا أن الثقافة الفأسية لـ T. cruzi amastigotes يمكن استخدامها في ضربة قاضية للجين كريسبر/كاس9 بوساطة، وذلك عن طريق الكهربائي gRNA مباشرة إلى Cas9-التعبير عن EA. وبهذه الطريقة، يمكن تقييم ضرورة الجين المستهدف على وجه التحديد في مرحلة الماستيغوت دون المرور بمراحل تنموية أخرى.
ج?...
Disclosures
وليس لدى أصحاب البلاغ أي تضارب في المصالح للكشف عنها.
Acknowledgements
وقد تم دعم هذا العمل جزئيا من قبل JSPS KAKENHI منحة رقم 18K15141 إلى Y.T.
Materials
| Name | Company | Catalog Number | Comments |
| 20% formalin solution | FUJIFILM Wako Pure Chemical | 068-03863 | fixing cells |
| 25 cm2 double seal cap culture flask | AGC Techno Glass | 3100-025 | |
| 75 cm2 double seal cap culture flask | AGC Techno Glass | 3110-075 | |
| All-in One Fluorescence Microscope | Keyence | BZ-X710 | |
| Alt-R CRISPR-Cas9 crRNA (for Control) | IDT | custom made | target sequence = GGACGGCACCTTCATCTACAAGG |
| Alt-R CRISPR-Cas9 crRNA (for TcCGM1) | IDT | custom made | target sequence = TAGCCGCGATGGAGAGTTTATGG |
| Alt-R CRISPR-Cas9 crRNA (for TcPAR1) | IDT | custom made | target sequence = CGTGGAGAACGCCATTGCCACGG |
| Alt-R CRISPR-Cas9 tracrRNA | IDT | 1072532 | to anneal with crRNA |
| Amaxa Nucleofector device | LONZA | AAN-1001 | electroporation |
| Basic Parasite Nucleofector Kit 2 | LONZA | VMI-1021 | electroporation |
| BSA | Sigma-Aldrich | A3294 | component of the medium for in vitro amastigogenesis |
| Burker-Turk disposable hemocytometer | Watson | 177-212C | cell counting |
| Coster 12-well Clear TC-Treated Multiple Well Plates | Corning | 3513 | |
| DMEM | FUJIFILM Wako Pure Chemical | 044-29765 | culture medium |
| Fetal bovine serum, Defined | Hyclone | SH30070.03 | heat-inactivate before use |
| G-418 Sulfate Solution | FUJIFILM Wako Pure Chemical | 077-06433 | selection of transformant |
| Hemin chloride | Sigma-Aldrich | H-5533 | component of LIT medium |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | staining of nuclei |
| Liver infusion broth, Difco | Becton Dickinson | 226920 | component of LIT medium |
| MES | FUJIFILM Wako Pure Chemical | 349-01623 | component of the medium for in vitro amastigogenesis |
| PBS (–) | FUJIFILM Wako Pure Chemical | 166-23555 | |
| Propidium Iodide | Sigma-Aldrich | P4864-10ML | staining of dead cells |
| RPMI 1646 | Sigma-Aldrich | R8758 | medium for metacyclogenesis |
References
- World Health Organization. . (WHO) Fact sheet: Chagas disease (American trypanosomiasis). , (2017).
- Clayton, J. Chagas disease 101. Nature. 465 (n7301_supp), S4-S5 (2010).
- Apt, W. Current and developing therapeutic agents in the treatment of Chagas disease. Drug Design, Development and Therapy. 4, 243-253 (2010).
- Lander, N., Li, Z. H. H., Niyogi, S., Docampo, R. CRISPR/Cas9-induced disruption of paraflagellar rod protein 1 and 2 genes in Trypanosoma cruzi reveals their role in flagellar attachment. mBio. 6 (4), e01012 (2015).
- Peng, D., Kurup, S. P., Yao, P. Y., Minning, T. A., Tarleton, R. L. CRISPR-Cas9-mediated single-gene and gene family disruption in Trypanosoma cruzi. mBio. 6 (1), e02097-e02114 (2015).
- Romagnoli, B. A. A., Picchi, G. F. A., Hiraiwa, P. M., Borges, B. S., Alves, L. R., Goldenberg, S. Improvements in the CRISPR/Cas9 system for high efficiency gene disruption in Trypanosoma cruzi. Acta Tropica. 178, 190-195 (2018).
- Burle-Caldas, G. A., Soares-Simões, M., Lemos-Pechnicki, L., DaRocha, W. D., Teixeira, S. M. R. Assessment of two CRISPR-Cas9 genome editing protocols for rapid generation of Trypanosoma cruzi gene knockout mutants. International Journal for Parasitology. 48 (8), 591-596 (2018).
- Costa, F. C. Expanding the toolbox for Trypanosoma cruzi: A parasite line incorporating a bioluminescence-fluorescence dual reporter and streamlined CRISPR/Cas9 functionality for rapid in vivo localisation and phenotyping. PLoS Neglected Tropical Diseases. 12 (4), e0006388 (2018).
- Soares Medeiros, L. C. High-Efficiency Genome Editing in Protozoan Parasites Using CRISPR-Cas9 Ribonucleoproteins. mBio. 8 (6), (2017).
- Callahan, H. L., Portal, A. C., Devereaux, R., Grogl, M. An axenic amastigote system for drug screening. Antimicrobial Agents and Chemotherapy. 41 (4), 818-822 (1997).
- Bates, P. A. Axenic culture of Leishmania amastigotes. Parasitology Today. 9 (4), 143-146 (1993).
- Ravinder, R., Bhaskar, B., Gangwar, S., Goyal, N. Development of luciferase expressing Leishmania donovani axenic amastigotes as primary model for in vitro screening of antileishmanial compounds. Current Microbiology. 65 (6), 696-700 (2012).
- Nühs, A. Development and Validation of a Novel Leishmania donovani Screening Cascade for High-Throughput Screening Using a Novel Axenic Assay with High Predictivity of Leishmanicidal Intracellular Activity. PLoS Neglected Tropical Diseases. 9 (9), 1-17 (2015).
- De Rycker, M. Comparison of a high-throughput high-content intracellular Leishmania donovani assay with an axenic amastigote assay. Antimicrobial Agents and Chemotherapy. 57 (7), 2913-2922 (2013).
- Rochette, A., Raymond, F., Corbeil, J., Ouellette, M., Papadopoulou, B. Whole-genome comparative RNA expression profiling of axenic and intracellular amastigote forms of Leishmania infantum. Molecular and Biochemical Parasitology. 165 (1), 32-47 (2009).
- Pescher, P., Blisnick, T., Bastin, P., Späth, G. F. Quantitative proteome profiling informs on phenotypic traits that adapt Leishmania donovani for axenic and intracellular proliferation. Cellular Microbiology. 13 (7), 978-991 (2011).
- Andrews, N. W., Hong, K. S. U., Robbins, E. S., Nussenzweig, V. Stage-specific surface antigens expressed during the morphogenesis of vertebrate forms of Trypanosoma cruzi. Experimental Parasitology. 64 (3), 474-484 (1987).
- Pan, S. C. Trypanosoma cruzi: intracellular stages grown in a cell-free medium at 37 C. Experimental Parasitology. 45 (2), 215-224 (1978).
- Tomlinson, S., Vandekerckhove, F., Frevert, U., Nussenzweig, V. The induction of Trypanosoma cruzi trypomastigote to amastigote transformation by low pH. Parasitology. 110 (05), 547 (1995).
- Ley, V., Andrews, N. W., Robbins, E. S., Nussenzweig, V. Amastigotes of Trypanosoma cruzi sustain an infective cycle in mammalian cells. Journal of Experimental Medicine. 168 (0022-1007 (Print)), 649-659 (1988).
- Bonfim-Melo, A., Ferreira, E. R., Florentino, P. T. V., Mortara, R. A. Amastigote Synapse: The Tricks of Trypanosoma cruzi Extracellular Amastigotes. Frontiers in Microbiology. 9, 1341 (2018).
- Takagi, Y., Akutsu, Y., Doi, M., Furukawa, K. Utilization of proliferable extracellular amastigotes for transient gene expression, drug sensitivity assay, and CRISPR/Cas9-mediated gene knockout in Trypanosoma cruzi. PLOS Neglected Tropical Diseases. 13 (1), e0007088 (2019).
- Fernandes, J. F., Castellani, O. Growth characteristics and chemical composition of Trypanosoma cruzi. Experimental Parasitology. 18 (2), 195-202 (1966).
- Oberholzer, M., Lopez, M. A., Ralston, K. S., Hill, K. L. Approaches for Functional Analysis of Flagellar Proteins in African Trypanosomes. Methods in Cell Biology. 93, 21-57 (2009).
- van den Hoff, M. J. B., Moorman, A. F. M., Lamers, W. H. Electroporation in ‘intracellular’ buffer increases cell survival. Nucleic Acids Research. 20 (11), 2902-2902 (1992).
- Pacheco-Lugo, L., Díaz-Olmos, Y., Sáenz-García, J., Probst, C. M., DaRocha, W. D. Effective gene delivery to Trypanosoma cruzi epimastigotes through nucleofection. Parasitology International. 66 (3), 236-239 (2017).
- Coughlin, B. C., Teixeira, S. M., Kirchhoff, L. V., Donelson, J. E. Amastin mRNA abundance in Trypanosoma cruzi is controlled by a 3’-untranslated region position-dependent cis-element and an untranslated region-binding protein. The Journal of Biological Chemistry. 275 (16), 12051-1260 (2000).
- Shaw, A. K., Kalem, M. C., Zimmer, S. L. Mitochondrial Gene Expression Is Responsive to Starvation Stress and Developmental Transition in Trypanosoma cruzi. mSphere. 1 (2), (2016).
- Chao, D., Dusanic, D. G. Comparative studies of the isolation of metacyclic trypomastigotes of Trypanosoma cruzi by DEAE ion exchange chromatography. Zhonghua Minguo wei sheng wu ji mian yi xue za zhi (Chinese Journal of Microbiology and Immunology). 17 (3), 146-152 (1984).
- Nogueira, N., Bianco, C., Cohn, Z. Studies on the selective lysis and purification of Trypanosoma cruzi. The Journal of Experimental Medicine. 142 (1), 224-229 (1975).
- Minning, T. A., Weatherly, D. B., Atwood, J., Orlando, R., Tarleton, R. L., Tarleton, R. L. The steady-state transcriptome of the four major life-cycle stages of Trypanosoma cruzi. BMC Genomics. 10, 370 (2009).
- Rico, E., Jeacock, L., Kovářová, J., Horn, D. Inducible high-efficiency CRISPR-Cas9-targeted gene editing and precision base editing in African trypanosomes. Scientific Reports. 8 (1), 7960 (2018).
- Fu, Y. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nature Biotechnology. 31 (9), 822-826 (2013).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Research. 24 (6), 1012-1019 (2014).
- Chiurillo, M. A., Lander, N., Bertolini, M. S., Storey, M., Vercesi, A. E., Docampo, R. Different roles of mitochondrial calcium uniporter complex subunits in growth and infectivity of Trypanosoma cruzi. mBio. 8 (3), e00574-e00617 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved