JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
CRISPR/Cas9 시스템을 사용하여 트리파노소마 크루지의 아마스티고테 스테이지에 유전자 녹아웃 직접 도입
요약
여기에서, 우리는 CRISPR/Cas9 시스템을 사용하여, Trypanosoma cruzi의 세포외 amastigote로 유전자 녹아웃을 소개하는 프로토콜을 기술합니다. 성장 표현형은 축세포 배양의 세포 계수 또는 숙주 세포 침입 후 세포 내 아마스티고테의 증식에 의해 추적될 수 있다.
초록
Trypanosoma cruzi는 주로 라틴 아메리카에서 Chagas' 질병을 일으키는 원인이 되는 병원성 원생 동물 기생충입니다. T. cruzi에대하여 새로운 약 표적을 확인하기 위하여는, 기생충의 포유류 단계에서 표적 유전자의 본질성을 확인하는 것이 중요합니다, amastigote. T. 크루지의 아마스티고테스는 숙주 세포 내부에 복제; 따라서, 다른 발달 단계를 거치지 않고 녹아웃 실험을 수행하는 것은 어렵다. 최근, 우리 그룹은 아마스티고테가 아마스티고테와 같은 특성을 잃지 않고 최대 10 일 동안 축으로 복제 할 수있는 성장 상태를보고했습니다. 이 시간적인 축 식 amastigote 문화를 사용하여, 우리는 성공적으로 유전자 녹아웃을 일으키는 원인이 되기 위하여 Cas9 표현 amastigote에 직접 gRNA를 소개하고 amastigote 단계에서 독점적으로 그들의 표현형을 분석했습니다. 이 보고서에서, 우리는 시험관 내에서 파생 된 세포 외 amastigotes를 생산 하는 상세한 프로토콜을 설명 하 고 CRISPR/Cas9 중재 녹아웃 실험에서 축 배양 활용. 녹아웃 amastigotes의 성장 표현형은 축세포 배양의 세포 수에 의해, 또는 숙주 세포 침략 후에 세포 내 amastigote의 복제에 의해 평가될 수 있습니다. 이 방법은 일반적으로 형질 전환 또는 녹아웃 amastigote생산에 관여하는 기생충 단계 분화를 우회합니다. 시간적 축아제아스티고트 문화의 활용은 T. cruzi에서 단계별 연구의 실험적 자유를 확장할 가능성이 있다.
서문
Trypanosoma cruzi는 라틴 아메리카1에서주로 널리 퍼진 Chagas'질병의 원인 에이전트입니다. T. cruzi는 곤충 벡터와 포유류 호스트2사이를 이동하는 독특한 라이프 사이클 단계를 가지고 있습니다. T. cruzi 혈액 을 빠는 triatomine 버그의 midgut에 epimastigote로 복제 하 고 인간 또는 동물 호스트에 증착 되기 전에 그것의 뒷글에 감염 성 메타 세포 trypomastigote로 분화. trypomastigote 물린 사이트를 통해 또는 점 막을 통해 호스트 몸으로 되 면, 기생충 호스트 세포를 침공 하 고 amastigote 라는 편모 없는 둥근 형태로 변환. amastigote는 호스트 세포 내의 복제하고 결국 trypomastigote로 분화합니다, 이는 호스트 세포에서 파열하고 다른 호스트 세포를 감염시키기 위하여 혈류를 입력합니다.
현재 이용 가능한 화학치료제, 벤즈니다졸 및 니푸르티목스는 부작용을 일으키고 질병의 만성 단계에서효과가 없기 때문에 3, T. cruzi에 대한 새로운 약물 표적을 식별하는 것이 큰 관심사이다. 최근 몇 년 동안, CRISPR/Cas9 시스템은 GRNA 및 Cas9 4를 포함하는 별도의 또는 단일 플라스미드(들)의 형질전환에의해, Cas9의 안정적인 발현에 의해 T. cruzi에서유전자 녹아웃을 효과적으로 수행할 수 있는 강력한 도구가 되었습니다. gRNA5,6,7 또는 gRNA8의전사 템플릿의 도입, 또는 미리 형성된 gRNA/Cas9 RNP 복합체의 전기화에 의해7,9. 이러한 기술 발전은 Chagas'질병의 약물 표적 연구를 가속화할 것으로 기대됩니다.
약물 개발을 진행하기 위해서는 포유류 숙주에서 기생충의 복제 단계이기 때문에 T. cruzi의amastigote에서 표적 유전자 또는 약물 후보 화합물의 효능의 본질성을 검증하는 것이 중요합니다. 그러나, 이것은 도전적인 작업, 때문에 방해 호스트 세포의 존재에 직접 조작 할 수 없습니다. 리슈마니아에서는 T. cruzi와밀접하게 관련된 원생 동물 기생충, 축아제 배양 방법이 개발되었으며 약물 스크리닝 검거 법제10,11,12, 13. 도끼 아마스티고테와 세포 내 아마스티고테스(14)사이의 화합물에 대한 감수성에 약간의 불일치가 있지만, 축배양을 유지하는 능력은 그럼에도 불구하고 연구할 귀중한 실험 도구를 제공합니다. 리슈마니아15,16의임상적으로 관련된 단계의 기본 생물학 . T. cruzi의경우, 자연적으로 발생하는 세포외 amastigotes의 존재에 관한 문헌 (EA)17 및 EA의 체외 생산17,18,19 거슬러 올라간다 수십 년 전. 또한, EA는 20의 전염성능력을 가지는 것으로 알려져 있으며, 이는 트라이포마스티고테보다 적기는 하지만, 아마스티고테 숙주 침공의 메커니즘은 최근 몇 년 동안 해명되었다(본피엠-멜로 등21). 그러나, Leishmania와는달리, EA는 T. cruzi에있는 실험 적인 공구로 이용되지 않았습니다, EA가 의무적인 세포내 기생충으로 여겨졌기 때문에, 따라서 실용적인에서 "복제 양식"으로 간주되지 않았기 때문에 감각.
최근 우리 그룹은 T. cruzi의 EA를 일시적인 축문화(22)로 활용하자고 제안했다. T. cruzi Tulahuen 균주의 아마스티고트는 37°C에서 LIT 배지에서 숙주 세포의 자유로운 복제를 최대 10일 동안 주요 열화 또는 아마티고테 유사 성질의 손실 없이 복제할 수 있다. 숙주 없는 성장 기간 동안, EA는 기존의 전기천공에 의한 외인성 유전자 발현, 트라이파노시드 화합물을 통한 약물 적정 분석, CRISPR/Cas9 매개 녹아웃에 의한 성장 표현형 모니터링에 성공적으로 활용되었다. 이 보고서에서, 우리는 시험관내에서 유래된 EA를 생산하고 녹아웃 실험에서 축산 아마스티고테를 활용하기 위한 상세한 프로토콜을 설명한다.
프로토콜
참고: 전체 실험 흐름에 대한 개요는 그림1에 설명되어 있습니다.
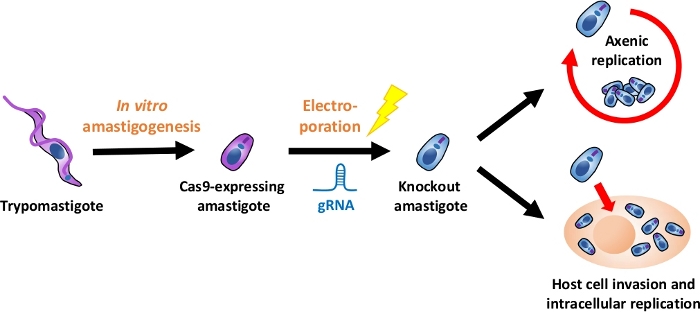
그림 1: EA를 사용한 녹아웃 실험개요. 조직 배양 유래 trypomastigotes는 EA로 수확되고 분화됩니다. gRNA는 전기 기공에 의해 Cas9 발현 아마스티고테로 형질전환되고, 녹아웃 아마스티고트의 성장 표현형은 축세포 복제또는 에 의해 평가된다. 호스트 세포 침략 후 세포 내 복제. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 기생충 문화 준비
- 트라이파노소마 크루지의 툴라후엔 균주는 이 보고서 전반에 걸쳐 사용된다. LIT 배지에서 T. 크루지의 에피마스티고트 유지(FCS 10%, 보충표 1참조). 뚜껑을 단단히 닫고 배양 플라스크를 28°C로 유지합니다.
- Cas9 엔도누슬리스를 항하는 T. 크루지의 형질전환 균주를 생성합니다. Cas9 코딩 서열 및 G418(neo r) 선택마커를 포함하는 발현 플라스미드의 예는 Lander et al.4 및 Peng et al.5에서 확인할 수 있습니다.
- 재료표에 열거된 키트를 사용하여 상기 플라스미드를 전기 천공에 의해 에피마스티고트로 트랜스펙트한다. 큐벳 1개에 대해 2 x 107 셀을 스핀다운하고 상류물을 버리고 제공된 보충제 용액을 함유한 100 μL의 전기 천공 완충제로 다시 중단하십시오.
참고: 전기 천공 버퍼는 EM 버퍼 24(사이토믹스25 및 인산염 수크로오스 완충액의 3:1 혼합물)로 치환될 수 있다. - 플라스미드 20-40 μg를 넣고 혼합물을 2mm 간격 전기 화기 큐벳으로 옮긴다. X-14 프로그램26을사용하여 전기 개루 장치(재료 표참조)로 펄스를 적용합니다.
- 큐벳 내용물 5mL의 LIT 배지(10% FCS)가 들어 있는 T-25 플라스크에 옮김을 옮김을 옮니다. 24 시간 동안 28 °C에서 플라스크를배양합니다.
- G418을 최종 농도 250 μg/mL에 추가하고 28°C에서 인큐베이션을 계속합니다. 그것은 비 형질 감염 된 epimastigotes를 죽일 약 1 주 걸립니다. 일단 G418 저항하는 인구가 복구하기 시작하면, 포화를 피하고 죽은 세포를 희석하기 위하여 문화를 일주일에 한두 번 통과합니다. 안정한 세포주의 설치는 일반적으로 총 4 주가 걸립니다.
참고: Cas9의 구성발현이 세포(5)에 대한부담이라면, Cas9 오픈 판독 프레임(27)의 하류에 있는 아마스틴 유전자의 3'-UTR을 즉시하류에 결합시킴으로써 아마스티고테 단계에 특이적인 발현을 한다. 아마스티고테 특이적 Cas9 식 플라스미드에 대한 자세한 설명은 타카기 외22에서 확인할 수 있습니다.
- 재료표에 열거된 키트를 사용하여 상기 플라스미드를 전기 천공에 의해 에피마스티고트로 트랜스펙트한다. 큐벳 1개에 대해 2 x 107 셀을 스핀다운하고 상류물을 버리고 제공된 보충제 용액을 함유한 100 μL의 전기 천공 완충제로 다시 중단하십시오.
- Cas9-발현 T. 크루지 및 포유류 숙주 세포의 숙주 기생충 공동 배양을 확립한다. 이 보고에서, 숙주로서 3T3-스위스 알비노 섬유아세포 세포를 사용한다.
- T. 크루시 에피마스티고테스를 메타사이클 트리포마스티고테스로 차별화합니다. 혈세포계를 사용하여 상피 배양의 세포 밀도를 결정하고 2,100 x g에서 15 분 동안 원심분리에 의해 5 x 107 세포를 수집합니다. 상급체를 버리고 RPMI 배지의 10 mL로 세포를 다시 일시 중단합니다. 1 주28에대 한 28 °C에서 기생충을 배양.
- RPMI 매체에 메타 사이클 트리포 마시고테스를 수집합니다. 조심스럽게 플라스크를 기울이고 바닥 면에 부착 된 기생충을 방해하지 않고 용액을 피펫. 2,100 x g에서 15 분 동안 원원수 튜브와 원심 분리기로 매체를 옮긴다. 상급을 버리고 5 mL의 DMEM (10 % FCS)로 기생충을 다시 중단하십시오.
참고: 기생충 인구는 메타 시크 릭 트리포 마 스티 고테의 혼합물, epimastigotes, 그리고 일부 중간 형태. 필요하지는 않지만 DEAE 이온 교환 크로마토그래피(29)에의해 trypomastigote를 분리 할 수 있습니다. 대안적으로, epimastigotes는 활성 혈청으로 기생충을 배양하여 용해(30)를보완하기 위해 그들을 대상으로 함으로써 제거될 수 있다. - 시드 3T3-스위스 알비노 섬유아세포는 T-25 배양 플라스크에서 DMEM(10% FCS)의 5 mL에서 60-70% 동률, 또는 약 1.7-2.0 x 10 6세포를 나타낸다. 성장 배지를 제거하고 단계 1.3.2에서 기생충 혼합물을 적용합니다. 감염을 확립하기 위해 가습 된 인큐베이터에서 5 %CO2 미만에서 37 °C에서 24 시간 동안 배양하십시오.
- DMEM(10% FCS)과 공동 배양을 세척하여 숙주 3T3 세포 외부에 남아 있는 기생충을 2회 제거한다.
- 일단 공동 배양이 포화되면, 트립시네화에 의해 아마스티고테-감염된 숙주 세포를 통로에 감염시다. 배지를 흡인하고 PBS로 배양을 한 번 헹구는다. 전체 배양 표면을 커버하기 위해 0.05% 트립신 용액 의 1 mL을 적용하고, 부착 된 숙주 세포가 느슨해질 때까지 실온에서 몇 분 동안 배양한다. 3 mL의 DMEM (10% FCS)을 세포 위로 플러시하여 플라스크 표면으로부터 세포를 분리합니다.
- 분리된 숙주 세포를 원유관으로 옮기고, 300 x g에서 3분 동안 원심분리기를 한다. 상월체를 흡인하고 신선한 DMEM (10 % FCS)의 3 mL로 세포를 재중단시. 이 단계는 남아있는 epimastigotes을 제거하는 데 도움이됩니다. DMEM 9mL(10% FCS)를 함유한 깨끗한 T-75 플라스크에 모두 옮김을 옮니다. trypomastigote 문화 상급으로 출시 될 때까지 배양을 계속.
- 일주일에 두 번 트립시니화와 함께 통과하여 공동 문화를 유지합니다. 일단 호스트 인구의 70-80%가 감염되면, 배양 악화를 피하기 위하여 5:1(이월:신선)의 비율로 감염되지 않은 호스트 3T3 세포를 정기적으로 추가합니다. 트리포마스티고테는 숙주 세포와 T. 크루지 사이의 균형이 적절히 유지되는 경우 지속적으로 송신한다.
2. EA로 트리포마스티고테스의 차별화
- 본 실험 전날, 숙주 기생충 공동 배양의 성장 배지를 제거하고 신선한 DMEM(10% FCS)을 첨가하여 이전에 숙주 세포로부터 이미 방출된 EA 및 trypomastigotes를 씻어낸다. 정기적인 실험은 적어도 두 개의 T-75 플라스크가 필요합니다.
-
원추형 튜브에 배양 상류를 수집하여 갓 출현한 trypomastigotes를 수확합니다. 현미경(10x 또는 20x 대물 렌즈)으로 샘플을 확인하여 품질을 확인합니다. 숙주 세포 파편이있는 경우, 샘플을 잠시 원심 분리하고 상구체를 새 튜브로 옮김. 상당한 수의 EA가 있는 경우, 다음 의 스윔아웃 절차에 의해 trypomastigotes를 격리하십시오.
- 2,100 x g에서 15 분 동안 trypomastigotes와 아마스티고테스의 혼합물을 스핀 다운하십시오. 튜브에 매체의 0.5-1.0 mL를 떠나, 상류의 대부분을 폐기.
참고: 볼륨을 줄이는 것은 선택 사항이지만 다음 단계를 더 쉽게 만듭니다. - 펠렛을 37°C에서 1-2시간 동안 배양하여 활성 트리포마스티고트가 펠릿에서수영할 수 있도록 합니다(그림 2).
- 1.5 mL 미세 원심 분리튜브에 trypomastigotes를 포함하는 상급을 전송합니다.
- 2,100 x g에서 15 분 동안 trypomastigotes와 아마스티고테스의 혼합물을 스핀 다운하십시오. 튜브에 매체의 0.5-1.0 mL를 떠나, 상류의 대부분을 폐기.
- 원원줄기를 2,100 x g에서 15분 동안 원원분리하여 트리포마스티고테스를 수집한다. 스윔 아웃 절차가 위에서 수행된 경우, 1.5 mL 튜브를 4,000 x g에서 2분 동안 원심분리하여 트립포마스티고테를 펠렛한다. 상급제는 버리십시오.
- 20 mM MES (pH 5.0)로 버퍼링 된 DMEM 5 mL로 펠릿을 다시 일시 중단하고 0.4 % BSA19로보충하십시오. T-25 배양 플라스크에 기생충을 전송합니다. 뚜껑을 느슨하게 둡니다. 세포 밀도는 과포화로 세포 사멸의 기회를 증가하기 때문에, 주위 또는 아래 1 x 107 세포 / mL이어야합니다.
참고: DMEM의 색상은 주황색이 아닌 노란색이어야 합니다. 원래 DMEM이 높은 버퍼링 용량을 가졌다면, 20 mM MES(pH 5.0)는 pH를 낮추기에 충분하지 않다. 배지의 pH는 이 경우 HCl을 첨가하여 조절되어야 한다. 산성 배지는 4°C에서 유지될 수 있지만, 1개월 이상 보관할 수 없다. - 가습 된 인큐베이터에서 5 %CO2 미만에서 37 °C에서 배양 플라스크를 배양합니다. 기생충의 약 95%는 24 시간 후에 amastigotes로 분화합니다.
3. EA의 전기 화
- 전기 개화를 위해 gRNA를 준비하십시오. 이것은 시험관 내 전사에 의해, 또는 단순히 제조 업체에서 합성 RNA 올리고 뉴클레오티드를 구입하여 수행 할 수 있습니다. 이 보고에서는, 통합 DNA 기술, Inc.에서 crRNA 및 tracrRNA가 이용됩니다.
- 2,100 x g에서 15 분 동안 EA의 문화를 원심 분리합니다. 상급을 버리십시오.
- 1 x 108 셀 /mL의 최종 세포 밀도에 대한 보충 용액을 포함하는 전기 화 버퍼로 펠릿을 다시 일시 중단하십시오.
참고 : EM 버퍼는 재료표에 나열된 전기 개화 버퍼에 비해 더 많은 세포 사망을 일으킵니다. 따라서, amastigote 형질 감염에 대 한 권장 하지 않습니다 (보충그림1). - Aliquot 100 μL의 재중단 된 기생충 (1 x 107 세포) 1.5 mL 미세 원심 분리튜브튜브. gRNA 5-10 μg를 넣고 파이펫팅하여 부드럽게 섞습니다.
- 혼합물을 2mm 갭 전기 화기 큐벳으로 옮니다. X-14 프로그램을 사용하여 전기 천공 장치로 펄스를 적용합니다.
- 큐벳 내용물 5mL의 미리 따뜻화된 LIT 매체(10% FCS)가 들어 있는 T-25 플라스크에 옮김을 옮니다. 캡을 느슨하게 두고 5% CO2 미만의 37°C에서 플라스크를배양합니다.
- 축배술의 연속에 의해 세포 성장을 모니터링 (섹션 4) 또는 숙주 세포 감염 후 세포 내 amastigotes로 (섹션 5).
4. 도끼 아마스티고테스로 녹아웃 세포의 성장을 모니터링
- EA는 배양 매체의 바닥에 정착, 그래서 부드럽게 용액에 다시 중단 플라스크를 흔들어. 일부 세포가 플라스크에 부착되기 때문에 파이펫팅으로 플라스크 표면을 세척하는 것이 도움이됩니다.
- 프로피듐 요오드화물 (PI) 용액 (20 μg / mL)의 1 μL을 20 μL의 아마스티고테 배양과 섞습니다.
참고: 배양 플라스크를 인큐베이터 외부에 오래 두지 마십시오. 온도는 축증증을 가능하게 하는 요인 중 하나이다22. - 샘플을 혈세포계에 적용하고 형광 현미경으로 관찰하십시오. PI는 손상된 세포막에 permeant하지만 살아있는 세포에서 제외됩니다. PI(예:em 570 nm/602 nm)로 얼룩지지 않는 실행 가능한 아마스티고트 수를 계산합니다.
5. 세포 내 Amastigotes로 녹아웃 세포의 성장을 모니터링
- 시드 숙주 3T3 세포를 DMEM(10% FCS)을 가진 12웰 플레이트에서 숙주한다. 세포 밀도를 70-80% 동률또는 웰당 약 3 x 105 셀로 조정합니다.
참고: 아마스티고테는 운동성이 아니기 때문에, 숙주 세포에 의해 성장 표면의 대부분을 덮는 것은 감염 효율을 향상시킨다. - 전기개공 후 1일 원심분리에 의해 3.6단계에서 녹아웃 아마스티고테를 모으자. 상급체를 버리고, 2 mL의 DMEM (10 % FCS)로 기생충을 다시 중단하십시오.
- 숙주 세포 배양으로부터 배지를 제거하고 다시 일시 중단된 아마스티고테를 적용한다. 감염의 복합성은 20 이상이어야합니다. 37°C에서 5% CO2 미만에서 2일 동안 배양하여 아마스티고트가 감염을 확립할 수 있도록 하였다.
참고: 감염 기간은 목적에 따라 1 일 수 있습니다. - 씻어 제거 EA는 DMEM (10% FCS)으로 숙주 세포 외부에 두 번 남아 있었다.
- 숙주 기생충 공동 배양에 신선한 DMEM(10% FCS)을 첨가하고 추가로 2일 동안 37°C에서 배양을 계속한다.
-
감염 효율을 평가하기 위해 숙주 세포 및 세포 내 아마티고테의 핵을 시각화합니다.
참고: 핵은 포화 된 공동 문화에서 중첩되는 경향이 있습니다. 고정 및 염색 전에 낮은 세포 밀도 (예 : 1 :5 희석)에서 세포를 다시 도금하면 핵을 보다 쉽게 계산하는 데 도움이됩니다.- 배양 배지를 제거하고 1 mL의 1 mL을 PBS에 적용하여 세포를 고치도록 하였다. 실온에서 10 분 동안 배양하십시오.
- 포르말린 용액을 1 μg/mL Hoechst 33342 및 0.1% 트리톤 X-100을 포함하는 PBS 의 1 mL로 교체하십시오. 실온에서 5 분 동안 배양하십시오.
- Hoechst 용액을 제거하고 PBS로 세포를 한 번 헹구어. 신선한 PBS 1 mL을 추가합니다.
- 형광 현미경의 밑에 관찰하고 더 작은 기생충 핵과 연관되는 호스트세포 핵을 확인합니다 (그림 4). 2 개 이상의 amastigotes를 포함하는 호스트 세포는 비생산적인 초기 감염 또는 세척되지 않은 EA를 포함하지 않는 감염으로 간주되어야 합니다.
결과
스윔 아웃 절차에 의한 트라이포마스티고트 격리
수영 아웃 절차에 의해 오래된 EA를 오염에서 신선한 trypomastigotes를 수확하려면, 세포 펠릿은 적어도 인큐베이션 할 필요가 1 시간. 2 시간 이상 에 대한 펠릿을 배양하는 것은 크게 용액에서 수영 trypomastigotes의 수를 증가하지 않습니다 ( 그림2B)를 참조하십시오. 이 특정 실험에서, 초기 혼합물...
토론
우리는 T. cruzi amastigotes의 축배양이 Cas9 발현 EA로 직접 gRNA를 전기로 전환해서 CRISPR/Cas9 매개 유전자 녹아웃에서 이용될 수 있다는 것을 보여주었습니다. 이와 같이, amastigote 단계에서 특히 표적 유전자의 본질성은 다른 발달 단계를 거치지 않고 평가될 수 있다.
amastigote 형질감염의 또 다른 유익한 양상은 많은 표적 유전자를 위한 시험에 있는 편의성입니다. 일단 Cas9 발?...
공개
저자는 공개할 이해상충이 없습니다.
감사의 말
이 작품은 Y.T에 JSPS KAKENHI 교부금 번호 18K15141에 의해 부분적으로 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 20% formalin solution | FUJIFILM Wako Pure Chemical | 068-03863 | fixing cells |
| 25 cm2 double seal cap culture flask | AGC Techno Glass | 3100-025 | |
| 75 cm2 double seal cap culture flask | AGC Techno Glass | 3110-075 | |
| All-in One Fluorescence Microscope | Keyence | BZ-X710 | |
| Alt-R CRISPR-Cas9 crRNA (for Control) | IDT | custom made | target sequence = GGACGGCACCTTCATCTACAAGG |
| Alt-R CRISPR-Cas9 crRNA (for TcCGM1) | IDT | custom made | target sequence = TAGCCGCGATGGAGAGTTTATGG |
| Alt-R CRISPR-Cas9 crRNA (for TcPAR1) | IDT | custom made | target sequence = CGTGGAGAACGCCATTGCCACGG |
| Alt-R CRISPR-Cas9 tracrRNA | IDT | 1072532 | to anneal with crRNA |
| Amaxa Nucleofector device | LONZA | AAN-1001 | electroporation |
| Basic Parasite Nucleofector Kit 2 | LONZA | VMI-1021 | electroporation |
| BSA | Sigma-Aldrich | A3294 | component of the medium for in vitro amastigogenesis |
| Burker-Turk disposable hemocytometer | Watson | 177-212C | cell counting |
| Coster 12-well Clear TC-Treated Multiple Well Plates | Corning | 3513 | |
| DMEM | FUJIFILM Wako Pure Chemical | 044-29765 | culture medium |
| Fetal bovine serum, Defined | Hyclone | SH30070.03 | heat-inactivate before use |
| G-418 Sulfate Solution | FUJIFILM Wako Pure Chemical | 077-06433 | selection of transformant |
| Hemin chloride | Sigma-Aldrich | H-5533 | component of LIT medium |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | staining of nuclei |
| Liver infusion broth, Difco | Becton Dickinson | 226920 | component of LIT medium |
| MES | FUJIFILM Wako Pure Chemical | 349-01623 | component of the medium for in vitro amastigogenesis |
| PBS (–) | FUJIFILM Wako Pure Chemical | 166-23555 | |
| Propidium Iodide | Sigma-Aldrich | P4864-10ML | staining of dead cells |
| RPMI 1646 | Sigma-Aldrich | R8758 | medium for metacyclogenesis |
참고문헌
- World Health Organization. . (WHO) Fact sheet: Chagas disease (American trypanosomiasis). , (2017).
- Clayton, J. Chagas disease 101. Nature. 465 (n7301_supp), S4-S5 (2010).
- Apt, W. Current and developing therapeutic agents in the treatment of Chagas disease. Drug Design, Development and Therapy. 4, 243-253 (2010).
- Lander, N., Li, Z. H. H., Niyogi, S., Docampo, R. CRISPR/Cas9-induced disruption of paraflagellar rod protein 1 and 2 genes in Trypanosoma cruzi reveals their role in flagellar attachment. mBio. 6 (4), e01012 (2015).
- Peng, D., Kurup, S. P., Yao, P. Y., Minning, T. A., Tarleton, R. L. CRISPR-Cas9-mediated single-gene and gene family disruption in Trypanosoma cruzi. mBio. 6 (1), e02097-e02114 (2015).
- Romagnoli, B. A. A., Picchi, G. F. A., Hiraiwa, P. M., Borges, B. S., Alves, L. R., Goldenberg, S. Improvements in the CRISPR/Cas9 system for high efficiency gene disruption in Trypanosoma cruzi. Acta Tropica. 178, 190-195 (2018).
- Burle-Caldas, G. A., Soares-Simões, M., Lemos-Pechnicki, L., DaRocha, W. D., Teixeira, S. M. R. Assessment of two CRISPR-Cas9 genome editing protocols for rapid generation of Trypanosoma cruzi gene knockout mutants. International Journal for Parasitology. 48 (8), 591-596 (2018).
- Costa, F. C. Expanding the toolbox for Trypanosoma cruzi: A parasite line incorporating a bioluminescence-fluorescence dual reporter and streamlined CRISPR/Cas9 functionality for rapid in vivo localisation and phenotyping. PLoS Neglected Tropical Diseases. 12 (4), e0006388 (2018).
- Soares Medeiros, L. C. High-Efficiency Genome Editing in Protozoan Parasites Using CRISPR-Cas9 Ribonucleoproteins. mBio. 8 (6), (2017).
- Callahan, H. L., Portal, A. C., Devereaux, R., Grogl, M. An axenic amastigote system for drug screening. Antimicrobial Agents and Chemotherapy. 41 (4), 818-822 (1997).
- Bates, P. A. Axenic culture of Leishmania amastigotes. Parasitology Today. 9 (4), 143-146 (1993).
- Ravinder, R., Bhaskar, B., Gangwar, S., Goyal, N. Development of luciferase expressing Leishmania donovani axenic amastigotes as primary model for in vitro screening of antileishmanial compounds. Current Microbiology. 65 (6), 696-700 (2012).
- Nühs, A. Development and Validation of a Novel Leishmania donovani Screening Cascade for High-Throughput Screening Using a Novel Axenic Assay with High Predictivity of Leishmanicidal Intracellular Activity. PLoS Neglected Tropical Diseases. 9 (9), 1-17 (2015).
- De Rycker, M. Comparison of a high-throughput high-content intracellular Leishmania donovani assay with an axenic amastigote assay. Antimicrobial Agents and Chemotherapy. 57 (7), 2913-2922 (2013).
- Rochette, A., Raymond, F., Corbeil, J., Ouellette, M., Papadopoulou, B. Whole-genome comparative RNA expression profiling of axenic and intracellular amastigote forms of Leishmania infantum. Molecular and Biochemical Parasitology. 165 (1), 32-47 (2009).
- Pescher, P., Blisnick, T., Bastin, P., Späth, G. F. Quantitative proteome profiling informs on phenotypic traits that adapt Leishmania donovani for axenic and intracellular proliferation. Cellular Microbiology. 13 (7), 978-991 (2011).
- Andrews, N. W., Hong, K. S. U., Robbins, E. S., Nussenzweig, V. Stage-specific surface antigens expressed during the morphogenesis of vertebrate forms of Trypanosoma cruzi. Experimental Parasitology. 64 (3), 474-484 (1987).
- Pan, S. C. Trypanosoma cruzi: intracellular stages grown in a cell-free medium at 37 C. Experimental Parasitology. 45 (2), 215-224 (1978).
- Tomlinson, S., Vandekerckhove, F., Frevert, U., Nussenzweig, V. The induction of Trypanosoma cruzi trypomastigote to amastigote transformation by low pH. Parasitology. 110 (05), 547 (1995).
- Ley, V., Andrews, N. W., Robbins, E. S., Nussenzweig, V. Amastigotes of Trypanosoma cruzi sustain an infective cycle in mammalian cells. Journal of Experimental Medicine. 168 (0022-1007 (Print)), 649-659 (1988).
- Bonfim-Melo, A., Ferreira, E. R., Florentino, P. T. V., Mortara, R. A. Amastigote Synapse: The Tricks of Trypanosoma cruzi Extracellular Amastigotes. Frontiers in Microbiology. 9, 1341 (2018).
- Takagi, Y., Akutsu, Y., Doi, M., Furukawa, K. Utilization of proliferable extracellular amastigotes for transient gene expression, drug sensitivity assay, and CRISPR/Cas9-mediated gene knockout in Trypanosoma cruzi. PLOS Neglected Tropical Diseases. 13 (1), e0007088 (2019).
- Fernandes, J. F., Castellani, O. Growth characteristics and chemical composition of Trypanosoma cruzi. Experimental Parasitology. 18 (2), 195-202 (1966).
- Oberholzer, M., Lopez, M. A., Ralston, K. S., Hill, K. L. Approaches for Functional Analysis of Flagellar Proteins in African Trypanosomes. Methods in Cell Biology. 93, 21-57 (2009).
- van den Hoff, M. J. B., Moorman, A. F. M., Lamers, W. H. Electroporation in ‘intracellular’ buffer increases cell survival. Nucleic Acids Research. 20 (11), 2902-2902 (1992).
- Pacheco-Lugo, L., Díaz-Olmos, Y., Sáenz-García, J., Probst, C. M., DaRocha, W. D. Effective gene delivery to Trypanosoma cruzi epimastigotes through nucleofection. Parasitology International. 66 (3), 236-239 (2017).
- Coughlin, B. C., Teixeira, S. M., Kirchhoff, L. V., Donelson, J. E. Amastin mRNA abundance in Trypanosoma cruzi is controlled by a 3’-untranslated region position-dependent cis-element and an untranslated region-binding protein. The Journal of Biological Chemistry. 275 (16), 12051-1260 (2000).
- Shaw, A. K., Kalem, M. C., Zimmer, S. L. Mitochondrial Gene Expression Is Responsive to Starvation Stress and Developmental Transition in Trypanosoma cruzi. mSphere. 1 (2), (2016).
- Chao, D., Dusanic, D. G. Comparative studies of the isolation of metacyclic trypomastigotes of Trypanosoma cruzi by DEAE ion exchange chromatography. Zhonghua Minguo wei sheng wu ji mian yi xue za zhi (Chinese Journal of Microbiology and Immunology). 17 (3), 146-152 (1984).
- Nogueira, N., Bianco, C., Cohn, Z. Studies on the selective lysis and purification of Trypanosoma cruzi. The Journal of Experimental Medicine. 142 (1), 224-229 (1975).
- Minning, T. A., Weatherly, D. B., Atwood, J., Orlando, R., Tarleton, R. L., Tarleton, R. L. The steady-state transcriptome of the four major life-cycle stages of Trypanosoma cruzi. BMC Genomics. 10, 370 (2009).
- Rico, E., Jeacock, L., Kovářová, J., Horn, D. Inducible high-efficiency CRISPR-Cas9-targeted gene editing and precision base editing in African trypanosomes. Scientific Reports. 8 (1), 7960 (2018).
- Fu, Y. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nature Biotechnology. 31 (9), 822-826 (2013).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Research. 24 (6), 1012-1019 (2014).
- Chiurillo, M. A., Lander, N., Bertolini, M. S., Storey, M., Vercesi, A. E., Docampo, R. Different roles of mitochondrial calcium uniporter complex subunits in growth and infectivity of Trypanosoma cruzi. mBio. 8 (3), e00574-e00617 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유