É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Introduzindo um nocaute genético diretamente no estágio Amastigote do Trypanosoma cruzi usando o sistema crispr/Cas9
Neste Artigo
Resumo
Aqui, nós descrevemos um protocolo para introduzir um nocaute do gene no amastigotas extracelular de Trypanosoma cruzi, usando o sistema de crispr/Cas9. O phenotype do crescimento pode ser seguido acima pela contagem da pilha da cultura axênicos do amastigotas ou pela proliferação de amastigotas intracelular após a invasão da pilha de anfitrião.
Resumo
O Trypanosoma cruzi é um parasita protozoário patogénico que causa a doença de Chagas principalmente na América Latina. A fim de identificar um novo alvo de drogas contra o T. cruzi, é importante validar a essencialidade do gene alvo na fase de mamíferos do parasita, o amastigote. Amastigotas de T. cruzi replicam dentro da célula hospedeira; assim, é difícil realizar uma experiência de nocaute sem passar por outros estágios de desenvolvimento. Recentemente, nosso grupo relatou uma condição do crescimento em que o amastigotas pode replicar axenically por até 10 dias sem perder suas propriedades amastigotas-like. Usando esta cultura axênica temporal do amastigotas, nós introduzimos com sucesso grnas diretamente no Cas9-expressando o amastigotas para causar nocautes do gene e analisou seus fenótipos exclusivamente no estágio do amastigotas. Neste relatório, nós descrevemos um protocolo detalhado para produzir in vitro os amastigotes extracelular derivados, e para utilizar a cultura axênicos em um experimento nocaute crispr/Cas9-negociado. O phenotype do crescimento de amastigotas do Knockout pode ser avaliado pela contagem da pilha da cultura axênicos, ou pela réplica do amastigotas intracelular após a invasão da pilha de anfitrião. Este método ignora a diferenciação do estágio do parasita envolvida normalmente em produzir um transgênicas ou um amastigote do knockout. A utilização da cultura do amastigotas axênico temporal tem o potencial de ampliar a liberdade experimental de estudos específicos do estágio em T. cruzi.
Introdução
O Trypanosoma cruzi é o agente causador da doença de Chagas, predominante principalmente na América Latina1. T. cruzi tem estágios distintos do ciclo de vida enquanto viaja entre um vetor do inseto e um anfitrião mamífero2. T. cruzi Replica como um atividade no intestino médio de um bug triatomíneo sugador de sangue e diferencia-se em um tripomastigota metacíclicos infeccioso em seu intestino posterior antes de ser depositado em um anfitrião humano ou animal. Uma vez que o tripomastigota entra no corpo hospedeiro através do local da mordida ou através de uma membrana mucosa, o parasita invade uma célula hospedeira e se transforma em uma forma redonda flagella-less chamada um amastigote. O amastigotas Replica dentro da célula hospedeira e, eventualmente, diferencia-se em trypomastigote, que explode fora da célula hospedeira e entra na corrente sanguínea para infectar outra célula hospedeira.
Como os agentes quimioterapêuticos atualmente disponíveis, o Benznidazol e o Nifurtimox, causam efeitos colaterais adversos e são ineficazes na fase crônica da doença3, é de grande interesse identificar novos alvos de drogas contra o T. cruzi. Nos últimos anos, o sistema CRISPR/Cas9 tornou-se uma poderosa ferramenta para efetivamente realizar nocaute genético em T. cruzi, seja por transfecção de plasmídeo (s) separado ou único contendo Grna e CAS94, por expressão estável de Cas9 e subsequente introdução de grna5,6,7 ou modelo de transcrição de grna8, ou por eletroporação do complexo pré-formado de grna/Cas9 RNP7,9. Este avanço tecnológico é altamente antecipado para acelerar a pesquisa-alvo de drogas na doença de Chagas.
Para prosseguir com o desenvolvimento da droga, é crucial validar a essencialidade do gene alvo ou a eficácia dos compostos candidatos à droga na amastigotas de T. cruzi, pois é a fase de replicação do parasita no hospedeiro de mamíferos. No entanto, esta é uma tarefa desafiadora, porque amastigotas não podem ser manipuladas diretamente devido à presença de uma célula hospedeira obstrutiva. Em Leishmania, um parasita de protozoário intimamente relacionado ao T. cruzi, um método de cultivo de amastigotas axênico foi desenvolvido e tem sido utilizado em ensaios de triagem de fármacos10,11,12, 13. embora existam algumas discrepâncias na suscetibilidade a compostos entre amastigotas axênicas e amastigotas intracelulares14, a capacidade de manter a cultura axênica, no entanto, fornece valiosas ferramentas experimentais para estudar a biologia básica do estágio clinicamente relevante de Leishmania15,16. No caso do T. cruzi, literaturas quanto à presença de amastigotas extracelulares (ea)17 e produção in vitro de ea17,18,19 datam de décadas atrás. Além disso, a EA é conhecida por ter uma capacidade infecciosa20, embora menos do que a do trypomastigote, e o mecanismo de invasão do hospedeiro amastigota tem sido elucidado nos últimos anos (revisado por Bonfim-Melo et al.21). No entanto, diferentemente da Leishmania, a ea não tinha sido utilizada como ferramenta experimental no T. cruzi, principalmente porque a ea tinha sido considerada como um parasita intracelular obrigatório e, portanto, não tinha sido considerada como "forma replicativa" em uma prática Sentido.
Recentemente, nosso grupo propôs utilizar a EA de T. cruzi como uma cultura axênica temporal22. Amastigotas de T. cruzi tulahuen estirpe pode replicar livre de células hospedeiras em meio iluminado a 37 ° c por até 10 dias sem grande deterioração ou perda de propriedades semelhantes a amastigotas. Durante o período de crescimento livre de hospedeiro, a EA foi utilizada com sucesso para expressão gênica exógena por eletroporação convencional, ensaio de titulação de fármacos com compostos tripanociais e nocaute de CRISPR/Cas9, seguido de monitoramento do fenótipo de crescimento. Neste relatório, nós descrevemos o protocolo detalhado para produzir in vitro o ea derivado e para utilizar o amastigotas axênicos em experimentos do nocaute.
Protocolo
Nota: Uma visão geral de todo o fluxo experimental é descrita na Figura 1.
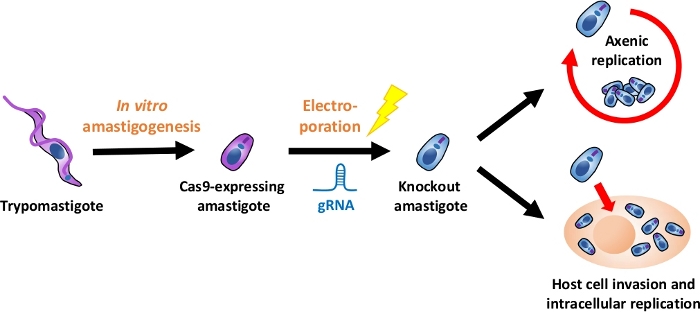
Figura 1: visão geral do experimento de nocaute usando o ea. Os tripomastigotas cultura-derivados do tecido são colhidos e diferenciados em ea. grna é transfected em Cas9-expressando amastigotas pelo Electroporation, e o phenotype do crescimento do amastigotas do Knockout é avaliado pela replicação axênicos ou pelo replicação intracelular após invasão de células hospedeiras. Por favor clique aqui para ver uma versão maior desta figura.
1. preparações da cultura do parasita
- A cepa de tulahuen do Trypanosoma cruzi é usada ao longo deste relatório. Manter epimastigotas de T. cruzi em meio lit (10% FCS, ver tabela suplementar 1). Feche firmemente a tampa e mantenha o balão de cultura a 28 ° c.
- Gerar uma cepa transgênica de T. cruzi que abriga a endonuclease Cas9. Exemplos da expressão plasmídica que contêm a seqüência de codificação Cas9 e o marcador de seleção G418 (neor) podem ser encontrados em Lander et al.4 e Peng et al.5
- Transfect o plasmídeo acima no atividade pelo Electroporation, usando o jogo alistado na tabela dos materiais. Para 1 cubeta, gire para baixo 2 x 107 pilhas, descarte o sobrenadante, e ressuspender com 100 μl do amortecedor do Electroporation que contem a solução fornecida do suplemento.
Nota: O tampão do Electroporation pode ser substituído com o tampão de em24 (3:1 mistura do comprimidos25 e do amortecedor da fosfato-sacarose). - Adicione 20-40 μg de plasmídeo e transfira a mistura para uma cubeta de electroporação de 2 mm de Gap. Aplique o pulso com um dispositivo do Electroporation (veja a tabela dos materiais), usando o programa X-1426.
- Transfira o conteúdo da cubeta para um balão T-25 contendo 5 mL de meio LIT (10% FCS). Incubar o balão a 28 ° c durante 24 h.
- Adicionar G418 a uma concentração final de 250 μg/mL e continuar a incubação a 28 ° c. Demora cerca de 1 semana para matar os epimastigotas não transfected. Uma vez que a população G418-resistant começa a recuperar, passagem a cultura uma vez ou duas vezes por semana para evitar a saturação e para diluir para fora as pilhas inoperantes. O estabelecimento de uma linha de pilha estável toma geralmente o total de 4 semanas.
Nota: Se a expressão constitutiva de Cas9 é um fardo para a célula5, faça a expressão específica para o estágio amastigotas, conjugando o 3 '-UTR do gene amastina imediatamente a jusante do quadro de leitura aberto de CAS927. A descrição detalhada do plasmídeo de expressão de Cas9 específico para amastigote pode ser encontrada em Takagi et al.22
- Transfect o plasmídeo acima no atividade pelo Electroporation, usando o jogo alistado na tabela dos materiais. Para 1 cubeta, gire para baixo 2 x 107 pilhas, descarte o sobrenadante, e ressuspender com 100 μl do amortecedor do Electroporation que contem a solução fornecida do suplemento.
- Estabelecer uma cocultura hospedeiro-parasita de Cas9-expressando T. cruzi e células hospedeiras de mamíferos. Neste relatório, use a pilha do fibroblasto do albino 3T3-Swiss como um anfitrião.
- Diferenciar epimastigotas de T. cruzi em tripomastigotas metacílicos. Determine a densidade celular da cultura atividade usando um hemociômetro e colete 5 x 107 células por centrifugação por 15 min a 2.100 x g. Descarte o sobrenadante e resuma as células com 10 mL de meio RPMI. Incubar o parasita a 28 ° c durante 1 semana28.
- Colete tripomastigotas metacílicos em meio RPMI. Incline cuidadosamente o balão e o Pipet para fora da solução sem perturbar os parasitas aderiram à superfície inferior. Transfira o meio para um tubo cônico e centrifugue por 15 min a 2.100 x g. Descartar o sobrenadante e ressuscitará o parasita com 5 mL de DMEM (10% FCS).
Nota: A população parasita é uma mistura de tripomastigotas metacílicos, epimastigotas e algumas formas intermediárias. Embora não seja necessário, você pode isolar o tripomastigota pela cromatografia de troca iónica29de DEAE. Alternativamente, os epimastigotas podem ser eliminados incubando os parasitas com soro ativo para sujei-los a complementar a Lise30. - Semente 3T3-pilha Suíça do fibroblasto do albino a 60-70% confluency, ou aproximadamente 1.7-2.0 x 106 pilhas em 5 ml de DMEM (10% FCS) no balão da cultura T-25. Retire o meio de crescimento e aplique a mistura parasita a partir do passo 1.3.2. Incubar para 24 h em 37 ° c 5% CO2 em uma incubadora humidificada para estabelecer a infecção.
- Remova os parasitas restantes fora das células do hospedeiro 3T3 lavando a cocultura com DMEM (10% FCS) duas vezes.
- Uma vez que a cocultura é saturada, as células hospedeiras da passagem amastigote-infectadas por trypsinization. Aspirar o meio e enxaguar a cultura uma vez com PBS. Aplique 1 mL de solução de tripsina de 0, 5% para cobrir toda a superfície da cultura e incubar por alguns minutos à temperatura ambiente até que as células hospedeiras anexadas fiquem soltas. Retire as células da superfície do balão, liberando 3 mL de DMEM (10% FCS) sobre as células.
- Transfira células hospedeiras separadas para um tubo cônico e centrifugue por 3 min a 300 x g. Aspirar o sobrenadante e suspender as células com 3 mL de DMEM fresco (10% FCS). Esta etapa ajuda a eliminar epimastigotas remanescentes. Transfira tudo para um frasco T-75 limpo contendo 9 mL de DMEM (10% FCS). Continue cultivando até que o tripomastigota seja liberado no sobrenadante da cultura.
- Manter a cocultura por de com tripsinização duas vezes por semana. Uma vez que 70-80% da população hospedeira se infecta, adicione regularmente células não infectadas do hospedeiro 3T3 na proporção de 5:1 (Carryover: fresco), a fim de evitar a deterioração da cultura. Trypomastigote egressos continuamente se o equilíbrio entre células hospedeiras e T. cruzi for mantido adequadamente.
2. diferenciação de tripomastigotas na EA
- No dia anterior a este experimento, remover o meio de crescimento da cocultura hospedeiro-parasita e adicionar DMEM fresco (10% FCS) para lavar afastado EA e tripomastigotas que já haviam sido liberados das células hospedeiras em dias anteriores. Experimentos regulares exigem pelo menos dois frascos T-75 de co-cultura confluente.
-
Colete o sobrenadante de cultura em um tubo cônico para colher tripomastigotas recém-emergidos. Verific a amostra um microscópio (lente objetiva de 10x ou de 20x) para a qualidade. Se houver restos de células hospedeiras, centrifugue brevemente a amostra e transfira o sobrenadante para um novo tubo. Se houver um número significativo de EAs, isole tripomastigotas pelo seguinte procedimento de mergulho.
- Gire para baixo a mistura de tripomastigotas e amastigotas por 15 min em 2.100 x g. Descarte a maior parte do sobrenadante, deixando 0,5-1,0 mL de meio no tubo.
Nota: reduzir o volume é opcional, mas facilita a etapa seguinte. - Incubar a pelota a 37 ° c por 1-2 h, permitindo que as tripomastigotas ativas nadem para fora da pelota (Figura 2).
- Transfira o sobrenadante contendo tripomastigotas para um tubo de microcentrífuga de 1,5 mL.
- Gire para baixo a mistura de tripomastigotas e amastigotas por 15 min em 2.100 x g. Descarte a maior parte do sobrenadante, deixando 0,5-1,0 mL de meio no tubo.
- Centrifugue o tubo cônico durante 15 min a 2.100 x g para recolher tripomastigotas. Se o procedimento de mergulho foi realizado acima, centrifugue o tubo de 1,5 mL por 2 min a 4.000 x g para pellet o trypomastigote. Descarte o sobrenadante.
- Ressuspender o pellet com 5 mL de DMEM tamponado com 20 mM MES (pH 5,0), suplementado com 0,4% BSA19. Transfira o parasita para um balão de cultura T-25. Deixe a tampa solta. A densidade celular deve ser em torno ou abaixo de 1 x 107 células/ml, uma vez que a sobresaturação aumenta a chance de morte celular.
Nota: A cor do DMEM deve ser amarela, não laranja. Se o DMEM original tinha alta capacidade de tamponamento, 20 mM MES (pH 5,0) não é suficiente para diminuir o pH. O pH do meio deve ser ajustado pela adição de HCl nesse caso. O meio ácido pode ser mantido a 4 ° c, mas não mais do que 1 mês. - Incubar o balão da cultura em 37 ° c 5% CO2 em uma incubadora humidificada. Cerca de 95% dos parasitas se diferenciam em amastigotas após 24 h.
3. electroporação da EA
- Prepare o gRNA para o electroporation. Isto pode ser feito pela transcrição in vitro, ou simplesmente comprando oligonucleotídeos sintéticos do RNA de um fabricante. Neste relatório, crRNA e tracrRNA da Integrated DNA Technologies, Inc. são utilizados.
- Centrifugue a cultura de EAs por 15 min em 2.100 x g. Descarte o sobrenadante.
- Ressuscitação da pelota com tampão do Electroporation que contem a solução fornecida do suplemento à densidade final da pilha de 1 x 108 Cells/ml.
Nota: o tampão EM causa mais mortes da pilha comparada ao amortecedor do Electroporation alistado na tabela dos materiais; assim, não é recomendado para o transfection do amastigotas (Figura suplementar 1). - Alíquota 100 μL de parasitas ressuscipended (1 x 107 células) em tubos de microcentrífuga de 1,5 ml. Adicionar 5-10 μg de gRNA e misturar suavemente com pipetagem.
- Transfira a mistura para uma cubeta da electroporação da abertura de 2 milímetros. Aplique o pulso com o dispositivo do Electroporation, usando o programa X-14.
- Transfira o conteúdo da cubeta para um balão T-25 contendo 5 mL de meio de LIT pré-aquecido (10% FCS). Deixar a tampa solta e incubar o balão a 37 ° c abaixo de 5% CO2.
- Monitore o crescimento celular, seja pela continuação da cultura axênica (seção 4) ou como amastigotas intracelulares após a infecção da célula hospedeira (seção 5).
4. monitorando o crescimento de células Knockout como amastigotas Axenic
- EAs se instalam na parte inferior do meio de cultura, assim agitar suavemente o balão para ressuscitem-los para a solução. A lavagem da superfície do balão por pipetagem ajuda, pois algumas células são aderiram ao balão.
- Misturar 1 μL de solução de iodeto de propiídio (PI) (20 μg/mL) com 20 μL de cultura de amastigotas.
Nota: Não deixe o balão de cultura fora da incubadora por mais tempo do que o necessário. A temperatura é um dos fatores que possibilita a proliferação axênica22. - Aplique a amostra no hemocitômetro e observe um microscópio de fluorescência. O PI é persignificado à membrana de pilha danificada mas é excluído das pilhas vivos. Conte o número de amastigotas viáveis que não são manchadas por PI (ex/em 570 nm/602 nm).
5. monitorando o crescimento de pilhas do Knockout como Amastigotes intracellular
- Semente do anfitrião 3T3 pilhas em uma placa de 12 poços com DMEM (10% FCS). Ajuste a densidade da célula para 70-80% de confluência, ou cerca de 3 x 105 células por poço.
Nota: Desde que os amastigotas não são motile, cobrindo a maioria da superfície do crescimento pelas pilhas do anfitrião melhora a eficiência da infecção. - Colete amastigotas Knockout da etapa 3,6 pela centrifugação um dia após o electroporation. Descartar o sobrenadante, e ressuscitará o parasita com 2 mL de DMEM (10% FCS).
- Remova o meio da cultura de célula hospedeira e aplique amastigotas resrepended. A multiplicidade de infecção deve ser 20 ou superior. Incubar a placa a 37 ° c abaixo de 5% CO2 por 2 dias para permitir que os amastigotas estabeleçam infecção.
Nota: O período de infecção pode ser 1 dia, dependendo da finalidade. - Lave afastado EAs remanesceu fora das pilhas do anfitrião duas vezes com DMEM (10% FCS).
- Adicione DMEM fresco (10% FCS) à cocultura hospedeiro-parasita e continue a incubação a 37 ° c por 2 dias adicionais.
-
Avaliar a eficiência da infecção, Visualizar núcleos das células hospedeiras e amastigotas intracelulares.
Nota: os núcleos tendem a ser sobrepostos em cocultura saturada. Re-plating as pilhas na mais baixa densidade da pilha (tal como a diluição 1:5) antes da fixação e a mancha ajuda a contar núcleos mais facilmente.- Remova o meio de cultura e aplique 1 mL de solução de formalina a 10% em PBS para fixar as células. Incubar por 10 min à temperatura ambiente.
- Substitua a solução de formalina por 1 mL de PBS contendo 1 μg/mL Hoechst 33342 e 0,1% Triton X-100. Incubar durante 5 min à temperatura ambiente.
- Retire a solução de Hoechst e enxague as células uma vez com PBS. Adicione 1 mL de PBS fresco.
- Observar microscópio de fluorescência e identificar núcleos de células hospedeiras que estão associados a núcleos parasitas menores (Figura 4). As células hospedeiras que contêm mais de 2 amastigotas devem ser consideradas como infectadas, não incluir infecção inicial não produtiva ou EAs não lavadas.
Resultados
Isolação de tripomastigotas pelo procedimento da nadada-para fora
Para colher tripomastigotas frescas contaminando EAs velhos pelo procedimento da nadada, as pelotas da pilha precisam de ser incubadas pelo menos para 1 h. incubando as pelotas por mais de 2 h não aumenta significativamente o número de tripomastigotas nadando na solução ( Figura 2b). Neste experimento em particular, a porcentagem de tripomastigotas na mistura inicial foi de 38...
Discussão
Nós demonstramos que a cultura axênicos de amastigotas do T. cruzi pode ser utilizada no nocaute crispr/Cas9-negociado do gene, electroporating o grna diretamente em Cas9-expressando o ea. Desta forma, a essencialidade do gene alvo especificamente no estágio amastigotas pode ser avaliada sem passar por outros estágios de desenvolvimento.
Um outro aspecto benéfico do transfection do amastigotas é a conveniência no teste para um grande número genes do alvo. Uma vez que a cocultu...
Divulgações
Os autores não têm conflito de interesse em divulgar.
Agradecimentos
Este trabalho foi apoiado em parte por JSPS KAKENHI Grant Number 18K15141 para Y.T.
Materiais
| Name | Company | Catalog Number | Comments |
| 20% formalin solution | FUJIFILM Wako Pure Chemical | 068-03863 | fixing cells |
| 25 cm2 double seal cap culture flask | AGC Techno Glass | 3100-025 | |
| 75 cm2 double seal cap culture flask | AGC Techno Glass | 3110-075 | |
| All-in One Fluorescence Microscope | Keyence | BZ-X710 | |
| Alt-R CRISPR-Cas9 crRNA (for Control) | IDT | custom made | target sequence = GGACGGCACCTTCATCTACAAGG |
| Alt-R CRISPR-Cas9 crRNA (for TcCGM1) | IDT | custom made | target sequence = TAGCCGCGATGGAGAGTTTATGG |
| Alt-R CRISPR-Cas9 crRNA (for TcPAR1) | IDT | custom made | target sequence = CGTGGAGAACGCCATTGCCACGG |
| Alt-R CRISPR-Cas9 tracrRNA | IDT | 1072532 | to anneal with crRNA |
| Amaxa Nucleofector device | LONZA | AAN-1001 | electroporation |
| Basic Parasite Nucleofector Kit 2 | LONZA | VMI-1021 | electroporation |
| BSA | Sigma-Aldrich | A3294 | component of the medium for in vitro amastigogenesis |
| Burker-Turk disposable hemocytometer | Watson | 177-212C | cell counting |
| Coster 12-well Clear TC-Treated Multiple Well Plates | Corning | 3513 | |
| DMEM | FUJIFILM Wako Pure Chemical | 044-29765 | culture medium |
| Fetal bovine serum, Defined | Hyclone | SH30070.03 | heat-inactivate before use |
| G-418 Sulfate Solution | FUJIFILM Wako Pure Chemical | 077-06433 | selection of transformant |
| Hemin chloride | Sigma-Aldrich | H-5533 | component of LIT medium |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | staining of nuclei |
| Liver infusion broth, Difco | Becton Dickinson | 226920 | component of LIT medium |
| MES | FUJIFILM Wako Pure Chemical | 349-01623 | component of the medium for in vitro amastigogenesis |
| PBS (–) | FUJIFILM Wako Pure Chemical | 166-23555 | |
| Propidium Iodide | Sigma-Aldrich | P4864-10ML | staining of dead cells |
| RPMI 1646 | Sigma-Aldrich | R8758 | medium for metacyclogenesis |
Referências
- World Health Organization. . (WHO) Fact sheet: Chagas disease (American trypanosomiasis). , (2017).
- Clayton, J. Chagas disease 101. Nature. 465 (n7301_supp), S4-S5 (2010).
- Apt, W. Current and developing therapeutic agents in the treatment of Chagas disease. Drug Design, Development and Therapy. 4, 243-253 (2010).
- Lander, N., Li, Z. H. H., Niyogi, S., Docampo, R. CRISPR/Cas9-induced disruption of paraflagellar rod protein 1 and 2 genes in Trypanosoma cruzi reveals their role in flagellar attachment. mBio. 6 (4), e01012 (2015).
- Peng, D., Kurup, S. P., Yao, P. Y., Minning, T. A., Tarleton, R. L. CRISPR-Cas9-mediated single-gene and gene family disruption in Trypanosoma cruzi. mBio. 6 (1), e02097-e02114 (2015).
- Romagnoli, B. A. A., Picchi, G. F. A., Hiraiwa, P. M., Borges, B. S., Alves, L. R., Goldenberg, S. Improvements in the CRISPR/Cas9 system for high efficiency gene disruption in Trypanosoma cruzi. Acta Tropica. 178, 190-195 (2018).
- Burle-Caldas, G. A., Soares-Simões, M., Lemos-Pechnicki, L., DaRocha, W. D., Teixeira, S. M. R. Assessment of two CRISPR-Cas9 genome editing protocols for rapid generation of Trypanosoma cruzi gene knockout mutants. International Journal for Parasitology. 48 (8), 591-596 (2018).
- Costa, F. C. Expanding the toolbox for Trypanosoma cruzi: A parasite line incorporating a bioluminescence-fluorescence dual reporter and streamlined CRISPR/Cas9 functionality for rapid in vivo localisation and phenotyping. PLoS Neglected Tropical Diseases. 12 (4), e0006388 (2018).
- Soares Medeiros, L. C. High-Efficiency Genome Editing in Protozoan Parasites Using CRISPR-Cas9 Ribonucleoproteins. mBio. 8 (6), (2017).
- Callahan, H. L., Portal, A. C., Devereaux, R., Grogl, M. An axenic amastigote system for drug screening. Antimicrobial Agents and Chemotherapy. 41 (4), 818-822 (1997).
- Bates, P. A. Axenic culture of Leishmania amastigotes. Parasitology Today. 9 (4), 143-146 (1993).
- Ravinder, R., Bhaskar, B., Gangwar, S., Goyal, N. Development of luciferase expressing Leishmania donovani axenic amastigotes as primary model for in vitro screening of antileishmanial compounds. Current Microbiology. 65 (6), 696-700 (2012).
- Nühs, A. Development and Validation of a Novel Leishmania donovani Screening Cascade for High-Throughput Screening Using a Novel Axenic Assay with High Predictivity of Leishmanicidal Intracellular Activity. PLoS Neglected Tropical Diseases. 9 (9), 1-17 (2015).
- De Rycker, M. Comparison of a high-throughput high-content intracellular Leishmania donovani assay with an axenic amastigote assay. Antimicrobial Agents and Chemotherapy. 57 (7), 2913-2922 (2013).
- Rochette, A., Raymond, F., Corbeil, J., Ouellette, M., Papadopoulou, B. Whole-genome comparative RNA expression profiling of axenic and intracellular amastigote forms of Leishmania infantum. Molecular and Biochemical Parasitology. 165 (1), 32-47 (2009).
- Pescher, P., Blisnick, T., Bastin, P., Späth, G. F. Quantitative proteome profiling informs on phenotypic traits that adapt Leishmania donovani for axenic and intracellular proliferation. Cellular Microbiology. 13 (7), 978-991 (2011).
- Andrews, N. W., Hong, K. S. U., Robbins, E. S., Nussenzweig, V. Stage-specific surface antigens expressed during the morphogenesis of vertebrate forms of Trypanosoma cruzi. Experimental Parasitology. 64 (3), 474-484 (1987).
- Pan, S. C. Trypanosoma cruzi: intracellular stages grown in a cell-free medium at 37 C. Experimental Parasitology. 45 (2), 215-224 (1978).
- Tomlinson, S., Vandekerckhove, F., Frevert, U., Nussenzweig, V. The induction of Trypanosoma cruzi trypomastigote to amastigote transformation by low pH. Parasitology. 110 (05), 547 (1995).
- Ley, V., Andrews, N. W., Robbins, E. S., Nussenzweig, V. Amastigotes of Trypanosoma cruzi sustain an infective cycle in mammalian cells. Journal of Experimental Medicine. 168 (0022-1007 (Print)), 649-659 (1988).
- Bonfim-Melo, A., Ferreira, E. R., Florentino, P. T. V., Mortara, R. A. Amastigote Synapse: The Tricks of Trypanosoma cruzi Extracellular Amastigotes. Frontiers in Microbiology. 9, 1341 (2018).
- Takagi, Y., Akutsu, Y., Doi, M., Furukawa, K. Utilization of proliferable extracellular amastigotes for transient gene expression, drug sensitivity assay, and CRISPR/Cas9-mediated gene knockout in Trypanosoma cruzi. PLOS Neglected Tropical Diseases. 13 (1), e0007088 (2019).
- Fernandes, J. F., Castellani, O. Growth characteristics and chemical composition of Trypanosoma cruzi. Experimental Parasitology. 18 (2), 195-202 (1966).
- Oberholzer, M., Lopez, M. A., Ralston, K. S., Hill, K. L. Approaches for Functional Analysis of Flagellar Proteins in African Trypanosomes. Methods in Cell Biology. 93, 21-57 (2009).
- van den Hoff, M. J. B., Moorman, A. F. M., Lamers, W. H. Electroporation in ‘intracellular’ buffer increases cell survival. Nucleic Acids Research. 20 (11), 2902-2902 (1992).
- Pacheco-Lugo, L., Díaz-Olmos, Y., Sáenz-García, J., Probst, C. M., DaRocha, W. D. Effective gene delivery to Trypanosoma cruzi epimastigotes through nucleofection. Parasitology International. 66 (3), 236-239 (2017).
- Coughlin, B. C., Teixeira, S. M., Kirchhoff, L. V., Donelson, J. E. Amastin mRNA abundance in Trypanosoma cruzi is controlled by a 3’-untranslated region position-dependent cis-element and an untranslated region-binding protein. The Journal of Biological Chemistry. 275 (16), 12051-1260 (2000).
- Shaw, A. K., Kalem, M. C., Zimmer, S. L. Mitochondrial Gene Expression Is Responsive to Starvation Stress and Developmental Transition in Trypanosoma cruzi. mSphere. 1 (2), (2016).
- Chao, D., Dusanic, D. G. Comparative studies of the isolation of metacyclic trypomastigotes of Trypanosoma cruzi by DEAE ion exchange chromatography. Zhonghua Minguo wei sheng wu ji mian yi xue za zhi (Chinese Journal of Microbiology and Immunology). 17 (3), 146-152 (1984).
- Nogueira, N., Bianco, C., Cohn, Z. Studies on the selective lysis and purification of Trypanosoma cruzi. The Journal of Experimental Medicine. 142 (1), 224-229 (1975).
- Minning, T. A., Weatherly, D. B., Atwood, J., Orlando, R., Tarleton, R. L., Tarleton, R. L. The steady-state transcriptome of the four major life-cycle stages of Trypanosoma cruzi. BMC Genomics. 10, 370 (2009).
- Rico, E., Jeacock, L., Kovářová, J., Horn, D. Inducible high-efficiency CRISPR-Cas9-targeted gene editing and precision base editing in African trypanosomes. Scientific Reports. 8 (1), 7960 (2018).
- Fu, Y. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nature Biotechnology. 31 (9), 822-826 (2013).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Research. 24 (6), 1012-1019 (2014).
- Chiurillo, M. A., Lander, N., Bertolini, M. S., Storey, M., Vercesi, A. E., Docampo, R. Different roles of mitochondrial calcium uniporter complex subunits in growth and infectivity of Trypanosoma cruzi. mBio. 8 (3), e00574-e00617 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados