A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
دراسة ديناميات التصاق الخلوي وانتشار الخلايا الظهاريه علي الفيبرونكتين اثناء الاكسده
In This Article
Summary
هذا الأسلوب مفيد لتحديد الديناميكيات المبكرة للتصاق الخلوية وانتشار الخلايا التي تعتمد علي المرسي علي الفيبرونكتين. وعلاوة علي ذلك ، يمكن استخدام هذا الفحص للتحقيق في اثار تغيير الاكسده والاختزال علي الخلية المنتشرة و/أو الخلايا المرتبطة بالتصاق الخلية مسارات الإشارات داخل الخلايا.
Abstract
التصاق وانتشار الخلايا علي مصفوفة خارج الخلية (ECM) هي العمليات الخلوية الاساسيه خلال التنمية الاسطحه والتوازن للانسجه الكبار. ومن المثير للاهتمام, الاكسده يمكن ان يغير هذه العمليات, التالي المساهمة في الفيزيولوجيا المرضية للامراض مثل السرطان المنتشر. ولذلك ، فهم اليه (ق) من كيفيه إرفاق الخلايا وانتشارها علي ECM خلال الاضطرابات في حاله الاكسده والاختزال يمكن ان توفر نظره ثاقبه في الدول العادية والامراض. وصفها أدناه هو بروتوكول خطوه الحكيمة التي تستخدم الفحص القائم علي المناعي لتحديد كميه التصاق الخلية ونشر الخلايا الليفية خلدت علي الفيبرونكتين (FN) في المختبر. لفتره وجيزة ، يتم عقد الخلايا التي تعتمد علي المرسي في التعليق وتتعرض لمثبطات الصراف الألى كيناز Ku55933 للحث علي الاكسده. ثم يتم طلاء الخلايا علي سطح مطلي بالFN ويسمح لها بالإرفاق لفترات زمنيه محدده مسبقا. والخلايا التي تبقي مرفقه ثابته وموسومة بعلامات الأجسام المضادة المستندة إلى الفلورية للتصاق (مثلا ، باكيلين) والانتشار (مثلا ، F-actin). ويجري الحصول علي البيانات وتحليلها باستخدام معدات مختبريه متاحه عاده ، بما في ذلك المجهر الكتابي وبرمجيات فيجي المتاحة بحريه. هذا الاجراء هو تنوعا للغاية ويمكن تعديلها لمجموعه متنوعة من خطوط الخلايا, البروتينات ECM, أو مثبطات من أجل دراسة مجموعه واسعه من المسائل البيولوجية.
Introduction
التصاقات مصفوفة الخلية (اي التصاقات البؤرية) هي مركبات البروتين الجزيئية الكبيرة والديناميكية التي تتوسط التصاق الخلايا وتنتشر. هذه العمليات هي حاسمه لتطوير الانسجه ، والصيانة ، والوظائف الفسيولوجية. وتتالف التصاقات البؤرية من مستقبلات مرتبطة بالغشاء ، مثل التكاملات ، فضلا عن البروتينات السقالات التي تربط الخلايا الدهنية الخلوية بالمصفوفة الخارجة عن الخلية (ECM)1. هذه المجمعات قادره علي الاستجابة للإشارات الفيزيائية الموجودة في البيئة خارج الخلية من خلال تفعيل مختلف الإشارات محولات المسارات. علي هذا النحو ، التصاقات البؤرية بمثابه مراكز الإشارات لنشر العظة الميكانيكية خارج الخلية في عدد من العمليات الخلوية بما في ذلك الهجرة الموجهة ، وتنظيم دوره الخلية ، والتمايز ، والبقاء علي قيد الحياة1،2. مجموعه واحده من الجزيئات الإشارات التي تنظم وتتفاعل مع التصاقات البؤرية تشمل أعضاء عائله رو من GTPases الصغيرة. رو GTPases هي البروتينات الرئيسية التي تنظم هجره الخلايا وديناميات التصاق من خلال التنشيط المكاني المحدد3. ليس من المستغرب ، وقد تورط تقلبات وظيفة البروتين رو في عدد من الامراض البشرية مثل الانبثاث ، وتولد الاوعيه ، وغيرها. من المهم بشكل خاص ، حاله الاكسده الخلوية يلعب دورا مهيمنا في تشكيل هجره الخلايا والتصاق. التعديلات في التوازن الاكسده ، مثل الزيادات في أنواع الأكسجين التفاعلية (ROS) ، وقد ثبت لتنظيم النشاط رو البروتين ، فضلا عن التصاق ، في عدد من أنواع الخلايا والامراض البشرية4،5،6 و7و8. علي سبيل المثال ، الافراد الذين يعانون من الاضطراب العصبي ترنح-توسع الشعيرات (ا-T) ، والذي يسببه طفرة في إصلاح الضرر الحمض النووي سيرين/threonine كيناز A-T-تحور (ATM) ، لديها زيادة خطر الاصابه بالسرطان المنتشر9، 10-الآن فقدان النشاط الصراف الألى كيناز في هذه المرضي وخطوط الخلايا ، اما من خلال الطفرة الجينية أو تثبيط الكيميائية ، والنتائج في مستويات عاليه من الاكسده بسبب الخلل في المسار الفوسفات البنتوز7،11، 12-الآن وعلاوة علي ذلك ، سلطت الدراسات الاخيره من المختبر الضوء علي دور الفيزيولوجيا المرضية لروس في a-T عن طريق تغيير ديناميات خلوي (اي التصاق والانتشار) كنتيجة مباشره لتفعيل جي تي اس الاسره في المختبر5. في نهايةالمطاف ، هذه التعديلات في ديناميات خلوي الناجمة عن تنشيط الاسره رو قد يؤدي إلى زيادة خطر الاصابه بالسرطان المنتشر لاحظت في المرضي-T5،13. لذلك ، فهم التفاعل بين التفاعلات مصفوفة الخلية اثناء الاكسده يمكن ان توفر رؤى في تنظيم التصاق والانتشار. ويمكن لهذه الدراسات أيضا ان تمهد السبيل لمزيد من التحقيقات في دور محتمل لل GTPases الاسره رو في هذه العمليات الإشارات.
وصف هنا هو بروتوكول لدراسة ديناميات الخلوية في وقت مبكر من تجميع التصاق والانتشار اثناء الاكسده الناجمة عن تثبيط نشاط الصراف الألى كيناز. ويستند هذا الفحص علي اليه المميزة للتصاق الخلايا المعتمدة علي المرسي بالبروتين الفيبرونكتين (FN). عندما يتم طلاء الخلايا المحتفظ بها في نظام التعليق علي FN ، عده رو gtpases تنسيق السيطرة علي سيتوسيكيلتال أعاده عرض3،14. وتلاحظ التغييرات المورفولوجية كما تحول الخلايا من الجولة والتعميم في المظهر إلى الأرض وتوسيعها. بالتزامن مع هذه الملاحظات هو تطوير العديد من التصاقات مصفوفة مع ECM. نسبت هذا تغيرات إلى ال [بيهاسيك] تنشيط من [روا] مع Rac1 اثناء الساعة اولي بما ان خلايا يلتصق وينشر 15,16.
وقد استخدمت مجموعه متنوعة من الطرق لفحص الشكل والديناميكيات التصاق وكذلك انتشار الخلايا. ومع ذلك ، تعتمد هذه الطرق علي متطورة طويلة الأجل ، والتصوير الحي الكلي الانعكاس الداخلي الفلوري (TIRF) أو نظم المجهر البؤري. التالي ، يجب ان يحصل المستخدمون علي معدات وبرامج متخصصة. وعلاوة علي ذلك ، فان وقت الاعداد الذي تتطلبه أنظمه التصوير الحيوي هذا يجعل التقاط احداث التصاق المبكر تحديا ، خاصه عند اختبار مثبطات متعددة أو ظروف معالجه متزامنة.
الأساليب المفصلة ، هنا ، توفر طريقه واضحة واقتصاديه ولكن كميه لتقييم المعلمات التي تحكم تجميع التصاق والانتشار في المختبر. يتم تنفيذ البروتوكول باستخدام المعدات المختبرية المتاحة عاده ، مثل المجهر الكتابي وكاميرا CCD. يتضمن هذا الفحص تطبيق الخلايا المعتمدة علي المرسي علي سطح مطلي بالقوات الخاصة بعد فتره من الاكسده الناجمة عن التثبيط الكيميائي لنشاط الصراف الألى ، والذي تم إثباته في السابق5. بعد الطلاء ، ويسمح للخلايا لنعلق والتزام لفترات محدده من الزمن. يتم غسلها الخلايا غير المرفقة بعيدا ، في حين يتم إصلاح الخلايا المرفقة ووصفت مع الأجسام المضادة القائمة علي الفلورية لعلامات التصاق (علي سبيل المثال ، باكيلين) والانتشار (علي سبيل المثال ، F-actin)2،5. ثم يتم تصور هذه البروتينات وتسجيلها باستخدام المجهر الكتابي. ويجري تحليل البيانات اللاحقة باستخدام برامجيات فيجي المتاحة بحريه. وعلاوة علي ذلك ، يمكن تكييف هذه الطريقة لفحص ديناميات التصاق تحت مجموعه واسعه من الشروط بما في ذلك البروتينات المختلفة ECM ، والعلاج مع مختلف العوامل المؤكسدة/ثقافة الخلايا أو مجموعه متنوعة من خطوط الخلايا التي تعتمد علي مرسي لمعالجه مجموعه واسعه من المسائل البيولوجية.
Access restricted. Please log in or start a trial to view this content.
Protocol
1-الاعمال التحضيرية
ملاحظه: تم تحسين البروتوكول الموضح أدناه للاستخدام مع خلايا REF52 وأجهزه الصرافالألى +/+ أو atm-/- الورم الليفي البشري. أنواع الخلايا الأخرى قد تتطلب المزيد من التحسين كما هو موضح في الملاحظات واستكشاف الأخطاء وإصلاحها المقاطع أدناه.
- جعل 500 mL من خليه كامله ثقافة المتوسطة للخلايا REF52. إلى 500 مل من ارتفاع الجلوكوز التي تحتوي علي المتوسط النسر المعدلة دولبيكو (DMEM) أضافه 10 ٪ من الطراز الثاني ، 2 مم L-الجلوتامين ، و 100 وحده/مل البنسلين-ستربتوميسين.
- اعداد 25 ميكروغرام/مل محلول من الفيبرونكتين (FN) عن طريق أضافه 300 μL من 1 مغ/مل الحل FN إلى 12 مل من العقيمة 1x الفوسفات مخزنه المالحة (تلفزيوني) ، pH 7.4. اخلط جيدا.
- اعداد 0.5 ٪ (ث/ف) ديليبيداتيد (اي الأحماض الدهنية الحرة) المصل البقري الزلال (dlBSA) حل في مصل الدم الحرة DMEM الثقافة المتوسطة. أضافه 0.5 غرام من dlBSA إلى 100 مل من المصل المتوسطة الحرة DMEM. مزيج الحل جيدا ، ولكن لا دوامه. تصفيه معقمه الحل في حاويه معقمه جديده ، وذلك باستخدام فلتر حقنه 0.22 μM قبل الاستخدام. يخزن عند درجه حرارة 4 درجات مئوية.
- جعل 3.7 ٪ محلول بارافورمالدهيد بحل 3.7 غرام من بارافورمالدهيد في 100 mL من 1x تلفزيوني. استخدام الحرارة لطيف والتحريك للحصول علي بارافورمالدهيد في الحل.
ملاحظه: الحل بارافورمالدهيد حساسة للضوء ويجب ان تكون محمية من الضوء. انها جيده لمده تصل إلى أسبوع واحد عند تخزينها في 4 درجه مئوية.
تحذير: بارافورمالدهيد هو سام وقابل للاشتعال ومسبب للتاكل وخطر صحي. مراجعه ورقه بيانات سلامه المواد للبارافورمالدهيد قبل الاستخدام. استخدام معدات الحماية الشخصية المناسبة عند التعامل معها بما في ذلك درع العين ، درع الوجه ، كامل الوجه الجسيمات التنفس ، والقفازات ، ومعطف المختبر. - اعداد حل التغلغل الذي يحتوي علي 0.2 ٪ غير الايونيه السطحي في 1x تلفزيوني (v/v). ل 100 mL ، أضافه ببطء 0.2 مل من تريتون X-100 إلى 100 مل من 1x تلفزيوني ، مع التحريك.
- جعل العازلة حجب المناعية التي تحتوي علي 2.5 ٪ بوسنيا ، 5 ٪ مصل الماعز ، و 0.05 ٪ غير الايونيه السطحي (ث/v/v) المذاب في 1x الحل تلفزيوني. ل 100 mL ، أضافه 5 مل من مصل الماعز ، 2.5 غرام من الجيش الصربي البوسني و 0.05 mL من تريتون X-100 في ~ 95 mL 1x تلفزيوني ، مع التحريك.
- تنمو الخلايا REF52 في DMEM كامله الثقافة المتوسطة في 10 سم2 (أو اي حجم السفينة الأخرى) خليه ثقافة معالجه الصفيحة في حاضنه ثقافة الخلية في 37 درجه مئوية و 5 ٪ CO2.
2. طلاء لوحات ثقافة الخلية مع الفيبرونكتين البروتين مصفوفة خارج الخلية
ملاحظه: تنفيذ هذا القسم باستخدام تقنيه العقيم والكواشف العقيمة في BSL-2 شهادة غطاء للتدفق الرقائقي. راجع الشكل 1A للحصول علي نظره عامه حول الخطوات الرئيسية قبل البدء.
- باستخدام ثقافة الانسجه المعتمدة 24 بئر لوحه ، ووضع واحد الزجاج المشبك (12-Cir-1) في كل بئر. تسميه لوحه وفقا لشكل 1b.
- ماصه 500 μL من 25 ميكروغرام/مل الحل FN لكل بئر من لوحه 24 بئر.
- ماصه المحلول علي كل كوفيرسليب بضع مرات لضمان طلاء حتى والغمر الكامل. ضع الغطاء مره أخرى علي اللوحة.
- احتضان لوحه في حاضنه ثقافة الخلية في 37 درجه مئوية و 5 ٪ CO2 لمده 1 ساعة.
ملاحظه: بدلا من ذلك ، احتضان بين عشيه وضحيها في 4 درجه مئوية. - بعد 1 ساعة ، وأزاله لوحه من الحاضنة ويستنشق حل الجبهة الكترونيه من الآبار.
- يغسل الآبار ثلاث مرات مع 500 μL من 1x تلفزيوني. يستنشق الغسيل النهائي من 1x تلفزيوني.
- كتله الآبار مع 500 μL من 0.5 ٪ من الحل dlBSA لمده لا تقل عن 15 دقيقه في 37 درجه مئوية و 5 ٪ CO2.
- يستنشق الحل dlBSA قبل الطلاء الخلايا في الخطوة 3 أدناه.
ملاحظه: إذا تخزين لوحات ، أضافه 500 μl من 1x تلفزيوني لكل كوفيرسليب بعد التطلع للحل dlbsa. ويمكن بعد ذلك الاحتفاظ بالصفائح عند درجه حرارة 4 درجات مئوية لمده تصل إلى أسبوع واحد.
3-اعداد الخلايا المعتمدة علي الرسو لفحص التصاق
ملاحظه: تنفيذ هذا القسم باستخدام تقنيه العقيم والكواشف العقيمة في BSL-2 شهادة غطاء للتدفق الرقائقي.
- علي الأقل 30 دقيقه قبل الطلاء الخلية ، قبل الحارة الحلول التالية: DMEM كامله المتوسطة ، dlBSA الحل ، 1x تلفزيوني ، 0.5 ٪ التريبسين--أدتا الحل ، و تريبسين تحييد المصل (TNS) في 37 درجه مئوية حمام المياه.
- بدءا من متموج أحادي الطبقة من خلايا REF52 في صحن 10 سم2 ، وغسل الخلايا مرتين مع 6 مل من الدافئة 1X تلفزيوني. مصل تجويع الخلايا لمده 1 ساعة علي الأقل (اعتمادا علي نوع الخلية) في 6 مل من الحل dlBSA الدافئة في 37 درجه مئوية و 5 ٪ CO2.
- غسل الخلايا مع 6 مل من تحسنت 1x تلفزيوني ، يستنشق تلفزيوني وأضافه 1.5 mL من الحارة 0.5 ٪ التريبسين--أدتا الحل.
- مكان الخلايا في حاضنه ثقافة الخلية في 37 درجه مئوية و 5 ٪ CO2 ل ~ 2 دقيقه.
- راقب الخلايا تحت المجهر الضوئي لضمان اكتمال الانفصال. إذا كانت الخلايا لا تزال ملتصقة بعد التنصت علي لوحه علي اعلي مقاعد البدلاء ، والعودة إلى 37 درجه مئوية حاضنه لمده اضافيه 2 دقيقه. ترسينايز الخلايا لمده قليله كما هو ضروري.
- ماصه 1.5 mL من محلول التريبسين الدافئ تحييد (TNS) إلى الطبق لوقف التريسينزيشن وجمع الخلايا المنفصلة. ماصه الحل صعودا وهبوطا علي الجزء السفلي من لوحه مرات عديده لأزاله جميع الخلايا الملتصقة المتبقية. إذا ظهرت الخلايا بالتكتل ، فانها تزيد من التعليق الخلوي عن طريق التغليف اللطيف صعودا وهبوطا علي الجانب الخلفي من الطبق.
- عد الخلايا باستخدام الاستبعاد الأزرق التريبين ومقياس الكريات الدموية تحت المجهر الضوئي. بدلا من ذلك ، استخدم عداد الخلايا التلقائي.
- أزاله كميه مناسبه من الخلايا لإنشاء 1.0-3.0 x 104 خلايا/مل تعليق خليه في 5 مل من dlbsa في أنبوب مخروطي 15 مل.
- خلايا الطرد المركزي في ~ 300 x g ل 5 دقيقه باستخدام الدوار زاوية ثابته في جهاز الطرد المركزي الجدول الأعلى.
- يستنشق ماده طافي من بيليه الخلية ، وأعاده التعليق الخلايا في ما مجموعه 7 مل من الحل dlbsa الدافئة. لا تسمح للخلايا ان تكون مفرطة المتموج عند طلاء الشفاه ، ولكن توزيعها بالتساوي مع عدد قليل من الخلايا لمس بعضها البعض.
- يقسم بالتساوي تعليق الخلية إلى 2 15 mL أنابيب مخروطيه ، واحده للتحكم في السيارة وحدها (DMSO) واحد ل Ku55933 (ATM كيناز المثبط ، أكسده)5. ضمان كل أنبوب يحتوي 3.5 مل من تعليق الخلية.
- باستخدام أنبوب مدور ، تدور الأنابيب في 37 درجه مئوية ل 90-120 دقيقه في حاضنه ثقافة الخلية.
- 30 دقيقه قبل الطلاء ، أضافه تركيز نهائي من 10 μM Ku55933 و DMSO (1:1000) لكل أنبوب المعنية. وضع تعليق الخلية مره أخرى علي المدورة للوقت المتبقي.
- مباشره قبل طلاء الخلايا ، واسترداد لوحه 24 بئر من الحاضنة ويستنشق الحل dlBSA.
- بعد دائر تعليق الخلية لمده 90-120 دقيقه ، أزاله 500 μl من تعليق الخلية من كل مجموعه العلاج وأضافه إلى واحده الجبهة المغلفة الصلبة كوفيرسليب في لوحه 24 بئر من الخطوة 2 كما هو موضح (الشكل 1b). العودة لوحه إلى 37 درجه مئوية و 5 ٪ CO2 خليه ثقافة الحاضنة وتعليق الخلية مره أخرى إلى التناوب.
- بعد الطلاء تعليق الخلية علي الجبهة التي تغطيها-الشفتين ، والسماح للخلايا التمسك لطول المطلوب من الوقت (علي سبيل المثال ، 10 دقيقه ، 15 دقيقه ، 20 دقيقه ، 30 دقيقه) ومن ثم المضي قدما فورا إلى الخطوة 4.
4. تثبيت الخلية وتلطيخ الأجسام المضادة للمناعة
ملاحظه: يتم تنفيذ الخطوات التالية تحت ظروف غير معقمه وفي درجه حرارة الغرفة ما لم يذكر خلاف ذلك.
- بعد الوقت المطلوب للتصاق مرت ، يستنشق حل الخلية من كل كوفيرسليب في لوحه.
- باستخدام الجانبين من البئر ، والاستغناء بلطف 500 μl من 3.7 ٪ محلول بارافورمالدهيد علي كل كوفيرسليب والانتظار 10-15 دقيقه.
- أزاله محلول بارافورمالدهيد وغسل كل كوفيرسليب مع 500 μl من 1x تلفزيوني لما مجموعه مرتين.
ملاحظه: التخلص من النفايات بارافورمالدهيد بمسؤوليه ، وفقا لخطه الصحة والسلامة البيئية للمؤسسة. - يستنشق في الاذاعه التلفزيونية ، والخلايا تتخلل كل كوفيرسليب مع 500 μl من 0.2 ٪ تريتون X-100 في 1x تلفزيوني (v/v) ل 10-15 دقيقه في درجه حرارة الغرفة.
- غسل كل كوفيرسليب مع 500 μl من 1x تلفزيوني ثلاث مرات.
- كتله الخلايا علي كل كوفيرسليب مع 500 μl من حجب المناعي العازلة التي تحتوي علي 5 ٪ مصل الماعز ، 2.5 ٪ بوسني و 0.05 ٪ تريتون X-100 المذاب في 1 × حل تلفزيوني لمده 30-60 دقيقه.
- تمييع الأجسام المضادة لمكافحه باكسيلين الاساسيه (1:250) في المخزن المؤقت للحظر. اخلط جيدا وأضف 200 μL من محلول الأجسام المضادة إلى كل شفه. احتضان في درجه حرارة الغرفة لمده 1 ساعة علي الأقل.
ملاحظه: بدلا من ذلك ، يمكن احتضان الحل المضاد الأساسي بين عشيه وضحيها في 4 درجه مئوية. هناك العديد من علامات التصاق البؤري المشتركة التي يمكن استخدامها لتلطيخ المجمعات التصاق وتحليل FA اللاحقة. وتشمل هذه الأجسام المضادة ضد البروتينات التالية: الوحدات الفرعية التكاملية (التي 1 ، α5 ، أو αv) ، talin ، أو فينكولين2. - يستنشق حل الأضداد ، ويغسل كل كوفيرسليب مع 500 μl من 1x تلفزيوني ثلاث مرات لمده 10 دقيقه لكل منهما. حماية العينات من الضوء من هذه النقطة إلى الامام.
- تمييع phسبائك المسبار F-actin مترافق إلى الأحمر الفلورسنت اليكسا 594 صبغ (1:1000) والماعز مكافحه الماوس 488 الأجسام المضادة الثانوية الفلورسنت (1:400) في نفس الحل العازلة الحاجز. تخلط جيدا وأضافه 200 μl من محلول الأجسام المضادة لكل كوفيرسليب لمده 30 دقيقه.
ملاحظه: يمكن استخدام الأجسام المضادة فلوريسسينتلي الثانوية المترافقة من الأنواع الأخرى أيضا. ومع ذلك ، فان استخدام الأجسام المضادة من الأنواع الأخرى يتطلب تعديل مصل الحاجز العازل. - يستنشق حل الأضداد ، ويغسل كل كوفيرسليب مع 500 μl من 1x تلفزيوني ثلاث مرات لمده 10 دقيقه لكل منهما.
- يستنشق 1x تلفزيوني وشطف مره واحده مع 500 μL من dIH2O.
- جبل الشفتين علي الشرائح المجهر باستخدام مكافحه تتلاشي تصاعد المتوسطة التي تحتوي علي DAPI.
- ترك الشرائح المجهر لتعيين بين عشيه وضحيها في الظلام في درجه حرارة الغرفة.
- تخزين الشرائح المجهر في الظلام في 4 درجه مئوية للتخزين علي المدى الطويل وحتى التصوير.
ملاحظه: الصورة باستخدام تقنيات المناعة القياسية. فمن المستحسن استخدام الغمر النفط عاليه الطاقة 60x عدسه الهدف لضمان دقه كافيه لملاحظه التصاقات البؤرية والكشكشة الطرفية في حواف الخلية. الحصول علي صور من الخلايا 20-30 في مجالات متعددة من الرؤية لكل كوفيرسليب تحت كل شرط العلاج والوقت. من الجمع بين النسخ المتماثلة ، وهذا ينبغي ان تسفر علي الأقل 60 خلايا من أجل اجراء التحليل الإحصائي. حفظ وتصدير الصور الفلورية باعتبارها. ملف TIFF مع الحد ادني من دقه 300 dpi.
5. القياس الكمي ألياف الإجهاد ، ودوران الخلية ، وتشكيل التصاق البؤري
ملاحظه: يتم تنفيذ تحليلات الصور التالية باستخدام أحدث إصدار من حزمه معالجه الصور المفتوحة المصدر فيجي هو مجرد صوره J (فيجي) ، والتي يمكن تحميلها مجانا في (http://fiji.sc/).
- معالجه الصور العامة
ملاحظه: ستحتاج جميع الصور إلى ان تكون مستعدة للتحليلات الحسابية من خلال تنفيذ الخطوات 5.1.1-5.1.5 أدناه (الشكل 2). بعد ذلك ، قد يتم اختيار اي أو كل إجراءات التحديد الكمي اللاحقة.- افتح الباب صوره مضانه TIFF باستخدام فيجي. تاكد من ان الصور هي 8 بت وتدرج الرمادي.
- حدد صوره-ضبط-نافذه/مستوي وحدد السيارات (الشكل 2a).
- حدد عمليه-طرح الخلفية لطرح مضان الخلفية. تحقق من انزلاق منحيات وحدد الخيار من دائره نصف قطرها الكره المتداول من 50 بكسل (الشكل 2b).
ملاحظه: للتحقق من الحجم المناسب لدائره نصف قطرها الكره المتداول ، حدد أداه الخط ورسم دائره نصف قطرها علي أكبر التصاق في الصورة. حدد قياس للتحقق من طول الخط المرسوم. إذا كانت قيمه نصف القطر كبيره جدا ، سيتم فقدان الميزات بما في ذلك التصاقات في الصورة. إذا كان نصف قطرها صغير جدا ، فانه سيؤدي إلى ظهور القطع الاثريه في الصورة المعالجة بسبب الضوضاء في الخلفية. - حدد صوره-ضبط-السطوع/التباين للتحقق من شده التصاق علي الخلفية. اضبط إذا لزم الأمر.
ملاحظه: لتحسين السطوع/التباين وتجنب تشبع الاشاره ، استخدم أداه البحث الخاصة بالصورة لفحص الرسم البياني الخاص بها لضبط السطوع/التباين. - حدد المعلمات التالية ضمن تحليل-تعيين القياسات: المنطقة ، متوسط القيمة الرمادية ، واصفات الشكل ، والكثافة المتكاملة.
- تحليل تشكيل ألياف الإجهاد
ملاحظه: يمكن ان تكون ألياف الإجهاد كميا عده طرق اعتمادا علي النمط الظاهري.- عد عدد الخلايا مع ألياف الإجهاد كنسبه مئوية علي العدد الإجمالي للخلايا. هذا التحليل هو أفضل إذا كان هناك اختلافات بصريه في عدد ألياف الإجهاد التي تشكلت في ظل ظروف تجريبية مختلفه.
- احسب عدد من ألياف الإجهاد التي مستعرضه الخلية. يسمح هذا التحليل للمقارنة بين عدد من ألياف الإجهاد التي شكلت لكل خليه.
- قياس كثافة الفلورية الاجماليه المعطية من قبل phسبائك (علي سبيل المثال ، F-actin) تلطيخ لكل خليه17،18. هذا الأسلوب سوف يسلط الضوء علي زيادات/انخفاضات جذريه في كثافة الفلوري بسبب تلطيخ F-actin.
- قم بتعيين معلمات القياس في الخطوة 5.1.5 أعلاه.
- حدد أداه اليد الحرة في شريط أدوات فيجي وتتبع الخلية (الخلايا) ذات الاهتمام يدويا. حدد تحليل-قياس. سيظهر اطار جديد يظهر معلمات القياس المحددة.
- حدد أداه Freehand في شريط أدوات فيجي وتتبع يدويا مساحة فارغه مع عدم وجود خلايا. حدد تحليل-قياس. سيكون هذا القياس بمثابه مضان الخلفية.
- استخدم المعادلة أدناه لتحديد إجمالي الفلورية F-actin لكل خليه:
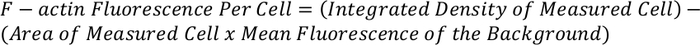
ملاحظه: يمكن تطبيع القياس الناتجة ومقارنتها مع الخلايا الأخرى لإعطاء F-actin مضان لكل خليه.
- تحليل الخلية الدائرية
ملاحظه: يمكن أيضا تسجيل المعلومات المتعلقة بمنطقه الخلية (مؤشر الخلية التي تنتشر علي مر الزمن) ، وكذلك الدوران. ويعطي هذا القياس كنسبه تتراوح بين 0 و 1 كطريقه لقياس الخلايا الممدودة إلى الجولة علي التوالي.- حدد أداه اليد الحرة في شريط أدوات فيجي ، وتتبع خليه فرديه. حدد صوره-قياس وتسجيل منطقه الخلية وقياسات المحيط لكل خليه. كرر هذا الاجراء لكل خليه.
ملاحظه: ضمن الدالة " تعيين القياسات " ، يتم توفير دائري كقياس واصفات الشكل (الخطوة 5.1.5). - عد يدويا المحير أو نتوءات المغذية لكل خليه كما هو مبين في الشكل 3 والشكل 4.
- حدد أداه اليد الحرة في شريط أدوات فيجي ، وتتبع خليه فرديه. حدد صوره-قياس وتسجيل منطقه الخلية وقياسات المحيط لكل خليه. كرر هذا الاجراء لكل خليه.
- تحليل التصاق البؤري
ملاحظه: قبل تنفيذ تحليل التصاق البؤري, تثبيت المكسيكي قبعة مرشح المساعد علي أحدث نسخه من فيجي. تم تعديل البروتوكول التالي من الدراسات السابقة19و20و21.- حدد عمليه-تعزيز التباين المحلي (كلاس) باستخدام حجم كتله من 19 ، سلال الرسم البياني 256 ، والمنحدر الأقصى من 6 ، مع عدم وجود قناع وليس بسرعة. (الشكل 2 جيم)
- حدد عمليه-فلاتر-التمويه الضبابي مع سيغما (نصف قطر) من 2.0 لتصفيه الصورة (الشكل 2d).
- حدد الإضافات-المكسيكي قبعة فلتر (Mhf) مع دائره نصف قطرها 2.0 (الشكل 2e).
- تشغيل عتبه وحدد خلفيه داكنه وأكثر/تحت استخدام اما هوانغ أو isodata كاسلوب الدرس. حدد العتبة التلقائية.
ملاحظه: هذه الخطوة تضمن ان يتم تمييز التصاقات ، ولكن أيضا مميزه عن بعضها البعض. - حدد تحليل-تحليل الجسيمات مع المعلمات التالية المحددة: الحجم = 20 ، بكسل-انفينيتي والدوران = 0.00-0.99. تحقق من الخطوط العريضة لضمان الكشف السليم وفصل التصاقات البؤرية.
ملاحظه: تسفر هذه النتائج عن الرقم والمساحة ووصف شكل التصاقات البؤرية الفردية.
Access restricted. Please log in or start a trial to view this content.
النتائج
مخطط عام لاعداد التجريبية
يمثل الشكل 1 المخطط العام للتصاق الخلية وبروتوكول النشر الذي يبدا بتجويع المصل من خلايا REF52 وينتهي بالتحليل الحسابي للصور الفلورية المكتسبة. يتم توضيح الخطوات الرئيسية في البروتوكول في الجدول الزمني. ومن الملاحظ ان الخطوة 2 من البرو...
Access restricted. Please log in or start a trial to view this content.
Discussion
البروتوكول الموصوف هنا هو طريقه متعددة واقتصاديه للشاشة بسرعة عدد من أنواع الخلايا التي تعتمد علي المرسي لأعاده عرض ديناميكية خلوي اثناء انتشار الخلية. علي وجه الخصوص ، هذا الأسلوب يفحص كميا ألياف الإجهاد وتشكيل التصاق البؤري اثناء الاكسده عندما تلتصق الخلايا إلى FN (الشكل 1A
Access restricted. Please log in or start a trial to view this content.
Disclosures
ويعلن صاحبا البلاغ انهما لا يملكان مصالح مالية متنافسة.
Acknowledgements
ويشكر المؤلفان السيد سكوت ر. هوتون وميشان س. بلاكدج علي المراجعة النقدية لهذه المخطوطة. تم تمويل هذا العمل من قبل البحوث والبرامج التي ترعاها جامعه هاي بوينت وبرنامج التكنولوجيا الحيوية في جامعه ولاية كارولينا الشمالية.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1x) | Gibco by Life Technologies | 25300-054 | cell dissociation |
| 10 cm2 dishes | Cell Treat | 229620 | sterile, tissue culture treated |
| 15 mL conical tubes | Fisher Scientific | 05-539-5 | sterile |
| 1X Phosphate Buffered Saline | Corning Cellgro | 21-031-CV | PBS, sterile, free of Mg2+ and Ca2+ |
| 24-well cell culture treated plates | Fisher Scientific | 07-200-740 | sterile, tissue culture treated |
| 4°C refrigerator | Fisher Scientific | ||
| Mouse IgG anti-paxillin primary antibody (clone 165) | BD Transduction Laboratories | 610620 | marker of focal adhesions |
| Aspirator | Argos | EV310 | |
| Biosafety cabinet | Nuair | NU-477-400 | Class II, Type A, series 5 |
| Delipidated Bovine Serum Albumin (Fatty Acid Free) Powder | Fisher Scientific | BP9704-100 | dlBSA |
| Dimethyl Sulfoxide | Fisher Scientific | BP231-100 | organic solvent to dissolve Ku55933 |
| Dulbecco's Modified Eagle Media, High Glucose | Fisher Scientific | 11965092 | REF52 base cell culture medium |
| Fetal bovine serum | Fisher Scientific | 16000044 | certified, cell culture medium supplement |
| Fiji | National Institutes of Health | http://fiji.sc/ | image analysis program |
| Filter syringe | Fisher Scientific | 6900-2502 | 0.2 µM, sterile |
| Glass coverslips (12-Cir-1.5) | Fisher Scientific | 12-545-81 | autoclave in foil to sterilize |
| Goat anti-mouse IgG secondary antibody Alexa Fluor 488 | Invitrogen | A11001 | fluorescent secondary antibody, light sensitive |
| Goat Serum | Gibco by Life Technologies | 16210-064 | component of blocking solution for immunofluorescence |
| Hemocytometer | Fisher Scientific | 22-600-107 | for cell counting |
| Human Plasma Fibronectin | Gibco by Life Technologies | 33016-015 | FN |
| IX73 Fluorescence Inverted Microscope | Olympus | microscope to visualize fluorescence, cell morphology, counting and dissociation | |
| Ku55933 | Sigma-Aldrich | SML1109-25MG | ATM kinase inhibitor, inducer of reactive oxygen species |
| L-glutamine | Fisher Scientific | 25-030-081 | cell culture medium supplement |
| Monochrome CMOS 16 bit camera | Optimos | ||
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | PFA, fixative for immunofluorescence |
| Penicillin-streptomycin | Fisher Scientific | 15-140-122 | P/S, antibiotic solution for culture medium |
| Alexa Fluor 594 phalloidin (F-actin probe) | Invitrogen | A12381 | marker of F-actin, light sensitive |
| ProLong Gold Anti-fade reagent with DAPI | Invitrogen | P36941 | cover slip mounting media including nuclear dye DAPI, light sensitive |
| REF52 cells | Graham, D.M. et. al. Journal of Cell Biology 2018 | ||
| Stir plate with heat control | Corning Incorporated | PC-420D | |
| Syringe | BD Biosciences | 309653 | 60 mL syringe |
| Tissue culture incubator | Nuair | ||
| Triton X-100 | Fisher Scientific | BP151-500 | detergent used to permeabilize cell membranes |
| Trypan Blue Solution | Fisher Scientific | 15-250-061 | for cell counting |
| Trypsin Neutralizing Solution (1x) | Gibco by Life Technologies | R-002-100 | TNS, neutralizes trypsin instead of fetal bovine serum |
| tube rotator | Fisher Scientific | 11-676-341 | |
| water bath | Fisher Scientific | FSGPD02 |
References
- Geiger, B., Bershadsky, A., Pankov, R., Yamada, K. M. Transmembrane crosstalk between the extracellular matrix--cytoskeleton crosstalk. Nature Reviews: Molecular Cell Biology. 2 (11), 793-805 (2001).
- Geiger, B., Yamada, K. M. Molecular architecture and function of matrix adhesions. Cold Spring Harbor Perspectives in Biology. 3 (5), (2011).
- Lawson, C. D., Burridge, K. The on-off relationship of Rho and Rac during integrin-mediated adhesion and cell migration. Small GTPases. 5, e27958(2014).
- Heo, J., Campbell, S. L. Mechanism of redox-mediated guanine nucleotide exchange on redox-active Rho GTPases. Journal of Biological Chemistry. 280 (35), 31003-31010 (2005).
- Tolbert, C. E., Beck, M. V., Kilmer, C. E., Srougi, M. C. Loss of ATM positively regulates Rac1 activity and cellular migration through oxidative stress. Biochemical and Biophysical Research Communications. 508 (4), 1155-1161 (2019).
- Hobbs, G. A., et al. Redox regulation of Rac1 by thiol oxidation. Free Radical Biology and Medicine. 79, 237-250 (2015).
- Zhang, Y., et al. Mitochondrial redox sensing by the kinase ATM maintains cellular antioxidant capacity. Science Signaling. 11 (538), (2018).
- Hobbs, G. A., Zhou, B., Cox, A. D., Campbell, S. L. Rho GTPases, oxidation, and cell redox control. Small GTPases. 5, e28579(2014).
- Shiloh, Y., Ziv, Y. The ATM protein kinase: regulating the cellular response to genotoxic stress, and more. Nature Reviews: Molecular Cell Biology. 14 (4), 197-210 (2013).
- Lang, L., et al. ATM-Mediated Phosphorylation of Cortactin Involved in Actin Polymerization Promotes Breast Cancer Cells Migration and Invasion. Cellular Physiology and Biochemistry. 51 (6), 2972-2988 (2018).
- Peter, Y., et al. Elevated Cu/Zn-SOD exacerbates radiation sensitivity and hematopoietic abnormalities of Atm-deficient mice. European Molecular Biology Organization Journal. 20 (7), 1538-1546 (2001).
- Takao, N., Li, Y., Yamamoto, K. Protective roles for ATM in cellular response to oxidative stress. Federation of European Biochemical Societies Letters. 472 (1), 133-136 (2000).
- Jansen, S., Gosens, R., Wieland, T., Schmidt, M. Paving the Rho in cancer metastasis: Rho GTPases and beyond. Pharmacology & Therapeutics. 183, 1-21 (2018).
- Berrier, A. L., Martinez, R., Bokoch, G. M., LaFlamme, S. E. The integrin beta tail is required and sufficient to regulate adhesion signaling to Rac1. Journal of Cell Science. 115 (Pt 22), 4285-4291 (2002).
- Arthur, W. T., Petch, L. A., Burridge, K. Integrin engagement suppresses RhoA activity via a c-Src-dependent mechanism. Current Biology. 10 (12), 719-722 (2000).
- Arthur, W. T., Burridge, K. RhoA inactivation by p190RhoGAP regulates cell spreading and migration by promoting membrane protrusion and polarity. Molecular Biology of the Cell. 12 (9), 2711-2720 (2001).
- Chandra, S., Kalaivani, R., Kumar, M., Srinivasan, N., Sarkar, D. P. Sendai virus recruits cellular villin to remodel actin cytoskeleton during fusion with hepatocytes. Molecular Biology of the Cell. 28 (26), 3801-3814 (2017).
- Fitzpatrick, M. Measuring Cell Fluorescence Using ImageJ. , https://theolb.readthedocs.io/en/latest/imaging/measuring-cell-fluorescence-using-imagej.html (2014).
- Berginski, M. E., Vitriol, E. A., Hahn, K. M., Gomez, S. M. High-resolution quantification of focal adhesion spatiotemporal dynamics in living cells. PLoS One. 6 (7), e22025(2011).
- Horzum, U., Ozdil, B., Pesen-Okvur, D. Step-by-step quantitative analysis of focal adhesions. MethodsX. 1, 56-59 (2014).
- Elosegui-Artola, A., et al. Image analysis for the quantitative comparison of stress fibers and focal adhesions. PLoS One. 9 (9), e107393(2014).
- Meller, J., Vidali, L., Schwartz, M. A. Endogenous RhoG is dispensable for integrin-mediated cell spreading but contributes to Rac-independent migration. Journal of Cell Science. 121 (Pt 12), 1981-1989 (2008).
- Donaldson, J. G. Immunofluorescence Staining. Current Protocols in Cell Biology. 69 (43), 1-7 (2015).
- Burry, R. W. Controls for immunocytochemistry: an update. Journal of Histochemistry and Cytochemistry. 59 (1), 6-12 (2011).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466 (7303), 263-266 (2010).
- Kumar, A., et al. Correction: Talin tension sensor reveals novel features of focal adhesion force transmission and mechanosensitivity. Journal of Cell Biology. 214 (2), 231(2016).
- Kumar, A., et al. Talin tension sensor reveals novel features of focal adhesion force transmission and mechanosensitivity. Journal of Cell Biology. 213 (3), 371-383 (2016).
- Friedrichs, J., Helenius, J., Muller, D. J. Quantifying cellular adhesion to extracellular matrix components by single-cell force spectroscopy. Nature Protocols. 5 (7), 1353-1361 (2010).
- Brown, M. A., et al. The use of mild trypsinization conditions in the detachment of endothelial cells to promote subsequent endothelialization on synthetic surfaces. Biomaterials. 28 (27), 3928-3935 (2007).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved