Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Oksidatif Stres Sırasında Fibronektin Üzerine Hücresel Adezyon Dinamiğinin İncelenmesi ve Epitel Hücrelerinin Yayılması
Bu Makalede
Özet
Bu yöntem, hücresel yapışmanın erken dinamiklerini ölçmek ve ankraja bağlı hücrelerin fibronektin üzerine yayılması için yararlıdır. Ayrıca, bu tetkik hücre yayılımı ve / veya hücre adezyonu ile ilgili hücre içi sinyal yolları üzerinde değişmiş redoks homeostaz etkilerini araştırmak için kullanılabilir.
Özet
Hücrelerin hücre dışı matrikse (ECM) yapışması ve yayılması, organizma gelişimi ve erişkin dokuların homeostazisi sırasında ki temel hücresel süreçlerdir. İlginçtir, oksidatif stres bu süreçleri değiştirebilir, böylece metastatik kanser gibi hastalıkların patofizyolojisine katkıda. Bu nedenle, redoks durumundaki tedirginlikler sırasında hücrelerin ECM'ye nasıl bağlanıp yayıldığı mekanizmasını anlamak normal ve hastalık durumlarına ışık verebilir. Aşağıda açıklanan bir immünofloresan tabanlı test özellikle hücre adezyonu ölçmek ve fibronektin üzerinde ölümsüzleştirilmiş fibroblast hücrelerinin yayılmasını kullanan bir adım-bilge protokoldür (FN) in vitro. Kısaca, ankraja bağımlı hücreler süspansiyon da tutulur ve oksidatif strese neden olmak için ATM kinaaz inhibitörü Ku55933 maruz kalır. Hücreler daha sonra FN kaplı yüzeye kaplanır ve önceden belirlenmiş süreler için bağlanmasına izin verilir. Bağlı kalan hücreler sabit ve yapışma esaslı antikor belirteçleri ile etiketlenir (örneğin, paxillin) ve yayılan (örneğin, F-aktin). Veri toplama ve analiz, epifloresan mikroskobu ve serbestçe kullanılabilen Fiji yazılımı da dahil olmak üzere yaygın olarak bulunan laboratuvar ekipmanları kullanılarak gerçekleştirilir. Bu prosedür çok yönlüdür ve çok çeşitli biyolojik soruları incelemek için çeşitli hücre hatları, ECM proteinleri veya inhibitörleri için değiştirilebilir.
Giriş
Hücre-matriks yapışıklıkları (yani fokal yapışıklıklar) hücre yapışıklığı ve yayılmasına aracılık eden büyük ve dinamik multimoleküler protein kompleksleridir. Bu süreçler doku gelişimi, bakımı ve fizyolojik fonksiyonu için çok önemlidir. Fokal yapışıklıklar integrinler gibi membrana bağlı reseptörlerin yanı sıra sitoskeletal aktini hücre dışı matrikse (ECM)1'ebağlayan iskele proteinlerinden oluşur. Bu kompleksler çeşitli sinyal iletim yollarının aktivasyonu yoluyla hücre dışı ortamda mevcut fizyokimyasal ipuçlarına yanıt verme yeteneğine sahiptir. Bu nedenle, odak yapışıklıkları yönlendirilmiş göç, hücre döngüsü düzenleme, farklılaşma ve sağkalım1dahil olmak üzere hücresel süreçlerin bir dizi içine hücre dışı mekanik ipuçları yaymak için sinyal merkezleri olarak hizmet vermektedir ,2. Odak yapışıklıklarını düzenleyen ve onlarla etkileşime girerek sinyal moleküllerinin bir grup küçük GTPases Rho ailesinin üyeleri içerir. Rho GTPases kendi özel spatiotemporal aktivasyon yoluyla hücre göçü ve yapışma dinamikleri düzenleyen anahtar proteinler3. Beklendiği gibi, Rho protein fonksiyonunun disregülasyonu metastaz, anjiyogenez ve diğerleri gibi insan patolojileri bir dizi karıştığı olmuştur. Özellikle ilgi, hücresel redoks durumu hücre göçü ve yapışma modülasyonu nda baskın bir rol oynar. Reaktif oksijen türlerindeki artışlar (ROS) gibi redoks homeostazındaki değişiklikler, bir dizi hücre tipinde ve insan hastalıklarında Rho protein aktivitesini ve adezyonu düzenleyen gösterilmiştir4,5,6 ,7,8. Örneğin, dna hasar onarım serine / threonin kizaz A-T-mutasyona uğramış bir mutasyon neden olduğu nörolojik bozukluk ataksi-telanjiektazi (A-T), muzdarip bireyler, metastatik kanser riski var9, 10. Bu hastalarda ve hücre hatlarında ATM kiazaz aktivitesinin kaybı, genetik mutasyon veya kimyasal inhibisyon yoluyla, pentoz fosfat yolunun disfonksiyonu nedeniyle oksidatif stres yüksek düzeyde sonuçları7,11, 12. Yıl. Ayrıca, laboratuvardan yapılan son çalışmalar, Rho ailesi GTPases in vitro5'inaktive edilmesinin doğrudan bir sonucu olarak sitoskeletal dinamikleri (yani yapışma ve yayılma) değiştirerek A-T'de ROS için patofizyolojik bir rolvurgulamıştır. Sonuçta, Rho aile aktivasyonu neden sitoskelet dinamikleri bu değişiklikler A-T hastalarında belirtilen metastatik kanser riskinin artmasına yol açabilir5,13. Bu nedenle, oksidatif stres sırasında hücre-matris etkileşimleri arasındaki etkileşimi anlamak yapışma ve yayılma nın düzenlenmesi hakkında öngörüler sağlayabilir. Bu çalışmalar aynı zamanda rho ailesi GTPases için bu sinyal süreçlerinde olası bir rol içine daha fazla araştırma için zemin hazırlayabilir.
Burada açıklanan adezyon montaj erken hücresel dinamikleri incelemek için bir protokol ve ATM kinaaz aktivitesiin inhibisyonu nedeniyle oksidatif stres sırasında yayılan. Bu test, ECM proteini fibronektin (FN) ankraja bağlı hücrelerin iyi karakterize mekanizmasına dayanmaktadır. Süspansiyon tutulan hücreler FN üzerine kaplanmış olduğunda, birkaç Rho GTPases aktin sitoskelet aliyi kontrol koordine3,14. Hücrelerin yuvarlak ve dairesel görünümden düzleştirilmiş ve genişlemiş olması yla morfolojik değişiklikler gözlenir. Bu gözlemler ile birlikte ECM ile çok sayıda matris yapışıklıkların geliştirilmesidir. Bu değişiklikler, hücreler yapışır ve yayıldı gibi ilk saat boyunca Rac1 ile RhoA biphasik aktivasyonu atfedilir 15,16.
Adezyon morfolojisi ve dinamiğinin yanı sıra hücre yayılımını incelemek için çeşitli yöntemler kullanılmıştır. Ancak, bu yöntemler sofistike uzun vadeli, canlı görüntüleme toplam iç yansıma floresans (TIRF) veya konfokal mikroskopi sistemlerine dayanır. Bu nedenle, kullanıcıların özel ekipman ve yazılımerişimi olmalıdır. Ayrıca, bu biyo-görüntüleme sistemlerinin gerektirdiği kurulum süresi, özellikle birden fazla inhibitörü veya tedavi koşullarını aynı anda test ederken erken yapışma olaylarını yakalamayı zorlaştırmaktadır.
Burada ayrıntılı olarak kullanılan yöntemler, yapışma montajını yöneten ve in vitro olarak yayılan parametreleri değerlendirmek için basit, ekonomik, ancak nicel bir yol sağlar. Protokol, epifloresan mikroskobu ve CCD kamera gibi yaygın olarak kullanılan laboratuvar ekipmanları kullanılarak gerçekleştirilir. Bu titre, daha önce 5 kez gösterilmiştir ATM kiazaz aktivitesikimyasal inhibisyonu nedeniyle oksidatif stres bir süre sonra bir FN kaplı yüzeye ankraj bağımlı hücrelerin uygulanması içerir. Kaplamayı takiben, hücrelerin belirli süreler boyunca takmasına ve yapışmasına izin verilir. Eklenmemiş hücreler yıkanırken, bağlı hücreler sabitlenir ve yapışma belirteçlerine (örneğin, paxillin) ve yayılma (örneğin, F-aktin)2,5floresan bazlı antikorlarla etiketlenir. Bu proteinler daha sonra görselleştirilir ve epifloresan mikroskobu kullanılarak kaydedilir. Sonraki veri analizi serbestçe kullanılabilir Fiji yazılımı kullanılarak gerçekleştirilir. Ayrıca, bu yöntem farklı ECM proteinleri, çeşitli oksidanlar/hücre kültürü koşulları veya çeşitli ankraja bağlı hücre hatları ile tedavi dahil olmak üzere çok çeşitli koşullar altında yapışma dinamiklerini incelemek için uyarlanabilir. biyolojik sorular.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Hazırlıklar
NOT: Aşağıda açıklanan protokol REF52 hücreleri ve ATM+/+ veya ATM-/- insan fibroblastları ile kullanım için optimize edilmiştir. Diğer hücre türleri, aşağıdaki notlar ve sorun giderme bölümlerinde açıklandığı gibi daha fazla optimizasyon gerektirebilir.
- REF52 hücreleri için 500 mL tam hücre kültürü ortamı yapın. 500 mL yüksek glikoz dulbecco modifiye Eagle's orta içeren (DMEM) eklemek 10% FBS, 2 mM L-glutamin, ve 100 adet/mL penisilin-streptomisin.
- 12 mL steril 1x fosfat tamponlu saline (PBS), pH 7.4'e 300 mg/mL FN çözeltisi ekleyerek fibronektin (FN) 25 g/mL çözeltisi hazırlayın. İyi bir şekilde karıştırın.
- Serumsuz DMEM hücre kültürü ortasında %0.5 (w/v) delipidated (yağ asidi içermez) büyükbaş serum albumin (dlBSA) çözeltisi hazırlayın. 100 mL serumsuz DMEM ortamına 0,5 g dlBSA ekleyin. Çözeltiyi iyice karıştırın, ancak girdap yapmayın. Steril filtre, kullanmadan önce 0,22 μM şırınga filtresi kullanarak çözümü yeni bir steril kap içine filtreleyin. 4 °C'de saklayın.
- 100 mL 1x PBS'de 3,7 g paraformaldehit eriterek %3.7 paraformaldehit çözeltisi yapın. Çözelti içine paraformaldehit almak için nazik ısı ve karıştırma kullanın.
NOT: Paraformaldehit çözeltisi ışığa duyarlıdır ve ışıktan korunmalıdır. 4 °C'de depolandığında bir haftaya kadar iyidir.
DİkKAT: Paraformaldehit toksik, yanıcı, aşındırıcı ve sağlık tehlikesi dir. Kullanmadan önce paraformaldehit için malzeme güvenlik veri sayfasını gözden geçirin. Göz kalkanı, yüz kalkanı, tam yüz partikül solunum cihazı, eldiven ler ve laboratuvar önlüğü dahil olmak üzere uygun kişisel koruyucu ekipmanı kullanın. - 1x PBS (v/v) içinde %0,2 non-iyonik yüzey aktif madde içeren permeabilizasyon çözeltisinihazırlayın. 100 mL için, karıştırma sırasında, yavaş yavaş 100 mL 1x PBS Triton X-100 ila 100 mL 0.2 mL ekleyin.
- 1x PBS çözeltisinde %2.5 BSA, %5 keçi serumu ve %0.05 non-iyonik yüzey aktif madde (w/v/v) içeren immünororesans bloke edici tamponu çözündür. 100 mL için 5 mL keçi serumu, 2,5 g BSA ve 0,05 mL Triton X-100'ü ~ 95 mL 1x PBS'ye ekleyin.
- 37 °C ve% 5 CO2bir hücre kültürü kuluçka hücre kültürü tedavi plaka 10 cm2 (veya başka bir damar boyutu) tam kültür orta REF52 hücreleri büyümek.
2. Hücre kültür plakalarını hücre dışı matriks proteinfibronektin ile kaplama
NOT: BSL-2 sertifikalı laminar akış kaputunda aseptik teknik ve steril reaktifler kullanarak bu bölümü gerçekleştirin. Başlamadan önce önemli adımlara genel bir bakış için Şekil 1A'ya bakın.
- 24 kuyulu plaka sertifikalı bir doku kültürü kullanarak, her kuyuya bir cam kapak lı (12-Cir-1) yerleştirin. Plakayı Şekil 1B'yegöre etiketle.
- 24 kuyulu bir plakanın her kuyusu için 25 μg/mL FN çözeltisinin pipet 500 μL'si.
- Pipet bile kaplama ve tam daldırma sağlamak için her coverslip üzerinde çözüm birkaç kez. Kapağı tabağa geri yerleştirin.
- Bir hücre kültürü kuluçka makinesinde plakayı 37 °C'de ve %5 CO2'de 1 saat kuluçkaya yatırın.
NOT: Alternatif olarak, 4 °C'de bir gecede kuluçkaya yatırın. - 1 saat sonra, kuvözden plakayı çıkarın ve FN çözeltisini kuyulardan aspire edin.
- 1x PBS'nin 500 μL'si ile kuyuları üç kez yıkayın. 1x PBS'nin son yıkamasını aspire edin.
- 37 °C'de en az 15 dakika ve %5 CO2'de%0,5 dlBSA çözeltisi içeren 500 μL'lik kuyuları bloke edin.
- Aşağıdaki adım 3'te hücreleri kaplamadan önce dlBSA çözeltisini aspire edin.
NOT: Plakaları saklarken, dlBSA çözeltisinin aspirasyonundan sonra her coverslip'e 500 μL 1x PBS ekleyin. Plakalar daha sonra 4 °C'de bir haftaya kadar tutulabilir.
3. Adezyon teşhezyon için ankraja bağlı hücrelerin hazırlanması
NOT: BSL-2 sertifikalı laminar akış kaputunda aseptik teknik ve steril reaktifler kullanarak bu bölümü gerçekleştirin.
- Hücre kaplaması öncesinde en az 30 dakika, aşağıdaki çözeltileri önceden ısıtın: DMEM komple orta, dlBSA solüsyonu, 1x PBS, %0.5 tripsin-EDTA çözeltisi ve 37°C'lik su banyosunda trypsin nötralize serumu (TNS).
- 10 cm2 çanak ref52 hücrelerinin bir confluent monolayer ile başlayarak, sıcak 1x PBS 6 mL hücreleri iki kez yıkayın. Serum 37 °C ve %5 CO2sıcak dlBSA çözeltisinin 6 mL'sinde hücreleri en az 1 saat (hücre tipine bağlı olarak) açkın.
- 6 mL ısıtılmış 1x PBS ile hücreleri yıkayın, PBS aspire edin ve 1,5 mL ılık %0,5 Tripsin-EDTA çözeltisi ekleyin.
- Hücreleri 37 °C ve %5 CO2'de ~2 dakika boyunca hücre kültürü kuluçka makinesine yerleştirin.
- Müfreze tamamlandığından emin olmak için hücreleri ışık mikroskobu altında gözlemleyin. Eğer hücreler tezgahın üstündeki tabağa dokunduktan sonra hala yapışıksa, 37 °C kuluçka makinesine 2 dakika daha dönün.
- Pipet 1.5 mL sıcak tripsin nötralize çözeltisi (TNS) tripsinizasyon durdurmak ve müstakil hücreleri toplamak için çanak. Pipet solüsyon yukarı ve aşağı plaka nın alt üzerinde birçok kez kalan tüm yapışık hücreleri kaldırmak için. Hücreler kümeli görünürse, yavaşça çanak arka üzerinde yukarı ve aşağı boru lama hücre süspansiyon daha triturate.
- Trippan mavisi dışlama ve bir ışık mikroskobu altında hemositometre kullanarak hücreleri sayın. Alternatif olarak, otomatik bir hücre sayacı kullanın.
- 15 mL konik tüpte dlBSA'nın 5 mL'sinde 1,0 - 3,0 x 104 hücre/mL hücre süspansiyonu oluşturmak için uygun miktarda hücreyi çıkarın.
- Bir masa üstü santrifüj sabit bir açı rotor kullanarak 5 dakika ~ 300 x g santrifüj hücreleri.
- Hücre peletinden süpernatant aspire ve sıcak dlBSA çözeltisi 7 mL toplam hücreleri resuspend. Hücrelerin coverslip kaplama üzerine aşırı confluent izin vermez, ama eşit birkaç hücre birbirine dokunmadan dağıtılır.
- Eşit iki 15 mL konik tüpler, bir araç tek başına kontrol (DMSO) ve Ku55933 (ATM kinaaz inhibitörü, oksidan)5için hücre süspansiyon bölmek . Her tüpün 3,5 mL hücre süspansiyonu içerdiğinden emin olun.
- Bir tüp rotator kullanarak, bir hücre kültürü kuluçka içinde 90-120 dakika boyunca 37 °C tüpler ilerler.
- Kaplamadan 30 dakika önce, her tüpe 10 μM Ku55933 ve DMSO (1:1000) son konsantrasyonu ekleyin. Kalan süre boyunca hücre süspansiyonuna geri rotator yerleştirin.
- Hücreleri kaplamadan hemen önce, 24 kuyulu plakayı kuvözden alın ve dlBSA çözeltisini aspire edin.
- Hücre süspansiyonuna 90-120 dk döndükten sonra, her tedavi grubundan 500 μL hücre süspansiyonu çıkarın ve 24 kuyulu plakaya gösterildiği gibi 24 kuyulu plakaya bir FN kaplamalı kapak kayması ekleyin (Şekil 1B). Plakayı 37 °C ve %5 CO2 hücre liksu kültür kuluçka makinesine ve hücre süspansiyonuna geri döndürün.
- FN kapalı kapaklı dudaklarda hücre süspansiyonu kaplandıktan sonra, hücrelerin istenilen süre boyunca yapışmasını bekleyin (örn. 10 dk, 15 dk, 20 dk, 30 dk) ve hemen adım 4'e geçin.
4. Hücre fiksasyonu ve immünoresans için antikor boyama
NOT: Aşağıdaki adımlar, aksi belirtilmedikçe steril olmayan koşullarda ve oda sıcaklığında gerçekleştirilir.
- Yapışma için istenilen süre geçtikten sonra, plakadaki her kapak kaymasından hücre çözeltisini aspire edin.
- Kuyunun kenarlarını kullanarak, her coverslip üzerine %3,7 paraformaldehit çözeltisi 500 μL'lik hafifçe dağıtın ve 10-15 dakika bekleyin.
- Paraformaldehit çözeltisini çıkarın ve her coverslip'i 500 μL 1x PBS ile iki kez yıkayın.
NOT: Kurumun çevre sağlığı ve güvenliği planına göre paraformaldehit atıklarını sorumlu bir şekilde bertaraf edin. - PBS aspire ve oda sıcaklığında 10-15 dakika için 1x PBS (v / v) içinde% 0.2 Triton X-100% 0.2 Triton X-100 ile her coverslip hücreleri permeabilize.
- Her coverslip'i 500 μL 1x PBS ile üç kez yıkayın.
- %5 keçi serumu, %2.5 BSA ve %0.05 Triton X-100 içeren 500 μL immünoresksan bloke tamponu içeren her kapaktaki blok hücreler 30-60 dakika boyunca 1 x PBS çözeltisinde çözünmüştür.
- Birincil anti-paxillin antikor seyreltin (1:250) engelleme tampon. İyice karıştırın ve her coverslip'e 200 μL antikor çözeltisi ekleyin. En az 1 saat oda sıcaklığında kuluçka.
NOT: Alternatif olarak, birincil antikor çözeltisi bir gecede 4 °C'de kuluçkaya yatıya çıkabilir. Yapışma komplekslerinin ve sonraki FA analizinin boyanması için kullanılabilecek birçok ortak odak yapışma belirteçleri vardır. Bunlar aşağıdaki proteinlere karşı antikorları içerir: integrin alt birimleri (β1, α5 veya αV), talin veya vinkülin2. - Antikor çözeltisini aspire edin ve her coverslip'i 10 dakika boyunca üç kez 500 μL 1x PBS ile yıkayın. Örnekleri ışıktan bu noktadan koruyun.
- Aynı engelleme tampon çözeltisi içinde kırmızı floresan Alexa 594 boya (1:1000) ve keçi-anti fare 488 floresan ikincil antikor (1:400) konjuge phalloidin F-actin probu seyreltin. İyice karıştırın ve 30 dakika boyunca her coverslip için antikor çözeltisi 200 μL ekleyin.
NOT: Diğer türlerden floresan konjuge ikincil antikorlar da kullanılabilir. Ancak, diğer türlerden antikorların kullanımı bloke tampon serum modifikasyon gerektirir. - Antikor çözeltisini aspire edin ve her coverslip'i 10 dakika boyunca üç kez 500 μL 1x PBS ile yıkayın.
- 1x PBS'yi aspire edin ve 500 μL dIH2O ile bir kez durula.
- DAPI içeren anti-fade montaj ortamı kullanarak mikroskop slaytlarına kapakları monte edin.
- Oda sıcaklığında karanlıkta bir gecede ayarlamak için mikroskop slaytlar bırakın.
- Mikroskop slaytlarını uzun süreli depolama ve görüntülemeye kadar 4 °C'de karanlıkta saklayın.
NOT: Standart immünofloresan teknikleri kullanarak görüntü. Hücre kenarlarındaki odak yapışıklıklarını ve çevresel fırfırları not etmek için yeterli çözünürlüğü sağlamak için yüksek güçlü yağ daldırma 60x objektif lens kullanılması tavsiye edilir. Her bir tedavi koşulu ve süresi altında her coverslip için birden fazla görüş alanında 20-30 hücre görüntüleri elde edin. Kombine çoğaltmalardan, istatistiksel analiz yapabilmek için en az 60 hücre verilmelidir. Floresan görüntülerini bir . En az 300 dpi çözünürlüğe sahip TIFF dosyası.
5. Stres liflerinin, hücre daireselliğinin ve odak yapışma oluşumunun ölçülmesi
NOT: Aşağıdaki görüntü analizleri, (http://fiji.sc/) adresinden ücretsiz olarak indirilebilen açık kaynak görüntüleme işleme paketi Fiji Is Just Image J'nin (Fiji) en son sürümü kullanılarak gerçekleştirilmektedir.
- Genel görüntü işleme
NOT: Tüm görüntülerin aşağıdaki 5.1.1-5.1.5 adımlarını gerçekleştirerek hesaplamalı analizler için hazırlanmasıgerekmektedir( Şekil 2 ). Daha sonra, sonraki niceleme yordamları veya tümü seçilebilir.- Açın. Fiji kullanarak TIFF floresan görüntü. Görüntülerin 8 bit ve gri tonlanındığından emin olun.
- Görüntü-Ayar-Pencere/düzey'i seçin ve Otomatik 'i seçin (Şekil 2A).
- Arka plan floresanını çıkarmak için İşlem-Çıkar Arka Planı'nı seçin. Sürgülü Paraboloid'i kontrol edin ve 50 piksellik Rolling Ball Yarıçapı seçeneğini seçin(Şekil 2B).
NOT: Yuvarlanan top yarıçapı için uygun boyutu doğrulamak için Çizgi Aracı'nı seçin ve görüntüdeki en büyük yapışma üzerine bir yarıçap çizin. Çizilen çizginin uzunluğunu doğrulamak için Ölçü'ü seçin. Yarıçapın değeri çok büyükse, görüntüde yapışıklıklar da dahil olmak üzere özellikler kaybolur. Yarıçap çok küçükse, arka plan gürültüsü nedeniyle işlenmiş görüntüdeki yapılara neden olur. - Yapışmanın arka plan üzerindeki yoğunluğunu kontrol etmek için Görüntü-Ayarla- Parlaklık/Kontrast'ı seçin. Gerekirse ayarlayın.
NOT: Parlaklığı/karşıtlığı optimize etmek ve sinyali doyurmaktan kaçınmak için, parlaklığı/kontrastı ayarlamak için histogramını incelemek için görüntünün arama aracını kullanın. - Analiz-Ayarölçümlerialtında aşağıdaki parametreleri seçin: Alan, Ortalama Gri Değeri, Şekil Tanımlayıcıları ve Tümleşik Yoğunluk.
- Stres lifi oluşum analizi
NOT: Stres lifleri fenotip bağlı olarak birden fazla şekilde ölçülebilir.- Stres lifli hücre sayısını toplam hücre sayısının üzerinde bir yüzde olarak sayın. Farklı deneysel koşullar altında oluşan stres liflerinin sayısında görsel farklılıklar varsa bu analiz en iyisidir.
- Hücreyi enine aktaran stres liflerinin sayısını sayın. Bu analiz, hücre başına oluşan stres liflerinin sayısının karşılaştırılmasına olanak sağlar.
- Hücre başına phalloidin (örneğin, F-aktin)17,18boyama tarafından verilen toplam floresan yoğunluğunu ölçün. Bu yöntem, F-aktin boyama nedeniyle floresan yoğunluğunda ciddi artışlar / azalmalar vurgulamak olacaktır.
- Yukarıdaki adım 5.1.5'te ölçüm parametrelerini ayarlayın.
- Fiji araç çubuğundaki Freehand Aracı'nı seçin ve ilgi çeken hücre(ler)i el ile takip edin. Analiz-Ölçü'yiseçin. Seçili ölçüm parametrelerini gösteren yeni bir pencere görüntülenir.
- Fiji araç çubuğundaki Serbest El Aracı'nı seçin ve hücresi olmayan boş bir alanı el ile izleyip takip edin. Analiz-Ölçü'yiseçin. Bu ölçüm arka plan floresan olarak hizmet verecektir.
- Hücre başına toplam F-aktin floresansını belirlemek için aşağıdaki denklemi kullanın:
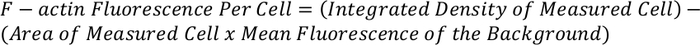
NOT: Elde edilen ölçüm normalleştirilebilir ve hücre başına F-aktin floresan vermek için diğer hücrelerle karşılaştırılabilir.
- Hücre dairesellik analizi
NOT: Hücre alanı (hücrenin zamana yayılmasının bir göstergesi) ve dairesellik hakkında bilgi de kaydedilebilir. Bu ölçüm, sırasıyla yuvarlama uzamış hücreleri ölçmek için 0 ile 1 arasında bir oran olarak verilir.- Fiji araç çubuğundaki Serbest Araç'ı seçin ve tek bir hücreyi izle. Görüntü Ölçümü'nü seçin ve her hücre için hücre alanı ve çevre ölçümlerini kaydedin. Her hücre için bu yordamı tekrarlayın.
NOT: Ölçümleri Ayarla işlevi altında Şekil Tanımlayıcıölçümü (adım 5.1.5) olarak dairesellik sağlanır. - Şekil 3 ve Şekil 4'tebetimlenen actin ile zenginleştirilmiş kabartma veya hücre başına çıkıntıları manuel olarak saymak.
- Fiji araç çubuğundaki Serbest Araç'ı seçin ve tek bir hücreyi izle. Görüntü Ölçümü'nü seçin ve her hücre için hücre alanı ve çevre ölçümlerini kaydedin. Her hücre için bu yordamı tekrarlayın.
- Odak yapışma analizi
NOT: Odak yapışma analizi yapmadan önce, Fiji'nin en son sürümüne Meksika Şapka Filtresi eklentisini takın. Aşağıdaki protokol önceki çalışmalardan değiştirilmiştir19,20,21.- 19 blok boyutu, histogram kutuları 256 ve maskesiz ve hızlı olmayan maksimum 6 eğimkullanarak Yerel Karşıtlığı Geliştir (Clahe) seçeneğini belirleyin. (Şekil 2C)
- Görüntüyü filtrelemek için 2,0 Sigmalı (Yarıçap) Ile İşlem-Filtreler- Gaussian Bulanıklığı'nı seçin(Şekil 2B).
- Yarıçapı 2,0 olan Eklentiler-Meksika Şapka Filtresi (Mhf) seçin(Şekil 2E).
- Eşik yöntemi olarak Huang veya Isodata'yı kullanarak Threshold'u çalıştırın ve Koyu Arka Plan ve Üzeri/Alt'ı seçin. Otomatik Eşik'iseçin.
NOT: Bu adım, yapışıklıkların vurgulanmasına, ancak aynı zamanda birbirinden farklı olmasını sağlar. - Aşağıdaki parametreleri seçerek Analiz-Analiz Parçacıklarını seçin: boyut=20, piksel-sonsuzluk ve dairesellik=0.00-0.99. Odak yapışıklıklarının doğru şekilde algılanmasını ve ayrılmasını sağlamak için ana hatlarını kontrol edin.
NOT: Bu sonuçlar, tek tek odak yapışıklıklarının sayı, alan ve şekil açıklamasını verir.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Deneysel kurulumun genel bir şeması
Şekil 1, REF52 hücrelerinin serum açlığı ile başlayan ve edinsel floresan görüntülerin inhesaplamalı analizi ile biten hücre yapışması ve yayma protokolü için genel şemaları temsil eder. Protokoldeki önemli adımlar zaman çizelgesinde gösterilmiştir. Not, protokolün adım 2 FN kaplı kapakların hazırlanması açıklar, hangi adım 3 ile eş zamanlı olarak yapılmalıdır: serum açlıktan REF52 hücrel...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Burada açıklanan protokol, hücre yayılımı sırasında dinamik sitoiskelet remodeling için anakağa bağlı hücre türlerini hızla taramak için çok yönlü ve ekonomik bir yoldur. Özellikle bu yöntem, hücreler FN'ye yapıştığında oksidatif stres sırasında stres lifi ve fokal yapışma oluşumunu nicel olarak inceler (Şekil 1A). Ayrıca, bu hücresel fenotipler onlar hücre eki sırasında rolleri belgelenmiş ve15,16,
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları olduğunu beyan.
Teşekkürler
Yazarlar dr Scott R. Hutton ve Meghan S. Blackledge el yazması eleştirel inceleme için teşekkür ederiz. Bu çalışma High Point Üniversitesi Araştırma ve Sponsor programları (MCS) ve North Carolina State University (MCS) Biyoteknoloji Programı tarafından finanse edilmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1x) | Gibco by Life Technologies | 25300-054 | cell dissociation |
| 10 cm2 dishes | Cell Treat | 229620 | sterile, tissue culture treated |
| 15 mL conical tubes | Fisher Scientific | 05-539-5 | sterile |
| 1X Phosphate Buffered Saline | Corning Cellgro | 21-031-CV | PBS, sterile, free of Mg2+ and Ca2+ |
| 24-well cell culture treated plates | Fisher Scientific | 07-200-740 | sterile, tissue culture treated |
| 4°C refrigerator | Fisher Scientific | ||
| Mouse IgG anti-paxillin primary antibody (clone 165) | BD Transduction Laboratories | 610620 | marker of focal adhesions |
| Aspirator | Argos | EV310 | |
| Biosafety cabinet | Nuair | NU-477-400 | Class II, Type A, series 5 |
| Delipidated Bovine Serum Albumin (Fatty Acid Free) Powder | Fisher Scientific | BP9704-100 | dlBSA |
| Dimethyl Sulfoxide | Fisher Scientific | BP231-100 | organic solvent to dissolve Ku55933 |
| Dulbecco's Modified Eagle Media, High Glucose | Fisher Scientific | 11965092 | REF52 base cell culture medium |
| Fetal bovine serum | Fisher Scientific | 16000044 | certified, cell culture medium supplement |
| Fiji | National Institutes of Health | http://fiji.sc/ | image analysis program |
| Filter syringe | Fisher Scientific | 6900-2502 | 0.2 µM, sterile |
| Glass coverslips (12-Cir-1.5) | Fisher Scientific | 12-545-81 | autoclave in foil to sterilize |
| Goat anti-mouse IgG secondary antibody Alexa Fluor 488 | Invitrogen | A11001 | fluorescent secondary antibody, light sensitive |
| Goat Serum | Gibco by Life Technologies | 16210-064 | component of blocking solution for immunofluorescence |
| Hemocytometer | Fisher Scientific | 22-600-107 | for cell counting |
| Human Plasma Fibronectin | Gibco by Life Technologies | 33016-015 | FN |
| IX73 Fluorescence Inverted Microscope | Olympus | microscope to visualize fluorescence, cell morphology, counting and dissociation | |
| Ku55933 | Sigma-Aldrich | SML1109-25MG | ATM kinase inhibitor, inducer of reactive oxygen species |
| L-glutamine | Fisher Scientific | 25-030-081 | cell culture medium supplement |
| Monochrome CMOS 16 bit camera | Optimos | ||
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | PFA, fixative for immunofluorescence |
| Penicillin-streptomycin | Fisher Scientific | 15-140-122 | P/S, antibiotic solution for culture medium |
| Alexa Fluor 594 phalloidin (F-actin probe) | Invitrogen | A12381 | marker of F-actin, light sensitive |
| ProLong Gold Anti-fade reagent with DAPI | Invitrogen | P36941 | cover slip mounting media including nuclear dye DAPI, light sensitive |
| REF52 cells | Graham, D.M. et. al. Journal of Cell Biology 2018 | ||
| Stir plate with heat control | Corning Incorporated | PC-420D | |
| Syringe | BD Biosciences | 309653 | 60 mL syringe |
| Tissue culture incubator | Nuair | ||
| Triton X-100 | Fisher Scientific | BP151-500 | detergent used to permeabilize cell membranes |
| Trypan Blue Solution | Fisher Scientific | 15-250-061 | for cell counting |
| Trypsin Neutralizing Solution (1x) | Gibco by Life Technologies | R-002-100 | TNS, neutralizes trypsin instead of fetal bovine serum |
| tube rotator | Fisher Scientific | 11-676-341 | |
| water bath | Fisher Scientific | FSGPD02 |
Referanslar
- Geiger, B., Bershadsky, A., Pankov, R., Yamada, K. M. Transmembrane crosstalk between the extracellular matrix--cytoskeleton crosstalk. Nature Reviews: Molecular Cell Biology. 2 (11), 793-805 (2001).
- Geiger, B., Yamada, K. M. Molecular architecture and function of matrix adhesions. Cold Spring Harbor Perspectives in Biology. 3 (5), (2011).
- Lawson, C. D., Burridge, K. The on-off relationship of Rho and Rac during integrin-mediated adhesion and cell migration. Small GTPases. 5, e27958(2014).
- Heo, J., Campbell, S. L. Mechanism of redox-mediated guanine nucleotide exchange on redox-active Rho GTPases. Journal of Biological Chemistry. 280 (35), 31003-31010 (2005).
- Tolbert, C. E., Beck, M. V., Kilmer, C. E., Srougi, M. C. Loss of ATM positively regulates Rac1 activity and cellular migration through oxidative stress. Biochemical and Biophysical Research Communications. 508 (4), 1155-1161 (2019).
- Hobbs, G. A., et al. Redox regulation of Rac1 by thiol oxidation. Free Radical Biology and Medicine. 79, 237-250 (2015).
- Zhang, Y., et al. Mitochondrial redox sensing by the kinase ATM maintains cellular antioxidant capacity. Science Signaling. 11 (538), (2018).
- Hobbs, G. A., Zhou, B., Cox, A. D., Campbell, S. L. Rho GTPases, oxidation, and cell redox control. Small GTPases. 5, e28579(2014).
- Shiloh, Y., Ziv, Y. The ATM protein kinase: regulating the cellular response to genotoxic stress, and more. Nature Reviews: Molecular Cell Biology. 14 (4), 197-210 (2013).
- Lang, L., et al. ATM-Mediated Phosphorylation of Cortactin Involved in Actin Polymerization Promotes Breast Cancer Cells Migration and Invasion. Cellular Physiology and Biochemistry. 51 (6), 2972-2988 (2018).
- Peter, Y., et al. Elevated Cu/Zn-SOD exacerbates radiation sensitivity and hematopoietic abnormalities of Atm-deficient mice. European Molecular Biology Organization Journal. 20 (7), 1538-1546 (2001).
- Takao, N., Li, Y., Yamamoto, K. Protective roles for ATM in cellular response to oxidative stress. Federation of European Biochemical Societies Letters. 472 (1), 133-136 (2000).
- Jansen, S., Gosens, R., Wieland, T., Schmidt, M. Paving the Rho in cancer metastasis: Rho GTPases and beyond. Pharmacology & Therapeutics. 183, 1-21 (2018).
- Berrier, A. L., Martinez, R., Bokoch, G. M., LaFlamme, S. E. The integrin beta tail is required and sufficient to regulate adhesion signaling to Rac1. Journal of Cell Science. 115 (Pt 22), 4285-4291 (2002).
- Arthur, W. T., Petch, L. A., Burridge, K. Integrin engagement suppresses RhoA activity via a c-Src-dependent mechanism. Current Biology. 10 (12), 719-722 (2000).
- Arthur, W. T., Burridge, K. RhoA inactivation by p190RhoGAP regulates cell spreading and migration by promoting membrane protrusion and polarity. Molecular Biology of the Cell. 12 (9), 2711-2720 (2001).
- Chandra, S., Kalaivani, R., Kumar, M., Srinivasan, N., Sarkar, D. P. Sendai virus recruits cellular villin to remodel actin cytoskeleton during fusion with hepatocytes. Molecular Biology of the Cell. 28 (26), 3801-3814 (2017).
- Fitzpatrick, M. Measuring Cell Fluorescence Using ImageJ. , https://theolb.readthedocs.io/en/latest/imaging/measuring-cell-fluorescence-using-imagej.html (2014).
- Berginski, M. E., Vitriol, E. A., Hahn, K. M., Gomez, S. M. High-resolution quantification of focal adhesion spatiotemporal dynamics in living cells. PLoS One. 6 (7), e22025(2011).
- Horzum, U., Ozdil, B., Pesen-Okvur, D. Step-by-step quantitative analysis of focal adhesions. MethodsX. 1, 56-59 (2014).
- Elosegui-Artola, A., et al. Image analysis for the quantitative comparison of stress fibers and focal adhesions. PLoS One. 9 (9), e107393(2014).
- Meller, J., Vidali, L., Schwartz, M. A. Endogenous RhoG is dispensable for integrin-mediated cell spreading but contributes to Rac-independent migration. Journal of Cell Science. 121 (Pt 12), 1981-1989 (2008).
- Donaldson, J. G. Immunofluorescence Staining. Current Protocols in Cell Biology. 69 (43), 1-7 (2015).
- Burry, R. W. Controls for immunocytochemistry: an update. Journal of Histochemistry and Cytochemistry. 59 (1), 6-12 (2011).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466 (7303), 263-266 (2010).
- Kumar, A., et al. Correction: Talin tension sensor reveals novel features of focal adhesion force transmission and mechanosensitivity. Journal of Cell Biology. 214 (2), 231(2016).
- Kumar, A., et al. Talin tension sensor reveals novel features of focal adhesion force transmission and mechanosensitivity. Journal of Cell Biology. 213 (3), 371-383 (2016).
- Friedrichs, J., Helenius, J., Muller, D. J. Quantifying cellular adhesion to extracellular matrix components by single-cell force spectroscopy. Nature Protocols. 5 (7), 1353-1361 (2010).
- Brown, M. A., et al. The use of mild trypsinization conditions in the detachment of endothelial cells to promote subsequent endothelialization on synthetic surfaces. Biomaterials. 28 (27), 3928-3935 (2007).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır