A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בחינת הדינמיקה של הדבקה תאית והפצת תאים אפיתל על Fibronectin במהלך לחץ חמצוני
In This Article
Summary
שיטה זו שימושית לכמת את הדינמיקה המוקדמת של הדבקה תאית והפצת תאים התלויים באנקורג ' בתוך הפיברוטין. יתר על כן, שינוי זה ניתן להשתמש כדי לחקור את ההשפעות של שינוי הומאוסטזיס מחדש על התפשטות התא ו/או הדבקה תא הקשורות מסלולים תאיים איתות.
Abstract
הדבקה והפצת תאים על מטריצת החילוץ (ECM) הם תהליכים סלולאריים חיוניים במהלך התפתחות ארגונית והומאוסטזיס של רקמות למבוגרים. מעניין, לחץ חמצוני יכול לשנות תהליכים אלה, ובכך לתרום פתופסיולוגיה של מחלות כגון סרטן גרורתי. לכן, הבנת המנגנון (ים) של כיצד תאים מתחברים ומתפשטים על ECM במהלך רטבאליות במצב מחדש יכול לספק תובנה לתוך מצבים נורמליים ומחלות. המתואר להלן פרוטוקול צעד נבון אשר מנצל באופן מבוסס immunofluorescence המבוססת במיוחד לכמת הדבקה תא והפצת התאים המוחיים פיברובטין על fibronectin (FN) ב מבחנה. בקצרה, התאים התלויים באנקורג ' מוחזקים בהשעיה וחשופים ל כספומט קינאז מעכבי Ku55933 כדי לגרום ללחץ חמצוני. התאים מצופים לאחר מכן במשטח מצופה FN ומורשים לצרף לפרקי זמן קבועים מראש. תאים שנשארים מחוברים הם קבועים ומסומנים עם סמני נוגדנים מבוססי-פלואורסצנטית של הדבקה (למשל, פקעבלין) ומריחה (למשל, F-actin). רכישת נתונים וניתוח מתבצעים באמצעות ציוד מעבדה זמין בדרך כלל, כולל מיקרוסקופ אפיפלואורסצנטית וזמין באופן חופשי תוכנת פיג'י. הליך זה הוא רב-תכליתי מאוד וניתן לשנותה למגוון קווי תאים, חלבונים מסוג ECM או מעכבי כדי לבחון מגוון רחב של שאלות ביולוגיות.
Introduction
הידקויות תא מטריצות (כלומר, הידקויות מוקד) הן מכלולי חלבון רב ודינאמיים מרובי-מולקולרית, אשר מתווכים בין הדבקה והפצת תאים. תהליכים אלה קריטיים לפיתוח רקמות, תחזוקה ותפקוד פיזיולוגי. הידקויות מיקוד מורכבים קולטנים מאוגדים ממברנה, כגון אינטנס, כמו גם הפיגומים חלבונים המקשרים אקטין השלד בתוך מטריצה החילוץ (ecm)1. מתחמי אלה מסוגלים להגיב לרמזים פיזיוכימיים נוכח בסביבה המומנת באמצעות הפעלה של שבילים איתות שונים התמרה. ככזה, הידקויות מיקוד לשמש מרכזי איתות כדי להפיץ רמזים מכניים לתוך מספר תהליכים סלולריים כולל הגירה מכוונת, רגולציה מחזור התא, בידול, והישרדות1,2. קבוצה אחת של מולקולות איתות המווסת ומאינטראקציה עם הידקויות מוקד כוללות חברים של משפחת Rho של GTPases קטנים. Rho GTPases הם חלבונים מרכזיים המסדירים את הגירה התא ואת הדינמיקה הדבקה דרך ההפעלה הטמפורלית הספציפית שלהם3. לא באופן מפתיע, דיסתקנה של תפקוד החלבון של רו היתה מעורב במספר הפתווגיות אנושיות כגון גרורות, אנגיוגנזה, ועוד. מעניין מיוחד, מעמד הסלולר התאי משחק תפקיד דומיננטי באפנון של הגירה תא והדבקה. שינויים ב הומאוסטזיס, כגון הגדלת מינים חמצן תגובתי (ROS), הוכחו להסדיר פעילות חלבון Rho, כמו גם הדבקה, במספר סוגי תאים ומחלות אדם4,5,6 ,7,8. לדוגמה, אנשים הסובלים הפרעת נוירולוגיות אטקסיה telangiectasia (A-T), אשר נגרמת על ידי מוטציה בתיקון הנזק DNA סרין/טראונין קינאז A-T-מוטציה (ATM), יש סיכון מוגבר של סרטן גרורתי9, . בסדר, עשר הפסד של פעילות ATM קינאז בחולים אלה קווי תאים, או באמצעות מוטציה גנטית או עיכוב כימי, תוצאות רמות גבוהות של מתח חמצוני עקב חוסר תפקוד של מסלול פוספטפנז 7,11, . שתיים עשרה יתר על כן, מחקרים שנעשו לאחרונה מן המעבדה הדגישו תפקיד פתופסולוגי עבור ROS ב-T על ידי שינוי דינמיקה השלד הציטומי (כלומר הדבקה והתפשטות) כתוצאה ישירה של הפעלת GTPases משפחת רו ב מבחנה5. בסופו של דבר, שינויים אלה הדינמיקה השלד ציטומי נגרמת על ידי הפעלת משפחת Rho עלול להוביל לסיכון מוגבר של סרטן גרורתי ציין בחולים5,13. לכן, הבנת הגומלין בין אינטראקציות תא מטריקס במהלך לחץ חמצוני יכולה לספק תובנות לגבי התקנה של הדבקה והתפשטות. מחקרים אלה יכולים גם להגדיר את הבמה לחקירה נוספת לתפקיד אפשרי עבור משפחת Rho GTPases בתהליכים אלה איתות.
מתואר כאן הוא פרוטוקול לחקור את הדינמיקה התאית המוקדמת של הרכבה הדבקה והתפשטות במהלך לחץ חמצוני הנגרמת על ידי עיכוב של פעילות ATM קינאז. שיטת הפעולה מבוססת על המנגנון המאופיין היטב של תאים התלויים באנקורג ' לחלבון ה-ecbronectin (FN). כאשר התאים הנשמרים ההשעיה מצופים FN, מספר רו gtpases לתאם את השליטה של שיפוץ אקטין השלד שיפוצים3,14. שינויים מורפולוגיים נצפו כאשר התאים משתנים מעגול ועגול במראה לשיטוח ולהרחבה. במקביל עם תצפיות אלה הוא התפתחות של הידקויות רבות של מטריקס עם ECM. שינויים אלה מיוחסים להפעלת biphasic של rhoa עם Rac1 בשעה הראשונה כמו תאים לדבוק ולהתפשט 15,16.
נעשה שימוש במגוון שיטות לבדיקת מורפולוגיה ודינמיקה של התאים והתפשטות התא. עם זאת, שיטות אלה מסתמכות על השתקפות מתוחכמת ארוכת טווח לאורך זמן, הדמיה פנימית (TIRF) או מערכות המיקרוסקופיה. לפיכך, על המשתמשים להיות בעלי גישה לציוד ולתוכנה מיוחדים. יתר על כן, זמן הגדרת הנדרש על ידי אלה הדמיה מערכות ביולוגי עושה לכידת אירועים הדבקה מוקדם מאתגרת, במיוחד בעת בדיקת מעכבי מרובים או תנאי טיפול במקביל.
השיטות המפורטות, להלן, מספקות דרך ישירה, חסכונית, אך כמותית, להעריך את הפרמטרים השולטים בהרכבת הדבקה ובהפצת מבחנה. הפרוטוקול מבוצע באמצעות ציוד מעבדה זמין בדרך כלל, כגון מיקרוסקופ אפיפלואורסצנטית מצלמת CCD. שיטת הפעולה כרוכה בהחלת תאים התלויים באנקורג ' למשטח FN-מצופה לאחר תקופה של מתח חמצוני הנגרם על ידי עיכוב כימי של פעילות ATM קינאז, אשר הפגינו בעבר5. לאחר הציפוי, תאים מורשים לצרף ולדבוק לאורך הזמן שצוין. תאים שאינם מצורפים נשטפים, בעוד התאים המחוברים הם קבועים ומסומנים עם נוגדנים מבוססי פלואורסצנטית סמנים של הדבקה (למשל, פקעבלין) ומתפשטת (למשל, F-actin)2,5. חלבונים אלה הם דמיינו ונרשמו באמצעות מיקרוסקופ אפיפייתי. ניתוח הנתונים הבאים מבוצע באמצעות תוכנת פיג'י זמינה בחופשיות. כמו-כן, ניתן להתאים שיטה זו לבדיקת דינמיקת הדבקה תחת מגוון רחב של תנאים, לרבות חלבונים מסוג ECM שונים, טיפול במספר רב של מצבים של חמצון/התרבות התאית או מגוון קווים תלויי-עגינה הקשורים למגוון רחב של שאלות ביולוגיות.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. ההכנות
הערה: הפרוטוקול המתואר להלן מותאם במיוחד לשימוש עם REF52 תאים ו-ATM+/+ או כספומט-/- כדוריות האדם. סוגי תאים אחרים עשויים לדרוש אופטימיזציה נוספת כמתואר בסעיפים הערות ופתרון בעיות להלן.
- להפוך 500 mL של התרבות התא המלא בינונית עבור תאים REF52. כדי 500 mL של גלוקוז גבוה המכיל מדיום הנשר של Dulbecco (DMEM) להוסיף 10% FBS, 2 מ"מ L-גלוטמין, ו 100 יחידות/mL-סטרפטומיצין.
- הכן 25 μg/mL פתרון של fibronectin (FN) על ידי הוספת 300 μL של 1 מ"ג/mL FN לפתרון 12 מ ל של מלוחים סטרילי 1x פוספט מאגור (PBS), pH 7.4. . תערבב היטב
- להכין 0.5% (w/v) מיושן (כלומר, חומצת שומן ללא תשלום) סרום אלבומין (dlBSA) פתרון בינוני בחינם התרבות של תא Dמאמ. הוסף 0.5 g של dlBSA כדי 100 mL של סרום חינם DMEM בינונית. מערבבים היטב את הפתרון, אבל לא מערבולת. המסנן הסטרילי מסנן את הפתרון לתוך מכולה סטרילית חדשה, תוך שימוש במסנן מזרק מ0.22 μM לפני השימוש. חנות ב -4 ° c.
- הפוך 3.7% הפתרון פאראפורמלדהיד על ידי המסת 3.7 g של פאראפורמלדהיד ב 100 mL של 1x PBS. השימוש חום עדין ערבוב כדי לקבל את הפאראמפורמלדהיד לתוך הפתרון.
הערה: הפתרון של פאראפורמלדהיד הוא רגיש באור ויש להגן מפני אור. היא טובה לשבוע אחד כאשר הוא מאוחסן ב -4 ° c.
התראה: פאראפורמלדהיד הוא רעיל, דליק, מאכל ומהווה סיכון בריאותי. סקור את דף נתונים בטיחות חומר עבור פאראפורמלדהיד לפני השימוש. השתמש בציוד המגן האישי המתאים בעת טיפול כולל מגן עיניים, מגן פנים, מסכת חלקיקים מלאה, כפפות, וחלוק מעבדה. - הכינו את פתרון החדירות המכיל 0.2% בלתי-יוניים של הערוץ ב-1x PBS (v/v). עבור 100 mL, לאט להוסיף 0.2 mL של טריטון X-100 כדי 100 mL של 1x PBS, תוך ערבוב.
- הפוך את המאגר לחסימת מאגר חסימות המכיל 2.5% BSA, 5% סרום עז, ו 0.05% שאינם יוניים (w/v/v) מומס 1x פתרון PBS. עבור 100 mL, להוסיף 5 מ ל של סרום עז, 2.5 g של BSA ו 0.05 mL של טריטון X-100 ב ~ 95 mL 1x PBS, תוך ערבוב.
- לגדול REF52 תאים ב-Dמאמ התרבות השלמה בינונית ב 10 ס מ2 (או כל גודל אחר של כלי) תא תרבות שטופלו צלחת בחממה תרבות התא ב 37 ° c ו 5% CO2.
2. ציפוי לוחיות התרבות של תאים עם מטריצה מיעית
הערה: ביצוע סעיף זה באמצעות טכניקה אספטי ו ריאגנטים סטרילי ב bsl-2 מוסמך זרימת כיסוי למינארי. עיין באיור 1A לקבלת מבט כולל על שלבי מפתח לפני תחילת הפעולה.
- באמצעות תרבות רקמה מוסמך צלחת 24-באר, המקום שמיכות זכוכית אחת (12-Cir-1) בכל טוב. סמן את הלוח לפי איור 1B.
- פיפטה 500 μL של 25 μg/mL FN הפתרון לכל טוב של צלחת 24 הבאר.
- פיפטה את הפתרון על כל שמיכות כמה פעמים כדי להבטיח גם ציפוי ושכל להשלים. . הניחו את המכסה בחזרה על הצלחת
- מודקת את הצלחת בחממה לתרבות התא ב 37 ° צ' ו 5% CO2 עבור 1 h.
הערה: לחלופין, המשך הלילה ב-4 ° c. - לאחר 1 h, להסיר את הצלחת מן החממה ומכה את פתרון FN מן הבארות.
- שטוף בארות שלוש פעמים עם 500 μL של 1x PBS. . מחלק את הכביסה האחרונה של ה-PBS
- בלוק בארות עם 500 μL של 0.5% dlBSA פתרון עבור מינימום של 15 דקות ב 37 ° צ' ו 5% CO2.
- לפני שאנו משלבים את הפתרון dlBSA לפני כדוריות הציפוי בשלב 3 להלן.
הערה: אם לאחסן צלחות, להוסיף 500 μL של 1x PBS לכל שמיכות לאחר השאיפה של פתרון dlBSA. לאחר מכן ניתן לשמור את הלוחות ב-4 ° c עד שבוע אחד.
3. הכנת תאים תלויי אנקורג ' לצורך הדבקה
הערה: ביצוע סעיף זה באמצעות טכניקה אספטי ו ריאגנטים סטרילי ב bsl-2 מוסמך זרימת כיסוי למינארי.
- לפחות 30 דקות לפני ציפוי התא, מראש לחמם את הפתרונות הבאים: DMEM דיום להשלים, פתרון dlBSA, 1x PBS, 0.5% טריפסין-EDTA פתרון, טריפסין נטרול סרום (TNS) באמבט מים 37 ° c.
- החל עם מונאולייר שוטפת של תאים REF52 בצלחת 10 ס"מ2 , לשטוף את התאים פעמיים עם 6 מ ל של חם 1X PBS. סרום להרעיב את התאים עבור לפחות 1 h (בהתאם לסוג תא) ב 6 מ ל של פתרון dlBSA חם ב 37 ° c ו 5% CO2.
- לשטוף את התאים עם 6 מ ל של מחמם 1x PBS, מטפי את PBS ולהוסיף 1.5 mL של חם 0.5% טריפסין-EDTA פתרון.
- מקם תאים בחממה לתרבות התא ב-37 ° צ' ו-5% CO2 עבור ~ 2 דקות.
- שימו לב לתאים תחת מיקרוסקופ קל כדי להבטיח שהוא יושלם. אם התאים עדיין מחסיד לאחר הקשה על הצלחת על גבי הספסל, לחזור לחממה 37 ° c עבור 2 דקות נוספות. טריסיזציה של התאים במשך זמן קצר ככל הנדרש.
- פיפטה 1.5 mL של טריפסין חם מנטרל את התמיסה (TNS) לצלחת להפסיק טריסינוניזציה ולאסוף תאים מנותקים. פיפטה את הפתרון למעלה ולמטה מעל החלק התחתון של הצלחת פעמים רבות כדי להסיר את כל התאים חסיד שנותרו. אם התאים מופיעים מקלאמפי, עוד קצוצות ההשעיה התא על ידי ליטוף בעדינות למעלה ולמטה מעל החלק האחורי של המנה.
- מספור תאים באמצעות טרי, הדרה כחולה והטציטוטומטר מתחת למיקרוסקופ אור. לחלופין, השתמש במונה תאים אוטומטיים.
- להסיר כמות מתאימה של תאים כדי ליצור 1.0-3.0 x 104 תאים/ml השעיית תא ב 5 מ ל של dlBSA ב 15 מ"ל צינור חרוט.
- בתאי צנטריפוגה ב ~ 300 x g עבור 5 דקות באמצעות רוטור זווית קבועה בצנטריפוגה בראש הטבלה.
- מריף את supernatant מתוך הגלולה התא, ו להשעות את התאים בסכום כולל של 7 מ ל של פתרון dlBSA חם. אל תאפשר לתאים להיות מיותר מדי שוטפת על ציפוי שמיכות, אבל מופץ באופן שווה עם מעטים התאים לגעת אחד בשני.
- באופן שווה לחלק את ההשעיה התא לתוך 2 15 מ ל צינורות חרוטי, אחד עבור הרכב לבד שליטה (DMSO) ואחד עבור Ku55933 (ATM קינאז מעכב, חמצון)5. ודא שכל צינורית מכילה 3.5 mL של השעיית התא.
- באמצעות מסובבי צינור, סובב את הצינורות ב 37 ° c עבור 90-120 דקות בחממה תרבות התא.
- 30 דקות לפני ציפוי, להוסיף ריכוז סופי של 10 μM Ku55933 ו DMSO (1:1000) לכל צינור בהתאמה. מניחים את התא מושהה בחזרה על הסובבי במשך הזמן הנותר.
- מיד לפני ציפוי התאים, לאחזר את הצלחת 24-באר מן החממה ומכה את פתרון dlBSA.
- לאחר סיבוב ההשעיה התא עבור 90-120 דקות, להסיר 500 μL של השעיית התא מכל קבוצה טיפול ולהוסיף שמיכות FN מצופה אחד בצלחת 24-הבאר משלב 2 מומחש (איור 1B). החזר את הצלחת 37 ° c ו-5% מאינקובטור תרבות התא2 והשעיית התא חזרה לסיבוב.
- לאחר ציפוי הבולם התא על כיסוי FN מכוסה, לאפשר לתאים לדבוק אורך הזמן הרצוי (למשל, 10 דקות, 15 דקות, 20 דקות, 30 דקות) ולאחר מכן מיד להמשיך לשלב 4.
4. קיבוע תא ומכתים נוגדנים לאימונולואונציה
הערה: השלבים הבאים מתבצעים תחת תנאים שאינם סטריליים ובטמפרטורת החדר אלא אם נכתב אחרת.
- לאחר הזמן הרצוי עבור הדבקה חלף, לבשל את פתרון התא מכל שמיכות בצלחת.
- באמצעות הצדדים של הבאר, לוותר בעדינות 500 μL של 3.7% הפתרון פאראמפורמלדהיד על כל שמיכות ולחכות 10-15 דקות.
- הסר את הפתרון פאראמפורמלדהיד ולשטוף כל coverslip עם 500 μL של 1x PBS עבור סך של שתי פעמים.
הערה: היפטר מפסולת פאראפורמלדהיד באחריות, בהתאם למצב הבריאות ותוכנית הבטיחות של המוסד. - מרוב הpbs, ולהחדיר את התאים על כל שמיכות עם 500 μL של 0.2% טריטון X-100 ב-1x PBS (v/v) עבור 10-15 דקות בטמפרטורת החדר.
- שטוף כל שמיכות עם 500 μL של 1x PBS שלוש פעמים.
- לחסום את התאים על כל coverslip עם 500 μL של מאגר החיסונית של immunofluorescence המכיל 5% הסרום עז, 2.5% BSA ו 0.05% טריטון X-100 מומס 1 X PBS הפתרון עבור 30-60 דקות.
- דלל את הנוגדן העיקרי נגד פקלין (1:250) במאגר חסימת. מערבבים היטב ולהוסיף 200 μL של פתרון הנוגדן כל coverslip. המשך בטמפרטורת החדר. לפחות 1 h
הערה: לחילופין, פתרון הנוגדן העיקרי ניתן לשלב בין לילה ב -4 ° c. ישנם הרבה סמנים נפוצים הדבקה מוקד שניתן להשתמש בהם לצביעת מכלולי הדבקה וניתוח הפא הבאים. אלה כוללים נוגדנים נגד החלבונים הבאים: אינטגרציה יחידות משנה (β1, α5, או αV), talin, או vinculin2. - מנושף את פתרון הנוגדן, ולשטוף כל שמיכות עם 500 μL של PBS 1x שלוש פעמים עבור 10 דקות כל אחד. הגנו על דגימות מהאור מנקודה זו והלאה.
- לדלל את phalloidin F-actin החללית מצותת הפלורסנט האדום אלקסה 594 צבען (1:1000) ו עז אנטי עכבר 488 נוגדנים משניים פלורסנט (1:400) באותו פתרון מאגר חוסם. מערבבים היטב ולהוסיף 200 μL של פתרון הנוגדן כל coverslip עבור 30 דקות.
הערה: ניתן להשתמש גם בנוגדנים משניים ממינים אחרים באמצעות פלואור. עם זאת, השימוש נוגדנים ממינים אחרים ידרוש שינוי של סרום מאגר חוסם. - מנושף את פתרון הנוגדן, ולשטוף כל שמיכות עם 500 μL של PBS 1x שלוש פעמים עבור 10 דקות כל אחד.
- מנושף את ה-PBS 1 x ולשטוף פעם אחת עם 500 μL של dIH2O.
- הר שמיכות על שקופיות מיקרוסקופ באמצעות אנטי לדעוך הרכבה בינונית המכילה DAPI.
- השאירו שקופיות מיקרוסקופ כדי לקבוע לילה בחושך בטמפרטורת החדר.
- שקופיות מיקרוסקופ לאחסן בחשכה ב -4 ° c לאחסון לטווח ארוך ועד הדמיה.
הערה: תמונה באמצעות טכניקות האימונולואוסטיות סטנדרטיות. מומלץ להשתמש בשמן רב עוצמה טבילה 60x המטרה כדי להבטיח רזולוציה מספיק כדי לציין את הידקויות מוקד קפלים היקפיים בקצוות התא. לרכוש תמונות של 20-30 תאים בשדות מרובים של תצוגה עבור כל שמיכות תחת כל תנאי טיפול וזמן. משכפל משולב, זה אמור להניב לפחות 60 תאים כדי לבצע ניתוח סטטיסטי. שמור וייצא תמונות פלואורסצנטית כמו. TIFF עם רזולוציה מינימלית של 300 dpi.
5. לכמת סיבי לחץ, מעגליות תאים ומערך הדבקה ממוקד
הערה: ניתוחי התמונה הבאים מתבצעים באמצעות הגירסה העדכנית ביותר של חבילת עיבוד הדמיה של הקוד הפתוח פיג'י הוא רק תמונה J (פיג'י), אשר ניתן להוריד ללא תשלום (http://fiji.sc/).
- עיבוד תמונה כללי
הערה: כל התמונות יצטרכו להיות מוכנים לניתוחים חישוביים על-ידי ביצוע צעדים 5.1.1-5.1.5 להלן (איור 2). לאחר מכן, כל שגרות הקוונדות העוקבות עשויות להיבחר.- . פתח את זה תמונה פלואורסצנטית TIFF באמצעות פיג'י. ודא שהתמונות הן 8 סיביות וגווני אפור.
- בחר את התמונה-התאם-חלון/רמה ובחר אוטומטי (איור 2 א).
- בחר באפשרות ' הפחתה בתהליך ' כדי להפחית את הזריחה ברקע. בדוק Paraboloid הזזה ובחר את האפשרות של רדיוס כדור מתגלגל של 50 פיקסלים (איור 2b).
הערה: כדי לוודא את הגודל המתאים עבור רדיוס הכדור המתגלגל, בחר בכלי הקו וצייר רדיוס על הדבקה הגדולה ביותר בתמונה. בחרו ' מדידה ' כדי לאמת את אורך הקו שצויר. אם ערך הרדיוס גדול מדי, תכונות הכוללות הידליות יאבדו בתמונה. אם הרדיוס קטן מדי, הוא ייתן ממצאים בתמונה המעובדת עקב רעשי רקע. - בחר באפשרות התאם תמונה-בהירות/ניגודיות כדי לבדוק את עוצמת ההדבקה על הרקע. התאם במידת הצורך.
הערה: כדי למטב את הבהירות/ניגודיות ולהימנע מלכוונן את האות, השתמש בכלי בדיקת החיפוש של התמונה כדי לבחון את ההיסטוגרמה כדי להתאים את הבהירות/הניגודיות. - בחר את הפרמטרים הבאים תחת מדידות שנקבעו על-ידי ניתוח: אזור, ממוצע ערך אפור, מתארי צורה ודחיסות משולבת.
- ניתוח מבנה סיבי לחץ
הערה: ניתן לכמת את סיבי הסטרס בדרכים מרובות בהתאם לפנוטיפים.- ספור את מספר התאים עם סיבי הסטרס כאחוזים על מספר התאים הכולל. ניתוח זה הוא הטוב ביותר אם יש הבדלים חזותיים במספר סיבי הלחץ שנוצרו בתנאים ניסיוניים שונים.
- לספור את מספר סיבי הלחץ כי לרוחב התא. ניתוח זה מאפשר השוואה בין מספר סיבי הלחץ הנוצרים בכל תא.
- למדוד את עוצמת הזריחה הכוללת שניתנה על ידי phalloidin (למשל, F-actin) כתמים לכל תא17,18. שיטה זו יהיה להדגיש עליות דרסטית/פוחתת בעוצמת הקרינה עקב מכתים F-actin.
- הגדר את פרמטרי המדידה בשלב 5.1.5 לעיל.
- בחרו בכלי ביד חופשית בסרגל הכלים של פיג'י ומעקב ידנית אחר תא (ים) של עניין. בחר באפשרות ' ניתוח מדידה'. יופיע חלון חדש שיציג את פרמטרי המדידה שנבחרו.
- בחרו בכלי ביד חופשית בסרגל הכלים של פיג'י ומעקב ידנית אחר שטח ריק ללא תאים. בחר באפשרות ' ניתוח מדידה'. מדידה זו תשמש כזריחה ברקע.
- השתמש במשוואה שלהלן כדי לקבוע את כל הזריחה הכוללת של F-actin לכל תא:
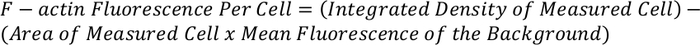
הערה: המדידה המתקבלת יכולה להיות מנורמלת ובהשוואה לתאים אחרים כדי להעניק לקרינה פלואורסצנטית F-actin לכל תא.
- ניתוח מעגלי תאים
הערה: מידע על אזור התא (מחוון של תא המתפשט לאורך זמן), כמו גם, ניתן להקליט את המעגל. מדידה זו ניתנת כיחס בין 0 ל-1 כדרך לכמת תאים מאורכים לסיבוב, בהתאמה.- בחרו בכלי ביד חופשית בסרגל הכלים פיג'י ומעקב אחר תא בודד. בחרו ' מדידה בתמונה ' והקליטו את אזור התא ואת מדידות ההיקף של כל תא. חזור על הליך זה עבור כל תא.
הערה: תחת הפונקציה Set מידות , מעגליות מסופקת כמדידה של מתארי צורה (שלב 5.1.5). - ספירה ידנית של אכטין-מועשר בבליטות או בליטה לכל תא כפי שמתואר באיור 3 ואיור 4.
- בחרו בכלי ביד חופשית בסרגל הכלים פיג'י ומעקב אחר תא בודד. בחרו ' מדידה בתמונה ' והקליטו את אזור התא ואת מדידות ההיקף של כל תא. חזור על הליך זה עבור כל תא.
- ניתוח הדבקה מוקד
הערה: לפני ביצוע ניתוח הדבקה מוקד, להתקין את התוסף מקסיקני כובע מסנן על הגירסה העדכנית ביותר של פיג'י. הפרוטוקול הבא השתנה ממחקרים קודמים19,20,21.- בחר באפשרות הגדל את הניגודיות המקומית (clahe) בגודל בלוק של 19, סלי היסטוגרמה 256 ושיפוע מרבי של 6, ללא מסכה ולא מהיר. (איור 2 ג)
- בחרו ' מסנני פרוצס '-טשטוש גאוסיאני עם סיגמא (רדיוס) של 2.0 כדי לסנן את התמונה (איור 2d).
- בחר באפשרות תוספים-מקסיקני כובע מסנן (Mhf) עם רדיוס של 2.0 (איור 2e).
- הפעל את הסף ובחר באפשרות רקע כהה ושוב/תחת שימוש באחת משתי הואנג או isodata כשיטה סף. בחר באפשרות ' סף אוטומטי'.
הערה: שלב זה מבטיח שהבלקויות יסומנו, אך גם נפרדות זו מזו. - בחר באפשרות ניתוח וניתוח חלקיקים עם הפרמטרים הבאים שנבחרו: גודל = 20, פיקסלים-אינסוף ומעגליות = 0.00-0.99. בדוק את קווי המתאר כדי להבטיח את הזיהוי הנכון וההפרדה של הידקויות מיקוד.
הערה: תוצאות אלה מפיקות את המספר, האזור ותיאור הצורה של הידקויות מיקוד בודדות.
Access restricted. Please log in or start a trial to view this content.
תוצאות
סכימה כללית של הגדרת הניסוי
איור 1 מייצג את הסכימה הכללית עבור הדבקה תא והפצת הפרוטוקול החל מהרעב בסרום של תאים REF52 ומסתיים בניתוח חישובית של תמונות פלואורסצנטית שנרכשו. שלבי המפתח בפרוטוקול מומחשים בציר הזמן. הערה, שלב 2 של הפרוטוקול מתאר את הכנת שמיכות FN-מצו?...
Access restricted. Please log in or start a trial to view this content.
Discussion
הפרוטוקול המתואר כאן הוא דרך מגוונת וחסכונית למסך במהירות מספר סוגי תאים תלויי האנקורג ' עבור שיפוץ השלד הדינאמי במהלך התפשטות התא. בפרט, שיטה זו בוחנת בוחן את סיבי הסטרס ואת היווצרות הדבקה מוקד במהלך הלחץ חמצוני כאשר התאים לדבוק FN (איור 1A). יתר על כן, אלה פנוטיפים סלולריים ע...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים כי אין להם אינטרסים פיננסיים מתחרים.
Acknowledgements
המחברים מודים לד"ר סקוט ר. האטון ומייגן ס. בלקאדן לסקירה הקריטית של כתב היד. עבודה זו ממומנת על ידי מחקר של אוניברסיטת High Point ותוכניות ממומנים (MCS) ותוכנית ביוטכנולוגיה באוניברסיטת צפון קרוליינה סטייט (MCS).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1x) | Gibco by Life Technologies | 25300-054 | cell dissociation |
| 10 cm2 dishes | Cell Treat | 229620 | sterile, tissue culture treated |
| 15 mL conical tubes | Fisher Scientific | 05-539-5 | sterile |
| 1X Phosphate Buffered Saline | Corning Cellgro | 21-031-CV | PBS, sterile, free of Mg2+ and Ca2+ |
| 24-well cell culture treated plates | Fisher Scientific | 07-200-740 | sterile, tissue culture treated |
| 4°C refrigerator | Fisher Scientific | ||
| Mouse IgG anti-paxillin primary antibody (clone 165) | BD Transduction Laboratories | 610620 | marker of focal adhesions |
| Aspirator | Argos | EV310 | |
| Biosafety cabinet | Nuair | NU-477-400 | Class II, Type A, series 5 |
| Delipidated Bovine Serum Albumin (Fatty Acid Free) Powder | Fisher Scientific | BP9704-100 | dlBSA |
| Dimethyl Sulfoxide | Fisher Scientific | BP231-100 | organic solvent to dissolve Ku55933 |
| Dulbecco's Modified Eagle Media, High Glucose | Fisher Scientific | 11965092 | REF52 base cell culture medium |
| Fetal bovine serum | Fisher Scientific | 16000044 | certified, cell culture medium supplement |
| Fiji | National Institutes of Health | http://fiji.sc/ | image analysis program |
| Filter syringe | Fisher Scientific | 6900-2502 | 0.2 µM, sterile |
| Glass coverslips (12-Cir-1.5) | Fisher Scientific | 12-545-81 | autoclave in foil to sterilize |
| Goat anti-mouse IgG secondary antibody Alexa Fluor 488 | Invitrogen | A11001 | fluorescent secondary antibody, light sensitive |
| Goat Serum | Gibco by Life Technologies | 16210-064 | component of blocking solution for immunofluorescence |
| Hemocytometer | Fisher Scientific | 22-600-107 | for cell counting |
| Human Plasma Fibronectin | Gibco by Life Technologies | 33016-015 | FN |
| IX73 Fluorescence Inverted Microscope | Olympus | microscope to visualize fluorescence, cell morphology, counting and dissociation | |
| Ku55933 | Sigma-Aldrich | SML1109-25MG | ATM kinase inhibitor, inducer of reactive oxygen species |
| L-glutamine | Fisher Scientific | 25-030-081 | cell culture medium supplement |
| Monochrome CMOS 16 bit camera | Optimos | ||
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | PFA, fixative for immunofluorescence |
| Penicillin-streptomycin | Fisher Scientific | 15-140-122 | P/S, antibiotic solution for culture medium |
| Alexa Fluor 594 phalloidin (F-actin probe) | Invitrogen | A12381 | marker of F-actin, light sensitive |
| ProLong Gold Anti-fade reagent with DAPI | Invitrogen | P36941 | cover slip mounting media including nuclear dye DAPI, light sensitive |
| REF52 cells | Graham, D.M. et. al. Journal of Cell Biology 2018 | ||
| Stir plate with heat control | Corning Incorporated | PC-420D | |
| Syringe | BD Biosciences | 309653 | 60 mL syringe |
| Tissue culture incubator | Nuair | ||
| Triton X-100 | Fisher Scientific | BP151-500 | detergent used to permeabilize cell membranes |
| Trypan Blue Solution | Fisher Scientific | 15-250-061 | for cell counting |
| Trypsin Neutralizing Solution (1x) | Gibco by Life Technologies | R-002-100 | TNS, neutralizes trypsin instead of fetal bovine serum |
| tube rotator | Fisher Scientific | 11-676-341 | |
| water bath | Fisher Scientific | FSGPD02 |
References
- Geiger, B., Bershadsky, A., Pankov, R., Yamada, K. M. Transmembrane crosstalk between the extracellular matrix--cytoskeleton crosstalk. Nature Reviews: Molecular Cell Biology. 2 (11), 793-805 (2001).
- Geiger, B., Yamada, K. M. Molecular architecture and function of matrix adhesions. Cold Spring Harbor Perspectives in Biology. 3 (5), (2011).
- Lawson, C. D., Burridge, K. The on-off relationship of Rho and Rac during integrin-mediated adhesion and cell migration. Small GTPases. 5, e27958(2014).
- Heo, J., Campbell, S. L. Mechanism of redox-mediated guanine nucleotide exchange on redox-active Rho GTPases. Journal of Biological Chemistry. 280 (35), 31003-31010 (2005).
- Tolbert, C. E., Beck, M. V., Kilmer, C. E., Srougi, M. C. Loss of ATM positively regulates Rac1 activity and cellular migration through oxidative stress. Biochemical and Biophysical Research Communications. 508 (4), 1155-1161 (2019).
- Hobbs, G. A., et al. Redox regulation of Rac1 by thiol oxidation. Free Radical Biology and Medicine. 79, 237-250 (2015).
- Zhang, Y., et al. Mitochondrial redox sensing by the kinase ATM maintains cellular antioxidant capacity. Science Signaling. 11 (538), (2018).
- Hobbs, G. A., Zhou, B., Cox, A. D., Campbell, S. L. Rho GTPases, oxidation, and cell redox control. Small GTPases. 5, e28579(2014).
- Shiloh, Y., Ziv, Y. The ATM protein kinase: regulating the cellular response to genotoxic stress, and more. Nature Reviews: Molecular Cell Biology. 14 (4), 197-210 (2013).
- Lang, L., et al. ATM-Mediated Phosphorylation of Cortactin Involved in Actin Polymerization Promotes Breast Cancer Cells Migration and Invasion. Cellular Physiology and Biochemistry. 51 (6), 2972-2988 (2018).
- Peter, Y., et al. Elevated Cu/Zn-SOD exacerbates radiation sensitivity and hematopoietic abnormalities of Atm-deficient mice. European Molecular Biology Organization Journal. 20 (7), 1538-1546 (2001).
- Takao, N., Li, Y., Yamamoto, K. Protective roles for ATM in cellular response to oxidative stress. Federation of European Biochemical Societies Letters. 472 (1), 133-136 (2000).
- Jansen, S., Gosens, R., Wieland, T., Schmidt, M. Paving the Rho in cancer metastasis: Rho GTPases and beyond. Pharmacology & Therapeutics. 183, 1-21 (2018).
- Berrier, A. L., Martinez, R., Bokoch, G. M., LaFlamme, S. E. The integrin beta tail is required and sufficient to regulate adhesion signaling to Rac1. Journal of Cell Science. 115 (Pt 22), 4285-4291 (2002).
- Arthur, W. T., Petch, L. A., Burridge, K. Integrin engagement suppresses RhoA activity via a c-Src-dependent mechanism. Current Biology. 10 (12), 719-722 (2000).
- Arthur, W. T., Burridge, K. RhoA inactivation by p190RhoGAP regulates cell spreading and migration by promoting membrane protrusion and polarity. Molecular Biology of the Cell. 12 (9), 2711-2720 (2001).
- Chandra, S., Kalaivani, R., Kumar, M., Srinivasan, N., Sarkar, D. P. Sendai virus recruits cellular villin to remodel actin cytoskeleton during fusion with hepatocytes. Molecular Biology of the Cell. 28 (26), 3801-3814 (2017).
- Fitzpatrick, M. Measuring Cell Fluorescence Using ImageJ. , https://theolb.readthedocs.io/en/latest/imaging/measuring-cell-fluorescence-using-imagej.html (2014).
- Berginski, M. E., Vitriol, E. A., Hahn, K. M., Gomez, S. M. High-resolution quantification of focal adhesion spatiotemporal dynamics in living cells. PLoS One. 6 (7), e22025(2011).
- Horzum, U., Ozdil, B., Pesen-Okvur, D. Step-by-step quantitative analysis of focal adhesions. MethodsX. 1, 56-59 (2014).
- Elosegui-Artola, A., et al. Image analysis for the quantitative comparison of stress fibers and focal adhesions. PLoS One. 9 (9), e107393(2014).
- Meller, J., Vidali, L., Schwartz, M. A. Endogenous RhoG is dispensable for integrin-mediated cell spreading but contributes to Rac-independent migration. Journal of Cell Science. 121 (Pt 12), 1981-1989 (2008).
- Donaldson, J. G. Immunofluorescence Staining. Current Protocols in Cell Biology. 69 (43), 1-7 (2015).
- Burry, R. W. Controls for immunocytochemistry: an update. Journal of Histochemistry and Cytochemistry. 59 (1), 6-12 (2011).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466 (7303), 263-266 (2010).
- Kumar, A., et al. Correction: Talin tension sensor reveals novel features of focal adhesion force transmission and mechanosensitivity. Journal of Cell Biology. 214 (2), 231(2016).
- Kumar, A., et al. Talin tension sensor reveals novel features of focal adhesion force transmission and mechanosensitivity. Journal of Cell Biology. 213 (3), 371-383 (2016).
- Friedrichs, J., Helenius, J., Muller, D. J. Quantifying cellular adhesion to extracellular matrix components by single-cell force spectroscopy. Nature Protocols. 5 (7), 1353-1361 (2010).
- Brown, M. A., et al. The use of mild trypsinization conditions in the detachment of endothelial cells to promote subsequent endothelialization on synthetic surfaces. Biomaterials. 28 (27), 3928-3935 (2007).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved