Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изучение динамики клеточной адгезии и распространения эпителиальных клеток на фибронектин во время окислительного стресса
В этой статье
Резюме
Этот метод полезен для количественной оценки ранней динамики клеточной адгезии и распространения якорно-зависимых клеток на фибронектин. Кроме того, этот анализ может быть использован для расследования влияния измененного редокс гомеостаза на распространение клеток и / или клеточной адгезии, связанные с внутриклеточной сигнальных путей.
Аннотация
Прилипание и распространение клеток на внеклеточной матрицы (ECM) являются важными клеточными процессами во время развития организма и для гомеостаза тканей взрослых. Интересно, что окислительный стресс может изменить эти процессы, тем самым способствуя патофизиологии таких заболеваний, как метастатический рак. Таким образом, понимание механизма (ы) того, как клетки прикрепляются и распространяются на ECM во время возмущений в статусе Redox может обеспечить понимание нормальных и заболеваний состояний. Ниже описан пошаговой протокол, который использует иммунофлуоресценции на основе анализа, чтобы конкретно количественно клеточной адгезии и распространения увековеченных клеток фибробластов на фибронектин (FN) в пробирке. Вкратце, якорно-зависимые клетки держатся в подвеске и подвергаются воздействию ингибитора киназы ATM Ku55933 для индуцирования окислительного стресса. Клетки затем покрываются на поверхности с покрытием FN и позволяют прикрепляться в течение предопределенных периодов времени. Клетки, которые остаются прилагается фиксированной и помечены флуоресценции на основе антител маркеров адгезии (например, паксиллин) и распространение (например, F-актин). Сбор и анализ данных осуществляется с использованием общедоступного лабораторного оборудования, включая микроскоп по эпифлюоресценции и свободно доступное программное обеспечение Фиджи. Эта процедура является весьма универсальной и может быть изменена для различных клеточных линий, белков ECM или ингибиторов для изучения широкого спектра биологических вопросов.
Введение
Клеточные матричные спайки (т.е. очаговые спайки) представляют собой крупные и динамические многомолекулярные белковые комплексы, которые посреднику клеточной сцепления и распространения. Эти процессы имеют решающее значение для развития тканей, поддержания и физиологической функции. Фокусные спайки состоят из мембранных рецепторов, таких как целы, а также строительных лесов белков, которые связывают цитоскелет актин с внеклеточной матрицы (ECM)1. Эти комплексы способны реагировать на физиохимические сигналы, присутствующие во внеклеточной среде, путем активации различных сигнальных путей трансдукции. Таким образом, координационные спайки служат в качестве сигнальных центров для распространения внеклеточных механических сигналов в ряд клеточных процессов, включая направленную миграцию, регулирование клеточного цикла, дифференциацию и выживание1,2. Одна группа сигнальных молекул, которые регулируют и взаимодействуют с координационными спайсами, включает в себя членов семейства Rho малых GTPases. Rho GTPases являются ключевыми белками, которые регулируют миграцию клеток и динамику адгезии через их специфическую пространственно-временной активации3. Неудивительно, что дисрегуляция функции белка Rho была вовлечена в ряд человеческих патологий, таких как метастаз, ангиогенез, и другие. Особый интерес представляет клеточный статус редокса, который играет доминирующую роль в модуляции миграции клеток и сливок. Изменения в редокс гомеостаза, такие как увеличение реактивных видов кислорода (ROS), были продемонстрированы для регулирования активности белка Rho, а также сливки, в ряде типов клеток и заболеваний человека4,5,6 ,7,8. Например, лица, страдающие от неврологического расстройства атаксия-телеангиэктазия (A-T), который вызван мутацией в восстановлении повреждения ДНК serine/threonine kinase A-T-mutated (ATM), имеют повышенный риск метастатического рака9, 10. Потеря активности атм киназы у этих пациентов и клеточных линий, либо через генетическую мутацию или химическое ингибирование, приводит к высокому уровню окислительного стресса из-за дисфункции пентозы фосфата путь7,11, 12. Кроме того, недавние исследования из лаборатории выявили патофизиологическую роль ДЛЯ ROS в A-T путем изменения динамики цитоскелета (т.е. схватки и распространения) как прямой результат активации Rho семьи GTPases в пробирке5. В конечномсчете, эти изменения в динамике цитоскелета, вызванные активацией семьи Rho, могут привести к повышенному риску развития метастатического рака, отмеченного у пациентов А-Т5,13. Таким образом, понимание взаимодействия между клеточными матричными взаимодействиями во время окислительного стресса может дать представление о регуляции слипа и распространения. Эти исследования могут также заложить основу для дальнейших исследований возможной роли семьи Rho GTPases в этих сигнальных процессах.
Описанный в настоящем виде протокол для изучения ранней клеточной динамики сборки адгезии и распространения во время окислительного стресса, вызванного ингибированием активности киназы АТМ. Этот анализ основан на хорошо охарактеризованном механизме крепления якорно-зависимых клеток к фибронектину белка ECM (FN). Когда клетки, поддерживаемые в подвеске, покрываются на FN, несколько Rho GTPases координируют контроль актина цитоскелета ремоделирования3,14. Морфологические изменения наблюдаются по мере того, как клетки переходят от круглых и круговых по внешнему виду к сплющенному и расширенному. Одновременно с этими наблюдениями происходит разработка многочисленных матричных спаек с ECM. Эти изменения связаны с двухфамной активации RhoA с Rac1 в течение первого часа, как клетки придерживаются и распространяются 15,16.
Различные методы были использованы для изучения морфологии адгезии и динамики, а также распространение клеток. Тем не менее, эти методы опираются на сложные долгосрочные, живой визуализации общего внутреннего отражения флуоресценции (TIRF) или конфокальной микроскопии систем. Таким образом, пользователи должны иметь доступ к специализированному оборудованию и программному обеспечению. Кроме того, время настройки, требуемое этими био-изображениясистемделает захват ранних событий сцепения сложной задачей, особенно при одновременном тестировании нескольких ингибиторов или условий лечения.
Методы, детализированные, в настоящем ива, обеспечивают простой, экономичный, но количественный способ оценки параметров, которые регулируют сборку стыковки и распространения в пробирке. Протокол выполняется с использованием широко доступного лабораторного оборудования, например, эпифлюоресцентного микроскопа и CCD-камеры. Этот анализ включает в себя применение якорно-зависимых клеток к FN покрытием поверхности после периода окислительного стресса, вызванного химическим ингибированием активности киназы АТМ, которая была продемонстрирована ранее5. После покрытия, клетки могут прикрепляться и придерживаться в течение определенного периода времени. Непривязанные клетки смываются, в то время как прикрепленные клетки фиксируются и маркируются антителами на основе флуоресценции к маркерам адгезии (например, паксиллин) и распространяются (например, F-актин)2,5. Эти белки затем визуализированы и записаны с помощью эпифлюоресцентного микроскопа. Последующий анализ данных проводится с использованием свободно доступного программного обеспечения Фиджи. Кроме того, этот метод может быть адаптирован для изучения динамики адгезии в широком диапазоне условий, включая различные белки ECM, лечение различными условиями окислителей/клеточной культуры или различных якорно-зависимых клеточных линий для решения широкого спектра биологические вопросы.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Подготовка
ПРИМЕЧАНИЕ: Протокол, описанный ниже, был оптимизирован для использования с клетками REF52 и банкоматамиили банкоматами-/- фибробластами человека. Другие типы клеток могут потребовать дальнейшей оптимизации, как описано в примечаниях и разделах устранения неполадок ниже.
- Сделайте 500 мл полной среды клеточной культуры для клеток REF52. До 500 мл высокоглюкозы, содержащей модифицированную среду Орла (DMEM) Дульбекко, добавляют 10% FBS, 2 мМ L-глютамин и 100 единиц/мл пенициллина-стрептомицина.
- Подготовьте раствор фибронектина (FN) на 25 мкг/мл, добавив 300 л 1 мг/мл FN раствора до 12 мл стерильного 1x фосфатного буферного солей (PBS), рН 7.4. Хорошо перемешать.
- Подготовьте 0,5% (w/v) delipidated (т.е., жирные кислоты бесплатно) бычьей сыворотки альбумин (dlBSA) решение в сыворотке свободной DMEM клеточной культуры среды. Добавьте 0,5 г dlBSA к 100 мл сыворотки бесплатно DMEM среды. Смешайте раствор хорошо, но не вихрь. Стерильный фильтр раствора в новый стерильный контейнер, используя перед использованием фильтр шприца 0,22 мкм. Хранить при 4 градусах по Цельсию.
- Сделать 3,7% параформальдегида путем растворения 3,7 г параформальдегида в 100 мл 1x PBS. Используйте нежное тепло и помешивая, чтобы получить параформальдегид в раствор.
ПРИМЕЧАНИЕ: Раствор параформальдегида светочувствительный и должен быть защищен от света. Это хорошо для до одной недели при хранении при 4 градусах Цельсия.
ВНИМАНИЕ: Параформальдегид является токсичным, легковоспламеняющимся, коррозионным и опасным для здоровья. Просмотрите лист данных о безопасности материалов для параформальдегида перед использованием. Используйте соответствующее индивидуальное защитное оборудование при обращении, включая щит для глаз, щит для лица, респиратор частиц полного лица, перчатки и лабораторное пальто. - Подготовьте пермяки, содержащие 0,2% неионического сурфактанта в 1x PBS (v/v). Для 100 мл, медленно добавить 0,2 мл Triton X-100 до 100 мл 1x PBS, в то время как помешивая.
- Сделайте иммунофлуоресцентный блокирующий буфер, содержащий 2,5% BSA, 5% козьей сыворотки и 0,05% неионический сурфактант (w/v/v), растворенный в растворе 1x PBS. Для 100 мл, добавить 5 мл козьей сыворотки, 2,5 г BSA и 0,05 мл Triton X-100 в 95 мл 1x PBS, в то время как перемешивание.
- Выращивайте клетки REF52 в DMEM полной культуры среды в 10 см2 (или любой другой размер сосуда) клеточной культуры обработанных пластины в инкубаторе клеточной культуры на 37 кС и 5% CO2.
2. Покрытие клеточных культурных пластин с внеклеточным матричным белками фибронектина
ПРИМЕЧАНИЕ: Выполните этот раздел с использованием асептической техники и стерильных реагентов в сертифицированный ламинарный капот BSL-2. Обратитесь к рисунку 1A для обзора ключевых шагов до начала.
- Используя ткань культуры сертифицированных 24-хорошо пластины, место один стеклянный coverslip (12-Cir-1) в каждом колодце. Этикетка пластины в соответствии с рисунком 1B.
- Pipette 500 л из 25 мкг/мл FN раствор для каждой скважины из 24-хорошо пластины.
- Pipette решение над каждым coverslip несколько раз, чтобы обеспечить равномерное покрытие и полное погружение. Поместите крышку обратно на тарелку.
- Инкубировать пластину в инкубаторе культуры клеток при 37 градусах По кв. м и 5% CO2 на 1 ч.
ПРИМЕЧАНИЕ: Кроме того, инкубировать на ночь при 4 градусах Цельсия. - После 1 ч снимите тарелку с инкубатора и снимите раствор FN с скважин.
- Вымойте скважины три раза с 500 зл 1x PBS. Аспирируй окончательную стирку 1x PBS.
- Блок скважин ы с 500 л 0,5% dlBSA раствор для как минимум 15 мин при 37 градусах Цельсия и 5% CO2.
- Аспирировать раствор dlBSA до покрытия клеток в шаге 3 ниже.
ПРИМЕЧАНИЕ: При хранении пластин, добавить 500 зл и 1x PBS к каждому coverslip после аспирации раствора dlBSA. Плиты могут храниться при 4 градусах Цельсия в течение одной недели.
3. Подготовка якорно-зависимых клеток для ассезионной ассеии
ПРИМЕЧАНИЕ: Выполните этот раздел с использованием асептической техники и стерильных реагентов в сертифицированный ламинарный капот BSL-2.
- По крайней мере, 30 минут до клеточного покрытия, предварительно разогреть следующие решения: DMEM полный средний, dlBSA решение, 1x PBS, 0,5% трипсин-EDTA решение, и трипсин нейтрализующей сыворотки (TNS) в 37 "C водяной бане.
- Начиная с сопливого монослой reF52 клеток в 10 см2 блюдо, мыть клетки дважды с 6 мл теплой 1x PBS. Сыворотка голодать клетки, по крайней мере 1 ч (в зависимости от типа клетки) в 6 мл теплого раствора dlBSA при 37 Градуса х и 5% CO2.
- Вымойте клетки с 6 мл разогретого 1x PBS, аспирировать PBS и добавить 1,5 мл теплого 0,5% Трипсин-EDTA раствор.
- Поместите клетки в инкубатор клеточной культуры при 37 градусах По Цельсию и 5% CO2 в течение 2 мин.
- Наблюдайте клетки под светлым микроскопом для того чтобы обеспечить отслоение закончено. Если клетки по-прежнему придерживаются после нажатия пластины на скамейке сверху, вернуться к 37 КС инкубатор для дополнительных 2 мин. Трипсинизировать клетки как мало времени, как это необходимо.
- Пипетка 1,5 мл теплого трипсина нейтрализуя раствор (TNS) к блюду, чтобы остановить трипсинизацию и собрать отдельные клетки. Pipette раствор вверх и вниз по нижней части пластины много раз, чтобы удалить все оставшиеся клетки адепта. Если клетки появляются неуклюжие, дальнейшее triturate клеточной подвески, мягко pipetting вверх и вниз по задней части блюда.
- Подсчитайте клетки, используя трипан синий исключение и гемоцитометр под легким микроскопом. Кроме того, используйте автоматический счетчик ячейки.
- Удалите соответствующее количество клеток, чтобы создать 1,0 - 3,0 х 104 ячейки / мл клеточной суспензии в 5 мл dlBSA в 15 мл конической трубки.
- Клетки центрифуги на 300 х г в течение 5 минут с помощью фиксированного угла ротора в столешницу центрифуги.
- Приготовьте супернатант из клеточных гранул и оттачивайте клетки в общей сложности 7 мл теплого раствора dlBSA. Не позволяйте клеткам быть чрезмерно сливными при покрытии, но равномерно распределены с несколькими ячейками, касаясь друг друга.
- Равномерно разделить подвеску клетки на две 15 мл конических труб, один для управления автомобилем в одиночку (DMSO) и один для Ku55933 (ингибитор киназы АТМ, окислитель)5. Убедитесь, что каждая трубка содержит 3,5 мл клеточной подвески.
- Используя ротатор трубки, вращайте трубки при 37 градусах по Цельсию в течение 90-120 мин в инкубаторе клеточной культуры.
- За 30 минут до покрытия добавьте окончательную концентрацию 10 мкм Ku55933 и DMSO (1:1,000) к каждой соответствующей трубке. Поместите суспензию ячейки обратно на ротатор на оставшееся время.
- Непосредственно перед покрытием клеток, получить 24-хорошо пластины из инкубатора и аспирировать раствор dlBSA.
- После вращающейся суспензии клетки в течение 90-120 мин, удалить 500 злиц клеточной подвески из каждой группы лечения и добавить к одному FN покрытием coverslip в 24-хорошо пластины от шага 2, как показано на рисунке (Рисунок 1B). Верните пластину в инкубатор культуры 37 градусов и 5% CO2 и суспензию клеток обратно в вращение.
- После покрытия клеточной подвески на FN покрытые крышки, позволяют клеткам придерживаться в течение нужного периода времени (например, 10 мин, 15 мин, 20 мин, 30 мин), а затем сразу же приступить к шагу 4.
4. Фиксация клеток и окрашивание антител для иммунофлуоресценции
ПРИМЕЧАНИЕ: Следующие шаги выполняются в нестерильных условиях и при комнатной температуре, если не указано иное.
- После того, как желаемое время для слипа прошло, аспирируя клеточный раствор от каждого coverslip в пластине.
- Используя стороны скважины, аккуратно распределите 500 л 3,7% параформальдегидного раствора на каждом покрывало и подождите 10-15 минут.
- Удалите раствор параформальдегида и промойте каждый покрывало с 500 зл 1x PBS в общей сложности два раза.
ПРИМЕЧАНИЕ: Утилизировать параформальдегидные отходы ответственно, в соответствии с экологическим здоровьем и планом безопасности учреждения. - Аспирировать PBS, и permeabilize клетки на каждом coverslip с 500 зл и 0,2% Тритон X-100 в 1x PBS (v/v) в течение 10-15 мин при комнатной температуре.
- Вымойте каждый coverslip с 500 зл и л 1x PBS три раза.
- Блок клетки на каждом coverslip с 500 л иммунофлуоресценции блокирующий буфер, содержащий 5% козьей сыворотки, 2,5% BSA и 0,05% Triton X-100 растворяется в растворе 1 х PBS в течение 30-60 минут.
- Разбавить первичное анти-паксиллин антитела (1:250) в блокирующем буфере. Хорошо перемешайте и добавьте 200 кл.л. раствора антител к каждому coverslip. Инкубировать при комнатной температуре не менее 1 ч.
ПРИМЕЧАНИЕ: Кроме того, основной антитела решение может быть инкубировано на ночь при 4 градусах Цельсия. Есть много общих фокусных маркеров адгезии, которые могут быть использованы для окрашивания стыковых комплексов и последующего анализа FA. К ним относятся антитела против следующих белков: интегринсубные субъединицы (No1, No5 или ЗВ), талин, или винкулин2. - Аспирируй раствор антитела и мойте каждый покрывало с 500 зл и 1x PBS три раза в течение 10 минут каждый. Защитите образцы от света с этой точки вперед.
- Разбавить фаллоидиновый зонд F-актина, спрягаемый с красным флуоресцентным красителем Alexa 594 (1:1000) и козьей мышью 488 флуоресцентных вторичных антител (1:400) в том же блокирующем буферном растворе. Хорошо перемешайте и добавьте 200 кл.л. раствора антител к каждому покрывалу в течение 30 минут.
ПРИМЕЧАНИЕ: Флуоресцентно спряженных вторичных антител от других видов могут быть использованы также. Однако использование антител других видов потребует модификации блокирующей буферной сыворотки. - Аспирируй раствор антитела и мойте каждый покрывало с 500 зл и 1x PBS три раза в течение 10 минут каждый.
- Аспирировать 1x PBS и промыть один раз с 500 Зл dIH2O.
- Гора охватывает на микроскоп слайды с использованием анти-fade монтажа среды, содержащей DAPI.
- Оставьте слайды микроскопа, чтобы установить на ночь в темноте при комнатной температуре.
- Храните микроскоп слайды в темноте при 4 градусах Цельсия для длительного хранения и до изображения.
ПРИМЕЧАНИЕ: Изображение с использованием стандартных методов иммунофлуоресценции. Рекомендуется использовать мощное погружение масло 60x объектив для обеспечения достаточного разрешения, чтобы отметить фокусные спайки и периферийные оборками на краях клеток. Приобретайте изображения 20-30 клеток в нескольких полях зрения для каждого покрывала под каждым условием лечения и временем. Из комбинированных реплик, это должно дать по крайней мере 60 клеток для того, чтобы выполнить статистический анализ. Сохранить и экспортировать флуоресценции изображения как . Файл TIFF с разрешением минимум 300 dpi.
5. Количественная оценка стрессовых волокон, клеточной круговорота и формирования фокусной адгезии
ПРИМЕЧАНИЕ: Следующий анализ изображений проводится с использованием последней версии пакета обработки изображений с открытым исходным кодом Fiji Is Just Image J (Фиджи), который можно скачать бесплатно по http://fiji.sc/).
- Общая обработка изображений
ПРИМЕЧАНИЕ: Все изображения должны быть подготовлены для вычислительного анализа, выполняя шаги 5.1.1.5.5 ниже(рисунок 2). После этого могут быть выбраны любые или все последующие процедуры количественной оценки.- Откройте . TIFF флуоресценции изображение с использованием Фиджи. Убедитесь, что изображения 8-битные и серые.
- Выберите Изображение-Настройка окна / уровня и выберите Авто (рисунок 2A).
- Выберите фон процесса-вычитания, чтобы вычесть фоновую флуоресценцию. Проверьте раздвижные параболоиды и выберите вариант Радиуса Rolling Ball 50 пикселей(рисунок 2B).
ПРИМЕЧАНИЕ: Чтобы проверить правильный размер радиуса подвижного шара, выберите линейный инструмент и нарисуйте радиус на самом большом сливе на изображении. Выберите меру для проверки длины нарисованной линии. Если значение радиуса слишком велико, объекты, включая спайки, будут потеряны на изображении. Если радиус слишком мал, это приведет к артефактам в обработанном изображении из-за фонового шума. - Выберите Изображение-Скорректировать-Яркость / Контраст, чтобы проверить интенсивность сливок на заднем плане. При необходимости отрегулируйте.
ПРИМЕЧАНИЕ: Чтобы оптимизировать яркость/контрастность и избежать насыщения сигнала, используйте инструмент поиска изображения, чтобы изучить его гистограмму, чтобы настроить яркость/контрастность. - Выберите следующие параметры в соответствии с измерениями анализа:Область, среднее серое значение, дескрипторы формы и интегрированная плотность.
- Анализ формирования стрессового волокна
ПРИМЕЧАНИЕ: Стресс волокон можно количественно несколько способов в зависимости от фенотипа.- Подсчитайте количество клеток со стрессовыми волокнами в процентах от общего числа клеток. Этот анализ лучше всего, если Есть визуальные различия в количестве волокон стресса, образуются в различных экспериментальных условиях.
- Подсчитайте количество стрессовых волокон, которые перечеркиваются в клетке. Этот анализ позволяет сравнить количество стрессовых волокон, образуювшихся на клетку.
- Измерьте общую интенсивность флуоресценции, учитываемую фаллоидином (например, F-актином) окрашивание на одну ячейку17,18. Этот метод будет выделить резкое увеличение / снижение интенсивности флуоресценции из-за F-актирования окрашивания.
- Установите параметры измерения в шаге 5.1.5 выше.
- Выберите инструмент Freehand в панели инструментов Фиджи и вручную проследите ячейку (ы) интерес. Выберите Анализ-мера. Появится новое окно, показывающее выбранные параметры измерения.
- Выберите инструмент Freehand в панели инструментов Фиджи и вручную проследите пустое пространство без присутствия ячеек. Выберите Анализ-мера. Это измерение будет служить фоновой флуоресценцией.
- Используйте уравнение ниже, чтобы определить общую флуоресценцию F-актина на одну клетку:
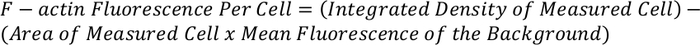
ПРИМЕЧАНИЕ: В результате измерения могут быть нормализованы и по сравнению с другими клетками, чтобы дать F-актина флуоресценции на клетку.
- Анализ круговой связи клеток
ПРИМЕЧАНИЕ: Информация о области клеток (показатель распространения клеток с течением времени), а также, круговость также может быть записана. Это измерение дается как соотношение между 0 к 1 как способ количественной оценки клеток, которые удлиненные до круглых, соответственно.- Выберите инструмент Freehand в панели инструментов Фиджи и отследите индивидуальную ячейку. Выберите измерять изображение и записывать измерения области ячейки и периметра для каждой ячейки. Повторите эту процедуру для каждой ячейки.
ПРИМЕЧАНИЕ: В соответствии с функцией Set Measurements круговая измерие обеспечивается в качестве измерения дескрипторов формы (шаг 5.1.5). - Ручно подсчитывая actin-обогащенный ruffling или выступы в клетку как показано в рисунке 3 и рисунке 4.
- Выберите инструмент Freehand в панели инструментов Фиджи и отследите индивидуальную ячейку. Выберите измерять изображение и записывать измерения области ячейки и периметра для каждой ячейки. Повторите эту процедуру для каждой ячейки.
- Анализ фокусной адгезии
ПРИМЕЧАНИЕ: Перед выполнением координационного анализа адгезии, установите мексиканский плагин Hat Filter на последней версии Фиджи. Следующий протокол был изменен по сравнению с предыдущими исследованиями19,20,21.- Выберите процесс-увеличить локальный контраст (Clahe) с использованием блока размером 19, гистограмма бункеров 256, и максимальный наклон 6, без маски и не быстро. (Рисунок 2C)
- Выберите процесс-фильтры- Гауссиан Пятно с Sigma (Радиус) 2.0 для фильтрации изображения(Рисунок 2D).
- Выберите Плагины-мексиканский фильтр шляпы (Mhf) с радиусом 2.0(Рисунок 2E).
- Выполнить порог и выбрать Темный фон и over/Under, используя либо Хуан или Isodata в качестве метода порога. Выберите Автопорог.
ПРИМЕЧАНИЕ: Этот шаг гарантирует, что спайки выделены, но и отличаются друг от друга. - Выберите Анализно-анализные частицы по следующим выбранным параметрам: размер 20, пикселей-бесконечность и круговая круговорота 0,00-0,99. Проверьте контуры, чтобы обеспечить надлежащее обнаружение и разделение очаговых спаек.
ПРИМЕЧАНИЕ: Эти результаты дают число, площадь и форму описания отдельных фокусных спаек.
Access restricted. Please log in or start a trial to view this content.
Результаты
Общая схема экспериментальной настройки
Рисунок 1 представляет общую схему сливк и распространения протокола, начинающийся с голодания в сыворотке крови клеток REF52 и заканчивающийся вычислительным анализом приобретенных изображений флуоресценции. Ключ...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Описанный здесь протокол является универсальным и экономичным способом быстрого скрининга ряда типов якорных клеток для динамической ремоделирования цитоскелетов во время распространения клеток. В частности, этот метод количественно исследует стрессовые волокна и образование коор...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Авторы благодарят доктора Скотта Р. Хаттона и Меган С. Блэкледж за критический обзор рукописи. Эта работа была профинансирована исследованиями и спонсорскими программами Университета Хай-Пойнта (MCS) и Программой биотехнологии в Университете штата Северная Каролина (MCS).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1x) | Gibco by Life Technologies | 25300-054 | cell dissociation |
| 10 cm2 dishes | Cell Treat | 229620 | sterile, tissue culture treated |
| 15 mL conical tubes | Fisher Scientific | 05-539-5 | sterile |
| 1X Phosphate Buffered Saline | Corning Cellgro | 21-031-CV | PBS, sterile, free of Mg2+ and Ca2+ |
| 24-well cell culture treated plates | Fisher Scientific | 07-200-740 | sterile, tissue culture treated |
| 4°C refrigerator | Fisher Scientific | ||
| Mouse IgG anti-paxillin primary antibody (clone 165) | BD Transduction Laboratories | 610620 | marker of focal adhesions |
| Aspirator | Argos | EV310 | |
| Biosafety cabinet | Nuair | NU-477-400 | Class II, Type A, series 5 |
| Delipidated Bovine Serum Albumin (Fatty Acid Free) Powder | Fisher Scientific | BP9704-100 | dlBSA |
| Dimethyl Sulfoxide | Fisher Scientific | BP231-100 | organic solvent to dissolve Ku55933 |
| Dulbecco's Modified Eagle Media, High Glucose | Fisher Scientific | 11965092 | REF52 base cell culture medium |
| Fetal bovine serum | Fisher Scientific | 16000044 | certified, cell culture medium supplement |
| Fiji | National Institutes of Health | http://fiji.sc/ | image analysis program |
| Filter syringe | Fisher Scientific | 6900-2502 | 0.2 µM, sterile |
| Glass coverslips (12-Cir-1.5) | Fisher Scientific | 12-545-81 | autoclave in foil to sterilize |
| Goat anti-mouse IgG secondary antibody Alexa Fluor 488 | Invitrogen | A11001 | fluorescent secondary antibody, light sensitive |
| Goat Serum | Gibco by Life Technologies | 16210-064 | component of blocking solution for immunofluorescence |
| Hemocytometer | Fisher Scientific | 22-600-107 | for cell counting |
| Human Plasma Fibronectin | Gibco by Life Technologies | 33016-015 | FN |
| IX73 Fluorescence Inverted Microscope | Olympus | microscope to visualize fluorescence, cell morphology, counting and dissociation | |
| Ku55933 | Sigma-Aldrich | SML1109-25MG | ATM kinase inhibitor, inducer of reactive oxygen species |
| L-glutamine | Fisher Scientific | 25-030-081 | cell culture medium supplement |
| Monochrome CMOS 16 bit camera | Optimos | ||
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | PFA, fixative for immunofluorescence |
| Penicillin-streptomycin | Fisher Scientific | 15-140-122 | P/S, antibiotic solution for culture medium |
| Alexa Fluor 594 phalloidin (F-actin probe) | Invitrogen | A12381 | marker of F-actin, light sensitive |
| ProLong Gold Anti-fade reagent with DAPI | Invitrogen | P36941 | cover slip mounting media including nuclear dye DAPI, light sensitive |
| REF52 cells | Graham, D.M. et. al. Journal of Cell Biology 2018 | ||
| Stir plate with heat control | Corning Incorporated | PC-420D | |
| Syringe | BD Biosciences | 309653 | 60 mL syringe |
| Tissue culture incubator | Nuair | ||
| Triton X-100 | Fisher Scientific | BP151-500 | detergent used to permeabilize cell membranes |
| Trypan Blue Solution | Fisher Scientific | 15-250-061 | for cell counting |
| Trypsin Neutralizing Solution (1x) | Gibco by Life Technologies | R-002-100 | TNS, neutralizes trypsin instead of fetal bovine serum |
| tube rotator | Fisher Scientific | 11-676-341 | |
| water bath | Fisher Scientific | FSGPD02 |
Ссылки
- Geiger, B., Bershadsky, A., Pankov, R., Yamada, K. M. Transmembrane crosstalk between the extracellular matrix--cytoskeleton crosstalk. Nature Reviews: Molecular Cell Biology. 2 (11), 793-805 (2001).
- Geiger, B., Yamada, K. M. Molecular architecture and function of matrix adhesions. Cold Spring Harbor Perspectives in Biology. 3 (5), (2011).
- Lawson, C. D., Burridge, K. The on-off relationship of Rho and Rac during integrin-mediated adhesion and cell migration. Small GTPases. 5, e27958(2014).
- Heo, J., Campbell, S. L. Mechanism of redox-mediated guanine nucleotide exchange on redox-active Rho GTPases. Journal of Biological Chemistry. 280 (35), 31003-31010 (2005).
- Tolbert, C. E., Beck, M. V., Kilmer, C. E., Srougi, M. C. Loss of ATM positively regulates Rac1 activity and cellular migration through oxidative stress. Biochemical and Biophysical Research Communications. 508 (4), 1155-1161 (2019).
- Hobbs, G. A., et al. Redox regulation of Rac1 by thiol oxidation. Free Radical Biology and Medicine. 79, 237-250 (2015).
- Zhang, Y., et al. Mitochondrial redox sensing by the kinase ATM maintains cellular antioxidant capacity. Science Signaling. 11 (538), (2018).
- Hobbs, G. A., Zhou, B., Cox, A. D., Campbell, S. L. Rho GTPases, oxidation, and cell redox control. Small GTPases. 5, e28579(2014).
- Shiloh, Y., Ziv, Y. The ATM protein kinase: regulating the cellular response to genotoxic stress, and more. Nature Reviews: Molecular Cell Biology. 14 (4), 197-210 (2013).
- Lang, L., et al. ATM-Mediated Phosphorylation of Cortactin Involved in Actin Polymerization Promotes Breast Cancer Cells Migration and Invasion. Cellular Physiology and Biochemistry. 51 (6), 2972-2988 (2018).
- Peter, Y., et al. Elevated Cu/Zn-SOD exacerbates radiation sensitivity and hematopoietic abnormalities of Atm-deficient mice. European Molecular Biology Organization Journal. 20 (7), 1538-1546 (2001).
- Takao, N., Li, Y., Yamamoto, K. Protective roles for ATM in cellular response to oxidative stress. Federation of European Biochemical Societies Letters. 472 (1), 133-136 (2000).
- Jansen, S., Gosens, R., Wieland, T., Schmidt, M. Paving the Rho in cancer metastasis: Rho GTPases and beyond. Pharmacology & Therapeutics. 183, 1-21 (2018).
- Berrier, A. L., Martinez, R., Bokoch, G. M., LaFlamme, S. E. The integrin beta tail is required and sufficient to regulate adhesion signaling to Rac1. Journal of Cell Science. 115 (Pt 22), 4285-4291 (2002).
- Arthur, W. T., Petch, L. A., Burridge, K. Integrin engagement suppresses RhoA activity via a c-Src-dependent mechanism. Current Biology. 10 (12), 719-722 (2000).
- Arthur, W. T., Burridge, K. RhoA inactivation by p190RhoGAP regulates cell spreading and migration by promoting membrane protrusion and polarity. Molecular Biology of the Cell. 12 (9), 2711-2720 (2001).
- Chandra, S., Kalaivani, R., Kumar, M., Srinivasan, N., Sarkar, D. P. Sendai virus recruits cellular villin to remodel actin cytoskeleton during fusion with hepatocytes. Molecular Biology of the Cell. 28 (26), 3801-3814 (2017).
- Fitzpatrick, M. Measuring Cell Fluorescence Using ImageJ. , https://theolb.readthedocs.io/en/latest/imaging/measuring-cell-fluorescence-using-imagej.html (2014).
- Berginski, M. E., Vitriol, E. A., Hahn, K. M., Gomez, S. M. High-resolution quantification of focal adhesion spatiotemporal dynamics in living cells. PLoS One. 6 (7), e22025(2011).
- Horzum, U., Ozdil, B., Pesen-Okvur, D. Step-by-step quantitative analysis of focal adhesions. MethodsX. 1, 56-59 (2014).
- Elosegui-Artola, A., et al. Image analysis for the quantitative comparison of stress fibers and focal adhesions. PLoS One. 9 (9), e107393(2014).
- Meller, J., Vidali, L., Schwartz, M. A. Endogenous RhoG is dispensable for integrin-mediated cell spreading but contributes to Rac-independent migration. Journal of Cell Science. 121 (Pt 12), 1981-1989 (2008).
- Donaldson, J. G. Immunofluorescence Staining. Current Protocols in Cell Biology. 69 (43), 1-7 (2015).
- Burry, R. W. Controls for immunocytochemistry: an update. Journal of Histochemistry and Cytochemistry. 59 (1), 6-12 (2011).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466 (7303), 263-266 (2010).
- Kumar, A., et al. Correction: Talin tension sensor reveals novel features of focal adhesion force transmission and mechanosensitivity. Journal of Cell Biology. 214 (2), 231(2016).
- Kumar, A., et al. Talin tension sensor reveals novel features of focal adhesion force transmission and mechanosensitivity. Journal of Cell Biology. 213 (3), 371-383 (2016).
- Friedrichs, J., Helenius, J., Muller, D. J. Quantifying cellular adhesion to extracellular matrix components by single-cell force spectroscopy. Nature Protocols. 5 (7), 1353-1361 (2010).
- Brown, M. A., et al. The use of mild trypsinization conditions in the detachment of endothelial cells to promote subsequent endothelialization on synthetic surfaces. Biomaterials. 28 (27), 3928-3935 (2007).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены