Method Article
الأرقاء أعاده برمجه الخلايا الليفية البشرية عن طريق التعبير القسري من عوامل النسخ
In This Article
Erratum Notice
Summary
هذا البروتوكول يدل علي التحريض من برنامج الأرقاء في الخلايا الليفية الجلدية البشرية عن طريق التعبير القسري من عوامل النسخ GATA2 ، GFI1B و FOS لتوليد الخلايا الجذعية التي تكون الدم و سلف.
Abstract
وتظل أليات الخلوية والجزيئية التي تقوم عليها مواصفات الخلايا الجذعية للدم البشرية (HSCs) بعيده المنال. استراتيجيات لتلخيص ظهور HSC الإنسان في المختبر مطلوبه للتغلب علي القيود في دراسة هذه العملية التنموية المعقدة. هنا ، ونحن وصف بروتوكول لتوليد الجذعية التي تكون الدم والخلايا الشبيهة بالسلف من الانسجه الليفية الجلدية البشرية التي تستخدم نهج أعاده برمجه الخلية المباشرة. هذه الخلايا العابرة من خلال نوع من الخلايا الوسيطة الأرقاء ، تشبه الانتقال من البطانة إلى الدم (EHT) سمه من مواصفات HSC. تمت أعاده برمجه الخلايا الليفية للخلايا الأرقاء عن طريق محول مع GATA2 ، GFI1B وعوامل النسخ فوس. هذا المزيج من ثلاثه عوامل الناجمة عن التغييرات المورفولوجية ، والتعبير عن الأرقاء والمكونات المكونة للدم والبرامج الديناميكية EHT المحولة. الخلايا المعاد برمجتها تولد ذريه الدم وأعاده ملء الفئران نقص المناعة لمده ثلاثه أشهر. ويمكن تكييف هذا البروتوكول نحو التشريح الألى لعمليه EHT البشرية كما هو مثال هنا من خلال تحديد أهداف GATA2 خلال المراحل المبكرة من أعاده البرمجة. وهكذا ، فان أعاده برمجه الأرقاء البشرية توفر نهجا بسيطا وعريكتا لتحديد العلامات الجديدة والمنظمين لظهور HSC الإنسان. في المستقبل ، قد يؤدي الحث المخلص لمصير الأرقاء في الخلايا الليفية إلى توليد HSCs خاصه بالمريض للزرع.
Introduction
الجذعية الدموية النهائية والخلايا سلف (hspcs) تظهر في الشريان الابهر-gonad-ميسونيفروس (AGM) والمشيمة من السلائف البطانية مع القدرة علي الأرقاء ، من خلال الانتقال من البطانة إلى الدم (eht)1، 2- السلائف الأرقاء (HPs) تعبر عن كل من علامات البطانة والدم ، ولكن تحديدها الدقيق لا يزال بعيد المنال ، وخاصه في النظام البشري. علي الرغم من كونها عمليه المحفوظة نسبيا في الثدييات ، الخلايا الجذعية التي تكون الدم (HSC) التنمية لا يزال يختلف بشكل كبير بين البشر ونماذج الفئران3،4. لذلك ، في المختبر النهج لتلخيص التنمية HSC البشرية مطلوبه.
التمايز من الخلايا الجذعية مستحث (PSCs) إلى HSCs ، علي الرغم من انها واعده ، وقد حققت نجاحا محدودا علي مدي السنوات ال 20 الماضية ، ويرجع ذلك في معظمه إلى بروتوكولات التمايز المتاحة ، والتي تؤدي إلى الأسلاف البدائية الدم مع الفقراء المطعمة القدرة5،6،7. بدلا من ذلك ، تم تطبيق منهجيات أعاده برمجه الخلايا المباشرة لتوليد خلايا شبيهه ب hspc من أنواع خلايا متعددة ، باستخدام عوامل النسخ (TFs)8،9. علي وجه الخصوص ، والإفراط في التعبير عن ثلاثه TFs ، Gata2 ، Gfi1b و cFos ، تحويل الخلايا الليفية الجنينية الماوس إلى HSPCs من خلال HP المتوسطة مع النمط الظاهري المحدد (Prom1 + Sca-1 + CD34 + CD45-)10. تشبه هذه العملية EHT التي تحدث في الجنين والمشيمة ، خلال تحديد الدم النهائي. هذا النمط الظاهري مكن تحديد وعزل السكان من HPs في المشيمة الماوس انه بعد الثقافة قصيرة الأجل والشق التنشيط ولدت بشكل متسلسل Hps11.
حتى الآن ، لم يتم إنشاء النمط الظاهري الذي يميز HSCs البشرية من السلائف الخاصة بهم ، ولكن من المعروف ان بعض الجزيئات التي أعرب عنها في HSCs الناشئة. انتيفين الفا 6 (ITGA6 أو CD49f) هو التعبير عنه بشكل كبير في المدى الطويل أعاده ملء HSCs ، الخلايا في المقصورة HSC12، وانزيم التحويل انجيوتنسين (ACE أو CD143) موجود في CD34 السلائف المكونة للدم السلبية في الانسجه الجنينية التي تشكل الدم13.
في الاونه الاخيره ، وقد أظهرنا ان الإصدارات البشرية من ثلاثه TFs ، GATA2 ، فوس و GFI1B أعاده برمجه الخلايا الليفية الجلدية البشرية (hdfs) في hps مع القدرة علي المدى القصير14. في المراحل الاوليه من أعاده برمجه ، GATA2 يشرك الكروماتين المفتوحة والمجندين GFI1B و FOS لقمع الخلايا الليفية وتنشيط الجينات البطانية والدم. الخلايا المستحثة للغاية وأعرب CD49f و ACE ، والتي تحتوي علي نسبه مئوية صغيره من الخلايا التعبير عن علامة HSPC CD34. وقد تبين ان الجين CD9 ، الذي يعبر عنه في15 hscs وهو مهم بالنسبة لموجه HSC16، ان يكون هدفا مباشرا لGATA2 وبين الجينات الأكثر تنظيما في الخلايا المعاد برمجتها14. CD9 قد تشكل بالتالي علامة اضافيه لل HPs من الإنسان نهائيا تكون الدم.
في هذا البروتوكول ، ونحن وصف جيل من الخلايا مثل hspc من الورم الليفي البشري من خلال التعبير القسري من GATA2 ، GFI1B و FOS ، فضلا عن طريقه تكييفها ل الكروماتين ايمونوبريسيبيتيشن (رقاقه)-التسلسل (seq) تحليل في بداية أعاده برمجه. تم ترميز TFs في الدوكسيسيكلين (دوكس)-المحرض لينتيفيرال (فوفو-tetO) الذي يحتوي علي عنصر الاستجابة الخاصة بالاختزال (TRE) ومروج CMV الحد الأدنى ، وكانت محوله مع ناقل التاسيسيه التي تحتوي علي الاتجاه المعاكس البروتين المتحول (pFUW-M2rtTA). عندما يتم أضافه دوكس (التناظرية من التالتيتير) بعد المحولة ، فانه يربط إلى البروتين rtTA الذي يتفاعل مع TRE السماح TF النسخ (نظام Tet علي). يتطلب الاجراء 25 يوما لإكمال. لتجارب رقاقه التسلسل ، تم محوله HDFs مع إصدارات الموسومة من GATA2 (pFUW-tetO-3xFLAG-GATA2) و GFI1B (pLV-tetO-HA-GFI1B) ، بالاضافه إلى pFUW-تيالي-فوس و TF ربط المواقع تم تحليلها بعد يومين من مكملات الاكسده.
في نهاية المطاف ، وأعاده برمجه الأرقاء من الخلايا الليفية البشرية يوفر نظام عريكة في المختبر لدراسة أليات الكامنة وراء النمو البشري الدم ومصدرا محتملا من HSPCs المريض محدده للتطبيق السريري في المستقبل.
Protocol
تم تنفيذ هذا البروتوكول وفقا للمبادئ التوجيهية للجنة أخلاقيات البحث الإنساني في جامعه لوند وينبغي القيام به وفقا للمبادئ التوجيهية المؤسسية الفردية.
1. اعداد كاشف
- بالنسبة لمصل البقر الجنيني المعدل (DMEM) من دولبيكو/20% ، اخلط الجلوكوز العالي DMEM الذي يحتوي علي بيروفات الصوديوم بنسبه 20% ، 1% البنسلين-ستربتومايسين (القلم/البكتيريا) ، 1% L-الجلوتامين ، 1% الأحماض الامينيه غير الاساسيه و 10-4-M 2- مركابتوايثانول.
- لكامل DMEM ، مزيج الجلوكوز عاليه DMEM التي تحتوي علي البيروفات الصوديوم مع 10 ٪ من الفارين ، 1 ٪ القلم/بكتيريا و 1 ٪ L-الجلوتامين.
- لمتوسط الدم ، اخلطي متوسطالدم (جدول المواد) مع هيدروكورتيزونمن 10 إلى 6 أمتار و 1% من القلم/العقديات.
- استخدام الفوسفات-مخزنه المالحة (تلفزيوني) دون الكالسيوم أو المغنيسيوم.
2. الإنسان الجلد الليفي العزلة
ملاحظه: يمكن شراء HDFs من الموردين المعتمدين (جدول المواد). في هذه الحالة ، وتوسيع الخلايا الليفية واستخدامها مباشره في أعاده برمجه التجارب (القسم 4). بدلا من ذلك ، يمكن عزل HDFs من الجهات المانحة. إذا تم عزل الخلايا الليفية من جات مانحه مختلفه ، والحفاظ علي عينات منفصلة عن بعضها البعض في جميع الخطوات من البروتوكول. لوحات التسمية/الآبار وأنابيب جمع مع رقم تعريف كل متبرع.
- الحصول علي HDFs من 3 مم جولة الخزعات الجلد لكمه التي يقوم بها الأطباء المؤهلين.
- معطف ثلاثه ابار من الانسجه المعالجة الثقافة 6-حسنا لوحه مع 500 μL من 0.1% الجيلاتين واحتضان لمده 20 دقيقه في 37 درجه مئوية.
- يستنشق حل الجيلاتين المتبقية وأضافه 750 μL من DMEM/20 ٪ لكل بئر. يجب ان تكون مغطاه السطح بأكمله من البئر مع المتوسطة.
- أضافه 1.5 mL من DMEM/20 ٪ من المدفع إلى السطح الداخلي للغطاء المعقم 100 مم بتري غطاء الطبق وانتشار قطره مع المعونة من ماصه المصلية 5 مل.
- ضع خزعة الجلد في الوسط علي الغطاء بملقط معقم.
- تشريح خزعة الجلد في تسعه أقسام مماثله ، وذلك باستخدام واحده مشرط معقمه لاجراء خزعة في مكان ومشرط الثاني لقطع.
- ضع ثلاث قطع خزعة لكل بئر باستخدام ملقط مدبب. تاكد من ان القطع نعلق علي الجزء السفلي من البئر.
- وضع المشبك 22 ملم علي راس القطع وتطبيق بعض الضغط.
- احتضان لوحه في 37 درجه مئوية ، 5 ٪ CO2، لمده أسبوع. افحص الخلايا يوميا وأضف 200 μL من DMEM/20% لكل يومين لاستبدال الوسط المبخر.
- بعد أسبوع واحد ، أضافه ما يصل إلى 2 مل من DMEM/20 ٪ واستبدال المتوسطة كل 2 − 3 أيام.
-
مرور الخلايا بنسبه 1:4 عندما تكون الآبار متموج (حوالي 4 − 8 أسابيع).
- اعداد 0.1 ٪ الجيلاتين المغلفة ثقافة الانسجه المعالجة 6-حسنا لوحات.
- يستنشق المتوسطة من الآبار في 80 ٪ كونفلوينسي ويغسل مره واحده مع 1 مل من تلفزيوني.
- أزاله كوفيرسليب مع ملقط معقمه ووضع كوفيرسليب في بئر جديده من 6-بئر لوحه, مع الجانب الانسجه اعلي.
ملاحظه: سيتم أيضا حصاد الخلايا التي بقيت ملتصقة بالشفة المختلطة. - أضافه 500 μL من حل التفكك (جدول المواد) لكل بئر (بما في ذلك الآبار مع الشفتين) واحتضان في 37 درجه مئوية ، 5 ٪ CO2 لمده 5 − 10 دقيقه. تحقق عندما تبدا الخلايا في الارتفاع من الجزء السفلي من البئر وتعطيل حل التفكك من قبل أضافه 500 μL من DMEM/20% لكل بئر.
- جمع الخلايا الليفية من جميع الآبار في أنبوب مخروطي 15 مل. أضافه وسيطه اضافيه إلى الآبار لجمع الخلايا المتبقية. الطرد المركزي أنبوب في 350 x g لمده 5 دقائق.
- في هذه الاثناء ، أضافه 500 μL من DMEM/20 ٪ لكل بئر من لوحات الجيلاتين المغلفة سابقا.
- يستنشق المتوسطة وأعاده تعليق الخلايا الليفية في 6 مل من DMEM/20 ٪.
- أضافه 500 μL من تعليق الخلايا الليفية لكل بئر (اثنين من 6 لوحات جيدا لكل عينه/المتبرع في المجموع). احتضان الخلايا بين عشيه وضحيها في 37 درجه مئوية ، 5 ٪ CO2.
- في اليوم التالي ، أضافه 1 مل من DMEM/20 ٪ لكل بئر. استبدل المتوسط ب 2 مل من DMEM/20% من الحجم السنوي لكل 2 − 3 أيام حتى تبلغ الآبار 80% متموج.
- كرر المقطع 2.11 لثلاثه ابار متموج حتى يتم الوصول إلى الممر الثالث.
-
تجميد الخلايا الليفية من الآبار المتموجة (الفقرتان 1 و 3).
- يستنشق المتوسطة من الآبار ويغسل مره واحده مع 1 مل من تلفزيوني.
- فك وجمع الخلايا الليفية كما هو موضح في الخطوات 2.11.4 و 2.11.5.
- عد الخلايا مع مقياس الكريات الدموية والطرد المركزي الأنبوب في 350 x g لمده 5 دقائق.
- بعد طرد ، يستنشق المتوسطة وأعاده تعليق الخلايا الليفية في الخلية مع 10 ٪ DMSO في كثافة 5 × 105 خلايا/مل.
- أضافه 1 مل من تعليق الخلية لكل كريوفيال وتجميد الخلايا بين عشيه وضحيها في-80 درجه مئوية باستخدام حاويه تجميد. نقل قوارير إلى-150 درجه مئوية (النيتروجين السائل) للتخزين علي المدى الطويل.
3. إنتاج لينتيفيرال
- تنمو الخلايا HEK293T في صحن الثقافة المعالجة الانسجه مم 100 مع 10 مل من DMEM كامله ، في 37 درجه مئوية ، 5 ٪ CO2، حتى يتم التوصل إلى كونفلوينسي.
- في اليوم السابق للتحويل ، يستنشق المتوسطة ويغسل الطبق بعناية مع 5 مل من تلفزيوني.
- بعد أزاله تلفزيوني, أضافه 1.5 mL من حل التفكك واحتضان في 37 °C, 5% CO2 ل 5 − 10 دقيقه لفك الخلايا من الطبق.
ملاحظه: فمن المستحسن لتسخين كل من الحل التلفزيوني والتفكك قبل استخدام ، بحيث لا تعاني الخلايا صدمه حراريه. - انتنشيط حل التفكك مع 3 مل من DMEM كامله ونقل تعليق الخلية إلى أنبوب مخروطي 15 مل. غسل الطبق مع 5 مل من DMEM كامله لأزاله الخلايا المرفقة المتبقية ونقل هذا الحجم إلى أنبوب مخروطي 15 مل.
- تعليق خليه الطرد المركزي في 350 x g لمده 5 دقائق.
- يستنشق ماده طافي وتقسيم الخلية بيليه بالتساوي بين 6 100 مم الانسجه المعالجة الثقافية الاطباق في حجم النهائي من 10 مل من dmem كامله لكل طبق. يجب ان تكون الخلايا حوالي 60% متموج بحلول وقت الانتقال.
- في اليوم التالي ، والخلايا transfect مع يمزج البلازميد علي النحو التالي:
ملاحظه: هذا الجزء من البروتوكول يصف إنتاج لينتيفيروسيس في 1 100 مم الانسجه المعالجة الثقافية الطبق في مزيج البلازميد. للحصول علي كميات اعلي من لينتيفيرال ماده طافي للتركيز ، واستخدام ما لا يقل عن 4 100 مم HEK293T الاطباق ثقافة الخلية لكل مزيج.- في أنبوب مخروطي 15 مل ، أضف 10 ميكروغرام من البلازميدات النقل الثلاثة معا: 3.33 ميكروغرام من pfuw-teto (addgene البلازميد #125028)14، 3.33 ميكروغرام من pfuw-teto GFI1B (addgene #125597) 14و 3.33 ميكروغرام من pfuw-teto-فوس (addgene #125598)14، بالاضافه إلى 10 ميكروغرام من الجيلالثاني psPAX2 ناقلات التعبئة والتغليف ترميز الكمامة، Pol، تات والجينات القس (Addgene #12260) و 5 ميكروغرام من ناقلات PMD2 المغلف ترميز الجينات vsv-G (addgene #12259). يضاف الماء إلى 500 μL.
- في اثنين جديده 15 مل أنابيب مخروطيه أضافه 10 ميكروغرام من M2rtTA بلازميد (Addgene #20342)17, 10 ميكروغرام من ناقلات التعبئة والتغليف psPAX2 و 5 ميكروغرام من ناقلات المغلفات pMD2 إلى كل أنبوب. يضاف الماء إلى 500 μL. أنبوب واحد سيستخدم كعنصر تحكم
- لكل أنبوب أضافه 62.5 μL من 2 M CaCl2. المقبل ، والإفراج عن فقاعات في كل خليط باستخدام ماصه pipet-x باستور ادراجها في وحده تحكم ماصه pipet-x. بينما فقاعات تتشكل ، ماصه 500 μL من n ، n-bis(2-هيدروكسي ايثيل) حمض -2-امينويثانسولفونيك (BES) المالحة المخزنة (PH 7.1 ، 25 درجه مئوية) ، مع ماصه P1000 ، قطره الحكمة ضد ماصه pipet-x باستور وعلي الخليط.
- احتضان الأنابيب في درجه حرارة الغرفة لمده 15 دقيقه علي الأقل. وسوف تظهر الخلائط غائم قليلا بعد بعض الوقت.
- وفي الوقت نفسه ، يستنشق المتوسطة من اطباق الخلية HEK293T (المرور في اليوم السابق) وأضافه 10 مل من DMEM كامله دون المضادات الحيوية. كن حذرا وأضافه المتوسطة ببطء كما HEK293T خلايا شبه ملتصقة.
- توزيع كل خليط الفردية (حوالي 1 مل) بالتساوي وقطره من الحكمة في اطباق منفصلة واحتضان بين عشيه وضحيها في 37 درجه مئوية ، 5 ٪ CO2.
- استبدال المتوسطة مع 4 مل من DMEM كامله ، 24 ساعة بعد الحضانة. احتضان بين عشيه وضحيها في 37 درجه مئوية ، 5 ٪ CO2. إذا كانت متاحه ، احتضان بدلا من ذلك في 32 درجه مئوية ، 5 ٪ CO2، وانخفاض درجه الحرارة سوف تزيد من نصف عمر جزيئات لينتيفيرال.
- جمع ماده طافي مع جزيئات لينتيفيرال ثلاث مرات إلى أنبوب مخروطي 50 mL. لا تخلط جزيئات لينتيفيرال مختلفه في هذه المرحلة. وسوف يؤدي كل طبق في 12 مل من supernatant لينتيفيرال. أربعه اطباق من نفس الاعداد الفيروسي يصلح في أنبوب مخروطي 1 50 mL.
تنبيه: قم باجراء مجموعه لينتيفيرال في مختبر من مستوي السلامة البيولوجية-2 في غطاء للتدفق الرقائقي مخصص للعمل اللينتيفيرال ووضع النفايات الملوثة الفيروسية (الأنابيب والنصائح والاطباق) في حاويه مناسبه للمواد البيولوجية الخطرة.- القيام بأول مجموعه 16 ح بعد حضانة الماضي وأضافه 4 مل من DMEM كامله. احتضان في 37 درجه مئوية ، 5 ٪ CO2.
- القيام المجموعة الثانية 8 ح بعد الأول إلى نفس الأنبوب ، أضافه 4 مل من DMEM كامله واحتضان في 37 درجه مئوية ، 5 ٪ CO2.
- القيام المجموعة الثالثة 16 ح بعد الثانية إلى نفس الأنبوب وتجاهل الاطباق.
ملاحظه: يخزن لينتيفيرال سوبرناتانتس عند درجه حرارة 4 درجات مئوية بعد كل مجموعه.
- تصفيه كل لينتيفيرال ماده طافي باستخدام فلتر ربط منخفض البروتين 0.45 μm مع غشاء خلات السليلوز (جدول المواد) إلى أنبوب نظيف.
- أضافه بحد اقصي 15 مل من ماده طافي تصفيتها إلى وحده تصفيه الطرد المركزي مع غشاء السليلوز المجددة (جدول المواد) وتدور في 4,000 x g لمده 25 دقيقه ، في 4 درجه مئوية. تجاهل التدفق من خلال. سيبقي سائل لزج يحتوي علي لينتيفيروسيس في وحده الفلتر.
- كرر الخطوة 3.13 عن طريق أضافه 15 مل من ماده طافي علي راس وحده فلتر ، حتى لا يكون هناك أكثر لينتيفيرال ماده طافي اليسار.
ملاحظه: عندما لا يكون هناك سوي عدد قليل من المليلتر من ماده طافي للتركيز ، وتقليل الوقت الغزل إلى 10 دقيقه. إذا كان لا يزال هناك سائل إضافي (غير لزج) علي فلتر ، الطرد المركزي لمده 10 دقيقه اضافيه. - جعل الارصفه (50 − 200 μl اعتمادا علي حجم ماده طافي الاولي) من كل نوع من اللينتيفيروسيس المركزة وتخزين في-80 درجه مئوية للتخزين علي المدى الطويل (1 − 2 سنوات) أو في 4 درجه مئوية للتخزين علي المدى القصير (1 − 2 أسابيع).
ملاحظه: ويمكن أيضا استخدام اللينتيفيروسيس المركزة أو غير المركزة الطازجة. لا أعاده تجميد وذوبان الجليد وهذا يؤدي إلى انخفاض titer.
4. أعاده برمجه الأرقاء
ملاحظه: استخدام HDFs مع عدد مرور من ثلاثه (P3) أو اعلي (حتى P10) لتنفيذ التجارب أعاده برمجه.
- معطف 100 mm الانسجه المعالجة الثقافية طبق مع 5 مل من 0.1 ٪ من الجيلاتين واحتضان في 37 درجه مئوية لمده 20 دقيقه. يستنشق الحل المتبقي الجيلاتين.
- أذابه الخلايا الليفية قارورة وصفيحه في الطبق المغلفة الجيلاتين 0.1 ٪. احتضان بين عشيه وضحيها في 37 درجه مئوية ، 5 ٪ CO2. إذا لزم الأمر ، قم بتوسيع الخلايا الليفية لفتره أطول من الزمن حتى يتم الوصول إلى الممر المطلوب والكونفلوينسي.
- معطف 6-حسنا الانسجه المعالجة الثقافة لوحه مع 500 μL من محلول الجيلاتين 0.1 ٪ واحتضان في 37 درجه مئوية لمده 20 دقيقه. أزاله الجيلاتين اضافيه.
- لوحه HDFs في كثافة 150,000 خلايا لكل لوحه (25,000 الخلايا في بئر) في 2 مل من DMEM كامله في بئر. احتضان بين عشيه وضحيها في 37 درجه مئوية ، 5 ٪ CO2، للسماح المرفقات الخلية.
- استبدال المتوسطة مع 2 مل من DMEM كامله زائد 8 ميكروغرام/مل polybrene. اعداد 1:1 مزيج نسبه من تجمع المنتجة TF لينتيفيروسيس و M2rtTA في أنبوب الطرد المركزي الجديد.
ملاحظه: في هذا البروتوكول ، يتم تنفيذ تجمع-إنتاج لينتيفيروسيس لثلاثه TFs ، والتي ، في ايدي الكتاب ، والنتائج في زيادة كفاءه أعاده برمجه. وبدلا من ذلك ، يقترح اجراء معايره للجسيمات اللينتيفيراله الفردية بواسطة qPCR18، علي خط خلوي قياسي. سيستخدم هذا لتحديد حجم الفيروسات الفردية اللازمة لمواجهه تعدد العدوى (وزاره الداخلية) الأمثل للتعاون وأعاده برمجه الأرقاء. - توزيع 10 إلى 100 μL من خليط لينتيفيرال لكل بئر ، لتحويل HDFs. هذا هو اليوم-2 من أعاده برمجه.
ملاحظه: يتطلب تحديد الحجم الأمثل لمزيج لينتيفيرال لأعاده البرمجة الفعالة ، دون المساس بسلامه الخلايا ، التحسين (راجع الشكل الإضافي 1 لمزيد من التفاصيل). HDFs مع أكثر من 7 الممرات قد تتطلب كميات أكبر من الفيروسات من الخلايا مع الممرات السفلي. - بعد 16 ساعة من الحضانة ، وأزاله الفيروسات وأضافه DMEM كامله. السماح للخلايا بالتعافي لمده 6 − 8 ساعات.
- بعد الانتعاش ، يستنشق المتوسطة وأضافه 2 مل من DMEM كامله مع 8 ميكروغرام/مل polybrene.
- القيام محول الثانية كما هو موضح في الخطوة 4.6 واحتضان في 37 درجه مئوية ، 5 ٪ CO2 لمده 16 ساعة. هذا هو اليوم-1 من أعاده برمجه. ويمكن اعداد مزيج لينتيفيرال في اليوم-2 لكل من المحولات والاحتفاظ بها في 4 درجه مئوية.
- في اليوم التالي, أزاله الفيروسات وأضافه DMEM كامله تستكمل مع 1 ميكروغرام/مل الاختزال. هذا هو اليوم 0 من أعاده برمجه. احتضان في 37 درجه مئوية ، 5 ٪ CO2 ل 48 h.
-
في اليوم 2 من أعاده برمجه ، وتقسيم كل بئر في نسبه 1:2.
- يستنشق المتوسطة ويغسل الخلايا مع 1 مل من تلفزيوني.
- الطامحين تلفزيونيا والخلايا انفصال مع 500 μL من حل التفكك. احتضان 5 − 10 دقيقه عند 37 درجه مئوية ، 5% CO2.
- انتنشيط حل التفكك مع 1 مل من DMEM كامله وجمع الخلايا في أنبوب مخروطي الشكل. الطرد المركزي في 350 x g لمده 5 دقائق.
- أعاده تعليق بيليه في المتوسطة التي تكون الدم (انظر الخطوة 1.3) ، تستكمل مع 1 ميكروغرام/مل الاختزال ، وخلايا لوحه في الانسجه الجديدة معالجه الثقافة 6-حسنا لوحات المغلفة مع 0.1 ٪ الجيلاتين إلى حجم النهائي من 2 مل لكل بئر.
- تغيير المتوسطة (المتوسطة للدم بالاضافه إلى دوكس) مرتين في الأسبوع لمده أعاده برمجه الثقافات (25 يوما).
- تحليل الخلايا الناتجة التي أعيد برمجتها في نقاط زمنيه مختلفه بواسطة المجهر الضوئي أو المجهري الفلوري (انظر الشكل التكميلي 2) ، وقياس التدفق الخلوي ، والجزء الأكبر والخلية الواحدة تسلسل RNA ، واختبارات الزرع لاكتساب التشكيل الغذائي للدم ، وجود علامات البطانة والدم ، والحصول علي البيانات الشخصية للتعبير الجيني البطانية/الدم والقدرة علي التجدد14.
5. الأمثل من الورم الليفي التوسع للتحليل المتسلسل رقاقه في بداية أعاده برمجه الأرقاء
- لوحه 300,000 HDFs (< P8) في 0.1 ٪ الجيلاتين المغلفة ثقافة الانسجه المعالجة 6-حسنا لوحات مع DMEM كامله لحجم النهائي من 2 مل لكل بئر. احتضان بين عشيه وضحيها في 37 درجه مئوية ، 5 ٪ CO2.
- في اليوم التالي, استبدال المتوسطة مع كامل DMEM تستكمل مع 8 ميكروغرام/مل polybrene.
- Transduce الخلايا مع العوامل الفردية: pFUW-tetO-فوس14، Plv-Teto (addgene #125599)14 و Pfuw-teto-GATA2 (addgene #125600)14 أو مع تجمع من العوامل الثلاثة ، بالاضافه إلى fuw-M2rtTA في 1:1 نسبه. استخدام 10 − 20 μL الفيروس الكلي (TF الفردية + M2rtTA أو ثلاثه TFs + M2rtTA). احتضان الخلايا بين عشيه وضحيها في 37 درجه مئوية ، 5 ٪ CO2.
ملاحظه: فمن المستحسن استخدام اثنا عشر لوحات 6-حسنا لكل حاله (لكل TF الفردية والثلاثة TFs مجتمعه). - أزاله لينتيفيروسيس وأضافه DMEM كامله 16 ح بعد المحول الأول. دع الخلايا تتعافي لمده 6 − 8 ساعات.
- Transduce الخلايا للمرة الثانية مع نفس الكمية من الفيروسات في حاله واحتضان في 37 درجه مئوية ، 5 ٪ CO2.
- في اليوم التالي أزاله الفيروسات وأضافه DMEM كامله. احتضان في 37 درجه مئوية ، 5 ٪ CO2 لمده 24 ساعة.
- أعاده لوحه كل بئر في 0.1 ٪ الجيلاتين المغلفة الانسجه المعالجة الثقافة 100 ملم طبق مع كامل DMEM إلى حجم النهائي من 10 مل لكل طبق. هذا يمثل تقريبا 1:6 ممر.
- السماح للخلايا تنمو لمده 6 أيام في 37 درجه مئوية ، 5 ٪ CO2.
- في اليوم 6 بعد أعاده الطلاء ، يستنشق المتوسطة وأضافه DMEM كامله مع 1 ميكروغرام/مل الاختزال. احتضان الخلايا في 37 درجه مئوية ، 5 ٪ CO2 لمده 2 أيام.
- جمع الخلايا الليفية وتحليل مواقع ربط الجينوم من ثلاثه TFs محوله بشكل فردي أو في تركيبه, بواسطة رقاقه-seq 2 أيام بعد مكملات الاكسده14.
ملاحظه: ستحتوي الاطباق النهائية التي 72 100 ملم علي ما بين 20 − 50 × 106 خلايا ، كافيه لاجراء تجارب الرقاقات المتسلسلة والنسخ المتماثلة.
النتائج
ويوضح الشكل 1(ا) التمثيل التخطيطي لنهج أعاده البرمجة باستخدام hdfs. يتم الحصول علي الخلايا الليفية من مصادر تجاريه أو جمعها من المتبرعين البشريين وتوسعت في المختبر السابق لأعاده برمجه. بعد الطلاء ، يتم توصيل الخلايا مرتين مع GATA2 ، GFI1B و FOS (و M2rtTA) لينتيفيروسيس ، ودوكسيسيكلين يضاف في اليوم 0 من أعاده برمجه. في اليوم الثاني ، يتم تقسيم الخلايا وطلاءها في وسط الدم حتى اليوم 25 من الثقافة. قد يتم إنشاء الخلايا المعاد برمجتها في نقاط زمنيه مختلفه للتطبيقات متعددة بما في ذلك زرع في الفئران المناعية ، خليه واحده الحمض الريبي النيبالي-تسلسل (scRNA-seq) من السكان الخلايا المنقية (اليوم 2 غير مفروزه ، اليوم 15CD49f + CD34 و اليوم 25CD49f +CD34 + الخلايا) ، فضلا عن تحليل المجهر والتدفق الخلوي لعلامات سطح الخلية CD49F ، CD34 ، CD9 و CD143. تظهر المؤامرات الخلوية التمثيلية ~ 17 ٪ من الخلايا المعاد برمجتها التعبير عن كل من CD49f و CD9 (الشكل 1ب ، لوحه اليسار) ، بعد 25 يوما من أعاده برمجه. الغالبية العظمي من الخلايا الايجابيه المزدوجة التعبير عن CD143 (~ 86 ٪) ، والسكان الصغيرة التعبير عن CD34 (0.9 ٪) ، مما يشير إلى الاستقراء مصير الأرقاء ديناميكية. لا يتم تنشيط هذه العلامات في M2rtTA محوله HDFs مثقف لمده 25 يوما (الشكل 1ب ، لوحه اليمين). الصور المناعية تؤكد التعبير عن CD9 و CD143 في الخلايا الملتصقة والمستديرة ، المتميزة شكليا عن الأورام الليفية السلبية لهذه العلامات (الشكل 1ج). مستعمرات الأرقاء الإنسان أيضا التعبير عن CD49f و CD3414. التحليل المتسلسل لل HDFs ، اليوم 2 الخلايا غير المفروزة ، والخلايا التي تمت أعاده برمجتها المنقية في اليوم 15 (CD49f +CD34) واليوم25 (CD49f +CD34 +) تظهر زيادة تدريجيه في الCD49f والCD9 والتعبير الCD143 من اليوم 2 إلى اليوم 25. CD49f و CD9 تظهر الخلايا الموجبة أولا اثناء عمليه أعاده البرمجة ، بين اليوم 2 و 15 ، مما يشير إلى ان هذه الجزيئات قد تمثل علامات لنشاه الأرقاء البشرية المبكرة. يبدا الكشف عن CD143 في اليوم 15 و CD34 التعبير عن الخلايا التي يتم الكشف عنها فقط في وقت لاحق النقاط (اليوم 25). CD34 + واستخدمت خلايا دم الحبل السري (ucb) كمرجع (الشكل 1د).
ويصف الشكل 2(ا ) بروتوكولا معدلا لتوليد عدد كاف من الخلايا للتحليل المتسلسل بالرقاقات في المراحل الاوليه لأعاده برمجه الأرقاء (اليوم 2). أولا ، يتم طلاء HDFs في كثافة مرتين اعلي من البروتوكول القياسي (300,000 خلايا مقابل 150,000 خلايا لكل لوحه). بعد التوصيل ، يتم أعاده طلاء كل بئر في صحن 100 مم يسمح للخلايا بالتمدد لمده 6 أيام قبل تكميل الوسط مع دوكس. يتم تحليل الخلايا 2 أيام بعد أضافه الاختزال وما يترتب علي ذلك TF التعبير. يظهر الشكل 2ب الملفات الشخصية لمتصفح الجينوم لGATA2 الملزمة للمناطق التنظيمية الجينية لITGA6 والاس عندما تكون الخلايا مشتركه مع العوامل الثلاثة (3tfs) أو GATA2 بشكل فردي. GATA2 أيضا يربط ان يفتح [كروماتين] مناطق من CD9 و CD34 مورثات14.
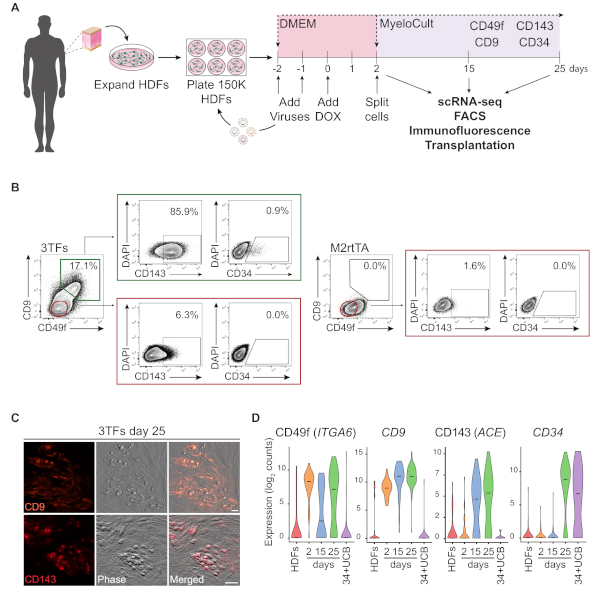
الشكل 1: استقراء مصير الأرقاء في الخلايا الليفية الجلدية البشرية. (ا) استراتيجية تجريبية لأعاده برمجه الاصبغه الدموية البشرية الليفية الجلدية (hdfs). يتم جمع الخلايا الليفية من الخزعات لكمه الجلد من الجهات المانحة ، وتوسيع ومحوله مع GATA2 ، GFI1B ، فوس و M2rtTA لينتيفيروسيس. يتم أضافه دوكسيسيكلين (دوكس) إلى الثقافة في اليوم 0 من أعاده برمجه ويتم تحليل الخلايا في عده نقاط زمنيه حتى اليوم 25. [سكرنا-تلي], خليه وحيد [رنا]-تسلسل. FACS ، الفرز الخلية المنشطة الفلورية. (ب) استراتيجية الصب المستخدمة لتقييم التعبير عن علامات الاصبغه الدموية/التي تكون الدم عن طريق قياس التدفق الخلوي في اليوم 25 بعد التوصيل بعوامل النسخ الثلاثة (3tfs). المؤامرات الخلوية تظهر النسبة المئوية للخلايا الايجابيه المزدوجة لCD49f و CD9 ، بوابات في السكان الخلية الحية (DAPI-سلبي). ضمن السكان ايجابيه مزدوجة ، يتم عرض التعبير عن CD143 و CD34. يتم استخدام HDFs فقط مع فيروس M2rtTA تحت نفس الظروف الثقافية كعنصر تحكم. (ج) الصور المناعية لمستعمرات اليوم 25 المعاد برمجتها والتي تؤكد التعبير عن CD9 (اللوحة العليا) و CD143 (اللوحة السفلي). كانت ملطخه الخلايا مع الأجسامالمضادة (جدول المواد) المخفف 1:100 في المكتب التلفزيوني/2 ٪ مع مصل الفار ، حضن 20 دقيقه في 37 درجه مئوية ، 5 ٪ CO2، غسلها ثلاث مرات والذين يعانون من الإيدز في الاذاعه التلفزيونية/2 ٪. المرحلة ، المرحلة الانحدار التباين. قضبان المقياس = 50 μm. (د) التحليل المتسلسل للخلايا التي تبلغ 253 خليه في نقاط زمنيه مختلفه. يتم تنشيط التعبير عن الITGA6 والCD9 والاس والCD34 اثناء أعاده البرمجة. يتم جمع الخلايا في اليوم الثاني (غير مفروز) ، اليوم 15 (CD49f +CD34) واليوم25 (CD49f +CD34 +). يتم استخدام الخلايا HDFs وCD34 + دم الحبل السري (34 + ucb) كمراجع. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
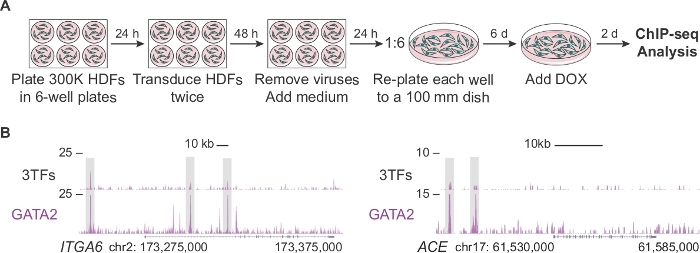
الشكل 2: توسيع الخلايا الليفية الجلدية البشرية لتحليل الرقاقات المتسلسلة. (ا) استراتيجية تجريبية تصور بروتوكولا معدلا لتوليد اعداد كبيره من الخلايا الليفية البشرية المحولة للجلد (hdfs) لرقاقه المتسلسلة في اليوم 2 من أعاده البرمجة. 300,000 يتم طلاء الخلايا في 6-حسنا لوحات ومحوله مرتين مع العوامل الفردية (pFUW-تيالي-فوس ، pLV-TETO أو pFUW--GATA2--3xFLAG) أو مزيج من العوامل الثلاثة (زائد M2rtTA). بعد أزاله الفيروسات ، يتم توسيع الخلايا الليفية لمده سته أيام في 100 مم الاطباق. يتم أضافه دوكسيسيكلين (دوكس) في اليوم 0 ويتم جمع الخلايا بعد يومين من أضافه الاختزال. (ب) ملامح متصفح الجينوم تسليط الضوء علي مواقع GATA2 (صناديق رمادية) في ITGA6 و ACE مكاني بعد يومين من المحول مع عوامل النسخ الثلاثة (3tfs) أو مع GATA2 وحدها. يتم تمثيل العدد الإجمالي للقراءة المعينة علي المحور ص. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
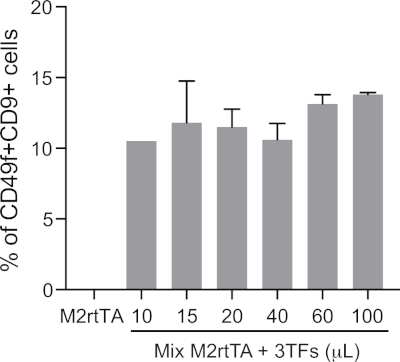
الشكل التكميلي 1: تحديد حجم لينتيفيرال محسن لأعاده برمجه الأرقاء بكفاءة. وتستخدم كميات متزايدة من الجزيئات اللينتيفيراله المركزة (10 إلى 100 μL) (3TFs: GATA2, GFI1B و FOS) لنقل الخلايا الليفية الجلدية البشرية (HDFs) ، بالاضافه إلى M2rtTA بنسبه 1:1 ، بعد الخطوات 4.5 − 4-12 من البروتوكول. يتم تحليل الخلايا المعاد برمجتها في اليوم 25 لتحديد حجم الأمثل لمحوله لأعاده برمجه الأرقاء ، نظرا لنسبهCD49f +CD9 + الخلايا بوابات في الخلايا الحية (dapi-سلبي). ويمكن تقييم سلامه الخلايا عن طريق تحديد العدد المطلق للخلايا الحية في اليوم 25. يتم استخدام HDFs محوله مع M2rtTA (100 μL) كعنصر تحكم سالب. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.

الشكل التكميلي 2: التغيرات المورفولوجية اثناء أعاده برمجه الخلايا الليفية الجلدية البشرية. الإنسان الخلايا الليفية الجلدية (HDF) الثقافات التي يتم تصويرها في اليوم من المحول الأول (يوم-2) ، عندما يتم أضافه دوكس إلى الثقافات (يوم 0) ، يومين (اليوم 2) وخمسه عشر يوما (اليوم 15) بعد مكملات الاكسده ، وعند نقطه نهاية التجربة (اليوم 25). ويسلط الضوء علي مستعمرات الأرقاء في الأيام 15 و 25. قضبان المقياس = 100 μm. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
في هذه المقالة ، يتم وصف أسلوب لتوليد خلايا السلف التي تكون الدم مباشره من الورم الليفي البشري ، والتي تذهب من خلال خليه HP المتوسطة ، المثل لنهائي HSCs14.
بركه-إنتاج الجزيئات لينتيفيرال ترميز GATA2 ، GFI1B و FOS كان يفضل علي الإنتاج الفردي ، لأنه في ايدينا انه يؤدي إلى زيادة كفاءه أعاده برمجه (البيانات غير المنشورة). لينتيفيروسيس, كاعضاء من ال [ رتروفيريد ] أسره, عاده احتويت اثنان نسخ من ايجابيه [ان-رفرد] [رنا]19. قد تكون زيادة كفاءه أعاده برمجه بسبب التعبئة والتغليف من اثنين من الجينات المختلفة في نفس الجسيمات لينتيفيرال ، مما ادي إلى زيادة عدد الخلايا المشتركة محوله مع عوامل النسخ الثلاثة. لضمان نجاح هذا البروتوكول ، فمن الضروري ان transduce مع كميه كافيه من الفيروس اعتمادا علي مرور الخلية للحصول علي التوازن الأمثل بين أعاده برمجه الكفاءة وسلامه الخلية ، علي النحو الموصي به في الخطوة 4.6. وعلاوة علي ذلك ، يمكن استخدام الفيروسات الطازجة غير المركزة. فمن المستحسن ان transduce الخلايا مع 0.5-3 مل من تجمع 3TFs و M2rtTA. أيضا ، يجب تعديل كثافة الخلايا وفقا للتطبيق. 150 000 HDFs لكل لوحه 6-بئر (الخطوة 4.4) توفير الكثافة المثلي لأداء FACS ، وزرع وتحليل تدفق الخلايا الخلوية للخلايا المعاد برمجتها. بالنسبة لتجارب الرقاقات المتسلسلة ، كانت هناك حاجه إلى المزيد من الخلايا من البداية (الخطوة 5.1). من المهم التحقق من الخلايا بانتظام للتغييرات المورفولوجية واستبدال المتوسطة التي تكون الدم مرتين في الأسبوع لدعم ظهور الخلايا التي يسببها الدم. أضافه السايتوكينات التي تكون الدم أو الثقافة المشتركة في طبقات التغذية قد تزيد من كفاءه أعاده برمجه.
مع هذه الطريقة ، يمكننا تحديد علامات جديده للدم التي يتم التعبير عنها بشكل حيوي اثناء أعاده برمجه الأرقاء. ويعبر عن CD9 ، الذي ثبت انه منظم في الخلايا المعاد برمجتها في المستوي العابر14، بسرعة علي سطح الخلية في المراحل الاوليه لأعاده البرمجة مع CD49F و CD143 ، بمثابه علامة جديده لسلائف HSC الإنسان. ونحن نظهر أيضا ان ITGA6 والاس هي الأهداف المباشرة لGATA2 خلال المراحل الاوليه من أعاده برمجه الأرقاء ، بالاضافه إلى CD9 و CD3414، وتوفير صله ميكانيكيه مباشره بين الأرقاء الإنسان النمط الظاهري السلائف و GATA2.
ميزه واحده من هذا النظام تكمن في استخدام ثقافات الخلايا الليفية متجانسة نسبيا. في حين يتم توسيع pscs بسهوله والحفاظ عليها في المختبر, بروتوكولات التمايز توليد السكان غير المتجانسة التي تشمل السلف التي تكون الدم, التي الطعم سيئه5,6,7. وعلاوة علي ذلك ، هناك خطر الاصابه بالأورام عند زرع HSPCs المشتقة من PSC ، لان PSCs غير المتمايزة قد لا تزال في الثقافة حتى بعد استخدام بروتوكولات التمايز. بدلا من ذلك إلى الخلايا الليفية ، وقد تم تطبيق أعاده البرمجة المباشرة إلى HSCs إلى الدم الملتزمين الأسلاف20 والخلية البطانية21. ومع ذلك ، بدءا من خلايا السلف المقيدة بالدم يعوق التطبيق العلاجي لل hscs الناتجة إذا كان المريض يحمل الطفرات التي تؤثر علي الجذعية/سلف السكان الذين تكون الدمه22. في حاله الخلايا البطانية ، وهذه هي أكثر صعوبة في الحصول علي مقارنه الليفية ، وتشكل الخلايا غير المتجانسة للغاية من حيث النمط الظاهري ، وظيفة وهيكل ، والتي تعتمد علي الجهاز23. وقد نجحت الدراسات الأخرى في أعاده برمجه الخلايا الليفية الماوس إلى أسلاف الدم الغذائية24,25 حتى الآن, حتى الآن, لا يوجد بروتوكول آخر يصف جيل من hspc مثل الخلية من الانسجه الليفية البشرية.
هذا النهج ، إلى جانب تثبيط الدوائية ، والجينات الخروج ، أو إسقاط التصاريح لتحديد الفرد أو مجموعه من العوامل المطلوبة للحث مباشره HSCs الإنسان. توظيف منهجيات الفحص عاليه الكفاءة استنادا إلى الاخيره تقنيات CRISPR-كاس 9 في HDFs قبل أعاده برمجه ، ويمثل مسعى مثيره لتعريف منظمي الرواية من الإنسان نهائي الدم. في المستقبل ، وأعاده برمجه أنواع الخلايا البشرية غير المرتبطة بالدم مثل الخلايا الليفية ستكون بمثابه منصة لتوليد صحية المريض المعدة للخلايا السلف الدم للتطبيقات السريرية.
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
ويعترف بالدعم المالي السخي لمؤسسه كنوت واليس فالينبرغ ، وكليه الطب في جامعه لوند ومنطقه سكاين. وكان هذا العمل مدعوما بمنحه من يول انجكفيستس ستيفتيلسي (194-0694 إلى فيليبي بيريرا) ومنح دراسية للدكتوراه من Fundação الفقرة a Ciência e Tecnologia (PTDC/BIM-MED/0075/2014 إلى فيليبي بيريرا ، و SFRH/BD/135725/2018 و SFRH/BD/51968/2012 إلى ريتا ألفيس و اندرييا غوميز). وقد دعمت هذه الدراسة أيضا بأموال من المعاهد القومية للصحة ونظام NYSTEM (1R01HL119404 و C32597GG إلى Kateri A. مور).
Materials
| Name | Company | Catalog Number | Comments |
| 0.45 μm low-protein binding filter, 150 mL Bottle Top Vacuum Filter | Corning | #430625 | |
| 2-Mercaptoethanol | Sigma-Aldrich | #M6250 | |
| Alexa Fluor 488 anti-human CD34 clone 581 | BioLegend | #343518 | |
| BD Pharmingen APC Mouse Anti-Human Angiotensin Converting Enzyme (CD143) clone BB9 | BD Biosciences | #557929 | |
| BES buffered saline | Sigma-Aldrich | #14280 | |
| Calcium chloride (CaCl2) | Sigma-Aldrich | #449709 | |
| Centrifugal filter unit, Amicon Ultra-15 Centrifugal Filter Unit | Sigma-Aldrich | #UFC903096 | |
| Dissociation solution, TrypLE Express Enzyme (1x) no phenol red | Gibco | #12604-021 | |
| Doxycycline hyclate (DOX) | Sigma-Aldrich | #D9891 | |
| eBioscience CD49f (Integrin alpha 6) Monoclonal Antibody (eBioGoH3 (GoH3)), PE-Cyanine7 | Invitrogen | #25-0495-82 | |
| FUW-M2rtTA | Addgene | #20342 | |
| Gelatin from Porcine Skin Type A | Sigma-Aldrich | #G1890 | |
| Gibco L-Glutamine (200 mM) | ThermoFisher Scientific | #25030-024 | |
| Gibco MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | #11140-035 | |
| Hematopoietic medium, MyeloCult H5100 | STEMCELL Technologies | #05150 | |
| Hexadimethrine bromide (polybrene) | Sigma-Aldrich | #H9268 | |
| Human Dermal Fibroblasts (HDFs) | ScienCell | #2320 | |
| HyClone Dulbecco's Modified Eagles Medium (DMEM) | GE Healthcare | #SH30243.01 | |
| HyClone Fetal Bovine Serum (FBS) | GE Healthcare | #SV30160.03 | |
| HyClone Penicillin Streptomycin 100x Solution (Pen/Strep) | GE Healthcare | #SV30010 | |
| HyClone Phosphate Buffered Saline solution (PBS) | GE Healthcare | #SH30256.01 | |
| Hydrocortisone | STEMCELL Technologies | #7904 | |
| Mouse serum | Sigma-Aldrich | #M5905 | |
| PE anti-human CD9 Antibody clone HI9a | BioLegend | #312105 | |
| pFUW-tetO-3xFLAG-GATA2 | Addgene | #125600 | |
| pFUW-tetO-FOS | Addgene | #125598 | |
| pFUW-tetO-GATA2 | Addgene | #125028 | |
| pFUW-tetO-GFI1B | Addgene | #125597 | |
| pLV-tetO-HA-GFI1B | Addgene | #125599 | |
| pMD2.G | Addgene | #12259 | |
| psPAX2 | Addgene | #12260 |
References
- Ivanovs, A., et al. Highly potent human hematopoietic stem cells first emerge in the intraembryonic aorta-gonad-mesonephros region. Journal of Experimental Medicine. 208, 2417-2427 (2011).
- Tavian, M., Biasch, K., Sinka, L., Vallet, J., Péault, B. Embryonic origin of human hematopoiesis. International Journal of Developmental Biology. 1065, 1061-1065 (2010).
- Medvinsky, A., Rybtsov, S., Taoudi, S. Embryonic origin of the adult hematopoietic system: advances and questions. Development. 138, 1017-1031 (2011).
- Ivanovs, A., et al. Human haematopoietic stem cell development: from the embryo to the dish. Development. 144, 2323-2337 (2017).
- Daniel, M. G., Pereira, C. F., Lemischka, I. R., Moore, K. A. Making a Hematopoietic Stem Cell. Trends in Cell Biology. 26, 202-214 (2016).
- Vo, L., Daley, G. De novo generation of HSCs from somatic and pluripotent stem cell sources. Blood. 125, 2641-2648 (2015).
- Rafii, S., et al. Human ESC-derived hemogenic endothelial cells undergo distinct waves of endothelial to hematopoietic transition. Blood. 121, 770-781 (2013).
- Ebina, W., Rossi, D. J. Transcription factor-mediated reprogramming toward hematopoietic stem cells. EMBO Journal. 34, 694-709 (2015).
- Sugimura, R., et al. Haematopoietic stem and progenitor cells from human pluripotent stem cells. Nature. 545, 432-438 (2017).
- Pereira, C. F., et al. Induction of a Hemogenic Program in Mouse Fibroblasts. Cell Stem Cell. 13, 205-218 (2013).
- Pereira, C. F., et al. Hematopoietic Reprogramming In vitro Informs In Vivo Identification of Hemogenic Precursors to Definitive Hematopoietic Stem Cells. Developmental Cell. 36, 525-539 (2016).
- Notta, F., et al. Isolation of Single Human Hematopoietic Stem Cells Capable of Long-Term Multilineage Engraftment. Science. 333, 218-221 (2011).
- Sinka, L., Biasch, K., Khazaal, I., Péault, B., Tavian, M. Angiotensin-converting enzyme (CD143) specifies emerging lympho-hematopoietic progenitors in the human embryo. Blood. 119, 3712-3724 (2012).
- Gomes, A. M., et al. Cooperative Transcription Factor Induction Mediates Hemogenic Reprogramming. Cell Reports. 25, 2821-2835 (2018).
- Karlsson, G., et al. Report The Tetraspanin CD9 Affords High-Purity Capture of All Murine Hematopoietic Stem Cells. Cell Reports. 4, 642-648 (2013).
- Leung, K. T., et al. The tetraspanin CD9 regulates migration, adhesion, and homing of human cord blood CD34+ hematopoietic stem and progenitor cells. Blood. 117, 1840-1851 (2011).
- Hockemeyer, D., et al. A drug-inducible system for direct reprogramming of human somatic cells to pluripotency. Cell Stem Cell. 3, 346-353 (2008).
- Kutner, R. H., Zhang, X., Reiser, J. Production concentration and titration of pseudotyped HIV-1-based lentiviral vectors. Nature Protocols. 4, 495-505 (2009).
- Suzuki, Y. S., Suzuki, Y., Ke, X. Gene Regulatable Lentiviral Vector System. Viral Gene Therapy. , (2011).
- Riddell, J., et al. Reprogramming committed murine blood cells to induced hematopoietic stem cells with defined factors. Cell. 157, 549-564 (2014).
- Lis, R., et al. Conversion of adult endothelium to immunocompetent haematopoietic stem cells. Nature. 545, 439-445 (2017).
- Pereira, C., Lemischka, I. R., Moore, K. From blood to blood’: de-differentiation of hematopoietic progenitors to stem cells. EMBO Journal. 33, 1511-1513 (2014).
- Nolan, D. J., et al. Molecular Signatures of Tissue-Specific Microvascular Endothelial Cell Heterogeneity in Organ Maintenance and Regeneration. Developmental Cell. 26, 204-219 (2013).
- Batta, K., Florkowska, M., Kouskoff, V., Lacaud, G. Direct Reprogramming of Murine Fibroblasts to Hematopoietic Progenitor Cells. Cell Reports. 9, 1871 (2014).
- Cheng, H., et al. Reprogramming mouse fibroblasts into engraftable myeloerythroid and lymphoid progenitors. Nature Communications. 7, 1-15 (2016).
Erratum
Formal Correction: Erratum: Hemogenic Reprogramming of Human Fibroblasts by Enforced Expression of Transcription Factors
Posted by JoVE Editors on 12/03/2019. Citeable Link.
An erratum was issued for: Hemogenic Reprogramming of Human Fibroblasts by Enforced Expression of Transcription Factors. The author affiliations were updated.
The second author affiliation was updated from:
2Wallenberg Center for Molecular, Lund University
to:
2Wallenberg Center for Molecular Medicine, Lund University
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved