Method Article
Reprogramación hemogénica de fibroblastos humanos por expresión forzada de factores de transcripción
En este artículo
Erratum Notice
Resumen
Este protocolo demuestra la inducción de un programa hemogénico en fibroblastos dérmicos humanos mediante la expresión forzada de los factores de transcripción GATA2, GFI1B y FOS para generar células hematopoyéticas madre y progenitoras.
Resumen
Los mecanismos celulares y moleculares subyacentes a la especificación de las células madre hematopoyéticas humanas (HSC) siguen siendo esquivas. Se requieren estrategias para recapitular la aparición humana de HSC in vitro para superar las limitaciones en el estudio de este complejo proceso de desarrollo. Aquí, describimos un protocolo para generar tallo hematopoyético y células similares a progenitoras a partir de fibroblastos dérmicos humanos que emplean un enfoque de reprogramación celular directa. Estas células transitan a través de un tipo de célula intermedia hemogénica, que se asemeja a la transición endotelial a hematopoyética (EHT) característica de la especificación HSC. Los fibroblastos fueron reprogramados a células hemogénicas a través de la transducción con factores de transcripción GATA2, GFI1B y FOS. Esta combinación de tres factores indujo cambios morfológicos, expresión de marcadores hemogénicos y hematopoyéticos y programas transcripcionales dinámicos de EHT. Las células reprogramadas generan progenie hematopoyética y repoblan ratones inmunodeficientes durante tres meses. Este protocolo se puede adaptar a la disección mecanicista del proceso de EHT humano como se ejemplifica aquí mediante la definición de objetivos DE GATA2 durante las primeras fases de la reprogramación. Por lo tanto, la reprogramación hemogénica humana proporciona un enfoque simple y manejable para identificar nuevos marcadores y reguladores de la aparición humana de HSC. En el futuro, la inducción fiel del destino hemogénico en fibroblastos puede conducir a la generación de HSC específicos del paciente para trasplante.
Introducción
Células hematopoyéticas definitivas de tallo y progenitoras (HSPC) emergen en la región aorta-gonad-mesonephros (AGM) y placenta de precursores endoteliales con capacidad hemogénica, a través de una transición endotelial a hematopoyética (EHT)1, 2. Los precursores hemogénicos (HP) expresan marcadores endoteliales y hematopoyéticos, pero su identificación precisa sigue siendo esquiva, particularmente en el sistema humano. A pesar de ser un proceso relativamente conservado en mamíferos, el desarrollo de células madre hematopoyéticas (HSC) todavía difiere significativamente entre los seres humanos y los modelos de ratón3,4. Por lo tanto, se necesitan enfoques in vitro para recapitular el desarrollo humano de HSC.
La diferenciación de las células madre pluripotentes (PSC) a las HSC, aunque prometedora, ha alcanzado un éxito limitado en los últimos 20 años, principalmente debido a los protocolos de diferenciación disponibles, que dan lugar a progenitores hematopoyéticos primitivos con un injerto deficiente capacidad5,6,7. Alternativamente, se han aplicado metodologías de reprogramación directa de celdas para generar células similares a HSPC a partir de varios tipos de celdas, utilizando factores de transcripción (TF)8,9. En particular, la sobreexpresión de tres TF, Gata2, Gfi1b y cFos, convirtió fibroblastos embrionarios de ratón en HSCCP a través de un intermedio de HP con un fenotipo definido (Prom1+Sca-1+CD34+CD45-)10. Este proceso se asemejaba a la EHT que se produce en el embrión y la placenta, durante la especificación de la hematopoyesis definitiva. Este fenotipo permitió la identificación y aislamiento de una población de HP en la placenta del ratón que después del cultivo a corto plazo y la activación de notch generaron HSCs trasplantables en serie11.
Hasta ahora, no se ha establecido ningún fenotipo que distinga los HSC humanos de sus precursores, pero se sabe que algunas moléculas se expresan en los HSC emergentes. células en el compartimiento12del HSC, y la enzima de conversión de angiotensina (ACE o CD143) está presente en los precursores hematopoyéticos negativos CD34 en los tejidos embrionarios que forman sangre13.
Recientemente, hemos demostrado que las versiones humanas de los tres TF, GATA2, FOS y GFI1B reprograman fibroblastos dérmicos humanos (HDF) en HP con capacidad de injerto a corto plazo14. En las fases iniciales de reprogramación, GATA2 activa la cromatina abierta y recluta a GFI1B y FOS para reprimir los genes fibroblastos y activar genes endoteliales y hematopoyéticos. Células inducidas altamente expresadas CD49f y ACE, y contenían un pequeño porcentaje de células que expresaban el marcador HSPC CD34. El gen CD9, que se expresa en los HSC15 y es importante para la cesión16,se demostró que era un objetivo directo de GATA2 y entre los genes más regulados en las células reprogramadas14. Por lo tanto, CD9 puede constituir un marcador adicional para los HP de hematopoyesis definitiva humana.
En este protocolo, describimos la generación de células similares a HSPC a partir de fibroblastos humanos a través de la expresión forzada de GATA2, GFI1B y FOS, así como un método adaptado para el análisis de secuenciación de inmunoprecipitación de cromatina (ChIP) (seq) Reprogramación. Los TF se codificaron en un vector lentiviral inducible por doxiciclina (DOX) (pFUW-tetO) que contiene un elemento de respuesta a la tetraciclina (TRE) y un promotor mínimo de CMV, y fueron transducidos junto con un vector constitutivo que contiene la tetraciclina inversa transactivador (pFUW-M2rtTA). Cuando DOX (análogo de la tetraciclina) se añade después de la transducción, se une a la proteína rtTA que interactúa con el TRE permitiendo la transcripción TF (sistema Tet-On). El procedimiento requiere 25 días para completarse. Para los experimentos ChIP-seq, los HDF fueron transducidos con versiones etiquetadas de GATA2 (pFUW-tetO-3xFLAG-GATA2) y GFI1B (pLV-tetO-HA-GFI1B), además de pFUW-tetO-FOS y sitios de enlace TF se analizaron dos días después de la suplementación con DOX.
En última instancia, la reprogramación hemogénica de fibroblastos humanos proporciona un sistema manejable in vitro para estudiar los mecanismos subyacentes a la hematopoyesis del desarrollo humano y una fuente potencial de HSCCP específicos del paciente para su aplicación clínica futura.
Protocolo
Este protocolo se realizó de acuerdo con las directrices del comité de ética de investigación humana de la Universidad de Lund y debe hacerse de acuerdo con las directrices institucionales individuales.
1. Preparación de reactivos
- Para el suero bovino fetal (FBS) de Eagle modificado de Dulbecco, mezcle el DMEM de alta glucosa que contiene piruvato sódico con 20% de FBS, 1% penicilina-estreptomicina (penitrina/estreptocina), 1% L-glutamina, 1% aminoácidos no esenciales y 10-4-M 2- Mercaptoetanol.
- Para DMEM completo, mezcle DMEM de alta glucosa que contenga piruvato sódico con 10% FBS, 1% Pluma/estreptococo y 1% L-glutamina.
- Para medio hematopoyético, mezcle el medio hematopoyético(Tabla de Materiales)con hidrocortisona de 10-6 M y 1% pluma/estreptococo.
- Utilice solución salina con fosfato (PBS) sin calcio ni magnesio.
2. Aislamiento de Fibroblastos Dermal Humano
NOTA: Los HDF se pueden comprar a proveedores certificados(Tabla de Materiales). En ese caso, expanda los fibroblastos y utilícelos directamente en experimentos de reprogramación (sección 4). Alternativamente, los HDF pueden aislarse de los donantes. Si los fibroblastos están aislados de diferentes donantes, mantenga las muestras separadas entre sí en todos los pasos del protocolo. Etiquetar placas/pozos y tubos de recogida con el número de identificación de cada donante.
- Obtener HDFs a partir de biopsias redondas de punzonado de la piel de 3 mm realizadas por médicos calificados.
- Recubrir tres pocillos de una placa de 6 pocillos tratada con cultivo tisular con 500 ml de gelatina al 0,1% e incubar durante 20 min a 37 oC.
- Aspirar la solución de gelatina restante y añadir 750 s l de DMEM/20% FBS a cada poca. Toda la superficie del pozo debe estar cubierta con medio.
- Añadir 1,5 ml de DMEM/20% FBS a la superficie interior de una tapa estéril de 100 mm petri para plato y esparcir la gota con la ayuda de una pipeta serológica de 5 ml.
- Coloque la biopsia de piel en el medio de la tapa con fórceps esterilizados.
- Diseccionar la biopsia de piel en nueve secciones idénticas, usando un bisturí esterilizado para mantener la biopsia en su lugar y un segundo bisturí para cortar.
- Coloque tres piezas de biopsia por pozo usando fórceps puntiagudos. Asegúrese de que las piezas se adhieren a la parte inferior del pozo.
- Poner un cubreobjetos de 22 mm en la parte superior de las piezas y aplicar un poco de presión.
- Incubar la placa a 37oC, 5% CO2,durante una semana. Compruebe las celdas diariamente y agregue 200 s de DMEM/20% FBS cada 2 días para reemplazar el medio evaporado.
- Después de una semana, agregue hasta 2 ml de DMEM/20% FBS y reemplace el medio cada 2 x 3 días.
-
Pasar las celdas en proporción 1:4 cuando los pozos son confluentes (alrededor de 4-8 semanas).
- Preparar 0.1% gelatina recubierta de tejido tratado con 6 placas de 6 pocillos.
- Aspirar el medio de los pozos al 80% de confluencia y lavar una vez con 1 ml de PBS.
- Retire el cubreobjetos con fórceps estériles y coloque el cubreobjetos en un nuevo pozo de una placa de 6 pocillos, con el lado del tejido hacia arriba.
NOTA: También se cosecharán las células que permanecieron unidas al cubreobjetos. - Añadir 500 l de solución de disociación(Tabla de materiales)por pozo (incluidos los pozos con los labios de las cubiertas) e incubar a 37 oC, 5% deCO2 durante 5-10 min. Compruebe cuándo las células comienzan a subir desde la parte inferior del pozo e inactivar la solución de disociación añadiendo 500 sl de DMEM/20% FBS a cada poca.
- Recoger los fibroblastos de todos los pozos en un tubo cónico de 15 ml. Agregue un medio adicional a los pozos para recoger las celdas restantes. Centrifugar el tubo a 350 x g durante 5 min.
- Mientras tanto, añada 500 ml de DMEM/20% FBS a cada pozo de placas recubiertas previamente de gelatina.
- Aspirar medio y resuspender fibroblastos en 6 mL de DMEM/20% FBS.
- Añadir 500 l de suspensión de fibroblastos a cada pocal (dos placas de 6 pocillos por muestra/donante en total). Incubar células durante la noche a 37oC, 5%CO2.
- Al día siguiente, agregue 1 mL de DMEM/20% FBS a cada pocto. Reemplace el medio por 2 ml de DMEM/20% FBS cada 2 a 3 días hasta que los pozos sean confluentes al 80%.
- Repita la sección 2.11 para tres pozos de confluentes hasta que se alcance el tercer pasaje.
-
Congele los fibroblastos de los pozos confluentes (pasajes 1 y 3).
- Aspirar el medio de los pozos y lavar una vez con 1 mL de PBS.
- Disociar y recoger fibroblastos como se describe en los pasos 2.11.4 y 2.11.5.
- Cuente las células con un hemocitómetro y centrifugar el tubo a 350 x g durante 5 min.
- Después de la centrifugación, aspirar medio y resuspender fibroblastos en FBS con 10% DMSO a una densidad de 5 x 105 células/ml.
- Añadir 1 ml de la suspensión celular por criovial y congelar las células durante la noche a -80 oC utilizando un recipiente de congelación. Mover los viales a -150 oC (nitrógeno líquido) para su almacenamiento a largo plazo.
3. Producción Lentiviral
- Cultivar células HEK293T en un plato tratado con cultivo tisular de 100 mm con 10 ml de DMEM completo, a 37 oC, 5% CO2,hasta que se alcance la confluencia.
- El día anterior a la transfección, aspirar el medio y lavar el plato cuidadosamente con 5 ml de PBS.
- Después de retirar el PBS, añadir 1,5 ml de solución de disociación e incubar a 37 oC, 5%CO2 durante 5 x 10 min para disociar las células del plato.
NOTA: Se recomienda calentar tanto el PBS como la solución de disociación antes de usar, para que las células no sufran un choque térmico. - Inactivar la solución de disociación con 3 ml de DMEM completo y transferir la suspensión celular a un tubo cónico de 15 ml. Lave el plato con 5 ml de DMEM completo para eliminar las células adheridas restantes y transferir este volumen al tubo cónico de 15 ml.
- Suspensión de celda de centrífuga a 350 x g durante 5 min.
- Aspirar sobrenadante y dividir el pellet celular uniformemente entre seis platos tratados con cultivo de tejido de 100 mm en un volumen final de 10 ml de DMEM completo por plato. Las células deben ser aproximadamente 60% confluentes en el momento de la transfección.
- Al día siguiente, las células transfect con el plásmido se mezclan de la siguiente manera:
NOTA: Esta parte del protocolo describe la producción de lentivirus en un plato tratado con cultivo tisular de 100 mm por mezcla de plásmido. Para obtener mayores volúmenes de sobrenadante lentiviral para la concentración, utilice al menos cuatro platos de cultivo celular HEK293T de 100 mm por mezcla.- En un tubo cónico de 15 ml, añadir 10 g de los tres plásmidos de transferencia juntos: 3,33 g de pFUW-tetO-GATA2 (#125028 de Plásmido de Addgene)14, 3,33 g de pFUW-tetO-GFI1B (Addgene #125597)14 y 3,33 g de pFUW-tetO-FOS (Addgene #125598)14 10 g de la2a generación de vectores de embalaje psPAX2 que codifican los genes Gag, Pol, Tat y Rev (Addgene #12260) y 5 g de vector de envolvente pMD2.G que codifica el gen VSV-G (Addgene #12259). Agregue agua de hasta 500 s.
- En dos nuevos tubos cónicos de 15 ml añaden 10 g de plásmido FUW-M2rtTA (Addgene #20342)17, 10 g de vector de embalaje psPAX2 y 5 g de vector de envolvente pMD2.G a cada tubo. Agregue agua de hasta 500 s. Un tubo va a ser utilizado como un control.
- A cada tubo añadir 62,5 ml de 2 M CaCl2. A continuación, suelte las burbujas en cada mezcla utilizando un pipeta Pasteur insertado en un controlador de pipetas. Mientras se forman burbujas, pipeta 500 l de N,N-bis(2-hidroxietilo)-2-ácido aminoetanosulfónico (BES) salina tamponada (pH 7.1, 25 oC), con una pipeta P1000, gota contra el pipeta Pasteur y sobre la mezcla.
- Incubar tubos a temperatura ambiente durante al menos 15 min. Las mezclas aparecerán ligeramente turbias después de algún tiempo.
- Mientras tanto, aspirar el medio de los platos celulares HEK293T (pasado el día anterior) y añadir 10 ml de DMEM completo sin antibióticos. Tenga cuidado y agregue el medio lentamente ya que las células HEK293T son semiadherentes.
- Distribuir cada mezcla individual (aproximadamente 1 ml) uniformemente y en la gota en platos separados e incubar durante la noche a 37 oC, 5% CO2.
- Reemplace el medio por 4 ml de DMEM completo, 24 h después de la incubación. Incubar durante la noche a 37oC, 5% CO2. Si está disponible, incubar en su lugar a 32 oC, 5% CO2, ya que la temperatura reducida aumentará la vida media de las partículas lentivirales.
- Recoger el sobrenadante con partículas lentivirales tres veces a un tubo cónico de 50 ml. No mezcle diferentes partículas lentivirales en este punto. Cada plato resultará en 12 ml de sobrenadante lentiviral. Cuatro platos de la misma preparación viral encajan en un tubo cónico de 50 ml.
ADVERTENCIA: Realizar la recolección lentiviral en un laboratorio de nivel 2 de bioseguridad en una campana de flujo laminar dedicada al trabajo lentiviral y colocar residuos virales contaminados (tubos, puntas, platos) en un recipiente adecuado para materiales biopeligrosos.- Haga la primera recolección 16 h después de la última incubación y agregue 4 ml de DMEM completo. Incubar a 37oC, 5% CO2.
- Hacer la segunda recolección 8 h después de la primera al mismo tubo, añadir 4 mL de DMEM completo e incubar a 37 oC, 5% CO2.
- Hacer la tercera colección 16 h después de la segunda al mismo tubo y desechar los platos.
NOTA: Conservar los sobrenatantes lentivirales a 4oC después de cada colección.
- Filtrar cada sobrenadante lentiviral utilizando un filtro de unión de proteína baja de 0,45 m con una membrana de acetato de celulosa(Tabla de materiales)a un tubo limpio.
- Añadir un máximo de 15 ml de sobrenadante filtrado a una unidad de filtro centrífugo con una membrana de celulosa regenerada(Tabla de Materiales)y girar a 4.000 x g durante 25 min, a 4oC. Deseche el flujo. Un líquido viscoso que contenga lentivirus permanecerá en la unidad de filtro.
- Repita el paso 3.13 añadiendo 15 ml de sobrenadante en la parte superior de la unidad de filtro, hasta que no quede más sobrenadante lentiviral.
NOTA: Cuando sólo hay unos pocos mililitros de sobrenadante para concentrarse, disminuir el tiempo de hilado a 10 min. Si todavía hay líquido extra (no viscoso) en el filtro, centrífuga durante 10 minutos adicionales. - Hacer alícuotas (50-200 l dependiendo del volumen inicial de sobrenadantes) de cada tipo de lentivirus concentrados y almacenar a -80 oC para almacenamiento a largo plazo (1-2 años) o a 4 oC para almacenamiento a corto plazo (1 x 2 semanas).
NOTA: Los lentivirus concentrados o no concentrados también se pueden utilizar frescos. No vuelva a congelar y descongelar, ya que esto reduce el rumbo.
4. Reprogramación hemogénica
NOTA: Utilice discos duros con un número de paso de tres (P3) o superior (hasta P10) para realizar experimentos de reprogramación.
- Recubrir un plato tratado con cultivo tisular de 100 mm con 5 ml de gelatina al 0,1% e incubar a 37 oC durante 20 minutos.
- Descongelar un vial de fibroblastos y células de placa en el plato recubierto de gelatina 0.1%. Incubar durante la noche a 37oC, 5% CO2. Si es necesario, expanda los fibroblastos durante un período de tiempo más largo hasta que se alcance el paso y la confluencia deseados.
- Recubrir una placa tratada con cultivo de tejido de 6 pocillos con 500 ml de solución de gelatina al 0,1% e incubar a 37 oC durante 20 min. Retire la gelatina extra.
- Placa HDFs a una densidad de 150.000 celdas por placa (25.000 celdas por pozo) en 2 ml de DMEM completo por pozo. Incubar durante la noche a 37oC, 5% CO2,para permitir la unión celular.
- Sustituya el medio por 2 ml de DMEM completo más 8 g/ml de polibreno. Prepare una mezcla de proporción 1:1 de lentivirus TF producidos en la piscina y M2rtTA en un nuevo tubo de microcentrífuga.
NOTA: En este protocolo, se realiza la producción de lentivirus para los tres TF, lo que, en manos de los autores, resulta en una mayor eficiencia de reprogramación. Alternativamente, se sugiere realizar una valoración de las partículas lentivirales individuales por qPCR18,en una línea celular estándar. Esto se utilizará para definir el volumen de virus individuales necesarios para satisfacer una multiplicidad de infección (MOI) óptima para la co-transducción y la reprogramación hemogénica. - Distribuir de 10 a 100 ml de mezcla lentiviral por pocto, para transducir HDFs. Este es el día -2 de la reprogramación.
NOTA: Definir el volumen óptimo de mezcla lentiviral para una reprogramación eficiente, sin comprometer la viabilidad celular, requiere optimización (consulte la Figura Suplementaria 1 para obtener más detalles). Los HDF con más de 7 pasajes pueden requerir mayores volúmenes de virus que las células con pasajes más bajos. - Después de 16 h de incubación, eliminar los virus y añadir DMEM completo. Permita que las células se recuperen durante 6 x 8 h.
- Después de la recuperación, aspirar el medio y añadir 2 mL de DMEM completo con 8 g/ml de polibreno.
- Realice una segunda transducción como se describe en el paso 4.6 e incubar a 37oC, 5%CO2 durante 16 h. Este es el día -1 de la reprogramación. La mezcla lentiviral se puede preparar el día -2 para las transducciones y mantenerse a 4 oC.
- Al día siguiente, elimine los virus y agregue el DMEM completo complementado con 1 g/ml DOX. Este es el día 0 de la reprogramación. Incubar a 37oC, 5%CO2 durante 48 h.
-
En el día 2 de la reprogramación, divida cada pozo en proporción 1:2.
- Aspirar células medianas y de lavado con 1 mL de PBS.
- Aspirar PBS y disociar células con 500 ml de solución de disociación. Incubar 5 a 10 min a 37oC, 5%CO2.
- Inactivar la solución de disociación con 1 ml de DMEM completo y recoger las células en un tubo cónico. Centrífuga a 350 x g durante 5 min.
- Resuspenda el pellet en medio hematopoyético (ver paso 1.3), complementado con DOX de 1 g/ml, y las células de la placa en placas de 6 pocillos tratadas con cultivo de tejido recubiertas con 0,1% de gelatina a un volumen final de 2 ml por pocto.
- Cambiar medio (medio hematopoyético más DOX) dos veces por semana durante la duración de los cultivos de reprogramación (25 días).
- Analizar las células reprogramadas resultantes en diferentes puntos de tiempo mediante microscopía de campo brillante o fluorescencia (ver Figura Suplementaria 2),citometría de flujo, secuenciación de ARN a granel y de una sola célula, y ensayos de trasplante para la adquisición de morfología hematopoyética, presencia de marcadores endoteliales y hematopoyéticos, adquisición del perfil de expresión génica endotelial/hematopoyética y capacidad de regeneración14.
5. Optimización de la expansión de fibroblastos para el análisis ChIP-seq al inicio de la reprogramación hemogénica
- Placa 300.000 HDFs (2.
- Al día siguiente, sustituya el medio por un DMEM completo complementado con polibreno de 8 g/ml.
- Células transductas con factores individuales: pFUW-tetO-FOS14, pLV-tetO-HA-GFI1B (Addgene #125599)14 y pFUW-tetO-3xFLAG-GATA2 (Addgene #125600)14 o con un grupo de los tres factores, más FUW-M2rtTA en proporción 1:1. Utilice un virus total de 10 a 20 l (TF + M2rtTA individual o tres TF + M2rtTA). Incubar células durante la noche a 37oC, 5%CO2.
NOTA: Se recomienda utilizar doce placas de 6 pocillos por condición (para cada TF individual y los tres TF combinados). - Retire los lentivirus y agregue DMEM 16 h completo después de la primera transducción. Deje que las células se recuperen durante 6 x 8 h.
- Transducir las células por segunda vez con la misma cantidad de virus por condición e incubar a 37 oC, 5%CO2.
- Al día siguiente, elimine los virus y agregue DMEM completo. Incubar a 37oC, 5%CO2 durante 24 h.
- Replaca cada pozo en un plato de 100 mm tratado con cultivo de tejido recubierto de gelatina al 0,1% con DMEM completo a un volumen final de 10 ml por plato. Esto representa aproximadamente un pasaje de 1:6.
- Permitir que las células crezcan durante 6 días a 37oC, 5%CO2.
- El día 6 después del re-plating, aspirar el medio y añadir DMEM completo con 1 g/ml DOX. Incubar células a 37oC, 5%CO2 durante 2 días.
- Recoger fibroblastos y analizar los sitios de unión genómica de los tres TF transducidos individualmente o en combinación, por ChIP-seq 2 días después de la suplementación con DOX14.
NOTA: Los últimos setenta y dos platos de 100 mm contendrán entre 20 x 50 x 106 células, suficientes para realizar experimentos Y réplicas de ChIP-seq.
Resultados
En la Figura 1Ase ilustra una representación esquemática del enfoque de reprogramación mediante discos duros de definición. Los fibroblastos se adquieren de fuentes comerciales o se recogen de donantes humanos y se expanden in vitro antes de la reprogramación. Después del chapado, las células se transduyen dos veces con lentivirus DE GATA2, GFI1B y FOS (y M2rtTA), y la doxiciclina se agrega en el día 0 de la reprogramación. El día 2, las células se dividen y se chapan en medio hematopoyético hasta el día 25 del cultivo. Las células reprogramadas pueden generarse en diferentes momentos para múltiples aplicaciones, incluyendo trasplante en ratones inmunocomprometidos, secuenciación de ARN de una sola célula (scRNA-seq) de poblaciones de células purificadas (día 2 sin clasificar, día 15 CD49f+ CD34 y día 25 CD49f+CD34+ células), así como análisis de microscopía y citometría de flujo para los marcadores de superficie celular CD49f, CD34, CD9 y CD143. Las gráficas representativas de la citometría muestran el 17 % de las celdas reprogramadas que expresan CD49f y CD9(Figura 1B, panel izquierdo),después de 25 días de reprogramación. La mayoría de las células positivas dobles expresan CD143 (86%) y una pequeña población expresa CD34 (0,9%), lo que sugiere una inducción dinámica del destino hemogénico. Estos marcadores no se activan en los HDF transducidos por M2rtTA cultivados durante 25 días(Figura 1B, panel derecho). Las imágenes de inmunofluorescencia confirman la expresión de CD9 y CD143 en células adherentes y redondas, morfológicamente distintas de los fibroblastos negativos para estos marcadores(Figura 1C). Las colonias hemogénicas humanas también expresan CD49f y CD3414. El análisis ScRNA-seq de HDFs, el día 2 de células no ordenadas y las células reprogramadas purificadas en el día 15 (CD49f+CD34-) y el día 25 (CD49f+CD34+) muestran un aumento escalonado en la expresión CD49f, CD9 y CD143 desde el día 2 hasta el día 25. Las células positivas CD49f y CD9 aparecen primero durante el proceso de reprogramación, entre los días 2 y 15, lo que indica que estas moléculas pueden representar marcadores de hemogénesis humana temprana. La expresión CD143 comienza a detectarse en el día 15 y las celdas de expresión CD34 se detectan solo en los puntos de tiempo posteriores (día 25). CD34+ Se utilizaron como referencia las células de la sangre del cordón umbilical (UCB)(Figura 1D).
La Figura 2A describe un protocolo modificado para generar un número suficiente de células para el análisis ChIP-seq en las etapas iniciales de la reprogramación hemogénica (día 2). En primer lugar, los HDF se celen a una densidad dos veces mayor que en el protocolo estándar (300.000 celdas frente a 150.000 celdas por placa). Después de la transducción, cada pozo se re-placa en un plato de 100 mm permitiendo que las células se expandan durante 6 días antes de complementar el medio con DOX. Las celdas se analizan 2 días después de agregar DOX y la expresión TF consecuente. La Figura 2B muestra los perfiles del navegador del genoma de GATA2 que se unen a las regiones reguladoras genómicas de ITGA6 y ACE cuando las células se transduelen con los tres factores (3TO) o GATA2 individualmente. GATA2 también se une a las regiones abiertas de cromatina de los genes CD9 y CD34 14.
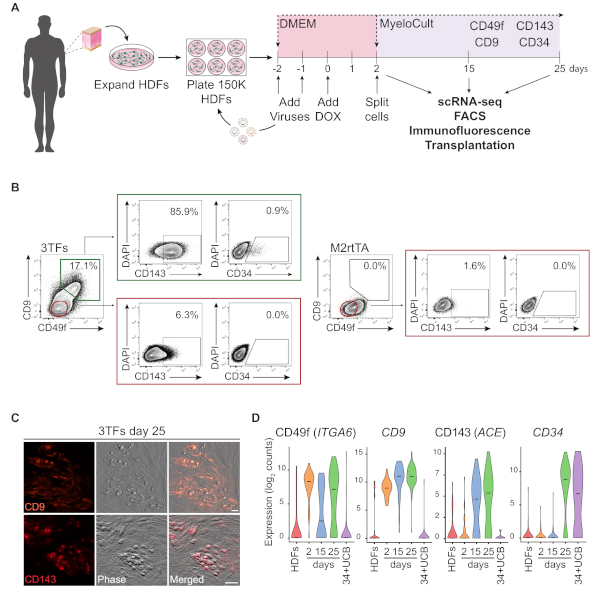
Figura 1: Inducción del destino hemogénico en fibroblastos dérmicos humanos. (A) Estrategia experimental para la reprogramación hemogénica de fibroblastos dérmicos humanos (HDF). Los fibroblastos de las biopsias de punzonado de la piel se recogen de donantes, se expanden y transdujeron con lentivirus GATA2, GFI1B, FOS y M2rtTA. La doxiciclina (DOX) se agrega al cultivo en el día 0 de la reprogramación y las células se analizan en varios puntos de tiempo hasta el día 25. scRNA-seq, secuenciación de ARN de una sola célula. FACS, Clasificación de células activadas por fluorescencia. (B) Estrategia de gating utilizada para evaluar la expresión de marcadores hemogénicos/hematopoyéticos mediante citometría de flujo en el día 25 después de la transducción con los tres factores de transcripción (3TO). Las gráficas de citometría muestran el porcentaje de celdas positivas dobles para CD49f y CD9, cerradas en la población de células vivas (DAPI negativa). Dentro de la doble población positiva, se muestra la expresión de CD143 y CD34. Los HDF transducidos sólo con el virus M2rtTA en las mismas condiciones de cultivo se utilizan como control. (C) Imágenes de inmunofluorescencia de las colonias reprogramadas del día 25 que confirman la expresión de CD9 (panel superior) y CD143 (panel inferior). Las células se tiñeron con anticuerpos(Tabla de Materiales)diluidas 1:100 en PBS/2% FBS con suero de ratón, incubadas 20 min a 37oC, 5% CO2,lavadas tres veces e imagendas en PBS/2% FBS. Fase, contraste de fase-gradiente. Barras de escala a 50 m. (D) Análisis ScRNA-seq de 253 celdas en diferentes puntos de tiempo. La expresión de ITGA6, CD9, ACE y CD34 se activa durante la reprogramación. Las células se recogen en el día 2 (sin clasificar), el día 15 (CD49f+CD34-) y el día 25 (CD49f+CD34+). Las células HDF y CD34+ sangre de cordón umbilical (34+UCB) se utilizan como referencias. Haga clic aquí para ver una versión más grande de esta figura.
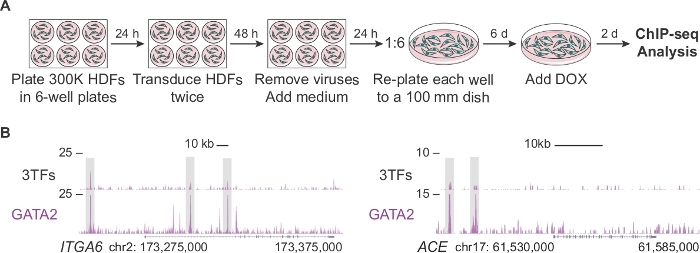
Figura 2: Expansión de fibroblastos dérmicos humanos para el análisis ChIP-seq. (A) Estrategia experimental que representa un protocolo modificado para generar un gran número de fibroblastos dérmicos humanos transducidos (HDF) para ChIP-seq en el día 2 de la reprogramación. 300.000 células se celen en placas de 6 pocillos y se transdulan dos veces con factores individuales (pFUW-tetO-FOS, pLV-tetO-HA-GFI1B o pFUW-tetO-3xFLAG-GATA2) o una combinación de los tres factores (más M2rtTA). Después de eliminar los virus, los fibroblastos se expanden durante seis días en platos de 100 mm. La doxiciclina (DOX) se agrega en el día 0 y las células se recogen dos días después de la adición de DOX. (B) Perfiles del navegador del genoma destacando los sitios de unión DE GATA2 (cajas grises) en ITGA6 y ACE loci dos días después de la transducción con los tres factores de transcripción (3TO) o solo con GATA2. El número total de lecturas asignadas se representa en el eje Y. Haga clic aquí para ver una versión más grande de esta figura.
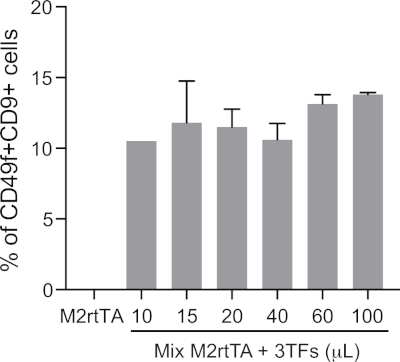
Figura suplementaria 1: Definición de un volumen lentiviral optimizado para una reprogramación hemogénica eficiente. El aumento de los volúmenes de partículas lentivirales concentradas (10 a 100 ol) producidas en piscinas (3TF: GATA2, GFI1B y FOS) se utilizan para transducir fibroblastos dérmales humanos (HDF), junto con M2rtTA en una proporción de 1:1, siguiendo los pasos 4.5 a 4.12 del protocolo. Las células reprogramadas se analizan en el día 25 para definir un volumen óptimo de transducción para la reprogramación hemogénica, dado por el porcentaje de CD49f+CD9+ células cerradas en células vivas (DAPI-negativa). La viabilidad celular se puede evaluar cuantificando el número absoluto de células vivas en el día 25. Los HDF transducidos con M2rtTA (100 l) se utilizan como control negativo. Haga clic aquí para ver una versión más grande de esta figura.

Figura suplementaria 2: Cambios morfológicos durante la reprogramación hemogénica de fibroblastos dérmicos humanos. Los cultivos de fibroblastos dérmicos humanos (HDF) se imágenen en el día de la primera transducción (día -2), cuando doX se añade a los cultivos (día 0), dos días (día 2) y quince días (día 15) después de la suplementación con DOX, y en el punto final del experimento (día 25). Se destacan las colonias hemogénicas en los días 15 y 25. Barras de escala a 100 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este artículo, se describe un método para generar células progenitoras hematopoyéticas directamente a partir de fibroblastos humanos, que pasan a través de una célula HP intermedia, de forma similar a los HSC14definitivos.
Se prefirió la producción de partículas lentivirales que codifican GATA2, GFI1B y FOS sobre la producción individual, ya que en nuestras manos se traduce en mayores eficiencias de reprogramación (datos no publicados). Lentiviruses, como miembros de la familia Retroviridae, normalmente contienen dos copias de ARN positivo de una sola cadena19. El aumento de la eficiencia de reprogramación puede deberse al empaquetado de dos transgenes diferentes en la misma partícula lentiviral, lo que resulta en un mayor número de células cotransducidas con los tres factores de transcripción. Para asegurar el éxito de este protocolo, es necesario transducir los HDF con una cantidad adecuada de virus dependiendo del paso celular para obtener un equilibrio óptimo entre la eficiencia de reprogramación y la viabilidad celular, como se recomienda en el paso 4.6. Además, se pueden utilizar virus frescos no concentrados. Se recomienda transducir las células con 0.5-3 mL de la agrupación 3TF s y M2rtTA. Además, la densidad celular debe ajustarse de acuerdo con la aplicación. 150 000 HDF por placa de 6 pocillos (paso 4.4) proporcionaron la densidad óptima para realizar el análisis de FACS, trasplante y citometría de flujo de células reprogramadas. Para los experimentos ChIP-seq, se requerían más celdas desde el principio (paso 5.1). Es importante revisar las células regularmente en busca de cambios morfológicos y reemplazar el medio hematopoyético dos veces por semana para apoyar la aparición de células hematopoyéticas inducidas. La adición de citoquinas hematopoyéticas o cocultivo en capas de alimentación puede aumentar la eficiencia de reprogramación.
Con este método, podemos identificar nuevos marcadores hematopoyéticos que se expresan dinámicamente durante la reprogramación hemogénica. CD9, que se demostró que estaba regulado en células reprogramadas en el nivel de transcripción14,se expresa rápidamente en la superficie celular en las fases iniciales de reprogramación junto con CD49f y CD143, sirviendo como un marcador novedoso de precursores humanos de HSC. También demostramos que ITGA6 y ACE son objetivos directos de GATA2 durante las etapas iniciales de la reprogramación hemogénica, además de CD9 y CD3414,proporcionando un vínculo mecanicista directo entre los hemogénicos humanos fenotipo precursor y GATA2.
Una ventaja de este sistema reside en el uso de cultivos de fibroblastos relativamente homogéneos. Mientras que los PSC se expanden y mantienen fácilmente in vitro,los protocolos de diferenciación generan poblaciones heterogéneas que incluyen progenitores hematopoyéticos, que injertan mal5,6,7. Además, existe el riesgo de tumorigenesis al trasplantar HSPC derivados de PSC, ya que los PsCCP indiferenciados todavía pueden permanecer en cultivo incluso después de emplear protocolos de diferenciación. Alternativamente a los fibroblastos, la reprogramación directa de los HSC se ha aplicado a los progenitores20 y a las células endoteliales21. Sin embargo, a partir de células progenitoras restringidas en sangre, se dificulta la aplicación terapéutica de los HSC resultantes si el paciente lleva mutaciones que afectan a la población hematopoyética del tallo/progenitor222. En el caso de las células endoteliales, son más difíciles de obtener en comparación con los fibroblastos, y constituyen una población celular muy heterogénea en términos de fenotipo, función y estructura, que dependen de órganos23. Otros estudios han logrado reprogramar fibroblastos de ratón en progenitores hematopoyéticos enesbables24,25 sin embargo, hasta ahora, ningún otro protocolo describe la generación de células similares a HSPC a partir de fibroblastos humanos.
Este enfoque, junto con la inhibición farmacológica, el desconexión genética o los permisos de derribo para definir factores individuales o combinados que se requieren para inducir directamente hSC humanos. Las tecnologías CRISPR-Cas9 en HDF antes de la reprogramación, representan un esfuerzo emocionante para definir nuevos reguladores de la hematopoyesis definitiva humana. En el futuro, la reprogramación de los tipos de células humanas no relacionadas con la sangre, como los fibroblastos, servirá como plataforma para generar células progenitoras hematopoyéticas sanas adaptadas al paciente para aplicaciones clínicas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
La fundación Knut y Alice Wallenberg, la Facultad de Medicina de la Universidad de Lund y la Región de Escania son reconocidas por su generoso apoyo financiero. Esta obra fue apoyada por una subvención de Olle Engkvists Stiftelse (194-0694 a Filipe Pereira) y becas de doctorado de la Fundación para la Ciencia y La Tecnología (PTDC/BIM-MED/0075/2014 a Filipe Pereira, y SFRH/BD/135725/2018 y SFRH/BD/51968/2012 a Rita Alves y Andreia Gomes). Este estudio también fue apoyado por fondos de NIH y NYSTEM (1R01HL119404 y C32597GG a Kateri A. Moore).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.45 μm low-protein binding filter, 150 mL Bottle Top Vacuum Filter | Corning | #430625 | |
| 2-Mercaptoethanol | Sigma-Aldrich | #M6250 | |
| Alexa Fluor 488 anti-human CD34 clone 581 | BioLegend | #343518 | |
| BD Pharmingen APC Mouse Anti-Human Angiotensin Converting Enzyme (CD143) clone BB9 | BD Biosciences | #557929 | |
| BES buffered saline | Sigma-Aldrich | #14280 | |
| Calcium chloride (CaCl2) | Sigma-Aldrich | #449709 | |
| Centrifugal filter unit, Amicon Ultra-15 Centrifugal Filter Unit | Sigma-Aldrich | #UFC903096 | |
| Dissociation solution, TrypLE Express Enzyme (1x) no phenol red | Gibco | #12604-021 | |
| Doxycycline hyclate (DOX) | Sigma-Aldrich | #D9891 | |
| eBioscience CD49f (Integrin alpha 6) Monoclonal Antibody (eBioGoH3 (GoH3)), PE-Cyanine7 | Invitrogen | #25-0495-82 | |
| FUW-M2rtTA | Addgene | #20342 | |
| Gelatin from Porcine Skin Type A | Sigma-Aldrich | #G1890 | |
| Gibco L-Glutamine (200 mM) | ThermoFisher Scientific | #25030-024 | |
| Gibco MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | #11140-035 | |
| Hematopoietic medium, MyeloCult H5100 | STEMCELL Technologies | #05150 | |
| Hexadimethrine bromide (polybrene) | Sigma-Aldrich | #H9268 | |
| Human Dermal Fibroblasts (HDFs) | ScienCell | #2320 | |
| HyClone Dulbecco's Modified Eagles Medium (DMEM) | GE Healthcare | #SH30243.01 | |
| HyClone Fetal Bovine Serum (FBS) | GE Healthcare | #SV30160.03 | |
| HyClone Penicillin Streptomycin 100x Solution (Pen/Strep) | GE Healthcare | #SV30010 | |
| HyClone Phosphate Buffered Saline solution (PBS) | GE Healthcare | #SH30256.01 | |
| Hydrocortisone | STEMCELL Technologies | #7904 | |
| Mouse serum | Sigma-Aldrich | #M5905 | |
| PE anti-human CD9 Antibody clone HI9a | BioLegend | #312105 | |
| pFUW-tetO-3xFLAG-GATA2 | Addgene | #125600 | |
| pFUW-tetO-FOS | Addgene | #125598 | |
| pFUW-tetO-GATA2 | Addgene | #125028 | |
| pFUW-tetO-GFI1B | Addgene | #125597 | |
| pLV-tetO-HA-GFI1B | Addgene | #125599 | |
| pMD2.G | Addgene | #12259 | |
| psPAX2 | Addgene | #12260 |
Referencias
- Ivanovs, A., et al. Highly potent human hematopoietic stem cells first emerge in the intraembryonic aorta-gonad-mesonephros region. Journal of Experimental Medicine. 208, 2417-2427 (2011).
- Tavian, M., Biasch, K., Sinka, L., Vallet, J., Péault, B. Embryonic origin of human hematopoiesis. International Journal of Developmental Biology. 1065, 1061-1065 (2010).
- Medvinsky, A., Rybtsov, S., Taoudi, S. Embryonic origin of the adult hematopoietic system: advances and questions. Development. 138, 1017-1031 (2011).
- Ivanovs, A., et al. Human haematopoietic stem cell development: from the embryo to the dish. Development. 144, 2323-2337 (2017).
- Daniel, M. G., Pereira, C. F., Lemischka, I. R., Moore, K. A. Making a Hematopoietic Stem Cell. Trends in Cell Biology. 26, 202-214 (2016).
- Vo, L., Daley, G. De novo generation of HSCs from somatic and pluripotent stem cell sources. Blood. 125, 2641-2648 (2015).
- Rafii, S., et al. Human ESC-derived hemogenic endothelial cells undergo distinct waves of endothelial to hematopoietic transition. Blood. 121, 770-781 (2013).
- Ebina, W., Rossi, D. J. Transcription factor-mediated reprogramming toward hematopoietic stem cells. EMBO Journal. 34, 694-709 (2015).
- Sugimura, R., et al. Haematopoietic stem and progenitor cells from human pluripotent stem cells. Nature. 545, 432-438 (2017).
- Pereira, C. F., et al. Induction of a Hemogenic Program in Mouse Fibroblasts. Cell Stem Cell. 13, 205-218 (2013).
- Pereira, C. F., et al. Hematopoietic Reprogramming In vitro Informs In Vivo Identification of Hemogenic Precursors to Definitive Hematopoietic Stem Cells. Developmental Cell. 36, 525-539 (2016).
- Notta, F., et al. Isolation of Single Human Hematopoietic Stem Cells Capable of Long-Term Multilineage Engraftment. Science. 333, 218-221 (2011).
- Sinka, L., Biasch, K., Khazaal, I., Péault, B., Tavian, M. Angiotensin-converting enzyme (CD143) specifies emerging lympho-hematopoietic progenitors in the human embryo. Blood. 119, 3712-3724 (2012).
- Gomes, A. M., et al. Cooperative Transcription Factor Induction Mediates Hemogenic Reprogramming. Cell Reports. 25, 2821-2835 (2018).
- Karlsson, G., et al. Report The Tetraspanin CD9 Affords High-Purity Capture of All Murine Hematopoietic Stem Cells. Cell Reports. 4, 642-648 (2013).
- Leung, K. T., et al. The tetraspanin CD9 regulates migration, adhesion, and homing of human cord blood CD34+ hematopoietic stem and progenitor cells. Blood. 117, 1840-1851 (2011).
- Hockemeyer, D., et al. A drug-inducible system for direct reprogramming of human somatic cells to pluripotency. Cell Stem Cell. 3, 346-353 (2008).
- Kutner, R. H., Zhang, X., Reiser, J. Production concentration and titration of pseudotyped HIV-1-based lentiviral vectors. Nature Protocols. 4, 495-505 (2009).
- Suzuki, Y. S., Suzuki, Y., Ke, X. Gene Regulatable Lentiviral Vector System. Viral Gene Therapy. , (2011).
- Riddell, J., et al. Reprogramming committed murine blood cells to induced hematopoietic stem cells with defined factors. Cell. 157, 549-564 (2014).
- Lis, R., et al. Conversion of adult endothelium to immunocompetent haematopoietic stem cells. Nature. 545, 439-445 (2017).
- Pereira, C., Lemischka, I. R., Moore, K. From blood to blood’: de-differentiation of hematopoietic progenitors to stem cells. EMBO Journal. 33, 1511-1513 (2014).
- Nolan, D. J., et al. Molecular Signatures of Tissue-Specific Microvascular Endothelial Cell Heterogeneity in Organ Maintenance and Regeneration. Developmental Cell. 26, 204-219 (2013).
- Batta, K., Florkowska, M., Kouskoff, V., Lacaud, G. Direct Reprogramming of Murine Fibroblasts to Hematopoietic Progenitor Cells. Cell Reports. 9, 1871 (2014).
- Cheng, H., et al. Reprogramming mouse fibroblasts into engraftable myeloerythroid and lymphoid progenitors. Nature Communications. 7, 1-15 (2016).
Erratum
Formal Correction: Erratum: Hemogenic Reprogramming of Human Fibroblasts by Enforced Expression of Transcription Factors
Posted by JoVE Editors on 12/03/2019. Citeable Link.
An erratum was issued for: Hemogenic Reprogramming of Human Fibroblasts by Enforced Expression of Transcription Factors. The author affiliations were updated.
The second author affiliation was updated from:
2Wallenberg Center for Molecular, Lund University
to:
2Wallenberg Center for Molecular Medicine, Lund University
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados