Method Article
Гемогенное перепрограммирование фибробластов человека путем принудительного выражения факторов транскрипции
В этой статье
Erratum Notice
Резюме
Этот протокол демонстрирует индукцию гемогенной программы в кожных фибробластах человека путем принудительного выражения транскрипционных факторов GATA2, GFI1B и FOS для генерации гематопоиетических стволовых и прародителей клеток.
Аннотация
Клеточные и молекулярные механизмы, лежащие в основе спецификации гематопоатических стволовых клеток человека (ГСК), остаются неуловимыми. Стратегии для повторения человеческого HSC появление in vitro необходимы для преодоления ограничений в изучении этого сложного процесса развития. Здесь мы описываем протокол для создания гематопоиетического стебля и клеток, похожих на гененора, из человеческих дермальных фибробластов, использующих подход прямого перепрограммирования клеток. Эти клетки проходят через гемогенный промежуточный клеточный тип, напоминающий эндотелиальный к гематопоиетному переходу (EHT), характерный для спецификации HSC. Фибробласты были перепрограммированы на гемогенные клетки с помощью трансдукции GATA2, GFI1B и FOS транскрипции факторов. Это сочетание трех факторов индуцированных морфологических изменений, выражение гемогенных и гематопогетических маркеров и динамических транскрипционных программ EHT. Перепрограммированные клетки генерируют гематопоитетическое потомство и заселяют иммунодефицитных мышей в течение трех месяцев. Этот протокол может быть адаптирован к механистскому вскрытию процесса EHT человека, о чем свидетельствует здесь, определив цели GATA2 на ранних этапах перепрограммирования. Таким образом, гемогенное перепрограммирование человека обеспечивает простой и уступчивый подход к выявлению новых маркеров и регуляторов возникновения HSC человека. В будущем верная индукция гемогенной судьбы в фибробластах может привести к генерации специфических для пациентов ГСК для трансплантации.
Введение
Окончательный гематопоиетических стволовых клеток и клеток-предшественников (HSPCs) возникают в области аорты-гонад-мезонефров (AGM) и плаценты из эндотелиальных прекурсоров с гемогенной емкостью, через эндотелиальный-гематопоатический переход (EHT)1, 2. Гемогенные прекурсоры (ГП) выражают как эндотелиальные, так и гематопоитические маркеры, но их точная идентификация остается неуловимой, особенно в человеческой системе. Несмотря на то, что относительно сохранивпроцесс у млекопитающих, развитие гематопоиетических стволовых клеток (HSC) по-прежнему значительно отличается между людьми и моделями мыши3,4. Поэтому необходимы подходы in vitro для повторения развития HSC человека.
Дифференциация плюрипотентных стволовых клеток (ПСК) на HSCs, хотя и многообещающая, встретила ограниченный успех в течение последних 20 лет, в основном из-за имеющихся протоколов дифференциации, которые приводят к примитивным гематопоитическим потомкам с плохим притворством способность5,6,7. Кроме того, методы перепрограммирования прямых ячеек были применены для генерации HSPC-подобных ячеек из нескольких типов клеток, используя транскрипционные факторы (TFs)8,9. В частности, переэкспрессия трех TFs, Gata2, Gfi1b и cFos, преобразованных мыши эмбриональных фибробластов в HSPCs через промежуточный HP с определенным фенотипом (Пром1-Ска-1'CD34-CD45-)10. Этот процесс напоминал EHT, который происходит в эмбрионе и плаценте, во время спецификации окончательного hematopoiesis. Этот фенотип позволил идентификации и изоляции населения HPs в мышь плаценты, что после краткосрочной культуры и Notch активации генерируется последовательно трансплантативных HSCs11.
До сих пор не было установлено фенотипа, который отличал бы человеческие ГХК от их предшественников, но некоторые молекулы, как известно, выражены в новых HSCs. Integrin alpha 6 (ITGA6 или CD49f) высоко выражен в долгосрочном заселении ГХК, самых незрелых клетки в отсеке HSC12, и ангиотензин-преобразующий фермент (ACE или CD143) присутствует в CD34 отрицательных гематопоитических предшественников в эмбриональных кроветворных тканей13.
Недавно мы показали, что человеческие версии трех TFs, GATA2, FOS и GFI1B перепрограммировать человеческие кожные фибробласты (HDFs) в HPs с краткосрочной возможностью привить14. На начальных этапах перепрограммирования GATA2 привлекает открытый хроматин и набирает GFI1B и FOS для подавления генов фибробластов и активации эндотелиальных и гематопогетических генов. Индуцированные клетки высоко выражали CD49f и ACE, и содержали небольшой процент клеток, выражающих маркер HSPC CD34. Ген CD9, который выражается в HSCs15 и имеет важное значение для HSC самонаведения16, было показано, что прямая цель GATA2 и среди наиболее до регулируемых генов в перепрограммированных клеток14. Таким образом, CD9 может представлять собой дополнительный маркер для HPs человеческого окончательного гематопоеза.
В этом протоколе мы описываем генерацию HSPC-подобных клеток из фибробластов человека через принудительное выражение GATA2, GFI1B и FOS, а также адаптированный метод анализа иммунопременции хроматина (ChIP)-секвенирования (seq) в начале Перепрограммирования. TFs были закодированы в доксициклин (DOX)-индуцируемого лентивирусного вектора (pFUW-tetO), который содержит элемент тетрациклина (TRE) и минимальный промоутер ЦМВ, и были трансукторованы вместе с составным вектором, содержащим обратный тетрациклин трансактиваторный белок (pFUW-M2rtTA). Когда DOX (аналог тетрациклина) добавляется после трансдукции, он связывается с белком rtTA, который взаимодействует с TRE, позволяющим транскрипцию TF (Система Тет-Он). Процедура требует 25 дней. Для экспериментов ChIP-seq, HDFs были трансуктором с помеченными версиями GATA2 (pFUW-tetO-3xFLAG-GATA2) и GFI1B (pLV-tetO-HA-GFI1B), плюс pFUW-tetO-FOS и tF связывающие сайты были проанализированы через два дня после doX дополнения.
В конечном счете, гемогенное перепрограммирование фибробластов человека обеспечивает систему витровых путей для изучения механизмов, лежащих в основе гематопоеза развития человека и потенциальный источник специфических для пациентов HSPCs для будущего клинического применения.
протокол
Этот протокол был выполнен в соответствии с руководящими принципами комитета по этике человеческих исследований Лундского университета и должен осуществляться в соответствии с индивидуальными институциональными руководящими принципами.
1. Подготовка реагента
- Для модифицированного орла Dulbecco (DMEM)/20% сыворотки крупного рогатого скота плода (FBS), смешать высокий уровень глюкозы DMEM, содержащий пируват натрия с 20% FBS, 1% пенициллин-стрептомицин (перо/стрепто, 1% L-глутамамин, 1% несущественные аминокислоты и 10-4-M - меркаптоэтанол.
- Для полного DMEM, смешать высокий уровень глюкозы DMEM, содержащий пируват натрия с 10% FBS, 1% Pen/strep и 1% L-глютамин.
- Для гематопоитической среды, смешать гематопоиетическую среду (Таблица материалов) с 10-6 M гидрокортизон и 1% пера / стреп.
- Используйте фосфат-буферный солен (PBS) без кальция или магния.
2. Изоляция дермальных фибробластов человека
ПРИМЕЧАНИЕ: HDFs можно приобрести у сертифицированных поставщиков(Таблица материалов). В этом случае расширьте фибробласты и используйте их непосредственно в экспериментах по перепрограммированию (раздел 4). Кроме того, ПГФ могут быть изолированы от доноров. Если фибробласты изолированы от разных доноров, держите образцы отделенными друг от друга на всех этапах протокола. Этикетка пластин / колодцев и трубки сбора с идентификационным номером каждого донора.
- Получить HDFs от 3 мм круглых биопсий пунша кожи в исполнении квалифицированных врачей.
- Пальто три колодца ткани культуры обработанных 6-наилучшим образом пластины с 500 л 0,1% желатина и инкубировать в течение 20 мин при 37 градусов по Цельсию.
- Усиливайте оставшийся желатиновый раствор и добавляйте 750 л DMEM/20% FBS к каждой скважине. Вся поверхность колодца должна быть покрыта средой.
- Добавьте 1,5 мл DMEM/20% FBS на внутреннюю поверхность стерильной 100 мм крышки чашки Петри и разложите каплю с помощью серологического пипетки калибра 5 мл.
- Поместите биопсию кожи в среду на крышку со стерилизованные щипты.
- Расчлените биопсию кожи на девять одинаковых секций, используя один стерилизованный скальпель для проведения биопсии на месте и второй скальпель, чтобы сократить.
- Поместите три части биопсии на хорошо с помощью остроконечных щипков. Убедитесь, что части прикрепляются к нижней части колодца.
- Положите 22 мм coverslip на верхней части и применить некоторое давление.
- Инкубировать тарелку при 37 градусах Цельсия, 5% CO2,в течение недели. Проверяйте клетки ежедневно и добавляйте 200 кЛ DMEM/20% FBS каждые 2 дня, чтобы заменить испаряемую среду.
- Через неделю добавьте до 2 мл DMEM/20% FBS и замените среду каждые 2-3 дня.
-
Проходные клетки при соотношении 1:4 при слиянии скважин (около 4–8 недель).
- Приготовьте 0,1% желатина с покрытием ткани культуры обработанных 6-колодец пластин.
- Аспирная среда из скважин при 80% вспыхивании и мойте один раз с 1 мл PBS.
- Удалить coverslip с стерильными щипками и поместите coverslip в новый колодец 6-колодец пластины, с тканью вверх.
ПРИМЕЧАНИЕ: Клетки, которые остались прикреплены к крышке, также будут собраны. - Добавьте 500 зЛ диссоциационизмовательного раствора(Таблица материалов)на скважину (включая скважины с крышками) и инкубируйте при 37 градусах Цельсия, 5% CO2 в течение 5–10 мин. Проверьте, когда клетки начинают подниматься со дна скважины, и инактивируйте диссоциационный раствор добавив 500 зл DMEM/20% FBS к каждой скважине.
- Соберите фибробласты из всех скважин в коническую трубку 15 мл. Добавьте дополнительный средний к скважинам, чтобы собрать оставшиеся ячейки. Центрифуга трубки на 350 х г в течение 5 мин.
- В то же время, добавить 500 зл DMEM/20% FBS к каждой скважине ранее желатина покрытием пластин.
- Аспирифицируетсредние и повторно приостанавливают фибробласты в 6 мл DMEM/20% FBS.
- Добавьте 500 зЛ фибробластной суспензии к каждой скважине (две 6-колодцовые пластины на образец/донор в общей сложности). Инкубировать клетки на ночь при 37 градусах Цельсия, 5% CO2.
- На следующий день, добавить 1 мл DMEM/20% FBS к каждой скважине. Заменяйте среду на 2 мл DMEM/20% FBS каждые 2-3 дня, пока скважины не будут сопливыми.
- Повторите раздел 2.11 для трех сливочные скважины до тех пор, пока не будет достигнут третий проход.
-
Заморозить фибробласты из сливожих скважин (проходы 1 и 3).
- Аспирируем средство из скважин и мыть один раз с 1 мл PBS.
- Диссоциатив и сбор фибробластов, как описано в шагах 2.11.4 и 2.11.5.
- Подсчитайте клетки с гемоситометром и центрифуги трубку на 350 х г в течение 5 мин.
- После центрифугирования, аспирировать средние и resuspend фибробластов в FBS с 10% DMSO при плотности 5 х 105 клеток / мл.
- Добавьте 1 мл клеточной суспензии на криовую и заморозить клетки на ночь при -80 градусов по Цельсию с помощью замораживания контейнера. Перемещай флаконы до -150 градусов по Цельсию (жидкий азот) для длительного хранения.
3. Лентивирное производство
- Выращивайте клетки HEK293T в культовой тарелке 100 мм с 10 мл полного DMEM, при 37 КС, 5% CO2,до тех пор, пока не будет достигнута нештатная выпуклость.
- На кануне трансфекции, аспирировать средний и мыть блюдо тщательно с 5 мл PBS.
- После удаления PBS, добавить 1,5 мл раствора диссоциации и инкубировать при 37 градусах Цельсия, 5% CO2 в течение 5-10 минут, чтобы отделить клетки от блюда.
ПРИМЕЧАНИЕ: Рекомендуется прогреть как PBS, так и раствор диссоциации перед использованием, чтобы клетки не страдали от теплового шока. - Инактивируйте раствор диссоциации с 3 мл полного DMEM и перенесите клеточную подвеску на коническую трубку 15 мл. Вымойте блюдо с 5 мл полного DMEM, чтобы удалить оставшиеся прикрепленные клетки и передать этот объем в 15 мл конической трубки.
- Суспензия центробежных клеток при 350 х г в течение 5 мин.
- Аспирный супернатант и равномерно расщепляйте клеточные гранулы между шестью 100-мм культовыми блюдами в окончательном объеме 10 мл полного DMEM на блюдо. Клетки должны быть примерно 60% конфлюентирования к моменту трансфекции.
- На следующий день трансфектные клетки с плазмидными смесями:
ПРИМЕЧАНИЕ: Эта часть протокола описывает производство лентивирусов в одном 100 мм ткани культуры обработанных блюдо на плазмидную смесь. Для получения более высоких объемов лентивирусного супернатанта для концентрации, используйте не менее четырех 100 мм HEK293T клеточной культуры блюд в смеси.- В 15 мл конической трубки, добавить 10 мкг из трех плазмидов передачи вместе: 3,33 мкг pFUW-tetO-GATA2 (Addgene плазмид #125028)14, 3,33 мкг pFUW-tetO-GFI1B (Addgene #125597)14 и 3,33 мкг pFUW-te #125598t 10 мкг вектора упаковки2-го поколения psPAX2, кодирующего гены Gag, Pol, Tat и Rev (Addgene #12260) и 5 мкг вектора конверта pMD2.G, кодирующего ген VSV-G (Addgene #12259). Добавьте воду до 500 л.
- В двух новых 15 мл конических труб добавить 10 мкг FUW-M2rtTA плазмида (Addgene #20342)17, 10 мкг psPAX2 упаковки вектор и 5 мкг pMD2.G конверт вектор для каждой трубки. Добавьте воду до 500 л. Одна трубка будет использоваться в качестве элемента управления.
- К каждой трубке добавляем 62,5 л 2 M CaCl2. Далее, выпустить пузыри в каждой смеси с помощью пастера вставляется в контроллер пипетки. В то время как пузырьки образуются, пипетка 500 л N,N-bis(2-гидроксиэтил)-2-аминоэтанесульфоновая кислота (BES) буферный солен (pH 7.1, 25 c), с пипеткой P1000, дроп-мудрым против пайпа Пастера и на смесь.
- Инкубировать трубки при комнатной температуре не менее 15 мин. Через некоторое время смесятся облачность.
- Между тем, аспирсредовая среда из heK293T клеточных блюд (проходима накануне) и добавить 10 мл полного DMEM без антибиотиков. Будьте осторожны и добавить среду медленно, как HEK293T клетки полу-придерживаться.
- Распределите каждую отдельную смесь (примерно 1 мл) равномерно и по-разному на отдельные блюда и инкубировать на ночь при 37 градусах Цельсия, 5% CO2.
- Замените среду на 4 мл полного DMEM, 24 ч после инкубации. Инкубировать ночь при 37 градусах Цельсия, 5% CO2. При наличии, инкубировать вместо этого при температуре 32 градуса Цельсия, 5% CO2, так как пониженная температура увеличит период полураспада лентивирусных частиц.
- Соберите супернатант с лентивирусными частицами три раза до 50 мл конической трубки. Не смешивайте различные ленцивиральные частицы в этой точке. Каждое блюдо приведет к 12 мл лентивирусного супернатанта. Четыре блюда одного и того же вирусного приготовления вписываются в одну коническую трубку 50 мл.
ВНИМАНИЕ: Выполните лентивирусную коллекцию в лаборатории уровня биобезопасности-2 в ламинарном капюшоне потока, предназначенном для лецивирной работы, и поместите вирусные загрязненные отходы (трубки, советы, посуда) в подходящий контейнер для биоопасных материалов.- Сделайте первую коллекцию 16 ч после последней инкубации и добавьте 4 мл полного DMEM. Инкубировать при 37 градусах Цельсия, 5% CO2.
- Сделайте вторую коллекцию 8 ч после первого в ту же трубку, добавьте 4 мл полного DMEM и инкубировать при 37 градусах Цельсия, 5% CO2.
- Сделайте третью коллекцию 16 ч после второй в ту же трубку и отбросить посуду.
ПРИМЕЧАНИЕ: Храните лентивирусные супернацианты при 4 градусах По Цельсию после каждой коллекции.
- Фильтр каждого lentiviral супернатант с помощью 0,45 мкм низкобелковый связывающий фильтр с клеточной ацетатной мембраны (Таблица материалов) в чистую трубку.
- Добавьте максимум 15 мл фильтровального супернатанта в центробежный фильтрсретельс с регенерированной целлюлозной мембраной(Таблица материалов)и закрутите при 4000 х г в течение 25 мин при 4 градусах Цельсия. Отбросьте поток через. В фильтровальной установке останется вязкая жидкость, содержащая лентивирусы.
- Повторите шаг 3.13, добавив 15 мл супернатанта в верхней части фильтровального блока, пока не останется больше лентивирусного супернатанта.
ПРИМЕЧАНИЕ: Когда есть только несколько миллилитров супернатанта, чтобы сконцентрироваться, уменьшить время вращения до 10 мин. Если на фильтре еще есть дополнительная жидкость (невязкая), центрифуга еще 10 мин. - Сделать аликвоты (50–200 л в зависимости от первоначального сверхнатантного объема) каждого типа концентрированных лентивирусов и хранить при уровне -80 градусов по Цельсию для длительного хранения (1–2 года) или при 4 градусах Цельсия для кратковременного хранения (1–2 недели).
ПРИМЕЧАНИЕ: Концентрированные или неконцентрированные лентивирусы также могут быть использованы свежими. Не замораживайте и не замораживайте, так как это приводит к уменьшению титера.
4. Гемогенное перепрограммирование
ПРИМЕЧАНИЕ: Используйте HDFs с номером прохождения три (P3) или выше (до P10) для выполнения экспериментов перепрограммирования.
- Пальто 100 мм ткани культуры обработанных блюдо с 5 мл 0,1% желатина и инкубировать при 37 кв кв 20 мин. Аспир оставшийся желатин овый раствор.
- Оттепель фибробластный флакон и пластины клеток в 0,1% желатина покрытием блюдо. Инкубировать ночь при 37 градусах Цельсия, 5% CO2. При необходимости расширьте фибробласты в течение более длительного периода времени до достижения желаемого прохода и стельности.
- Пальто 6-хорошо ткани культуры обработанных пластины с 500 л 0,1% желатина раствора и инкубировать при 37 градусов по Цельсию в течение 20 мин. Удалить дополнительный желатин.
- Плита HDFs при плотности 150000 клеток на пластину (25000 клеток на скважину) в 2 мл полного DMEM на скважину. Инкубировать на ночь при 37 градусах Цельсия, 5% CO2,чтобы позволить вложению клеток.
- Замените среду на 2 мл полного DMEM плюс 8 мкг/мл полибрена. Подготовьте смесь соотношения 1:1 из производимых в пуле TF лентивирусов и M2rtTA в новой микроцентрифуговой трубке.
ПРИМЕЧАНИЕ: В этом протоколе выполняется пул-производство лентивирусов для трех TFs, что, по мнению авторов, приводит к более высокой эффективности перепрограммирования. Кроме того, предлагается выполнить титрование отдельных лентивирных частиц qPCR18, на стандартной клеточной линии. Это будет использоваться для определения объема отдельных вирусов, необходимых для удовлетворения множественности инфекции (МВД), оптимальной для котрансдукции и гемогенного перепрограммирования. - Распределите от 10 до 100 л/с лентивирусной смеси на скважину, чтобы преобразовать HDF. Это день -2 перепрограммирования.
ПРИМЕЧАНИЕ: Определение оптимального объема лентивирусной смеси для эффективного перепрограммирования без ущерба для жизнеспособности клеток требует оптимизации (подробнее см. Дополнительную диаграмму 1). HDFs с более чем 7 проходами может потребовать больших объемов вирусов, чем клетки с более низкими проходами. - После 16 ч инкубации, удалить вирусы и добавить полный DMEM. Разрешить клеткам восстанавливаться в течение 6-8 ч.
- После восстановления, аспир среднего и добавить 2 мл полного DMEM с 8 мкг /мл полибрена.
- У второй трансдукции, как описано в шаге 4,6 и инкубировать на 37 градусов по Цельсию, 5% CO2 для 16 ч. Это день -1 перепрограммирования. Лентивирная смесь может быть подготовлена в день -2 для обоих трансдукций и хранится при 4 градусах Цельсия.
- На следующий день, удалить вирусы и добавить полный DMEM дополнены 1 мкг /мл DOX. Это день 0 перепрограммирования. Инкубировать при 37 градусах Цельсия, 5% CO2 на 48 ч.
-
На второй день перепрограммирования, разделить каждый хорошо на 1:2 соотношение.
- Аспирируй средние и мыть клетки с 1 мл PBS.
- Аспирировать PBS и разъединять клетки с 500 злителю диссоциационизмного раствора. Инкубировать 5-10 мин при 37 градусах Цельсия, 5% CO2.
- Инактивируйте раствор диссоциации 1 мл полного DMEM и соберите клетки в коническую трубку. Центрифуга при 350 х г в течение 5 мин.
- Приостановите пеллеты в гематопоитической среде (см. шаг 1.3), дополненный 1 мкг/мл DOX, и пластинки в новые ткани культуры обработанных 6-колодных пластин, покрытых 0,1% желатин до окончательного объема 2 мл на скважину.
- Изменение среды (гематопоиетическая среда плюс DOX) два раза в неделю в течение продолжительности перепрограммирования культур (25 дней).
- Анализ в результате перепрограммированных клеток в разных точках времени с помощью яркой или флуоресценционной микроскопии (см. Дополнительная рисунок 2), цитометрия потока, массовое и одноклеточное секвенирование РНК, и трансплантационные анализы для приобретения гематопоитической морфологии, наличие эндотелиальных и гематопогетических маркеров, приобретение эндотелиального/гематопойетического профиля экспрессии генов и регенерационной способности14.
5. Оптимизация расширения Фибробластов для анализа CHIP-seq в начале гемогенного перепрограммирования
- Плита 300,000 HDFs (Злт;P8) в 0,1% желатина покрытием ткани культуры обработанных 6-колодец пластин с полным DMEM до окончательного объема 2 мл на скважину. Инкубировать ночь при 37 градусах Цельсия, 5% CO2.
- На следующий день замените среду с полным DMEM, дополненным 8 мкг/мл полибрена.
- Преобразующие клетки с индивидуальными факторами: pFUW-tetO-FOS14,pLV-tetO-HA-GFI1B (Addgene #125599)14 и pFUW-tetO-3xFLAG-GATA2 (Addgene #125600)14 или с пулом из трех факторов, плюс FUW-M2rtTA в соотношении 1:1. Используйте общий вирус от 10–20 л (индивидуальный TF и M2rtTA или три TFs и M2rtTA). Инкубировать клетки на ночь при 37 градусах Цельсия, 5% CO2.
ПРИМЕЧАНИЕ: Рекомендуется использовать двенадцать 6-колодных пластин на одно состояние (для каждого отдельного TF и трех TFs вместе взятых). - Удалить лентивирусы и добавить полный DMEM 16 ч после первого трансдукции. Пусть клетки восстанавливаются в течение 6 х8 ч.
- Преобразуем клетки во второй раз с таким же количеством вируса на одно состояние и инкубировать при 37 градусах Цельсия, 5% CO2.
- На следующий день удалите вирусы и добавьте полный DMEM. Инкубировать при 37 градусах Цельсия, 5% CO2 на 24 ч.
- Re-пластины каждый хорошо в 0,1% желатина покрытием ткани культуры обработанных 100 мм блюдо с полным DMEM до окончательного объема 10 мл на блюдо. Это представляет собой примерно 1:6 прохода.
- Разрешить клеткам расти в течение 6 дней при 37 градусах Цельсия, 5% CO2.
- На 6-й день после повторного покрытия, аспир среднего и добавить полный DMEM с 1 мкг /мл DOX. Инкубировать клетки при 37 градусах Цельсия, 5% CO2 в течение 2 дней.
- Соберите фибробласты и проанализируйте геномные места связывания трех TFs, транскорпорированных индивидуально или в комбинации, по ChIP-seq через 2 дня после DOX добавок14.
ПРИМЕЧАНИЕ: Окончательные 72 100 мм блюда будут содержать между 20 х 106 клеток, достаточно для выполнения экспериментов ChIP-seq и репликации.
Результаты
Схематическое представление подхода перепрограммирования с использованием HDFs иллюстрируется на рисунке 1A. Фибробласты приобретаются из коммерческих источников или собираются у доноров и расширяются в пробирке до перепрограммирования. После покрытия, клетки трансумции дважды с GATA2, GFI1B и FOS (и M2rtTA) лентивирусов, и доксициклин добавляется в день 0 перепрограммирования. На второй день, клетки разделены и покрывают в гематопоитической среде до 25 дня культуры. Перепрограммированные клетки могут создаваться в разных точках времени для нескольких применений, включая трансплантацию у мышей с ослабленным иммунитетом, одноклеточное РНК-секвенирование (scRNA-seq) очищенных клеточных популяций (день 2 несортированный, день 15 CD49f день 25 CD49fиCD34- клетки), а также анализ микроскопии и цитометрии потока для маркеров поверхности клетки CD49f, CD34, CD9 и CD143. Представитель цитометрии участков показать, что 17% перепрограммированных ячеек, выражающих как CD49f и CD9(Рисунок 1B, левая панель),после 25 дней перепрограммирования. Большинство двойных положительных клеток выражают CD143 (86%), а небольшая популяция выражает CD34 (0,9%), что свидетельствует о динамической индукции гемогенной судьбы. Эти маркеры не активируются в M2rtTA трансиндуцированных HDFs культивируется в течение 25 дней(Рисунок 1B, правая панель). Иммунофлуоресценция изображения подтверждают выражение CD9 и CD143 в приверженных и круглых клеток, морфологически отличается от фибробластов, которые являются отрицательными для этих маркеров (Рисунок 1C). Человеческие гемогеные колонии также выражают CD49f и CD3414. ScRNA-seq анализ HDFs, день 2 несортированных клеток, и очищенные перепрограммированные клетки на день 15 (CD49fCD34- )и день 25 (CD49fcd34)показать пошаговое увеличение cd49f, CD9 и CD143 выражение от дня 2 до дня 25. CD49f и CD9 положительные клетки появляются сначала в процессе перепрограммирования, между днем 2 и 15, что указывает на то, что эти молекулы могут представлять маркеры раннего гемогенеза человека. Выражение CD143 начинает обнаруживаться в день 15, а CD34, выражающих клетки, обнаруживаются только в более поздние временные моменты (день 25). В качестве эталона были использованы клетки CD34- пуповинной крови (UCB).
Рисунок 2А описывает измененный протокол для генерации достаточного количества клеток для анализа CHIP-seq на начальных стадиях гемогенного перепрограммирования (день 2). Во-первых, HDFs покрываются плотностью в два раза выше, чем в стандартном протоколе (300 000 ячеек против 150 000 клеток на тарелку). После трансдукции, каждая скважина повторно покрыта в 100 мм блюдо позволяет клеткам расширяться в течение 6 дней, прежде чем дополнять среду с DOX. Клетки анализируются через 2 дня после добавления DOX и последующего выражения TF. На рисунке 2B показаны профили генома браузера GATA2, связывающиеся с геномными регулятивными регионами ITGA6 и ACE, когда клетки со-трансумции с тремя факторами (3TF) или GATA2 индивидуально. GATA2 также связывается с открытыми регионами хроматина генов CD9 и CD34 14.
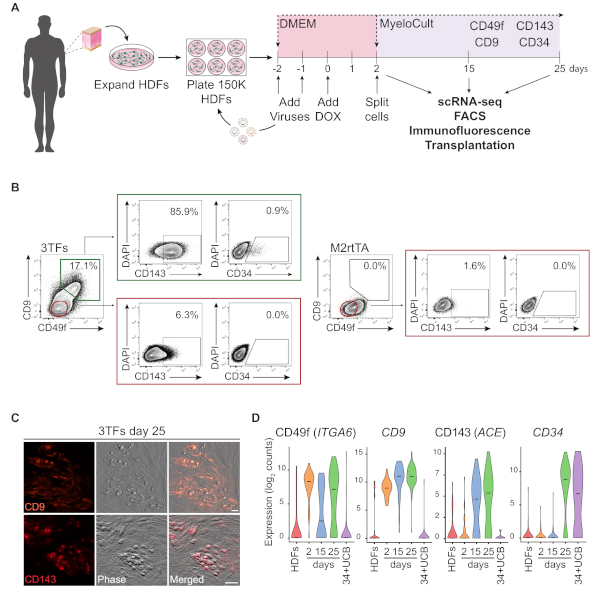
Рисунок 1: Индукция гемогенной судьбы в кожных фибробластах человека. (A) Экспериментальная стратегия гемогенного перепрограммирования кожных фибробластов человека (HDFs). Фибробласты из биопсии кожи пунш собираются у доноров, расширяются и перекрываются с помощью лентивирусов GATA2, GFI1B, FOS и M2rtTA. Доксициклин (DOX) добавляется в культуру на 0 день перепрограммирования и клетки анализируются в несколько точек времени до 25-го дня. scRNA-seq, одноклеточный РНК-секвенирование. FACS, Флуоресценция активированная сортировка клеток. (B) Стратегия Gating используемая для того чтобы оценить выражение гемогеновых/гематопоитических маркеров цитометрией потока на день 25 после transduction с 3 факторами транскрипции (3TFs). Цитометрии участки показывают процент двойных положительных клеток для CD49f и CD9, закрытые в живой клетке населения (DAPI-отрицательный). В двойном положительном населении показано выражение CD143 и CD34. HDFs, трансцированные только с вирусом M2rtTA при тех же условиях культуры используются в качестве контроля. (C) Иммунофлуоресценция изображения день 25 перепрограммированных колоний, подтверждающих выражение CD9 (верхняя панель) и CD143 (нижняя панель). Клетки были окрашены антителами(Таблица материалов) разбавленной 1:100 в PBS/2% FBS с сывороткой мыши, инкубировали 20 мин при 37 КС, 5% CO2, промывают три раза и изображения в PBS/2% FBS. Фазовый, фазовый градиентный контраст. Шкала баров 50 мкм. (D) ScRNA-seq анализ 253 клеток в разных точках времени. Выражение ITGA6, CD9, ACE и CD34 активируется во время перепрограммирования. Клетки собираются на второй день (несортированный), день 15 (CD49fиCD34- )и день 25 (CD49fиCD34). В качестве справочных данных используются hdFs и CD34- пуповинная кровь (34-UCB). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
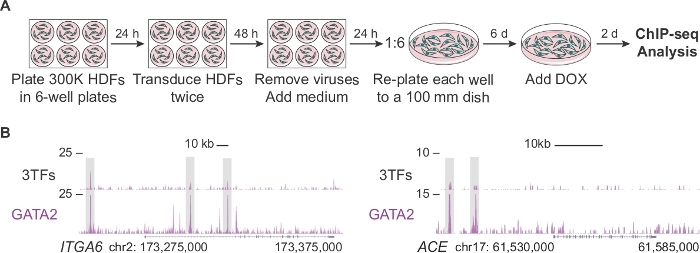
Рисунок 2: Расширение кожных фибробластов человека для анализа ChIP-seq. (A) Экспериментальная стратегия, изображающая измененный протокол для генерации большого количества трансмальных человеческих кожных фибробластов (HDFs) для ChIP-seq на второй день перепрограммирования. 300 000 клеток покрываются 6-колодными пластинами и дважды трансумциируются с помощью индивидуальных факторов (pFUW-tetO-FOS, pLV-tetO-HA-GFI1B или pFUW-tetO-3xFLAG-GATA2) или сочетанием трех факторов (плюс M2rtTA). После удаления вирусов фибробласты расширяются на шесть дней в 100 мм. Доксициклин (DOX) добавляется в день 0 и клетки собираются через два дня после добавления DOX. (B) Профили браузера генома подчеркивая GATA2-обязательные места (серые коробки) на ITGA6 и ace loci через два дня после трансдукции с тремя транскрипционными факторами (3TFs) или только с GATA2. Общее количество отображенных считываемых отображается на оси y-. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
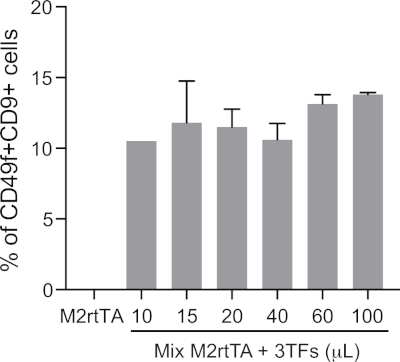
Дополнительная цифра 1: Определение оптимизированного объема лентивирных препаратов для эффективного гемогенного перепрограммирования. Для трансдуцирования кожных фибробластов (HDF) используются увеличивающиеся объемы концентрированных (10-100 кл.) пуля, производимых пулом, последующие шаги 4,5–4,12 протокола. Перепрограммированные клетки анализируются на 25-й день, чтобы определить оптимальный объем трансдукции для гемогенного перепрограммирования, учитывая процент CD49fиCD9- клетки, закрытые в живых клетках (DAPI-отрицательный). Жизнеспособность клеток может быть оценена путем количественной оценки абсолютного числа живых клеток на 25-й день. В качестве отрицательного контроля используются HDF, трансцированные с помощью M2rtTA (100 л). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Дополнительная рисунок 2: Морфология изменяется во время гемогенного перепрограммирования кожных фибробластов человека. Человеческие дермальные фибробласты культуры изображены в день первого трансдукции (день -2), когда DOX добавляется в культуры (день 0), два дня (день 2) и пятнадцать дней (день 15) после DOX добавок, и в конечной точке эксперимента (день 25). Подсвечиваются гемогенные колонии в 15 и 25 дней. Шкала баров 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
В этой статье описан метод для генерации гематопоиетических клеток-прародителей непосредственно из фибробластов человека, которые проходят через промежуточные клетки HP, подобно окончательному HSCs14.
Бассейн производства лентивирных частиц, кодирующих GATA2, GFI1B и FOS был предпочтительным по сравнению с отдельным производством, так как в наших руках это приводит к более высокой эффективности перепрограммирования (неопубликованные данные). Лентивирусы, как члены семейства Retroviridae, как правило, содержат две копии положительной одноцепочечной РНК19. Повышенная эффективность перепрограммирования может быть обусловлена упаковкой двух различных трансгенов в одной и той же лецивирусной частице, что приводит к увеличению числа клеток, связанных с тремя транскрипционными факторами. Для обеспечения успеха этого протокола необходимо преобразовать HDF с достаточным количеством вируса в зависимости от прохождения клеток, чтобы получить оптимальный баланс между эффективностью перепрограммирования и жизнеспособностью клеток, как это рекомендовано в шаге 4.6. Кроме того, можно использовать свежие неконцентрированные вирусы. Рекомендуется преобразовывать клетки с 0,5-3 мл пула 3TF и M2rtTA. Кроме того, плотность клеток должна быть скорректирована в соответствии с приложением. 150 000 HDFs на 6-ну хорошую пластину (шаг 4.4) обеспечили оптимальную плотность для выполнения FACS, трансплантации и цитометрии потока анализа перепрограммированных клеток. Для экспериментов по ChIP-seq с самого начала требовалось больше ячеек (шаг 5.1). Важно регулярно проверять клетки на наличие морфологических изменений и два раза в неделю заменять гематопоиетическую среду для поддержки появления индуцированных гематопоэтиных клеток. Добавление гематопоитических цитокинов или сокультуры в слоях фидера может повысить эффективность перепрограммирования.
С помощью этого метода мы можем определить новые гематопоитические маркеры, которые динамически выражены во время гемогенного перепрограммирования. CD9, который, как было показано, регулируется в перепрограммированных клеток на транскрипционном уровне14, быстро выражается на поверхности клетки в начальных фазах перепрограммирования вместе с CD49f и CD143, выступающей в качестве нового маркера человеческих прекурсоров HSC. Мы также показываем, что ITGA6 и ACE являются прямыми целями GATA2 на начальных этапах гемогенного перепрограммирования, в дополнение к CD9 и CD3414, обеспечивая прямую механистическую связь между гемогеной человека прекурсор фенотип и GATA2.
Одним из преимуществ этой системы является использование относительно однородных фибробластных культур. В то время как PSCs легко расширяются и поддерживаются в пробирке,протоколы дифференциации генерируют неоднородные популяции, которые включают гематопоитетические прародители, которые прививаютсявряют плохо 5,6,7. Кроме того, существует риск опухолевого генеза при пересадке ПСК полученных HSPCs, так как недифференцированные PSCs все еще может оставаться в культуре даже после использования протоколов дифференциации. Кроме того, фибробласты, прямое перепрограммирование в HSCs была применена к крови совершенных прародителей20 и эндотелиальных клеток21. Однако, начиная с крови ограниченных клеток-прародителей препятствует терапевтическое применение в результате HSCs, если пациент несет мутации, которые влияют на стволовых / прародитель гематопоитической популяции22. В случае эндотелиальных клеток, они более трудно получить по сравнению с фибробластов, и представляют собой очень неоднородной популяции клеток с точки зрения фенотипа, функции и структуры, которые являются орган-зависимых23. Другие исследования удалось перепрограммировать мыши фибробластов в привитых гематопоиетических прародителей24,25 еще, до сих пор, ни один другой протокол описывает поколение HSPC-подобных клеток из человеческих фибробластов.
Этот подход, в сочетании с фармакологическим ингибированием, генным нокаутом, или нокдаун позволяет определить индивидуальные или комбинации факторов, которые необходимы для непосредственного стимулирования человека HSCs. Технологии CRISPR-Cas9 в HDF до перепрограммирования представляют собой захватывающую попытку определить новые регуляторы человеческого окончательного гематоподия. В будущем, перепрограммирование не связанных с кровью типов клеток человека, таких как фибробласты будет служить в качестве платформы для создания здоровых пациентов с учетом гематопоиетических клеток-прародителей для клинического применения.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Фонд Кнута и Алисы Валленберг, медицинский факультет Лундского университета и региона Сконе признаны за щедрую финансовую поддержку. Эта работа была поддержана грантом от Olle Engkvists Stiftelse (194-0694 Филипе Перейра) и стипендии PhD от Фунданьо пара Ci'ncia электронной Tecnologia (PTDC/BIM-MED/0075/2014 Филипе Перейра, и SFRH/BD/135725/2018 и SFRH/BD/51968/2012 Рите Алвес и Андрея Гомеша). Это исследование было также поддержано средствами от NIH и NYSTEM (1R01HL119404 и C32597GG к Kateri A. Moore).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.45 μm low-protein binding filter, 150 mL Bottle Top Vacuum Filter | Corning | #430625 | |
| 2-Mercaptoethanol | Sigma-Aldrich | #M6250 | |
| Alexa Fluor 488 anti-human CD34 clone 581 | BioLegend | #343518 | |
| BD Pharmingen APC Mouse Anti-Human Angiotensin Converting Enzyme (CD143) clone BB9 | BD Biosciences | #557929 | |
| BES buffered saline | Sigma-Aldrich | #14280 | |
| Calcium chloride (CaCl2) | Sigma-Aldrich | #449709 | |
| Centrifugal filter unit, Amicon Ultra-15 Centrifugal Filter Unit | Sigma-Aldrich | #UFC903096 | |
| Dissociation solution, TrypLE Express Enzyme (1x) no phenol red | Gibco | #12604-021 | |
| Doxycycline hyclate (DOX) | Sigma-Aldrich | #D9891 | |
| eBioscience CD49f (Integrin alpha 6) Monoclonal Antibody (eBioGoH3 (GoH3)), PE-Cyanine7 | Invitrogen | #25-0495-82 | |
| FUW-M2rtTA | Addgene | #20342 | |
| Gelatin from Porcine Skin Type A | Sigma-Aldrich | #G1890 | |
| Gibco L-Glutamine (200 mM) | ThermoFisher Scientific | #25030-024 | |
| Gibco MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | #11140-035 | |
| Hematopoietic medium, MyeloCult H5100 | STEMCELL Technologies | #05150 | |
| Hexadimethrine bromide (polybrene) | Sigma-Aldrich | #H9268 | |
| Human Dermal Fibroblasts (HDFs) | ScienCell | #2320 | |
| HyClone Dulbecco's Modified Eagles Medium (DMEM) | GE Healthcare | #SH30243.01 | |
| HyClone Fetal Bovine Serum (FBS) | GE Healthcare | #SV30160.03 | |
| HyClone Penicillin Streptomycin 100x Solution (Pen/Strep) | GE Healthcare | #SV30010 | |
| HyClone Phosphate Buffered Saline solution (PBS) | GE Healthcare | #SH30256.01 | |
| Hydrocortisone | STEMCELL Technologies | #7904 | |
| Mouse serum | Sigma-Aldrich | #M5905 | |
| PE anti-human CD9 Antibody clone HI9a | BioLegend | #312105 | |
| pFUW-tetO-3xFLAG-GATA2 | Addgene | #125600 | |
| pFUW-tetO-FOS | Addgene | #125598 | |
| pFUW-tetO-GATA2 | Addgene | #125028 | |
| pFUW-tetO-GFI1B | Addgene | #125597 | |
| pLV-tetO-HA-GFI1B | Addgene | #125599 | |
| pMD2.G | Addgene | #12259 | |
| psPAX2 | Addgene | #12260 |
Ссылки
- Ivanovs, A., et al. Highly potent human hematopoietic stem cells first emerge in the intraembryonic aorta-gonad-mesonephros region. Journal of Experimental Medicine. 208, 2417-2427 (2011).
- Tavian, M., Biasch, K., Sinka, L., Vallet, J., Péault, B. Embryonic origin of human hematopoiesis. International Journal of Developmental Biology. 1065, 1061-1065 (2010).
- Medvinsky, A., Rybtsov, S., Taoudi, S. Embryonic origin of the adult hematopoietic system: advances and questions. Development. 138, 1017-1031 (2011).
- Ivanovs, A., et al. Human haematopoietic stem cell development: from the embryo to the dish. Development. 144, 2323-2337 (2017).
- Daniel, M. G., Pereira, C. F., Lemischka, I. R., Moore, K. A. Making a Hematopoietic Stem Cell. Trends in Cell Biology. 26, 202-214 (2016).
- Vo, L., Daley, G. De novo generation of HSCs from somatic and pluripotent stem cell sources. Blood. 125, 2641-2648 (2015).
- Rafii, S., et al. Human ESC-derived hemogenic endothelial cells undergo distinct waves of endothelial to hematopoietic transition. Blood. 121, 770-781 (2013).
- Ebina, W., Rossi, D. J. Transcription factor-mediated reprogramming toward hematopoietic stem cells. EMBO Journal. 34, 694-709 (2015).
- Sugimura, R., et al. Haematopoietic stem and progenitor cells from human pluripotent stem cells. Nature. 545, 432-438 (2017).
- Pereira, C. F., et al. Induction of a Hemogenic Program in Mouse Fibroblasts. Cell Stem Cell. 13, 205-218 (2013).
- Pereira, C. F., et al. Hematopoietic Reprogramming In vitro Informs In Vivo Identification of Hemogenic Precursors to Definitive Hematopoietic Stem Cells. Developmental Cell. 36, 525-539 (2016).
- Notta, F., et al. Isolation of Single Human Hematopoietic Stem Cells Capable of Long-Term Multilineage Engraftment. Science. 333, 218-221 (2011).
- Sinka, L., Biasch, K., Khazaal, I., Péault, B., Tavian, M. Angiotensin-converting enzyme (CD143) specifies emerging lympho-hematopoietic progenitors in the human embryo. Blood. 119, 3712-3724 (2012).
- Gomes, A. M., et al. Cooperative Transcription Factor Induction Mediates Hemogenic Reprogramming. Cell Reports. 25, 2821-2835 (2018).
- Karlsson, G., et al. Report The Tetraspanin CD9 Affords High-Purity Capture of All Murine Hematopoietic Stem Cells. Cell Reports. 4, 642-648 (2013).
- Leung, K. T., et al. The tetraspanin CD9 regulates migration, adhesion, and homing of human cord blood CD34+ hematopoietic stem and progenitor cells. Blood. 117, 1840-1851 (2011).
- Hockemeyer, D., et al. A drug-inducible system for direct reprogramming of human somatic cells to pluripotency. Cell Stem Cell. 3, 346-353 (2008).
- Kutner, R. H., Zhang, X., Reiser, J. Production concentration and titration of pseudotyped HIV-1-based lentiviral vectors. Nature Protocols. 4, 495-505 (2009).
- Suzuki, Y. S., Suzuki, Y., Ke, X. Gene Regulatable Lentiviral Vector System. Viral Gene Therapy. , (2011).
- Riddell, J., et al. Reprogramming committed murine blood cells to induced hematopoietic stem cells with defined factors. Cell. 157, 549-564 (2014).
- Lis, R., et al. Conversion of adult endothelium to immunocompetent haematopoietic stem cells. Nature. 545, 439-445 (2017).
- Pereira, C., Lemischka, I. R., Moore, K. From blood to blood’: de-differentiation of hematopoietic progenitors to stem cells. EMBO Journal. 33, 1511-1513 (2014).
- Nolan, D. J., et al. Molecular Signatures of Tissue-Specific Microvascular Endothelial Cell Heterogeneity in Organ Maintenance and Regeneration. Developmental Cell. 26, 204-219 (2013).
- Batta, K., Florkowska, M., Kouskoff, V., Lacaud, G. Direct Reprogramming of Murine Fibroblasts to Hematopoietic Progenitor Cells. Cell Reports. 9, 1871 (2014).
- Cheng, H., et al. Reprogramming mouse fibroblasts into engraftable myeloerythroid and lymphoid progenitors. Nature Communications. 7, 1-15 (2016).
Erratum
Formal Correction: Erratum: Hemogenic Reprogramming of Human Fibroblasts by Enforced Expression of Transcription Factors
Posted by JoVE Editors on 12/03/2019. Citeable Link.
An erratum was issued for: Hemogenic Reprogramming of Human Fibroblasts by Enforced Expression of Transcription Factors. The author affiliations were updated.
The second author affiliation was updated from:
2Wallenberg Center for Molecular, Lund University
to:
2Wallenberg Center for Molecular Medicine, Lund University
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены