Method Article
転写因子の強制発現によるヒト線維芽細胞のヘモジェニックリプログラミング
Erratum Notice
要約
このプロトコルは、血球性幹および前駆細胞を生成する転写因子GATA2、GFI1BおよびFOSの強制発現によるヒト皮膚線維芽細胞における血球形成プログラムの誘導を示す。
要約
ヒト造血幹細胞(HSC)の仕様の基礎となる細胞および分子機構は、依然として不可解である。インビトロでヒトHSCの出現を再現するための戦略は、この複雑な発達過程を研究する際の限界を克服するために必要とされる。ここでは、直接細胞リプログラミングアプローチを採用したヒト皮膚線維芽細胞から造血幹および前駆細胞を生成するプロトコルについて説明する。これらの細胞は、HSC仕様の内皮から造血転移(EHT)特性に似た造血中間細胞型を通過する。線維芽細胞は、GATA2、GFI1BおよびFOS転写因子を用いた形質転換を介して血球に再プログラムされた。この3つの因子の組み合わせは、形態学的変化、造血および造血マーカーの発現および動的EHT転写プログラムを誘発した。再プログラムされた細胞は造血前駆虫を生成し、免疫不全マウスを3ヶ月間再び生息させる。このプロトコルは、リプログラミングの初期段階でGATA2ターゲットを定義することにより、ここで例示されるようにヒトEHTプロセスの機械的解剖に向けて適応させることができる。したがって、ヒトヘモジェニックリプログラミングは、ヒトHSC出現の新規マーカーおよびレギュレータを同定するためのシンプルでトラクタブルなアプローチを提供する。将来的には、線維芽細胞における血球形成運命の忠実な誘導は、移植のための患者特異的HSCの生成につながる可能性がある。
概要
決定的造血幹細胞および前駆細胞(HSPC)は、大動脈性ゴナド・メソネフロス(AGM)領域および造血能を有する内皮前駆体から胎盤に出現し、内皮から造血性転移(EHT)1を通じて、 2.血原性前駆体(HPs)は内皮マーカーと造血マーカーの両方を発現するが、その正確な同定は、特にヒトシステムにおいては依然として不明瞭である。哺乳類では比較的保存されたプロセスであるにもかかわらず、造血幹細胞(HSC)の発達は依然としてヒトとマウスモデル3、4の間で有意に異なる。したがって、ヒトHSC開発を再現するためのin vitroアプローチが必要である。
HSCに対する多能性幹細胞(PSC)の分化は、有望であるものの、過去20年間で限られた成功を収めており、主に利用可能な分化プロトコルによるもので、原始造着前駆体は生着不良である能力5,6,7.あるいは、直接細胞リプログラミング手法が適用され、転写因子(TF)8、9を用いて複数の細胞型からHSPC様細胞を生成する。特に、3つのTの過剰発現は、Gata2、Gfi1bおよびcFos、定義された表現型(Prom1+Sca-1+CD34+CD45-)10を有するHP中間体を介してHSPCにマウス胚性線維芽細胞を変換した。このプロセスは、決定的造形の指定中に胚および胎盤で発生するEHTに似た。この表現型は、短期培養およびノッチ活性化後に連続移植可能なHSC11を生成したマウス胎盤中のHPの集団の同定および単離を可能にした。
これまでのところ、ヒトHSCと前駆体を区別する表現型は確立されていないが、一部の分子は新興のHSCで発現することが知られている。HSCコンパートメント12内の細胞、およびアンジオテンシン変換酵素(ACEまたはCD143)は、胚性血液形成組織13においてCD34陰性造血前駆体中に存在する。
最近、我々は、3つのTF、GATA2、FOSおよびGFI1Bのヒトバージョンが、短期生着能力14を有するヒト皮膚線維芽細胞(HDF)をハフスに再プログラムすることを実証した。リプログラミングの初期段階では、GATA2はオープンクロマチンに従事し、GFI1BとFOSを募集して線維芽細胞遺伝子を抑制し、内皮および造血遺伝子を活性化します。誘導細胞はCD49fおよびACEを高度に発現し、かつHSPCマーカーCD34を発現する細胞の割合が少ない。HSC15で発現し、HSCホーミング16にとって重要であるCD9遺伝子は、GATA2の直接的な標的であり、再プログラムされた細胞14において最もアップ調節された遺伝子の中でも示された。したがって、CD9は、ヒト決定的造耳のHのための追加マーカーを構成し得る。
このプロトコルでは、GATA2、GFI1BおよびFOSの強制発現を通じたヒト線維芽細胞からのHSPC様細胞の生成と、クロマチン免疫沈降(ChIP)シーケンシング(seq)の開始時の適応方法について説明する。リプログラミング。TFをテトラサイクリン応答要素(TRE)と最小限のCMVプロモーターを含むドキシサイクリン(DOX)誘導性レンチウイルスベクター(pFUW-tetO)でコード化し、逆テトラサイクリンを含む構成ベクターと共に形質転換した。トランスアクティベータータンパク質(pFUW-M2rtTA)。DOX(テトラサイクリンのアナログ)を導入後に添加すると、TF転写を可能にするTRE(Tet-Onシステム)と相互作用するrtTAタンパク質に結合します。この手順が完了するまでに 25 日かかります。ChIP-seq実験では、GATA2(pFUW-tetO-3xFLAG-GATA2)およびGFI1B(pLV-tetO-HA-GFI1B)のタグ付きバージョンを用いてHDFをトランスジェクションし、さらにpFUW-tetO-FOSおよびTF結合部位をDOX補充の2日後に分析した。
最終的に、ヒト線維芽細胞の血原リプログラミングは、ヒト発達造血の基礎となるメカニズムを研究する体外トラクタブルシステムと、将来の臨床応用のための患者特異的HSPCの潜在的な供給源を提供する。
プロトコル
このプロトコルは、ルンド大学の人間研究倫理委員会のガイドラインに従って行われ、個々の制度ガイドラインに従って行われるべきです.
1. 試薬調製
- ダルベッコの修飾イーグル培地(DMEM)/20%胎児ウシ血清(FBS)の場合、20%FBS、1%ペニシリンストレプトマイシン(ペン/ストレップ)、1%L-グルタミン、1%非必須アミノ酸および10-4-M-2-でピルビン酸ナトリウムを含有する高グルコースDMEMを混合する。メルカプトエタノール。
- 完全なDMEMの場合は、10%FBS、1%ペン/ストレップ、1%L-グルタミンを含む高グルコースDMEMを混合します。
- 造血培地の場合は、造血培地(材料表)を10-6Mのヒドロコルチゾンと1%ペン/ストレップと混合します。
- カルシウムやマグネシウムを含まないリン酸緩衝生理食塩水(PBS)を使用してください。
2. ヒト皮膚線維芽細胞分離
注:HDFは、認定サプライヤー(材料表)から購入することができます。その場合は、線維芽細胞を展開し、リプログラミング実験で直接使用します(セクション4)。あるいは、HDFをドナーから分離することもできる。線維芽細胞が異なるドナーから分離されている場合は、プロトコルのすべてのステップでサンプルを互いに分離しておきます。各ドナーの識別番号を持つラベルプレート/井戸と回収チューブ。
- 資格のある医師が行う3mmラウンドスキンパンチ生検からHDFを取得します。
- 0.1%ゼラチンの500 μLで組織培養処理された6ウェルプレートの3つのウェルをコーティングし、37°Cで20分間インキュベートする。
- 残りのゼラチン溶液を吸引し、DMEM/20%FBSの750 μLを各ウェルに加えます。井戸の全面は媒体で覆われるべきである。
- 無菌の100mmペトリ皿蓋の内面にDMEM/20%FBSの1.5 mLを追加し、5 mLの血清学的ピペットの助けを借りてドロップを広げます。
- 皮膚生検を殺菌鉗子でふたの媒体に入れる。
- 皮膚生検を9つの同一の切片に解剖し、1つの殺菌されたメスを使用して生検を所定の場所に保持し、2番目のメスを切断する。
- 尖った鉗子を使用して、井戸ごとに3つの生検片を配置します。井戸の底に取り付ける部分を確認してください。
- ピースの上に22ミリメートルのカバースリップを敷き、いくつかの圧力をかけます。
- プレートを37°C、5%CO2で1週間インキュベートします。細胞を毎日チェックし、蒸発した媒体を交換するために2日ごとに200 μLのDMEM/20%FBSを加えます。
- 1 週間後、DMEM/20% FBS を最大 2 mL 追加し、2 ~3 日ごとにメディアを交換します。
-
井戸がコンフルエントである場合1:4の比率で通過細胞(約4−8週間)。
- 0.1%ゼラチンコーティングされた組織培養処理された6ウェルプレートを調製する。
- 80%のコンフルエンスで井戸から吸引媒体を吸引し、PBSの1 mLで一度洗浄する。
- 滅菌鉗子でカバースリップを取り外し、カバースリップをティッシュ側を上にして6ウェルプレートの新しい井戸に入れます。
注:カバースリップに取り付けられたままのセルも収穫されます。 - ウェルあたり解離溶液(材料表)を500μL加え(カバーリップ付きのウェルを含む)、37°Cでインキュベートし、5-10分で5%CO2をインキュベートする。各井戸に500 μLのDMEM/20%FBSを追加します。
- すべての井戸から15 mL円錐形チューブに線維芽細胞を収集します。残りの細胞を収集するために井戸に余分な媒体を追加します。チューブを350 x gで5分間遠心分離します。
- その間に、以前にゼラチンコーティングされたプレートの各ウェルに500 μLのDMEM/20%FBSを加えます。
- 吸引媒体およびDMEM/20%FBSの6 mLの線維芽細胞を再中断する。
- 各ウェルに500μLの線維芽球懸濁液を加えます(サンプル/ドナーあたり6ウェルプレートを合計2枚)。細胞を37°Cで一晩インキュベートし、5%CO2.
- 翌日、各井戸にDMEM/20%FBSを1mL加えます。ウェルが80%のコンフルエントになるまで、2~3日ごとに2mLのDMEM/20%FBSにメディアを交換してください。
- 3 番目の通路に到達するまで、3 つのコンフルエント ウェルに対してセクション 2.11 を繰り返します。
-
コンフルエントウェル(通路1および3)から線維芽細胞を凍結する。
- ウェルから吸引媒体を吸引し、PBSの1 mLで一度洗浄する。
- ステップ2.11.4および2.11.5に記載されているように、関連解解除し、線維芽細胞を収集する。
- ヘモサイトメーターで細胞を数え、350 x gでチューブを5分間遠心分離します。
- 遠心分離後、吸引媒体および5x 105細胞/mLの密度で10%DMSOでFBS中の線維芽細胞を再吸引する。
- 凍結容器を使用して、凍結毎に細胞懸濁液を1mL加え、-80°Cで一晩細胞を凍結する。バイアルを-150°C(液体窒素)に移動して長期保存します。
3. レンチウイルス生産
- 完全なDMEMの10 mLで100ミリメートルの組織培養処理皿でHEK293T細胞を成長させ、37°、5%CO2で、コンフルエンスに達するまで。
- トランスフェクションの前日に、培地を吸引し、5mLのPBSで丁寧に洗います。
- PBSを取り除いた後、解離溶液を1.5mL加え、37°Cでインキュベートし、5~10分間5%CO2で培養し、皿から細胞を解離します。
注:細胞が熱ショックを受けないように、使用前にPBSと解離液の両方を温めることをお勧めします。 - 完全なDMEMの3 mLで解離溶液を不活性化し、細胞懸濁液を15 mL円錐管に移す。完全なDMEMの5 mLで皿を洗い、残りの付着した細胞を取り除き、このボリュームを15 mL円錐管に移します。
- 遠心分離機細胞懸濁液を350 x gで5分間。
- 上清を吸引し、6つの100ミリメートルの組織培養処理された皿の間で細胞ペレットを均等に分割し、1皿あたり10mLの最終容積で処理した。細胞は、トランスフェクションの時までに約60%のコンフルエントでなければなりません。
- 翌日、プラスミドを有するトランスフェクト細胞は以下のように混合する。
注:プロトコルのこの部分は、プラスミドミックスあたり1つの100ミリメートルの組織培養処理皿におけるレンチウイルスの産生を記述する。濃縮のためのより多くのレンチウイルス上清を得るために、少なくとも4つの100 mm HEK293T細胞培養皿を1ミックス当たり使用する。- 15 mL円錐形チューブに3つの転写プラスミドの10μgを加え#125598pFUW-tetO-GATA2(#125028#125028のアドジーンプラスギド)、3.33μg(アドジーン#125597)、3.33μgのpFUW-teo-teO-14を加えたもの(14#125598 第2世代psPAX2包装ベクターの10μgは、GAG、Pol、TatおよびRev遺伝子(#12260添加)およびVSV-G遺伝子をコードするpMD2.Gエンベロープベクターの5μg(Addgene #12259)をコードする。 500°Lまでの水を加えます。
- 2つの新しい15 mL円錐チューブに、FUW-M2rtTAプラスミド(アズジーン#20342)17、psPAX2包装ベクターの10μg、pMD2.Gエンベロープベクトルの5μgを各チューブに追加します。500°Lまでの水を加えます。1本のチューブをコントロールとして使用する予定です。
- 各チューブに2 M CaCl2の62.5 μLを追加します。次に、ピペットコントローラに挿入されたパスツールピペットを使用して、各混合物に気泡を放出します。気泡が形成されている間、ピペット500μLのN,N-ビス(2-ヒドロキシエチル)-2-アミノエタンスルホン酸(BES)緩衝生理活性酸塩(pH 7.1,25°)を、P1000ピペットと共に、パスツールピペットに対してドロップワイズし、混合物に当てる。
- 少なくとも15分間室温でチューブをインキュベートする。混合物は、しばらくするとわずかに曇って表示されます。
- 一方、HEK293T細胞皿から吸引媒体(前日に通過)し、抗生物質なしで完全なDMEMの10 mLを追加する。HEK293T細胞は半密着性を持つため、注意してゆっくりと培地を追加してください。
- 個々の混合物(約1mL)を均等に分散し、別々の皿に滴下し、37°、5%CO2で一晩インキュベートする。
- 培地を完全なDMEMの4 mL、インキュベーション後24時間に交換してください。37°で一晩インキュベートし、5%CO2.利用可能な場合は、代わりに32°C、5%CO2でインキュベートし、温度を下げるとレンチウイルス粒子の半減期が増加します。
- レンチウイルス粒子で上清を3回集めて50mL円錐管にする。この時点で異なるレンチウイルス粒子を混ぜないでください。各料理はレンチウイルス上清の12 mLをもたらす。同じウイルス製剤の4つの皿は1つの50 mL円錐形の管に合う。
注意:レンチウイルスの仕事専用の層流フードでバイオセーフティレベル2の実験室でレンチウイルス収集を行い、ウイルス汚染廃棄物(チューブ、チップ、皿)をバイオ危険物の適切な容器に入れます。- 最後のインキュベーションの後に最初のコレクション 16 時間を実行し、完全な DMEM の 4 mL を追加します。37 °C でインキュベート, 5% CO2.
- 同じチューブに最初の後に2番目のコレクション8 hを行い、完全なDMEMの4 mLを追加し、37°、5%CO2でインキュベートする。
- 同じチューブに2番目の後に3番目のコレクション16時間を行い、皿を捨てます。
注:各収集後4°Cでレンチウイルス上清を保管してください。
- 0.45μmの低タンパク質結合フィルターを酢酸セルロース膜(材料表)でクリーンチューブに用いて、各レンチウイルス上清を濾過します。
- 再生セルロース膜(材料表)を備えた遠心フィルターユニットに最大15mLの濾過上清を加え、45分間4,000 x gでスピンします。フロースルーを破棄します。レンチウイルスを含む粘性液体は、フィルターユニットに残ります。
- フィルタユニットの上に15mLの上清を加えてステップ3.13を繰り返し、レンチウイルス上清が残らなくなるまで。
注:濃縮する上清がわずか数ミリリットルしかない場合は、紡糸時間を10分に減らす。フィルターにまだ余分な液体(非粘性)がある場合は、さらに10分間遠心分離機。 - 濃縮レンチウイルスの各タイプのアリコート(初期上清量に応じて50~200°L)を作り、長期保存(1~2年)の場合は-80°C、短期保存用は4°C(1~2週間)に保存します。
注:濃縮または非濃縮レンチウイルスも新鮮に使用することができる。この結果、小人が減少するので、再凍結して解凍しないでください。
4. ヘモジェニックリプログラミング
注:3つ以上の通過番号(P3)以上(P10まで)のHDFを使用して、リプログラミング実験を実行します。
- 100mm組織培養処理皿を5mL0.1%ゼラチンでコーティングし、残りのゼラチン溶液を吸引して37°Cでインキュベートします。
- 0.1%ゼラチンコーティングされた皿の線維芽細胞バイアルとプレート細胞を解凍します。37°で一晩インキュベートし、5%CO2.必要に応じて、所望の通路と合流性に達するまで、線維芽細胞を長期間拡大する。
- 6ウェル組織培養処理プレートを500μLの0.1%ゼラチン溶液でコーティングし、37°Cで20分間インキュベートします。
- プレートごとに 150,000 セル (ウェルあたり 25,000 セル) の密度でプレート HDF を 2 mL のウェルあたりの完全な DMEM で構成します。37°、5%CO2で一晩インキュベートし、細胞付着を可能にする。
- 中型を完全なDMEM+8μg/mLポリブレンの2 mLに交換してください。新しいマイクロ遠心管にプール生産TFレンチウイルスとM2rtTAの1:1比ミックスを準備します。
注:このプロトコルでは、3つのTFに対するレンチウイルスのプール生産が行われ、著者の手では、より高いリプログラミング効率をもたらす。あるいは、qPCR18によって個々のレンチウイルス粒子の滴定を行うことが提案され、標準的な細胞株上で行うことが示唆される。これは、共伝達および血原リプログラミングに最適な感染(MOI)の多重度を満たすために必要な個々のウイルスの量を定義するために使用されます。 - ウェルあたり10~100μLのレンチウイルス混合物を配り、HDFをトランスデュースします。これは、リプログラミングの -2 日目です。
注:効率的なリプログラミングのためのレンチウイルスミックスの最適なボリュームを定義するには、細胞の生存率を損なうことなく、最適化が必要です(詳細については補足図1を参照)。7 箇所を超える HDF は、より低い通路を持つ細胞よりも大量のウイルスを必要とする可能性があります。 - 16 時間のインキュベーションの後、ウイルスを除去し、完全な DMEM を追加します。セルが 6 ~8 時間回復できるようにします。
- 回収後、吸引媒体を加え、8μg/mLポリブレンを用いて完全なDMEMを2mL加えた。
- ステップ4.6に記載の2回目の伝達を行い、37°でインキュベートし、16時間5%CO2を行います。これは、リプログラミングの -1 日目です。レンチウイルスミックスは、両方の伝達のために-2日目に調製することができ、4°Cに保つことができます。
- 翌日、ウイルスを除去し、1 μg/mL DOX を補完する完全な DMEM を追加します。これは、リプログラミングの 0 日目です。37°Cでインキュベートし、48時間5%CO2。
-
リプログラミングの2日目に、それぞれ1:2の比率でウェルを分割します。
- 吸引媒体と1mLのPBSで細胞を洗浄する。
- 500 μL の解離溶液を用いてPBSおよび解離細胞を吸引する。37 °Cで 5−10分、5% CO2をインキュベートする。
- 完全なDMEMの1 mLで解離溶液を不活性化し、円錐形チューブに細胞を収集します。350 x gで 5 分間遠心分離。
- 造血培地(ステップ1.3を参照)でペレットを再スマードし、1μg/mL DOXで補充し、0.1%ゼラチンでコーティングされた新しい組織培養処理6ウェルプレートにプレートセルをウェルあたり2mLの最終体積にします。
- リプログラミング培養の期間(25日間)に週2回培地(造血培地+DOX)を変更する。
- 明視野または蛍光顕微鏡(補足図2参照)、フローサイトメトリー、バルクおよび単細胞RNAシーケンシング、および取得のための移植アッセイによって、異なる時点で結果として生じた再プログラムされた細胞を分析する造血形態,内皮および造血マーカーの存在,内皮/造血遺伝子発現プロファイルおよび再生能力14の取得
5. ヘモジェニックリプログラミング発症時のChIP-seq解析のための線維芽細胞拡張の最適化
- プレート 300,000 HDF (
- 翌日、培地を8μg/mLポリブレンを補充した完全なDMEMに交換してください。
- 個々の因子を有するトランスデュース細胞:pFUW-tetO-FOS 14、pLV-tetO-HA-GFI1B(#125599付き)14およびpFUW-tetO-3xFLAG-GATA2(アドジーン#125600)14または3つの因子のプールを有する、1:1の比率でFUW-M2rtTA。10−20°L合計ウイルス(個々のTF + M2rtTAまたは3つのTF + M2rtTA)を使用します。細胞を37°Cで一晩インキュベートし、5%CO2.
注:条件ごとに 12 個の 6 ウェル プレートを使用することをお勧めします (個々の TF と 3 つの TF を組み合わせて使用します)。 - レンチウイルスを除去し、最初の導入後に完全なDMEM 16時間を追加します。細胞を6−8時間回復させます。
- 細胞を状態ごとに同じ量のウイルスで2回目にトランスデュースし、37°、5%CO2でインキュベートする。
- 翌日にウイルスを削除し、完全なDMEMを追加します。37°Cでインキュベートし、24時間5%CO2。
- 各ウェルを0.1%ゼラチンコーティングされた組織培養処理100mm皿に、完全なDMEMを1皿あたり10mLの最終容積に再プレートします。これは約1:6の通路を表します。
- 細胞が37°で6日間増殖することを可能にし、5%CO2.
- 再めっき後の6日目に、吸引媒体を吸引し、1μg/mL DOXで完全なDMEMを追加します。細胞を37°Cでインキュベートし、5%CO2を2日間行う。
- 線維芽細胞を収集し、DOX補充14の2日後にChIP-seqによって、個別または組み合わせて誘導された3つのTFのゲノム結合部位を分析する。
注:最後の72個の100 mm皿には20-50 x 106セルの間に含まれ、ChIP-seqの実験と複製を行うのに十分です。
結果
HDF を使用したリプログラミングアプローチの概略図を図1Aに示します。線維芽細胞は、商業的なソースから取得されるか、ヒトドナーから収集され、リプログラミングの前にインビトロで拡大されます.めっき後、細胞はGATA2、GFI1BおよびFOS(およびM2rtTA)レンチウイルスで2回形質転換され、再プログラミングの0日目にドキシサイクリンが添加される。2日目には、培養25日目まで造血培地で細胞を分割してめっきする。再プログラムされた細胞は、免疫不全マウスにおける移植、精製細胞集団の単細胞RNAシーケンシング(scRNA-seq)(2日目未分類、15日目CD49f+CD34およびCD34および25日目 CD49f+CD34+細胞)、ならびに細胞表面マーカーCD49f、CD34、CD9およびCD143の顕微鏡およびフローサイトメトリー分析。代表的なサイトメトリープロットは、25日間のリプログラミング後にCD49fとCD9の両方を発現する再プログラムされた細胞の約17%を示す(図1B、左パネル)。二重陽性細胞の大部分はCD143(〜86%)を発現し、かつ小集団発現CD34(0.9%)は、動的なヘモジェニック運命誘導を示唆している。これらのマーカーは、25日間培養したM2rtTA形質動HDFでは活性化されません(図1B、右側パネル)。免疫蛍光画像は、接着細胞および丸細胞におけるCD9およびCD143の発現を確認し、これらのマーカーに対して陰性である線維芽細胞と形態学的に異なる(図1C)。ヒトヘモジェニックコロニーはまた、CD49fおよびCD3414を発現する。HDFのScRNA-seq分析は、2日目の未分類細胞、および精製再プログラムされた細胞を15日目(CD49f+CD34-)および25日目(CD49f+ CD34+)で精製し、2日目から25日目までのCD49f、CD9およびCD143発現の段階的な増加を示す。CD49fおよびCD9陽性細胞は、リプログラミングプロセス中に最初に現れ、2日目から15日目の間に、これらの分子が初期ヒトヘモジェネシスのマーカーを表し得る可能性があることを示す。CD143発現は15日目に検出され始め、CD34発現細胞は後の時点(25日目)にのみ検出される。CD34+臍帯血(UCB)細胞を基準として用いた(図1D)。
図2Aは、ヘモジェニックリプログラミングの初期段階でChIP-seq分析のための十分な数の細胞を生成する改変プロトコルを記載している(2日目)。まず、HDFは標準プロトコルの2倍高い密度でめっきされます(300,000セル対プレートあたり150,000セル)。形質導入後、各ウェルを100mm皿に再めっきし、DOXで培地を補充する前に細胞を6日間拡張させる。細胞は、DOXと結果のTF発現を追加した2日後に分析されます。図2Bは、細胞が3つの因子(3TF)またはGATA2と個別に共に形質転換される場合のITGA6およびACEのゲノム調節領域に結合するGATA2のゲノムブラウザプロファイルを示す。GATA2はまた、CD9およびCD34遺伝子14のオープンクロマチン領域に結合する。
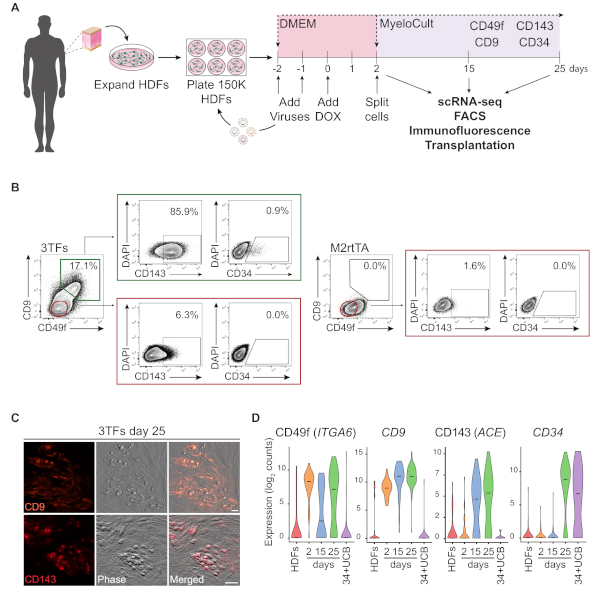
図1:ヒト皮膚線維芽細胞における出血性運命の誘導(A)ヒト皮膚線維芽細胞(HDF)のヘモジェニックリプログラミングのための実験戦略皮膚パンチ生検からの線維芽細胞は、ドナーから収集され、GATA2、GFI1B、FOSおよびM2rtTAレンチウイルスで拡張および形質転換される。ドキシサイクリン(DOX)は、リプログラミングの0日目に培養物に添加され、細胞は25日目までいくつかの時点で分析される。scRNA-seq,単一細胞RNAシーケンシング。FACS、蛍光活性化細胞選別。(B)3つの転写因子(3TF)を有する転移後25日目のフローサイトメトリーによる血原性/造血マーカーの発現を評価するために用いられるゲーティング戦略。サイトメトリープロットは、CD49fおよびCD9の二重陽性細胞のパーセンテージを示し、生細胞集団(DAPI陰性)にゲートする。二重陽性集団内では、CD143およびCD34の発現が示される。同じ培養条件下でM2rtTAウイルスのみを吹き込んだHDFが制御として用いられる。(C)CD9(上部パネル)およびCD143(下部パネル)の発現を確認する25日目の再プログラムコロニーの免疫蛍光画像。細胞をマウス血清でPBS/2%FBSで1:100希釈した抗体(材料表)で染色し、37°で20分間インキュベートし、5%CO2を、3回洗浄し、PBS/2%FBSで画像化した。位相、位相勾配コントラスト。スケールバー = 50 μm. (D) 異なる時点での253細胞のScRNA-seq分析。ITGA6、CD9、ACEおよびCD34の発現は、リプログラミング中に活性化される。 細胞は、2 日目 (未分類)、15 日目 (CD49f+CD34-) 、および 25 日目 (CD49f+CD34+) で収集されます。HDFおよびCD34+臍帯血(34+UCB)細胞が参照として使用される。この図の大きなバージョンを表示するには、ここをクリックしてください。
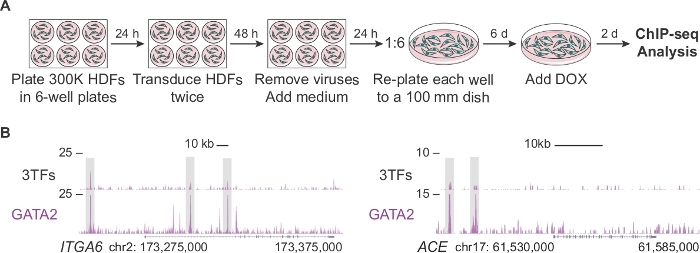
図2:ChIP-seq分析のためのヒト皮膚線維芽細胞の拡大(A) リプログラミングの2日目にChIP-seqに対して多数の形質転換ヒト皮膚線維芽細胞(HDF)を生成する改変プロトコルを示す実験戦略。300,000個の細胞を6ウェルプレートでめっきし、個々の因子(pFUW-tetO-FOS、pLV-tetO-HA-GFI1BまたはpFUW-tetO-3xFLAG-GATA2)または3つの因子(プラスM2rtTA)の組み合わせで2回転写する。ウイルスを除去した後、線維芽細胞は100ミリメートルの皿で6日間拡張される。ドキシサイクリン(DOX)は0日目に添加され、細胞はDOX添加の2日後に採取される。(B)3つの転写因子(3TF)またはGATA2単独で転移した2日後にITGA6およびACE lociでGATA2結合部位(灰色のボックス)を強調するゲノムブラウザプロファイル。マップされた読み取りの合計数は、Y 軸に表示されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
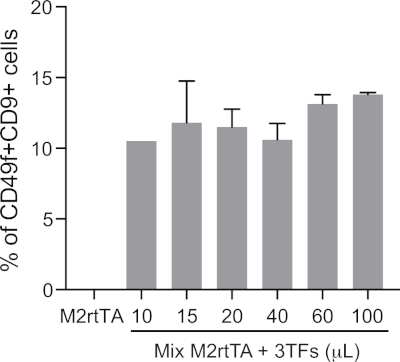
補足図1:効率的なヘモジェニックリプログラミングのための最適化されたレンチウイルスボリュームを定義する。濃縮(10~100μL)プール生産レンチウイルス粒子(3TF:GATA2、GFI1B、FOS)の量を増やすことで、M2rtTAと共にM2rtTAを1:1の比率でトランスデュースし、プロトコルのステップ4.5-4.12に従います。再プログラムされた細胞は、25日目に分析され、生細胞にゲートされたCD49f+CD9+細胞の割合(DAPI陰性)によって与えられる、ヘモジェニックリプログラミングのための最適な伝達量を定義する。細胞生存率は、25日目の生細胞の絶対数を定量することによって評価することができる。M2rtTA(100μL)で伝達されたHDFは負の対照として使用される。この図の大きなバージョンを表示するには、ここをクリックしてください。

補足図2:ヒト皮膚線維芽細胞のヘモジェニックリプログラミング中の形態変化ヒト皮膚線維芽細胞(HDF)培養物は、第1の形質導入の日(-2日目)、DOXが培養物に添加されるとき(0日目)、DOX補充後2日(2日目)および15日(15日目)、および実験の終了点(25日目)に画像化される。15日と25日のヘモジェニックコロニーが強調表示されます。スケールバー = 100μm.ここをクリックすると、この図の大きなバージョンが表示されます。
ディスカッション
本稿では、HP細胞中間体を通過するヒト線維芽細胞から造血前駆細胞を直接生成する方法について、決定的なHSC14と同様に説明する。
GATA2、GFI1BおよびFOSをコードするレンチウイルス粒子のプール生産は、我々の手でより高いリプログラミング効率(未公開データ)をもたらすので、個々の生産よりも好ましい。レンチウイルスは、レトロウイルス科のメンバーとして、通常、正の一本鎖RNA19の2つのコピーを含む。リプログラミング効率の増加は、同じレンチウイルス粒子中の2つの異なるトランスジーンの包装によるものであってもよく、その結果、3つの転写因子と共に転写される細胞の数が増加する。このプロトコルの成功を確実にするためには、ステップ4.6で推奨されるように、リプログラミング効率と細胞生存率の最適なバランスを得るために、細胞通路に応じて十分な量のウイルスを持つHDFをトランスデュースする必要があります。また、新鮮な非濃縮ウイルスを使用することができます。3TF プールと M2rtTA の 0.5 ~ 3 mL のセルを変換することをお勧めします。また、セル密度は、アプリケーションに応じて調整する必要があります。6ウェルプレートあたり150,000 HDF(ステップ4.4)は、再プログラムされた細胞のFACS、移植およびフローサイトメトリー分析を行う最適な密度を提供しました。ChIP-seq実験では、最初からより多くの細胞が必要でした(ステップ5.1)。細胞の形態変化を定期的にチェックし、造血培地を週2回交換して、誘発造血細胞の出現をサポートすることが重要です。フィーダー層に造血サイトカインまたは共培養を添加すると、リプログラミング効率が向上する可能性があります。
この方法により、造血リプログラミング中に動的に表現される新しい造血マーカーを同定することができます。CD9は、転写レベル14で再プログラムされた細胞でアップレギュレートされていることが示されたが、CD49fおよびCD143と共にリプログラミングの初期段階で細胞表面で急速に発現し、ヒトHSC前駆体の新規マーカーとして機能する。また、ITGA6とACEは、CD9とCD34 14に加えて、ヘモジェニックリプログラミングの初期段階におけるGATA2の直接的な標的であり、ヒトヘモジェニック間の直接的な機械的リンクを提供することを示す前駆体表現型およびGATA2.
このシステムの利点の1つは、比較的均質な線維芽細胞培養物の使用に存在する。PSCはインビトロで容易に拡張され維持されるが、分化プロトコルは造血前駆体を含む異種集団を生成し、5、6、7を生着させる。また、PSC由来のHSPCを移植する際に腫瘍形成のリスクがあり、分化プロトコルを採用しても未分化PSCが培養中に残る可能性があるためである。線維芽細胞に代わるものとして、HSCへの直接リプログラミングは、血液中血前駆細胞20および内皮細胞21に適用されている。しかしながら、血液制限前駆細胞から始まり、患者が幹/前駆造血集団22に影響を与える突然変異を運ぶ場合、得られたHSCの治療適用を妨げる。内皮細胞の場合、これらは線維芽細胞に比べて得ることがより困難であり、臓器依存性23である表現型、機能および構造の点で非常に異種細胞集団を構成する。他の研究は、マウス線維芽細胞を生着造血前駆体24、25に再プログラミングすることに成功したが、これまでのところ、ヒト線維芽細胞からのHSPC様細胞の生成を記述する他のプロトコルはない。
このアプローチは、薬理学的阻害、遺伝子ノックアウト、またはノックダウンの許可と相まって、ヒトHSCを直接誘導するために必要な個々または組み合わせを定義することを可能にする。リプログラミングの前にHDFのCRISPR-Cas9技術は、ヒト決定的造電の新しいレギュレータを定義するためのエキサイティングな努力を表しています。将来的には、線維芽細胞のような非血液関連ヒト細胞型のリプログラミングは、臨床応用のための健康な患者に合わせた造血前駆細胞を生成するプラットフォームとして機能する。
開示事項
著者たちは何も開示する必要はない。
謝辞
クヌートとアリス・ワレンバーグ財団、ルンド大学と地域スコーネの医学部は、寛大な財政支援のために認められています。この作品は、オルレ・エングヴィスト・スティフテッレス(194-0694からフィリペ・ペレイラへ)とフンダソン・パラ・ア・シエンシア・エ・テクノロジア(PTDC/BIM-MED/0075/2014からフィリペ・ペレイラへの博士奨学金)の助成金によって支えられ、 SFRH/BD/135725/2018 および SFRH/BD/51968/2012 からリタ・アウベスそしてアンドレア・ゴメス)。この研究はまた、NIHとNYSTEM(1R01HL119404とC32597GGからカテリA.ムーアへの)からの資金によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 0.45 μm low-protein binding filter, 150 mL Bottle Top Vacuum Filter | Corning | #430625 | |
| 2-Mercaptoethanol | Sigma-Aldrich | #M6250 | |
| Alexa Fluor 488 anti-human CD34 clone 581 | BioLegend | #343518 | |
| BD Pharmingen APC Mouse Anti-Human Angiotensin Converting Enzyme (CD143) clone BB9 | BD Biosciences | #557929 | |
| BES buffered saline | Sigma-Aldrich | #14280 | |
| Calcium chloride (CaCl2) | Sigma-Aldrich | #449709 | |
| Centrifugal filter unit, Amicon Ultra-15 Centrifugal Filter Unit | Sigma-Aldrich | #UFC903096 | |
| Dissociation solution, TrypLE Express Enzyme (1x) no phenol red | Gibco | #12604-021 | |
| Doxycycline hyclate (DOX) | Sigma-Aldrich | #D9891 | |
| eBioscience CD49f (Integrin alpha 6) Monoclonal Antibody (eBioGoH3 (GoH3)), PE-Cyanine7 | Invitrogen | #25-0495-82 | |
| FUW-M2rtTA | Addgene | #20342 | |
| Gelatin from Porcine Skin Type A | Sigma-Aldrich | #G1890 | |
| Gibco L-Glutamine (200 mM) | ThermoFisher Scientific | #25030-024 | |
| Gibco MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | #11140-035 | |
| Hematopoietic medium, MyeloCult H5100 | STEMCELL Technologies | #05150 | |
| Hexadimethrine bromide (polybrene) | Sigma-Aldrich | #H9268 | |
| Human Dermal Fibroblasts (HDFs) | ScienCell | #2320 | |
| HyClone Dulbecco's Modified Eagles Medium (DMEM) | GE Healthcare | #SH30243.01 | |
| HyClone Fetal Bovine Serum (FBS) | GE Healthcare | #SV30160.03 | |
| HyClone Penicillin Streptomycin 100x Solution (Pen/Strep) | GE Healthcare | #SV30010 | |
| HyClone Phosphate Buffered Saline solution (PBS) | GE Healthcare | #SH30256.01 | |
| Hydrocortisone | STEMCELL Technologies | #7904 | |
| Mouse serum | Sigma-Aldrich | #M5905 | |
| PE anti-human CD9 Antibody clone HI9a | BioLegend | #312105 | |
| pFUW-tetO-3xFLAG-GATA2 | Addgene | #125600 | |
| pFUW-tetO-FOS | Addgene | #125598 | |
| pFUW-tetO-GATA2 | Addgene | #125028 | |
| pFUW-tetO-GFI1B | Addgene | #125597 | |
| pLV-tetO-HA-GFI1B | Addgene | #125599 | |
| pMD2.G | Addgene | #12259 | |
| psPAX2 | Addgene | #12260 |
参考文献
- Ivanovs, A., et al. Highly potent human hematopoietic stem cells first emerge in the intraembryonic aorta-gonad-mesonephros region. Journal of Experimental Medicine. 208, 2417-2427 (2011).
- Tavian, M., Biasch, K., Sinka, L., Vallet, J., Péault, B. Embryonic origin of human hematopoiesis. International Journal of Developmental Biology. 1065, 1061-1065 (2010).
- Medvinsky, A., Rybtsov, S., Taoudi, S. Embryonic origin of the adult hematopoietic system: advances and questions. Development. 138, 1017-1031 (2011).
- Ivanovs, A., et al. Human haematopoietic stem cell development: from the embryo to the dish. Development. 144, 2323-2337 (2017).
- Daniel, M. G., Pereira, C. F., Lemischka, I. R., Moore, K. A. Making a Hematopoietic Stem Cell. Trends in Cell Biology. 26, 202-214 (2016).
- Vo, L., Daley, G. De novo generation of HSCs from somatic and pluripotent stem cell sources. Blood. 125, 2641-2648 (2015).
- Rafii, S., et al. Human ESC-derived hemogenic endothelial cells undergo distinct waves of endothelial to hematopoietic transition. Blood. 121, 770-781 (2013).
- Ebina, W., Rossi, D. J. Transcription factor-mediated reprogramming toward hematopoietic stem cells. EMBO Journal. 34, 694-709 (2015).
- Sugimura, R., et al. Haematopoietic stem and progenitor cells from human pluripotent stem cells. Nature. 545, 432-438 (2017).
- Pereira, C. F., et al. Induction of a Hemogenic Program in Mouse Fibroblasts. Cell Stem Cell. 13, 205-218 (2013).
- Pereira, C. F., et al. Hematopoietic Reprogramming In vitro Informs In Vivo Identification of Hemogenic Precursors to Definitive Hematopoietic Stem Cells. Developmental Cell. 36, 525-539 (2016).
- Notta, F., et al. Isolation of Single Human Hematopoietic Stem Cells Capable of Long-Term Multilineage Engraftment. Science. 333, 218-221 (2011).
- Sinka, L., Biasch, K., Khazaal, I., Péault, B., Tavian, M. Angiotensin-converting enzyme (CD143) specifies emerging lympho-hematopoietic progenitors in the human embryo. Blood. 119, 3712-3724 (2012).
- Gomes, A. M., et al. Cooperative Transcription Factor Induction Mediates Hemogenic Reprogramming. Cell Reports. 25, 2821-2835 (2018).
- Karlsson, G., et al. Report The Tetraspanin CD9 Affords High-Purity Capture of All Murine Hematopoietic Stem Cells. Cell Reports. 4, 642-648 (2013).
- Leung, K. T., et al. The tetraspanin CD9 regulates migration, adhesion, and homing of human cord blood CD34+ hematopoietic stem and progenitor cells. Blood. 117, 1840-1851 (2011).
- Hockemeyer, D., et al. A drug-inducible system for direct reprogramming of human somatic cells to pluripotency. Cell Stem Cell. 3, 346-353 (2008).
- Kutner, R. H., Zhang, X., Reiser, J. Production concentration and titration of pseudotyped HIV-1-based lentiviral vectors. Nature Protocols. 4, 495-505 (2009).
- Suzuki, Y. S., Suzuki, Y., Ke, X. Gene Regulatable Lentiviral Vector System. Viral Gene Therapy. , (2011).
- Riddell, J., et al. Reprogramming committed murine blood cells to induced hematopoietic stem cells with defined factors. Cell. 157, 549-564 (2014).
- Lis, R., et al. Conversion of adult endothelium to immunocompetent haematopoietic stem cells. Nature. 545, 439-445 (2017).
- Pereira, C., Lemischka, I. R., Moore, K. From blood to blood’: de-differentiation of hematopoietic progenitors to stem cells. EMBO Journal. 33, 1511-1513 (2014).
- Nolan, D. J., et al. Molecular Signatures of Tissue-Specific Microvascular Endothelial Cell Heterogeneity in Organ Maintenance and Regeneration. Developmental Cell. 26, 204-219 (2013).
- Batta, K., Florkowska, M., Kouskoff, V., Lacaud, G. Direct Reprogramming of Murine Fibroblasts to Hematopoietic Progenitor Cells. Cell Reports. 9, 1871 (2014).
- Cheng, H., et al. Reprogramming mouse fibroblasts into engraftable myeloerythroid and lymphoid progenitors. Nature Communications. 7, 1-15 (2016).
Erratum
Formal Correction: Erratum: Hemogenic Reprogramming of Human Fibroblasts by Enforced Expression of Transcription Factors
Posted by JoVE Editors on 12/03/2019. Citeable Link.
An erratum was issued for: Hemogenic Reprogramming of Human Fibroblasts by Enforced Expression of Transcription Factors. The author affiliations were updated.
The second author affiliation was updated from:
2Wallenberg Center for Molecular, Lund University
to:
2Wallenberg Center for Molecular Medicine, Lund University
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved