Method Article
通过转录因子的强制表达,人类纤维细胞的造血再编程
Erratum Notice
摘要
该协议通过强制表达转录因子GATA2、GFI1B和FOS来生成造血干细胞和祖细胞,证明在人类皮肤成纤维细胞中诱导造血程序。
摘要
人类造血干细胞(HSCs)的细胞和分子机制仍然难以捉摸。需要重新评价人类HSC在体外出现的策略,以克服研究这一复杂发育过程的局限性。在这里,我们描述了一个协议,利用直接细胞重新编程方法,从人类皮肤纤维细胞中生成造血干细胞和类似祖细胞的细胞。这些细胞通过造血的中间细胞类型,类似于HSC规范的内皮到造血过渡(EHT)特性。使用GATA2、GFI1B和FOS转录因子转导,将纤维细胞重新编程为造血细胞。这三个因素的组合诱发形态变化,造血和造血标记的表达和动态EHT转录程序。重新编程的细胞产生造血代代和重新填充免疫缺陷小鼠三个月。该协议可以适应人类EHT过程的机械解剖,如这里的例子,在重新编程的早期阶段定义GATA2目标。因此,人类造血再编程提供了一种简单而易于操作的方法,用于识别人类HSC出现的新标记和调控因素。将来,在成纤维细胞中忠实地诱导造血性命运可能导致患者特定的HSC的生成进行移植。
引言
通过内皮-造血转化(EHT)1,从具有造血能力的内皮前体和胎盘中出现决定性的造血干细胞和祖细胞(HSPCs) 2.造血前体(HPs)既表示内皮和造血标记,又表示其精确识别,特别是在人体系统中。尽管在哺乳动物中是一个相对保守的过程,造血干细胞(HSC)的发展仍然显著不同,人类和小鼠模型3,4。因此,需要用体外方法概括人类HSC发育。
多能干细胞(PSCs)分化到HSC,虽然很有希望,但在过去20年中取得了有限的成功,这主要是由于现有的分化方案,导致原始造血原体祖生移植不良能力5,6,7。或者,直接细胞重新编程方法已应用,以产生HSPC样的细胞从多个细胞类型,使用转录因子(TFs)8,9。特别是,三个TF的过度表达,Gata2,Gfi1b和cFos,通过HP中间体(Prom1_Sca-1_CD34_CD45-)10将小鼠胚胎成纤维细胞转化为HSP。这个过程类似于在胚胎和胎盘中发生的EHT,在确定造异物的规范期间。这种表型能够识别和分离小鼠胎盘中的HPs种群,这种填充物在短期培养和Notch激活后产生可连续移植的HSCs11。
到目前为止,还没有建立表型来区分人类HSC及其前体,但已知有些分子在新兴的HSC中表达。 Integrin α 6(ITGA6或CD49f)在长期重填充的HSC中表达得很高,最不成熟HSC腔室12中的细胞和血管紧张素转化酶(ACE或CD143)存在于CD34阴性造血前体中,胚胎造血组织13。
最近,我们已经证明,人类版本的三个TF,GATA2,FOS和GFI1B重新编程人类皮肤成纤维细胞(HDF)到惠普与短期移植能力14。在重新编程的初始阶段,GATA2采用开放染色质,并招募GFI1B和FOS来抑制成纤维细胞基因并激活内皮和造血基因。诱导细胞高度表达CD49f和ACE,并包含一小部分表示HSPC标记CD34的细胞。CD9基因在HSCs15中表达,对HSC归源16很重要,它被证明是GATA2的直接靶点,也是重新编程细胞14中调控程度最高的基因之一。因此,CD9可能构成人类最终造形的惠普的另一个标志。
在本协议中,我们描述了通过强制表达GATA2、GFI1B和FOS从人类成纤维细胞中产生类似HSPC的细胞,以及在编程。TF编码在多西环素(DOX)诱导的慢病毒载体(pFUW-ttO),含有四环素响应元件(TRE)和最小的CMV启动子,并与含有反向四环素的构成载体一起转导转活化蛋白(pFUW-M2rtTA)。当转导后添加DOX(四环素模拟)时,它与RTTA蛋白结合,后者与TRE相互作用,允许TF转录(Tet-On系统)。该过程需要 25 天才能完成。对于ChIP-seq实验,HDF在DOX补充两天后用标记版本的GATA2(pFUW-tetO-3xFLAG-GATA2)和GFI1B(pLV-tetO-HA-GFI1B)进行转导,并分析pFUW-tetO-FOS和TF结合位点。
最终,人类成纤维细胞的造血再编程提供了一个体外可处理系统,用于研究人类发育造血机制,以及患者特异性HSPCs的潜在来源,供将来临床应用。
研究方案
该协议是根据隆德大学人类研究伦理委员会的指导方针执行的,应当按照个别机构准则执行。
1. 试剂制备
- 对于 Dulbecco 的改性 Eagle 介质 (DMEM)/20% 胎儿牛血清 (FBS),将含有丙酮酸钠的高葡萄糖 DMEM 与 20% FBS、1% 青霉素-链霉素 (笔/链球菌)、1% L-谷氨酰胺、1% 非必需氨基酸和 10-4-M 2-麦卡托乙醇。
- 对于完整的DMEM,将含有丙酮酸钠的高葡萄糖DMEM与10%FBS、1%Pen/链环和1%L谷氨酰胺混合。
- 对于造血介质,将造血介质(材料表)与10-6M氢皮质酮和1%笔/链球菌混合。
- 使用磷酸盐缓冲盐水(PBS),不含钙或镁。
2. 人类皮肤纤维细胞隔离
注:HDF 可以从认证供应商处购买 (材料表).在这种情况下,扩展成纤维细胞,并直接使用它们在重新编程实验中(第4节)。或者,HDF 可以从捐助者中分离出来。如果从不同的捐赠者中分离出来成纤维细胞,在协议的所有步骤中保持样品彼此分离。带有每个捐赠者的识别号的牌/孔和收集管。
- 从由合格医生进行的 3 mm 圆形皮肤冲孔活检中获得 HDF。
- 用500μL 0.1%明胶涂覆组织培养处理的6孔板的三口井,在37°C下孵育20分钟。
- 吸气剩余的明胶溶液,并在每口井中加入750μL的DMEM/20%FBS。油井的整个表面应用介质覆盖。
- 将 1.5 mL 的 DMEM/20% FBS 添加到无菌 100 mm 培养皿盖的内表面,并在 5 mL 血清移液器的帮助下将跌落展开。
- 将皮肤活检置于用消毒钳子放在盖子上的介质中。
- 将皮肤活检分成九个相同的部分,使用一个消毒手术刀将活检放在原位,用第二个手术刀进行切割。
- 使用尖钳每井放置三个活检片。确保这些部件附着在井底。
- 在件上放置一个 22 mm 盖玻片,然后施加一些压力。
- 在37°C,5%CO2孵育板一周。每天检查细胞,每2天加入200μL的DMEM/20%FBS,以取代蒸发的介质。
- 一周后,添加高达 2 mL 的 DMEM/20% FBS,每 2⁄3 天更换一次介质。
-
当井流时(约4~8周),通道细胞比例为1:4。
- 准备 0.1% 明胶涂层组织培养处理的 6 孔板。
- 在80%的汇合时从井中吸气培养基,用1mL的PBS洗涤一次。
- 用无菌钳子拆下盖玻片,并将盖玻片放入 6 孔板的新井中,组织侧向上。
注:与盖玻片相连的细胞也将被收获。 - 每口井(包括带盖玻片的井)加入500μL解离溶液(材料表),在37°C下孵育,5%CO2孵育5-10分钟。在每个井中加入 500 μL 的 DMEM/20% FBS。
- 从所有井中收集成纤维细胞到15 mL锥形管中。向井中添加额外的介质以收集剩余的细胞。将管在 350 x g下离心 5 分钟。
- 同时,在以前的明胶涂层板的每个孔中加入 500 μL 的 DMEM/20% FBS。
- 在 DMEM/20% FBS 的 6 mL 中吸气介质和重新悬浮成纤维细胞。
- 在每个孔中加入500μL的成纤维细胞悬浮液(每个样品/供体共两个6孔板)。在37°C,5%CO2孵育细胞过夜。
- 第二天,在每个井中添加 1 mL 的 DMEM/20% FBS。每 2⁄3 天用 2 mL 的 DMEM/20% FBS 更换介质,直到油井 80% 汇出。
- 对三个汇出孔重复第 2.11 节,直到到达第三个通道。
-
从汇井中冻结成纤维细胞(通道 1 和 3)。
- 从井中吸气介质,用1mL的PBS清洗一次。
- 如步骤 2.11.4 和 2.11.5 所述分离和收集成纤维细胞。
- 用血细胞计对细胞进行计数,并在350 x g下将管离心5分钟。
- 离心后,在FBS中吸气培养基和重新悬浮成纤维细胞,在5 x 105细胞/mL的密度下,用10%DMSO。
- 每个冷冻室加入1mL的细胞悬浮液,并使用冷冻容器在-80°C冷冻细胞过夜。将小瓶移至-150°C(液氮),以便长期储存。
3. 伦蒂病毒生产
- 在100毫米组织培养处理的培养皿中生长HEK293T细胞,其完整DMEM为10mL,在37°C,CO2为5%,直到达到汇合。
- 在转染前一天,吸气介质,用5mL的PBS仔细洗碗。
- 去除PBS后,加入1.5 mL的解离溶液,在37°C下孵育,5%CO 2,5-10分钟,使细胞从培养皿中分离。
注:建议在使用前加热PBS和解散溶液,使细胞不会遭受热冲击。 - 使用 3 mL 的完整 DMEM 灭活分离溶液,并将细胞悬浮液转移到 15 mL 锥形管中。用 5 mL 的完整 DMEM 清洗盘子,以去除剩余的附着细胞,并将此体积转移到 15 mL 锥形管中。
- 离心细胞悬浮在350 x g下5分钟。
- 吸气上清液,在六个100毫米组织培养处理的菜肴之间均匀地分粒细胞颗粒,最终体积为每盘10 mL的完整DMEM。到转染时,细胞应约60%的结对。
- 第二天,具有质粒混合物的转染细胞如下:
注:该协议的这一部分描述了每个质粒混合物在一个100毫米组织培养处理盘中生产慢病毒。要获得更高体积的慢病毒上清液浓度,请每次混合至少使用四个 100 mm HEK293T 细胞培养皿。- 在15 mL锥形管中,将三个转移质粒中的10微克加在一起:3.33微克的pFUW-tetO-GATA2(添加基因质粒#125028)14,3.33微克pFUW-tetO-GFI1B(添加基因#125597)14和3.33微克pFUW-tetO-FOS(添加基因#12559810 μg的第二代 psPAX2 封装载体编码Gag、Pol、Tat和Rev基因(添加基因#12260)和 5 μg pMD2.G 包络载体编码VSV-G基因(添加基因#12259)。 加水高达500μL。
- 在两个新的15 mL锥形管中,向每个管中加入10μg的FUW-M2rtTA质粒(添加基因#20342)17、10μg psPAX2包装载体和5μgpMD2.G包络载体。加水高达500μL。一根管子将用作控制。
- 每管添加62.5 μL的2MCaCl2.接下来,使用插入移液器控制器的巴斯德移液器将气泡释放到每个混合物中。当气泡形成时,移液器 500 μL N, N-bis(2-羟基) -2-氨基硫酸 (BES) 缓冲盐水 (pH 7.1, 25 °C), 与 P1000 移液器, 滴对巴斯德移液器和混合物.
- 在室温下孵育管至少15分钟。混合物在一段时间后会出现轻微多云。
- 同时,从HEK293T细胞菜肴(前一天通过)的吸气介质,并在不带抗生素的情况下加入10mL的完整DMEM。小心,慢慢添加培养基,因为HEK293T细胞是半粘附的。
- 均匀地将每种混合物(约1 mL)均匀分布到单独的菜肴中,并在37°C、5%CO2下孵育过夜。
- 用4 mL的完整DMEM,孵育后24小时更换培养基。在37°C,5%CO2下孵育过夜。如果可用,在32°C,5%CO2孵育,因为温度降低将增加慢病毒颗粒的半寿命。
- 收集上清液与慢病毒颗粒三次到50 mL锥形管。此时不要混合不同的慢病毒颗粒。每道菜会产生12 mL的慢病毒上清液。四个相同病毒制剂的菜肴适合一个 50 mL 锥形管。
注意:在用于慢病毒工作的层流罩中的生物安全-2级实验室中进行慢病毒收集,并将病毒污染废物(管、尖、碟)放入适当的容器中,用于生物有害物质。- 在最后一次孵育后16小时进行第一次采集,并添加4 mL的完整DMEM。在37°C下孵育,CO2为5%。
- 做第二次收集8小时后,第一个到同一管,添加4 mL的完整DMEM和孵育在37°C,5%CO2。
- 做第三次收集16小时后,第二个到同一管,并丢弃的盘子。
注:每次收集后,将慢病毒上生子储存在4°C。
- 使用0.45μm低蛋白结合过滤器过滤每个慢病毒上清液,用醋酸纤维素膜(材料表)过滤到干净的管中。
- 在具有再生纤维素膜(材料表)的离心滤芯单元中,向离心滤芯单元添加最多 15 mL 的过滤上清液,并在 4°C 下以 4,000 x g旋转 25 分钟。丢弃流通过。含有慢病毒的粘性液体将保留在过滤单元中。
- 通过在过滤单元顶部添加 15 mL 上清液来重复步骤 3.13,直到没有更多的慢病毒上清液。
注:当只有几毫升的上清液浓缩时,将旋转时间缩短至10分钟。如果过滤器上仍有多余的液体(非粘性),则再离心 10 分钟。 - 使每种浓缩扁豆病毒的等分(50~200 μL,取决于初始上清体积)在-80°C储存,用于长期储存(1⁄2年)或4°C,用于短期储存(1⁄2周)。
注:浓缩或非浓缩的慢病毒也可以新鲜使用。不要重新冻结和解冻,因为这将导致减少的丁二重。
4. 造血再编程
注:使用通道数为三 (P3) 或更高的 HDF(直到 P10)执行重新编程实验。
- 用5mL 0.1%明胶涂上100毫米组织培养处理的培养皿,在37°C孵育20分钟。
- 在 0.1% 明胶涂层盘中解冻成纤维细胞小瓶和板细胞。在37°C,5%CO2下孵育过夜。如有必要,将成纤维细胞扩大更长时间,直到达到所需的通道和汇合。
- 用500μL的0.1%明胶溶液涂覆6孔组织培养处理板,在37°C孵育20分钟。
- 每孔密度为 150,000 个单元(每孔 25,000 个单元)的板 HDF,每孔 2 mL 的 DMEM。在37°C,5%CO2孵育过夜,以允许细胞附着。
- 用 2 mL 的完整 DMEM 加上 8 μg/mL 多宝醇更换介质。在新的微离心管中制备池状TF慢病毒和M2rtTA的1:1比例组合。
注:在此协议中,对三个 T 的慢病毒进行池生产,这在作者手中,可产生更高的重新编程效率。或者,建议在标准细胞系上用qPCR18对单个慢病毒颗粒进行滴定。这将用于定义单个病毒的体积,以满足多种感染 (MOI) 最佳共转导和造血再编程。 - 每口井分配10至100 μL的慢病毒混合物,以转导HDF。这是重新编程第 2 天。
注:在不影响细胞活力的情况下,定义慢病毒混合物的最佳体积,以便进行有效的重新编程,这需要优化(有关更多详细信息,请参阅补充图 1)。与通道较低的细胞相比,通道超过 7 个通道的 HDF 可能需要更高的病毒量。 - 孵育16小时后,清除病毒并添加完整的DMEM。允许细胞恢复6~8小时。
- 恢复后,吸气介质,加入2 mL的完整DMEM与8μg/mL聚二苯乙烯。
- 如步骤 4.6 所述进行第二次转导,在 37°C 下孵育,CO2为 16 小时孵育。这是重新编程第 1 天。慢病毒混合物可在-2日为两种转导做好准备,并保持在4°C。
- 第二天,清除病毒,并添加完整的DMEM,辅以1μg/mL DOX。这是重新编程的 0 天。在37°C下孵育,5%CO2孵育48小时。
-
在重新编程第 2 天,以 1:2 的比例分割每个井。
- 吸气培养基和洗涤细胞与1 mL的PBS。
- 用500μL解毒溶液吸气PBS和分离细胞。在37°C下孵育5-10分钟,CO2为5%。
- 使用 1 mL 的完整 DMEM 灭活分离溶液,并将细胞收集到锥形管中。在 350 x g下离心 5 分钟。
- 在造血介质中重新悬浮颗粒(参见步骤 1.3),辅以 1 μg/mL DOX,并将板细胞放入经过新组织培养处理的 6 孔板中,涂有 0.1% 明胶,最终体积为每孔 2 mL。
- 在重新编程培养期间(25天),每周两次改变介质(造血介质加DOX)。
- 通过明场或荧光显微镜分析不同时间点产生的重新编程的细胞(参见补充图2)、流式细胞测定、散装和单细胞RNA测序以及用于采集的移植检测造血形态学,内皮和造血标记的存在,内皮/造血基因表达的获取和再生能力14。
5. 在造血再编程的发病时,ChIP-seq分析的纤维细胞扩展优化
- 板 300,000 HDF (2下孵育过夜。
- 第二天,用完整的DMEM替换介质,辅以8微克/mL聚二苯乙烯。
- 转导具有单个因子的细胞:pFUW-tetO-FOS14、pLV-tetO-HA-GFI1B(#125599添加基因)14和pFUW-tetO-3xFLAG-GATA2(添加基因#125600)14或具有三个因子的池,加上FUW-M2rtTA在1:1的比例。使用 10~20 μL 总病毒(单个 TF + M2rtTA 或三个 TF = M2rtTA)。在37°C,5%CO2孵育细胞过夜。
注:建议每个条件使用 12 个 6 孔板(对于每个单独的 TF 和三个 TF 组合)。 - 去除慢病毒,并在第一次转导后添加完整的DMEM 16 h。让细胞恢复6~8小时。
- 以相同数量的病毒,在37°C,CO2中孵育细胞。
- 第二天删除病毒并添加完整的 DMEM。在37°C下孵育,5%CO2孵育24小时。
- 将每口孔重新盘入 0.1% 明胶涂层组织培养处理的 100 mm 盘中,并带有完整的 DMEM,最终体积为每盘 10 mL。这表示大约 1:6 的段落。
- 允许细胞在37°C,5%CO2下生长6天。
- 在重新电镀后第 6 天,吸气介质,并添加完整的 DMEM,带 1 μg/mL DOX。在37°C下孵育细胞,5%CO2,2天。
- 收集成纤维细胞和分析三个TF的基因组结合位点单独或组合,由ChIP-seq 2天后DOX补充14。
注:最后72个100毫米的碟子将包含20×50×106个细胞,足以进行ChIP-seq实验和复制。
结果
图1A说明了使用HDF重新编程方法的原理图表示。成纤维细胞是从商业来源获得或从人类捐赠者那里收集的,在重新编程之前在体外扩展。电镀后,使用GATA2、GFI1B和FOS(和M2rtTA)慢病毒转导细胞两次,并在重新编程的第0天加入多西环素。在第2天,细胞分裂,在造血介质中镀层,直到培养第25天。重新编程的细胞可以在不同的时间点生成,用于多种应用,包括免疫功能低下小鼠的移植、纯化细胞群的单细胞RNA测序(scRNA-seq)(第2天未分类,第15天CD49f= CD34和第 25 天 CD49f+CD34+细胞),以及细胞表面标记 CD49f、CD34、CD9 和 CD143 的显微镜和流式细胞测定分析。代表性细胞学图显示,经过25天的重新编程后,表达CD49f和CD9(图1B,左面板)的重新编程细胞的比例为17%。大多数双阳性细胞表达CD143(+86%),小群体表达CD34(0.9%),表明动态造血命运诱导。这些标记在培养了 25 天的 M2rtTA 转导式 HDF 中未激活(图 1B,右侧面板)。免疫荧光图像确认CD9和CD143在附着细胞和圆形细胞中的表达,在形态上不同于对这些标记负的纤维细胞(图1C)。人类造血菌落也表达CD49f和CD3414。在 HDF、第 2 天未分类的细胞和纯化的重新编程的细胞的 ScRNA-seq 分析(CD49f+CD34-) 和第 25 天(CD49f+CD34+) 显示 CD49f、CD9 和 CD143 表达从第 2 天到第 25 天逐步增加。CD49f和CD9阳性细胞在第2天至第15天重新编程过程中首先出现,表明这些分子可能代表早期人类造血的标记物。CD143 表达式在第 15 天开始检测,CD34 表达细胞仅在稍后时间点(第 25 天)检测到。CD34=脐带血 (UCB) 细胞用作参考 (图 1D)。
图 2A描述了一个经过修改的协议,用于在造血重编程的初始阶段(第 2 天)生成足够数量的细胞,用于 ChIP-seq 分析。首先,HDF的镀层密度是标准协议的两倍(300,000个细胞,而每板150,000个细胞)。转导后,每口井被重新镀入100毫米的培养皿中,使细胞在补充DOX介质之前膨胀6天。在添加 DOX 和随后的 TF 表达式后 2 天对单元格进行分析。图2B显示了当细胞与三个因子(3TF)或GATA2单独进行联合转导时,GATA2与ITGA6和ACE的基因组调控区域结合的基因组浏览器配置文件。GATA2还结合打开染色质区域CD9和CD34基因14。
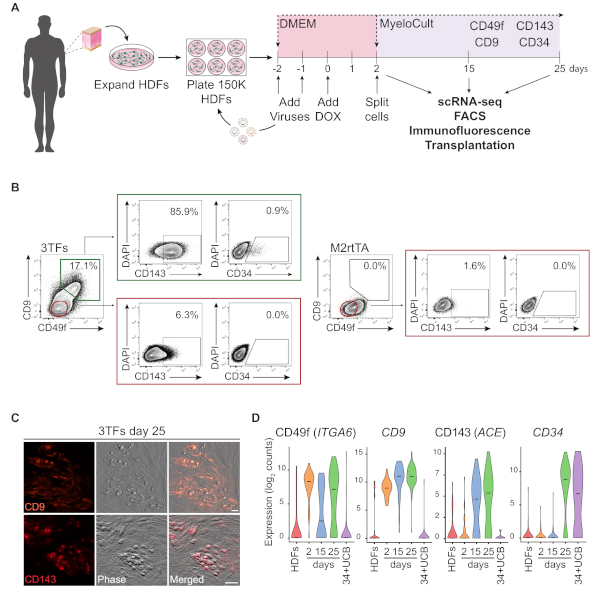
图1:诱导人体皮肤成纤维细胞的造血命运。(A) 人类皮肤成纤维细胞(HDF)造血再编程的实验策略。皮肤冲孔活检的纤维细胞从捐赠者那里收集,用GATA2、GFI1B、FOS和M2rtTA慢病毒进行扩充和转导。多西环素 (DOX) 被添加到重新编程的第 0 天培养中,并在多个时间点分析细胞,直到第 25 天。scRNA-seq,单细胞RNA测序。FACS,荧光激活细胞分拣。(B) 使用三个转录因子(3TF)在第25天通过流式细胞测定法评估造血/造血标记的表达。细胞测定图显示CD49f和CD9的双阳性细胞百分比,在活细胞群(DAPI阴性)中封闭。在双阳性总体中,显示CD143和CD34的表达。在相同的培养条件下,仅使用M2rtTA病毒转导的HDF用作对照。(C) 第 25 天重新编程的菌落的免疫荧光图像,确认 CD9(上面板)和 CD143(下面板)的表达。细胞被沾染抗体(材料表)稀释1:100在PBS/2%FBS与小鼠血清,孵育20分钟在37°C,5%CO2,洗涤三次,并在PBS/2%FBS成像。相位、相位梯度对比度。刻度条 = 50 μm (D) 不同时间点的 253 个细胞的 ScRNA-seq 分析。ITGA6、CD9、ACE和CD34的表达在重新编程过程中被激活。 细胞在第2天(未分类)、第15天(CD49f+CD34-)和第25天(CD49f+CD34+) 收集。HDF 和 CD34=脐带血 (34+UCB) 细胞用作参考。请点击此处查看此图的较大版本。
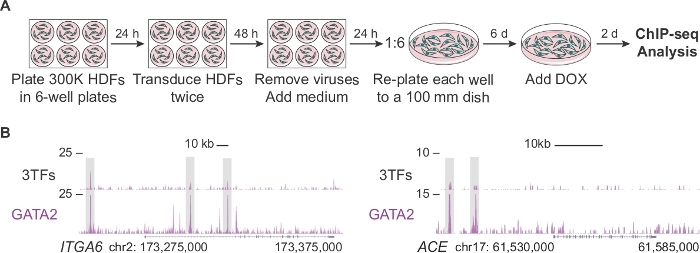
图2:用于ChIP-seq分析的人类皮肤成纤维细胞的扩展。(A) 实验策略描绘了经过修改的协议,在重新编程的第 2 天为 ChIP-seq 生成大量转导的人类皮肤成纤维细胞 (HDF)。300,000 个电池在 6 孔板中镀层,用单个因子(pFUW-tetO-FOS、pLV-tetO-HA-GFI1B 或 pFUW-tetO-3xFLAG-GATA2)或三个因素(加上 M2rtTA)组合进行两次转导。去除病毒后,成纤维细胞在100毫米的盘子中扩大6天。多西环素 (DOX) 在第 0 天添加,细胞在 DOX 添加后两天收集。(B) 基因组浏览器配置文件突出显示在ITGA6和ACE 位点处的 GATA2 结合位点(灰色框),在转导后两天使用三个转录因子 (3TF)或仅与 GATA2 进行转导。映射读取的总数在 y 轴上表示。请点击此处查看此图的较大版本。
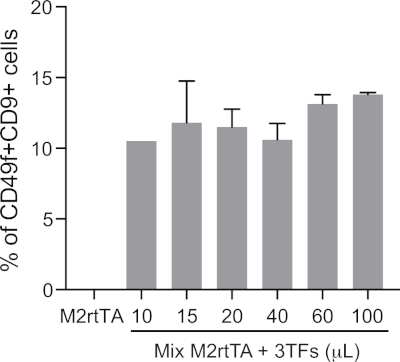
补充图1:定义优化的慢病毒体积,以便进行高效的造血再编程。增加浓缩(10至100μL)池生产的慢病毒颗粒(3TF:GATA2、GFI1B和FOS)的体积增加,用于以1:1的比例与M2rtTA一起转导人类皮肤成纤维(HDF),按照协议的步骤4.5-4.12。在第25天对重新编程的细胞进行分析,以定义造血性重编程的最佳转导量,给出CD49f+CD9+活细胞(DAPI阴性)中封闭细胞的百分比。细胞活力可以通过在第25天量化活细胞的绝对数量来评估。使用 M2rtTA (100 μL) 转导的 HDF 用作负控制。请点击此处查看此图的较大版本。

补充图2:人类皮肤成纤维细胞造血再编程过程中的形态变化。人类皮肤纤维细胞 (HDF) 培养在第一个转导日(第 2 天),当 DOX 添加到培养物(第 0 天)、DOX 补充后两天(第 2 天)和 15 天(第 15 天)以及实验结束点(第 25 天)时进行成像。第15天和第25天的血原菌落被突出显示。比例尺 = 100 μm。请点击此处查看此图的较大版本。
讨论
本文介绍了一种方法,直接从人类成纤维细胞生成造血祖细胞,通过HP细胞中间体,类似于最终的HSCs14。
编码GATA2、GFI1B和FOS的慢病毒颗粒的池生产比单个生产更受欢迎,因为在我们手中,它带来了更高的重新编程效率(未公布的数据)。伦蒂病毒,作为逆转录病毒家族的成员,通常含有两个阳性单链RNA19副本。重新编程效率的提高可能是由于将两个不同的转基因封装在同一慢病毒颗粒中,导致与三个转录因子共导的细胞数量增加。为了确保该协议的成功,有必要根据细胞通道,根据细胞通道,将具有足够数量的病毒转导HDF,以在重新编程效率和细胞活力之间取得最佳平衡,如步骤4.6中所建议的那样。此外,可以使用新的非浓缩病毒。建议使用 0.5-3 mL 的 3TF 池和 M2rtTA 转导电池。此外,细胞密度应根据应用进行调整。每 6 孔板 150 000 HDF(步骤 4.4)提供了最佳密度,用于执行 FACS、移植和流式细胞学分析。对于 ChIP-seq 实验,从一开始就需要更多的细胞(步骤 5.1)。定期检查细胞的形态变化,每周两次更换造血介质,以支持诱导造血细胞的出现,这一点很重要。在进料层中添加造血细胞因子或共培养物可提高重新编程效率。
通过这种方法,我们可以识别在造血重编程过程中动态表达的新造血标记。CD9在转录级别14的重新编程细胞中被证明是向上调节的,在与CD49f和CD143一起重新编程的初始阶段,在细胞表面迅速表达,作为人类HSC前体的一个新标记。我们还表明,ITGA6和ACE是GATA2在造血再编程的初始阶段的直接目标,除了CD9和CD3414之外,在人类造血性之间提供了直接的机械联系前体表型和GATA2。
该系统的一个优点在于使用相对均匀的成纤维细胞培养物。虽然PSC在体外很容易扩展和维护,但分化协议产生异质种群,包括造血原代,其中移植不良5,6,7。此外,在移植PSC衍生的HSPCs时存在肿瘤发生的风险,因为未分化的PSC即使在采用分化协议后仍可能留在培养中。或者对成纤维细胞,直接重新编程到HSC已应用于血液承诺的后代20和内皮细胞21。然而,从血液受限的祖细胞开始,如果患者携带影响干细胞/祖细胞造血的突变22,则阻碍由此产生的HSC的治疗应用。在内皮细胞的情况下,与成纤维细胞相比,这些细胞更难获得,在表型、功能和结构方面构成一个非常异质的细胞群,它们依赖于器官23。其他研究已经成功地将小鼠成纤维细胞重新编程为可移植的造血原体24,25,但到目前为止,还没有其它协议描述从人类成纤维细胞中产生类似HSPC的细胞。
这种方法,加上药理抑制、基因敲除或击倒,可以定义直接诱导人类HSC所需的个别或组合因素。在重新编程之前,HDF 中的 CRISPR-Cas9 技术代表了定义人类最终造体体的新型调节器的令人振奋的努力。将来,重新编程非血液相关的人类细胞类型,如成纤维细胞,将作为一个平台,产生健康的患者定制的造血原细胞用于临床应用。
披露声明
作者没有什么可透露的。
致谢
克努特和爱丽丝·瓦伦堡基金会、隆德大学医学院和斯科讷地区都因慷慨的财政支持而得到认可。这项工作得到了Olle EngkvistsStiftelse(194-0694年给菲利佩·佩雷拉)的赠款和来自"技术基金会"的博士奖学金(PTDC/BIM-MED/0075/2014向菲利佩·佩雷拉提供)的支持, 和SFRH/BD/135725/2018和SFRH/BD/51968/2012到丽塔阿尔维斯和安德烈娅·戈麦斯)。这项研究也得到了NIH和NYSTEM(1R01HL1119404和C32597GG至Kateri A. Moore)的资金的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.45 μm low-protein binding filter, 150 mL Bottle Top Vacuum Filter | Corning | #430625 | |
| 2-Mercaptoethanol | Sigma-Aldrich | #M6250 | |
| Alexa Fluor 488 anti-human CD34 clone 581 | BioLegend | #343518 | |
| BD Pharmingen APC Mouse Anti-Human Angiotensin Converting Enzyme (CD143) clone BB9 | BD Biosciences | #557929 | |
| BES buffered saline | Sigma-Aldrich | #14280 | |
| Calcium chloride (CaCl2) | Sigma-Aldrich | #449709 | |
| Centrifugal filter unit, Amicon Ultra-15 Centrifugal Filter Unit | Sigma-Aldrich | #UFC903096 | |
| Dissociation solution, TrypLE Express Enzyme (1x) no phenol red | Gibco | #12604-021 | |
| Doxycycline hyclate (DOX) | Sigma-Aldrich | #D9891 | |
| eBioscience CD49f (Integrin alpha 6) Monoclonal Antibody (eBioGoH3 (GoH3)), PE-Cyanine7 | Invitrogen | #25-0495-82 | |
| FUW-M2rtTA | Addgene | #20342 | |
| Gelatin from Porcine Skin Type A | Sigma-Aldrich | #G1890 | |
| Gibco L-Glutamine (200 mM) | ThermoFisher Scientific | #25030-024 | |
| Gibco MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | #11140-035 | |
| Hematopoietic medium, MyeloCult H5100 | STEMCELL Technologies | #05150 | |
| Hexadimethrine bromide (polybrene) | Sigma-Aldrich | #H9268 | |
| Human Dermal Fibroblasts (HDFs) | ScienCell | #2320 | |
| HyClone Dulbecco's Modified Eagles Medium (DMEM) | GE Healthcare | #SH30243.01 | |
| HyClone Fetal Bovine Serum (FBS) | GE Healthcare | #SV30160.03 | |
| HyClone Penicillin Streptomycin 100x Solution (Pen/Strep) | GE Healthcare | #SV30010 | |
| HyClone Phosphate Buffered Saline solution (PBS) | GE Healthcare | #SH30256.01 | |
| Hydrocortisone | STEMCELL Technologies | #7904 | |
| Mouse serum | Sigma-Aldrich | #M5905 | |
| PE anti-human CD9 Antibody clone HI9a | BioLegend | #312105 | |
| pFUW-tetO-3xFLAG-GATA2 | Addgene | #125600 | |
| pFUW-tetO-FOS | Addgene | #125598 | |
| pFUW-tetO-GATA2 | Addgene | #125028 | |
| pFUW-tetO-GFI1B | Addgene | #125597 | |
| pLV-tetO-HA-GFI1B | Addgene | #125599 | |
| pMD2.G | Addgene | #12259 | |
| psPAX2 | Addgene | #12260 |
参考文献
- Ivanovs, A., et al. Highly potent human hematopoietic stem cells first emerge in the intraembryonic aorta-gonad-mesonephros region. Journal of Experimental Medicine. 208, 2417-2427 (2011).
- Tavian, M., Biasch, K., Sinka, L., Vallet, J., Péault, B. Embryonic origin of human hematopoiesis. International Journal of Developmental Biology. 1065, 1061-1065 (2010).
- Medvinsky, A., Rybtsov, S., Taoudi, S. Embryonic origin of the adult hematopoietic system: advances and questions. Development. 138, 1017-1031 (2011).
- Ivanovs, A., et al. Human haematopoietic stem cell development: from the embryo to the dish. Development. 144, 2323-2337 (2017).
- Daniel, M. G., Pereira, C. F., Lemischka, I. R., Moore, K. A. Making a Hematopoietic Stem Cell. Trends in Cell Biology. 26, 202-214 (2016).
- Vo, L., Daley, G. De novo generation of HSCs from somatic and pluripotent stem cell sources. Blood. 125, 2641-2648 (2015).
- Rafii, S., et al. Human ESC-derived hemogenic endothelial cells undergo distinct waves of endothelial to hematopoietic transition. Blood. 121, 770-781 (2013).
- Ebina, W., Rossi, D. J. Transcription factor-mediated reprogramming toward hematopoietic stem cells. EMBO Journal. 34, 694-709 (2015).
- Sugimura, R., et al. Haematopoietic stem and progenitor cells from human pluripotent stem cells. Nature. 545, 432-438 (2017).
- Pereira, C. F., et al. Induction of a Hemogenic Program in Mouse Fibroblasts. Cell Stem Cell. 13, 205-218 (2013).
- Pereira, C. F., et al. Hematopoietic Reprogramming In vitro Informs In Vivo Identification of Hemogenic Precursors to Definitive Hematopoietic Stem Cells. Developmental Cell. 36, 525-539 (2016).
- Notta, F., et al. Isolation of Single Human Hematopoietic Stem Cells Capable of Long-Term Multilineage Engraftment. Science. 333, 218-221 (2011).
- Sinka, L., Biasch, K., Khazaal, I., Péault, B., Tavian, M. Angiotensin-converting enzyme (CD143) specifies emerging lympho-hematopoietic progenitors in the human embryo. Blood. 119, 3712-3724 (2012).
- Gomes, A. M., et al. Cooperative Transcription Factor Induction Mediates Hemogenic Reprogramming. Cell Reports. 25, 2821-2835 (2018).
- Karlsson, G., et al. Report The Tetraspanin CD9 Affords High-Purity Capture of All Murine Hematopoietic Stem Cells. Cell Reports. 4, 642-648 (2013).
- Leung, K. T., et al. The tetraspanin CD9 regulates migration, adhesion, and homing of human cord blood CD34+ hematopoietic stem and progenitor cells. Blood. 117, 1840-1851 (2011).
- Hockemeyer, D., et al. A drug-inducible system for direct reprogramming of human somatic cells to pluripotency. Cell Stem Cell. 3, 346-353 (2008).
- Kutner, R. H., Zhang, X., Reiser, J. Production concentration and titration of pseudotyped HIV-1-based lentiviral vectors. Nature Protocols. 4, 495-505 (2009).
- Suzuki, Y. S., Suzuki, Y., Ke, X. Gene Regulatable Lentiviral Vector System. Viral Gene Therapy. , (2011).
- Riddell, J., et al. Reprogramming committed murine blood cells to induced hematopoietic stem cells with defined factors. Cell. 157, 549-564 (2014).
- Lis, R., et al. Conversion of adult endothelium to immunocompetent haematopoietic stem cells. Nature. 545, 439-445 (2017).
- Pereira, C., Lemischka, I. R., Moore, K. From blood to blood’: de-differentiation of hematopoietic progenitors to stem cells. EMBO Journal. 33, 1511-1513 (2014).
- Nolan, D. J., et al. Molecular Signatures of Tissue-Specific Microvascular Endothelial Cell Heterogeneity in Organ Maintenance and Regeneration. Developmental Cell. 26, 204-219 (2013).
- Batta, K., Florkowska, M., Kouskoff, V., Lacaud, G. Direct Reprogramming of Murine Fibroblasts to Hematopoietic Progenitor Cells. Cell Reports. 9, 1871 (2014).
- Cheng, H., et al. Reprogramming mouse fibroblasts into engraftable myeloerythroid and lymphoid progenitors. Nature Communications. 7, 1-15 (2016).
Erratum
Formal Correction: Erratum: Hemogenic Reprogramming of Human Fibroblasts by Enforced Expression of Transcription Factors
Posted by JoVE Editors on 12/03/2019. Citeable Link.
An erratum was issued for: Hemogenic Reprogramming of Human Fibroblasts by Enforced Expression of Transcription Factors. The author affiliations were updated.
The second author affiliation was updated from:
2Wallenberg Center for Molecular, Lund University
to:
2Wallenberg Center for Molecular Medicine, Lund University
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。