Method Article
Reprogramação hemogénica de fibroblastos humanos pela expressão forçada de fatores de transcrição
Neste Artigo
Erratum Notice
Resumo
Este protocolo demonstra a indução de um programa hemogenic em fibroblastos dérmicos humanos pela expressão forçada dos fatores de transcrição GATA2, GFI1B e FOS para gerar células-tronco e progenitoras hematopoiéticas.
Resumo
Os mecanismos celulares e moleculares subjacentes à especificação das células-tronco hematopoiéticas humanas (HSCs) permanecem evasivos. Estratégias para recapitular o surgimento do HSC humano in vitro são necessárias para superar as limitações no estudo deste complexo processo de desenvolvimento. Aqui, descrevemos um protocolo para gerar células-tronco hematopoiéticas e progenitoras de fibroblastos dérmicos humanos que empregam uma abordagem direta de reprogramação celular. Essas células transitam através de um tipo de célula intermediária hemogenic, assemelhando-se à transição endotelilista-hematopoiética (EHT) característica da especificação do HSC. Os fibroblastos foram reprogramados para células hemogénicas por meio de transdução com fatores de transcrição GATA2, GFI1B e FOS. Essa combinação de três fatores induziu mudanças morfológicas, expressão de marcadores hemogénicos e hematopoiéticos e programas transcricionais dinâmicos do EHT. As células reprogramadas geram progênie hematopoiética e repovoam camundongos imunodeficientes por três meses. Este protocolo pode ser adaptado para a dissecação mecanicista do processo de EHT humano, como exemplificado aqui, definindo metas GATA2 durante as fases iniciais de reprogramação. Assim, a reprogramação hemogenic humana fornece uma aproximação simples e tractable para identificar marcadores novos e reguladores da emergência humana de HSC. No futuro, a indução fiel do destino hemogenic nos fibroblastos pode conduzir à geração de HSCs paciente-específicos para a transplantação.
Introdução
Células hematopoiéticas definitivas e células progenitoras (HSPCs) emergem na região e placenta de aorta-gonad-mesonephros (AGM) de precursores endotélios com capacidade hemogenica, através de uma transição endoteliética para hematopoiética (EHT)1, 2. Precursores hemogénicos (HPs) expressam marcadores endotélicos e hematopoiéticos, mas sua identificação precisa permanece ilusória, particularmente no sistema humano. Apesar de ser um processo relativamente conservado em mamíferos, o desenvolvimento de células-tronco hematopoiéticas (HSC) ainda difere significativamente entre os seres humanos e os modelos de camundongos3,4. Portanto, são necessárias abordagens in vitro para recapitular o desenvolvimento humano do HSC.
A diferenciação de células-tronco pluripotentes (PSCs) aos HSCs, embora promissora, tem recebido sucesso limitado nos últimos 20 anos, principalmente devido aos protocolos de diferenciação disponíveis, que resultam em progenitores hematopoiéticos primitivos com enxerto ruim capacidade5,6,7. Alternativamente, metodologias de reprogramação direta de células têm sido aplicadas para gerar células semelhantes a HSPC de vários tipos de células, usando fatores de transcrição (TFs)8,9. Em particular, a superexpressão de três TFs, Gata2, Gfi1b e cFos, fibroblastos embrionários de camundongos convertidos em HSPCs através de um intermediário HP com um fenótipo definido (Prom1+Sca-1+CD34+CD45-)10. Este processo se assemelhava ao EHT que ocorre no embrião e placenta, durante a especificação da hematopoiesis definitiva. Este fenótipo permitiu a identificação e o isolamento de uma população de HPs na placenta do rato que, após a cultura de curto prazo e a ativação de Notch, geraram HSCs transplantáveis em série11.
Até agora, nenhum fenótipo foi estabelecido que distingue os HSCs humanos de seus precursores, mas algumas moléculas são conhecidas por serem expressas em HSCs emergentes. Integrin alpha 6 (ITGA6 ou CD49f) é altamente expressa em HSCs repovoantes de longo prazo, os mais imaturos células no compartimentoHSC 12,e enzima de conversão de angiotensina (ACE ou CD143) está presente em precursores hematopoiéticos negativos CD34 em tecidos embrionários formadores de sangue13.
Recentemente, demonstramos que as versões humanas dos três TFs, GATA2, FOS e GFI1B reprogramam fibroblastos dérmicos humanos (HDFs) em HPs com capacidade de enxerto de curto prazo14. Nas fases iniciais da reprogramação, o GATA2 envolve a cromatina aberta e recruta GFI1B e FOS para reprimir genes fibroblastos e ativar genes endotélios e hematopoiéticos. Células induzidas altamente expressa CD49f e ACE, e continha uma pequena porcentagem de células expressando o marcador HSPC CD34. O gene CD9, que é expresso em HSCs15 e é importante para hsc homing16, mostrou-se um alvo direto de GATA2 e entre os genes mais regulamentados em células reprogramadas14. CD9 pode, portanto, constituir um marcador adicional para HPs de hematopoiesis definitivas humanas.
Neste protocolo, descrevemos a geração de células semelhantes ao HSPC a partir de fibroblastos humanos através da expressão forçada de GATA2, GFI1B e FOS, bem como um método adaptado para a análise de sequenciamento de cromatoinária (ChIP) (seq) no início da análise de sequenciamento de cromatos (ChIP) (seq) no início da análise de Reprogramação. TFs foram codificados em um vetor lentiviral indutor (pFUW-tetO) indutor de doxiciclina (DOX) que contém um elemento de resposta tetraciclina (TRE) e um promotor cmv mínimo, e foram transinduzidos juntamente com um vetor constitutivo contendo a tetraciclina reversa proteína transativadora (pFUW-M2rtTA). Quando o DOX (análogo da tetraciclina) é adicionado após a transdução, ele se liga à proteína rtTA que interage com o TRE permitindo a transcrição do TF (sistema Tet-On). O procedimento requer 25 dias para ser concluído. Para experimentos ChIP-seq, hdfs foram transduced com versões marcadas de GATA2 (pFUW-tetO-3xFLAG-GATA2) e GFI1B (pLV-tetO-HA-GFI1B), além de pFUW-tetO-FOS e TF sites de ligação foram analisados dois dias após a suplementação DOX.
Em última análise, a reprogramação hemogenic de fibroblastos humanos fornece um sistema intratável in vitro para estudar os mecanismos subjacentes à hematopoiese de desenvolvimento humano e uma fonte potencial de HSPCs específicos do paciente para futura aplicação clínica.
Protocolo
Este protocolo foi realizado de acordo com as diretrizes do comitê de ética em pesquisa humana da Universidade de Lund e deve ser feito de acordo com as diretrizes institucionais individuais.
1. Preparação reagente
- Para o meio modificado da Águia de Dulbecco (DMEM)/20% de soro bovino fetal (FBS), misture o DMEM de alta glicose contendo piruvato de sódio com 20% FBS, 1% penicilina-estreptomicina (caneta/estreptococo), 1% L-glutamina, 1% de aminoácidos não essenciais e 10-4 -M2- mercaptoetanol.
- Para dmem completo, misture alta glicose DMEM contendo sódio piruvate com 10% FBS, 1% Pen / estreptococos e 1% L-glutamina.
- Para médio hematopoiético, misture o meio hematopoiético(Tabela de Materiais)com 10-6 M de hidrocortisona e 1% de caneta/estreptococo.
- Use soro soro para o fosfato (PBS) sem cálcio ou magnésio.
2. Isolamento do fibroblasto dérmico humano
Nota: HDFs podem ser comprados de fornecedores certificados(Tabela de Materiais). Nesse caso, expanda os fibroblastos e os use diretamente em experimentos de reprogramação (seção 4). Alternativamente, os HDFs podem ser isolados dos doadores. Se os fibroblastos são isolados de diferentes doadores, manter as amostras separadas uns dos outros em todas as etapas do protocolo. Placas/poços de etiqueta e tubos de coleta com o número de identificação de cada doador.
- Obter HDFs de 3 mm de biópsias de perfuração de pele redonda realizadas por médicos qualificados.
- Cubra três poços de uma placa de 6 poços tratada com cultura de tecidocom 500 μL de 0,1% de gelatina e incubada por 20 min a 37 °C.
- Assaa a solução de gelatina restante e adicione 750 μL de DMEM/20% FBS a cada poço. Toda a superfície do poço deve ser coberta com médio.
- Adicione 1,5 mL de DMEM/20% FBS à superfície interna de uma tampa estéril de 100 mm da placa de Petri e espalhe a queda com o auxílio de uma pipeta sorológica de 5 mL.
- Coloque a biópsia da pele no meio na tampa com fórceps esterilizados.
- Dissecar a biópsia da pele em nove seções idênticas, usando um bisturi esterilizado para manter a biópsia no lugar e um segundo bisturi para cortar.
- Coloque três peças de biópsia por poço usando fórceps pontiagudos. Certifique-se de que as peças se prendem ao fundo do poço.
- Coloque um coverslip de 22 mm em cima das peças e aplique alguma pressão.
- Incubar a placa a 37 °C, 5% CO2, por uma semana. Verifique as células diariamente e adicione 200 μL de DMEM/20% FBS a cada 2 dias para substituir o meio evaporado.
- Após uma semana, adicione até 2 mL de DMEM/20% FBS e substitua o meio a cada 2 a 3 dias.
-
Células de passagem em 1:4 proporção quando os poços são confluentes (cerca de 4 a 8 semanas).
- Prepare placas de 6 poços tratadas com cultura de gelatina de 0,1% de gelatina.
- Aspirate médio de poços em 80% de confluência e lavar uma vez com 1 mL de PBS.
- Retire o deslizamento de cobertura com fórceps estéreis e coloque o coverslip em um novo poço de uma placa de 6 poços, com o lado do tecido para cima.
Nota: As células que permaneceram ligadas ao deslizamento de cobertura também serão colhidas. - Adicione 500 μL de solução de dissociação(Tabela de Materiais)por poço (incluindo poços com os lábios) e incubar a 37 °C, 5% CO2 para 5-10 min. Verifique quando as células começam a subir a partir do fundo do poço e inativar a solução de dissociação por adicionando 500 μL de DMEM/20% FBS a cada poço.
- Coletar fibroblastos de todos os poços em um tubo cônico de 15 mL. Adicione o meio extra aos poços para coletar as células restantes. Centrífuga do tubo a 350 x g por 5 min.
- Enquanto isso, adicione 500 μL de DMEM/20% FBS a cada poço de placas revestidas de gelatina anteriormente.
- Aspiro médio e resuspender fibroblastos em 6 mL de DMEM/20% FBS.
- Adicione 500 μL de suspensão do fibroblasto a cada poço (duas placas de 6 poços por amostra/doador no total). Incubate células durante a noite em 37 °C, 5% CO2.
- No dia seguinte, adicione 1 mL de DMEM/20% FBS para cada poço. Substitua o meio por 2 mL de DMEM/20% FBS a cada 2 a 3 dias até que os poços sejam 80% confluentes.
- Repita a seção 2.11 para três poços de confluentes até que a terceira passagem seja alcançada.
-
Congele os fibroblastos dos poços de confluentes (passagens 1 e 3).
- Aspirate médio dos poços e lavar uma vez com 1 mL de PBS.
- Dissociar e coletar fibroblastos como descrito nos passos 2.11.4 e 2.11.5.
- Conte as células com um hemocytometer e centrífuga o tubo a 350 x g por 5 min.
- Após a centrífugação, aspirar fibroblastos médios e resuspendem na FBS com 10% DMSO a uma densidade de 5 x 105 células/mL.
- Adicione 1 mL da suspensão celular por criovial e congelar as células durante a noite em -80 °C usando um recipiente de congelamento. Mova frascos para -150 °C (nitrogênio líquido) para armazenamento a longo prazo.
3. Produção lentiviral
- Crescer células HEK293T em um prato de 100 mm de cultura de tecido tratado com 10 mL de DMEM completo, a 37 °C, 5% CO2, até que a confluência seja alcançada.
- No dia anterior à transfecção, aspirar médio e lavar o prato cuidadosamente com 5 mL de PBS.
- Após a remoção da PBS, adicione 1,5 mL de solução de dissociação e incubar a 37 °C, 5% CO2 para 5-10 min para dissociar as células do prato.
Nota: Recomenda-se aquecer a solução pbs e dissociação antes de usar, para que as células não sofram um choque térmico. - Inativar a solução de dissociação com 3 mL de DMEM completo e transferir a suspensão celular para um tubo cônico de 15 mL. Lave o prato com 5 mL de DMEM completo para remover as células anexadas restantes e transfira este volume para o tubo cônico de 15 mL.
- Suspensão celular centrífuga a 350 x g por 5 min.
- Aspirate supernatant e dividir a pelota celular uniformemente entre seis 100 mm tecido cultura tratadapratos em um volume final de 10 mL de DMEM completo por prato. As células devem ser aproximadamente 60% confluent até o momento da transfecção.
- No dia seguinte, as células transfect com o plasmídeo se misturam da seguinte forma:
NOTA: Esta parte do protocolo descreve a produção de lentivírus em um prato de 100 mm tratados com cultura de tecido por mistura plasmídeo. Para obter maiores volumes de supernatant lentiviral para concentração, use pelo menos quatro pratos de cultura de células HEK293T de 100 mm por mistura.- Em um tubo cônico de 15 mL, adicione 10 μg dos três plasmídeos de transferência juntos: 3,33 μg de pFUW-tetO-GATA2 (Addgene plasmid #125028)14, 3,33 μg de pFUW-tetO-GFI1B (Addgene #125597)14 e 3,33 μg de pFUW-tetO-FOS (Addgene #125598) + 14 , mais 14 , mais 14 , mais 14 , mais14, mais 14, mais 14, mais 14, mais 14, mais 14, 4, mais 144, mais 144, mais 144, mais 14, mais 14, mais 144, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14, mais 14,mais 10 μg da 2ª geração psPAX2 embalagem vetores codificando a mordaça, Pol, Tat e rev genes (Addgene #12260) e 5 μg de pMD2.G envelope vetor codificando o gene VSV-G (Addgene #12259). Adicione a água até 500 μL.
- Em dois novos tubos cônicos de 15 mL adicionam 10 μg de plasmid FUW-M2rtTA (Addgene #20342)17,10 μg de vetor de embalagens psPAX2 e 5 μg de vetor de envelope pMD2.G a cada tubo. Adicione a água até 500 μL. Um tubo vai ser usado como um controle.
- A cada tubo adicione 62,5 μL de 2 M CaCl2. Em seguida, libere bolhas em cada mistura usando um pipet pasteur inserido em um controlador de tubos. Enquanto as bolhas estão se formando, pipette 500 μL de N,N-bis(2-hidroxyethyl)-2-aminoethanesulfonic ácido (BES) salina tampão (pH 7,1, 25 °C), com uma pipeta P1000, drop-wise contra o tubo Pasteur e sobre a mistura.
- Incubam tubos à temperatura ambiente por pelo menos 15 min. As misturas aparecerão ligeiramente nebuloso depois de algum tempo.
- Enquanto isso, aspirar médio de pratos de células HEK293T (passado no dia anterior) e adicionar 10 mL de DMEM completo sem antibióticos. Tenha cuidado e adicione o meio lentamente como células HEK293T são semi-aderentes.
- Distribua cada mistura individual (aproximadamente 1 mL) uniformemente e drop-wise em pratos separados e incubar durante a noite em 37 °C, 5% CO2.
- Substitua o meio por 4 mL de DMEM completo, 24 h após a incubação. Incubar durante a noite em 37 °C, 5% CO2. Se disponível, incubar em vez de 32 °C, 5% CO2, como a temperatura reduzida irá aumentar a meia-vida das partículas lentivirais.
- Colete supernatant com partículas lentivirais três vezes a um tubo cónico de 50 mL. Não misture diferentes partículas lentivirais neste momento. Cada prato resultará em 12 mL de supernatant lentiviral. Quatro pratos da mesma preparação viral cabem em um tubo cônico de 50 mL.
CUIDADO: Realize a coleta lentiviral em um laboratório de nível 2 de biossegurança em um capô de fluxo laminar dedicado ao trabalho lentiviral e coloque resíduos contaminados virais (tubos, dicas, pratos) em um recipiente apropriado para materiais bioperigosos.- Faça a primeira coleção 16 h após a última incubação e adicione 4 mL de DMEM completo. Incubar a 37 °C, 5% CO2.
- Faça a segunda coleção 8 h após o primeiro para o mesmo tubo, adicione 4 mL de DMEM completo e incubar a 37 °C, 5% CO2.
- Faça a terceira coleção 16 h após o segundo para o mesmo tubo e descartar os pratos.
Nota: Armazenar supernatantes lentivirais a 4 °C após cada coleção.
- Filtre cada supernatant lentiviral usando um filtro de ligação de 0,45 μm de baixa proteína com uma membrana de acetato de celulose(Tabela de Materiais)para um tubo limpo.
- Adicione um máximo de 15 mL de supernatant filtrado a uma unidade centrífuga do filtro com uma membrana regenerada da celulose(tabela dos materiais)e gire em 4.000 x g para 25 min, em 4 °C. Descarte o fluxo. Um líquido viscoso contendo lentivírus permanecerá na unidade de filtro.
- Repita o passo 3.13 adicionando 15 mL de supernatant em cima da unidade de filtro, até que não haja mais supernatant lentiviral esquerda.
Nota: Quando há apenas alguns mililitros de supernatant para se concentrar, diminuir o tempo de fiação para 10 min. Se ainda houver líquido extra (não viscoso) no filtro, centrífuga por mais 10 min. - Faça alíquotas (50 a 200 μL dependendo do volume supernatant inicial) de cada tipo de lentivírus concentrados e guarde a -80 °C para armazenamento a longo prazo (1-2 anos) ou em 4 °C para armazenamento a curto prazo (1-2 semanas).
Nota: Lentivírus concentrados ou não concentrados também podem ser usados frescos. Não recongele e descongele, pois isso resulta em redução do díter.
4. Reprogramação hemogénica
Nota: Use HDFs com um número de passagem de três (P3) ou superior (até P10) para realizar experimentos de reprogramação.
- Cubra um prato de 100 mm tratado sitecido com 5 mL de 0,1% de gelatina e incubada a 37 °C por 20 min. Aspirate a solução de gelatina restante.
- Descongele um frasco de fibroblasto e células de placa no prato revestido de gelatina de 0,1%. Incubar durante a noite em 37 °C, 5% CO2. Se necessário, expanda fibroblastos por um período de tempo mais longo até que a passagem e a confluência desejadas estejam alcançadas.
- Cubra uma placa de 6 poços tratadas com cultura de tecido com 500 μL de 0,1% de solução de gelatina e incubar a 37 °C por 20 min. Retire gelatina extra.
- HDFs de placa a uma densidade de 150.000 células por placa (25.000 células por poço) em 2 mL de DMEM completo por poço. Incubar durante a noite em 37 °C, 5% CO2, para permitir o acessório celular.
- Substitua o meio por 2 mL de DMEM completo mais 8 μg/mL polibrene. Prepare uma mistura de proporção de 1:1 de lentivírus TF produzidos em piscina e M2rtTA em um novo tubo de microcentrífuga.
Nota: Neste protocolo, é realizada a produção de pool de lentivírus para os três TFs, o que, nas mãos dos autores, resulta em maior eficiência de reprogramação. Alternativamente, sugere-se realizar uma titration das partículas lentivirais individuais por qPCR18,em uma linha de pilha padrão. Isso será usado para definir o volume de vírus individuais necessários para atender a uma multiplicidade de infecção (MOI) ideal para co-transdução e reprogramação hemogénica. - Distribua 10 a 100 μL de mistura lentiviral por poço, para transduzir HDFs. Este é o dia -2 de reprogramação.
Nota: Definir o volume ideal de mix lentiviral para reprogramação eficiente, sem comprometer a viabilidade celular, requer otimização (ver Figura Suplementar 1 para mais detalhes). HDFs com mais de 7 passagens podem exigir maiores volumes de vírus do que as células com passagens mais baixas. - Após 16 h de incubação, remover vírus e adicionar DMEM completo. Permita que as células se recuperem por 6 a 8 h.
- Após a recuperação, aspirar médio e adicionar 2 mL de DMEM completo com 8 μg/mL polibrene.
- Faça uma segunda transdução, conforme descrito na etapa 4.6 e incubar a 37 °C, 5% CO2 para 16 h. Este é o dia -1 de reprogramação. A mistura lentiviral pode ser preparada no dia -2 para ambas as transducações e mantida em 4 °C.
- No dia seguinte, retire os vírus e adicione o DMEM completo complementado com 1 μg/mL DOX. Este é o dia 0 de reprogramação. Incubar a 37 °C, 5% CO2 para 48 h.
-
No dia 2 de reprogramação, dividir cada poço em 1:2 relação.
- Aspirate células médias e lavam com 1 mL de PBS.
- Aspirate PBS e dissociar células com 500 μL de solução de dissociação. Incubar 5-10 min a 37 °C, 5% CO2.
- Inativar a solução de dissociação com 1 mL de DMEM completo e coletar células em um tubo cônico. Centrífuga a 350 x g por 5 min.
- Resuspenda a pelota no meio hematopoiético (ver passo 1.3), complementada com 1 μg/mL DOX, e células de placa em novas placas de 6 poços tratadas pela cultura de tecidores com gelatina de 0,1% a um volume final de 2 mL por poço.
- Alterar médio (médio hematopoiético mais DOX) duas vezes por semana para a duração das culturas de reprogramação (25 dias).
- Analise as células reprogramadas resultantes em diferentes momentos por microscopia de campo brilhante ou fluorescência (ver Figura Suplementar 2),citometria de fluxo, sequenciamento de RNA em massa e células únicas e ensaios de transplante para a aquisição de morfologia hematopoiética, presença de marcadores endotélicos e hematopoiéticos, aquisição do perfil de expressão gênica endoteliética/hematopoiética e capacidade de regeneração14.
5. Otimização da expansão do fibroblasto para análise de ChIP-seq no início da reprogramação hemogenic
- Placa 300.000 HDFs (2.
- No dia seguinte, substitua o meio por DMEM completo complementado por polibreno de 8 μg/mL.
- Células transduciantes com fatores individuais: pFUW-tetO-FOS14, pLV-tetO-HA-GFI1B (Addgene #125599)14 e pFUW-tetO-3xFLAG-GATA2 (Addgene #125600)14 ou com um pool dos três fatores, além de FUW-M2rtTA às 1:1 ratio. Use 10 a 20 μL vírus total (TF individual + M2rtTA ou três TFs + M2rtTA). Incubate células durante a noite em 37 °C, 5% CO2.
Nota: Recomenda-se usar doze placas de 6 poços por condição (para cada TF individual e os três TFs combinados). - Remover lentivírus e adicionar DMEM completo 16 h após a primeira transdução. Deixe as células se recuperarem por 6 a 8 h.
- Transduzem as células uma segunda vez com a mesma quantidade de vírus por condição e incubam a 37 °C, 5% CO2.
- No dia seguinte, remover vírus e adicionar DMEM completo. Incubar a 37 °C, 5% CO2 para 24 h.
- Replacar cada poço em um prato de 100 mm tratado sigelatina de 0,1% com DMEM completo para um volume final de 10 mL por prato. Isso representa aproximadamente uma passagem de 1:6.
- Permitir que as células cresçam por 6 dias a 37 °C, 5% DECO 2.
- No dia 6 após o re-revestimento, aspirar médio e adicionar DMEM completo com 1 μg/mL DOX. Incubate células a 37 °C, 5% CO2 por 2 dias.
- Coletar fibroblastos e analisar locais de ligação genômica dos três TFs transduzidos individualmente ou em combinação, por ChIP-seq 2 dias após a suplementação DOX14.
Nota: Os pratos finais de setenta e dois 100 mm conterão entre 20 a 50 x 106 células, suficientes para realizar experimentos e réplicas de ChIP-seq.
Resultados
Uma representação esquemática da abordagem de reprogramação usando HDFs é ilustrada na Figura 1A. Fibroblastos são adquiridos a partir de fontes comerciais ou coletados de doadores humanos e expandido in vitro anterior para reprogramação. Após o revestimento, as células são transinduzidas duas vezes com lentivírus GATA2, GFI1B e FOS (e M2rtTA), e a doxiciclina é adicionada no dia 0 de reprogramação. No dia 2, as células são divididas e banhadas em meio hematopoiético até o dia 25 da cultura. Células reprogramadas podem ser geradas em diferentes momentos para múltiplas aplicações, incluindo transplante em camundongos imunocomprometidos, sequenciamento de RNA unicelular (scRNA-seq) de populações de células purificadas (dia 2 sem sorte, dia 15 CD49f+ CD34 e CD34 e CD34 e dia 25 CD49f+CD34+ células), bem como análise de microscopia e fluxo de citometria para os marcadores de superfície celular CD49f, CD34, CD9 e CD143. Parcelas representativas de citometria mostram ~ 17% das células reprogramadas expressando CD49f e CD9 (Figura 1B, painel esquerdo),após 25 dias de reprogramação. A maioria das células duplas positivas expressa CD143 (~86%), e uma pequena população expressa CD34 (0,9%), sugerindo uma indução dinâmica do destino hemogénico. Esses marcadores não são ativados em HDFs transinduzidos por M2rtTA cultivados por 25 dias(Figura 1B, painel direito). As imagens de imunofluorescência confirmam a expressão de CD9 e CD143 em células aderentes e redondas, morfologicamente distintas dos fibroblastos que são negativas para esses marcadores(Figura 1C). Colônias hemogenic humanas também expressam CD49f e CD3414. Análise ScRNA-seq de HDFs, células não classificadas do dia 2 e células reprogramadas purificadas no dia 15 (CD49f+CD34-) e dia 25 (CD49f+CD34+) mostram um aumento superficial na expressão de CD49f, CD9 e CD143 do dia 2 ao dia 25. As células positivas CD49f e CD9 aparecem primeiro durante o processo de reprogramação, entre os dias 2 e 15, indicando que essas moléculas podem representar marcadores da hemogênese humana primitiva. A expressão cd143 começa a ser detectada no dia 15 e as células expressantes CD34 são detectadas apenas em pontos posteriores (dia 25). As células CD34+ sangue do cordão umbilical (UCB) foram utilizadas como referência(Figura 1D).
A Figura 2A descreve um protocolo modificado para gerar número suficiente de células para a análise ChIP-seq nos estágios iniciais da reprogramação hemogénica (dia 2). Primeiro, os HDFs são banhados a uma densidade duas vezes maior do que no protocolo padrão (300.000 células versus 150.000 células por placa). Após a transdução, cada poço é rebanhado em um prato de 100 mm permitindo que as células se expandam por 6 dias antes de completar o meio com DOX. As células são analisadas 2 dias após a adição do DOX e consequente expressão de TF. A Figura 2B mostra os perfis do navegador genoma do GATA2 ligados às regiões regulatórias genômicas de ITGA6 e ACE quando as células são cotransinduzidas com os três fatores (3TFs) ou GATA2 individualmente. GATA2 também se liga a abrir regiões de cromatina de CD9 e CD34 genes14.
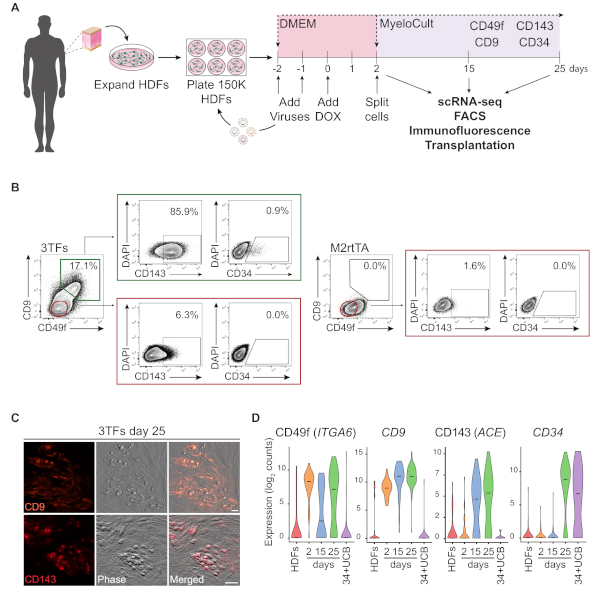
Figura 1: Indução do destino hemogénico em fibroblastos dérmicos humanos. (A)Estratégia experimental para reprogramação hemogénica de fibroblastos dérmicos humanos (HDFs). Fibroblastos de biópsias de perfuração da pele são coletados de doadores, expandidos e transinduzidos com lentivírus GATA2, GFI1B, FOS e M2rtTA. A doxiciclina (DOX) é adicionada à cultura no dia 0 de reprogramação e as células são analisadas em vários pontos de tempo até o dia 25. scRNA-seq, sequenciamento de RNA de uma única célula. FACS, triagem de células ativadas por fluorescência. (B) Estratégia de gating usada para avaliar a expressão de marcadores hemogenic/hematopoietic pela citometria do fluxo no dia 25 após a transdução com os três fatores da transcrição (3TFs). Parcelas de citometria mostram porcentagem de células duplas positivas para CD49f e CD9, fechados na população de células vivas (DAPI-negativo). Dentro da população duplamente positiva, mostra-se a expressão de CD143 e CD34. HDFs transduced somente com vírus de M2rtTA as mesmas circunstâncias da cultura são usados como o controle. (C) Imagens de imunofluorescência das colônias reprogramadas do dia 25 confirmando a expressão de CD9 (painel superior) e CD143 (painel inferior). As células foram manchadas com anticorpos(Tabela de Materiais)diluído 1:100 em PBS/2% FBS com soro de rato, incubado 20 min em 37 °C, 5% CO2, lavado três vezes e imagemda em PBS/2% FBS. Fase, contraste de fase-gradiente. Barras de escala = 50 μm. (D)Análise ScRNA-seq de 253 células em diferentes pontos de tempo. Expressão de ITGA6, CD9, ACE e CD34 é ativada durante a reprogramação. As células são coletadas no dia 2 (não sorteado), dia 15 (CD49f+CD34-) e dia 25 (CD49f+CD34+). HDFs e CD34+ sangue do cordão umbilical (34+UCB) células são usadas como referências. Clique aqui para ver uma versão maior deste número.
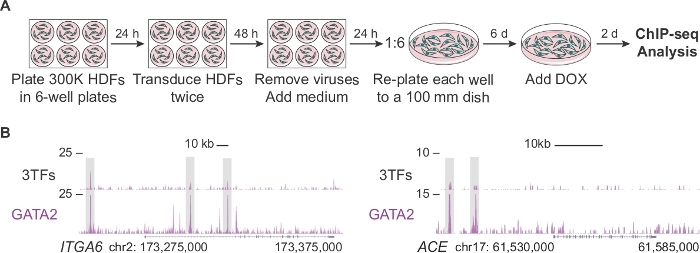
Figura 2: Expansão de fibroblastos dérmicos humanos para a análise chip-seq. (A)Estratégia experimental que descreve um protocolo modificado para gerar um número elevado de fibroblastos dérmicos humanos transduced (HDFs) para ChIP-seq no dia 2 da reprogramação. 300.000 células são banhadas em placas de 6 poços e transinduzidas duas vezes com fatores individuais (pFUW-tetO-FOS, pLV-tetO-HA-GFI1B ou pFUW-tetO-3xFLAG-GATA2) ou uma combinação dos três fatores (mais M2rtTA). Após a remoção de vírus, fibroblastos são expandidos por seis dias em pratos de 100 mm. A doxiciclina (DOX) é adicionada no dia 0 e as células são coletadas dois dias após a adição do DOX. (B) Perfis do navegador Genoma destacando sites de ligação GATA2 (caixas cinzentas) na ITGA6 e ace loci dois dias após a transdução com os três fatores de transcrição (3TFs) ou apenas com GATA2. O número total de leituras mapeadas está representado no eixo y. Clique aqui para ver uma versão maior deste número.
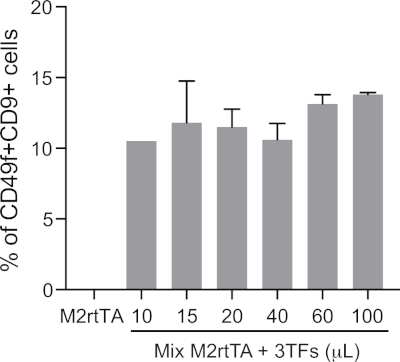
Figura suplementar 1: Definindo um volume lentiviral otimizado para reprogramação hemogénica eficiente. Volumes crescentes de partículas lentivirais produzidas em piscina (10 a 100 μL) (10 a 100 μL) produzem (3TFs: GATA2, GFI1B e FOS) são usados para transduzir fibroblastos dérmicos humanos (HDFs), juntamente com M2rtTA em uma proporção de 1:1, seguindo os passos 4,5-4,12 do protocolo. As células reprogramadas são analisadas no dia 25 para definir um volume ideal de transdução para reprogramação hemogénica, dada pela porcentagem de CD49f+CD9+ células fechadas em células vivas (DAPI-negativa). A viabilidade celular pode ser avaliada quantificando o número absoluto de células vivas no dia 25. HDFs transduced com M2rtTA (100 μL) são usados como controle negativo. Clique aqui para ver uma versão maior deste número.

Figura suplementar 2: A morfologia muda durante a reprogramação hemogénica de fibroblastos dérmicos humanos. As culturas de Fibroblasto Dérmico Humano (HDF) são imagemdas no dia da primeira transdução (dia -2), quando o DOX é adicionado às culturas (dia 0), dois dias (dia 2) e quinze dias (dia 15) após a suplementação DOX, e no ponto final do experimento (dia 25). Colônias hemogénicas nos dias 15 e 25 são destacadas. Barras de escala = 100 μm. Por favor, clique aqui para ver uma versão maior deste número.
Discussão
Neste artigo, um método é descrito para gerar células progenitoras hematopoiéticas diretamente dos fibroblastos humanos, que passam por um intermediário de células HP, da mesma forma que os HSCs14definitivos.
A produção de pool de partículas lentivirais codificando GATA2, GFI1B e FOS foi preferida em relação à produção individual, uma vez que em nossas mãos resulta em maior eficiência de reprogramação (dados inéditos). Lentiviruses, como membros da família Retroviridae, normalmente contêm duas cópias de positivo single-stranded RNA19. O aumento da eficiência de reprogramação pode ser devido à embalagem de dois transgenes diferentes na mesma partícula lentiviral, resultando em aumento do número de células co-transinduzidas com os três fatores de transcrição. Para garantir o sucesso desse protocolo, é necessário transduzir HDFs com quantidade adequada de vírus, dependendo da passagem celular para obter um equilíbrio ideal entre a eficiência de reprogramação e viabilidade celular, conforme recomendado na etapa 4.6. Além disso, vírus frescos não concentrados podem ser usados. Recomenda-se transduzir células com 0,5-3 mL de piscina 3TFs e M2rtTA. Além disso, a densidade celular deve ser ajustada de acordo com a aplicação. 150 000 HDFs por placa de 6 poços (passo 4.4) forneceram a densidade ideal para realizar análise suita, transplante e citometria de fluxo de células reprogramadas. Para experimentos ChIP-seq, mais células foram necessárias desde o início (passo 5.1). É importante verificar regularmente as células quanto a alterações morfológicas e substituir o meio hematopoiético duas vezes por semana para apoiar o surgimento de células hematopoiéticas induzidas. A adição de citocinas hematopoiéticas ou cocultura em camadas de alimentação pode aumentar a eficiência de reprogramação.
Com este método, podemos identificar novos marcadores hematopoiéticos que são expressos dinamicamente durante a reprogramação hemogénica. O CD9, que se mostrou regulado em células reprogramadas no nível transcricional14,é rapidamente expresso na superfície celular nas fases iniciais de reprogramação, juntamente com CD49f e CD143, servindo como um novo marcador de precursores humanos do HSC. Mostramos também que a ITGA6 e a ACE são alvos diretos do GATA2 durante os estágios iniciais de reprogramação hemogénica, além de CD9 e CD3414,proporcionando uma ligação mecanicista direta entre a hemogenicidade humana precursor fenótipo e GATA2.
Uma vantagem deste sistema reside no uso de culturas fibroblasto relativamente homogêneas. Enquanto os PSCs são facilmente expandidos e mantidos in vitro,os protocolos de diferenciação geram populações heterogêneas que incluem progenitores hematopoiéticos, que enxertam mal5,6,7. Além disso, existe o risco de tumorigênese ao transplantar HSPCs derivados de PSC, uma vez que pscs indiferenciados ainda podem permanecer na cultura, mesmo depois de empregar protocolos de diferenciação. Alternativamente, para fibroblastos, reprogramação direta para HSCs tem sido aplicada a progenitores cometidos pelo sangue20 e células endotélias21. No entanto, começar com células progenitoras com restrição sanguínea dificulta a aplicação terapêutica dos HSCs resultantes se o paciente carrega mutações que afetam a população hematopoiética de tronco/progenitor22. No caso das células endotélias, estas são mais difíceis de obter em comparação com fibroblastos, e constituem uma população celular muito heterogênea em termos de fenótipo, função e estrutura, que são dependentes de órgãos23. Outros estudos conseguiram reprogramar fibroblastos de camundongos em progenitores hematopoiéticos esgraftáveis24,25 ainda, até agora, nenhum outro protocolo descreve a geração de células semelhantes a HSPC de fibroblastos humanos.
Esta abordagem, juntamente com a inibição farmacológica, gene knock-out, ou knock-down permite definir individual ou combinação de fatores que são necessários para induzir diretamente HSCs humanos. Crispr-Cas9 tecnologias em HDFs antes da reprogramação, representa um esforço emocionante para definir novos reguladores da hematopoiese definitiva humana. No futuro, a reprogramação de tipos de células humanas não relacionadas ao sangue, como fibroblastos, servirá como uma plataforma para gerar células progenitoras hematopoiéticas saudáveis medida do paciente para aplicações clínicas.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
A Fundação Knut e Alice Wallenberg, a Faculdade de Medicina da Universidade e Região de Lund Skåne são reconhecidas por generoso apoio financeiro. Este trabalho contou com o apoio de uma subvenção da Olle Engkvists Stiftelse (194-0694 a Filipe Pereira) e bolsas de doutoramento da Fundação para a Ciência e Tecnologia (PTDC/BIM-MED/0075/2014 a Filipe Pereira, e SFRH/BD/135725/2018 e SFRH/BD/51968/2012 para Rita Alves e Andreia Gomes). Este estudo também foi apoiado por fundos do NIH e NYSTEM (1R01HL119404 e C32597GG para Kateri A. Moore).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.45 μm low-protein binding filter, 150 mL Bottle Top Vacuum Filter | Corning | #430625 | |
| 2-Mercaptoethanol | Sigma-Aldrich | #M6250 | |
| Alexa Fluor 488 anti-human CD34 clone 581 | BioLegend | #343518 | |
| BD Pharmingen APC Mouse Anti-Human Angiotensin Converting Enzyme (CD143) clone BB9 | BD Biosciences | #557929 | |
| BES buffered saline | Sigma-Aldrich | #14280 | |
| Calcium chloride (CaCl2) | Sigma-Aldrich | #449709 | |
| Centrifugal filter unit, Amicon Ultra-15 Centrifugal Filter Unit | Sigma-Aldrich | #UFC903096 | |
| Dissociation solution, TrypLE Express Enzyme (1x) no phenol red | Gibco | #12604-021 | |
| Doxycycline hyclate (DOX) | Sigma-Aldrich | #D9891 | |
| eBioscience CD49f (Integrin alpha 6) Monoclonal Antibody (eBioGoH3 (GoH3)), PE-Cyanine7 | Invitrogen | #25-0495-82 | |
| FUW-M2rtTA | Addgene | #20342 | |
| Gelatin from Porcine Skin Type A | Sigma-Aldrich | #G1890 | |
| Gibco L-Glutamine (200 mM) | ThermoFisher Scientific | #25030-024 | |
| Gibco MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | #11140-035 | |
| Hematopoietic medium, MyeloCult H5100 | STEMCELL Technologies | #05150 | |
| Hexadimethrine bromide (polybrene) | Sigma-Aldrich | #H9268 | |
| Human Dermal Fibroblasts (HDFs) | ScienCell | #2320 | |
| HyClone Dulbecco's Modified Eagles Medium (DMEM) | GE Healthcare | #SH30243.01 | |
| HyClone Fetal Bovine Serum (FBS) | GE Healthcare | #SV30160.03 | |
| HyClone Penicillin Streptomycin 100x Solution (Pen/Strep) | GE Healthcare | #SV30010 | |
| HyClone Phosphate Buffered Saline solution (PBS) | GE Healthcare | #SH30256.01 | |
| Hydrocortisone | STEMCELL Technologies | #7904 | |
| Mouse serum | Sigma-Aldrich | #M5905 | |
| PE anti-human CD9 Antibody clone HI9a | BioLegend | #312105 | |
| pFUW-tetO-3xFLAG-GATA2 | Addgene | #125600 | |
| pFUW-tetO-FOS | Addgene | #125598 | |
| pFUW-tetO-GATA2 | Addgene | #125028 | |
| pFUW-tetO-GFI1B | Addgene | #125597 | |
| pLV-tetO-HA-GFI1B | Addgene | #125599 | |
| pMD2.G | Addgene | #12259 | |
| psPAX2 | Addgene | #12260 |
Referências
- Ivanovs, A., et al. Highly potent human hematopoietic stem cells first emerge in the intraembryonic aorta-gonad-mesonephros region. Journal of Experimental Medicine. 208, 2417-2427 (2011).
- Tavian, M., Biasch, K., Sinka, L., Vallet, J., Péault, B. Embryonic origin of human hematopoiesis. International Journal of Developmental Biology. 1065, 1061-1065 (2010).
- Medvinsky, A., Rybtsov, S., Taoudi, S. Embryonic origin of the adult hematopoietic system: advances and questions. Development. 138, 1017-1031 (2011).
- Ivanovs, A., et al. Human haematopoietic stem cell development: from the embryo to the dish. Development. 144, 2323-2337 (2017).
- Daniel, M. G., Pereira, C. F., Lemischka, I. R., Moore, K. A. Making a Hematopoietic Stem Cell. Trends in Cell Biology. 26, 202-214 (2016).
- Vo, L., Daley, G. De novo generation of HSCs from somatic and pluripotent stem cell sources. Blood. 125, 2641-2648 (2015).
- Rafii, S., et al. Human ESC-derived hemogenic endothelial cells undergo distinct waves of endothelial to hematopoietic transition. Blood. 121, 770-781 (2013).
- Ebina, W., Rossi, D. J. Transcription factor-mediated reprogramming toward hematopoietic stem cells. EMBO Journal. 34, 694-709 (2015).
- Sugimura, R., et al. Haematopoietic stem and progenitor cells from human pluripotent stem cells. Nature. 545, 432-438 (2017).
- Pereira, C. F., et al. Induction of a Hemogenic Program in Mouse Fibroblasts. Cell Stem Cell. 13, 205-218 (2013).
- Pereira, C. F., et al. Hematopoietic Reprogramming In vitro Informs In Vivo Identification of Hemogenic Precursors to Definitive Hematopoietic Stem Cells. Developmental Cell. 36, 525-539 (2016).
- Notta, F., et al. Isolation of Single Human Hematopoietic Stem Cells Capable of Long-Term Multilineage Engraftment. Science. 333, 218-221 (2011).
- Sinka, L., Biasch, K., Khazaal, I., Péault, B., Tavian, M. Angiotensin-converting enzyme (CD143) specifies emerging lympho-hematopoietic progenitors in the human embryo. Blood. 119, 3712-3724 (2012).
- Gomes, A. M., et al. Cooperative Transcription Factor Induction Mediates Hemogenic Reprogramming. Cell Reports. 25, 2821-2835 (2018).
- Karlsson, G., et al. Report The Tetraspanin CD9 Affords High-Purity Capture of All Murine Hematopoietic Stem Cells. Cell Reports. 4, 642-648 (2013).
- Leung, K. T., et al. The tetraspanin CD9 regulates migration, adhesion, and homing of human cord blood CD34+ hematopoietic stem and progenitor cells. Blood. 117, 1840-1851 (2011).
- Hockemeyer, D., et al. A drug-inducible system for direct reprogramming of human somatic cells to pluripotency. Cell Stem Cell. 3, 346-353 (2008).
- Kutner, R. H., Zhang, X., Reiser, J. Production concentration and titration of pseudotyped HIV-1-based lentiviral vectors. Nature Protocols. 4, 495-505 (2009).
- Suzuki, Y. S., Suzuki, Y., Ke, X. Gene Regulatable Lentiviral Vector System. Viral Gene Therapy. , (2011).
- Riddell, J., et al. Reprogramming committed murine blood cells to induced hematopoietic stem cells with defined factors. Cell. 157, 549-564 (2014).
- Lis, R., et al. Conversion of adult endothelium to immunocompetent haematopoietic stem cells. Nature. 545, 439-445 (2017).
- Pereira, C., Lemischka, I. R., Moore, K. From blood to blood’: de-differentiation of hematopoietic progenitors to stem cells. EMBO Journal. 33, 1511-1513 (2014).
- Nolan, D. J., et al. Molecular Signatures of Tissue-Specific Microvascular Endothelial Cell Heterogeneity in Organ Maintenance and Regeneration. Developmental Cell. 26, 204-219 (2013).
- Batta, K., Florkowska, M., Kouskoff, V., Lacaud, G. Direct Reprogramming of Murine Fibroblasts to Hematopoietic Progenitor Cells. Cell Reports. 9, 1871 (2014).
- Cheng, H., et al. Reprogramming mouse fibroblasts into engraftable myeloerythroid and lymphoid progenitors. Nature Communications. 7, 1-15 (2016).
Erratum
Formal Correction: Erratum: Hemogenic Reprogramming of Human Fibroblasts by Enforced Expression of Transcription Factors
Posted by JoVE Editors on 12/03/2019. Citeable Link.
An erratum was issued for: Hemogenic Reprogramming of Human Fibroblasts by Enforced Expression of Transcription Factors. The author affiliations were updated.
The second author affiliation was updated from:
2Wallenberg Center for Molecular, Lund University
to:
2Wallenberg Center for Molecular Medicine, Lund University
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados