Method Article
إعداد متوسط لزراعة الكائنات الحية الدقيقة في ظل ظروف اللاهوائية / اللاهوائية بدقة
* These authors contributed equally
In This Article
Summary
وبما أن الكائنات اللاهوائية الملتزمة غير قادرة على النمو عند التعرض للأكسجين، فإن استخدام تقنيات الزراعة اللاهوائية أمر لا غنى عنه. هنا، نبرهن على طريقة بسيطة وفعالة لزراعة ثقافة مختلطة مستمدة من مصنع للغاز الحيوي من إعداد وسائل الإعلام إلى الغاز والقياس الكمي للحمض الدهني المتطاير.
Abstract
على النقيض من الكائنات الهوائية، تتطلب الكائنات الحية الدقيقة اللاهوائية بدقة عدم وجود الأكسجين وعادة ما تكون إمكانية الأكسدة منخفضة لبدء النمو. كما الأكسجين هو في كل مكان في الهواء، والاحتفاظ O2خالية من الظروف خلال جميع خطوات الزراعة هو التحدي ولكن شرطا مسبقا للزراعة اللاهوائية. ويبين البروتوكول المعروض هنا نجاح زراعة ثقافة مختلطة لاهوائية مستمدة من مصنع للغاز الحيوي باستخدام طريقة بسيطة وغير مكلفة. يتم إعطاء وصف دقيق لكامل عملية زراعة اللاكسي بما في ذلك إعداد وسائل الإعلام، وملء قوارير الزراعة، والمكملات الغذائية مع مؤشر الأكسدة والحد من العوامل لتوفير إمكانات الأكسدة منخفضة، فضلا عن تبادل مساحة الرأس للحفاظ على وسائل الإعلام خالية من الأكسجين. وعلاوة على ذلك، يتم توفير نظرة عامة مفصلة على قوارير المصل ضيق الغاز المطهر ة عنطريق التعقيم (باستخدام المحاقن والإبر المعقمة) وظروف الحضانة المناسبة. ويتناول هذا البروتوكول كذلك أخذ عينات من الغاز والسوائل لإجراء تحليلات لاحقة فيما يتعلق بتكوين الغاز وتركيزات الأحماض الدهنية المتطايرة باستخدام الكروماتوغرافيا الغازية والكروماتوغرافيا السائلة العالية الأداء، على التوالي، وعلى حساب الغاز الحيوي والميثان الغلة النظر في قانون الغاز المثالي.
Introduction
على الأرض الأكسجين الجزيئي في تركيزات ملحوظة متاح في المناطق التي لديها اتصال مباشر مع الغلاف الجوي أو في وجود phototrophs الأكسجين. وتسمى البيئات التي يكون فيها الأكسجين غائبا اللاهوائية. ومع ذلك، تحويل الطاقة لا يزال ممكنا في ظل الظروف اللاهوائية عن طريق اثنين من العمليات الأيضية المختلفة، والتخمير والتنفس اللاهوائي1.
في حين أن الكائنات التي تمر بالتنفس الهوائي تستخدم الأكسجين كمقبل الإلكترون الطرفي، فإن التنفس اللاهوائي يتطلب مقبلين إلكترون بديلين مثل النترات أو الكبريتات2. في ما يسمى "برج الإلكترون"، يتم تنظيم الأزواج الأكسدة وفقا لإمكاناتها الأكسدة، مع تلك الأكثر سلبية تقع في الجزء العلوي (المانحين الإلكترون) وأقوى عوامل الأكسدة مع إمكانية الأكسدة الإيجابية في الجزء السفلي (تقبل الإلكترون). نقل الإلكترون بين المانحين والمقبولين يؤدي إلى الحفاظ على الطاقة عن طريق ما يسمى سلسلة الجهاز التنفسي والإلكترونات يمكن التقاطها من قبل تقبل الإلكترون - للبقاء في الصورة - في طوابق مختلفة من البرج. وبالتالي، كلما ارتفع سقوط الإلكترونات من خلال برج الإلكترون، كلما زاد استهلاك الطاقة من خلال رد الفعل المعني. لذلك، التنفس ممكن أيضا في الموائل اللاهوائية، على سبيل المثال، مع أزواج الأكسدة بما في ذلك NO3-/ NO2-، حمض الفوماريك / حمض السوتشينيك، SO32-/ H2S، S° / H2S، Mn (IV)/Mn (II) )، Fe(III)/Fe(II)2،3. أولا، يتم حفظ الطاقة الناتجة كإمكانات الغشاء، والتي تستخدم في وقت لاحق عن طريق الفسفور نقل الإلكترون لتوليف أدينوسين ثلاثي الفوسفات (ATP) بواسطة غشاء ملزمة ATP-synthases. وعلى النقيض من التنفس الهوائي، يمكن تخفيض كمية الطاقة التي يمكن الحفاظ عليها عن طريق التنفس اللاهوائي بشكل كبير. ومع ذلك، فإن إنتاج الطاقة من معظم التنفس اللاهوائي لا يزال أعلى بالمقارنة مع التخمير، ومسار الحفاظ على الطاقة اللاهوائية في الموائل التي تفتقر إلى الأكسجين وغيرها من تقبل الإلكترون الطرفية2.
أثناء التخمير، يتم تحلل ركائز العضوية الغنية بالطاقة إلى مختلف منتجات التخمير التي غالباً ما تحدد اسم العملية الشاملة، على سبيل المثال، التخمير الكحولي. وعلى النقيض من عمليات التنفس، يقتصر توليد ATP أثناء التخمير على الفسفورية على مستوى الركيزة التي يتم خلالها نقل مجموعة الفوسفات إلى أدينوسين-دي فوسفات (ADP) من الركيزة الفسفورية الغنية بالطاقة2. الكائنات الحية الدقيقة التخمير تلعب دورا مركزيا في تدهور اللاهوائية من المواد العضوية لأنها اللاعبين الرئيسيين في انهيار الركيزة. منتجات التخمير الأولية، مثل الأحماضالعضوية، والكحول، CO 2، و H2،ويمكن استخدامها في وقت لاحق من قبل الكائنات الحية الدقيقة التخمير الثانوية لإنتاج حمض الخليك، CO2،و H2. وتشمل الأمثلة على منتجات التخمير حمض اللبنيك، ومختلف الأحماض الدهنية المتطايرة (الفورميك، الخليك، بروبيونيك، بوتيريك، حمض حشيشة الهر)، ن-بيوتانول، 2،3-بيوتانديول، الأسيتون، والإيثانول.
زراعة الكائنات الحية الدقيقة في ظل ظروف لاهوائية بحتة يتطلب أساليب ومعدات مختلفة تماما مقارنة مع زراعة الكائنات الهوائية. في حين أن الكائنات التي تحمل الأكسجين غالبا ما تزرع على أطباق أجار، ما يسمى الثقافات السطحية، وهذا هو - مع استثناءات قليلة - بالكاد ممكن للكائنات الدقيقة اللاهوائية بدقة. لذلك، يتم تأسيس ثقافات الإثراء من الكائنات الحية الدقيقة اللاهوائية بدقة أساسا في وسائل الإعلامالسائلة تطبيق الأوعية الثقافية مختومة مع الحاجز ضيق الغاز التي تضمن الغلاف الجوي خالية من الأكسجين headspace 4،6، 7.
وسيوفر الوصف الحالي للبروتوكول أساليب زراعة مناسبة للكائنات الدقيقة المستهدفة من مجموعة مختلطة من السكان المستمدة من مصنع للغاز الحيوي اللاهوائي. بل إن عزل الثقافات النقية وزراعتها أكثر تحديا ولكنليس جزءا من هذا العمل.
هنا، نعرض الإجراء لزراعة مجتمع الميكروبات اللاهوائية على أساس دراسة تتعلق بتكوين أحماض فينيل أثناء الهضم اللاهوائي للركائز البروتينية8. تألف المجتمع الميكروبي من أعضاء من جميع المراحل الأربع للهضم اللاهوائي: التحلل المائي، والتكوين الحمضي، وتكوين الأسيتوجيني، وتكوين الميثانوجينيس. تم تطبيق وسيلة الملح المعدني ة مع مصدر الكربون، مؤشر الأكسدة، وفيتامين ومحلول عنصر النزر، والحد من عامل9. تم تعديل المتوسط مع الركائز السلائف حمض فينيل البروتينية ذات الصلة8.
Protocol
1- إعداد الوسائط المتوسطة
2. ملء قوارير الزراعة
- تنظف وتجف قوارير المصل 120 مل.
ملاحظة: تتوفر قوارير المصل بسعة حجم مختلفة (على سبيل المثال، 20 و60 و120 و250 مل). - نظيفة تماما وجافة بوتيل المطاط الحاجز.
- وزن مكونات متوسطة إضافية (على سبيل المثال، ركائز السلائف حمض فينيل) في قوارير الزراعة.
ملاحظة: تعتمد مكونات إضافية على الإعداد التجريبي والفرضية. - ملء قوارير المصل مع 50 مل من المتوسطة.
3. خفض / إزالة الأكسجين في المرحلة السائلة
- إعداد ~ 100 درجة مئوية حمام المياه.
- تعيين قوارير المصل شغلها في حمام الماء وحضانة لمدة 20-30 دقيقة تقريبا للحد من ذوبان O2 في المرحلة السائلة.
- اغسل مساحة الرأس على الفور بالغاز N2 أو بدلاً من ذلك مع مخاليط الغاز أو الغاز الأخرى مثل N 2/CO2.
تحذير: رعاية التهوية المناسبة للغرفة. - أغلق القوارير مع الحاجز المطاطي بوتيل وإصلاح مع قبعات الألومنيوم.
ملاحظة: الحاجز المطاطي قد يصلح في كثير من الأحيان بشكل أفضل على عنق القارورة عن طريق إضافة قطرة من الماء / المتوسطة أثناء الحفر في. - إضافة 0.1 مل من عامل الحد (حل الأسهم) إلى كل قارورة مليئة 50 مل من المتوسطة لزيادة الحد من إمكانات الأكسدة (0.1 مل من وكيل الحد لكل 50 مل من المتوسطة).
- الأوتوكلاف لمدة 20 دقيقة عند 121 درجة مئوية.
تحذير: يجب استخدام الأوتوكلاف المعتمد لتعقيم الأوعية المغلقة. وإلا، فإن الضغط الزائد الناجم عن زيادة درجة الحرارة قد يتسبب في انفجار قوارير المصل.
4. تلقيح المتوسط
- إعداد inoculum من هاضم اللاهوائية.
- أضف 400 مل من الماء المقطر إلى قارورة واغليها.
- تبريده (< 30 درجة مئوية) في حين مسح بشكل دائم headspace مع N2.
- أضف حوالي 100 غرام من الحمأة المشتقة من هاضم لاهوائي.
ملاحظة: تجنب التلامس المفرط من الحمأة مع الأكسجين. - تسجيل الكتلة الدقيقة من الحمأة المضافة لتحديد الدقيق للتخفيف.
- تبادل مساحة الرأس قارورة مع N2 وإغلاقه مع الحاجز المطاط بوتيل.
- هز القارورة لمدة 30 دقيقة عند 120 دورة في الدقيقة.
- إزالة 5 مل التلقيح باستخدام حقنة + قنية وحقنه في قوارير المصل المعدة كما هو موضح في الخطوة 1-3.
5- الحضانة وأخذ العينات والتحليل
- قوارير مصل الحضانة الحاضنة في درجة حرارة مناسبة للتجربة ذات الصلة.
ملاحظة: درجة حرارة الحضانة تعتمد على الإعداد التجريبي والتلقيح المستخدمة.- استنزاف الضغط الزائد الناجم عن زيادة درجة الحرارة باستخدام حقنة + قنية، عندما السائل في قوارير المصل قد تعادل إلى درجة حرارة الحضانة (حوالي 15 - 30 دقيقة، اعتمادا على درجة حرارة الحضانة).
تحذير: اعتمادا على الركيزة التطبيقية، وتركيزها، ودرجة الحرارة، ووقت الحضانة، ونوع inoculum والتركيز، يمكن أن ترتفع الضغط الزائد داخل قوارير بنسبة تصل إلى > 2 ضغط شريط، ويمكن أن يسبب تقشر المصل لتنفجر. وبالتالي فإن رصد الضغط الزائد باستخدام مقياس المانوية وبالتالي استنزاف الضغط الزائد بالقنانة أمر إلزامي.
- استنزاف الضغط الزائد الناجم عن زيادة درجة الحرارة باستخدام حقنة + قنية، عندما السائل في قوارير المصل قد تعادل إلى درجة حرارة الحضانة (حوالي 15 - 30 دقيقة، اعتمادا على درجة حرارة الحضانة).
- تقييم إنتاج الغاز الحيوي وتكوينه خلال فترة الحضانة.
ملاحظة: فترة الحضانة يمكن أن تمتد بضعة أيام إلى عدة أسابيع.- تسجيل الضغط الجوي الحالي.
- إعداد مقياس المانوقي وتقييم الضغط داخل القوارير المستمدة من النشاط الميكروبي.
- هز القوارير
- إزالة 1 مل من غاز الفضاء الخارجي باستخدام حقنة+ قنية، وقياس H 2، O2،CH4،و / أو ثاني أكسيد الكربونتركيزات عن طريق الكروماتوغرافيا الغاز.
ملاحظة: للتأهيل والتحديد الكمي للساعة H2وO2وCH4وCO2، تم استخدام كروماتوغراف غاز لتطبيق درجات حرارة التشغيل 160 درجة مئوية (فرن العمود)، و100 درجة مئوية (حاقن)، و180 درجة مئوية (كاشف التوصيل الحراري، TCD ). تم استخدام N2 كغاز ناقل. لمزيد من التفاصيل، راجع الدراسات السابقة10.
- مراقبة تركيزات الأحماض الدهنية المتطايرة (VFA) والأحماض فينيل. لتحليل حمض VFA وحمض فينيل، استخدم نظام HPLC مجهز بكاشف للأشعة فوق البنفسجية (على 220 نانومتر) يعمل مع 5 mM H2SO4 كمرحلة متنقلة. للحصول على تفاصيل الأسلوب ومعلومات إضافية عن تخزين العينات، يرجى الرجوع إلى الدراسات السابقة11.
ملاحظة: تحليل VFA مثالي للعديد من التحليلات الفيزيائية والكيميائية الأخرى أو التقييمات المجهرية. وعلاوة على ذلك، يمكن تطبيق الأساليب البيولوجية الجزيئية التي تستهدف وفرة الكائنات الدقيقة المحددة و/أو تكوين المجتمع الميكروبي في مرحلة معينة من التجربة باستخدام الإجراء الموصوف.- إزالة 1 مل من السائل مع حقنة + قنية.
ملاحظة: يمكن تجميد العينات (-20 درجة مئوية) مباشرة بعد الانسحاب وتحليلها في نهاية التجربة11. - الطرد المركزي في 15,000-20,000 × ز ويمر من خلال 0.2 ميكرومتر RC (السليلوز المجددة) المرشحات.
- حقن 5-20 درجة مئوية على نظام HPLC وتحليل لتكوين VFA وتركيز أحماض فينيل.
- إزالة 1 مل من السائل مع حقنة + قنية.
- استنزاف قارورة الضغط الزائد باستخدام قنية.
ملاحظة: بعد تحديد الضغط وتكوين الغاز، فضلا عن أخذ أي عينة ضرورية، وضع قارورة الزراعة مرة أخرى على درجة حرارة كل منها وعدم استنزاف الضغط الزائد قبل أن يحقق السائل درجة حرارة الحضانة. - حساب إنتاج الغاز الحيوي والميثان VCH4N النظر في قانون الغاز المثالي باستخدام المعادلة 1-3. ويرجى أيضا الرجوع إلى الجدول 4.
المعادلة 1:
حيث
المعادلة 2: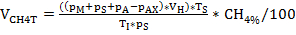
و
المعادلة 3:
ملاحظة: لحساب إجمالي إنتاج الغاز الحيوي، يجب تعيين كمية الميثان4% وCH4% X في المعادلة 2 و3 إلى 100. NmL: تطبيع حجم الغاز في ظل ظروف موحدة (0 درجة مئوية، 1 atm)، والتي بموجبها حجم الغاز الأضراس هو 22.414 نيوتن متر/مليمول.
النتائج
وقد ملأت قوارير الزراعة مع المتوسطة في ظل الظروف اللاهوائية وفقا للبروتوكول المذكور أعلاه، والتحقق من اللون المناسب (الشكل1)،وتستخدم كالمفاعلات الحيوية دفعة مصغرة إجراء الهضم اللاهوائي. وقد تم تعديل هذه مع ركائز يحتمل أن تسبب تشكيل حمض فينيل وحضانة باستخدامالحمأة هاضم اللاهوائية كما inoculum (الشكل 2). تم تطبيق التربتوفان, التيروزين, وفينيل ألانين, فضلا عن استخراج اللحوم السلائف البروتينية المعقدة والكازين في اثنين وثلاثة تركيزات مختلفة, على التوالي. تم إعداد الضوابط دون مكملات الركيزة إضافية. تركيزات الركيزة المختلفة تهدف إلى محاكاة مراحل مختلفة من الحمل الزائد. تم احتضان قوارير في 37 درجة مئوية (mesophilic) لمدة 4 أسابيع.
تم رصد إنتاج الغازالحيوي وتكوينه (H 2، CH4،CO2)بانتظام عن طريق الكروماتوغرافيا الغازية (GC TCD)10 وتقييم ضغط حيز الرأس. ويبين الشكل 3 الاختلافات في إنتاج الميثان التراكمي المستمد من هضم الركائز المطبقة بتركيزات متنوعة خلال 4 أسابيع من الحضانة اللاهوائية. إلى جانب ذلك، تم تصور methanogens عن طريق تشعيع الإنزيم المساعد F420، وهو ناقل إلكترون في التناسل، وتظهر الفلورةالزرقاء والخضراء مع الحد الأقصى للامتصاص في 420 نانومتر (الشكل 4).
وبالتزامن مع تحليل الغاز، تم سحب عينات لقياسات تركيز VFA وحمض فينيل عن طريق HPLC11 وتخزينها حتى مواصلة المعالجة. ويبين الشكل 5 تأثير المراحل المختلفة من الحمل الزائد كما يتجلى في تراكم في عينات مثقلة للغاية تصور بشكل مثالي للخلات. ويبين الشكل 6 ديناميات تركيزات خلات فينيل خلال فترة الحضانة.

الشكل 1: مؤشر ريدوكس. يمكن التحكم في إمكانية الأكسدة الصحيحة في قوارير الزراعة عن طريق إضافة مؤشر الأكسدة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: المفاعلات الحيوية الدفعية المصغرة. المفاعلات الحيوية دفعة مصغرة أعدت في 120 مل زراعة قوارير لتجارب الهضم اللاهوائية. تمتلئ القوارير مع المتوسطة وتلقيحها مع الحمأة هاضم المخفف. وكانت المفاعلات مغلقة بالغاز بإحكام مع سدادات مطاطية بوتيل وأغطية من الألومنيوم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
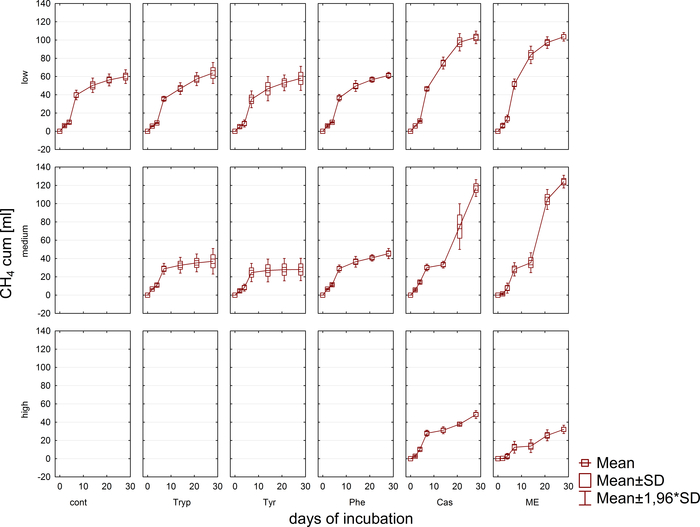
الشكل 3: إنتاج الميثان. إنتاج الميثان التراكمي خلال 28 يوما من الحضانة المتوسطة من المفاعلات التي تعكس ظروف الحمل الزائد المختلفة (منخفضة ومتوسطة وعالية). تابع: السيطرة؛ التربب: التربتوفان; تاير: التيروزين؛ في: فينيل ألانين; ME: استخراج اللحوم; كاسين هذا هو الرقم المعدلة الناشئة عن دراسة سابقة8. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
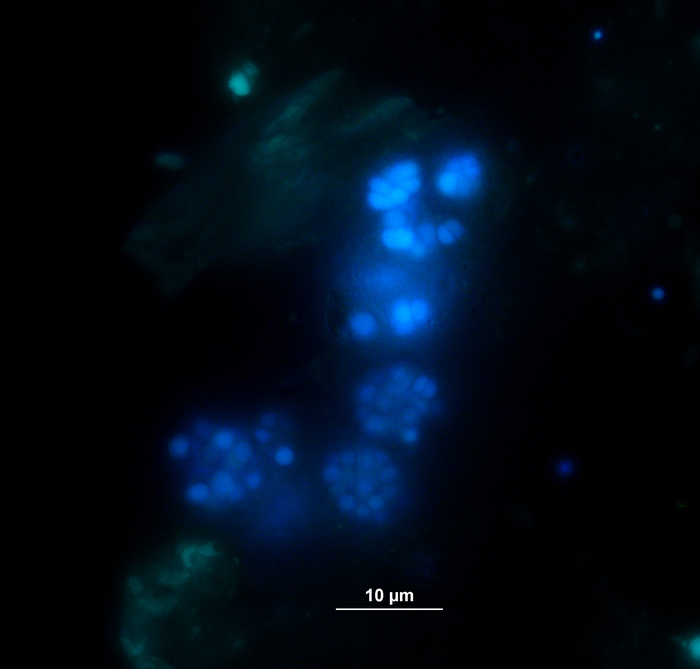
الشكل 4: الفلورة الميثانوجينات. الميثانوجينت تنبعث منها ضوء أزرق عندما تكون متحمسة مع ضوء الأشعة فوق البنفسجية. هنا، يتم إرفاق methanogens إلى جزيئات النبات (الضوء الأخضر). وقد أخذت العينات من مفاعل دفعي، وتم تخفيفها للتنظير المجهري، وتم تحليلها على الفور. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
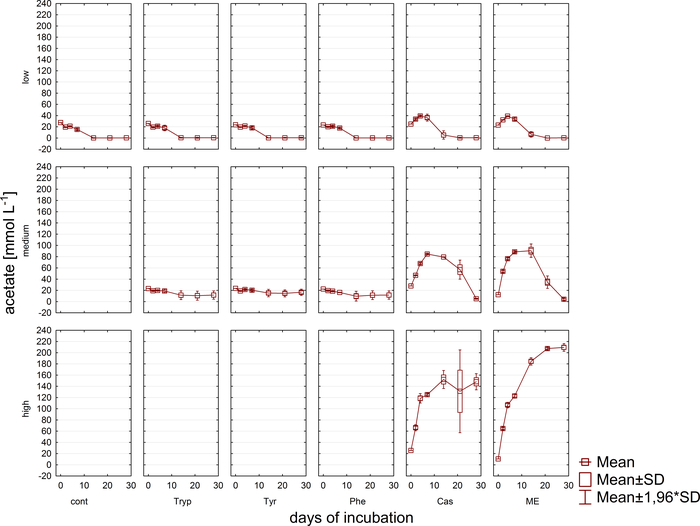
الشكل 5: تركيز خلات. تركيز خلات خلال 28 يوما من الحضانة المتوسطة في المفاعلات التي تعكس ظروف الحمل الزائد مختلفة (منخفضة، متوسطة، عالية). تابع: السيطرة؛ التربب: التربتوفان; تاير: التيروزين؛ في: فينيل ألانين; ME: استخراج اللحوم; كاسين هذا هو الرقم المعدلة الناشئة عن دراسة سابقة8. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
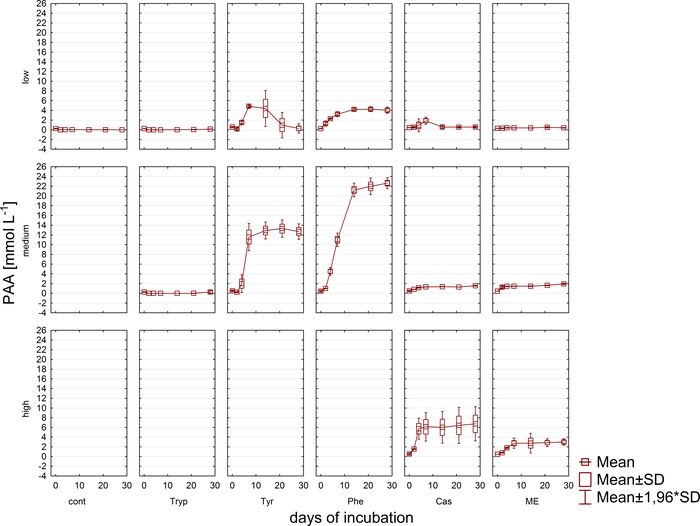
الشكل 6: تركيز فينيلسيتات. تركيز فينيلسيتات خلال 28 يوما من حضانة المتوسطة في المفاعلات التي تعكس ظروف الحمل الزائد المختلفة (منخفضة، متوسطة، عالية). تابع: السيطرة؛ التربب: التربتوفان; تاير: التيروزين؛ في: فينيل ألانين; ME: استخراج اللحوم; كاسين هذا هو الرقم المعدلة الناشئة عن دراسة سابقة8. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: رد فعل ريسزورين. يخضع الريزازورين الملون الأزرق لتخفيض لا رجعة فيه إلى resorufin (الوردي) ومزيد من الانخفاض عكسها إلى dihydroresorufin عديم اللون وفقا لUzarski وآخرون12. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| سيانوكوبالامين | 0.050 غ |
| 4-حمض أمينوبنزويك | 0.050 غ |
| D-البيوتين | 0.010 غ |
| حمض النيكوتينيك | 0.100 غ |
| البيريدوكسين | 0.250 غ |
| حمض البانتوهاتيك د | 0.025 غ |
| كلوريد الثيامينيوم حمض الهيدروكلوريك | 0.18 غ |
| الماء المقطر | 1000 مل |
الجدول 1: محلول الفيتامينات.
| 25٪ (ث / v) حمض الهيدروكلوريك | 10.0 مل |
| في كل2 × 4 ح2س | 1.50 غ |
| ZnCl2 | 0.070 غ |
| MnCl2 × 4 H2O | 0.100 غ |
| H3BO3 | 0.006 غ |
| CoCl2 × 6 H2O | 0.190 غ |
| CuCl2 × 2 H2O | 0.002 غ |
| NiCl2 × 6 H2O | 0.024 غ |
| Na2MoO4 x 2 H2O | 0.036 غ |
| الماء المقطر | 990.0 مل |
| توصية الإعداد | إضافة حمض الهيدروكلوريكوحل FeCl 2، إضافة 100 مل الماء المقطر، حل المكونات الأخرى، وجعل ما يصل إلى 1000 مل. |
الجدول 2: حل عنصر التتبع.
| فى الان | 1.0 غ |
| MgCl2 × 6 H2O | 0.4 غ |
| KH2PO4 | 0.2 غ |
| KCl | 0.5 غ |
| CaCl2 × 2 H2O | 0.15 غ |
| L-سيستين | 0.5 غ |
| الخميرة استخراج | 1.0 غ |
| ريسازورين الحل | 1 مل |
| محلول فيتامين | 1 مل |
| حل عنصر التتبع | 1 مل |
| الماء المقطر | 1000 مل |
| الرقم الهيدروجيني | 7.2 |
الجدول 3: الحد الأدنى من الملح المتوسط.
| متغير | وحده | وصف |
| رY | [د] | نقطة زمنية القياس |
| tX | [د] | النقطة الزمنية للقياس السابق |
| عميم | حسناً، حسناً، حسناً، حسناً | قياس الضغط الزائد في رY |
| عألف | حسناً، حسناً، حسناً، حسناً | الضغط المحيط في رY |
| فAX | حسناً، حسناً، حسناً، حسناً | الضغط المحيط في tX |
| عS | حسناً، حسناً، حسناً، حسناً | الضغط القياسي، 1013،25 مبار acc. DIN 1343 |
| TI | حسناً، حسناً، حسناً، حسناً | الحضانة درجة الحرارة |
| TS | حسناً، حسناً، حسناً، حسناً | درجة الحرارة القياسية، 273،15 K (يتوافق مع 0 درجة مئوية) acc. DIN 1343 |
| خامساحاء | حسناً، حسناً، حسناً، حسناً | حجم المساحة الرأسية في tY |
| VHX | حسناً، حسناً، حسناً، حسناً | حجم مساحة الرأس في tX |
| CH4% | [المجلد%] | تركيز الميثان وفقا لقياس GC في رY |
| CH4٪ X | [المجلد%] | تركيز الميثان وفقا لقياس GC في tX |
| VCH4T | حسناً، حسناً، حسناً، حسناً | مجموع كمية الميثان في زجاجة المصل في رY |
| VCH4R | حسناً، حسناً، حسناً، حسناً | كمية الميثان المتبقية في حيز الرأس في tX |
| VCH4N | حسناً، حسناً، حسناً، حسناً | الميثان المنتج حديثا من tX إلى tY |
الجدول 4: وصف المتغيرات في المعادلة 1-3.
Discussion
الخطوة الأكثر أهمية وحاسمة في زراعة الكائنات الحية الدقيقة اللاهوائية هو ضمان ظروف خالية من الأكسجين في وسائل الإعلام زراعة وقوارير 'مساحة الرأس. يمكن استخدام مؤشر مثل ريسازورين للتحقق بشكل غير مباشر من ملء اللاهوائية الصحيحة من قوارير. ريسازورين هو صبغة الأكسدة شائعة الاستخدام لأنها غير مكلفة وغير سامة، وفعالة بالفعل في جرعات منخفضة وقصيرة الحضانة مرات 12. عندما أدرجت في وسائل الإعلام، ريسازورين الملونة الزرقاء يخضع أولا خطوة تخفيض لا رجعة فيها إلى resorufin، وهو وردي في قيم درجة الحموضة محايدة. يمكن أن يحدث هذا التفاعل الأول عندما يتم تسخين وسائل الإعلام 13. في وقت لاحق، يتم تقليل resorufin إلى ثنائي اللون dihydroresorufin في رد فعل ثانوي عكسها (الشكل7)12. نظام ريسوروفين /ديهيدروريسوروفين ريدوكس يصبح عديم اللون تماما في إمكانية الحد من الأكسدة القياسية من حواليH = -110 mV ويتحول الوردي فوق إمكانات الأكسدة من -51 mV 13.
من أجل زيادة الحد من إمكانات الأكسدة، على سبيل المثال، لتسهيل نمو الكائنات الحية الدقيقة المثاني من المعروف أنها تتطلب أقل من -200 ملفي14،يمكن إضافة حل Na2S. بدلا من ذلك، السيستين-حمض الهيدروكلوريك، الصوديوم-ثيوغليكولات، أو ثنائي ثيونيت الصوديوم تستخدم عادة. ومع ذلك، فإن أي عامل تقليل مناسب للاستخدام يعتمد على الإعداد التجريبي المعني وقد يتطلب اهتماماً خاصاً. على سبيل المثال، ثيوغليكولات الصوديوم يحتاج إلى تنشيط درجة الحرارة (على سبيل المثال، عن طريق الأوتوكلاف).
ويمكن زيادة تقييم اتحاد الميكروبات المتوازن، الذي يتألف من أجناس مختلفة من البكتيريا وArchaea، وسلسلة تدهور لاهوائي تعمل بكفاءة من خلال تحديد تكوين غاز الفضاء الرئيسي في قوارير الثقافة عن طريق الغاز اللوني. عند التعامل مع مركبات مثل أحماض فينيل مشتقة من سلائف مختلفة، وتقييم مساحة الرأس هو وسيلة سريعة للتحقق من عملية تكوين الميثانوجينيس8. يشير تركيز مساحة الرأس CH4 بنسبة 50-60% تقريبًا في الضوابط في نهاية فترة الحضانة إلى الاستخدام الناجح للمغذيات التطبيقية وبالتالي تمعدن المواد العضوية في الظروف اللاهوائية. يمكن تحديد إنتاج الميثان النظري وتركيزات الميثان المتوقعة أثناء عملية الهضم مسبقاً وفقاً لمعادلة بوسويل بويل بعد التحليل الأولي للغواصة أو عن طريق تقدير محتوى الكربوهيدرات والبروتينات والدهون في الركيزة. وفقا لVDI 4630 15،يمكن أن تؤدي الكربوهيدرات إلى إنتاج الغاز الحيوي النظري من 750 ل كجم-1 VSS (50٪ CH4 و 50٪ CO2)،والبروتينات إلى 800 لتر كجم-1 VSS (72٪ CH4 و 28٪ CO2)،والدهون إلى 1390 لكجم -1 VSS (60٪ CH4 و 40٪ CO2).
وعلاوة على ذلك، تم رصد التكوين والتدهور المحتمل اللاحق لـ VFAs والأحماض فينيل. ويمكن تقييم عملية التحلل عن طريق تحليل تركيزات VFA (على سبيل المثال، خلات، بروبيونات) في نقاط زمنية مختلفة. تراكم الأحماض الدهنية قصيرة السلسلة مثل خلات و / أو بروبيونات يمكن أن تشير إلى اضطرابات في تكوين المجتمع methanogenic وإلى الحمل الزائد مفاعل عموما. ومع ذلك، يمكن لشلال التدهور الميكروبي متوازن حتى التعامل مع تركيزات VFA عالية جدا وخلات9. الى جانب ذلك، فإن خلات / نسبة بروبيونات قد توفر المزيد من المعلومات عن حالة المفاعل العام16. ومع ذلك، هناك العديد من المعلمات المناسبة لرصد العمليات التي يتعين اختيارها وفقا للفرضيات التجريبية المقترحة. وفي المثال الحالي، كانت المتغيرات المستهدفةهي تركيزات حمض فينيل (الشكل 6).
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
تم تمويل هذا البحث من قبل صندوق العلوم النمساوي (FWF): أرقام المشروع P 29360 و P 29143. وحظيت النشرة بدعم من بوبليكationsfonds der Universität Innsbruck. ونحن نعترف إلى حد كبير EIG.
Materials
| Name | Company | Catalog Number | Comments |
| culture flasks (120 mL, N20) | Ochs, Germany | 102046 | |
| buty rubber septa (N20) | Ochs, Germany | 102049 | |
| aluminium caps (N20) | Ochs, Germany | 102050 | |
| N2 gas | Messer, Austria | purity 5.0 | |
| syringes + cannulae | various | ||
| crimper | Ochs, Germany | 102051 | |
| de-crimper | Ochs, Germany | 102052 | |
| GC2010 | Shimadzu | ||
| Shin-carbon GC column | Restek | chromatographic separation of H2, O2, CH4, and CO2 | |
| HPLC Prominence | Shimadzu | ||
| Fast Fruit HPLC Column | Phenomenex | chromatographic separation of VFAs, phenyl acids, etc. |
References
- Wiebe, W. J., et al. Anaerobic Respiration and Fermentation. The Ecology of a Salt Marsh. Pomeroy, L. R., Wiegert, R. G. , Springer New York. New York, NY. 137-159 (1981).
- Kim, B. H., Gadd, G. M. Anaerobic fermentation. Bacterial physiology and metabolism. Kim, B. H., Gadd, G. M. , Cambridge University Press. Cambridge. 252-297 (2008).
- Stolz, J. F., Oremland, R. S. Bacterial respiration of arsenic and selenium). FEMS Microbiology Reviews. 23 (5), 615-627 (1999).
- Lackner, N., Hintersonnleitner, A., Wagner, A. O., Illmer, P. Hydrogenotrophic Methanogenesis and Autotrophic Growth of Methanosarcina thermophila. Archaea. 2018 (5), 1-7 (2018).
- Mutschlechner, M., Praeg, N., Illmer, P. The ecological importance of grazing to methane fluxes and engaged microbial communities in alpine forest soils. FEMS Microbiology Ecology. , (2018).
- Prem, E. M., Reitschuler, C., Illmer, P. Livestock grazing on alpine soils causes changes in abiotic and biotic soil properties and thus in abundance and activity of microorganisms engaged in the methane cycle. European Journal of Soil Biology. 62, 22-29 (2014).
- Praeg, N., Wagner, A. O., Illmer, P. Effects of fertilisation, temperature and water content on microbial properties and methane production and methane oxidation in subalpine soils. European Journal of Soil Biology. 65, 96-106 (2014).
- Wagner, A. O., Prem, E. M., Markt, R., Kaufmann, R., Illmer, P. Formation of phenylacetic acid and phenylpropionic acid under different overload conditions during mesophilic and thermophilic anaerobic digestion. Biotechnology for Biofuels. 12 (1), 359(2019).
- Lins, P., Malin, C., Wagner, A. O., Illmer, P. Reduction of accumulated volatile fatty acids by an acetate-degrading enrichment culture. FEMS Microbiology Ecology. 71 (3), 469-478 (2010).
- Wagner, A. O., Hohlbrugger, P., Lins, P., Illmer, P. Effects of different nitrogen sources on the biogas production - a lab-scale investigation. Microbiological research. 167 (10), 630-636 (2012).
- Wagner, A. O., et al. Sample preparation, preservation, and storage for volatile fatty acid quantification in biogas plants. Engineering in Life Sciences. 17 (2), 132-139 (2017).
- Uzarski, J. S., DiVito, M. D., Wertheim, J. A., Miller, W. M. Essential design considerations for the resazurin reduction assay to noninvasively quantify cell expansion within perfused extracellular matrix scaffolds. Biomaterials. 129, 163-175 (2017).
- Costilow, R. N., Breznak, J. A., et al. Physicochemical Factors in Growth. Methods for General and Molecular Microbiology. Marzluf, G. A. , Third Edition, 309-329 (2007).
- Le Mer, J., Roger, P. Production, oxidation, emission and consumption of methane by soils: a review. European Journal of Soil Biology. 37 (1), 25-50 (2001).
- Verein deutscher Ingenieure VDI 4630: Fermentation of organic material. VDI Richtlinien. , (2006).
- Wagner, A. O., Reitschuler, C., Illmer, P. Effect of different acetate: Propionate ratios on the methanogenic community during thermophilic anaerobic digestion in batch experiments. Biochemical Engineering Journal. 90, 154-161 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved