Method Article
הכנה בינונית לטיפוח מיקרואורגניזמים בתנאים אנאירובית/אנקסימית בלבד
* These authors contributed equally
In This Article
Summary
כמו אורגניזמים אנאירובית מחייב אינם מסוגלים לצמוח על החשיפה לחמצן, השימוש של טכניקות culturing אנאירובית הוא הכרחי. כאן, אנו להדגים שיטה פשוטה ויעילה לטפח תרבות מעורבת נגזר צמח ביוגז מפני התקשורת הכנה גז וכימות חומצות שומן נדיף.
Abstract
בניגוד לאורגניזמים האירובית, מיקרואורגניזמים אנאירובית לחלוטין דורשים היעדר חמצן ובדרך כלל פוטנציאל נמוך החמצון ליזום צמיחה. כמו חמצן נמצא בכל מקום באוויר, שמירה על תנאי O2-חינם במהלך כל השלבים של הטיפוח הוא מאתגר, אבל תנאי מוקדם לקבלת culturing אנאירובית. הפרוטוקול המוצג כאן ממחיש את הטיפוח המוצלח של תרבות מעורבת אנאירובית הנגזרת מצמח ביוגז באמצעות שיטה פשוטה וזולה. תיאור מדויק של התהליך האנטומי כולו מוענק כולל הכנה למדיה, מילוי מבחנות, תוספת של מחוון חמצון והפחתת סוכנים כדי לספק פוטנציאל החמצון נמוך, כמו גם להחליף את החלל הקדמי כדי לשמור על תקשורת ללא חמצן. יתר על כן, סקירה מפורטת של aseptically מבחנות סרום הדוקה גז הדוק (באמצעות מזרקים ומחטים סטרילי) ותנאי דגירה מתאים מסופק. הפרוטוקול הנוכחי עוסק עוד יותר בדיגום גז ונוזלים לניתוחים הבאים לגבי הרכב גז וריכוזי חומצות שומן נדיפות באמצעות כרומטוגרפיה גז (GC) וביצועים גבוהים כרומטוגרפיה נוזלית (בהתאמה), וה חישוב של ביוגז ותשואה מתאן בהתחשב בחוק הגז האידיאלי.
Introduction
על חמצן מולקולרי כדור הארץ בריכוזים הבולטים זמין באזורים שיש להם קשר ישיר עם האטמוספירה או בנוכחות של פוטוגניים מחמצן. סביבות שבו החמצן נעדר נקראים אנאירובית. עם זאת, המרת אנרגיה היא עדיין אפשרית בתנאים אנאירובית באמצעות שני תהליכים מטבוליים שונים, תסיסה ונשימה אנאירובית1.
בעוד שאורגניזמים העוברים נשימה אירובית משתמשים בחמצן כקבלה אלקטרון מסוף, הנשימה אנאירובית דורשת מעבר אלקטרוני חלופי כמו חנקה או סולפט2. ב "מגדל האלקטרונים", זוגות החמצון מאורגנים על פי הפוטנציאל החוזר שלהם, עם השליליות השלילית ביותר בחלק העליון (תורמים אלקטרונים) וסוכני חמצון החזקה ביותר עם פוטנציאל החמצון החיובי בתחתית (למועמדים אלקטרונים). העברת האלקטרונים בין התורמים והמועמדים מובילה לשימור האנרגיה דרך שרשרת הנשימה והאלקטרונים יכולים להילכד בידי מקבל האלקטרונים-להישאר בתמונה בקומות שונים של המגדל. ולכן, ככל שנפילת האלקטרונים באמצעות מגדל האלקטרונים גבוהה יותר, ניתן לטפל ביותר אנרגיה על-ידי התגובה המתאימה. לכן, נשימה אפשרית גם בבתי גידול אנאירובית, למשל, עם צמדי חמצון כולללא 3-/no2-, חומצה פומרית/חומצה סואית,אז 32-/H2S, s °/H2, Mn (IV)/mn (II ), Fe (III)/fe (II)2,3. ראשית, האנרגיה הנוצרת שימור כפוטנציאל ממברנה, אשר משמש לאחר מכן באמצעות זירחון התחבורה האלקטרונים של אדנוזין-triphosphate (ATP) סינתזה על ידי ממברנה הקשורות ATP-סטנדרטים. בניגוד לנשימה אירובית, כמות האנרגיה שניתן לשימור על ידי נשימה אנאירובית יכול להיות מופחת באופן דרמטי; עם זאת, תפוקת האנרגיה של מרבית הנשימות האנאירובית היא עדיין גבוהה יותר לעומת תסיסה, מסלול שימור אנרגיה אנאירובית בבתי הגידול החסרים חמצן ומסופי אלקטרון מסופים אחרים2.
במהלך התסיסה, מצעים אורגניים עתירי אנרגיה, מכוהים למוצרי תסיסה שונים, המגדירים לעתים קרובות את שם התהליך הכולל, למשל, תסיסה אלכוהוליסטית. בניגוד לתהליכי הנשימה, דור ה-ATP בזמן התסיסה מוגבל לזרחון ברמת המצע שבמהלכו מועברת קבוצת פוספט ל-אדנוזין-די-פוספט (ADP) ממצעזרחניעתיר אנרגיה. מיקרואורגניזמים הגדלת תפקיד מרכזי השפלה אנאירובית של חומר אורגני כפי שהם מפתח-שחקנים בהתמוטטות המצע. מוצרי התסיסה העיקריים, כמו חומצות אורגניות, אלכוהול, CO2, ו-H2, לאחר מכן ניתן להשתמש על ידי מיקרואורגניזמים משני הגדלת לייצר חומצה אצטית, CO2, ו-H2. דוגמאות למוצרי תסיסה כוללים חומצת חלב, חומצות שומן נדיפות שונות (formic-, אצטט-, propionic-, בוטירית-, חומצה valeric), n-butanol, 2, 3-butandiol, אצטון, ו אתנול.
טיפוח של מיקרואורגניזמים בתנאים אנאירובית לחלוטין דורש שיטות וציוד שונים לגמרי בהשוואה לטיפוח האורגניזמים האירוביים. בעוד אורגניזמים עמידים בפני חמצן מעובדים לעתים קרובות על מנות אגר, כביכול תרבויות פני השטח, זה-עם כמה חריגים-בקושי אפשרי עבור מיקרואורגניזמים אנאירובית לחלוטין. לפיכך, תרבויות העשרה של מיקרואורגניזמים אנאירובית לחלוטין מבוססים בעיקר במדיה נוזלית החלה בכלי התרבות האטומים עם septa גז המבטיחים אווירה של חלל ראש נקי מחמצן4,6, 7. לאחר מכן
תיאור הפרוטוקול הנוכחי יספק שיטות הטיפוח המתאימות למיקרואורגניזמים היעד של אוכלוסיה מעורבת הנגזרת מצמח אניוגז אירובי. הבידוד והטיפוח של תרבויות טהורות הוא אפילו יותר מאתגר, אבל לא חלק מהעבודה הזאת.
כאן, אנו מראים את ההליך לטיפוח הקהילה מיקרוביאלית אנאירובית מבוסס על מחקר לגבי היווצרות חומצות פנקסיל במהלך העיכול אנאירובית של מצעים הפרוטטינופה8. קהילת החיידקים מורכבת מחברים מכל ארבעת השלבים של העיכול האנאירובי: הידרוליזה, אקאיגנזה, אספטוגנזה ומתיאנוגנזה. בינוני מלח מינרלים בתוספת עם מקור פחמן, החמצון מחוון, ויטמין ורכיב מעקב פתרון, והפחתת הסוכן הוחל9. המדיום תוקן עם המתאים ביותר חומצה הפרוטאינאכאיל הבשר מצעיםשמונה 8.
Protocol
1. הכנת המדיום
- הכנת מלאי חמצון פתרון מניות (0.1 g של resazurin/100 מ"ל מימית הפתרון).
- הכן פתרון ויטמינים (שולחן 1).
- הכן את פתרון רכיב המעקב (טבלה 2).
הערה: סדר התוספת חשוב; עיין בטבלה 2 ובפרוטוקולים המתאימים. - להכין הפחתת פתרון מניות סוכן (60 g Na2S/L מימית הפתרון).
- שוקלים מרכיבים בינוניים (בינוני מלח מינרלי, שולחן 3) בבקבוקון מתאים (למשל, 1 כובע מעבדה בקבוקון).
הערה: בהתאם לכיוונון הנסיוני, ייתכן שיהיה צורך בהוספה של מקור פחמן נפרד. - מוסיפים חצי נפח של מים מזוקקים (שולחן 3) וממיסים את החומרים.
- הוסף 1 mL של פתרון מחוון החמצון לפי לוח 3.
- הוסף ויטמין ומעקב אחר הפתרון בהתאם לטבלה 3.
- כוונן את ה-pH לפי דרישות בינוניות/אורגניזם בטבלה 3.
הערה: צבע מחוון החמצון הוא תלוי-pH וייתכן שיידרש זמן מה כדי לכוונן. - הביאו לכרך האחרון של 1 ל' עם מים מזוקקים.
הערה: ויטמין ומעקב פתרונות אלמנט ניתן גם להוסיף לאחר autoclaving לאחר על ידי הוספת מסנן-סדרת מחלקים מסננים (פתרונות מדולל, מסנן גודל הנקבוביות < 0.2 μm) לתוך מבחנות שנסגרו בעבר והנסיוב האוטומטי. עם זאת, גישה זו נושאת סיכון מוגבר של זיהום.
2. מילוי בקבוקי טיפוח
- ניקוי יסודי ויבש 120 מבחנות סרום mL.
הערה: מבחנות סרום זמינים בקיבולות נפח שונות (למשל, 20, 60, 120, 250 mL). - ביסודיות לנקות ויבש בוטיל גומי septa.
- שוקלים מרכיבים בינוניים נוספים (למשל, מצעים מבשר חומצה פנילי) בצלוחיות הטיפוח.
הערה: רכיבים נוספים תלויים בכיוונון והיפותזה ניסיוניים. - למלא את מבחנות סרום עם 50 mL של בינוני.
3. הפחתה/הסרה של חמצן בשלב הנוזלי
- להכין אמבטיה מים ~ 100 ° C.
- הגדר מבחנות סרום מלא באמבט מים ו-דגירה עבור כ. 20-30 דקות כדי להפחית את מסיסות של O2 בשלב נוזלי.
- רוקן את החלל הקדמי מיד עם N2 גז או לחלופין עם תערובות גז או גז אחרים כמו n2/co2.
התראה: לטפל באוורור החדר המתאים. - סגור את מבחנות עם septa גומי בוטיל ולתקן עם כובעי אלומיניום.
הערה: septa גומי עשוי להתאים בדרך כלל טוב יותר על הצוואר של הבקבוקון על ידי הוספת טיפת מים/בינונית תוך הסתעפות אותו. - הוסף 0.1 mL של הסוכן הפחתת (פתרון מניות) לכל בקבוקון מתמלא 50 mL של בינוני כדי לצמצם עוד יותר את הפוטנציאל של החמצון (0.1 mL של הפחתת סוכן לכל 50 mL של בינוני).
- אוטוקלב במשך 20 דקות ב 121 ° c.
התראה: יש להשתמש בחיטוי מוסמך לעיקור כלי הדם הסגורים. אחרת, לחץ יתר נגזר מעלייה בטמפרטורה עלול לגרום צלוחיות סרום להתפוצץ.
4. החיסונים של המדיום
- הכינו את הרשת. מעיכול אנאירובי
- הוסף 400 mL של מים מזוקקים לתוך בקבוקון ולהביא אותו לרתיחה.
- לצנן את זה (< 30 ° c) בעוד לצמיתות לרוקן את החלל הקדמי עם N2.
- הוסף כ. 100 גרם של בוצה נגזר מעיכול אנאירובי.
הערה: הימנע ממגע מוגזם של בוצה עם חמצן. - הקלט את המסה המדויקת של בוצה נוספת לקביעת הדילול המדויק.
- החלף את החלל הקדמי של הבקבוקון עם N2 וסגור אותו עם מחיצת גומי בוטיל.
- לנער את הבקבוקון עבור 30 דקות ב 120 סל ד.
- הסירו 5 מ"ל באמצעות מזרק + צינורית והכנס אותו לתוך מבחנות סרום מוכנות כמתואר בשלב 1-3.
5. דגירה, דיגום וניתוח
- מבחנות מחוסנת סרום מחוסן בטמפרטורה המתאימה לניסוי בהתאמה.
הערה: הטמפרטורה של הדגירה תלויה בכיוונון ניסיוני ובשימוש ברשת.- בריחת לחץ הנובע הטמפרטורה להגדיל באמצעות מזרק + צינורית, כאשר הנוזל בצלוחיות סרום יש שימוש לטמפרטורת דגירה (כ 15 – 30 דקות, בהתאם לטמפרטורת הדגירה).
התראה: בהתאם למצע שהוחל, הריכוז שלה, הטמפרטורה, זמן הדגירה, הסוג הנרשת והריכוז, לחץ יתר בתוך מבחנות יכול לעלות על ידי ל> 2 לחץ בר ועלול לגרום flaks סרום להתפוצץ. מעקב אחר הלחץ העודף באמצעות מדידת מהירות ולאחר מכן מרוקן את הלחץ העודף עם צינורית היא אפוא חובה.
- בריחת לחץ הנובע הטמפרטורה להגדיל באמצעות מזרק + צינורית, כאשר הנוזל בצלוחיות סרום יש שימוש לטמפרטורת דגירה (כ 15 – 30 דקות, בהתאם לטמפרטורת הדגירה).
- הערכת ביוגז ייצור וקומפוזיציה במהלך זמן הדגירה.
הערה: תקופת הדגירה יכולה להתפרס כמה ימים למספר שבועות.- . מקליט לחץ אטמוספירי עדכני
- הכן משטח והערך את הלחץ בתוך המבחנות הנגזרות מפעילות מיקרוביאלית.
- לנער את מבחנות.
- הסירו 1 מ ל גז השטח באמצעות מזרק + צינורית, ולמדוד את H2, O2, CH4, ו/או2 ריכוזי דרך כרומטוגרפיה גז.
הערה: עבור ההסמכה והכמת של H2, O2, CH4, ו-CO 2, כרומטוגרף גז השתמשו בהחלת טמפרטורות מבצע של 160 ° צ' (תנור טור), 100 ° צ' (מזרק), ו 180 ° צ' (גלאי מוליכות תרמית, tcd ). N2 שימש גז המוביל. לפרטים, עיין במחקרים קודמים10.
- ריכוזי ניטור של חומצות שומן נדיפות (VFA) וחומצות פנקסיל. עבור VFA ניתוח חומצה פנקסיל, השתמש במערכת האבחון מצויד עם גלאי UV (ב 220 ננומטר) פועל עם 5 מ"מ H2כל כך4 כשלב נייד. לפרטים על השיטה ומידע נוסף אודות אחסון מדגם, עיין במחקרים קודמים11.
הערה: ניתוח ה-VFA הוא מופת לניתוחים רבים אחרים של פיזיקאלית-כימיים או הערכות מיקרוסקופית. כמו-כן, ניתן להחיל שיטות ביולוגיות מולקולריות המכוונות על שפע מיקרואורגניזמים ו/או קומפוזיציה של הקהילה בנקודה מסוימת של הניסוי באמצעות ההליך המתואר.- הסר 1 מ ל של נוזל עם מזרק + צינורית.
הערה: ניתן להקפיא דגימות (20 ° c) מיד לאחר הנסיגה והניתוח בסוף הניסוי11. - צנטריפוגה ב 15000-20000 x g ולעבור דרך 0.2 יקרומטר RC (מחדש תאית) מסננים.
- הכנס 5-20 μL אל מערכת האנליזה ונתח עבור הרכב VFA וריכוז של חומצות פניקסיל.
- הסר 1 מ ל של נוזל עם מזרק + צינורית.
- לנקז את לחץ היתר של הבקבוקון. בעזרת צינורית
הערה: לאחר קביעת הלחץ והרכב הגז, כמו גם לקיחת כל המדגם הנדרש, מניחים את הבקבוק לחזור על הטמפרטורה המתאימה ולא לנקז לחץ מוגזם לפני הנוזל השיגה את טמפרטורת הדגירה. - לחשב ביוגז וייצור מתאן VCH4N בהתחשב בחוק הגז האידיאלי באמצעות משוואה 1-3. נא התייחס גם לטבלה 4.
משוואה 1:
פיה
משוואה 2: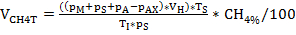
ו
משוואה 3:
הערה: לחישוב הייצור ביוגז סה כ, כמות ה-4% ו-ch4% X במשוואה 2 ו-3 צריך להיות מוגדר ל-100. NmL: נפח גז מנורמל תחת תנאים סטנדרטיים (0 ° c, 1 כספומט), תחתיו נפח הגז הטוחנת הוא 22.414 NmL/mmol.
תוצאות
מבחנות טיפוח היו מלאים בינוני תחת תנאים אנאירובית על פי הפרוטוקול המתואר לעיל, בדק את הצבע המתאים (איור 1), ומשמש אצווה מיניאטורי ריאקטורים חקנים לנהל את העיכול אנאירובי. אלה שתוקנו עם מצעים העלולים לגרום להיווצרות חומצה פניקסיל ו מודלחות באמצעות בוצה אנאירובית מעכל כמו האירשת (איור 2). טריפטופן, טירוצין, ו פנילאלנין, כמו גם תמצית הבשר המורכבת מפרוטאינמיט וקזאין הוחלו בשני ושלושה ריכוזים שונים, בהתאמה. הפקדים הוכנו ללא תוספי מצע נוספים. ריכוזי מצע שונים שמטרתם הדמיה של שלבים שונים של עומס יתר. מבחנות היו מודבטים ב 37 ° צ' (meסופיזם) במשך 4 שבועות.
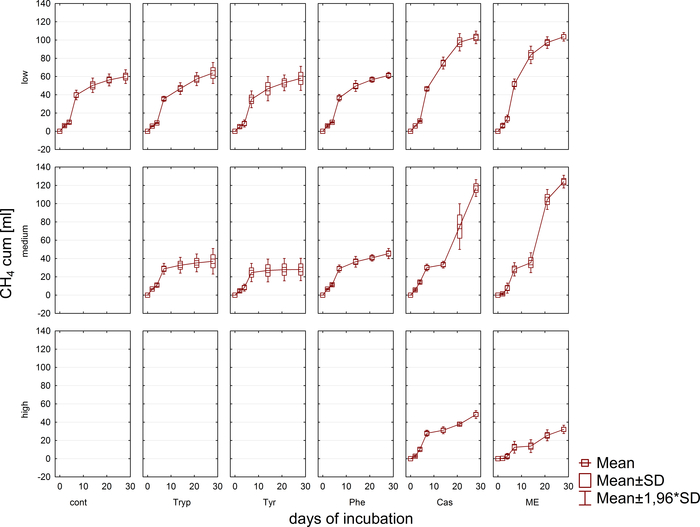
ביוגז ייצור וקומפוזיציה (H2, CH4, CO2) היה תחת פיקוח סדיר באמצעות גז כרומטוגרפיה (GC tcd)10 ו הערכה של לחץ אמות. איור 3 מדגים הבדלים בייצור מתאן המצטבר נגזר מעיכול של מצעים שהוחלו בריכוזים מגוונים במהלך 4 שבועות של דגירה אנאירובית. חוץ מזה, מתיונין היו דמיינו על ידי הקרנת הקואנזים F420, המוביל אלקטרון ב מתיונין, הציג זריחה כחולה ירוק עם ספיגה מקסימלית ב 420 Nm (איור 4).
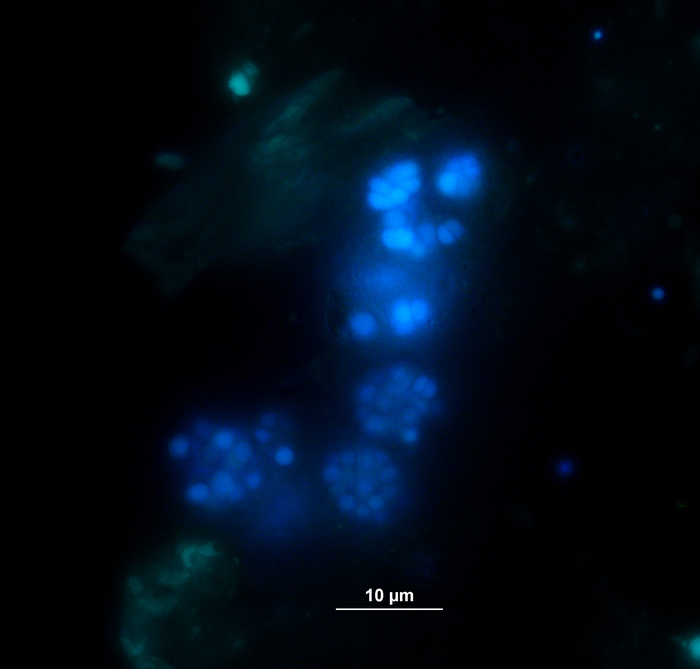
במקביל לניתוח גז, דוגמיות של מדידות הריכוז של VFA וחומצה פנילי באמצעות האנליזה11 הונסוגו ואוחסנו בהקפאה עד לעיבוד נוסף. איור 5 מראה את ההשפעה של שלבים שונים של עומס יתר כפי שניכר על ידי הצטברות בדגימות עומס יתר מאוד מתוארת עבור אצטט. איור 6 מתאר את הדינמיקה של ריכוזים אצטט פניאיל בתקופת הדגירה.

איור 1: אינדיקטור מחדש. ניתן לשלוט בפוטנציאל החוזר הנכון בצלוחיות הטיפוח על ידי הוספת אינדיקטור מחדש. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: ביוורישחקנים אצווה זעירים. אצווה מיניאטורי ריאקטורים חקנים הכין ב 120 mL מבחנות עיבוד עבור ניסויים בעיכול אנאירובית. מבחנות היו מלאים בינוני ומחוסן עם בוצה לעיכול מדולל. הכורים היו גז אטום היטב עם פקקים גומי בוטיל וכובעי אלומיניום. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 3: ייצור מתאן. ייצור מתאן מצטבר במהלך 28 ימים של דגירה מסופיזם מכורים המשקף תנאי עומס שונים (נמוך, בינוני, גבוה). המשך: שליטה; טריפ: טריפטופן; להיות: טירולה; פה: פנילאלנין; ME: תמצית בשר; רשויות אישורים: קזאין. זוהי דמות ששונתה שמקורם במחקר מוקדם יותר8. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 4: Fluorescing מתיונין. מתיונין מזינוגנים פולט אור כחלחל כאשר הוא מתרגש עם אור UV. כאן, מתיאנוגנים מחוברים חלקיקי צמחים (ירוק בהיר). הדגימות נלקחו ממחולל אצווה, מדולל במיקרוסקופ, וניתח מיד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 5: ריכוז אצטט. הריכוז אצטט במהלך 28 ימים של דגירה mesophilic בכורים המשקף תנאי עומס שונים (נמוך, בינוני, גבוה). המשך: שליטה; טריפ: טריפטופן; להיות: טירולה; פה: פנילאלנין; ME: תמצית בשר; רשויות אישורים: קזאין. זוהי דמות ששונתה שמקורם במחקר מוקדם יותר8. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
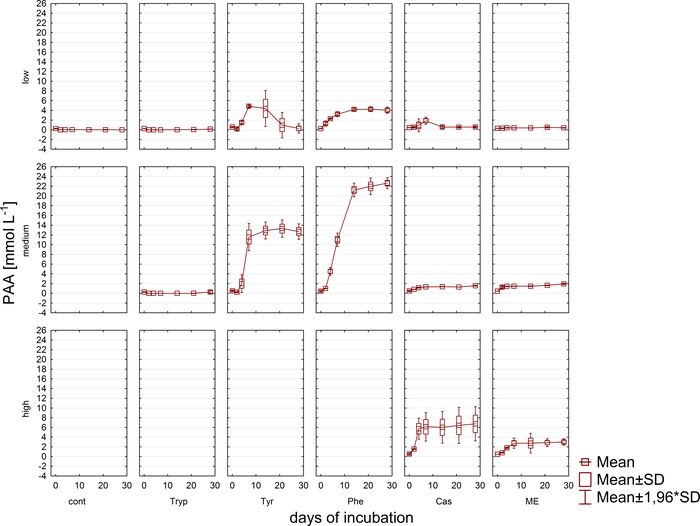
איור 6: ריכוז פנילאצטט. הריכוז פנילאצטט במהלך 28 ימים של הדגירה המספילית בכורים המשקף תנאי עומס שונים (נמוך, בינוני, גבוה). המשך: שליטה; טריפ: טריפטופן; להיות: טירולה; פה: פנילאלנין; ME: תמצית בשר; רשויות אישורים: קזאין. זוהי דמות ששונתה שמקורם במחקר מוקדם יותר8. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 7: התגובה Resazurin. Resazurin בצבע כחול עובר הפחתה בלתי הפיכה לספיגה (ורוד) והפחתה הפיך נוספת הדיאוציםהזול ביותר על פי אוזרנסקי ואח '12. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| ציאנוקובלמין | 0.050 גרם |
| 4-האמינבאיקון חומצה | 0.050 גרם |
| ד-ביוטין | 0.010 גרם |
| חומצה ניטילית | 0.100 גרם |
| Pyridoxine | 0.250 גרם |
| חומצה D-פנטאית | 0.025 גרם |
| טאמיניום כלוריד HCl | 0.18 גרם |
| מים מזוקקים | 1000 מ ל |
שולחן 1: פתרון ויטמין.
| 25% (w/v) HCl | 10.0 מ ל |
| 2 x 4 H2O | 1.50 גרם |
| שפני העכבר2 | 0.070 גרם |
| 2xcl2 x 4 H2O | 0.100 גרם |
| H3בו3 | 0.006 גרם |
| מריו2 x 6 H2O | 0.190 גרם |
| כונן2 x 2 H2O | 0.002 גרם |
| מריו2 x 6 H2O | 0.024 גרם |
| Na2MoO4 x 2 H2O | 0.036 גרם |
| מים מזוקקים | 990.0 מ ל |
| המלצת הכנה | הוסף את HCl ולפזר את פוריות2, להוסיף 100 mL מים מזוקקים, לפזר את החומרים האחרים, ולפצות עד 1000 mL. |
טבלה 2: פתרון רכיב מעקב.
| מיכל שלמה | 1.0 גרם |
| 2xcl2 x 6 H2O | 0.4 גרם |
| KH2פו4 | 0.2 גרם |
| אשלגן כלורי | 0.5 גרם |
| CaCl2 x 2 H2O | 0.15 גרם |
| ל-ציסטאין | 0.5 גרם |
| תמצית שמרים | 1.0 גרם |
| תמיסת רזזורין | 1 מ ל |
| תמיסת ויטמינים | 1 מ ל |
| פתרון רכיב מעקב | 1 מ ל |
| מים מזוקקים | 1000 מ ל |
| pH | 7.2 |
שולחן 3: בינוני מלח מינימלי.
| שתנה | יחידה | תיאור/ |
| tY | d | זמן מדידה |
| tX | d | נקודת זמן של מדידה קודמת |
| pM | . אני מבין | נמדד לחץ-יתר ב t-Y |
| pA | . אני מבין | לחץ סביבתי ב t-Y |
| pAX | . אני מבין | לחץ סביבתי ב-tX |
| p | . אני מבין | לחץ סטנדרטי, 1013, 25 מבער 1343 דין |
| אני | K | טמפרטורת דגירה |
| TS | K | טמפרטורה סטנדרטית, 273, 15 K (מתאים 0 ° C) acc. DIN 1343 |
| VH | מ ל | נפח עוצמת הרווח ב-tY |
| VHX | מ ל | נפח כמות השטח ב-tX |
| 4% CH | [vol%] | ריכוז מתאן לפי GC-מדידה ב t-Y |
| CH4% X | [vol%] | ריכוז מתאן לפי GC-מדידה ב tX |
| VCH4T | . אני מבין | סה כ סכום מתאן בבקבוק הסרום ב-tY |
| VCH4R | . אני מבין | כמות מתאן שיורית בחלל הראש ב tX |
| VCH4N | . אני מבין | מתאן המיוצר לאחרונה מ tX כדי t |
שולחן 4: תיאור המשתנים במשוואה 1-3.
Discussion
הצעד החשוב והקריטי ביותר ב culturing מיקרואורגניזמים אנאירובית היא להבטיח מצבים ללא חמצן בעיבוד המדיה ומרחב הראש של בקבוקי. מחוון כמו resazurin יכול לשמש בעקיפין לבדוק את המילוי אנאירובית הנכון של מבחנות. Resazurin הוא צבע שימוש נפוץ החמצון כפי שהוא זול, לא רעיל, והוא כבר יעיל במינונים נמוכים הדגירה קצר פעמים 12. כאשר משולבים בתקשורת, הצבע הכחול resazurin הראשון עובר צעד הפחתה בלתי הפיך לספיגה, אשר הוא ורוד בערכי ה-pH נייטרלי. תגובה ראשונה זו יכולה להתרחש כאשר המדיה מחוממת 13. לאחר מכן, הריאופין מופחת לסטייה חסרת צבע בתגובה משנית הפיכה (איור 7)12. המערכת מחדש הופך לחסר צבע לחלוטין בפוטנציאל הפחתת חמצון רגיל של אודות Eh =-110 mv והופך ורוד מעל פוטנציאל החמצון של-51 mV 13.
על מנת לצמצם עוד יותר את הפוטנציאל לחמצון, למשל, כדי להקל על הצמיחה של מיקרואורגניזמים מתיונין ידוע לדרוש פחות מ-200 mV14, פתרון Na2S ניתן להוסיף. לחילופין, cysteine-HCl, נתרן-תאיוגליקוליום, או נתרן דיתיוניט משמשים בדרך כלל. עם זאת, אשר הפחתת הסוכן מתאים לשימוש תלוי בכיוונון ניסיוני בהתאמה והוא עשוי לדרוש תשומת לב מיוחדת. למשל, נתרן thioglycolate צריך הפעלת טמפרטורה (למשל, על ידי אוטוקלינג).
חיידקים מאוזנים היטב, המורכב מסוגים שונים של חיידקים והארכאונים, והוא עובד ביעילות השפלה אנאירובית מדורגת ניתן עוד להעריך על ידי קביעת הרכב החלל הקדמי גז בצלוחיות התרבות באמצעות גז כרומטוגרפיה. כאשר הטיפול תרכובות כמו חומצות פנקסיל הנגזרות precursors שונים, הערכה של החלל הקדמי היא דרך מהירה כדי לבדוק את התהליך של מתיונין8. מרחב אמות4 ריכוז של כ. 50-60% בפקדים בסוף תקופת הדגירה מצביע על ניצול מוצלח של החומרים המזינים שהוחלו ולכן מינרליזציה של חומר אורגני בתנאים אנאירובית. הפקת מתאן תיאורטית וריכוזי מתאן במהלך תהליך העיכול ניתן לקבוע לאחר מכן על פי משוואת buswell-בויל לאחר ניתוח יסודי של המצע או על ידי הערכת התוכן של פחמימות, חלבונים ושומנים במצע. על פי VDI 4630 15, פחמימות יכול להוביל לייצור ביוגז תיאורטי של 750 L kg-1 VSS (50% CH4 ו 50% CO2), חלבונים עד 800 L ק"ג-1 VSS (72% CH4 ו 28% CO2), ו שומנים כדי 1,390 L ק ג . אני לא מבין VSS (60% CH '4 ו 40% CO2).
יתר על כן, היווצרות אפשרי השפלה הבאים של VFAs וחומצות פנקסיל היו מנוטרים. תהליך ההשפלה ניתן להעריך על ידי ניתוח של ריכוזי VFA (למשל, אצטט, propionate) בנקודות זמן שונות. הצטברות חומצות שומן קצרות כמו אצטט ו/או propionate יכול להצביע על הפרעות בקומפוזיציה הקהילה methanogenic לבין עומס יתר המגיב הכולל. עם זאת, מאוזן מאוזנת השפלה מיקרוביאלית יכול אפילו להתמודד עם VFA גבוהה מאוד ריכוזי אצטט9. חוץ מזה, יחס אצטט/propionate עשוי לספק עוד מידע על תנאי המחולל הכולל16. עם זאת, ישנם פרמטרים רבים המתאימים לניטור תהליך כי יש לבחור על פי השערות ניסיוני המוצע. בדוגמה הנוכחית, משתני היעד היו בריכוזים של חומצה פניקסיל (איור 6).
Disclosures
. למחברים אין מה לגלות
Acknowledgements
מחקר זה מומן על ידי קרן המדע האוסטרי (FWF): מספרי הפרוייקט P 29360 ו-P 29143. הפרסום נתמך על ידי בעלי ההון באוניברסיטת אינסברוק. אנו מכירים במידה רבה את EIG.
Materials
| Name | Company | Catalog Number | Comments |
| culture flasks (120 mL, N20) | Ochs, Germany | 102046 | |
| buty rubber septa (N20) | Ochs, Germany | 102049 | |
| aluminium caps (N20) | Ochs, Germany | 102050 | |
| N2 gas | Messer, Austria | purity 5.0 | |
| syringes + cannulae | various | ||
| crimper | Ochs, Germany | 102051 | |
| de-crimper | Ochs, Germany | 102052 | |
| GC2010 | Shimadzu | ||
| Shin-carbon GC column | Restek | chromatographic separation of H2, O2, CH4, and CO2 | |
| HPLC Prominence | Shimadzu | ||
| Fast Fruit HPLC Column | Phenomenex | chromatographic separation of VFAs, phenyl acids, etc. |
References
- Wiebe, W. J., Pomeroy, L. R., Wiegert, R. G., et al. Anaerobic Respiration and Fermentation. The Ecology of a Salt Marsh. , 137-159 (1981).
- Kim, B. H., Gadd, G. M., Kim, B. H., Gadd, G. M. Anaerobic fermentation. Bacterial physiology and metabolism. , 252-297 (2008).
- Stolz, J. F., Oremland, R. S. Bacterial respiration of arsenic and selenium). FEMS Microbiology Reviews. 23 (5), 615-627 (1999).
- Lackner, N., Hintersonnleitner, A., Wagner, A. O., Illmer, P. Hydrogenotrophic Methanogenesis and Autotrophic Growth of Methanosarcina thermophila. Archaea. 2018 (5), 1-7 (2018).
- Mutschlechner, M., Praeg, N., Illmer, P. The ecological importance of grazing to methane fluxes and engaged microbial communities in alpine forest soils. FEMS Microbiology Ecology. , (2018).
- Prem, E. M., Reitschuler, C., Illmer, P. Livestock grazing on alpine soils causes changes in abiotic and biotic soil properties and thus in abundance and activity of microorganisms engaged in the methane cycle. European Journal of Soil Biology. 62, 22-29 (2014).
- Praeg, N., Wagner, A. O., Illmer, P. Effects of fertilisation, temperature and water content on microbial properties and methane production and methane oxidation in subalpine soils. European Journal of Soil Biology. 65, 96-106 (2014).
- Wagner, A. O., Prem, E. M., Markt, R., Kaufmann, R., Illmer, P. Formation of phenylacetic acid and phenylpropionic acid under different overload conditions during mesophilic and thermophilic anaerobic digestion. Biotechnology for Biofuels. 12 (1), 359 (2019).
- Lins, P., Malin, C., Wagner, A. O., Illmer, P. Reduction of accumulated volatile fatty acids by an acetate-degrading enrichment culture. FEMS Microbiology Ecology. 71 (3), 469-478 (2010).
- Wagner, A. O., Hohlbrugger, P., Lins, P., Illmer, P. Effects of different nitrogen sources on the biogas production - a lab-scale investigation. Microbiological research. 167 (10), 630-636 (2012).
- Wagner, A. O., et al. Sample preparation, preservation, and storage for volatile fatty acid quantification in biogas plants. Engineering in Life Sciences. 17 (2), 132-139 (2017).
- Uzarski, J. S., DiVito, M. D., Wertheim, J. A., Miller, W. M. Essential design considerations for the resazurin reduction assay to noninvasively quantify cell expansion within perfused extracellular matrix scaffolds. Biomaterials. 129, 163-175 (2017).
- Costilow, R. N., Breznak, J. A., Marzluf, G. A., et al. Physicochemical Factors in Growth. Methods for General and Molecular Microbiology. , 309-329 (2007).
- Le Mer, J., Roger, P. Production, oxidation, emission and consumption of methane by soils: a review. European Journal of Soil Biology. 37 (1), 25-50 (2001).
- . Verein deutscher Ingenieure VDI 4630: Fermentation of organic material. VDI Richtlinien. , (2006).
- Wagner, A. O., Reitschuler, C., Illmer, P. Effect of different acetate: Propionate ratios on the methanogenic community during thermophilic anaerobic digestion in batch experiments. Biochemical Engineering Journal. 90, 154-161 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved