Method Article
엄격하게 혐기성 /안산 조건하에서 미생물의 재배를위한 중간 준비
요약
의무 혐기성 유기체는 산소 노출시 성장할 수 없기 때문에 혐기성 배양 기술의 사용은 필수적입니다. 여기서, 우리는 배지 제제로부터 가스 및 휘발성 지방산 정량화에 이르기까지 바이오가스 플랜트로부터 유래된 혼합 배양을 배양하는 간단하고 효과적인 방법을 입증한다.
초록
호기성 유기체와는 달리, 엄격하게 혐기성 미생물은 산소의 부재와 일반적으로 성장을 시작하는 낮은 레독스 잠재력을 필요로한다. 산소는 공기 중에 유비쿼터스이기 때문에 모든 재배 단계에서 O2-free 조건을 유지하는 것은 어렵지만 혐기성 배양의 전제 조건입니다. 여기에 제시된 프로토콜은 간단하고 저렴한 방법을 사용하여 바이오 가스 플랜트로부터 유래된 혐기성 혼합 배양의 성공적인 재배를 입증한다. 전체 무산소 배양 과정에 대한 정확한 설명은 미디어 준비, 재배 플라스크 의 충진, 레독스 표시기 보충 및 저감제를 통해 낮은 산화배전 잠재력을 제공하고 헤드스페이스를 교환하는 것을 포함합니다. 산소가 없는 매체를 공급합니다. 또한, 무균 접종 가스 꽉 혈청 플라스크 (멸균 주사기와 바늘을 사용하여)와 적절한 배양 조건의 상세한 개요가 제공됩니다. 본 프로토콜은 가스 크로마토그래피(GC) 및 고성능 액체 크로마토그래피(HPLC)를 사용하여 가스 조성 및 휘발성 지방산 농도에 관한 후속 분석을 위해 가스 및 액체 샘플링을 각각 다루고, 이상적인 가스 법칙을 고려하여 바이오 가스와 메탄 수율을 계산합니다.
서문
주목할만한 농도의 지구 분자 산소는 대기와 직접 접촉하거나 산소 광트로프가있는 지역에서 사용할 수 있습니다. 산소가 없는 환경은 혐기성이라고 합니다. 그러나, 에너지 변환은 2개의 상이한 신진 대사 프로세스, 발효 및 혐기성호흡을 통해 혐기성 조건 하에서 아직도 가능하다 1.
호기성 호흡을 겪고 있는 유기체가 말기 전자 수용자로 산소를 사용하는 동안, 혐기성 호흡은 질산염 또는황산염 2와 같은 대체 전자 수용자가 필요합니다. 소위 "전자 타워"에서, 레독스 커플은 상단에있는 가장 부정적인 것들 (전자 기증자)와 하단에 긍정적 인 산화 전위 (전자 수용기)와 함께, 자신의 산화 전위에 따라 구성됩니다. 기증자와 수용자 사이의 전자 전달은 소위 호흡 사슬을 통해 에너지 절약으로 이어지며 전자는 전자 수용자가 포착 할 수 있습니다 - 타워의 다른 층에 있습니다. 이에 따라, 전자탑을 통해 전자의 가을이 높을수록, 각각의 반응에 의해 더 많은 에너지를 보존할 수 있다. 따라서 혐기성 서식지에서 호흡이 가능합니다(예: NO3-/NO2-- 푸마릭산/수치닉산, SO32-/H2SS, S°/H2S, Mn(IV)/Mn(II)을 포함한 레독스 쌍으로도 가능합니다. ), Fe(III)/Fe(II)2,3. 첫째, 생성된 에너지는 멤브레인 전위로 보존되며, 이는 아데노신-트리포스페이트(ATP) 합성을 위한 전자 수송 인산화에 의해 연속적으로 사용된다 ATP-synthases. 호기성 호흡과는 달리 혐기성 호흡으로 보존 할 수있는 에너지의 양을 크게 줄일 수 있습니다. 그러나, 대부분의 혐기성 호흡의 에너지 출력은 발효에 비해 여전히 높다, 산소 및 기타 말단 전자 수용자가 부족한 서식지에서 혐기성 에너지 보존 경로2.
발효 중에 에너지가 풍부한 유기 기질은 알코올 발효와 같은 전체 공정의 이름을 정의하는 다양한 발효 제품으로 분해됩니다. 호흡 과정과 는 달리, 발효 동안 ATP 생성은 인산염 그룹이 에너지가 풍부한 인산 기판으로부터 아데노신 디 인산염(ADP)으로 이송되는 동안 기질 수준 인산화로 제한된다. 발효 미생물은 기판 고장의 핵심 플레이어이기 때문에 유기물의 혐기성 분해에 중심적인 역할을합니다. 유기산, 알코올, CO2 및 H2와같은 1차 발효 생성물은 이후에 이차 발효 미생물에 의해 아세트산,CO2및 H2를 생성하는 데 사용될 수 있다. 발효 제품에 대한 예로는 젖산, 다양한 휘발성 지방산 (포믹, 아세트, 프로피온, 부티릭- 발릭산), n-부탄놀, 2,3-부탄디올, 아세톤 및 에탄올이 있습니다.
엄격하게 혐기성 조건하에서 미생물을 재배하려면 호기성 유기체의 재배와 비교하여 완전히 다른 방법과 장비가 필요합니다. 산소 내성 유기체는 종종 한천 요리, 소위 표면 배양에서 재배되지만, 이것은 몇 가지 예외를 제외하고는 엄격하게 혐기성 미생물에 거의 불가능합니다. 따라서, 엄격하게 혐기성 미생물의 농축 배양은 주로 무산소 헤드 스페이스 분위기를 보장 가스 꽉 셉트로 밀봉 배양 혈관을 적용 액체 매체에 설립4,6, 7.
현재 프로토콜 설명은 혐기성 바이오가스 플랜트로부터 유래된 혼합 집단의 표적 미생물에 대한 적절한 재배 방법을 제공할 것이다. 순수한 문화의 고립과 재배는 훨씬 더 어렵지만 이 일의 일부가 아닙니다.
여기서, 단백질성기질의혐기성 소화 동안 페닐산의 형성에 관한 연구에 기초하여 혐기성 미생물 군락을 육성하는 절차를 8. 미생물 공동체는 혐기성 소화의 모든 4단계의 구성원으로 구성되었습니다: 가수분해, 산성발생, 아세토제네시스, 및 메탄발생. 탄소공급원, 레독스-인디케이터, 비타민 및 미량 원소 용액을첨가한 미네랄 염 배지를 적용하였다 9. 배지는 각각의 단백질페닐산 전구체 기판8로개정하였다.
프로토콜
1. 매체의 준비
- 레독스 표시기 재고 솔루션 (0.1 g의 resazurin /100 mL 수성 용액)을 준비하십시오.
- 비타민 용액을 준비합니다(표1).
- 추적 요소 솔루션을준비합니다(표 2).
참고: 추가 순서는 중요합니다. 표 2 및 각 프로토콜을 참조하십시오. - 환원 에이전트 재고 솔루션 (60g Na2S / L 수성 용액)을 준비하십시오.
- 중간 크기의 재료(미네랄 소금 배지, 표3)를 적절한 플라스크(예: 1L 스크류 캡 랩 플라스크)에 계량합니다.
참고: 실험 설정에 따라 별도의 탄소 원천을 추가해야 할 수 있습니다. - 증류수 반량을 넣고 (표3) 재료를 녹입니다.
- 표3에 따라 1 mL의 산화도표시솔루션을 추가합니다.
- 표3에 따라 비타민과 미량 원소 솔루션을 추가합니다.
- 표3의 중간/유기체 요구 사항에 따라 pH를 조정합니다.
참고: 산화환도표의 색상은 pH에 따라 달라지며 조정하는 데 약간의 시간이 필요할 수 있습니다. - 증류수로 최종 부피 1L를 가져옵니다.
참고: 비타민 과 미량 원소 용액은 이전에 폐쇄되고 오토클레이브 된 혈청 플라스크에 필터 멸균 된 aliquot (희석 된 용액, 필터 기공 크기 및 0.2 μm)를 첨가하여 오토클레이브 후 추가 할 수 있습니다. 그러나, 이 접근은 오염의 높은 리스크를 품습니다.
2. 재배 플라스크 의 충전
- 120 mL 세럼 플라스크를 철저히 깨끗하게 건조시고 건조시다.
참고: 세럼 플라스크는 다양한 부피 용량(예: 20, 60, 120, 250 mL)으로 제공됩니다. - 철저하게 깨끗하고 건조 부틸 고무 septa.
- 재배 플라스크에서 추가중간 성분(예를 들어, 페닐산 전구체 기판)을 계량한다.
참고: 추가 구성 요소는 실험 설정 및 가설에 따라 달라집니다. - 50 mL의 매체로 세럼 플라스크를 채웁니다.
3. 액체 상에서 산소의 감소 /제거
- ~ 100 ° C 수조를 준비하십시오.
- 수조에 채워진 혈청 플라스크를 설정하고 액체 상에서 O2의 용해도를 감소시키기 위해 약 20-30 분 동안 배양한다.
- N 2 가스로 즉시 헤드 스페이스를 세척하거나N2 / CO2와 같은 다른 가스 또는 가스 혼합물로 대체하십시오.
주의: 적절한 실내 환기를 주의하십시오. - 부틸 고무 패혈증으로 플라스크를 닫고 알루미늄 캡으로 고정하십시오.
참고 : 고무 septa는 종종 그것을 드릴링하는 동안 물 / 매체의 방울을 추가하여 플라스크의 목에 더 잘 맞을 수 있습니다. - 배지 50mL로 채워진 각 플라스크에 0.1 mL의 환원제(스톡 솔루션)를 추가하여 레독스 전위(배지 50 mL당 환원제 0.1 mL)를 추가합니다.
- 121 °C에서 20 분 동안 오토 클레이브.
주의: 밀폐용기의 멸균인증을 받은 오토클레이브를 사용해야 합니다. 그렇지 않으면 온도 상승에서 파생된 과압으로 인해 혈청 플라스크가 폭발할 수 있습니다.
4. 매체의 접종
- 혐기성 소화조에서 접종을 준비하십시오.
- 400 mL의 증류수를 플라스크에 넣고 끓입니다.
- N 2로 헤드 스페이스를 영구적으로 플러시하면서 (&30 °C) 식히십시오.
- 혐기성 소화제에서 추출한 슬러지 약 100 g을 넣습니다.
참고: 산소와 슬러지가 과도하게 접촉하지 않도록 하십시오. - 희석의 정확한 결정을 위해 추가 된 슬러지의 정확한 질량을 기록합니다.
- 플라스크의 헤드스페이스를 N2로 교환하고 부틸 고무 중격으로 닫습니다.
- 120 rpm에서 30 분 동안 플라스크를 흔들어주세요.
- 주사기 + 캐뉼라를 사용하여 5 mL 접종을 제거하고 1-3 단계에서 설명한 대로 준비된 혈청 플라스크에 주입합니다.
5. 인큐베이션, 샘플링 및 분석
- 각각의 실험에 적합한 온도에서 접종된 혈청 플라스크를 배양한다.
참고: 인큐베이션 온도는 실험 설정에 따라 달라지며 접종을 사용합니다.- 주사기 + 캐뉼라를 사용하여 온도 증가로 인한 과압을 배출하는 경우 혈청 플라스크의 액체가 인큐베이션 온도 (배양 온도에 따라 약 15 - 30 분)에 평형화됩니다.
주의: 적용된 기판에 따라 농도, 온도, 배양 시간, 접종 유형 및 농도, 플라스크 내과압은 최대 > 2 바 압력까지 상승할 수 있으며 혈청 플랙이 폭발할 수 있습니다. 따라서 기압계를 사용하여 과압을 모니터링하고 캐뉼라로 과압을 배출하는 것이 필수적입니다.
- 주사기 + 캐뉼라를 사용하여 온도 증가로 인한 과압을 배출하는 경우 혈청 플라스크의 액체가 인큐베이션 온도 (배양 온도에 따라 약 15 - 30 분)에 평형화됩니다.
- 인큐베이션 시간 동안 바이오 가스 생산 및 조성을 평가합니다.
참고: 잠복기는 며칠에서 몇 주까지 지속될 수 있습니다.- 전류 대기압을 기록합니다.
- 기압계를 준비하고 미생물 활성에서 파생된 플라스크 내의 압력을 평가한다.
- 플라스크를 흔들어 주세요.
- 주사기 + 캐뉼라를 사용하여 헤드스페이스 가스 1mL를 제거하고가스 크로마토그래피를 통해 H 2, O2,CH4및/또는 CO2 농도를 측정합니다.
참고 : H2, O2,CH4및CO2의 검증 및 정량화를 위해가스 크로마토 그래프는 160 ° C (컬럼 오븐), 100 ° C (인젝터) 및 180 °C (열 전도성 검출기, TCD)의 작동 온도를 적용하는 데 사용되었습니다. ). N2는 캐리어 가스로 사용되었다. 자세한 내용은 이전 연구10을참조하십시오.
- 휘발성 지방산(VFA) 및 페닐산의 농도를 모니터링합니다. VFA 및 페닐산 분석의 경우, 5mM H2 SO4를 이월상으로 실행하는 UV검출기(220nm)가 장착된 HPLC 시스템을 사용하십시오. 방법의 세부 사항 및 샘플 저장에 대한 추가 정보는 이전 연구11을참조하십시오.
참고: VFA의 분석은 다른 많은 물리 화학 적 분석 또는 현미경 평가에 대한 예시입니다. 더욱이, 실험의 특정 시점에서 미생물 군락의 풍부성 및/또는 미생물 군비 의 조성을 표적으로 하는 분자 생물학적 방법은 기재된 절차를 사용하여 적용될 수 있다.- 주사기 + 캐뉼라로 액체 1 mL을 제거합니다.
참고: 샘플은 철수 직후(-20°C)로 동결하고 실험11의끝에서 분석할 수 있다. - 15,000-20,000 x g에서 원심 분리기를 통과하고 0.2 μm RC (재생 셀룰로오스) 필터를 통과합니다.
- HPLC 시스템에 5-20 μL을 주입하고 VFA 조성 및 페닐산 농도를 분석합니다.
- 주사기 + 캐뉼라로 액체 1 mL을 제거합니다.
- 캐뉼라를 사용하여 플라스크의 과압을 배출합니다.
참고 : 압력과 가스 조성을 결정하고 필요한 샘플을 채취한 후 재배 플라스크를 각각의 온도에 다시 놓고 액체가 인큐베이션 온도를 달성하기 전에 과압을 배출하지 마십시오. - 방정식 1-3을 사용하여 이상적인 가스 법칙을 고려하여 바이오 가스 및 메탄 생산 VCH4N을 계산합니다. 표4를 참조하십시오.
방정식 1:
이에 따라
방정식 2: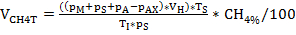
및
방정식 3:
참고: 총 바이오가스 생산량을 계산하려면 수학식 2와 3에서 CH4%와 CH4%X의 양을 100으로 설정해야 합니다. NmL: 표준화된 조건(0°C, 1 atm)에서 정규화된 가스 부피, 응치가스 부피는 22.414 NmL/mmol입니다.
결과
재배 플라스크는 전술한 프로토콜에 따라 혐기성 조건 하에서 배지로 채워졌고,적절한 색상을 확인하였다(도 1), 혐기성 소화를 수행하는 소형 배치 바이오리액터로서 사용하였다. 이들은 잠재적으로 페닐산 형성을 일으키는 원인이 되는 기질로 개정되고 혐기성 소화제 슬러지를 접종물로사용하여 배양하였다(도 2). 트립토판, 티로신, 페닐알라닌, 복합 단백질 전구체 고기 추출물 및 카제인은 각각 2및 3개의 서로 다른 농도로 적용되었다. 대조군을 추가의 기판 보충 없이 제조하였다. 과부하의 다른 단계의 시뮬레이션을 목표로 다른 기판 농도. 플라스크를 37°C(중소성)에서 4주 동안 배양하였다.
바이오가스 생산 및조성물(H2, CH4, CO2)은 가스 크로마토그래피(GC TCD)10 및 헤드스페이스 압력의 평가를 통해 정기적으로 모니터링하였다. 도 3은 혐기성 인큐베이션 4주 동안 다양한 농도에서 적용된 기판의 소화로부터 유래된 누적 메탄 생산의 차이를 보여준다. 게다가, 메탄겐은 메탄발생에서 전자 담체인 코엔자임 F420을조사하여 가시화되었고, 420 nm에서 최대 흡수를 가진 청록색 형광을 나타낸다(도 4).
가스 분석에 동시, HPLC11을 통한 VFA 및 페닐산 농도 측정을 위한 샘플은 추가 처리될 때까지 철회및 냉동 보관하였다. 도 5는 아세테이트에 대해 예시적으로 묘사된 고도로 과부하된 샘플의 축적에 의해 반영된 과부하의 상이한 단계의 효과를 나타낸다. 도 6은 잠복기 동안페닐 아세테이트 농도의 역학을 도시한다.

그림 1: 레독스 표시기. 재배 플라스크에서 올바른 산화배전전위는 산화배설기를 첨가하여 조절될 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 소형 배치 바이오리액터. 혐기성 소화 실험을 위해 120 mL 재배 플라스크에서 제조된 소형 배치 바이오리액터. 플라스크는 중간 매체로 채워지고 희석 된 소화기 슬러지로 접종하였다. 원자로는 부틸 고무 스토퍼와 알루미늄 캡으로 가스를 단단히 밀봉했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
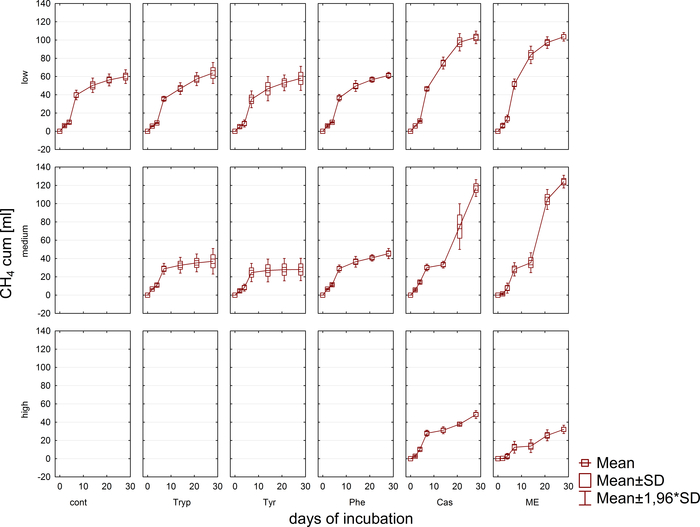
그림 3: 메탄 생산. 다른 과부하 조건을 반영하는 반응기로부터의 중원 인큐베이션의 28일 동안 의 누적 메탄 생산(낮음, 중간, 높음). 연속: 제어; 트립: 트립토판; 티르: 티로신; 페: 페닐알라닌; 나: 고기 추출물; Cas: 카제인. 이것은 이전 연구에서 유래 수정 된 그림8. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
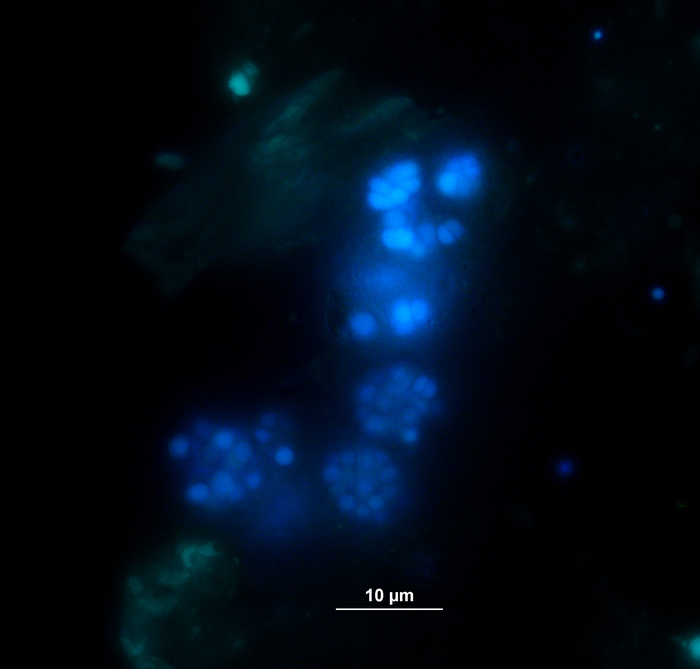
그림 4: 형광 메탄겐. 메탄오겐은 자외선으로 흥분할 때 청색광을 방출합니다. 여기서, 메탄오겐은 식물 입자(연한 녹색)에 부착된다. 샘플은 배치 반응기에서 채취하고 현미경 검사를 위해 희석된 후 즉시 분석했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 5: 아세테이트 농도. 다른 과부하 조건을 반영하는 반응기에서 의 중증 인큐베이션의 28 일 동안 아세테이트 농도 (낮음, 중간, 높음). 연속: 제어; 트립: 트립토판; 티르: 티로신; 페: 페닐알라닌; 나: 고기 추출물; Cas: 카제인. 이것은 이전 연구에서 유래 수정 된 그림8. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
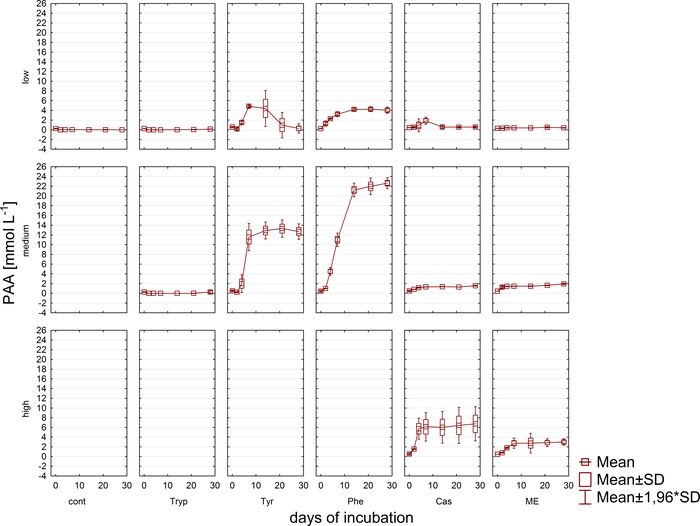
그림 6: 페닐아세테이트 농도. 다른 과부하 조건 (낮음, 중간, 높음)을 반영하는 반응기에서 중원 인큐베이션의 28 일 동안 Phenylacetate 농도. 연속: 제어; 트립: 트립토판; 티르: 티로신; 페: 페닐알라닌; 나: 고기 추출물; Cas: 카제인. 이것은 이전 연구에서 유래 수정 된 그림8. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 레자주린 반응. 우자르스키 외12에따르면 청색 레자주린은 레소루핀(분홍색)에 대한 돌이킬 수 없는 감소와 무색 디하이드로레소루핀에 대한 추가적인 가역적 감소를 겪는다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 시아노코발라민 | 0.050 g |
| 4-아미노벤조산 | 0.050 g |
| D-비오틴 | 0.010 g |
| 니코틴산 | 0.100 g |
| 피리독신 | 0.250 g |
| D-판토테닉산 | 0.025 g |
| 티아미늄 염화물 HCl | 0.18 g |
| 증류수 | 1000 mL |
표 1: 비타민 용액.
| 25% (v) HCl | 10.0 mL |
| FeCl2 x 4 H2O | 1.50 g |
| ZnCl2 | 0.070 g |
| MnCl2 x 4 H2O | 0.100 g |
| H3BO3 | 0.006 g |
| 코클2 x 6 H2O | 0.190 g |
| CuCl2 x 2 H2O | 0.002 g |
| 니클2 x 6 H2O | 0.024 g |
| Na2MoO4 x 2 H2O | 0.036 g |
| 증류수 | 990.0 mL |
| 준비 권장 사항 | HCl을 추가하고 FeCl2를용해시키고, 100 mL 증류수를 추가하고, 다른 재료를 용해시키고, 최대 1000 mL을 만듭니다. |
표 2: 추적 요소 솔루션입니다.
| Nacl | 1.0 g |
| MgCl2 x 6 H2O | 0.4 g |
| KH2PO4 | 0.2 g |
| KCl | 0.5 g |
| CaCl2 x 2 H2O | 0.15 g |
| L-시스테인 | 0.5 g |
| 효모 추출물 | 1.0 g |
| 레자주린 용액 | 1 mL |
| 비타민 솔루션 | 1 mL |
| 추적 요소 솔루션 | 1 mL |
| 증류수 | 1000 mL |
| Ph | 7.2 |
표 3: 최소 소금 매체.
| 변수 | 단위 | 설명 |
| tY | [d] | 측정 시간 |
| tX | [d] | 선행 측정의 타임포인트 |
| pM | [mbar] | t Y에서 측정된 과압 |
| pA | [mbar] | t Y에서의 주변 압력 |
| pAX | [mbar] | t X에서의 주변 압력 |
| pS | [mbar] | 표준 압력, 1013,25 mbar acc. DIN 1343 |
| TI | [K] | 인큐베이션 온도 |
| TS | [K] | 표준 온도, 273,15 K(0° C에 해당) acc. DIN 1343 |
| VH | 【 ml 】 | t Y의 헤드스페이스 볼륨 |
| VHX | 【 ml 】 | t X의 헤드스페이스 볼륨 |
| CH4% | [vol%] | t Y에서 GC 측정에 따른 메탄 농도 |
| CH4%X | [vol%] | t X에서 GC 측정에 따른 메탄 농도 |
| VCH4T | [Nml] | t Y의 혈청 병에 있는 총 메탄 양 |
| VCH4R | [Nml] | t X의 헤드스페이스에 잔류 메탄 량 |
| VCH4N | [Nml] | t X에서 tY까지 새로 생산된 메탄 |
표 4: 수학식 1 - 3의 변수에 대한 설명입니다.
토론
혐기성 미생물을 배양하는 데 있어 가장 중요하고 중요한 단계는 재배 매체와 플라스크의 헤드스페이스에서 무산소 상태를 보장하는 것입니다. resazurin 같은 표시기는 간접적으로 플라스크의 정확한 혐기성 충진을 확인하는 데 사용할 수 있습니다. Resazurin은 저렴하고, 비독성이며, 이미 저용량 및 짧은 배양 시간 12에효과적이기 때문에 일반적으로 사용되는 레독스 염료이다. 미디어에 통합될 때, 청색 resazurin는 먼저 중성 pH 값에서 분홍색인 resorufin에 돌이킬 수 없는 환원 단계를 겪습니다. 이 첫 번째 반응은 미디어가 가열 될 때 발생할 수 있습니다 13. 이어서, 레소루핀은 가역적인 이차 반응에서 무색 디하이드로레소루핀으로 감소된다(도7)12. 레소루핀/디하이드로레소루핀 레독스 시스템은 약 Eh=-110 mV의 표준 산화 환감소 전위에서 완전히 무색해지고 -51 mV 13의산화 전위 위에 분홍색으로 변한다.
레독스 전위를 더욱 감소시키기 위해, 예를 들어, -200mV미만을 필요로 하는 것으로 알려진 메탄생성 미생물의 성장을 용이하게 하기 위해, Na2 S 용액을 첨가할 수 있다. 대안적으로, 시스테인-HCl, 티오글리콜레이트 나트륨 또는 디티오미트 나트륨이 일반적으로 사용된다. 그러나 환원제가 사용하기에 적합한 것은 각각의 실험 설정에 따라 달라지며 특별한 주의가 필요할 수 있습니다. 예를 들어, 티오글리콜라이나트륨은 온도 활성화가 필요합니다(예를 들어, 오토클레이브에 의해).
박테리아와 고고학의 다양한 제네라로 구성된 균형 잡힌 미생물 컨소시엄과 효율적으로 작동하는 혐기성 분해 캐스케이드는 가스를 통한 배양 플라스크내의 헤드스페이스 가스 조성을 결정함으로써 더욱 평가될 수 있습니다. 크로마토그래피. 상이한 전구체로부터 유래된 페닐산과 같은 화합물을 취급할 때, 헤드스페이스의 평가는 메탄발생 과정8을 확인하는 빠른 방법이다. 인큐베이션 기간의 끝에 있는 대조군에서 약 50-60%의 헤드스페이스 CH4 농도는 적용된 영양소의 성공적인 활용을 나타내며, 따라서 혐기성 조건 하에서 유기 물질의 미네랄화를 나타낸다. 소화 과정 동안 이론적 메탄 생산 및 예상 메탄 농도는 기판의 기본 분석 후 또는 의 함량을 추정하여 Buswell-Boyle 방정식에 따라 전 앤티를 결정할 수 있습니다. 탄수화물, 단백질, 그리고 기판에 지방. VDI 4630 15에따르면 탄수화물은 750 L kg-1 VSS (50 % CH4 및 50 % CO2),단백질 800 L kg-1 VSS (72 % CH4 및 28 % CO2)및 지방 1,390 L kg의 이론적 바이오 가스 생산으로 이어질 수 있습니다. -1 VSS (60% CH4 및 40% CO 2).
더욱이, VFA 및 페닐산의 형성 및 가능한 후속 분해를 모니터링시켰다. 분해 과정은 상이한 시점에서 VFA 농도(예를 들어, 아세테이트, 프로피오네이트)를 분석함으로써 평가될 수 있다. 아세테이트 및/또는 프로피오네이트와 같은 짧은 사슬 지방산의 축적은 메탄생성 공동체 조성및 전반적인 반응기 과부하의 교란을 가리킬 수 있습니다. 그러나, 균형 잡힌 미생물 분해 캐스케이드는 매우 높은 VFA 및 아세테이트 농도9에대처할 수 있다. 게다가, 아세테이트/프로피오네이트 비율은 전체 반응기상태(16)에대한 정보를 더 제공할 수 있다. 그러나 제안된 실험 가설에 따라 선택해야 하는 공정 모니터링에 적합한 많은 파라미터가 있습니다. 본 실시예에서, 표적 변수는 페닐산농도였다(도 6).
공개
저자는 공개 할 것이 없다.
감사의 말
이 연구는 오스트리아 과학 기금 (FWF)에 의해 투자되었다 : 프로젝트 번호 P 29360 및 P 29143. 출판은 Publikations폰드 데르 Universität 인스 브루크에 의해 지원되었다. 우리는 EIG를 크게 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| culture flasks (120 mL, N20) | Ochs, Germany | 102046 | |
| buty rubber septa (N20) | Ochs, Germany | 102049 | |
| aluminium caps (N20) | Ochs, Germany | 102050 | |
| N2 gas | Messer, Austria | purity 5.0 | |
| syringes + cannulae | various | ||
| crimper | Ochs, Germany | 102051 | |
| de-crimper | Ochs, Germany | 102052 | |
| GC2010 | Shimadzu | ||
| Shin-carbon GC column | Restek | chromatographic separation of H2, O2, CH4, and CO2 | |
| HPLC Prominence | Shimadzu | ||
| Fast Fruit HPLC Column | Phenomenex | chromatographic separation of VFAs, phenyl acids, etc. |
참고문헌
- Wiebe, W. J., Pomeroy, L. R., Wiegert, R. G., et al. Anaerobic Respiration and Fermentation. The Ecology of a Salt Marsh. , 137-159 (1981).
- Kim, B. H., Gadd, G. M., Kim, B. H., Gadd, G. M. Anaerobic fermentation. Bacterial physiology and metabolism. , 252-297 (2008).
- Stolz, J. F., Oremland, R. S. Bacterial respiration of arsenic and selenium). FEMS Microbiology Reviews. 23 (5), 615-627 (1999).
- Lackner, N., Hintersonnleitner, A., Wagner, A. O., Illmer, P. Hydrogenotrophic Methanogenesis and Autotrophic Growth of Methanosarcina thermophila. Archaea. 2018 (5), 1-7 (2018).
- Mutschlechner, M., Praeg, N., Illmer, P. The ecological importance of grazing to methane fluxes and engaged microbial communities in alpine forest soils. FEMS Microbiology Ecology. , (2018).
- Prem, E. M., Reitschuler, C., Illmer, P. Livestock grazing on alpine soils causes changes in abiotic and biotic soil properties and thus in abundance and activity of microorganisms engaged in the methane cycle. European Journal of Soil Biology. 62, 22-29 (2014).
- Praeg, N., Wagner, A. O., Illmer, P. Effects of fertilisation, temperature and water content on microbial properties and methane production and methane oxidation in subalpine soils. European Journal of Soil Biology. 65, 96-106 (2014).
- Wagner, A. O., Prem, E. M., Markt, R., Kaufmann, R., Illmer, P. Formation of phenylacetic acid and phenylpropionic acid under different overload conditions during mesophilic and thermophilic anaerobic digestion. Biotechnology for Biofuels. 12 (1), 359 (2019).
- Lins, P., Malin, C., Wagner, A. O., Illmer, P. Reduction of accumulated volatile fatty acids by an acetate-degrading enrichment culture. FEMS Microbiology Ecology. 71 (3), 469-478 (2010).
- Wagner, A. O., Hohlbrugger, P., Lins, P., Illmer, P. Effects of different nitrogen sources on the biogas production - a lab-scale investigation. Microbiological research. 167 (10), 630-636 (2012).
- Wagner, A. O., et al. Sample preparation, preservation, and storage for volatile fatty acid quantification in biogas plants. Engineering in Life Sciences. 17 (2), 132-139 (2017).
- Uzarski, J. S., DiVito, M. D., Wertheim, J. A., Miller, W. M. Essential design considerations for the resazurin reduction assay to noninvasively quantify cell expansion within perfused extracellular matrix scaffolds. Biomaterials. 129, 163-175 (2017).
- Costilow, R. N., Breznak, J. A., Marzluf, G. A., et al. Physicochemical Factors in Growth. Methods for General and Molecular Microbiology. , 309-329 (2007).
- Le Mer, J., Roger, P. Production, oxidation, emission and consumption of methane by soils: a review. European Journal of Soil Biology. 37 (1), 25-50 (2001).
- . Verein deutscher Ingenieure VDI 4630: Fermentation of organic material. VDI Richtlinien. , (2006).
- Wagner, A. O., Reitschuler, C., Illmer, P. Effect of different acetate: Propionate ratios on the methanogenic community during thermophilic anaerobic digestion in batch experiments. Biochemical Engineering Journal. 90, 154-161 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유