Method Article
严格厌氧/缺氧条件下微生物培养的介质制备
摘要
由于义务厌氧生物在氧气暴露后无法生长,使用厌氧培养技术是必不可少的。在这里,我们演示了一种简单而有效的方法,从沼气厂到气体和挥发性脂肪酸定量,培养从沼气厂衍生的混合培养物。
摘要
与有氧生物相比,严格的厌氧微生物需要缺氧,通常氧化还原潜力较低,才能促进生长。由于氧气在空气中无处不在,在种植的所有步骤中保持O 2-无条件具有挑战性,但也是厌氧培养的先决条件。这里提出的协议演示了使用简单且廉价的方法成功培育了从沼气厂衍生的厌氧混合培养物。给出了整个缺氧培养过程的精确描述,包括培养剂制备、灌装培养瓶、补充氧化还原指示器和还原剂以提供低氧化还原电位,以及交换头部空间以保持不含氧气的介质。此外,还详细介绍了无菌接种气体紧固血清瓶(通过使用无菌注射器和针头)和适当的孵育条件。本议定书还涉及气体和液体取样,以便随后分别使用气相色谱法(GC)和高性能液相色谱(HPLC)对气体成分和挥发性脂肪酸浓度进行分析,以及考虑到理想的气体定律,计算沼气和甲烷产量。
引言
在地球上,分子氧在与大气直接接触或存在氧光营养器的区域有显著浓度。缺氧的环境称为厌氧。然而,在厌氧条件下,通过两种不同的代谢过程,发酵和厌氧呼吸1,能量转换仍然是可能的。
当进行有氧呼吸的生物体使用氧气作为终端电子接受器时,厌氧呼吸需要硝酸盐或硫酸盐2等替代电子接受器。在所谓的"电子塔"中,氧化还原夫妇根据其氧化还原电位进行组织,其中最负的在顶部(电子捐赠者),最强的氧化剂在底部具有正氧化电位(电子接受器)。捐赠者和接受者之间的电子转移通过所谓的呼吸链导致节能,电子接受者可以在塔的不同楼层捕获电子-留在图片中。因此,电子通过电子塔的下降幅度越高,通过各自反应可以保存的能量就越多。因此,在厌氧生境中也可以呼吸,例如,使用氧化还原对,包括 NO 3-/NO2-、富马酸/琥珀酸、SO32-/H2S、S/H2S、Mn(IV)/Mn(II),Fe(III)/Fe(II)2,3。首先,产生的能量作为膜电位保存,随后由电子传输磷酸化用于腺苷-三磷酸(ATP)合成膜结合的ATP合成。与有氧呼吸相比,厌氧呼吸可以节省的能量量;然而,大多数厌氧呼吸的能量输出仍然高于发酵,在缺乏氧气的栖息地的厌氧能量保护路径和其他终端电子接受器2。
在发酵过程中,富含能量的有机基质降解为各种发酵产物,这些产品通常定义整个工艺的名称,例如酒精发酵。与呼吸过程相比,发酵过程中的ATP生成仅限于基质水平磷酸化,在此期间,磷酸盐组从富含能量的磷酸基板2转移到腺苷-二磷酸(ADP)。发酵微生物在有机物的厌氧降解中起着核心作用,因为它们是基质分解的关键参与者。初级发酵产物,如有机酸、醇、CO2和H2,随后可用于二次发酵微生物生产醋酸、CO2和H2。发酵产品的示例包括乳酸、各种挥发性脂肪酸(碱酸、醋酸、丙酸、丁酸、瓦列克酸)、n-丁醇、2、3-丁二醇、丙酮和乙醇。
与有氧生物的培养相比,在严格厌氧条件下培养微生物需要完全不同的方法和设备。虽然耐氧生物经常在琼脂菜上栽培,即所谓的表面培养物,但除了少数例外,对于严格厌氧微生物来说,这几乎是不可能的。因此,严格厌氧微生物的富集培养主要建立在液体介质中,使用密封的气密隔膜的培养容器,确保无氧头空间气氛4,6,7.
目前的协议描述将为来自厌氧沼气厂的混合种群的目标微生物提供适当的培养方法。纯文化的孤立和培养更具挑战性,但不是这项工作的一部分。
在这里,我们展示了培养厌氧微生物群落的程序,基于一项关于在厌氧消化蛋白基质8期间苯基酸形成的研究。微生物群落由来自厌氧消化所有四个阶段的成员组成:水解、酸生成、乙酰乙酸生成和甲氧生成。应用了一种矿物盐介质,辅以碳源、氧化还原指标、维生素和微量元素溶液,以及还原剂。该介质用各自的蛋白性苯基酸前体基质8进行了修正。
研究方案
1. 培养介质
- 准备氧化还原指标库存溶液(0.1 克雷沙祖林/100 mL 水溶液)。
- 准备维生素溶液 (表 1).
- 准备跟踪元素解 (表 2.
注:添加顺序很重要;请参阅表2和相应的协议。 - 准备还原剂库存溶液(60 g Na2S/L 水溶液)。
- 在适当的烧瓶中称量介质成分(矿物盐介质,表3)(例如,1 L 螺帽实验室烧瓶)。
注:根据实验设置,可能需要添加单独的碳源。 - 加入半体积蒸馏水(表3),溶解原料。
- 根据表3添加1mL的氧化还原指示器溶液。
- 根据表3添加维生素和微量元素溶液。
- 根据表 3中的介质/有机体要求调整 pH。
注: 氧化还原指示器的颜色与 pH 相关,可能需要一些时间来调整。 - 用蒸馏水将最终体积调至1升。
注:高压灭菌后,还可以通过无菌地将过滤灭菌的等分(稀释溶液、过滤孔径<0.2 μm)添加到先前关闭和高压灭菌的血清瓶中,从而添加维生素和微量元素溶液。然而,这种方法具有更高的污染风险。
2. 填充种植瓶
- 彻底清洁和干燥 120 mL 血清瓶。
注: 血清瓶提供不同的容量(例如,20、60、120、250 mL)。 - 彻底清洁和干燥丁基橡胶隔膜。
- 称称种植瓶中的其他介质成分(例如苯基酸前体基质)。
注:其他组件取决于实验设置和假设。 - 用50 mL的介质填充血清瓶。
3. 在液相中减少/去除氧气
- 准备一个+100°C水浴。
- 在水浴中设置填充血清瓶,孵育约20-30分钟,以降低液体相中O2的溶解度。
- 立即用N2气体或其他气体或气体混合物(如N2/CO 2)冲洗头部空间。
注意:注意适当的房间通风。 - 用丁基橡胶隔膜关闭烧瓶,用铝盖固定。
注:橡胶隔膜在钻取时加入一滴水/介质,通常可以更好地安装在烧瓶的颈部。 - 向每个装有 50 mL 介质的烧瓶添加 0.1 mL 的还原剂(库存溶液),以进一步降低氧化还原电位(每 50 mL 介质减少剂 0.1 mL)。
- 高压灭菌器在121°C下工作20分钟。
注意:必须使用经认证用于封闭容器灭菌的高压灭菌器。否则,温度升高产生的过压可能导致血清瓶爆炸。
4. 接种介质
- 从厌氧消化池准备接种。
- 将400 mL的蒸馏水加入烧瓶中煮沸。
- 冷却(<30°C),同时用N2永久冲洗头部空间。
- 加入从厌氧沼气池中提取的约 100 g 污泥。
注意:避免污泥与氧气过度接触。 - 记录添加污泥的确切质量,以便精确测定稀释。
- 用N2交换烧瓶的头部空间,用丁基橡胶隔膜将其关闭。
- 在 120 rpm 转速下摇动烧瓶 30 分钟。
- 使用注射器 + 管状剂去除 5 mL 接种液,并将其注射到步骤 1-3 中所述的制备血清瓶中。
5. 孵化、取样和分析
- 在适合相应实验的温度下孵育接种血清瓶。
注:孵育温度取决于实验设置和使用接种。- 当血清瓶中的液体平衡到孵育温度(约15~30分钟,取决于孵育温度)时,使用注射器+管状剂排出因温度升高而产生的过压。
注意:根据所应用的基材、其浓度、温度、孵育时间、接种类型和浓度,烧瓶内的过压可能上升至多2bar压力,并可能导致血清片状爆炸。因此,使用压力计监控过压,然后用导管排空过压是强制性的。
- 当血清瓶中的液体平衡到孵育温度(约15~30分钟,取决于孵育温度)时,使用注射器+管状剂排出因温度升高而产生的过压。
- 评估孵化期间的沼气生产和组成。
注:孵育期可能跨越几天到几周。- 记录当前大气压力。
- 准备一个压力计,并评估从微生物活性衍生的烧瓶内的压力。
- 摇动烧瓶。
- 使用注射器+管状去除1mL的头部空间气体,并通过气相色谱测量H2、O2、CH4和/或CO2浓度。
注:对于 H 2、O2、CH4和 CO2的鉴定和定量,使用气体色谱仪应用 160 °C(柱烤箱)、100 °C(喷油器)和 180°C(导热检测器、TCD)的工作温度).N2被用作载运气体。有关详细信息,请参阅以前的研究10。
- 监测挥发性脂肪酸(VFA)和苯基酸的浓度。对于 VFA 和苯基酸分析,请使用配备 UV 探测器(220 nm)的 HPLC 系统,该系统以 5 mM H2SO4作为移动相。有关方法的详细信息和有关样品存储的其他信息,请参阅以前的研究11。
注:VFA的分析是许多其他物理化学分析或微观评估的典范。此外,在实验的某一点,可采用所述程序,针对特定微生物的丰度和/或微生物群落的丰度进行分子生物学方法。- 用注射器和管拔去除1 mL液体。
注:样品在提取后立即冷冻(-20°C),并在实验结束时进行分析。 - 在 15,000-20,000 x g下离心,并通过 0.2 μm RC(再生纤维素)过滤器。
- 将5-20μL注射到HPLC系统中,并分析VFA成分和苯基酸浓度。
- 用注射器和管拔去除1 mL液体。
- 使用导管排空烧瓶的过压。
注:在确定压力和气体成分并采集任何必要的样品后,将培养瓶放回相应的温度,在液体达到孵育温度之前不要排出过压。 - 使用公式 1-3 计算沼气和甲烷生产 VCH4N,考虑理想的气体定律。另请参阅表4。
公式 1:
从而
公式 2: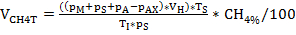
和
公式 3:
注:为了计算总沼气产量,公式2和3中的CH4%和CH4%X的量必须设置为100。NmL:标准化条件下的标准化气体体积(0°C,1 atm),其下摩尔气体体积为22.414 NmL/mmol。
结果
根据上述方案,在厌氧条件下,培养瓶填充介质,检查颜色(图1),并作为进行厌氧消化的微型批次生物反应器。这些被修改与基质可能导致苯基酸形成,并孵化使用厌氧消化池污泥作为接种(图2)。色氨酸、酪氨酸和苯丙氨酸,以及复杂的蛋白质前体肉提取物和酪蛋白分别应用于两种和三种不同的浓度。无需补充额外的基板即可制备控制。不同的基板浓度,旨在模拟不同阶段的过载。在37°C(嗜血)孵育4周。
沼气生产和组合物(H2,CH4,CO2)通过气相色谱(GC TCD)10和头部空间压力评价定期监测。图3显示了在厌氧孵育4周内,从不同浓度消化所应用基质而产生的累积甲烷产量的差异。此外,通过辐照辅酶F420(一种在介子发生中的电子载体)来可视化,它表现出一种蓝绿色荧光,吸收最大度为420nm(图4)。
与气体分析同时进行,通过HPLC11提取和冷冻的VFA和苯基酸浓度测量样品,直到进一步处理。图 5显示了不同过载阶段的影响,这反映在醋酸盐所描绘的高度过载样品中。图6描述了孵育期间醋酸苯乙烯浓度的动态。

图 1:Redox 指标。通过添加氧化还原指示器可以控制种植瓶中的正确氧化还原电位。请点击此处查看此图的较大版本。

图2:微型批次生物反应器。微型批量生物反应器在120 mL培养瓶中制备,用于厌氧消化实验。烧瓶充满介质,接种稀释的沼气池污泥。反应堆用丁基橡胶塞和铝盖密封。请点击此处查看此图的较大版本。
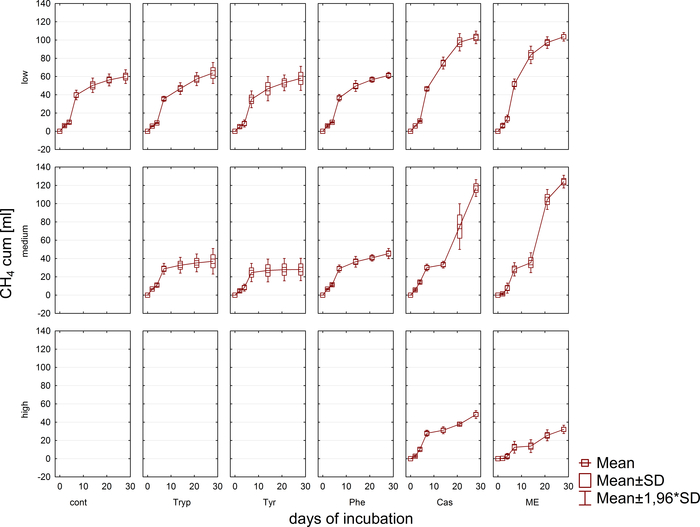
图3:甲烷生产。反应器中反应不同过载条件(低、中、高)的28天中亲培养过程中累积甲烷产量。康特:控制;胰子板:锥顶丹;蒂尔:酪氨酸;Phe: 苯丙氨酸;ME:肉提取物;卡斯:盒数。这是一个修改的数字,源自早期的研究8。请点击此处查看此图的较大版本。
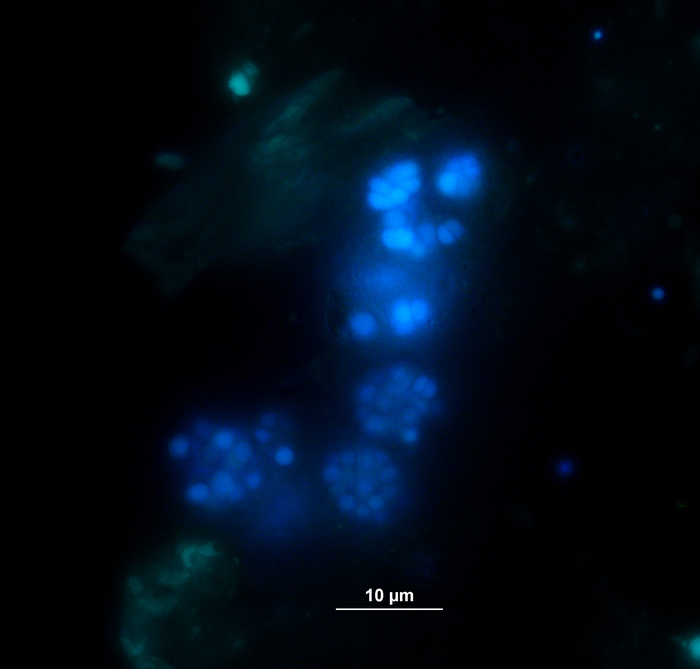
图4:氟化美他原。当受到紫外线的兴奋时,美他根会发出蓝色光。在这里,美他原附着在植物颗粒上(浅绿色)。样品取自一批反应器,稀释后进行显微镜,并立即进行分析。请点击此处查看此图的较大版本。
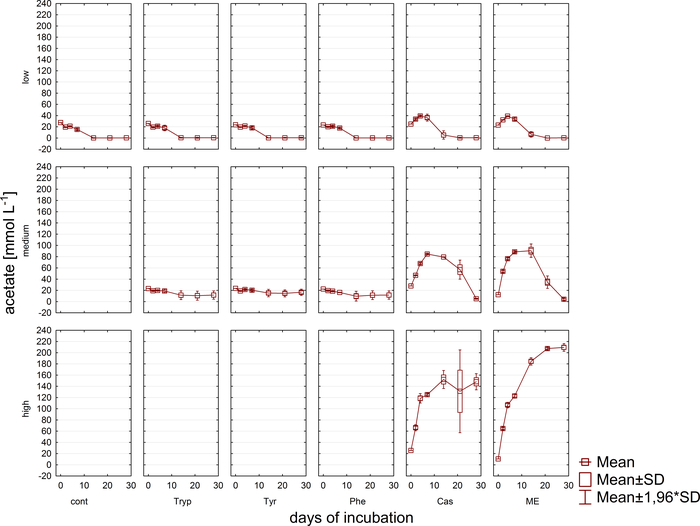
图5:醋酸浓度。乙酸在反应器中28天的嗜血孵育中浓度,反映不同的过载条件(低、中、高)。康特:控制;胰子板:锥顶丹;蒂尔:酪氨酸;Phe: 苯丙氨酸;ME:肉提取物;卡斯:盒数。这是一个修改的数字,源自早期的研究8。请点击此处查看此图的较大版本。
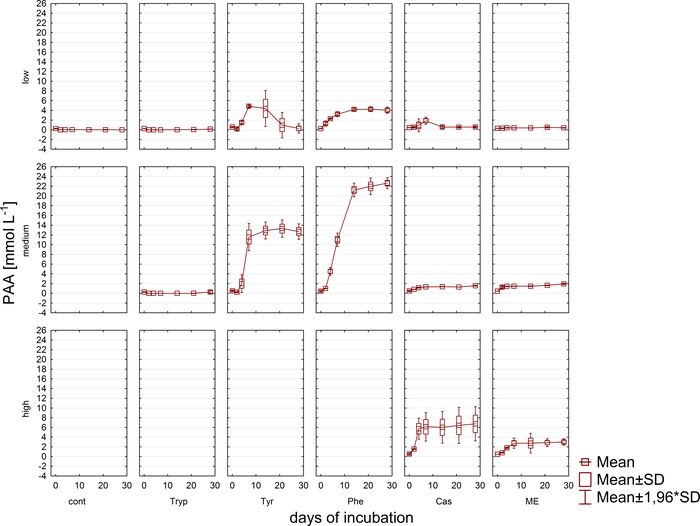
图6:苯甲酸酯浓度。苯甲酸酯浓度在反应器中28天的嗜血潜伏期,反映不同的过载条件(低、中、高)。康特:控制;胰子板:锥顶丹;蒂尔:酪氨酸;Phe: 苯丙氨酸;ME:肉提取物;卡斯:盒数。这是一个修改的数字,源自早期的研究8。请点击此处查看此图的较大版本。

图7:雷沙祖林反应。根据乌扎尔斯基等人12,蓝色resazurin经历了不可逆转的减少到再松丁(粉红色)和进一步可逆的减少对无色的二氢苏鲁丁。请点击此处查看此图的较大版本。
| 氰诺科拉明 | 0.050克 |
| 4-氨基苯甲酸 | 0.050克 |
| D-生物锡 | 0.010克 |
| 烟酸 | 0.100克 |
| 皮里多辛尼 | 0.250克 |
| D-泛酸 | 0.025克 |
| 氯化钛 HCl | 0.18克 |
| 蒸馏水 | 1000 mL |
表1:维生素溶液。
| 25% (w/v) HCl | 10.0 mL |
| FeCl2 x 4 H2O | 1.50克 |
| ZnCl2 | 0.070克 |
| MnCl2 x 4 H2O | 0.100克 |
| H3BO3 | 0.006克 |
| CoCl2 x 6 H2O | 0.190克 |
| CuCl2 x 2 H2O | 0.002克 |
| NiCl2 x 6 H2O | 0.024克 |
| 纳2MoO4 x 2 H2O | 0.036克 |
| 蒸馏水 | 990.0 mL |
| 准备建议 | 加入HCl并溶解FeCl2,加入100mL蒸馏水,溶解其他成分,并制成1000mL。 |
表 2:跟踪元素解决方案。
| Nacl | 1.0 克 |
| MgCl2 x 6 H2O | 0.4 克 |
| KH2PO4 | 0.2 克 |
| 氯化钾 | 0.5 克 |
| CaCl2 x 2 H2O | 0.15克 |
| L-半胱氨酸 | 0.5 克 |
| 酵母提取物 | 1.0 克 |
| 雷萨祖林溶液 | 1 mL |
| 维生素溶液 | 1 mL |
| 跟踪元素解决方案 | 1 mL |
| 蒸馏水 | 1000 mL |
| Ph | 7.2 |
表3:最小盐基。
| 变量 | 单位 | 描述 |
| tY | [d] | 测量时间点 |
| tX | [d] | 前一个测量的时间点 |
| pM | [mbar] | 在 tY处测量过压 |
| pA | [mbar] | tY处的环境压力 |
| pAX | [mbar] | tX处的环境压力 |
| pS | [mbar] | 标准压力,1013,25 mbar 符合 DIN 1343 |
| TI | [K] | 孵化温度 |
| TS S | [K] | 标准温度, 273,15 K (对应于 0°C) 符合 DIN 1343 |
| VH | [毫升] | tY处的头空间音量 |
| VHX | [毫升] | tX处的头空间卷 |
| CH4% | [vol%] | 根据 tY处 GC 测量的甲烷浓度 |
| CH4%X | [vol%] | 根据 tX处 GC 测量的甲烷浓度 |
| VCH4T | [Nml] | 血清瓶中总甲烷量在 tY |
| VCH4R | [Nml] | tX时头部空间中的残余甲烷量 |
| VCH4N | [Nml] | 从 tX到 tY的新产生的甲烷 |
表 4:公式 1 - 3 中变量的描述。
讨论
培养厌氧微生物的最重要和最关键的步骤是确保培养介质和瓶头空间的无氧条件。像resazurin这样的指示器可用于间接检查烧瓶的正确厌氧填充。Resazurin是一种常用的氧化还原染料,因为它价格低廉,无毒,在低剂量和短孵育时间12中已经有效。当被纳入介质时,蓝色resazurin首先经历一个不可逆转的还原步骤,以resorufin,这是粉红色的中性pH值。当介质被加热13时,可能会出现这种第一反应。随后,在可逆的二次反应中,雷苏鲁丁被降为无色二氢反苏鲁丁(图7)12。在约Eh = -110 mV的标准氧化还原电位下,再红二越林/二氢再红还原剂系统变得完全无色,在-51 mV 13的氧化电位上变成粉红色。
为了进一步降低氧化还原电位,例如,为了促进已知需要低于-200 mV14的甲烷微生物的生长,可以添加Na2S溶液。或者,通常使用半胱氨酸-HCl、硫化钠或二硫磷酸钠。但是,哪种还原剂适合使用取决于相应的实验设置,可能需要特别注意。例如,硫化钠需要温度激活(例如,通过高压灭菌)。
一个平衡平衡的微生物联合体,由各种细菌和古生物属组成,一个高效工作的厌氧降解级联可以通过通过气体确定培养瓶中的头空间气体组成来进一步评估相 色 谱 法。当处理从不同前体衍生的苯基酸等化合物时,头部空间的评估是检查甲氧生成过程的快速方法8。在潜伏期结束时,在控制中,头空间CH4浓度约为50-60%,表明在厌氧条件下成功利用了应用的营养物质,从而实现了有机物质的矿化。在消化过程中,理论上的甲烷产量和可预期甲烷浓度可以在对基材进行初步分析或估算基板含量后,根据Buswell-Boyle方程确定。基质中的碳水化合物、蛋白质和脂肪。根据VDI 4630 15,碳水化合物可以导致理论上沼气生产750 Lkg-1 VSS(50%CH4和50%CO2),蛋白质到800 L kg-1 VSS(72% CH4和 28 % CO2),脂肪达到 1,390 L kg-1VSS (60% CH4和 40% CO2)
此外,还监测了VFA和苯基酸的形成和随后可能的降解。通过分析不同时间点的VFA浓度(例如醋酸盐、丙酸酯),可以评估降解过程。醋酸和/或丙酸等短链脂肪酸的积累可能指向甲氧乙酯群落成分的干扰和反应堆的整体过载。然而,一个平衡的微生物降解级联甚至可以应付非常高的VFA和醋酸浓度9。此外,醋酸酯/丙酸比可能进一步提供有关整个反应器条件16的信息。然而,有许多参数适合过程监测,必须根据拟议的实验假设来选择。在本示例中,目标变量为苯基酸浓度(图6)。
披露声明
作者没有什么可透露的。
致谢
这项研究由奥地利科学基金(FWF)资助:项目编号P29360和P29143。出版工作得到了因斯布鲁克大学人民出版社的支持。我们非常重视EIG。
材料
| Name | Company | Catalog Number | Comments |
| culture flasks (120 mL, N20) | Ochs, Germany | 102046 | |
| buty rubber septa (N20) | Ochs, Germany | 102049 | |
| aluminium caps (N20) | Ochs, Germany | 102050 | |
| N2 gas | Messer, Austria | purity 5.0 | |
| syringes + cannulae | various | ||
| crimper | Ochs, Germany | 102051 | |
| de-crimper | Ochs, Germany | 102052 | |
| GC2010 | Shimadzu | ||
| Shin-carbon GC column | Restek | chromatographic separation of H2, O2, CH4, and CO2 | |
| HPLC Prominence | Shimadzu | ||
| Fast Fruit HPLC Column | Phenomenex | chromatographic separation of VFAs, phenyl acids, etc. |
参考文献
- Wiebe, W. J., Pomeroy, L. R., Wiegert, R. G., et al. Anaerobic Respiration and Fermentation. The Ecology of a Salt Marsh. , 137-159 (1981).
- Kim, B. H., Gadd, G. M., Kim, B. H., Gadd, G. M. Anaerobic fermentation. Bacterial physiology and metabolism. , 252-297 (2008).
- Stolz, J. F., Oremland, R. S. Bacterial respiration of arsenic and selenium). FEMS Microbiology Reviews. 23 (5), 615-627 (1999).
- Lackner, N., Hintersonnleitner, A., Wagner, A. O., Illmer, P. Hydrogenotrophic Methanogenesis and Autotrophic Growth of Methanosarcina thermophila. Archaea. 2018 (5), 1-7 (2018).
- Mutschlechner, M., Praeg, N., Illmer, P. The ecological importance of grazing to methane fluxes and engaged microbial communities in alpine forest soils. FEMS Microbiology Ecology. , (2018).
- Prem, E. M., Reitschuler, C., Illmer, P. Livestock grazing on alpine soils causes changes in abiotic and biotic soil properties and thus in abundance and activity of microorganisms engaged in the methane cycle. European Journal of Soil Biology. 62, 22-29 (2014).
- Praeg, N., Wagner, A. O., Illmer, P. Effects of fertilisation, temperature and water content on microbial properties and methane production and methane oxidation in subalpine soils. European Journal of Soil Biology. 65, 96-106 (2014).
- Wagner, A. O., Prem, E. M., Markt, R., Kaufmann, R., Illmer, P. Formation of phenylacetic acid and phenylpropionic acid under different overload conditions during mesophilic and thermophilic anaerobic digestion. Biotechnology for Biofuels. 12 (1), 359 (2019).
- Lins, P., Malin, C., Wagner, A. O., Illmer, P. Reduction of accumulated volatile fatty acids by an acetate-degrading enrichment culture. FEMS Microbiology Ecology. 71 (3), 469-478 (2010).
- Wagner, A. O., Hohlbrugger, P., Lins, P., Illmer, P. Effects of different nitrogen sources on the biogas production - a lab-scale investigation. Microbiological research. 167 (10), 630-636 (2012).
- Wagner, A. O., et al. Sample preparation, preservation, and storage for volatile fatty acid quantification in biogas plants. Engineering in Life Sciences. 17 (2), 132-139 (2017).
- Uzarski, J. S., DiVito, M. D., Wertheim, J. A., Miller, W. M. Essential design considerations for the resazurin reduction assay to noninvasively quantify cell expansion within perfused extracellular matrix scaffolds. Biomaterials. 129, 163-175 (2017).
- Costilow, R. N., Breznak, J. A., Marzluf, G. A., et al. Physicochemical Factors in Growth. Methods for General and Molecular Microbiology. , 309-329 (2007).
- Le Mer, J., Roger, P. Production, oxidation, emission and consumption of methane by soils: a review. European Journal of Soil Biology. 37 (1), 25-50 (2001).
- . Verein deutscher Ingenieure VDI 4630: Fermentation of organic material. VDI Richtlinien. , (2006).
- Wagner, A. O., Reitschuler, C., Illmer, P. Effect of different acetate: Propionate ratios on the methanogenic community during thermophilic anaerobic digestion in batch experiments. Biochemical Engineering Journal. 90, 154-161 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。