Method Article
Mittlere Vorbereitung für den Anbau von Mikroorganismen unter streng anaeroben/anoxischen Bedingungen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Da verpflichtende anaerobe Organismen bei Sauerstoffexposition nicht wachsen können, ist der Einsatz anaerobe Kultivierungstechniken unerlässlich. Hier zeigen wir eine einfache und effektive Methode zur Kultivierung einer Mischkultur aus einer Biogasanlage von der Medienaufbereitung bis zur Gas- und Fettsäurequantifizierung.
Zusammenfassung
Im Gegensatz zu aeroben Organismen erfordern streng anaerobe Mikroorganismen das Fehlen von Sauerstoff und in der Regel ein geringes Redoxpotenzial, um Wachstum zu initiieren. Da Sauerstoff in der Luft allgegenwärtigist, ist die Beibehaltung der O2-freien Bedingungen bei allen Kultivierungsschritten eine Herausforderung, aber eine Voraussetzung für die anaerobe Kultivierung. Das hier vorgestellte Protokoll zeigt den erfolgreichen Anbau einer anaeroben Mischkultur aus einer Biogasanlage mit einer einfachen und kostengünstigen Methode. Eine genaue Beschreibung des gesamten anoxischen Kultivierungsprozesses wird gegeben, einschließlich Der Medienvorbereitung, Deminfüllung von Kultivierungskolben, Supplementierung mit Redox-Indikator und Reduktionsmitteln, um niedrige Redoxpotentiale zu bieten sowie den Kopfraum auszutauschen, um sauerstofffrei. Darüber hinaus wird ein detaillierter Überblick über aseptisch impfende gasdichte Serumkolben (mit sterilen Spritzen und Nadeln) und geeignete Inkubationsbedingungen gegeben. Das vorliegende Protokoll befasst sich ferner mit Gas- und Flüssigkeitsproben für nachfolgende Analysen zur Gaszusammensetzung und flüchtigen Fettsäurekonzentrationen mittels Gaschromatographie (GC) bzw. Hochleistungsflüssigkeitschromatographie (HPLC) bzw. Berechnung der Biogas- und Methanausbeute unter Berücksichtigung des idealen Gasgesetzes.
Einleitung
Auf der Erde ist molekularer Sauerstoff in bemerkenswerten Konzentrationen in Bereichen mit direktem Kontakt mit der Atmosphäre oder in Gegenwart von sauerstoffhaltigen Phototrophen verfügbar. Umgebungen, in denen Sauerstoff fehlt, werden anaerobe genannt. Die Energieumwandlung ist jedoch unter anaeroben Bedingungen über zwei verschiedeneStoffwechselprozesse, Fermentation und anaerobe Atmung 1, weiterhin möglich.
Während Organismen, die sich einer aeroben Atmung unterziehen, Sauerstoff als Terminalelektronenakzeptor verwenden, erfordert die anaerobe Atmung alternative Elektronenakzeptoren wie Nitrat oder Sulfat2. Im sogenannten "Elektronenturm" sind Redoxpaare nach ihrem Redoxpotential organisiert, wobei sich die negativsten an der Spitze (Elektronenspender) und die stärksten Oxidationsmittel mit positivem Redoxpotenzial am Boden (Elektronenakzeptoren) befinden. Der Elektronentransfer zwischen Spendern und Akzeptoren führt über die sogenannte Atemkette zur Energieeinsparung und Elektronen können von Elektronenakzeptoren - um im Bild zu bleiben - in verschiedenen Stockwerken des Turms eingefangen werden. Je höher der Fall der Elektronen durch den Elektronenturm, desto mehr Energie kann durch die jeweilige Reaktion konserviert werden. Daher ist die Atmung auch in anaeroben Lebensräumen möglich, z.B. mit Redoxpaaren wie NO3-/NO2-, Fumarsäure/Bernsteinsäure, SO32-/H2S, S°/H2S, Mn(IV)/Mn(II ), Fe(III)/Fe(II)2,3. Zunächst wird die resultierende Energie als Membranpotential konserviert, das anschließend durch Elektronentransportphosphorylierung zur Adenosin-Triphosphat-Synthese (ATP) durch membrangebundene ATP-Synthasen genutzt wird. Im Gegensatz zur aeroben Atmung kann die Energiemenge, die durch anaerobe Atmung konserviert werden kann, drastisch reduziert werden; jedoch ist die Energieleistung der meisten anaeroben Reapirationen noch höher als bei der Fermentation, einem anaeroben Energiesparpfad in Lebensräumen ohne Sauerstoff und anderen Terminalelektronenakzeptoren2.
Während der Fermentation werden energiereiche, organische Substrate zu verschiedenen Fermentationsprodukten abgebaut, die oft den Namen des Gesamtprozesses definieren, z. B. die alkoholische Fermentation. Im Gegensatz zu Atmungsprozessen beschränkt sich die ATP-Erzeugung während der Fermentation auf die Phosphorylierung auf Substratebene, bei der eine Phosphatgruppe von einem energiereichen phosphorylierten Substrat2auf Adenosin-Di-Phosphat (ADP) übertragen wird. Fermentierende Mikroorganismen spielen eine zentrale Rolle beim anaeroben Abbau organischer Stoffe, da sie Schlüsselfaktoren beim Substratabbau sind. Die primären Fermentationsprodukte, wie organischeSäuren, Alkohole, CO2 und H2, können anschließend von sekundären Fermentmikroorganismen zur Herstellung von Essigsäure, CO2 und H2 verwendet werden. Beispiele für Fermentationsprodukte sind Milchsäure, verschiedene flüchtige Fettsäuren (Formic-, Essig-, Propion-, Butyric-, Baldriansäure), n-Butanol, 2,3-Butandiol, Aceton und Ethanol.
Die Kultivierung von Mikroorganismen unter streng anaeroben Bedingungen erfordert völlig andere Methoden und Ausrüstungen als die Kultivierung von aeroben Organismen. Während sauerstofftolerante Organismen oft auf Agargerichten, sogenannten Oberflächenkulturen, kultiviert werden, ist dies - bis auf wenige Ausnahmen - für streng anaerobe Mikroorganismen kaum möglich. Daher werden Anreicherungskulturen streng anaeroben Mikroorganismen hauptsächlich in flüssigen Medien hergestellt, die Kulturgefäße auftragen, die mit gasdichten Septen versiegelt sind, die eine sauerstofffreieKopfraumatmosphäre4,6, 7.
Die aktuelle Protokollbeschreibung wird geeignete Anbaumethoden für Zielmikroorganismen einer gemischten Population aus einer anaeroben Biogasanlage enthalten. Die Isolation und Kultivierung reiner Kulturen ist noch schwieriger, aber nicht Teil dieser Arbeit.
Hier zeigen wir das Verfahren zur Kultivierung einer anaeroben mikrobiellen Gemeinschaft auf der Grundlage einer Studie über die Bildung von Phenylsäuren während der anaeroben Verdauung von proteinhaltigen Substraten8. Die mikrobielle Gemeinschaft bestand aus Mitgliedern aus allen vier Phasen der anaeroben Verdauung: Hydrolyse, Säuerung, Acetogenese und Methanogenese. Ein Mineralsalzmedium, ergänzt durch eine Kohlenstoffquelle, Redox-Indikator, Vitamin- und Spurenelementlösung, und Reduktionsmittel wurdeangewendet 9. Das Medium wurde mit den jeweiligen proteinhaltigen Phenylsäurevorläufersubstraten8geändert.
Protokoll
1. Vorbereitung des Mediums
- Bereiten Sie Redox-Indikator-Lagerlösung (0,1 g Resazurin/100 ml wässrige Lösung).
- Bereiten Sie Vitaminlösung (Tabelle 1).
- Vorbereiten der Ablaufverfolgungselementlösung (Tabelle 2).
HINWEIS: Die Reihenfolge der Ergänzung ist wichtig; siehe Tabelle 2 und entsprechende Protokolle. - Vorbereiten sie eine Reduktionslösung für Agenten (60 g Na2S/L wässrige Lösung).
- Wiegen Sie mittlere Inhaltsstoffe (Mineralsalzmedium, Tabelle 3) in einem geeigneten Kolben (z. B. 1 L Schraubverschluss-Laborkolben).
HINWEIS: Je nach Versuchsaufbau kann die Zugabe einer separaten Kohlenstoffquelle erforderlich sein. - Das halbe Volumen des destillierten Wassers (Tabelle 3) hinzufügen und die Zutaten auflösen.
- Fügen Sie 1 ml Redox-Indikatorlösung gemäß Tabelle 3hinzu.
- Vitamin- und Spurenelementlösung nach Tabelle 3hinzufügen.
- Stellen Sie den pH-Wert entsprechend den Anforderungen des Mediums/Organismus in Tabelle 3ein.
HINWEIS: Die Farbe des Redox-Indikators ist pH-abhängig und kann einige Zeit benötigen, um sich anzupassen. - Auf ein Endvolumen von 1 L mit destilliertem Wasser bringen.
HINWEIS: Vitamin- und Spurenelementlösungen können auch nach dem Autoklavieren hinzugefügt werden, indem ein filtersterilisierter Aliquot (verdünnte Lösungen, Filterporengröße < 0,2 m) in zuvor geschlossene und autoklavierte Serumkolben aufgenommen wird. Dieser Ansatz birgt jedoch ein erhöhtes Kontaminationsrisiko.
2. Füllung von Anbaukolben
- 120 ml Serumkolben gründlich reinigen und trocknen.
HINWEIS: Serumkolben sind in verschiedenen Volumenkapazitäten (z. B. 20, 60, 120, 250 ml) erhältlich. - Gründlich sauber und trocken Butylkautschuk septa.
- Wiegen Sie zusätzliche mittlere Komponenten (z.B. Phenylsäure-Vorläufersubstrate) in den Anbaukolben.
HINWEIS: Zusätzliche Komponenten hängen von Versuchsaufbau und Hypothese ab. - Füllen Sie die Serumkolben mit 50 ml Medium.
3. Reduktion/Entfernung von Sauerstoff in der flüssigen Phase
- Bereiten Sie ein Wasserbad im Wasserbad von 100 °C vor.
- Gefüllte Serumkolben im Wasserbad einstellen und ca. 20-30 min brüten, um die Löslichkeit von O2 in der flüssigen Phase zu reduzieren.
- Spülen Sie den Kopfraum sofort mit N2-Gas oder alternativ mit anderen Gas- oder Gasgemischewie N2 /CO2 .
VORSICHT: Achten Sie auf eine angemessene Raumlüftung. - Schließen Sie die Kolben mit Butylgummi-Septa und fixieren Sie mit Aluminiumkappen.
HINWEIS: Gummisepta könnte oft besser auf den Hals des Kolbens passen, indem ein Tropfen Wasser/Medium hinzugefügt wird, während sie hineinbohren. - Fügen Sie 0,1 ml Reduktionsmittel (Lagerlösung) zu jedem Kolben hinzu, der mit 50 ml Medium gefüllt ist, um das Redoxpotential weiter zu reduzieren (0,1 ml Reduktionsmittel pro 50 ml Medium).
- Autoklav für 20 min bei 121 °C.
VORSICHT: Es muss ein Autoklav verwendet werden, der für die Sterilisation geschlossener Gefäße zertifiziert ist. Andernfalls kann ein Durchdruck, der durch temperaturauflösende Temperaturerhöhungen entsteht, dazu führen, dass Serumkolben explodieren.
4. Impfung des Mediums
- Bereiten Sie Inoculum aus anaerobem Fermenter vor.
- 400 ml destilliertes Wasser in einen Kolben geben und zum Kochen bringen.
- Abkühlen (< 30 °C) beim dauerhaften Spülen des Kopfraums mit N2.
- Ca. 100 g Schlamm aus einem anaeroben Fermenter hinzufügen.
HINWEIS: Vermeiden Sie übermäßigen Kontakt von Schlamm mit Sauerstoff. - Erfassen Sie die genaue Masse des zugesetzten Schlamms für die genaue Bestimmung der Verdünnung.
- Tauschen Sie den Kopfraum des Kolbens mit N2 aus und schließen Sie ihn mit einem Butylgummiseptum.
- Schütteln Sie den Kolben für 30 min bei 120 U/min.
- Entfernen Sie 5 ml Inokulum mit Spritze + Kanüle und injizieren Sie es in vorbereitete Serumkolben, wie in Schritt 1-3 beschrieben.
5. Inkubation, Probenahme und Analyse
- Inkubieren Sie geimpfte Serumkolben bei einer Für das jeweilige Experiment geeigneten Temperatur.
HINWEIS: Die Inkubationstemperatur ist abhängig vom Versuchsaufbau und dem verwendeten Inokulum.- Überdruck, der durch den Temperaturanstieg entsteht, mit Spritze + Kanüle abtropfen lassen, wenn die Flüssigkeit in den Serumkolben auf Inkubationstemperatur (ca. 15 – 30 min, abhängig von der Inkubationstemperatur) ausgeglichen wurde.
VORSICHT: Je nach aufgebrachtem Substrat können Konzentration, Temperatur, Inkubationszeit, Inokulumtyp und Konzentration, Überdruck in Kolben um bis zu > 2 bar Druck steigen und Serumflaks explodieren lassen. Die Überwachung des Überdrucks mittels manometer und anschließendes Ablassen von Überdruck mit einer Kanüle ist daher zwingend erforderlich.
- Überdruck, der durch den Temperaturanstieg entsteht, mit Spritze + Kanüle abtropfen lassen, wenn die Flüssigkeit in den Serumkolben auf Inkubationstemperatur (ca. 15 – 30 min, abhängig von der Inkubationstemperatur) ausgeglichen wurde.
- Bewerten Sie die Biogasproduktion und -zusammensetzung während der Inkubationszeit.
HINWEIS: Die Inkubationszeit kann einige Tage bis mehrere Wochen dauern.- Zeichnen Sie den aktuellen Atmosphärischen Druck auf.
- Bereiten Sie ein Manometer vor und bewerten Sie den Druck innerhalb der Kolben, der aus der mikrobiellen Aktivität abgeleitet wird.
- Schütteln Sie die Kolben.
- Entfernen Sie 1 ml Kopfraumgas mit einer Spritze +Kanüle, und messen Sie die Konzentrationen H2 , O2 , CH4und/oder CO2 mittels Gaschromatographie.
ANMERKUNG: Für die Qualifizierung und Quantifizierung von H2, O2 , CH4und CO 2 wurde ein Gaschromatograph verwendet, der Betriebstemperaturen von 160 °C (Säulenofen), 100 °C (Injektor) und 180 °C (Wärmeleitfähigkeitsdetektor, TCD) anwendete. ). N2 wurde als Trägergas verwendet. Weitere Informationen finden Sie in früheren Studien10.
- Überwachen Sie die Konzentrationen von flüchtigen Fettsäuren (VFA) und Phenylsäuren. Für die VFA- und Phenylsäureanalyse verwenden Sie ein HPLC-System mit einem UV-Detektor (bei 220 nm) mit 5 mM H2SO4 als mobile Phase. Einzelheiten zur Methode und zusätzliche Informationen zur Probenlagerung finden Sie in früheren Studien11.
HINWEIS: Die Analyse von VFA ist beispielhaft für viele andere physikalisch-chemische Analysen oder mikroskopische Auswertungen. Darüber hinaus können molekularbiologische Methoden, die auf die Fülle spezifischer Mikroorganismen und/oder die Zusammensetzung der mikrobiellen Gemeinschaft an einem bestimmten Punkt des Experiments abzielen, mit dem beschriebenen Verfahren angewendet werden.- 1 ml Flüssigkeit mit Spritze + Kanüle entfernen.
HINWEIS: Proben können unmittelbar nach dem Entzug eingefroren (-20 °C) eingefroren und am Ende des Experiments analysiert werden11. - Zentrifuge bei 15.000–20.000 x g und durch0,2 m RC-Filter (regenerierte Zellulose).
- Injizieren Sie 5-20 l in ein HPLC-System und analysieren Sie die VFA-Zusammensetzung und -Konzentration von Phenylsäuren.
- 1 ml Flüssigkeit mit Spritze + Kanüle entfernen.
- Den Überdruck des Kolbens mit einer Kanüle abtropfen lassen.
HINWEIS: Nach der Bestimmung der Druck- und Gaszusammensetzung sowie der Entnahme der erforderlichen Probe stellen Sie den Kultivierungskolben wieder auf die jeweilige Temperatur und leiten Sie keinen Überdruck ab, bevor die Flüssigkeit die Inkubationstemperatur erreicht hat. - Berechnen Sie biogas- und Methanproduktion VCH4N unter Berücksichtigung des idealen Gasgesetzes unter Verwendung der Gleichung 1-3. Siehe auch Tabelle 4.
Gleichung 1:
Wobei
Gleichung 2: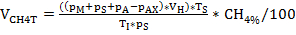
und
Gleichung 3:
ANMERKUNG: Für die Berechnung der gesamten Biogasproduktion muss die Menge von CH4% und CH4%X in Gleichung 2 und 3 auf 100 gesetzt werden. NmL: normalisiertes Gasvolumen unter standardisierten Bedingungen (0 °C, 1 atm), bei dem das Molgasvolumen 22.414 NmL/mmol beträgt.
Ergebnisse
Anbaukolben wurden gemäß dem oben beschriebenen Protokoll mit Medium unter anaeroben Bedingungen gefüllt, auf die entsprechende Farbe überprüft (Abbildung 1) und als Miniatur-Chargenbioreaktoren verwendet, die anaerobe Verdauung durchführen. Diese wurden mit Substraten geändert, die möglicherweise phenylsäurebildung verursachen, und mit anaerobem Fermenterschlamm als Inokulum inkubiert (Abbildung 2). Tryptophan, Tyrosin und Phenylalanin sowie der komplexe proteinhaltige Vorläuferfleischextrakt und Kasein wurden in zwei bzw. drei verschiedenen Konzentrationen angewendet. Die Steuerung enpariert wurde ohne zusätzliche Substratergänzung. Unterschiedliche Substratkonzentrationen zur Simulation verschiedener Überlaststufen. Flaschen wurden 4 Wochen lang bei 37 °C (mesophil) inkubiert.
Die Biogaserzeugung und -zusammensetzung (H2, CH4, CO2) wurde regelmäßig mittels Gaschromatographie (GC TCD)10 und Auswertung des Kopfraumdrucks überwacht. Abbildung 3 zeigt Unterschiede in der kumulativen Methanproduktion, die aus der Verdauung der aufgebrachten Substrate in unterschiedlichen Konzentrationen während 4 Wochen anaeroben Inkubation gewonnen wird. Außerdem wurden Methanogene durch Bestrahlung des Coenzyms F420, eines Elektronenträgers in der Methanogenese, visualisiert, der eine blaugrüne Fluoreszenz mit einem Absorptionsmaximum von 420 nm aufweist (Abbildung 4).
Gleichzeitig mit der Gasanalyse wurden Proben für VFA- und Phenylsäurekonzentrationsmessungen über HPLC11 entnommen und bis zur Weiterverarbeitung eingefroren gelagert. Abbildung 5 zeigt die Wirkung verschiedener Überlaststufen, die durch eine Anhäufung in stark überlasteten Proben, die exemplarisch für Acetat dargestellt werden, reflektiert werden. Abbildung 6 zeigt die Dynamik der Phenylacetatkonzentrationen während der Inkubationszeit.

Abbildung 1: Redox-Indikator. Das richtige Redoxpotenzial in den Kultivierungskolben kann durch Hinzufügen eines Redox-Indikators gesteuert werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Miniatur-Batch-Bioreaktoren. Miniatur-Chargen-Bioreaktoren, die in 120 ml Anbaukolben für anaerobe Verdauungsexperimente hergestellt werden. Die Flaschen wurden mit Medium gefüllt und mit verdünntem Faulschlamm geimpft. Die Reaktoren waren gasdicht mit Butylgummistopfen und Aluminiumkappen versiegelt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
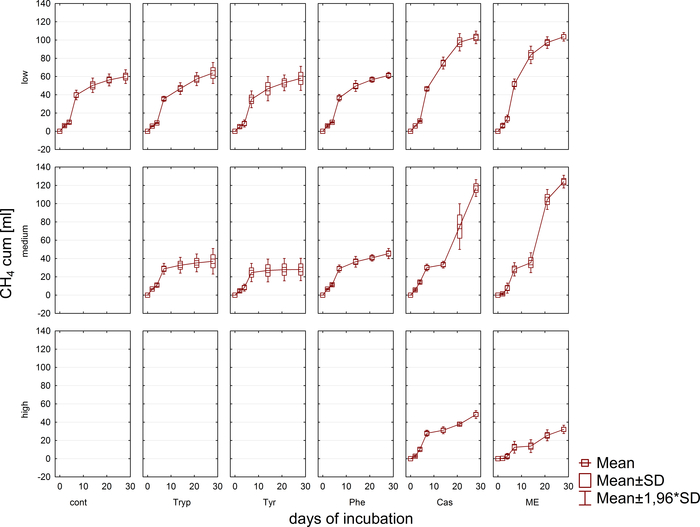
Abbildung 3: Methanproduktion. Kumulierte Methanproduktion während 28 Tagen mesophiler Inkubation aus Reaktoren, die unterschiedliche Überlastbedingungen (niedrig, mittel, hoch) widerspiegeln. Cont: Kontrolle; Tryp: Tryptophan; Tyr: Tyrosin; Phe: Phenylalanin; ME: Fleischextrakt; Cas: Kasein. Dies ist eine modifizierte Zahl, die aus einer früheren Studiestammt 8. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
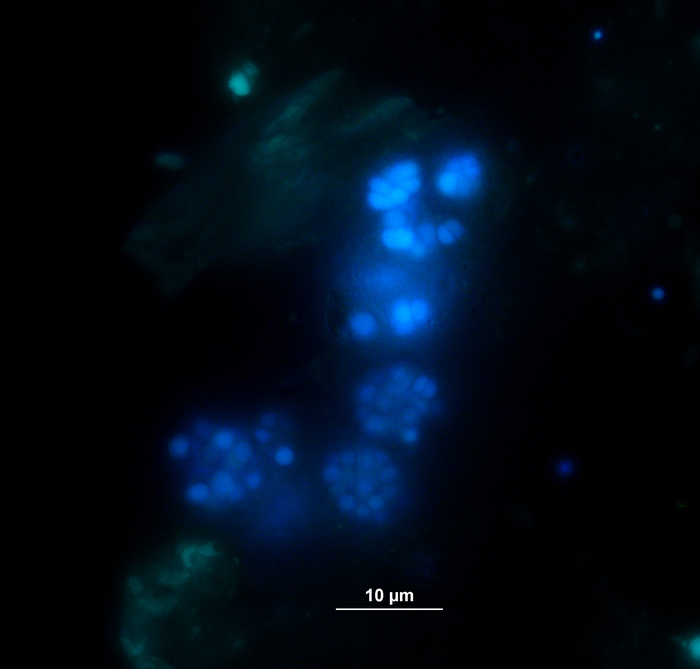
Abbildung 4: Fluoreszierende Methanogene. Methanogene strahlen ein blauliches Licht aus, wenn sie mit UV-Licht angeregt werden. Hier werden Methanogene an Pflanzenpartikeln (hellgrün) befestigt. Die Proben wurden aus einem Batch-Reaktor entnommen, für die Mikroskopie verdünnt und sofort analysiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
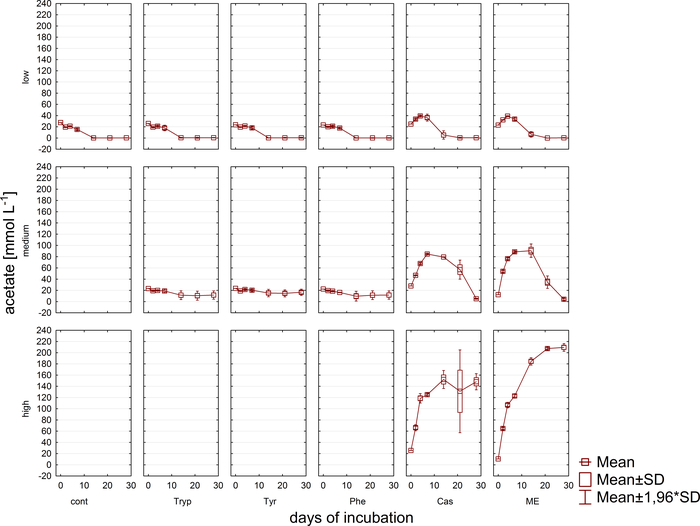
Abbildung 5: Acetatkonzentration. Acetatkonzentration während 28 Tagen mesophiler Inkubation in Reaktoren, die unterschiedliche Überlastungsbedingungen (niedrig, mittel, hoch) widerspiegeln. Cont: Kontrolle; Tryp: Tryptophan; Tyr: Tyrosin; Phe: Phenylalanin; ME: Fleischextrakt; Cas: Kasein. Dies ist eine modifizierte Zahl, die aus einer früheren Studiestammt 8. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
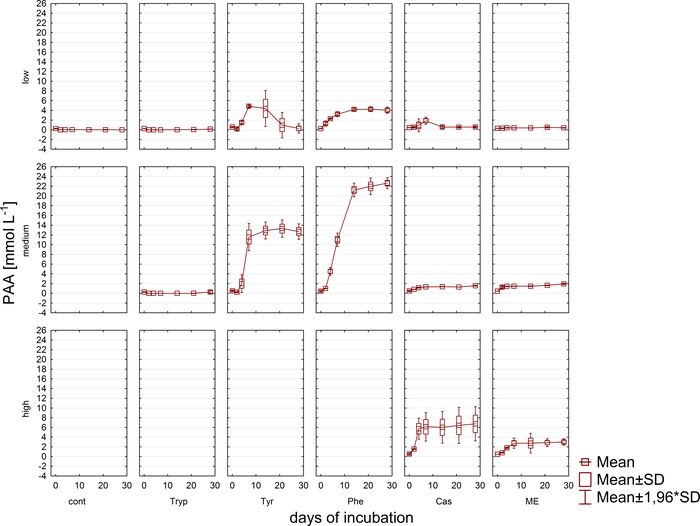
Abbildung 6: Phenylacetatkonzentration. Phenylacetat-Konzentration während 28 Tagen mesophiler Inkubation in Reaktoren, die unterschiedliche Überlastungsbedingungen (niedrig, mittel, hoch) widerspiegeln. Cont: Kontrolle; Tryp: Tryptophan; Tyr: Tyrosin; Phe: Phenylalanin; ME: Fleischextrakt; Cas: Kasein. Dies ist eine modifizierte Zahl, die aus einer früheren Studiestammt 8. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Resazurin-Reaktion. Blau gefärbtes Resazurin erfährt eine irreversible Reduktion auf Resorufin (rosa) und eine weitere reversible Reduktion auf das farblose Dihydroresorufin nach Uzarski et al.12. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Cyanocobalamin | 0,050 g |
| 4-Aminobenzoesäure | 0,050 g |
| D-Biotin | 0,010 g |
| Nikotinsäure | 0,100 g |
| Pyridoxin | 0,250 g |
| D-Pantothensäure | 0,025 g |
| Thiaminiumchlorid HCl | 0,18 g |
| Destilliertes Wasser | 1000 ml |
Tabelle 1: Vitaminlösung.
| 25% (w/v) HCl | 10,0 ml |
| FeCl2 x 4 H2O | 1,50 g |
| ZnCl2 | 0,070 g |
| MnCl2 x 4 H2O | 0,100 g |
| H3BO3 | 0,006 g |
| CoCl2 x 6 H2O | 0,190 g |
| CuCl2 x 2 H2O | 0,002 g |
| NiCl2 x 6 H2O | 0,024 g |
| Na2MoO4 x 2 H2O | 0,036 g |
| Destilliertes Wasser | 990,0 mL |
| Vorbereitungsempfehlung | HCl hinzufügen und FeCl2auflösen, 100 ml destilliertes Wasser hinzufügen, die anderen Inhaltsstoffe auflösen und bis zu 1000 ml aufbereiten. |
Tabelle 2: Trace-Elementlösung.
| Nacl | 1,0 g |
| MgCl2 x 6 H2O | 0,4 g |
| KH2PO4 | 0,2 g |
| Kcl | 0,5 g |
| CaCl2 x 2 H2O | 0,15 g |
| L-Cystein | 0,5 g |
| Hefe-Extrakt | 1,0 g |
| Resazurin-Lösung | 1 ml |
| Vitaminlösung | 1 ml |
| Trace-Element-Lösung | 1 ml |
| Destilliertes Wasser | 1000 ml |
| Ph | 7.2 |
Tabelle 3: Minimales Salzmedium.
| veränderlich | einheit | beschreibung |
| tY | [d] | Zeitpunkt der Messung |
| tX | [d] | Zeitpunkt der vorhergehenden Messung |
| pM | [mbar] | Gemessener Überdruck bei tY |
| pA | [mbar] | Umgebungsdruck bei tY |
| pAX | [mbar] | Umgebungsdruck bei tX |
| pS | [mbar] | Standarddruck, 1013,25 mbar nach DIN 1343 |
| TI | [K] | Inkubationstemperatur |
| TS | [K] | Standardtemperatur, 273,15 K (entspricht 0° C) nach DIN 1343 |
| VH | [ml] | Headspace-Volumen bei tY |
| VHX | [ml] | Headspace-Volumen bei tX |
| CH4% | [vol%] | Methankonzentration nach GC-Messung bei tY |
| CH4%X | [vol%] | Methankonzentration nach GC-Messung bei tX |
| VCH4T | [Nml] | Gesamtmethanmenge in der Serumflasche bei tY |
| VCH4R | [Nml] | Restmethanmenge im Kopfraum bei tX |
| VCH4N | [Nml] | Neu produziertes Methan von tX bis tY |
Tabelle 4: Beschreibung der Variablen in Gleichung 1 - 3.
Diskussion
Der wichtigste und wichtigste Schritt bei der Kultivierung anaeroben Mikroorganismen ist die Gewährleistung sauerstofffreier Bedingungen in Kultivierungsmedien und im Kopfraum von Kolben. Ein Indikator wie Resazurin kann verwendet werden, um indirekt die korrekte anaerobe Füllung der Kolben zu überprüfen. Resazurin ist ein häufig verwendeter Redoxfarbstoff, da er kostengünstig, ungiftig und bereits in niedrigen Dosen und kurzen Inkubationszeiten 12wirksam ist. Bei Der Verwendung in die Medien erfährt das blau gefärbte Resazurin zunächst einen irreversiblen Reduktionsschritt zum Resorufin, das bei neutralen pH-Werten rosa ist. Diese erste Reaktion kann auftreten, wenn die Medien erhitzt werden 13. Anschließend wird Resorufin in einer reversiblen Sekundärreaktion auf farbloses Dihydroresorufin reduziert (Abbildung 7)12. Das Resorufin/Dihydroresorufin Redoxsystem wird bei einem Standard-Oxidationsreduktionspotential von etwa Eh = -110 mV völlig farblos und wird über einem Redoxpotential von -51 mV 13rosa.
Um beispielsweise das Redoxpotenzial weiter zu reduzieren, um das Wachstum methanogener Mikroorganismen zu erleichtern, die bekanntermaßen weniger als -200 mV14benötigen, kann eine Na2S-Lösung hinzugefügt werden. Alternativ werden häufig Cystein-HCl, Natriumthioglycolat oder Natriumdithionit verwendet. Welches Reduktionsmittel für den Einsatz geeignet ist, hängt jedoch vom jeweiligen Versuchsaufbau ab und kann besondere Aufmerksamkeit erfordern. Natriumthioglycolat benötigt beispielsweise eine Temperaturaktivierung (z. B. durch Autoklavieren).
Ein ausgewogenes mikrobielles Konsortium, bestehend aus verschiedenen Gattungen von Bakterien und Archaeen, und eine effizient funktionierende anaerobe Abbaukaskade können weiter bewertet werden, indem die Kopfraumgaszusammensetzung in den Kulturkolben über Gas bestimmt wird. Chromatographie. Beim Umgang mit Verbindungen wie Phenylsäuren aus verschiedenen Vorläufern ist die Beurteilung des Kopfraums eine schnelle Möglichkeit, den Methanogenese-Prozess zu überprüfen8. Eine Kopfraum-CH 4-Konzentration von ca. 50-60% in den Kontrollen am Ende der Inkubationszeit deutet auf eine erfolgreiche Nutzung der aufgetragenen Nährstoffe und damit auf eine Mineralisierung organischen Materials unter anaeroben Bedingungen hin. Die theoretische Methanproduktion und die zu erwartenden Methankonzentrationen während des Verdauungsprozesses können ex ante nach der Buswell-Boyle-Gleichung nach elementarer Analyse des Substrats oder durch Abschätzung des Kohlenhydrate, Proteine und Fette im Substrat. Laut VDI 4630 15können Kohlenhydrate zu einer theoretischen Biogasproduktion von 750 L kg-1 VSS (50% CH4 und 50% CO2), Proteinen bis 800 L kg-1 VSS (72% CH4 und 28 % CO2) und Fetten bis 1.390 L kg führen. -1 VSS (60% CH4 und 40% CO2).
Darüber hinaus wurden die Bildung und der mögliche nachfolgende Abbau von VFA und Phenylsäuren überwacht. Der Abbauprozess kann durch Analyse der VFA-Konzentrationen (z.B. Acetat, Propionat) zu verschiedenen Zeitpunkten ausgewertet werden. Die Anhäufung von kurzkettigen Fettsäuren wie Acetat und/oder Propionat kann auf Störungen in der methanogenen Gemeinschaftszusammensetzung und auf eine Gesamtüberlast des Reaktors hinweisen. Eine ausgewogene mikrobielle Abbaukaskade kann jedoch sogar mit sehr hohen VFA- und Acetatkonzentrationen9zurechtkommen. Außerdem könnte das Acetat/Propionat-Verhältnis weitere Informationen über den Gesamtreaktorzustand16liefern. Es gibt jedoch viele Parameter, die für die Prozessüberwachung geeignet sind und gemäß den vorgeschlagenen experimentellen Hypothesen ausgewählt werden müssen. Im vorliegenden Beispiel waren die Zielvariablen die Phenylsäurekonzentrationen (Abbildung 6).
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Forschung wurde vom Wissenschaftsfonds (FWF) gefördert: die Projektnummern P 29360 und P 29143. Die Veröffentlichung wurde vom Publikationsfonds der Universität Innsbruck unterstützt. Wir würdigen die EIG sehr.
Materialien
| Name | Company | Catalog Number | Comments |
| culture flasks (120 mL, N20) | Ochs, Germany | 102046 | |
| buty rubber septa (N20) | Ochs, Germany | 102049 | |
| aluminium caps (N20) | Ochs, Germany | 102050 | |
| N2 gas | Messer, Austria | purity 5.0 | |
| syringes + cannulae | various | ||
| crimper | Ochs, Germany | 102051 | |
| de-crimper | Ochs, Germany | 102052 | |
| GC2010 | Shimadzu | ||
| Shin-carbon GC column | Restek | chromatographic separation of H2, O2, CH4, and CO2 | |
| HPLC Prominence | Shimadzu | ||
| Fast Fruit HPLC Column | Phenomenex | chromatographic separation of VFAs, phenyl acids, etc. |
Referenzen
- Wiebe, W. J., Pomeroy, L. R., Wiegert, R. G., et al. Anaerobic Respiration and Fermentation. The Ecology of a Salt Marsh. , 137-159 (1981).
- Kim, B. H., Gadd, G. M., Kim, B. H., Gadd, G. M. Anaerobic fermentation. Bacterial physiology and metabolism. , 252-297 (2008).
- Stolz, J. F., Oremland, R. S. Bacterial respiration of arsenic and selenium). FEMS Microbiology Reviews. 23 (5), 615-627 (1999).
- Lackner, N., Hintersonnleitner, A., Wagner, A. O., Illmer, P. Hydrogenotrophic Methanogenesis and Autotrophic Growth of Methanosarcina thermophila. Archaea. 2018 (5), 1-7 (2018).
- Mutschlechner, M., Praeg, N., Illmer, P. The ecological importance of grazing to methane fluxes and engaged microbial communities in alpine forest soils. FEMS Microbiology Ecology. , (2018).
- Prem, E. M., Reitschuler, C., Illmer, P. Livestock grazing on alpine soils causes changes in abiotic and biotic soil properties and thus in abundance and activity of microorganisms engaged in the methane cycle. European Journal of Soil Biology. 62, 22-29 (2014).
- Praeg, N., Wagner, A. O., Illmer, P. Effects of fertilisation, temperature and water content on microbial properties and methane production and methane oxidation in subalpine soils. European Journal of Soil Biology. 65, 96-106 (2014).
- Wagner, A. O., Prem, E. M., Markt, R., Kaufmann, R., Illmer, P. Formation of phenylacetic acid and phenylpropionic acid under different overload conditions during mesophilic and thermophilic anaerobic digestion. Biotechnology for Biofuels. 12 (1), 359 (2019).
- Lins, P., Malin, C., Wagner, A. O., Illmer, P. Reduction of accumulated volatile fatty acids by an acetate-degrading enrichment culture. FEMS Microbiology Ecology. 71 (3), 469-478 (2010).
- Wagner, A. O., Hohlbrugger, P., Lins, P., Illmer, P. Effects of different nitrogen sources on the biogas production - a lab-scale investigation. Microbiological research. 167 (10), 630-636 (2012).
- Wagner, A. O., et al. Sample preparation, preservation, and storage for volatile fatty acid quantification in biogas plants. Engineering in Life Sciences. 17 (2), 132-139 (2017).
- Uzarski, J. S., DiVito, M. D., Wertheim, J. A., Miller, W. M. Essential design considerations for the resazurin reduction assay to noninvasively quantify cell expansion within perfused extracellular matrix scaffolds. Biomaterials. 129, 163-175 (2017).
- Costilow, R. N., Breznak, J. A., Marzluf, G. A., et al. Physicochemical Factors in Growth. Methods for General and Molecular Microbiology. , 309-329 (2007).
- Le Mer, J., Roger, P. Production, oxidation, emission and consumption of methane by soils: a review. European Journal of Soil Biology. 37 (1), 25-50 (2001).
- . Verein deutscher Ingenieure VDI 4630: Fermentation of organic material. VDI Richtlinien. , (2006).
- Wagner, A. O., Reitschuler, C., Illmer, P. Effect of different acetate: Propionate ratios on the methanogenic community during thermophilic anaerobic digestion in batch experiments. Biochemical Engineering Journal. 90, 154-161 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten