Method Article
Preparazione media per la coltivazione di microrganismi in condizioni rigorosamente anaerobiche/anossiche
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Poiché gli organismi anaerobici obbligati non sono in grado di crescere dopo l'esposizione all'ossigeno, l'uso di tecniche di coltura anaerobica è indispensabile. Qui, dimostriamo un metodo semplice ed efficace per coltivare una coltura mista derivata da una pianta di biogas dalla preparazione dei media alla quantificazione del gas e degli acidi grassi volatili.
Abstract
A differenza degli organismi aerobici, microrganismi strettamente anaerobici richiedono l'assenza di ossigeno e di solito un basso potenziale di redox per avviare la crescita. Poiché l'ossigeno è onnipresente nell'aria, mantenere le condizioni libere di O2durante tutte le fasi della coltivazione è impegnativo ma un prerequisito per la coltivazione anaerobica. Il protocollo qui presentato dimostra il successo della coltivazione di una coltura mista anaerobica derivata da una pianta di biogas utilizzando un metodo semplice ed economico. Viene fornita una descrizione precisa dell'intero processo di coltura anossica, tra cui la preparazione dei media, il riempimento di flaconi di coltivazione, il completamento con indicatore di redox e gli agenti che riducono la protezione per fornire bassi potenziali di redox, nonché lo scambio dello spazio della testa per mantenere senza ossigeno. Inoltre, viene fornita una panoramica dettagliata dei flaconi di siero stretto a gas a gas a livello ape (utilizzando siringhe e aghi sterili) e di condizioni di incubazione adeguate. Il presente protocollo si occupa inoltre del campionamento di gas e liquidi per le successive analisi relative alla composizione del gas e alle concentrazioni di acidi grassi volatili utilizzando la cromografia a gas (GC) e la cromografia liquida ad alte prestazioni (HPLC), calcolo del biogas e della resa del metano considerando la legge ideale sul gas.
Introduzione
Sulla terra l'ossigeno molecolare in notevoli concentrazioni è disponibile in aree a contatto diretto con l'atmosfera o in presenza di fototrofi ossigeni. Ambienti in cui l'ossigeno è assente sono chiamati anaerobici. Tuttavia, la conversione energetica è ancora possibile in condizioni anaerobiche attraverso due diversi processi metabolici, fermentazione e respirazione anaerobica1.
Mentre gli organismi sottoposti a respirazione aerobica utilizzano l'ossigeno come un accettatore di elettroni terminale, la respirazione anaerobica richiede accetti di elettroni alternativi come nitrato o solfato2. Nella cosiddetta "torre degli elettroni", le coppie di ridox sono organizzate in base al loro potenziale di ridox, con quelle più negative situate nella parte superiore (donatori di elettroni) e agenti di ossidazione più forti con potenziale di redox positivo nella parte inferiore (accettatori di elettroni). Il trasferimento di elettroni tra donatori e accetti porta alla conservazione dell'energia attraverso la cosiddetta catena respiratoria e gli elettroni possono essere catturati da accettanti elettronici - per rimanere nell'immagine - in diversi piani della torre. Di conseguenza, maggiore è la caduta degli elettroni attraverso la torre degli elettroni, maggiore è l'energia che può essere conservata dalla rispettiva reazione. Pertanto, la respirazione è possibile anche negli habitat anaerobici, ad esempio, con coppie di redox tra cui NO3-/NO2-, acido fumarico/acido succinico, SO32-/H2S, S/H2S, Mn(IV)/Mn(II ), Fe(III)/Fe(II)2,3. In primo luogo, l'energia risultante è conservata come potenziale di membrana, che viene successivamente utilizzata dal trasporto elettronico di fosfororylazione per la sintesi adenosina-tripfosfato (ATP) da ATP-synthases legati alla membrana. A differenza della respirazione aerobica, la quantità di energia che può essere conservata dalla respirazione anaerobica può essere drasticamente ridotta; tuttavia, la produzione di energia della maggior parte delle respirazioni anaerobiche è ancora superiore rispetto alla fermentazione, un percorso anaerobico di conservazione dell'energia in habitat privi di ossigeno e altri accetti di elettroni terminali2.
Durante la fermentazione, i substrati organici ricchi di energia vengono degradati a vari prodotti di fermentazione che spesso definiscono il nome del processo complessivo, ad esempio la fermentazione alcolica. A differenza dei processi respiratori, la generazione di ATP durante la fermentazione è limitata al fosforo a livello di substrato durante il quale un gruppo di fosfati viene trasferito all'adenosina-difosfato (ADP) da un substrato fosforo 2 ricco di energia. I microrganismi fermentanti svolgono un ruolo centrale nella degradazione anaerobica della materia organica in quanto sono attori chiave nella ripartizione del substrato. I prodotti primari di fermentazione, come gli acidi organici, gli alcoli, CO2e H2,possono successivamente essere utilizzati da microrganismi fermentanti secondari per produrre acido acetico, CO2e H2. Esempi di prodotti di fermentazione includono acido lattico, vari acidi grassi volatili (formic-, acetica-, propionico-, butirico-, acido valerico), n-butanolo, 2,3-butandiolo, acetone ed etanolo.
La coltivazione di microrganismi in condizioni strettamente anaerobiche richiede metodi e attrezzature completamente diversi rispetto alla coltivazione di organismi aerobici. Mentre gli organismi tolleranti all'ossigeno sono spesso coltivati su piatti di agar, le cosiddette colture superficiali, questo è - con poche eccezioni - difficilmente possibile per i microrganismi strettamente anaerobici. Pertanto, le colture di arricchimento di microrganismi strettamente anaerobici sono stabilite principalmente in supporti liquidi che applicano vasi di coltura sigillati con setti a tenuta di gas che garantiscono un'atmosfera senza testa priva di ossigeno4,6, 7.
L'attuale descrizione del protocollo fornirà metodi di coltivazione appropriati per i microrganismi bersaglio di una popolazione mista derivata da una pianta di biogas anaerobica. L'isolamento e la coltivazione di culture pure è ancora più impegnativo ma non fa parte di questo lavoro.
Qui, mostriamo la procedura per coltivare una comunità microbica anaerobica basata su uno studio riguardante la formazione di acidi fenili durante la digestione anaerobica di substrati proteici8. La comunità microbica era composta da membri di tutte e quattro le fasi della digestione anaerobica: idrolisi, acidogenesi, acetogenesi e metanogenesi. Un mezzo di sale minerale integrato con una fonte di carbonio, redox-indicatore, vitamina e traccia elemento soluzione, e agente di riduzione è stato applicato9. Il mezzo è stato modificato con il rispettivo precursore dell'acido fenile proteico substrati8.
Protocollo
1. Preparazione del mezzo
- Preparare la soluzione stock indicatore redox (0,1 g di resazurin/100 mL soluzione aqueous).
- Preparare la soluzione vitaminica (Tabella 1).
- Preparare la soluzione dell'elemento di traccia (tabella2).
NOTA: l'ordine di addizione è importante; si prega di fare riferimento alla Tabella 2 e ai rispettivi protocolli. - Preparare la soluzione di riduzione delle scorte di agenti (60 g di soluzione aqueous Na2S/L).
- Pesare gli ingredienti medi (mezzo di sale minerale, tabella 3) in un pallone appropriato (ad esempio, 1 l vite cap lab).
NOTA: a seconda della configurazione sperimentale, potrebbe essere necessaria l'aggiunta di una fonte di carbonio separata. - Aggiungere metà volume di acqua distillata (tabella 3) e sciogliere gli ingredienti.
- Aggiungere 1 mL di soluzione indicatore redox secondo la tabella 3.
- Aggiungere vitamina e traccia elemento soluzione secondo la tabella 3.
- Regolare il pH in base ai requisiti medi/organismi nella tabella 3.
NOTA: il colore dell'indicatore di redox dipende dal pH e potrebbe richiedere del tempo per la regolazione. - Portare ad un volume finale di 1 L con acqua distillata.
NOTA: Le soluzioni per vitamine e oligoelementi possono essere aggiunte anche dopo l'autoclaving aggiungendo appostamente un filtro-sterilizzato (soluzioni diluite aliquote, dimensione dei pori del filtro < 0,2 m) in flaconi di siero precedentemente chiusi e autoclavi. Tuttavia, questo approccio comporta un elevato rischio di contaminazione.
2. Riempimento di flaconi di coltivazione
- Assollo accuratamente pulite e asciutte 120 mL di siero.
NOTA: i flaconi del siero sono disponibili in diverse capacità di volume (ad esempio, 20, 60, 120, 250 mL). - Setta di gomma butile accuratamente pulita e asciutta.
- Pesare ulteriori componenti medi (ad esempio, substrati precursori dell'acido fenile) nei flaconi di coltivazione.
NOTA: i componenti aggiuntivi dipendono dall'installazione sperimentale e dall'ipotesi. - Riempire i flaconi del siero con 50 mL di media.
3. Riduzione/rimozione dell'ossigeno nella fase liquida
- Preparare un bagno d'acqua da 100 gradi centigradi.
- Impostare i flaconi di siero riempiti nel bagno d'acqua e incubare per circa 20-30 minuti per ridurre la solubilità di O2 nella fase liquida.
- Sciacquare immediatamente lo spazio della testa con Gas N2 o in alternativa con altre miscele di gas o gas come N2/ CO2.
AVVISO: prendersi cura della ventilazione della camera appropriata. - Chiudere i flaconi con setti di gomma butil e fissare con tappi in alluminio.
NOTA: Setti di gomma potrebbe spesso adattarsi meglio al collo del pallone aggiungendo una goccia di acqua / media durante la perforazione in. - Aggiungere 0,1 mL di agente degrado (soluzione di riserva) a ogni fiaschetta riempita con 50 mL di media per ridurre ulteriormente il potenziale di redox (0,1 mL di agente di riduzione per 50 mL di media).
- Autoclave per 20 min a 121 gradi centigradi.
AGGIORNAMENTO: Deve essere utilizzata un'autoclave certificata per la sterilizzazione dei recipienti chiusi. In caso contrario, la sovrapressione derivante dall'aumento della temperatura potrebbe causare l'esplosione dei flaconi del siero.
4. Inoculazione del mezzo
- Preparare l'inoculum dal digestore anaerobico.
- Aggiungere 400 mL di acqua distillata in una fiaschetta e portarla a ebollizione.
- Raffreddare il sistema (< 30 gradi centigradi) mentre si scarica permanentemente lo spazio della testa con N2.
- Aggiungere circa 100 g di fango derivati da un digestore anaerobico.
NOTA: Evitare il contatto eccessivo dei fanghi con l'ossigeno. - Registrare la massa esatta dei fanghi aggiunti per l'esatta determinazione della diluizione.
- Scambia lo spazio della testata del pallone con N2 e chiudilo con un setto di gomma butil.
- Agitare il flacone per 30 min a 120 giri/m.
- Rimuovere 5 mL di inoculum utilizzando la siringa e cannula e iniettarla in flaconi di siero preparate come descritto al punto 1-3.
5. Incubazione, campionamento e analisi
- Incubare i flaconi del siero inoculato ad una temperatura appropriata per il rispettivo esperimento.
NOTA: La temperatura di incubazione dipende dalla configurazione sperimentale e l'inoculum utilizzato.- Scarico sovrapressione derivante dall'aumento della temperatura utilizzando la siringa - cannula, quando il liquido nei flaconi del siero ha equilibrato alla temperatura di incubazione (circa 15 – 30 min, a seconda della temperatura di incubazione).
UTILITÀ: A seconda del substrato applicato, della sua concentrazione, temperatura, tempo di incubazione, tipo di inoculo e concentrazione, la sovrapressione all'interno dei flaconi può aumentare fino a > pressione di 2 bar e potrebbe causare l'esplosione dei flak del siero. È quindi obbligatorio monitorare la sovrapressione utilizzando un manometro e successivamente drenando la sovrapressione con una cannula.
- Scarico sovrapressione derivante dall'aumento della temperatura utilizzando la siringa - cannula, quando il liquido nei flaconi del siero ha equilibrato alla temperatura di incubazione (circa 15 – 30 min, a seconda della temperatura di incubazione).
- Valutare la produzione e la composizione di biogas durante i tempi di incubazione.
NOTA: Il periodo di incubazione può estendersi da alcuni giorni a diverse settimane.- Registrare la pressione atmosferica attuale.
- Preparare un manometro e valutare la pressione all'interno dei flaconi derivati dall'attività microbica.
- Agitare i flaconi.
- Rimuovere 1 mL di gas headspace utilizzando una siringa , cannula, e misurare le concentrazioni di H2, O2, CH4e/o CO2 tramite cromatografia a gas.
NOTA: Per la qualificazione e la quantificazione di H2, O2, CH4e CO2, è stato utilizzato un cromatografo a gas applicando temperature di funzionamento di 160 s (forno a colonna), 100 gradi (iniettore) e 180 gradi (rilevatore di conduttività termica, TCD ). N2 è stato utilizzato come gas trasportatore. Per i dettagli, fare riferimento agli studi precedenti10.
- Monitorare le concentrazioni di acidi grassi volatili (VFA) e acidi fenili. Per l'analisi VFA e l'acido fenile, utilizzare un sistema HPLC dotato di un rilevatore UV (a 220 nm) in esecuzione con 5 mM H2SO4 come fase mobile. Per i dettagli del metodo e ulteriori informazioni sull'archiviazione dei campioni, fare riferimento agli studi precedenti11.
NOTA: L'analisi di VFA è esemplare per molte altre analisi fisico-chimiche o valutazioni microscopiche. Inoltre, i metodi biologici molecolari mirati all'abbondanza di microrganismi specifici e/o alla composizione della comunità microbica in un certo punto dell'esperimento possono essere applicati utilizzando la procedura descritta.- Togliere 1 mL di liquido con la siringa e la cannula.
NOTA: I campioni possono essere congelati (-20 gradi centigradi) immediatamente dopo il ritiro e analizzati alla fine dell'esperimento11. - Centrifuga a 15.000-20.000 x g e passare attraverso 0,2 m RC (cellulosa rigenerata) filtri.
- Iniettare 5-20 -L su un sistema HPLC e analizzare la composizione VFA e la concentrazione di acidi fenili.
- Togliere 1 mL di liquido con la siringa e la cannula.
- Scolare la pressione eccessiva del flacone usando una cannula.
NOTA: Dopo aver determinato la pressione e la composizione del gas, oltre a prendere il campione necessario, riporre il pallone di coltivazione sulla rispettiva temperatura e non defluire la pressione eccessiva prima che il liquido abbia raggiunto la temperatura di incubazione. - Calcolare la produzione di biogas e metano VCH4N considerando la legge del gas ideale utilizzando l'equazione 1-3. Si prega di fare riferimento anche alla tabella 4.
Equazione 1:
per cui
Equazione 2: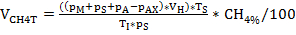
e
Equazione 3:
NOTA: Per il calcolo della produzione totale di biogas, la quantità di CH4% e CH4%X nell'equazione 2 e 3 deve essere impostata su 100. NmL: volume di gas normalizzato in condizioni standardizzate (0 o C, 1 atm), in base al quale il volume di gas molare è 22.414 NmL/mmol.
Risultati
I flaconi di coltivazione sono stati riempiti di medie condizioni anaerobiche secondo il protocollo sopra descritto, hanno verificato il colore appropriato (Figura1)e sono stati utilizzati come bioreattori a lotti in miniatura che conducono la digestione anaerobica. Questi sono stati modificati con substrati che potenzialmente causano formazione di fenili-acido e incubati utilizzando fanghi anaerobici come inoculum (Figura 2). Triptofano, tirosina e fenilalina, così come il complesso estratto di carne precursore della proteinaceo e caseina sono stati applicati in due e tre diverse concentrazioni, rispettivamente. I controlli sono stati preparati senza ulteriori completamento del substrato. Diverse concentrazioni di substrato finalizzate alla simulazione di diverse fasi di sovraccarico. I flasks sono stati incubati a 37 gradi centigradi (mesofili) per 4 settimane.
La produzione e la composizione di biogas (H2, CH4, CO2) sono state monitorate regolarmente tramite la cromatografia a gas (GC TCD)10 e la valutazione della pressione dello spazio di testa. La figura 3 mostra differenze nella produzione cumulativa di metano derivante dalla digestione dei substrati applicati in concentrazioni diverse durante 4 settimane di incubazione anaerobica. Inoltre, i metanogeni sono stati visualizzati irradiando il coenzima F420, un vettore elettronico in metanogenesi, che presenta una fluorescenza blu-verde con un massimo di assorbimento a 420 nm (Figura 4).
Simultanee all'analisi del gas, i campioni per le misurazioni della concentrazione di VFA e di acido fenile tramite HPLC11 sono stati ritirati e conservati congelati fino a un'ulteriore elaborazione. Figura 5 viene illustrato l'effetto di diverse fasi di sovraccarico come riflesso da un accumulo in campioni altamente sovraccarichi ampiamente raffigurato per acetato. La figura 6 illustra la dinamica delle concentrazioni di acetato fenildurante il periodo di incubazione.

Figura 1: indicatore di redox. Il corretto potenziale di redox nei flaconi di coltivazione può essere controllato aggiungendo un indicatore di redox. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: bioreattori a lotti in miniatura. Bioreattori a lotti in miniatura preparati in flaconi di coltivazione da 120 mL per esperimenti di digestione anaerobica. I flaconi erano pieni di mezzi e inoculati con fanghi di digestione diluiti. I reattori erano sigillati a gas con tappi di gomma butil e tappi in alluminio. Fare clic qui per visualizzare una versione più grande di questa figura.
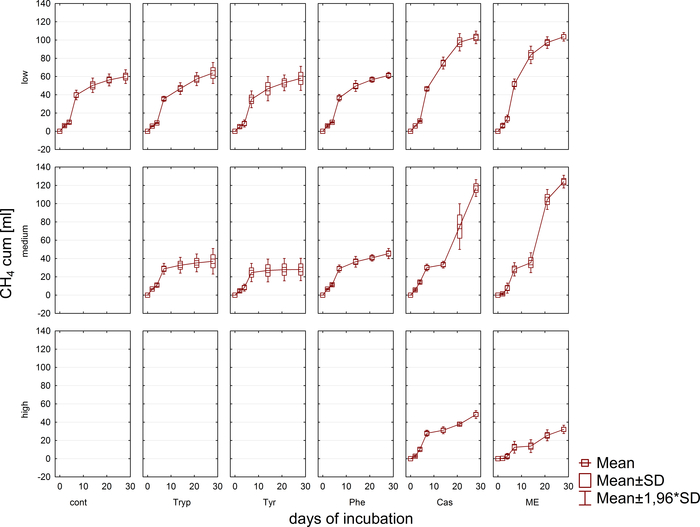
Figura 3: Produzione di metano. Produzione cumulativa di metano durante 28 giorni di incubazione mesofilica da reattori che riflettono diverse condizioni di sovraccarico (basso, medio, alto). Cont: controllo; Tryp: metatono; Tyr: tirosina; Phe: fenilalanina; ME: Estratto di carne; Cas: caseina. Questa è una figura modificata proveniente da uno studio precedente8. Fare clic qui per visualizzare una versione più grande di questa figura.
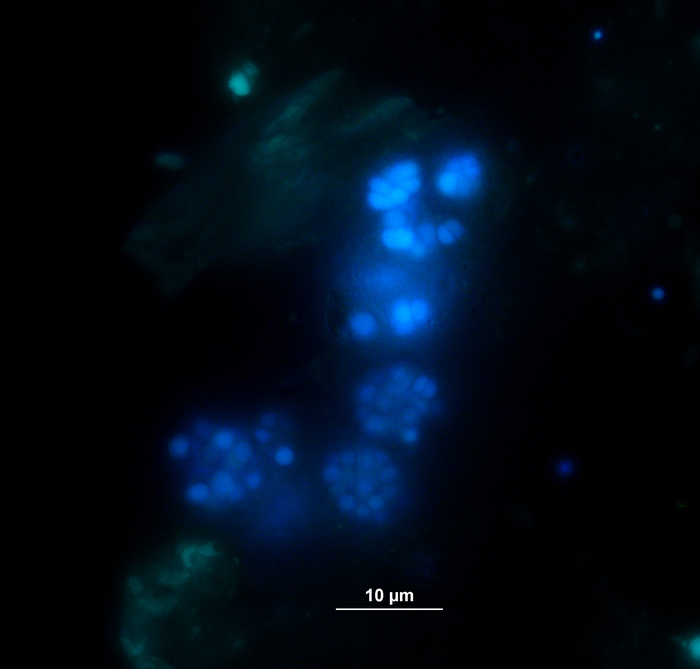
Figura 4: Metanogeni fluorescing. I metanogeni emettono una luce bluastra quando sono eccitati dalla luce UV. Qui, i metanogeni sono attaccati alle particelle vegetali (verde chiaro). I campioni sono stati prelevati da un reattore a lotti, diluiti per la microscopia e analizzati immediatamente. Fare clic qui per visualizzare una versione più grande di questa figura.
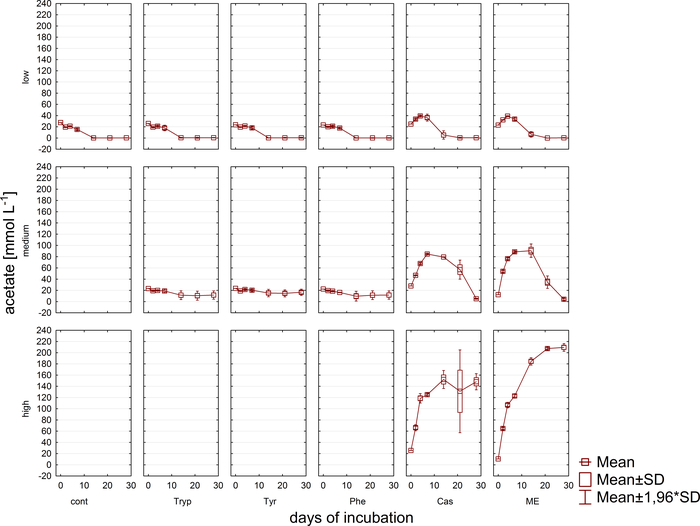
Figura 5: Concentrazione di acetato. Concentrazione di acetato durante 28 giorni di incubazione mesofilo nei reattori che riflette diverse condizioni di sovraccarico (bassa, media, alta). Cont: controllo; Tryp: metatono; Tyr: tirosina; Phe: fenilalanina; ME: Estratto di carne; Cas: caseina. Questa è una figura modificata proveniente da uno studio precedente8. Fare clic qui per visualizzare una versione più grande di questa figura.
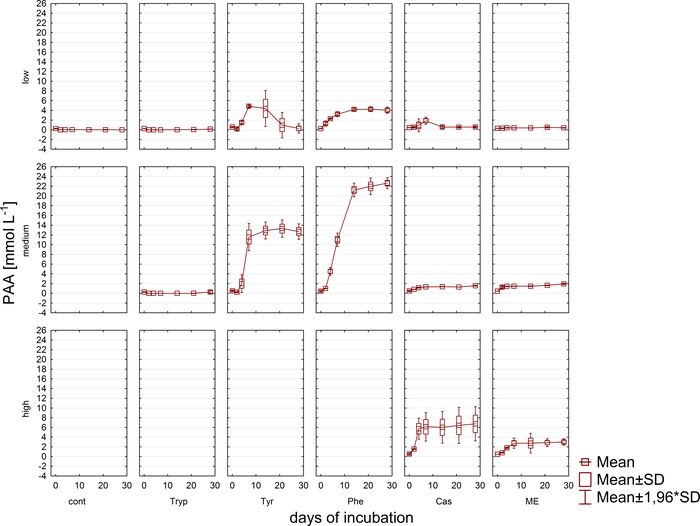
Figura 6: Concentrazione di fenilattico. Concentrazione di fenilfiore durante 28 giorni di incubazione mesofilica nei reattori che riflettono diverse condizioni di sovraccarico (basso, medio, alto). Cont: controllo; Tryp: metatono; Tyr: tirosina; Phe: fenilalanina; ME: Estratto di carne; Cas: caseina. Questa è una figura modificata proveniente da uno studio precedente8. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: Reazione di Resazurin. La resazurina di colore blu subisce una riduzione irreversibile alla rirufin (rosa) e un'ulteriore riduzione reversibile alla dihydroresorufin incolore secondo Uzarski et al.12. Fare clic qui per visualizzare una versione più grande di questa figura.
| Cianocobalamina | 0,050 g |
| 4-acido aminobenzoico | 0,050 g |
| D-biotina | 0,010 g |
| Acido nicotinico | 0,100 g |
| Piridossina | 0,250 g |
| Acido D-pantotenico | 0,025 g |
| Cloruro di Thiaminium HCl | 0,18 g |
| Acqua distillata | 1000 mL |
Tabella 1: Soluzione vitaminica.
| 25% (w/v) HCl | 10,0 mL |
| FeCl2 x 4 H2O | 1,50 g |
| NCl2 (NCl) | 0,070 g |
| MnCl2 x 4 H2O | 0,100 g |
| H3BO3 | 0,006 g |
| CoCl2 x 6 H2O | 0,190 g |
| CuCl2 x 2 H2O | 0,002 g |
| NiCl2 x 6 H2O | 0,024 g |
| Na2MoO4 x 2 H2O | 0,036 g |
| Acqua distillata | 990,0 mL |
| Raccomandazione di preparazione | Aggiungere HCl e sciogliere FeCl2, aggiungere 100 mL di acqua distillata, sciogliere gli altri ingredienti e fare fino a 1000 mL. |
Tabella 2: soluzione dell'elemento di traccia.
| Nacl | 1,0 g |
| MgCl2 x 6 H2O | 0,4 g |
| KH2PO4 | 0,2 g |
| Kcl | 0,5 g |
| CaCl2 x 2 H2O | 0,15 g |
| L-cisteina | 0,5 g |
| Estratto di lievito | 1,0 g |
| Soluzione Resazurin | 1 mL |
| Soluzione vitaminica | 1 mL |
| Soluzione dell'elemento di traccia | 1 mL |
| Acqua distillata | 1000 mL |
| Ph | 7.2 |
Tabella 3: Minimo sale medio.
| variabile | unità | descrizione |
| tY | [d] | Timepoint di misurazione |
| tX | [d] | Timepoint della misurazione precedente |
| pM | [mbar] | Sovrapressione misurata a tY |
| pA | [mbar] | Pressione ambientale a tY |
| pAX | [mbar] | Pressione ambientale a tX |
| pS | [mbar] | Pressione standard, 1013,25 mbar acc. |
| TI | [K] | Temperatura di incubazione |
| TS | [K] | Temperatura standard, 273,15 K (corrisponde a 0 gradi centigradi) acc. |
| VH | [ml] | Volume dello spazio di testa a tY |
| VHX | [ml] | Volume Headspace a tX |
| CH4% | [vol%] | Concentrazione di metano secondo GC-measurement a tY |
| CH4%X | [vol%] | Concentrazione di metano secondo la misurazione GC a tX |
| VCH4T | [Nml] | Quantità totale di metano nella bottiglia del siero a tY |
| VCH4R | [Nml] | Quantità residua di metano nello spazio della testa a tX |
| VCH4N | [Nml] | Metano di nuova produzione da tX a tY |
Tabella 4: Descrizione delle variabili nell'equazione 1 - 3.
Discussione
Il passo più importante e critico nella coltura di microrganismi anaerobici è quello di garantire condizioni prive di ossigeno nei media di coltivazione e nello spazio della testa dei flaconi. Un indicatore come resazurin può essere utilizzato per controllare indirettamente il corretto riempimento anaerobico dei flaconi. Resazurin è un coloranti redox comunemente usato in quanto è poco costoso, non tossico, e già efficace in basse dosi e tempi di incubazione brevi 12. Quando incorporato nei media, la resazurina di colore blu subisce per la prima volta un passaggio di riduzione irreversibile alla rirufin, che è rosa con valori di pH neutri. Questa prima reazione può verificarsi quando il supporto è riscaldato 13. Successivamente, la rirumarcia viene ridotta a dihydroresorufin incolore in una reazione secondaria reversibile (Figura 7)12. Il sistema di redox redox rerufin/diidroresorufin diventa completamente incolore ad un potenziale di riduzione di ossidazione standard di circa Eh - -110 mV e diventa rosa sopra un potenziale di redox di -51 mV 13.
Al fine di ridurre ulteriormente il potenziale di redox, ad esempio, per facilitare la crescita di microrganismi metanogenici noti per richiedere meno di -200 mV14, può essere aggiunta una soluzione Na2S. In alternativa, sono comunemente usati cisteine-HCl, sodio-tioglicolato o dithionite di sodio. Tuttavia, quale agente di riduzione è appropriato da utilizzare dipende dalla rispettiva configurazione sperimentale e potrebbe richiedere particolare attenzione. Ad esempio, il tioglicolicolo di sodio ha bisogno di attivazione della temperatura (ad esempio, automatizzando l'autoclaving).
Un consorzio microbico ben bilanciato, composto da vari generi di batteri e archea, e una cascata di degradazione anaerobica efficiente può essere ulteriormente valutata determinando la composizione del gas headspace nei flaconi di coltura tramite gas Cromatografia. Quando si trattano composti come gli acidi fenili derivati da diversi precursori, la valutazione dello spazio della testa è un modo veloce per controllare il processo di metanogenesi8. Una concentrazione di CH4 nello spazio della testa di circa il 50-60% dei controlli alla fine del periodo di incubazione indica un utilizzo positivo dei nutrienti applicati e quindi una mineralizzazione del materiale organico in condizioni anaerobiche. La produzione teorica di metano e le concentrazioni prevedibili di metano durante il processo di digestione possono essere determinate ex secondo l'equazione di Buswell-Boyle dopo l'analisi elementare del substrato o stimando il contenuto di carboidrati, proteine e grassi nel substrato. Secondo VDI 4630 15, i carboidrati possono portare a una produzione teorica di biogas di 750 L kg-1 VSS (50% CH4 e 50% CO2), proteine a 800 L kg-1 VSS (72% CH4 e 28 % CO2), e grassi a 1.390 L kg -1 VSS (60% CH4 e 40% CO2).
Inoltre, sono stati monitorati la formazione e la possibile successiva degradazione di VFA e acidi fenili. Il processo di degradazione può essere valutato analizzando le concentrazioni di VFA (ad esempio, acetato, propionato) in momenti diversi. L'accumulo di acidi grassi a catena corta come acetato e/o propionato può indicare disturbi nella composizione della comunità metanogenica e ad un sovraccarico complessivo del reattore. Tuttavia, una cascata di degradazione microbica ben bilanciata può anche far fronte a concentrazioni molto elevate di VFA e acetato9. Inoltre, il rapporto acetato / propionato potrebbe fornire ulteriori informazioni sulla condizione complessiva del reattore16. Tuttavia, ci sono molti parametri adatti per il monitoraggio dei processi che devono essere selezionati secondo le ipotesi sperimentali proposte. Nell'esempio attuale, le variabili di destinazione erano concentrazioni di acidi fenili (Figura 6).
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata finanziata dal Fondo scientifico austriaco (FWF): i numeri di progetto P 29360 e P 29143. La pubblicazione è stata supportata da Publikationsfonds der Universitat Innsbruck. Riconosciamo molto il BEI.
Materiali
| Name | Company | Catalog Number | Comments |
| culture flasks (120 mL, N20) | Ochs, Germany | 102046 | |
| buty rubber septa (N20) | Ochs, Germany | 102049 | |
| aluminium caps (N20) | Ochs, Germany | 102050 | |
| N2 gas | Messer, Austria | purity 5.0 | |
| syringes + cannulae | various | ||
| crimper | Ochs, Germany | 102051 | |
| de-crimper | Ochs, Germany | 102052 | |
| GC2010 | Shimadzu | ||
| Shin-carbon GC column | Restek | chromatographic separation of H2, O2, CH4, and CO2 | |
| HPLC Prominence | Shimadzu | ||
| Fast Fruit HPLC Column | Phenomenex | chromatographic separation of VFAs, phenyl acids, etc. |
Riferimenti
- Wiebe, W. J., Pomeroy, L. R., Wiegert, R. G., et al. Anaerobic Respiration and Fermentation. The Ecology of a Salt Marsh. , 137-159 (1981).
- Kim, B. H., Gadd, G. M., Kim, B. H., Gadd, G. M. Anaerobic fermentation. Bacterial physiology and metabolism. , 252-297 (2008).
- Stolz, J. F., Oremland, R. S. Bacterial respiration of arsenic and selenium). FEMS Microbiology Reviews. 23 (5), 615-627 (1999).
- Lackner, N., Hintersonnleitner, A., Wagner, A. O., Illmer, P. Hydrogenotrophic Methanogenesis and Autotrophic Growth of Methanosarcina thermophila. Archaea. 2018 (5), 1-7 (2018).
- Mutschlechner, M., Praeg, N., Illmer, P. The ecological importance of grazing to methane fluxes and engaged microbial communities in alpine forest soils. FEMS Microbiology Ecology. , (2018).
- Prem, E. M., Reitschuler, C., Illmer, P. Livestock grazing on alpine soils causes changes in abiotic and biotic soil properties and thus in abundance and activity of microorganisms engaged in the methane cycle. European Journal of Soil Biology. 62, 22-29 (2014).
- Praeg, N., Wagner, A. O., Illmer, P. Effects of fertilisation, temperature and water content on microbial properties and methane production and methane oxidation in subalpine soils. European Journal of Soil Biology. 65, 96-106 (2014).
- Wagner, A. O., Prem, E. M., Markt, R., Kaufmann, R., Illmer, P. Formation of phenylacetic acid and phenylpropionic acid under different overload conditions during mesophilic and thermophilic anaerobic digestion. Biotechnology for Biofuels. 12 (1), 359 (2019).
- Lins, P., Malin, C., Wagner, A. O., Illmer, P. Reduction of accumulated volatile fatty acids by an acetate-degrading enrichment culture. FEMS Microbiology Ecology. 71 (3), 469-478 (2010).
- Wagner, A. O., Hohlbrugger, P., Lins, P., Illmer, P. Effects of different nitrogen sources on the biogas production - a lab-scale investigation. Microbiological research. 167 (10), 630-636 (2012).
- Wagner, A. O., et al. Sample preparation, preservation, and storage for volatile fatty acid quantification in biogas plants. Engineering in Life Sciences. 17 (2), 132-139 (2017).
- Uzarski, J. S., DiVito, M. D., Wertheim, J. A., Miller, W. M. Essential design considerations for the resazurin reduction assay to noninvasively quantify cell expansion within perfused extracellular matrix scaffolds. Biomaterials. 129, 163-175 (2017).
- Costilow, R. N., Breznak, J. A., Marzluf, G. A., et al. Physicochemical Factors in Growth. Methods for General and Molecular Microbiology. , 309-329 (2007).
- Le Mer, J., Roger, P. Production, oxidation, emission and consumption of methane by soils: a review. European Journal of Soil Biology. 37 (1), 25-50 (2001).
- . Verein deutscher Ingenieure VDI 4630: Fermentation of organic material. VDI Richtlinien. , (2006).
- Wagner, A. O., Reitschuler, C., Illmer, P. Effect of different acetate: Propionate ratios on the methanogenic community during thermophilic anaerobic digestion in batch experiments. Biochemical Engineering Journal. 90, 154-161 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon