Method Article
Preparação média para o cultivo de microrganismos condições estritamente anaeróbicas/anóxicas
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Como os organismos anaeróbios obrigam são incapazes de crescer em cima da exposição de oxigênio, o uso de técnicas de cultivo anaeróbicos é indispensável. Aqui, demonstramos um método simples e efetivo para cultivar uma cultura mista derivada de uma usina de biogás a partir da preparação de mídia para o gás e quantificação de ácidos graxos voláteis.
Resumo
Em contraste com os organismos aeróbios, microrganismos estritamente anaeróbios requerem a ausência de oxigênio e geralmente um baixo potencial redox para iniciar o crescimento. Como O oxigênio é onipresente no ar, reter O2-condições livres durante todas as etapas de cultivo é desafiador, mas um pré-requisito para a cultura anaeróbia. O protocolo aqui apresentado demonstra o cultivo bem-sucedido de uma cultura mista anaeróbia derivada de uma planta de biogás utilizando um método simples e barato. Uma descrição precisa de todo o processo de cultivo anóxico é dada, incluindo preparação de mídia, enchimento de frascos de cultivo, suplementação com indicador redox e agentes redutores para fornecer baixos potenciais redox, bem como trocar o headspace para manter mídia livre de oxigênio. Além disso, uma visão detalhada dos frascos de soro herméticamente inoculados com gás (usando seringas e agulhas estéreis) e condições de incubação apropriadas é fornecida. O presente protocolo aborda ainda mais a amostragem de gás e líquido para análises subsequentes sobre a composição gasosa e as concentrações de ácidos graxos voláteis utilizando cromatografia gasosa (GC) e cromatografia líquida de alta eficiência (HPLC), respectivamente, e a cálculo da produção de biogás e metano Considerando a lei de gás ideal.
Introdução
No oxigênio molecular da terra em concentrações notáveis está disponível nas áreas que têm o contato direto com a atmosfera ou na presença de phototrophs oxygenic. Ambientes em que o oxigênio está ausente são chamados anaeróbios. No entanto, a conversão de energia ainda é possível em condições anaeróbias através de dois processos metabólicos diferentes, fermentação e respiração anaeróbia1.
Quando os organismos que submetem-se à respiração aeróbia estiverem usando o oxigênio como um aceitador terminal do elétron, a respiração anaeróbica exige aceitadores alternativos do elétron como o nitrato ou o sulfato2 Na chamada "Torre de elétrons", os casais redox são organizados de acordo com seu potencial redox, com os mais negativos localizados na parte superior (doadores de elétrons) e agentes de oxidação mais fortes com potencial redox positivo na parte inferior (aceitadores de elétrons). A transferência de elétrons entre doadores e aceitadores leva à conservação de energia através da chamada cadeia respiratória e os elétrons podem ser capturados por aceitadores de elétrons-para ficar na imagem-em diferentes andares da torre. Assim, quanto maior a queda de elétrons através da torre de elétrons, mais energia pode ser conservada pela respectiva reação. Portanto, a respiração também é possível em habitats anaeróbios, por exemplo, com pares redox, incluindo no3-/no2-, ácido fumárico/ácido succínico, então32-/h2s, s °/h2s, MN (IV)/MN (II ), FE (III)/Fe (II)2,3. Primeiramente, a energia resultante é conservada como o potencial da membrana, que é usada subseqüentemente pelo fosforilação do transporte do elétron para a síntese do Adenosine-triphosphate (ATP) por ATP-synthAses membrana-ligados. Em contraste com a respiração aeróbia, a quantidade de energia que pode ser conservada pela respiração anaeróbia pode ser drasticamente reduzida; no entanto, a produção de energia da maioria das respirações anaeróbias ainda é maior em comparação com a fermentação, um caminho de conservação de energia anaeróbia em habitats sem oxigênio e outros aceitadores de elétrons terminais2.
Durante a fermentação, os substratos orgânicos ricos em energia são degradados a vários produtos de fermentação que muitas vezes definem o nome do processo geral, por exemplo, a fermentação alcoólica. Em contraste com os processos respiratórios, a geração de ATP durante a fermentação é limitada à fosforilação em nível de substrato durante a qual um grupo fosfato é transferido para a adenosina-di-fosfato (ADP) de um substrato fosforilado rico em energia2. Os microrganismos fermentadores desempenham um papel central na degradação anaeróbia da matéria orgânica, pois são atores-chave na decomposição do substrato. Os produtos de fermentação primários, como ácidos orgânicos, álcoois, CO2e h2, podem ser usados posteriormente por microrganismos fermentadores secundários para produzir ácido acético, co2e h2. Exemplos de produtos de fermentação incluem ácido láctico, vários ácidos graxos voláteis (fórmico-, acético-, propiônico-, butírico-, Ácido valérico), n-butanol, 2,3-butandiol, acetona e etanol.
O cultivo de microrganismos em condições estritamente anaeróbias requer métodos e equipamentos completamente diferentes em comparação com o cultivo de organismos aeróbios. Quando os organismos oxigênio-tolerantes forem cultivados frequentemente em pratos do ágar, culturas de superfície assim chamadas, esta é-com algumas exceções-mal possível para micro-organismos estritamente anaeróbicos. Portanto, culturas de enriquecimento de microrganismos estritamente anaeróbios são estabelecidas principalmente em meios líquidos aplicando vasos de cultura selados com septos estanques a gás que garantem uma atmosfera de headspace livre de oxigênio4,6, o 7.
A descrição atual do protocolo fornecerá métodos apropriados do cultivation para micro-organismos do alvo de uma população misturada derivada de uma planta anaeróbia do biogás. O isolamento e cultivo de culturas puras é ainda mais desafiador, mas não faz parte deste trabalho.
Aqui, mostramos o procedimento para cultivar uma comunidade microbiana anaeróbia com base em um estudo sobre a formação de ácidos fenílicos durante a digestão anaeróbia de substratos proteicos8. A comunidade microbiana consistiu de membros de todas as quatro fases de digestão anaeróbia: hidrólise, acidogênese, acetogênese e metanogênese. Um meio de sal mineral suplementado com uma fonte de carbono, um redox-indicador, uma vitamina e uma solução do oligoelemento, e um agente de redução foram aplicados9. O meio foi emendado com os respectivos substratos de precursor do ácido fenil proteico8.
Protocolo
1. preparação do meio
- Prepare a solução de estoque do indicador redox (0,1 g de solução aquosa de resazurin/100 mL).
- Prepare a solução vitamínica (tabela 1).
- Prepare a solução de oligoelemento (tabela 2).
Nota: a ordem de adição é importante; por favor, consulte a tabela 2 e respectivos protocolos. - Prepare a solução de redução de estoque do agente (60 g na2S/L solução aquosa).
- Pesar os ingredientes médios (meio de sal mineral, tabela 3) em um frasco apropriado (por exemplo, balão do laboratório da tampa de parafuso de 1 L).
Nota: dependendo da configuração experimental, a adição de uma fonte de carbono separada pode ser necessária. - Adicione meio volume de água destilada (tabela 3) e dissolva os ingredientes.
- Adicionar 1 mL de solução de indicador redox de acordo com a tabela 3.
- Adicione a solução de vitamina e oligoelemento de acordo com a tabela 3.
- Ajuste o pH de acordo com as exigências do meio/organismo na tabela 3.
Nota: a cor do indicador redox é dependente do pH e pôde exigir alguma hora de ajustar. - Trazer para um volume final de 1 L com água destilada.
Nota: as soluções de vitaminas e oligoelementos também podem ser adicionadas após a autoclavagem por meio da adição asséptica de uma alíquota filtro-esterilizada (soluções diluídas, tamanho de poros do filtro < 0,2 μm) em frascos de soro previamente fechados e autoclánicos. No entanto, esta abordagem tem um risco elevado de contaminação.
2. enchimento de frascos de cultivo
- Limpe e seque completamente 120 frascos do soro do mL.
Nota: as garrafas de soro estão disponíveis em diferentes capacidades de volume (por exemplo, 20, 60, 120, 250 mL). - Septos de borracha butílica completamente limpos e secos.
- Pesar componentes médios adicionais (por exemplo, substratos de precursor de ácido fenilo) nos frascos de cultivo.
Nota: os componentes adicionais dependem da configuração experimental e da hipótese. - Encha os frascos de soro com 50 mL de meio.
3. redução/remoção de oxigénio na fase líquida
- Prepare um banho de água ~ 100 ° C.
- Definir frascos de soro preenchido no banho de água e incubar por cerca de 20-30 min para reduzir a solubilidade de O2 na fase líquida.
- Lave o headspace imediatamente com o gás N2 ou alternativamente com outras misturas do gás ou do gás como n2/co2.
Cuidado: cuide da ventilação adequada do quarto. - Feche as garrafas com septos de borracha butílica e fixar com tampas de alumínio.
Nota: os septos de borracha puderam frequentemente caber melhor no pescoço do balão adicionando uma gota da água/meio ao perfurá-lo dentro. - Adicionar 0,1 mL de agente redutor (solução de estoque) a cada frasco preenchido com 50 mL de meio para reduzir ainda mais o potencial redox (0,1 mL de agente redutor por 50 mL de meio).
- Autoclave por 20 min a 121 ° c.
Cuidado: uma autoclave certificada para a esterilização de embarcações fechadas tem que ser usada. Caso contrário, a sobrepressão derivada do aumento da temperatura pode causar a explosão de frascos séricos.
4. inoculação do meio
- Prepare o inóculo do digestor anaeróbio.
- Adicionar 400 mL de água destilada em um balão e trazê-lo para ferver.
- Refresque-o (< 30 ° c) enquanto está permanentemente nivelando o headspace com N2.
- Adicionar cerca de 100 g de lodo derivado de um digestor anaeróbio.
Nota: Evite o contacto excessivo de lamas com oxigénio. - Registre a massa exata de lodo adicionado para a determinação exata da diluição.
- Troque o headspace do balão com N2 e feche-o com um septo de borracha butílica.
- Agitar o balão durante 30 min a 120 rpm.
- Remova o inuso de 5 mL usando a seringa + cânula e injete-o em frascos de soro preparados conforme descrito na etapa 1-3.
5. incubação, amostragem e análise
- Incubar frascos séricos inoculados a uma temperatura adequada para o respectivo experimento.
Nota: a temperatura de incubação depende da configuração experimental e do inuso utilizado.- Drenar a sobrepressão resultante do aumento da temperatura utilizando a seringa + cânula, quando o líquido nos frascos séricos equilibrou a temperatura de incubação (cerca de 15 – 30 min, dependendo da temperatura de incubação).
Cuidado: dependendo do substrato aplicado, sua concentração, temperatura, tempo de incubação, tipo de inuso e concentração, a sobrepressão dentro dos frascos pode subir até > pressão de 2 bar e pode causar a explosão de fardos séricos. O monitoramento da sobrepressão usando um manômetro e, subsequentemente, drenando a sobrepressão com uma cânula é, portanto, obrigatório.
- Drenar a sobrepressão resultante do aumento da temperatura utilizando a seringa + cânula, quando o líquido nos frascos séricos equilibrou a temperatura de incubação (cerca de 15 – 30 min, dependendo da temperatura de incubação).
- Avalie a produção e a composição do biogás durante o tempo de incubação.
Nota: período de incubação pode abranger alguns dias a várias semanas.- Grave a pressão atmosférica atual.
- Prepare um manômetro e avalie a pressão dentro dos frascos derivados da atividade microbiana.
- Agite os frascos.
- Retire 1 mL de gás de headspace utilizando uma seringa + cânula e Meça as concentrações H2, o2, ch4e/ou co2 através de cromatografia gasosa.
Nota: para a qualificação e quantificação de H2, O2, ch4e co2, utilizou-se um cromatografo a gás aplicando temperaturas de operação de 160 ° c (forno de coluna), 100 ° c (injector) e 180 ° c (detector de condutividade térmica, TCD ). N2 foi usado como um gás transportador. Para mais detalhes, consulte os estudos anteriores10.
- Monitore as concentrações de ácidos graxos voláteis (VFA) e ácidos fenílicos. Para a análise de VFA e de ácido fenílico, use um sistema de HPLC equipado com um detector de UV (a 220 nm) rodando com 5 mM H2so4 como uma fase móvel. Para obter detalhes do método e informações adicionais sobre o armazenamento de amostras, consulte os estudos anteriores11.
Nota: a análise da VFA é exemplar para muitas outras análises físico-químicas ou avaliações microscópicas. Além disso, métodos biológicos moleculares visando a abundância de microrganismos específicos e/ou composição da comunidade microbiana em um determinado ponto do experimento podem ser aplicados usando o procedimento descrito.- Remover 1 mL de líquido com seringa + cânula.
Nota: as amostras podem ser congeladas (-20 ° c) imediatamente após a retirada e analisadas no final do experimento11. - Centrifugador em 15000 – 20000 x g e passar através de 0,2 μm RC (celulose regenerada) filtros.
- Injete 5-20 μl em um sistema de HPLC e analise para a composição de VFA e a concentração de ácidos de fenil.
- Remover 1 mL de líquido com seringa + cânula.
- Sobrepressão do balão de drenagem usando uma cânula.
Nota: depois de determinar a pressão e a composição do gás, bem como tomar qualquer amostra necessária, coloque o balão de cultivo de volta na respectiva temperatura e não drenar a sobrepressão antes que o líquido tenha atingido a temperatura de incubação. - Calcule a produção de biogás e metano VCH4N Considerando a lei de gás ideal usando a equação 1-3. Por favor, consulte também a tabela 4.
Equação 1:
Qual
Equação 2: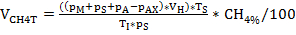
E
Equação 3:
Nota: para o cálculo da produção total de biogás, a quantidade de CH4% e CH4% X na equação 2 e 3 deve ser definida como 100. NmL: volume de gás normalizado em condições padronizadas (0 ° c, 1 ATM), o qual o volume de gás molar é 22,414 NmL/mmol.
Resultados
Os frascos de cultivo foram preenchidos com meio condições anaeróbias de acordo com o protocolo descrito acima, verificados para a cor apropriada (Figura 1), e utilizados como bioreatores em miniatura realizando digestão anaeróbia. Estes foram alterados com substratos que potencialmente causavam formação de ácido fenil e incubados utilizando lodo de digestor anaeróbio como inóculo (Figura 2). Triptofano, tirosina e fenilalanina, bem como o complexo extrato de carne precursora proteica e caseína foram aplicados em duas e três concentrações diferentes, respectivamente. Os controles foram preparados sem suplementação adicional de substrato. Diferentes concentrações de substrato voltadas para a simulação de diferentes estágios de sobrecarga. Os frascos foram incubados em 37 ° c (mesophilic) por 4 semanas.
A produção e composição do biogás (H2, ch4, co2) foi monitorada regularmente via cromatografia gasosa (GC TCD)10 e avaliação da pressão do headspace. A Figura 3 demonstra diferenças na produção acumulada de metano derivada da digestão dos substratos aplicados em concentrações variadas durante 4 semanas de incubação anaeróbia. Adicionalmente, os methanogens foram visualizados irradiando o coenzima F420, um portador do elétron no methanogenesis, exibindo uma fluorescência azul-verde com um máximo da absorção em 420 nanômetro (Figura 4).
Concomitantemente à análise gasosa, as amostras para medidas de concentração de VFA e de ácido fenílico via HPLC11 foram retiradas e armazenadas congeladas até o processamento posterior. A Figura 5 mostra o efeito de diferentes estágios de sobrecarga, como refletido por um acúmulo em amostras altamente sobrecarregadas, exemplarmente retratadas para acetato. A Figura 6 retrata a dinâmica das concentrações de acetato de fenilo durante o período de incubação.

Figura 1: indicador redox. O potencial redox correto nos frascos do cultivo pode ser controlado adicionando um indicador redox. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: biorreatores em miniatura em lote. Bioreatores em miniatura preparados em frascos de cultivo de 120 mL para experimentos de digestão anaeróbia. Os frascos foram preenchidos com meio e inoculados com lodo digestor diluído. Os reatores foram selados a gás com rolhas de borracha butílica e tampas de alumínio. Por favor clique aqui para ver uma versão maior desta figura.
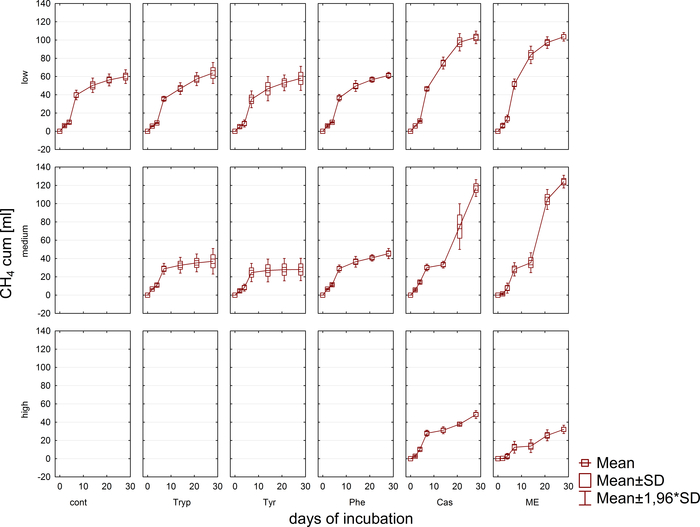
Figura 3: produção de metano. Produção cumulativa de metano durante 28 dias de incubação mesofílica de reatores refletindo diferentes condições de sobrecarga (baixa, média, alta). Cont: controle; Tryp: triptofano; Tyr: tyrosine; PHE: fenilalanina; ME: extrato de carne; CAS: caseína. Esta é uma figura modificada originada de um estudo anterior8. Por favor clique aqui para ver uma versão maior desta figura.
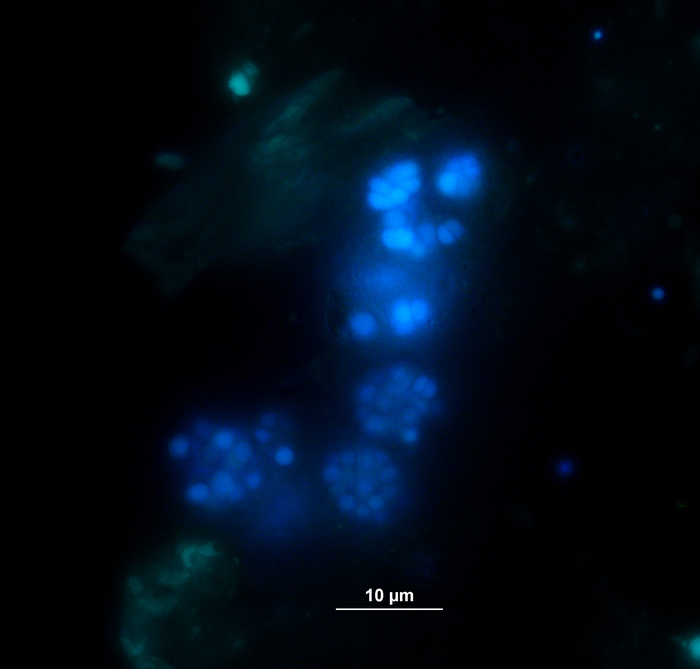
Figura 4: metanogens fluorescentes. Methanogens emitem uma luz azulado ao ser excited com luz UV. Aqui, os methanogens são Unidos às partículas da planta (verde claro). As amostras foram retiradas de um reator em lote, diluídas para microscopia e analisadas imediatamente. Por favor clique aqui para ver uma versão maior desta figura.
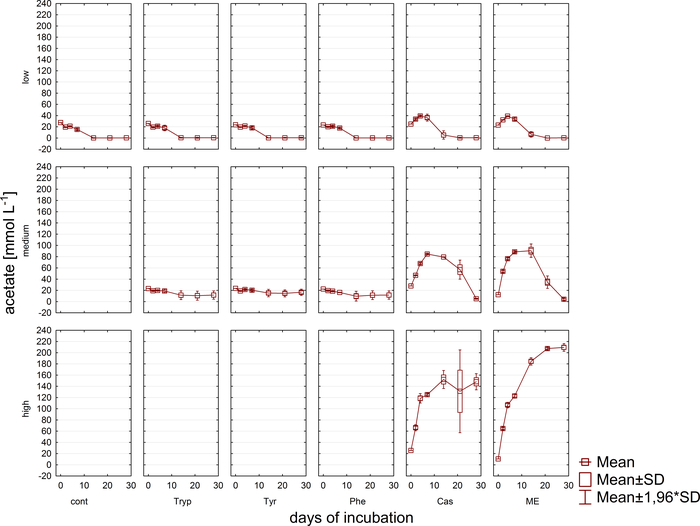
Figura 5: concentração de acetato. Concentração de acetato durante 28 dias de incubação mesofílica em reatores refletindo diferentes condições de sobrecarga (baixa, média, alta). Cont: controle; Tryp: triptofano; Tyr: tyrosine; PHE: fenilalanina; ME: extrato de carne; CAS: caseína. Esta é uma figura modificada originada de um estudo anterior8. Por favor clique aqui para ver uma versão maior desta figura.
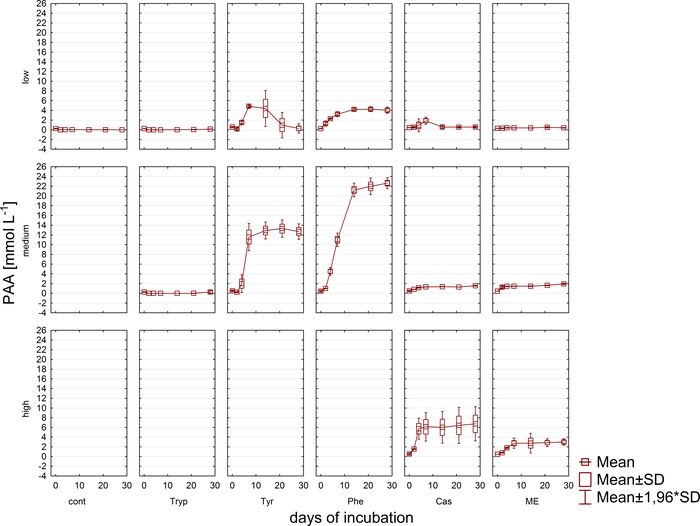
Figura 6: concentração de fenilacetato. Concentração de fenilacetato durante 28 dias de incubação mesofílica em reatores refletindo diferentes condições de sobrecarga (baixa, média, alta). Cont: controle; Tryp: triptofano; Tyr: tyrosine; PHE: fenilalanina; ME: extrato de carne; CAS: caseína. Esta é uma figura modificada originada de um estudo anterior8. Por favor clique aqui para ver uma versão maior desta figura.

Figura 7: reação de resazurin. O resazurin colorido azul sofre uma redução irreversível à resorufina (cor-de-rosa) e uma redução reversível mais adicional à dihydroresorufin incolor de acordo com Uzarski et al.12. Por favor clique aqui para ver uma versão maior desta figura.
| Cyanocobalamin | 0, 50 g |
| ácido 4-aminobenzoico | 0, 50 g |
| D-biotina | 0, 10 g |
| Ácido nicotínico | 0,100 g |
| Piridoxina | 0,250 g |
| D-ácido pantotênico | 0, 25 g |
| Cloreto de thiaminium HCl | 0,18 g |
| Água destilada | 1000 mL |
Tabela 1: solução vitamínica.
| HCl de 25% (w/v) | 10,0 mL |
| FeCl2 x 4 H2O | 1,50 g |
| ZnCl2 | 0, 70 g |
| MnCl2 x 4 H2O | 0,100 g |
| H3Bo3 | 0, 6 g |
| CoCl2 x 6 H2O | 0,190 g |
| Cubo2 x 2 H2O | 0, 2 g |
| NiCl2 x 6 H2O | 0, 24 g |
| Nd2Moo4 x 2 H2O | 0, 36 g |
| Água destilada | 990,0 mL |
| Recomendação de preparação | Adicionar HCl e dissolver FeCl2, adicionar 100 ml de água destilada, dissolver os outros ingredientes, e fazer até 1000 ml. |
Tabela 2: solução de elemento de rastreamento.
| Nacl | 1,0 g |
| MgCl2 x 6 H2O | 0,4 g |
| KH2po4 | 0,2 g |
| Kcl | 0,5 g |
| CaCl2 x 2 H2O | 0,15 g |
| L-cisteína | 0,5 g |
| Extrato de levedura | 1,0 g |
| Solução de resazurin | 1 mL de |
| Solução vitamínica | 1 mL de |
| Solução de elemento de rastreamento | 1 mL de |
| Água destilada | 1000 mL |
| Ph | 7,2 |
Tabela 3: meio de sal mínimo.
| Variável | Unidade | Descrição |
| tY | d | Timepoint da medida |
| tX | d | Timepoint da medida precedente |
| pM | mbar | Sobrepressão medida em tY |
| pA | mbar | Pressão ambiental em tY |
| pAX | mbar | Pressão ambiental em tX |
| (S o) | mbar | Pressão padrão, 1013, 25 mbar ACC. DIN 1343 |
| TI | K | Temperatura de incubação |
| tanySales | K | Temperatura padrão, 273, 15 K (corresponde a 0 ° C) ACC. DIN 1343 |
| VH | ml | Volume headspace em tY |
| VHX | ml | Volume headspace em tX |
| CH4% | [VOL%] | Concentração de metano de acordo com a GC-Measurement em tY |
| CH4% X | [VOL%] | Concentração de metano de acordo com a GC-Measurement em tX |
| VCH4T | NML | Quantidade total de metano no frasco de soro em tY |
| VCH4R | NML | Quantidade residual de metano no headspace em tX |
| VCH4N | NML | Metano recém-produzido de tX para tY |
Tabela 4: Descrição das variáveis na equação 1-3.
Discussão
O passo mais importante e crítico na cultura de microrganismos anaeróbios é garantir condições livres de oxigênio em meios de cultivo e headspace de garrafas. Um indicador como o resazurin pode ser usado para verific indiretamente o enchimento anaeróbio correto dos frascos. Resazurin é um corante redox comumente usado como é barato, não-tóxico, e já eficaz em doses baixas e tempos de incubação curtos 12. Quando incorporado aos meios de comunicação, o resazurin cor azul primeiro passa por uma etapa de redução irreversível para resorufin, que é rosa em valores de pH neutro. Esta primeira reação pode ocorrer quando os meios são aquecidos 13. Subseqüentemente, o resorufina é reduzido à dihydroresorufin incolor em uma reação secundária reversível (Figura 7)12. O sistema redox de resorufin/dihydroresorufin torna-se completamente incolor em um potencial oxidação-redução padrão de aproximadamente Eh =-110 MV e transforma-se cor-de-rosa acima de um potencial redox de-51 MV 13.
A fim de reduzir ainda mais o potencial redox, por exemplo, para facilitar o crescimento de microrganismos metanogênicos conhecidos por exigir menos de-200 mV14, uma solução na2S pode ser adicionada. Alternativamente, cisteína-HCL, sódio-tioglycolate, ou ditionito sódica são comumente usados. No entanto, qual agente redutor é apropriado para uso depende da respectiva configuração experimental e pode exigir atenção especial. Por exemplo, o tioglicolato do sódio precisa a ativação da temperatura (por exemplo, por autoclaving).
Um consórcio microbiano bem equilibrado, composto por vários gêneros de bactérias e archaea, e uma cascata de degradação anaeróbia de trabalho eficiente pode ainda ser avaliada através da determinação da composição do gás de headspace nos frascos de cultura através de gás Cromatografia. Ao manusear compostos como os ácidos fenílicos derivados de diferentes precursores, a avaliação do headspace é uma maneira rápida de verificar o processo de metanogênese8. Um headspace CH4 concentração de aproximadamente 50-60% nos controles no final do período de incubação indica uma utilização bem-sucedida dos nutrientes aplicados e, portanto, uma mineralização de material orgânico em condições anaeróbias. A produção teórica do metano e as concentrações expectable do metano durante o processo da digestão podem ser determinadas ex ante de acordo com a equação de Buswell-Boyle após a análise elementar do substrato ou estimando o índice de carboidratos, proteínas e gorduras no substrato. De acordo com a VDI 4630 15, carboidratos podem levar a uma produção teórica de biogás de 750 l kg-1 VSS (50% ch4 e 50% CO2), proteínas para 800 l kg-1 VSS (72% ch4 e 28% co2), e gorduras para 1.390 l kg -1 de VSS (60% CH4 e 40% co2).
Além disso, a formação e a possível degradação subsequente de VFAs e ácidos fenílicos foram monitoradas. O processo de degradação pode ser avaliado analisando-se as concentrações de VFA (por exemplo, acetato, propionato) em diferentes pontos temporais. O acúmulo de ácidos graxos de cadeia curta como acetato e/ou propionato pode apontar para distúrbios na composição da Comunidade metanogênica e para uma sobrecarga geral do reator. No entanto, uma cascata de degradação microbiana bem equilibrada pode até mesmo lidar com concentrações muito elevadas de VFA e acetato9. Além disso, a relação Acetato/propionato pode fornecer informações sobre a condição geral do reator16. No entanto, há muitos parâmetros adequados para o monitoramento de processos que devem ser selecionados de acordo com as hipóteses experimentais propostas. No presente exemplo, as variáveis-alvo foram concentrações de ácido fenílico (Figura 6).
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Esta pesquisa foi financiada pelo Austrian Science Fund (FWF): números de projeto P 29360 e P 29143. A publicação foi apoiada por Publikationsfonds der Universität Innsbruck. Reconhecemos muito a EIG.
Materiais
| Name | Company | Catalog Number | Comments |
| culture flasks (120 mL, N20) | Ochs, Germany | 102046 | |
| buty rubber septa (N20) | Ochs, Germany | 102049 | |
| aluminium caps (N20) | Ochs, Germany | 102050 | |
| N2 gas | Messer, Austria | purity 5.0 | |
| syringes + cannulae | various | ||
| crimper | Ochs, Germany | 102051 | |
| de-crimper | Ochs, Germany | 102052 | |
| GC2010 | Shimadzu | ||
| Shin-carbon GC column | Restek | chromatographic separation of H2, O2, CH4, and CO2 | |
| HPLC Prominence | Shimadzu | ||
| Fast Fruit HPLC Column | Phenomenex | chromatographic separation of VFAs, phenyl acids, etc. |
Referências
- Wiebe, W. J., Pomeroy, L. R., Wiegert, R. G., et al. Anaerobic Respiration and Fermentation. The Ecology of a Salt Marsh. , 137-159 (1981).
- Kim, B. H., Gadd, G. M., Kim, B. H., Gadd, G. M. Anaerobic fermentation. Bacterial physiology and metabolism. , 252-297 (2008).
- Stolz, J. F., Oremland, R. S. Bacterial respiration of arsenic and selenium). FEMS Microbiology Reviews. 23 (5), 615-627 (1999).
- Lackner, N., Hintersonnleitner, A., Wagner, A. O., Illmer, P. Hydrogenotrophic Methanogenesis and Autotrophic Growth of Methanosarcina thermophila. Archaea. 2018 (5), 1-7 (2018).
- Mutschlechner, M., Praeg, N., Illmer, P. The ecological importance of grazing to methane fluxes and engaged microbial communities in alpine forest soils. FEMS Microbiology Ecology. , (2018).
- Prem, E. M., Reitschuler, C., Illmer, P. Livestock grazing on alpine soils causes changes in abiotic and biotic soil properties and thus in abundance and activity of microorganisms engaged in the methane cycle. European Journal of Soil Biology. 62, 22-29 (2014).
- Praeg, N., Wagner, A. O., Illmer, P. Effects of fertilisation, temperature and water content on microbial properties and methane production and methane oxidation in subalpine soils. European Journal of Soil Biology. 65, 96-106 (2014).
- Wagner, A. O., Prem, E. M., Markt, R., Kaufmann, R., Illmer, P. Formation of phenylacetic acid and phenylpropionic acid under different overload conditions during mesophilic and thermophilic anaerobic digestion. Biotechnology for Biofuels. 12 (1), 359 (2019).
- Lins, P., Malin, C., Wagner, A. O., Illmer, P. Reduction of accumulated volatile fatty acids by an acetate-degrading enrichment culture. FEMS Microbiology Ecology. 71 (3), 469-478 (2010).
- Wagner, A. O., Hohlbrugger, P., Lins, P., Illmer, P. Effects of different nitrogen sources on the biogas production - a lab-scale investigation. Microbiological research. 167 (10), 630-636 (2012).
- Wagner, A. O., et al. Sample preparation, preservation, and storage for volatile fatty acid quantification in biogas plants. Engineering in Life Sciences. 17 (2), 132-139 (2017).
- Uzarski, J. S., DiVito, M. D., Wertheim, J. A., Miller, W. M. Essential design considerations for the resazurin reduction assay to noninvasively quantify cell expansion within perfused extracellular matrix scaffolds. Biomaterials. 129, 163-175 (2017).
- Costilow, R. N., Breznak, J. A., Marzluf, G. A., et al. Physicochemical Factors in Growth. Methods for General and Molecular Microbiology. , 309-329 (2007).
- Le Mer, J., Roger, P. Production, oxidation, emission and consumption of methane by soils: a review. European Journal of Soil Biology. 37 (1), 25-50 (2001).
- . Verein deutscher Ingenieure VDI 4630: Fermentation of organic material. VDI Richtlinien. , (2006).
- Wagner, A. O., Reitschuler, C., Illmer, P. Effect of different acetate: Propionate ratios on the methanogenic community during thermophilic anaerobic digestion in batch experiments. Biochemical Engineering Journal. 90, 154-161 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados