Method Article
Preparación media para el cultivo de microorganismos bajo condiciones estrictamente anaeróbicas/anóxicos
* Estos autores han contribuido por igual
En este artículo
Resumen
Como los organismos anaeróbicos obligatorios son incapaces de crecer al exponerse al oxígeno, el uso de técnicas de cultivo anaeróbico es indispensable. Aquí, demostramos un método simple y eficaz para cultivar un cultivo mixto derivado de una planta de biogás desde la preparación de medios hasta la cuantificación de gases y ácidos grasos volátiles.
Resumen
A diferencia de los organismos aeróbicos, los microorganismos estrictamente anaeróbicos requieren la ausencia de oxígeno y, por lo general, un bajo potencial de redox para iniciar el crecimiento. Como el oxígeno es omnipresente en el aire, conservar las condiciones libres de O2durante todos los pasos del cultivo es un reto, pero un requisito previo para el cultivo anaeróbico. El protocolo presentado aquí demuestra el cultivo exitoso de un cultivo mixto anaeróbico derivado de una planta de biogás utilizando un método simple y barato. Se da una descripción precisa de todo el proceso de cultivo anóxico, incluida la preparación de los medios de cultivo, el llenado de matraces de cultivo, la suplementación con indicador de redox y los agentes reductores para proporcionar bajos potenciales de redox, así como el intercambio del espacio de la cabeza para mantener libres de oxígeno. Además, se proporciona una descripción detallada de los matraces séricos herméticos de gas (mediante el uso de jeringas y agujas estériles) y condiciones de incubación adecuadas. El presente protocolo se ocupa además del muestreo de gases y líquidos para análisis posteriores relativos a la composición del gas y las concentraciones de ácidos grasos volátiles mediante cromatografía de gases (GC) y cromatografía líquida de alto rendimiento (HPLC), respectivamente, y la cálculo del biogás y el rendimiento del metano teniendo en cuenta la ley de gas ideal.
Introducción
En la tierra oxígeno molecular en concentraciones notables está disponible en áreas que tienen contacto directo con la atmósfera o en presencia de fototróficos oxigenados. Los entornos en los que el oxígeno está ausente se denominan anaeróbicos. Sin embargo, la conversión de energía todavía es posible en condiciones anaeróbicas a través de dos procesos metabólicos diferentes, fermentación y respiración anaeróbica1.
Mientras que los organismos sometidos a respiración aeróbica están utilizando oxígeno como un aceptador de electrones terminal, la respiración anaeróbica requiere aceptadores de electrones alternativos como nitrato o sulfato2. En la llamada "torre de electrones", las parejas redox se organizan de acuerdo a su potencial redox, con los más negativos situados en la parte superior (donantes de electrones) y los agentes de oxidación más fuertes con potencial redox positivo en la parte inferior (aceptadores de electrones). La transferencia de electrones entre donantes y aceptadores conduce a la conservación de la energía a través de la llamada cadena respiratoria y los electrones pueden ser capturados por los aceptadores de electrones - para permanecer en la imagen - en diferentes pisos de la torre. Por lo tanto, cuanto mayor sea la caída de electrones a través de la torre de electrones, más energía se puede conservar por la reacción respectiva. Por lo tanto, la respiración también es posible en hábitats anaeróbicos, por ejemplo, con pares de oxox rojo incluyendo NO3-/NO2-, ácido fumarico/ácido succínico, SO32-/ H2S, S /H2S, Mn(IV)/Mn(II ), Fe(III)/Fe(II)2,3. En primer lugar, la energía resultante se conserva como potencial de membrana, que posteriormente es utilizado por la fosforilación de transporte de electrones para la síntesis de adenosina-trifosfato (ATP) por membrana unida ATP-synthasas. A diferencia de la respiración aeróbica, la cantidad de energía que puede ser conservada por la respiración anaeróbica puede reducirse drásticamente; sin embargo, la producción de energía de la mayoría de las respiraciones anaeróbicas es aún mayoren comparación con la fermentación, una ruta de conservación de energía anaeróbica en hábitats que carecen de oxígeno y otros aceptadores de electrones terminales 2.
Durante la fermentación, los sustratos orgánicos ricos en energía se degradan a varios productos de fermentación que a menudo definen el nombre del proceso general, por ejemplo, la fermentación alcohólica. A diferencia de los procesos de respiración, la generación de ATP durante la fermentación se limita a la fosforilación a nivel desustrato durante la cual un grupo de fosfato se transfiere a adenosina-difosfato (ADP) a partir de un sustrato fosforilado rico en energía 2. Los microorganismos fermentadores desempeñan un papel central en la degradación anaeróbica de la materia orgánica, ya que son actores clave en la descomposición del sustrato. Los productos de fermentación primaria, como los ácidos orgánicos, alcoholes, CO2y H2,pueden ser utilizados posteriormente por microorganismos de fermentación secundaria para producir ácido acético, CO2y H2. Ejemplos para los productos de fermentación incluyen ácido láctico, varios ácidos grasos volátiles (formático-, acético-, propionic-, butírico-, ácido valerico), n-butanol, 2,3-butandiol, acetona, y etanol.
El cultivo de microorganismos en condiciones estrictamente anaeróbicas requiere métodos y equipos completamente diferentes en comparación con el cultivo de organismos aeróbicos. Mientras que los organismos tolerantes al oxígeno a menudo se cultivan en platos de agar, los llamados cultivos superficiales, esto es - con algunas excepciones - difícilmente posible para los microorganismos estrictamente anaeróbicos. Por lo tanto, los cultivos de enriquecimiento de microorganismos estrictamente anaeróbicos se establecen principalmente en medios líquidos que aplican recipientes de cultivo sellados con septos herméticos a gas que aseguran una atmósfera de espacio libre de oxígeno4,6, 7.
La descripción actual del protocolo proporcionará métodos de cultivo adecuados para los microorganismos objetivo de una población mixta derivados de una planta de biogás anaeróbico. El aislamiento y el cultivo de las culturas puras es aún más difícil, pero no parte de esta obra.
Aquí, mostramos el procedimiento para el cultivo de una comunidad microbiana anaeróbica basada en unestudio sobre la formación de ácidos fenil durante la digestión anaeróbica de sustratos proteicos 8. La comunidad microbiana estaba formada por miembros de las cuatro fases de la digestión anaeróbica: hidrólisis, acidogénesis, acetogénesis y metanogénesis. Se aplicó un medio de sal mineral complementado con una fuente de carbono, redox-indicador, solución de vitamina y oligoelemento, y agente reductor9. El medio fue modificado con los respectivos sustratos precursores de fenilácido proteico8.
Protocolo
1. Preparación del medio
- Preparar la solución de stock del indicador redox (0,1 g de solución acuosa de resazurina/100 ml).
- Preparar la solución vitamínico (Tabla1).
- Preparar la solución de oligoelementos (Tabla 2).
NOTA: El orden de adición es importante; consulte el Cuadro 2 y los protocolos respectivos. - Preparar la solución de stockde agente reductor (60 g Den2 S/L solución acuosa).
- Pesar ingredientes medianos (medio de sal mineral, Tabla 3) en un matraz adecuado (p. ej., matraz de laboratorio de tapa de tornillo de 1 L).
NOTA: Dependiendo de la configuración experimental, la adición de una fuente de carbono separada podría ser necesaria. - Añadir medio volumen de agua destilada (Tabla 3) y disolver los ingredientes.
- Añadir 1 ml de solución indicadora redox según el Cuadro 3.
- Agregue la solución de vitamina y oligoelementos de acuerdo con la Tabla 3.
- Ajuste el pH de acuerdo con los requisitos medios/organismos del Cuadro3.
NOTA: El color del indicador redox depende del pH y puede requerir algún tiempo para ajustarse. - Llevar a un volumen final de 1 L con agua destilada.
NOTA: Las soluciones de vitaminas y oligoelementos también se pueden añadir después de autoclave añadiendo asépticamente una alícuota esterilizada por filtro (soluciones diluidas, tamaño de poro de filtro < 0,2 m) en matraces de suero previamente cerrados y autoclave. Sin embargo, este enfoque conlleva un riesgo elevado de contaminación.
2. Relleno de frascos de cultivo
- Limpie y seque completamente los matraces séricos de 120 ml.
NOTA: Los matraces séricos están disponibles en diferentes capacidades de volumen (por ejemplo, 20, 60, 120, 250 ml). - Septa de goma de butilo completamente limpia y seca.
- Pesar componentes medianos adicionales (por ejemplo, sustratos precursores de fenil) en los matraces de cultivo.
NOTA: Los componentes adicionales dependen de la configuración experimental y la hipótesis. - Llene los matraces séricos con 50 ml de medio.
3. Reducción/eliminación de oxígeno en la fase líquida
- Preparar un baño de agua de 100oC.
- Poner matraces de suero rellenos en el baño de agua e incubar durante aprox. 20-30 min para reducir la solubilidad de O2 en la fase líquida.
- Enjuague el espacio de la cabeza inmediatamente con N2 gas o alternativamente con otras mezclas de gas o gas como N 2/CO2.
ADVERTENCIA: Cuidar la ventilación adecuada de la habitación. - Cierre los matraces con septo de goma de butilo y fije con tapas de aluminio.
NOTA: El tabique de goma a menudo puede encajar mejor en el cuello del matraz añadiendo una gota de agua/medio mientras lo perfora. - Añadir 0,1 ml de agente reductor (solución en stock) a cada matraz lleno de 50 ml de medio para reducir aún más el potencial de redox (0,1 ml de agente reductor por 50 ml de medio).
- Autoclave a 20 min a 121oC.
ADVERTENCIA: Se debe utilizar un autoclave certificado para la esterilización de recipientes cerrados. De lo contrario, la sobrepresión derivada del aumento de la temperatura podría hacer que los matraces de suero exploten.
4. Inoculación del medio
- Preparar el inóculo del digestor anaeróbico.
- Añadir 400 ml de agua destilada en un matraz y llevarla a ebullición.
- Enfriar (< 30 oC) mientras se vacía permanentemente el espacio de la cabeza con N2.
- Añadir aprox. 100 g de lodos derivados de un digestor anaeróbico.
NOTA: Evite el contacto excesivo de lodos con oxígeno. - Registre la masa exacta de lodos añadidos para la determinación exacta de la dilución.
- Cambie el espacio de la cabeza del matraz con N2 y ciérrelo con un tabique de goma de butilo.
- Agitar el matraz durante 30 min a 120 rpm.
- Retire el inóculo de 5 ml utilizando jeringa + cánula e inyecte en matraces séricos preparados como se describe en el paso 1-3.
5. Incubación, muestreo y análisis
- Incubar matraces séricos inoculados a una temperatura apropiada para el experimento respectivo.
NOTA: La temperatura de incubación depende de la configuración experimental y del inóculo utilizado.- Sobrepresión de drenaje resultante del aumento de temperatura con jeringa + cánula, cuando el líquido en los matraces séricos se ha equilibrado a la temperatura de incubación (alrededor de 15 – 30 min, dependiendo de la temperatura de incubación).
ADVERTENCIA: Dependiendo del sustrato aplicado, su concentración, temperatura, tiempo de incubación, tipo de inóculo y concentración, la sobrepresión dentro de los matraces puede aumentar hasta > 2 bar de presión y puede hacer que los descomunaciones séricas exploten. Por lo tanto, es obligatorio controlar la sobrepresión utilizando un manómetro y, posteriormente, drenando la sobrepresión con una cánula.
- Sobrepresión de drenaje resultante del aumento de temperatura con jeringa + cánula, cuando el líquido en los matraces séricos se ha equilibrado a la temperatura de incubación (alrededor de 15 – 30 min, dependiendo de la temperatura de incubación).
- Evaluar la producción y composición de biogás durante el tiempo de incubación.
NOTA: El período de incubación puede abarcar de unos días a varias semanas.- Registre la presión atmosférica actual.
- Preparar un manómetro y evaluar la presión dentro de los matraces derivados de la actividad microbiana.
- Agitar los frascos.
- Retire 1 ml de gas en el espacio de cabeza con una jeringa + cánula y mida las concentraciones de H2, O2, CH4y/o CO2 mediante cromatografía de gases.
NOTA: Para la calificación y cuantificación de H2, O2, CH4y CO2, se utilizó un cromatógrafo de gases aplicando temperaturas de funcionamiento de 160 oC (horno de columna), 100 oC (inyector) y 180 oC (detector de conductividad térmica, TCD ). N2 fue utilizado como gas portador. Para obtener más información, consulte los estudios anteriores10.
- Monitorear las concentraciones de ácidos grasos volátiles (VFA) y fenilácidos. Para el análisis de VFA y fenilácido, utilice un sistema HPLC equipado con un detector UV (a 220 nm) que funcione con 5 mM H2SO4 como fase móvil. Para obtener detalles del método e información adicional sobre el almacenamiento de muestras, consulte los estudios anteriores11.
NOTA: El análisis de VFA es ejemplar para muchos otros análisis fisicoquímicos o evaluaciones microscópicas. Además, los métodos biológicos moleculares dirigidos a la abundancia de microorganismos específicos y/o la composición de la comunidad microbiana en un determinado punto del experimento pueden aplicarse mediante el procedimiento descrito.- Retire 1 ml de líquido con jeringa + cánula.
NOTA: Las muestras se pueden congelar (-20 oC) inmediatamente después de la extracción y analizarse al final del experimento11. - Centrifugar a 15.000–20.000 x g y pasar a través de filtros de 0,2 m RC (celulosa regenerada).
- Inyectar 5-20 l en un sistema HPLC y analizar la composición de VFA y la concentración de fenilácidos.
- Retire 1 ml de líquido con jeringa + cánula.
- Escurra la sobrepresión del matraz con una cánula.
NOTA: Después de determinar la presión y la composición del gas, así como tomar cualquier muestra necesaria, vuelva a colocar el matraz de cultivo en la temperatura respectiva y no drene la sobrepresión antes de que el líquido haya alcanzado la temperatura de incubación. - Calcule la producción de biogás y metano VCH4N teniendo en cuenta la ley de gas ideal utilizando la Ecuación 1-3. Consulte también la Tabla 4.
Ecuación 1:
Cual
Ecuación 2: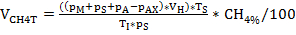
Y
Ecuación 3:
NOTA: Para el cálculo de la producción total de biogás, la cantidad de CH4% y CH4%X en las ecuaciones 2 y 3 debe establecerse en 100. NmL: volumen de gas normalizado en condiciones estandarizadas (0 oC, 1 atm), bajo el cual el volumen de gas molar es de 22.414 NmL/mmol.
Resultados
Los matraces de cultivo se llenaron de medio en condiciones anaeróbicas de acuerdo con el protocolo descrito anteriormente, comprobaron el color adecuado (Figura1),y se utilizaron como biorreactores por lotes en miniatura que realizaban la digestión anaeróbica. Estos fueron modificados con sustratos que potencialmente causaron la formación de fenil-ácido e incubaron utilizando lodos digestores anaeróbicos como inóculo (Figura 2). Triptófano, tirosina y fenilalanina, así como el complejo extracto de carne precursora proteica y caseína se aplicaron en dos y tres concentraciones diferentes, respectivamente. Se prepararon controles sin suplementos de sustrato adicionales. Diferentes concentraciones de sustrato dirigidas a la simulación de diferentes etapas de sobrecarga. Los frascos se incuban a 37oC (mesofílico) durante 4 semanas.
La producción y composición de biogás (H2, CH4, CO2)se monitorizó regularmente a través de cromatografía de gases (GC TCD)10 y evaluación de la presión del espacio de la cabeza. La Figura 3 muestra diferencias en la producción acumulada de metano derivada de la digestión de los sustratos aplicados en concentraciones variadas durante 4 semanas de incubación anaeróbica. Además, los metanogenos se visualizaban irradiando la coenzima F420,un portador de electrones en metanogénesis, exhibiendo una fluorescencia azul-verde con un máximo de absorción de 420 nm (Figura4).
Las muestras simultáneas al análisis de gases, las muestras para las mediciones de VFA y concentración de fenilo a través de HPLC11 se retiraron y almacenaron congeladas hasta su posterior procesamiento. La Figura 5 muestra el efecto de las diferentes etapas de sobrecarga reflejada por una acumulación en muestras altamente sobrecargadas representadas ejemplarmente para el acetato. La Figura 6 representa la dinámica de las concentraciones de acetato de fenilo durante el período de incubación.

Figura 1: Indicador Redox. El potencial correcto de redox en los matraces de cultivo se puede controlar añadiendo un indicador redox. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Biorreactores de lotes en miniatura. Biorreactores de lotes en miniatura preparados en matraces de cultivo de 120 ml para experimentos de digestión anaeróbica. Los frascos se llenaron de lodos de digestor medio e inoculados con diluidos. Los reactores estaban herméticamente sellados con tapones de goma de butilo y tapas de aluminio. Haga clic aquí para ver una versión más grande de esta figura.
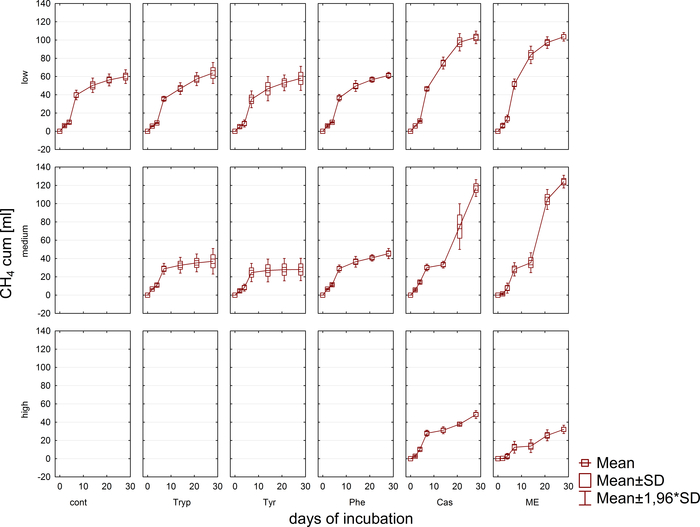
Figura 3: Producción de metano. Producción acumulada de metano durante 28 días de incubación mesofílica a partir de reactores que reflejan diferentes condiciones de sobrecarga (baja, media, alta). Cont: control; Tryp: triptófano; Tyr: tirosina; Phe: fenilalanina; ME: extracto de carne; Cas: caseína. Esta es una cifra modificada que se origina en un estudio anterior8. Haga clic aquí para ver una versión más grande de esta figura.
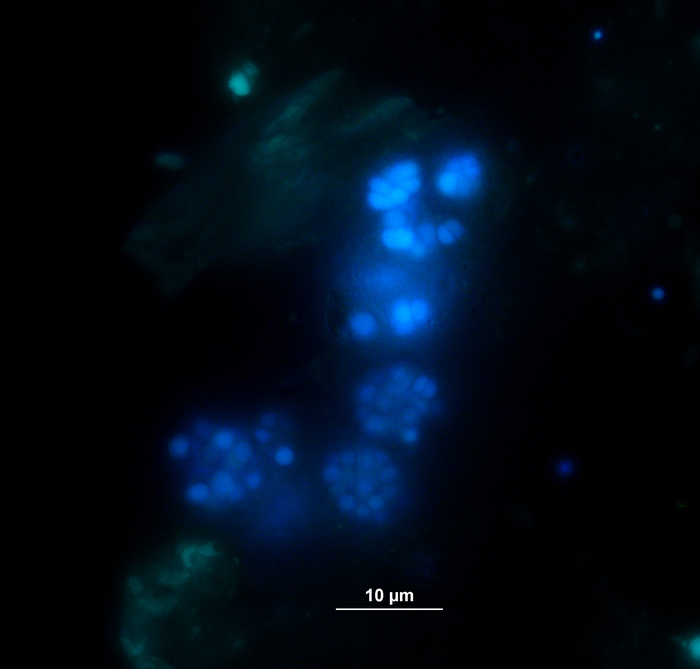
Figura 4: Metanógenos de fluorescencia. Los metanogenos emiten una luz azula cuando se excitan con la luz UV. Aquí, los metanogenos se unen a las partículas de la planta (verde claro). Las muestras se tomaron de un reactor por lotes, se diluyeron para microscopía y se analizaron inmediatamente. Haga clic aquí para ver una versión más grande de esta figura.
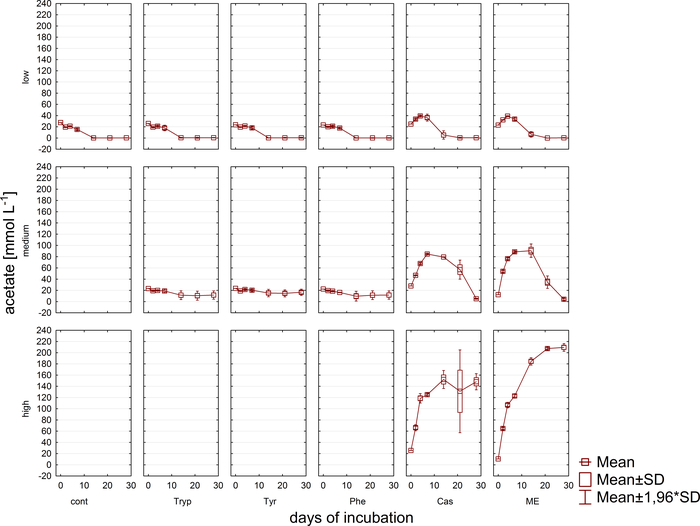
Figura 5: Concentración de acetato. Concentración de acetato durante 28 días de incubación mesofílica en reactores que refleja diferentes condiciones de sobrecarga (baja, media, alta). Cont: control; Tryp: triptófano; Tyr: tirosina; Phe: fenilalanina; ME: extracto de carne; Cas: caseína. Esta es una cifra modificada que se origina en un estudio anterior8. Haga clic aquí para ver una versión más grande de esta figura.
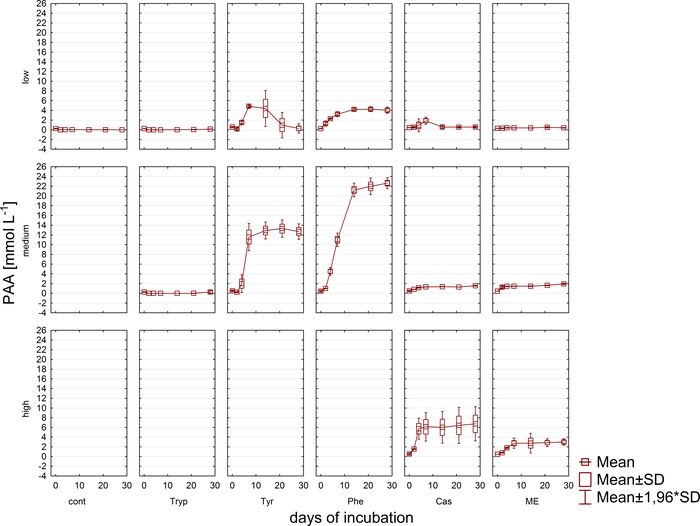
Figura 6: Concentración de fenilacetato. Concentración de fenilacetato durante 28 días de incubación mesofílica en reactores que reflejan diferentes condiciones de sobrecarga (baja, media, alta). Cont: control; Tryp: triptófano; Tyr: tirosina; Phe: fenilalanina; ME: extracto de carne; Cas: caseína. Esta es una cifra modificada que se origina en un estudio anterior8. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Reacción de Resazurin. La resazurina de color azul sufre una reducción irreversible de la resorufina (rosa) y una reducción adicional reversible a la dihidrorresorufina incolora según Uzarski et al.12. Haga clic aquí para ver una versión más grande de esta figura.
| Cianocobalamina | 0.050 g |
| 4-ácido aminobenzoico | 0.050 g |
| D-biotina | 0.010 g |
| Acido nicotínico | 0.100 g |
| Piridoxina | 0.250 g |
| Acido D-pantoténico | 0.025 g |
| Cloruro de tiaminio HCl | 0,18 g |
| Agua destilada | 1000 ml |
Tabla 1: Solución vitamínico.
| 25% (p/v) HCl | 10,0 ml |
| FeCl2 x 4 H2O | 1.50 g |
| ZnCl2 | 0.070 g |
| MnCl2 x 4 H2O | 0.100 g |
| H3BO3 | 0.006 g |
| CoCl2 x 6 H2O | 0.190 g |
| CuCl2 x 2 H2O | 0.002 g |
| NiCl2 x 6 H2O | 0.024 g |
| Na2MoO4 x 2 H2O | 0.036 g |
| Agua destilada | 990.0 mL |
| Recomendación de preparación | Añadir HCl ydisolver FeCl 2, añadir 100 ml de agua destilada, disolver los demás ingredientes, y hacer hasta 1000 mL. |
Tabla 2: Solución de elementos de seguimiento.
| Nacl | 1.0 g |
| MgCl2 x 6 H2O | 0,4 g |
| KH2PO4 | 0,2 g |
| Kcl | 0,5 g |
| CaCl2 x 2 H2O | 0,15 g |
| L-cisteína | 0,5 g |
| Extracto de levadura | 1.0 g |
| Solución de Resazurin | 1 mL |
| Solución vitamínico | 1 mL |
| Solución de elementos de seguimiento | 1 mL |
| Agua destilada | 1000 ml |
| Ph | 7.2 |
Tabla 3: Medio salina mínimo.
| Variable | Unidad | Descripción |
| tY | [d] | Punto de tiempo de medición |
| tX | [d] | Punto de tiempo de la medición anterior |
| pM | [mbar] | Sobrepresión medida en tY |
| pA | [mbar] | Presión ambiental a tY |
| pAX | [mbar] | Presión ambiental a tX |
| pS | [mbar] | Presión estándar, 1013,25 mbar según DIN 1343 |
| TI | [K] | Temperatura de incubación |
| TS | [K] | Temperatura estándar, 273,15 K (corresponde a 0oC) según DIN 1343 |
| VH | [ml] | Volumen del espacio de cabeza en tY |
| VHX | [ml] | Volumen del espacio de cabeza en tX |
| CH4% | [vol%] | Concentración de metano según GC-medida en tY |
| CH4%X | [vol%] | Concentración de metano según gc-medida en tX |
| VCH4T | [Nml] | Cantidad total de metano en el frasco de suero en tY |
| VCH4R | [Nml] | Cantidad de metano residual en el espacio de la cabeza en tX |
| VCH4N | [Nml] | Metano recién producido de tX a tY |
Tabla 4: Descripción de las variables en la Ecuación 1 - 3.
Discusión
El paso más importante y crítico en el cultivo de microorganismos anaeróbicos es garantizar condiciones libres de oxígeno en los medios de cultivo y el espacio en la cabeza de los matraces. Un indicador como la resazurina se puede utilizar para comprobar indirectamente el llenado anaeróbico correcto de los matraces. Resazurin es un tinte redox comúnmente utilizado ya que es barato, no tóxico, y ya eficaz en dosis bajas y corta incubación veces 12. Cuando se incorpora a los medios, la resazurina de color azul primero sufre un paso de reducción irreversible a la resorulina, que es de color rosa a valores de pH neutros. Esta primera reacción puede ocurrir cuando los medios se calientan 13. Posteriormente, la resorufina se reduce a dihidrorresorufina incolora en una reacción secundaria reversible (Figura 7)12. El sistema redox de resorufina/dihidroresorufina se vuelve completamente incoloro en un potencial estándar de reducción de la oxidación de aproximadamente Eh -110 mV y se vuelve rosa por encima de un potencial redox de -51 mV 13.
Con el fin de reducir aún más el potencial de los redox, por ejemplo, para facilitar el crecimiento de microorganismos metanogénicos que se sabe que requieren menos de -200 mV14, se puede añadir una solución Na2S. Alternativamente, cisteína-HCl, tioglicolato de sodio, o ditonita de sodio se utilizan comúnmente. Sin embargo, qué agente reductor es apropiado utilizar depende de la configuración experimental respectiva y podría requerir una atención especial. Por ejemplo, el tioglicolato de sodio necesita activación de la temperatura (por ejemplo, mediante autoclave).
Un consorcio microbiano bien equilibrado, compuesto por varios géneros de bacterias y arqueas, y una cascada de degradación anaeróbica de trabajo eficiente se puede evaluar aún más determinando la composición del gas del espacio de la cabeza en los matraces de cultivo a través del gas Cromatografía. Al manipular compuestos como los fenilácidos derivados de diferentes precursores, la evaluación del espacio de la cabeza es una forma rápida de comprobar el proceso de metanogénesis8. Una concentración de CH4 en el espacio de cabeza de aprox. 50-60% en los controles al final del período de incubación indica una utilización exitosa de los nutrientes aplicados y por lo tanto una mineralización de material orgánico en condiciones anaeróbicas. La producción teórica de metano y las concentraciones de metano esperadas durante el proceso de digestión se pueden determinar ex ante de acuerdo con la ecuación Buswell-Boyle después del análisis elemental del sustrato o estimando el contenido de carbohidratos, proteínas y grasas en el sustrato. Según VDI 4630 15, los carbohidratos pueden conducir a una producción teórica de biogás de 750 L kg-1 VSS (50% CH4 y 50% CO2),proteínas a 800 L kg-1 VSS (72% CH4 y 28 % CO2),y grasas a 1.390 L kg -1 VSS (60% CH4 y 40% CO2).
Además, se monitoreó la formación y posible degradación posterior de los VFA y los fenilácidos. El proceso de degradación se puede evaluar mediante el análisis de las concentraciones de VFA (por ejemplo, acetato, propionato) en diferentes momentos. La acumulación de ácidos grasos de cadena corta como el acetato y/o propionato puede apuntar a alteraciones en la composición de la comunidad metanogénica y a una sobrecarga general del reactor. Sin embargo, una cascada de degradación microbiana bien equilibradapuede incluso hacer frente a concentraciones muy altas de VFA y acetato 9. Además, la relación acetato/propionato podría proporcionar más información sobre el estado general del reactor16. Sin embargo, hay muchos parámetros adecuados para la supervisión de procesos que deben seleccionarse de acuerdo con las hipótesis experimentales propuestas. En el ejemplo actual, las variables diana fueron las concentraciones de fenil (Figura6).
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue financiada por el Fondo De Ciencia de Austria (FWF): números de proyecto P 29360 y P 29143. La publicación fue apoyada por Publikationsfonds der Universitét Innsbruck. Reconocemos en gran medida a la AIE.
Materiales
| Name | Company | Catalog Number | Comments |
| culture flasks (120 mL, N20) | Ochs, Germany | 102046 | |
| buty rubber septa (N20) | Ochs, Germany | 102049 | |
| aluminium caps (N20) | Ochs, Germany | 102050 | |
| N2 gas | Messer, Austria | purity 5.0 | |
| syringes + cannulae | various | ||
| crimper | Ochs, Germany | 102051 | |
| de-crimper | Ochs, Germany | 102052 | |
| GC2010 | Shimadzu | ||
| Shin-carbon GC column | Restek | chromatographic separation of H2, O2, CH4, and CO2 | |
| HPLC Prominence | Shimadzu | ||
| Fast Fruit HPLC Column | Phenomenex | chromatographic separation of VFAs, phenyl acids, etc. |
Referencias
- Wiebe, W. J., Pomeroy, L. R., Wiegert, R. G., et al. Anaerobic Respiration and Fermentation. The Ecology of a Salt Marsh. , 137-159 (1981).
- Kim, B. H., Gadd, G. M., Kim, B. H., Gadd, G. M. Anaerobic fermentation. Bacterial physiology and metabolism. , 252-297 (2008).
- Stolz, J. F., Oremland, R. S. Bacterial respiration of arsenic and selenium). FEMS Microbiology Reviews. 23 (5), 615-627 (1999).
- Lackner, N., Hintersonnleitner, A., Wagner, A. O., Illmer, P. Hydrogenotrophic Methanogenesis and Autotrophic Growth of Methanosarcina thermophila. Archaea. 2018 (5), 1-7 (2018).
- Mutschlechner, M., Praeg, N., Illmer, P. The ecological importance of grazing to methane fluxes and engaged microbial communities in alpine forest soils. FEMS Microbiology Ecology. , (2018).
- Prem, E. M., Reitschuler, C., Illmer, P. Livestock grazing on alpine soils causes changes in abiotic and biotic soil properties and thus in abundance and activity of microorganisms engaged in the methane cycle. European Journal of Soil Biology. 62, 22-29 (2014).
- Praeg, N., Wagner, A. O., Illmer, P. Effects of fertilisation, temperature and water content on microbial properties and methane production and methane oxidation in subalpine soils. European Journal of Soil Biology. 65, 96-106 (2014).
- Wagner, A. O., Prem, E. M., Markt, R., Kaufmann, R., Illmer, P. Formation of phenylacetic acid and phenylpropionic acid under different overload conditions during mesophilic and thermophilic anaerobic digestion. Biotechnology for Biofuels. 12 (1), 359 (2019).
- Lins, P., Malin, C., Wagner, A. O., Illmer, P. Reduction of accumulated volatile fatty acids by an acetate-degrading enrichment culture. FEMS Microbiology Ecology. 71 (3), 469-478 (2010).
- Wagner, A. O., Hohlbrugger, P., Lins, P., Illmer, P. Effects of different nitrogen sources on the biogas production - a lab-scale investigation. Microbiological research. 167 (10), 630-636 (2012).
- Wagner, A. O., et al. Sample preparation, preservation, and storage for volatile fatty acid quantification in biogas plants. Engineering in Life Sciences. 17 (2), 132-139 (2017).
- Uzarski, J. S., DiVito, M. D., Wertheim, J. A., Miller, W. M. Essential design considerations for the resazurin reduction assay to noninvasively quantify cell expansion within perfused extracellular matrix scaffolds. Biomaterials. 129, 163-175 (2017).
- Costilow, R. N., Breznak, J. A., Marzluf, G. A., et al. Physicochemical Factors in Growth. Methods for General and Molecular Microbiology. , 309-329 (2007).
- Le Mer, J., Roger, P. Production, oxidation, emission and consumption of methane by soils: a review. European Journal of Soil Biology. 37 (1), 25-50 (2001).
- . Verein deutscher Ingenieure VDI 4630: Fermentation of organic material. VDI Richtlinien. , (2006).
- Wagner, A. O., Reitschuler, C., Illmer, P. Effect of different acetate: Propionate ratios on the methanogenic community during thermophilic anaerobic digestion in batch experiments. Biochemical Engineering Journal. 90, 154-161 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados