Method Article
Kesinlikle Anaerobik/Anoksik Koşullarda Mikroorganizmaların Yetiştirilmesi için Orta Hazırlık
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Zorunlu anaerobik organizmalar oksijene maruz kaldıktan sonra büyüyemedikleri için anaerobik kültür tekniklerinin kullanımı vazgeçilmezdir. Burada, medya hazırlığından gaz ve uçucu yağ asidi nicelleştirmesine kadar bir biyogaz bitkisinden elde edilen karışık bir kültürü yetiştirmek için basit ve etkili bir yöntem gösteriyoruz.
Özet
Aerobik organizmaların aksine, kesinlikle anaerobik mikroorganizmalar oksijen yokluğu ve büyüme başlatmak için genellikle düşük bir redoks potansiyeli gerektirir. Oksijen havada her yerde olduğu için, ekimin tüm adımları sırasında O2-serbest koşulları istinat zor ama anaerobik kültüriçin bir ön koşuldur. Burada sunulan protokol, basit ve ucuz bir yöntem le biyogaz bitkisinden elde edilen anaerobik karma kültürün başarılı bir şekilde yetiştirilmesinin olduğunu göstermektedir. Tüm anoksik kültür sürecinin kesin bir açıklaması medya hazırlama, yetiştirme şişelerinin doldurulması, redoks indikatörü ile takviyesi ve düşük redoks potansiyeli sağlamak için ajanlar azaltılması yanı sıra tutmak için headspace alışverişi de dahil olmak üzere verilir oksijensiz medya. Ayrıca, aseptik aşılama gaz sıkı serum şişeleri ayrıntılı bir bakış (steril şırınga ve iğneler kullanılarak) ve uygun kuluçka koşulları sağlanır. Bu protokol, gaz kromatografisi (GC) ve yüksek performanslı sıvı kromatografisi (HPLC) kullanılarak gaz bileşimi ve uçucu yağ asidi konsantrasyonları ile ilgili sonraki analizler için gaz ve sıvı numune alma ile ilgili ideal gaz yasası göz önünde bulundurularak biyogaz ve metan veriminin hesaplanması.
Giriş
Dünya üzerinde önemli konsantrasyonlarda moleküler oksijen atmosfer ile doğrudan temas eden alanlarda veya oksijenli fototrofların varlığında mevcuttur. Oksijenin olmadığı ortamlara anaerobik denir. Ancak, enerji dönüşüm hala iki farklı metabolik süreçler, fermantasyon ve anaerobik solunum1ile anaerobik koşullar altında mümkündür.
Aerobik solunum geçiren organizmalar terminal elektron kabul edici olarak oksijen kullanırken, anaerobik solunum nitrat veya sülfat2 gibi alternatif elektron kabul ediciler gerektirir. "Elektron kulesi" olarak adlandırılan, redoks çiftleri en negatif olanlar üstte (elektron donörleri) ve en altta pozitif redoks potansiyeline sahip en güçlü oksidasyon ajanları (elektron alıcıları) ile redoks potansiyellerine göre düzenlenirler. Donörler ve kabul edenler arasındaki elektron transferi sözde solunum zinciri üzerinden enerji tasarrufu yol açar ve elektronlar elektron kabul edenler tarafından yakalanabilir - resimde kalmak için - kulenin farklı katlarında. Bu nedenle, elektronların elektron kulesinden düşmesi ne kadar yüksekse, ilgili reaksiyon la o kadar fazla enerji korunabilir. Bu nedenle, solunum da anaerobik habitatlarda mümkündür, örneğin, NO3dahil redoks çiftleri ile-/NO2-, fumarik asit / süksinik asit, SO32-/H2S, S°/H2S, Mn(IV)/Mn(II ), Fe(III)/Fe(II)2,3. İlk olarak, elde edilen enerji membran potansiyeli olarak korunur, daha sonra membranbağlı ATP-sintalseler tarafından adenozin-trifosfat (ATP) sentezi için elektron taşıma fosforilasyon tarafından kullanılır. Aerobik solunum aksine, anaerobik solunum tarafından korunabilir enerji miktarı önemli ölçüde azaltılabilir; ancak, en anaerobik solunum enerji çıkışı hala fermantasyon ile karşılaştırıldığında daha yüksektir, oksijen ve diğer terminal elektron alıcılar 2 eksik habitatlarda bir anaerobik enerji koruma yolu.
Fermantasyon sırasında, enerji açısından zengin, organik substratlar genellikle genel sürecin adını tanımlayan çeşitli fermantasyon ürünleri, örneğin, alkollü fermantasyon bozulur. Solunum süreçlerinin aksine, fermantasyon sırasında ATP üretimi, enerji açısından zengin fosforlu substrat 2'den adenozin-di-fosfata (ADP) aktarılan substrat düzeyinde fosforilasyon ile sınırlıdır. Fermantasyon mikroorganizmaları, substrat dökümünde anahtar oyuncular oldukları için organik maddenin anaerobik bozulmasında merkezi bir rol oynarlar. Birincil fermantasyon ürünleri, organik asitler gibi, alkoller, CO2, ve H2, daha sonra asetik asit üretmek için ikincil fermantasyon mikroorganizmalar tarafından kullanılabilir, CO2, ve H2. Fermantasyon ürünleri için örnekler laktik asit, çeşitli uçucu yağ asitleri (formik, asetik-, propiyonik-, bütirik-, valeric asit), n-butanol, 2,3-butandiol, aseton ve etanol içerir.
Mikroorganizmaların kesinlikle anaerobik koşullarda yetiştirilmesi, aerobik organizmaların yetiştirilmesine kıyasla tamamen farklı yöntem ve ekipmanlar gerektirir. Oksijene dayanıklı organizmalar genellikle agar yemekleri, sözde yüzey kültürleri üzerinde yetiştirilen iken, bu - birkaç istisna dışında - neredeyse kesinlikle anaerobik mikroorganizmalar için mümkündür. Bu nedenle, kesinlikle anaerobik mikroorganizmaların zenginleştirme kültürleri esas olarak bir oksijen-free headspace atmosfer4sağlamak gaz geçirmez septa ile mühürlü kültür kapları uygulayarak sıvı ortamda kurulmuştur 4,6, 7 .
Mevcut protokol tanımı, anaerobik biyogaz bitkisinden elde edilen karışık popülasyondaki hedef mikroorganizmalar için uygun yetiştirme yöntemleri sağlayacaktır. Saf kültürlerin izole edilmesi ve yetiştirilmesi daha da zor ama bu çalışmanın bir parçası değildir.
Burada, proteinaceous substratların anaerobik sindirim sırasında fenil asitoluşumu ile ilgili bir çalışmaya dayalı bir anaerobik mikrobiyal topluluk yetiştirmek için prosedür göstermek8. Mikrobiyal topluluk anaerobik sindirimin dört evresinden üyelerden oluşuyordu: hidroliz, asidozez, asetongenez ve metanogenez. Bir mineral tuz orta karbon kaynağı ile takviye, redoks-indikatör, vitamin ve iz element çözeltisi ve azaltıcı ajan uygulandı9. Ortam ilgili proteinaceous fenil asit öncüsü substratlarıiledeğiştirilmiştir 8 .
Protokol
1. Orta hazırlanması
- Redoks gösterge stok çözeltisi (0.1 g resazurin/100 mL sulu çözelti) hazırlayın.
- Vitamin çözeltisi hazırlayın (Tablo 1).
- Eser eleman çözeltisi hazırlama (Tablo 2).
NOT: İlave sırası önemlidir; lütfen Tablo 2'ye ve ilgili protokollere bakın. - Azaltıcı ajan stok çözeltisi (60 g Na2S/L sulu çözelti) hazırlayın.
- Uygun bir şişede (örneğin, 1 L vidalı kapak lı laboratuvar şişesi) orta malzemeleri (mineral tuz ortası, Tablo3) tartın.
NOT: Deneysel kuruluma bağlı olarak, ayrı bir karbon kaynağının eklenmesi gerekebilir. - Yarım hacimli distile su ekleyin (Tablo3) ve malzemeleri çözün.
- Tablo3'e göre 1 mL redoks indikatör çözeltisi ekleyin.
- Tablo3'e göre vitamin ve iz element çözeltisi ekleyin.
- PH'ı Tablo3'teki orta/organizma gereksinimlerine göre ayarlayın.
NOT: Redoks göstergesinin rengi pH'ya bağlıdır ve ayarlamak için biraz zaman gerekebilir. - Distile su ile 1 L son hacmine getirin.
NOT: Vitamin ve iz element çözeltileri, daha önce kapalı ve otoklavlı serum şişelerine filtre sterilize edilmiş aliquot (seyreltilmiş çözeltiler, filtre gözenek boyutu < 0,2 μm) eklenerek otoklavlamadan sonra da eklenebilir. Ancak, bu yaklaşım kontaminasyon riski yüksek taşımaktadır.
2. Yetiştirme şişelerinin doldurulması
- Iyice temiz ve kuru 120 mL serum şişeleri.
NOT: Serum şişeleri farklı hacim kapasitelerinde mevcuttur (örn. 20, 60, 120, 250 mL). - Iyice temiz ve kuru bütil kauçuk septa.
- Ekorta mataralarında ek orta bileşenleri (örn. fenil asit öncüsü substratları) tartın.
NOT: Ek bileşenler deneysel kurulum ve hipoteze bağlıdır. - Serum şişelerini 50 mL orta ile doldurun.
3. Sıvı fazda oksijenin azaltılması/çıkarılması
- ~100° C su banyosu hazırlayın.
- Su banyosunda doldurulmuş serum şişeleri ayarlayın ve sıvı fazda O 2'nin çözünürlüğünü azaltmak için yaklaşık 20-30 dakika kuluçkaya yatırın.
- Kafa boşluğunu hemen N2 gazıyla veya alternatif olarak N2/CO2gibi diğer gaz veya gaz karışımlarıyla temizle.
DİkKAT: Uygun oda havalandırmadikkat edin. - Butil kauçuk septa ile şişeleri kapatın ve alüminyum kapaklar ile düzeltmek.
NOT: Kauçuk septa genellikle şişenin boynuna daha iyi sığabilir. - Redoks potansiyelini daha da azaltmak için 50 mL orta ile dolu her şişeye 0,1 mL azaltma maddesi (stok çözümü) ekleyin ve daha da azaltın .
- 121 °C'de 20 dk için otoklav.
DİkKAT: Kapalı damarların sterilizasyonu için onaylı bir otoklav kullanılmalıdır. Aksi takdirde, sıcaklık artışından kaynaklanan aşırı basınç serum şişeleri patlamaya neden olabilir.
4. Ortamın aşılanması
- Anaerobik sindirim den inoculum hazırlayın.
- Bir şişe içine distile su 400 mL ekleyin ve kaynatın getirmek.
- Kafa boşluğunu kalıcı olarak N2ile yıkarsa onu (< 30 °C) soğutun.
- Anaerobik bir digester türetilen çamur yaklaşık 100 g ekleyin.
NOT: Oksijen ile çamuraşırı temas kaçının. - Seyreltmenin tam tayini için eklenen çamurun tam kütlesini kaydedin.
- Şişenin kafa boşluğunu N2 ile değiştirin ve butil kauçuk septumla kapatın.
- 120 rpm 30 dakika için şişe çalkalayın.
- Şırınga + kanül kullanarak 5 mL inokül çıkarın ve adım 1-3 açıklandığı gibi hazırlanan serum şişeleri içine enjekte.
5. Kuluçka, örnekleme ve analiz
- İlgili deney için uygun bir sıcaklıkta incubate incubaulated serum şişeleri.
NOT: Kuluçka sıcaklığı deneysel kuruluma bağlıdır ve inokül kullanılır.- Serum şişelerinde sıvı kuluçka sıcaklığı (yaklaşık 15 - 30 dakika, kuluçka sıcaklığına bağlı olarak) dengelendiğinde, şırınga + kanül kullanarak sıcaklık artışı ndan kaynaklanan aşırı basınç drenaj.
DİkKAT: Uygulanan substrata bağlı olarak konsantrasyonu, sıcaklığı, kuluçka süresi, inokül tipi ve konsantrasyonu, şişeler içindeki aşırı basınç > 2 bar basıncına kadar yükselebilir ve serum pullarının patlamasına neden olabilir. Bu nedenle, bir manometre kullanarak aşırı basıncın izlenmesi ve daha sonra kanülile aşırı basıncın boşaltılsA zorunludur.
- Serum şişelerinde sıvı kuluçka sıcaklığı (yaklaşık 15 - 30 dakika, kuluçka sıcaklığına bağlı olarak) dengelendiğinde, şırınga + kanül kullanarak sıcaklık artışı ndan kaynaklanan aşırı basınç drenaj.
- Kuluçka süresi boyunca biyogaz üretimini ve bileşimini değerlendirin.
NOT: Kuluçka dönemi birkaç gün ile birkaç hafta arasında sürebilir.- Mevcut atmosfer basıncını kaydedin.
- Bir manometre hazırlayın ve mikrobiyal aktiviteden elde edilen şişelerin içindeki basıncı değerlendirin.
- Şişeleri salla.
- Şırınga + kanül kullanarak 1 mL kafa boşluğugazını çıkarın ve gaz kromatografisi yoluyla H 2, O2,CH4ve/veya CO2 konsantrasyonlarını ölçün.
NOT: H2, O2, CH4ve CO 2'nin kalifikasyonu ve niceliği için 160 °C (kolon fırın), 100 °C (enjektör) ve 180 °C (ısı iletkenliği dedektörü, TCD) çalışma sıcaklıkları uygulanarak gaz kromatografı kullanılmıştır. ). N2 taşıyıcı gaz olarak kullanılmıştır. Ayrıntılar için, önceki çalışmalara bakın10.
- Uçucu yağ asitleri (VFA) ve fenil asit konsantrasyonlarını izleyin. VFA ve fenil asit analizi için, mobil faz olarak 5 mM H2SO4 ile çalışan uv dedektörü (220 nm) ile donatılmış bir HPLC sistemi kullanın. Yöntemin ayrıntıları ve örnek depolama ile ilgili ek bilgiler için lütfen önceki çalışmalara bakın11.
NOT: VFA analizi diğer birçok fiziko-kimyasal analiz veya mikroskobik değerlendirmeler için örnek teşkil etmektedir. Ayrıca, deney belirli bir noktada belirli mikroorganizmaların bolluğunu ve/veya mikrobiyal topluluğun bileşimini hedefleyen moleküler biyolojik yöntemler, açıklanan prosedür kullanılarak uygulanabilir.- Şırınga + kanül ile 1 mL sıvı çıkarın.
NOT: Numuneler çekilmeden hemen sonra dondurulabilir (-20 °C) ve deney sonunda analiz edilebilir11. - 15.000-20.000 x g'de santrifüj ve 0.2 μm RC (rejenere selüloz) filtreden geçer.
- Bir HPLC sistemine 5-20°L enjekte edin ve VFA bileşimi ve fenil asit konsantrasyonu için analiz edin.
- Şırınga + kanül ile 1 mL sıvı çıkarın.
- Drenaj şişesi kanül kullanarak aşırı basınç.
NOT: Basınç ve gaz bileşimini belirledikten ve gerekli numuneyi aldıktan sonra, ekim şişesini ilgili sıcaklığa geri yerleştirin ve sıvı kuluçka sıcaklığına ulaşamadan aşırı basıncı boşaltmayın. - Denklem 1-3 kullanarak ideal gaz yasasını göz önünde bulundurarak biyogaz ve metan üretimi VCH4N'yi hesaplayın. Lütfen Tablo4'e de bakın.
Denklem 1:
Mademki
Denklem 2: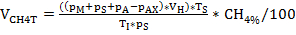
Ve
Denklem 3:
NOT: Toplam biyogaz üretiminin hesaplanmasında, 2 ve 3 denklemindeki CH%4 ve CH%4 X miktarı 100 olarak ayarlanmalıdır. NmL: standart koşullar altında normalleştirilmiş gaz hacmi (0 °C, 1 atm), molar gaz hacmi 22.414 NmL/mmol altında.
Sonuçlar
Yetiştirme şişeleri yukarıda açıklanan protokole göre anaerobik koşullar altında ortam iledoldurulmuş, uygun renk için kontrol (Şekil 1), ve anaerobik sindirim yürüten minyatür toplu biyoreaktörler olarak kullanılmıştır. Bunlar fenil-asit oluşumuna neden olabilecek substratlarla değiştirilmiş ve inokül gibi anaerobik sindirim çamurukullanılarak kuluçkaya yatırılmış (Şekil 2). Triptofan, tirozin ve fenilalaninin yanı sıra kompleks proteinaceous öncül et özü ve kazein sırasıyla iki ve üç farklı konsantrasyonda uygulandı. Kontroller ek substrat takviyesi olmadan hazırlandı. Aşırı yük farklı aşamalarısimülasyon amaçlayan farklı substrat konsantrasyonları. Şişeler 4 hafta boyunca 37 °C 'de (mezofilik) kuluçkaya yatırıldı.
Biyogaz üretimi ve bileşimi (H2, CH4, CO2) gaz kromatografisi (GC TCD)10 ve kafa boşluğu basıncının değerlendirilmesi ile düzenli olarak izlendi. Şekil 3, 4 haftalık anaerobik kuluçka döneminde uygulanan substratların çeşitli konsantrasyonlarda sindiriminden elde edilen kümülatif metan üretimindeki farklılıkları göstermektedir. Ayrıca metanojenler, metanogenezdeki bir elektron taşıyıcısı olan F420koenziminin ışınlanmasıyla, maksimum 420 nm'de emilimi olan mavi-yeşil floresan göstererek görselleştirildi (Şekil 4).
Gaz analizine eş zamanlı olarak, VFA ve Fenil asit konsantrasyonu ölçümleri için HPLC11 ile numuneler geri çekildi ve daha fazla işleme kadar dondurulmuş olarak depolandı. Şekil 5, asetat için örnek olarak betimlenen aşırı yüklü örneklerdeki bir birikim tarafından yansıtılan farklı aşırı yük aşamalarının etkisini göstermektedir. Şekil 6 kuluçka döneminde fenil asetat konsantrasyonlarının dinamiklerini gösteriş.

Şekil 1: Redoks göstergesi. Yetiştirme şişelerinde doğru redoks potansiyeli bir redoks göstergesi eklenerek kontrol edilebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Minyatür toplu biyoreaktörler. Minyatür toplu biyoreaktörler anaerobik sindirim deneyleri için 120 mL yetiştirme şişeleri hazırlanan. Şişeler orta ile doldurulmuş ve seyreltilmiş digester çamur ile aşılanmış. Reaktörler bütil kauçuk durdurucular ve alüminyum kapaklarla sıkıca kapatılmıştı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
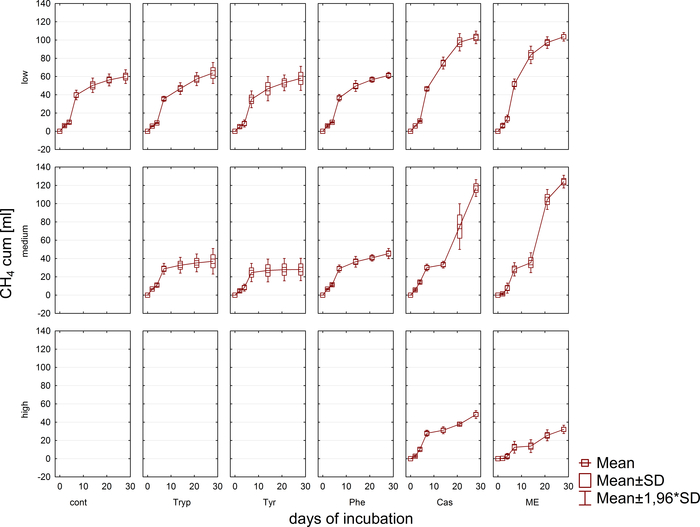
Şekil 3: Metan üretimi. Farklı aşırı yük koşullarını yansıtan reaktörlerden 28 günlük mezofilik kuluçka döneminde kümülatif metan üretimi (düşük, orta, yüksek). Cont: kontrol; Tryp: triptofan; Tyrozin: tirozin; Phe: fenilalanin; ME: et özü; Cas: kazein. Bu daha önceki bir çalışma8kaynaklanan değiştirilmiş bir rakamdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
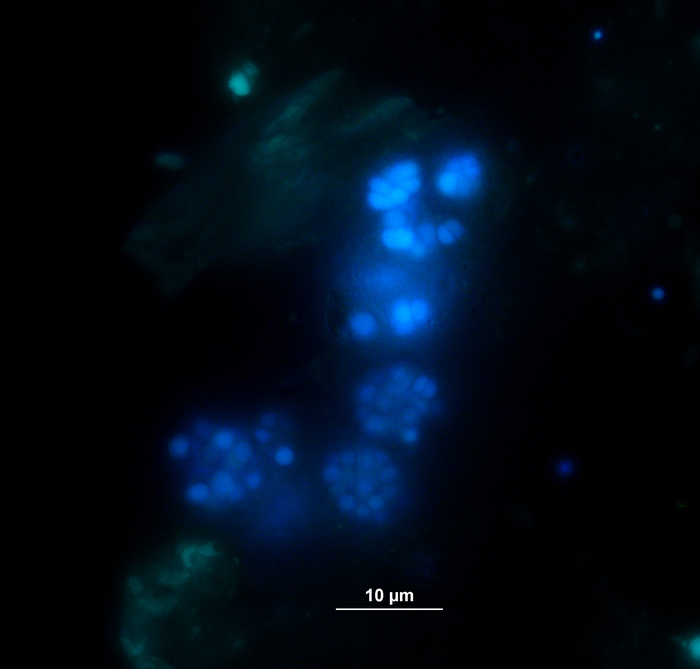
Şekil 4: Floresan metanojenler. Metanojenler UV ışığı ile heyecanlanırken mavimsi bir ışık yalarlar. Burada, metanojenler bitki parçacıkları (açık yeşil) bağlı. Numuneler bir toplu reaktörden alındı, mikroskopi için seyreltildi ve hemen analiz edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
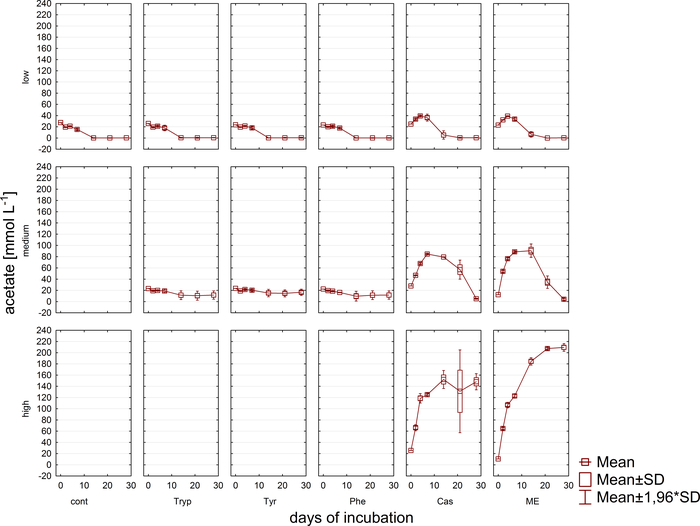
Şekil 5: Asetat konsantrasyonu. Farklı aşırı yük koşullarını yansıtan reaktörlerde 28 günlük mezofilik kuluçka döneminde asetat konsantrasyonu (düşük, orta, yüksek). Cont: kontrol; Tryp: triptofan; Tyrozin: tirozin; Phe: fenilalanin; ME: et özü; Cas: kazein. Bu daha önceki bir çalışma8kaynaklanan değiştirilmiş bir rakamdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
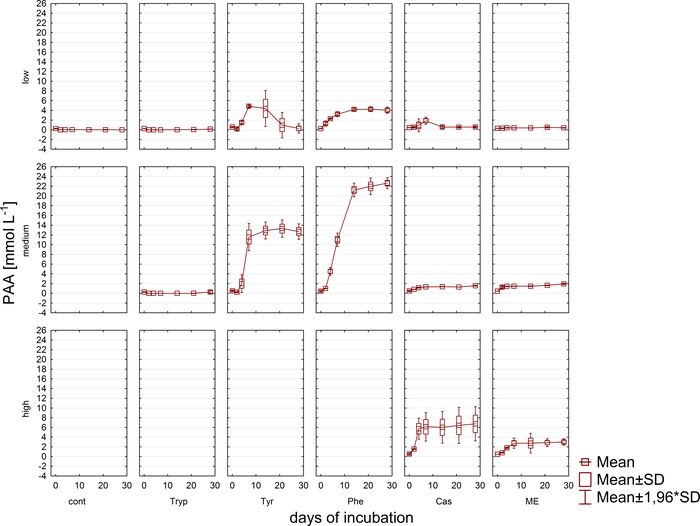
Şekil 6: Fenilat konsantrasyonu. Farklı aşırı yük koşullarını yansıtan reaktörlerde 28 günlük mezofilik kuluçka döneminde fenilat konsantrasyonu (düşük, orta, yüksek). Cont: kontrol; Tryp: triptofan; Tyrozin: tirozin; Phe: fenilalanin; ME: et özü; Cas: kazein. Bu daha önceki bir çalışma8kaynaklanan değiştirilmiş bir rakamdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: Resazurin reaksiyonu. Mavi renkli resazurin uzarski ve ark.12göre resorufin (pembe) ve renksiz dihidroresorufin için daha geri dönüşümlü bir azalma geri dönüşümsüz bir azalma uğrar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Siyanokobalamin | 0,050 g |
| 4-aminobenzoik asit | 0,050 g |
| D-biotin | 0,010 g |
| Nikotinik asit | 0,100 g |
| Piridoksin | 0,250 g |
| D-pantotenik asit | 0,025 g |
| Tiamin klorür HCl | 0,18 g |
| Distile su | 1000 mL |
Tablo 1: Vitamin çözeltisi.
| %25 (w/v) HCl | 10.0 mL |
| FeCl2 x 4 H2O | 1.50 g |
| ZnCl2 | 0,070 g |
| MnCl2 x 4 H2O | 0,100 g |
| H3BO3 | 0,006 g |
| CoCl2 x 6 H2O | 0.190 g |
| CuCl2 x 2 H2O | 0,002 g |
| NiCl2 x 6 H2O | 0,024 g |
| Na2MoO4 x 2 H2O | 0,036 g |
| Distile su | 990.0 mL |
| Hazırlık önerisi | HCl ekleyin ve FeCl2çözünür, 100 mL distile su ekleyin, diğer maddeleri çözünve 1000 mL kadar makyaj. |
Tablo 2: İzleme öğesi çözümü.
| Nacl | 1.0 g |
| MgCl2 x 6 H2O | 0,4 g |
| KH2PO4 | 0,2 g |
| Kartal | 0,5 g |
| CaCl2 x 2 H2O | 0,15 g |
| L-sistein | 0,5 g |
| Maya özü | 1.0 g |
| Resazurin çözeltisi | 1 mL |
| Vitamin çözeltisi | 1 mL |
| İzleme öğesi çözümü | 1 mL |
| Distile su | 1000 mL |
| Ph | 7.2 |
Tablo 3: Minimal tuz orta.
| Değişken | Birim | Açıklama |
| tY | [d] | Ölçüm zaman noktası |
| tX | [d] | Önceki ölçümün zaman dilimi |
| pM | [mbar] | T Y'de ölçülen aşırı basınç |
| pA | [mbar] | t Y'de ortam basıncı |
| pAX | [mbar] | t X'te ortam basıncı |
| pS | [mbar] | Standart basınç, 1013,25 mbar acc. DIN 1343 |
| TI | [K] | Kuluçka sıcaklığı |
| TS | [K] | Standart sıcaklık, 273,15 K (0°C'ye karşılık gelir) acc. DIN 1343 |
| VH | [ml] | T Y'de headspace hacmi |
| VHX | [ml] | T X'te kafa boşluğu hacmi |
| CH%4 | [vol%] | T Y'de GC ölçümüne göre metan konsantrasyonu |
| CH%4 X | [vol%] | T X'te GC ölçümüne göre metan konsantrasyonu |
| VCH4T | [Nml] | T Y'deki serum şişesindeki toplam metan miktarı |
| VCH4R | [Nml] | T X'te kafa boşluğunda artık metan miktarı |
| VCH4N | [Nml] | T X'ten t Y'ye yeni üretilen metan |
Tablo 4: Denklem 1 - 3'teki değişkenlerin tanımı.
Tartışmalar
Anaerobik mikroorganizmaların kültüre atılmasında en önemli ve kritik adım, yetiştirme ortamlarında ve şişelerin kafa boşluğunda oksijensiz koşullar sağlamaktır. Resazurin gibi bir gösterge dolaylı olarak şişelerin doğru anaerobik dolgu kontrol etmek için kullanılabilir. Resazurin ucuz olduğu gibi yaygın olarak kullanılan redoks boya, toksik olmayan, ve zaten düşük dozlarda ve kısa kuluçka süreleri etkili 12. Ne zaman medya dahil, mavi renkli resazurin ilk nötr pH değerlerinde pembe resorufin için geri dönüşü olmayan bir azaltma adımı uğrar. Bu ilk reaksiyon ortam 13ısıtıldığında oluşabilir. Daha sonra, resorufin renksiz dihidroresorufin bir geri dönüşümlü ikincil reaksiyon azalır (Şekil 7)12. Resorufin/dihidroresorufin redoks sistemi, standart oksidasyon azaltma potansiyeline göre tamamen renksiz hale gelir ve yaklaşık Eh = -110 mV ve -51 mV 13redoks potansiyelinin üzerinde pembeye döner.
Redoks potansiyelini daha da azaltmak için, örneğin, -200 mV 14'ten daha azihtiyaç duyduğu bilinen metanojenik mikroorganizmaların büyümesini kolaylaştırmak için, bir Na2S çözeltisi eklenebilir. Alternatif olarak, sistein-HCl, sodyum-tiyoglikolat veya sodyum dithionite yaygın olarak kullanılır. Ancak, hangi azaltma aracısının kullanılması uygundur ilgili deneysel kuruluma bağlıdır ve özel dikkat gerektirebilir. Örneğin, sodyum tiyogliserin sıcaklık aktivasyonu (örneğin, otoklavlama) gerekir.
Bakteri ve Arkelerin çeşitli cinslerinden oluşan dengeli bir mikrobiyal konsorsiyum ve verimli bir şekilde çalışan anaerobik bozulma kaskad, gaz yoluyla kültür şişelerinde kafa boşluğu gaz bileşimi belirlenerek daha da değerlendirilebilir. Kromatografi. Farklı öncüllerden elde edilen fenil asitler gibi bileşikleri işlerken, kafa boşluğunun değerlendirilmesi metanogenez sürecini kontrol etmenin hızlı bir yoludur8. Kuluçka döneminin sonunda kontrollerde yaklaşık %50-60'lık bir headspace CH4 konsantrasyonu, uygulanan besinlerin başarılı bir şekilde kullanılmasını ve böylece anaerobik koşullarda organik maddelerin mineralizasyonunu gösterir. Sindirim işlemi sırasında teorik metan üretimi ve beklenen metan konsantrasyonları substrat temel analizi sonra Buswell-Boyle denklemine göre ex ante belirlenebilir veya içeriğini tahmin ederek substratkarbonhidratlar, proteinler ve yağlar. VDI 4630 15'egöre karbonhidratlar 750 L kg-1 VSS (%50 CH4 ve %50 CO2),proteinlerden 800 L kg-1 VSS'ye (%72 CH4 ve %28 CO2)teorik biyogaz üretimine ve 1.390 L kg'a kadar yağ üretimine yol açabilir -1.02.20 VSS (%60 CH4 ve %40 CO2).
Ayrıca VA'ların ve fenil asitlerin oluşumu ve sonraki bozulmaları izlendi. Bozulma süreci, farklı zaman noktalarında VFA konsantrasyonları (örn. asetat, propiyonat) analiz edilerek değerlendirilebilir. Asetat ve/veya propiyonat gibi kısa zincirli yağ asitlerinin birikmesi, metanojenik topluluk bileşimindeki bozukluklara ve genel bir reaktör aşırı yüküne işaret edebilir. Ancak, iyi dengelenmiş mikrobiyal bozulma kaskad bile çok yüksek VFA ve asetat konsantrasyonları ile başa çıkabilir9. Ayrıca, asetat / propiyonat oranı daha genel reaktör durumu hakkında bilgi sağlayabilir16. Ancak, önerilen deneysel hipotezlere göre seçilmesi gereken proses izleme için uygun birçok parametre vardır. Bu örnekte hedef değişkenler fenil asit konsantrasyonları idi (Şekil 6).
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu araştırma Avusturya Bilim Fonu (FWF) tarafından finanse edilmiştir: proje numaraları P 29360 ve P 29143. Yayın Publikationsfonds der Universität Innsbruck tarafından desteklendi. EIG'yi büyük ölçüde kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| culture flasks (120 mL, N20) | Ochs, Germany | 102046 | |
| buty rubber septa (N20) | Ochs, Germany | 102049 | |
| aluminium caps (N20) | Ochs, Germany | 102050 | |
| N2 gas | Messer, Austria | purity 5.0 | |
| syringes + cannulae | various | ||
| crimper | Ochs, Germany | 102051 | |
| de-crimper | Ochs, Germany | 102052 | |
| GC2010 | Shimadzu | ||
| Shin-carbon GC column | Restek | chromatographic separation of H2, O2, CH4, and CO2 | |
| HPLC Prominence | Shimadzu | ||
| Fast Fruit HPLC Column | Phenomenex | chromatographic separation of VFAs, phenyl acids, etc. |
Referanslar
- Wiebe, W. J., Pomeroy, L. R., Wiegert, R. G., et al. Anaerobic Respiration and Fermentation. The Ecology of a Salt Marsh. , 137-159 (1981).
- Kim, B. H., Gadd, G. M., Kim, B. H., Gadd, G. M. Anaerobic fermentation. Bacterial physiology and metabolism. , 252-297 (2008).
- Stolz, J. F., Oremland, R. S. Bacterial respiration of arsenic and selenium). FEMS Microbiology Reviews. 23 (5), 615-627 (1999).
- Lackner, N., Hintersonnleitner, A., Wagner, A. O., Illmer, P. Hydrogenotrophic Methanogenesis and Autotrophic Growth of Methanosarcina thermophila. Archaea. 2018 (5), 1-7 (2018).
- Mutschlechner, M., Praeg, N., Illmer, P. The ecological importance of grazing to methane fluxes and engaged microbial communities in alpine forest soils. FEMS Microbiology Ecology. , (2018).
- Prem, E. M., Reitschuler, C., Illmer, P. Livestock grazing on alpine soils causes changes in abiotic and biotic soil properties and thus in abundance and activity of microorganisms engaged in the methane cycle. European Journal of Soil Biology. 62, 22-29 (2014).
- Praeg, N., Wagner, A. O., Illmer, P. Effects of fertilisation, temperature and water content on microbial properties and methane production and methane oxidation in subalpine soils. European Journal of Soil Biology. 65, 96-106 (2014).
- Wagner, A. O., Prem, E. M., Markt, R., Kaufmann, R., Illmer, P. Formation of phenylacetic acid and phenylpropionic acid under different overload conditions during mesophilic and thermophilic anaerobic digestion. Biotechnology for Biofuels. 12 (1), 359 (2019).
- Lins, P., Malin, C., Wagner, A. O., Illmer, P. Reduction of accumulated volatile fatty acids by an acetate-degrading enrichment culture. FEMS Microbiology Ecology. 71 (3), 469-478 (2010).
- Wagner, A. O., Hohlbrugger, P., Lins, P., Illmer, P. Effects of different nitrogen sources on the biogas production - a lab-scale investigation. Microbiological research. 167 (10), 630-636 (2012).
- Wagner, A. O., et al. Sample preparation, preservation, and storage for volatile fatty acid quantification in biogas plants. Engineering in Life Sciences. 17 (2), 132-139 (2017).
- Uzarski, J. S., DiVito, M. D., Wertheim, J. A., Miller, W. M. Essential design considerations for the resazurin reduction assay to noninvasively quantify cell expansion within perfused extracellular matrix scaffolds. Biomaterials. 129, 163-175 (2017).
- Costilow, R. N., Breznak, J. A., Marzluf, G. A., et al. Physicochemical Factors in Growth. Methods for General and Molecular Microbiology. , 309-329 (2007).
- Le Mer, J., Roger, P. Production, oxidation, emission and consumption of methane by soils: a review. European Journal of Soil Biology. 37 (1), 25-50 (2001).
- . Verein deutscher Ingenieure VDI 4630: Fermentation of organic material. VDI Richtlinien. , (2006).
- Wagner, A. O., Reitschuler, C., Illmer, P. Effect of different acetate: Propionate ratios on the methanogenic community during thermophilic anaerobic digestion in batch experiments. Biochemical Engineering Journal. 90, 154-161 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır