Method Article
التصوير البصري لخلايا البطين البطيني المعزولة
In This Article
Summary
نقدم منهجيه لعزل البويضات murine وكيفيه الحصول علي اثار الجهد أو الكالسيوم في وقت واحد مع اثار تقصير ساركوميري باستخدام الضوئي مضان مع القياسات الرقمية في وقت واحد الهندسة الخلوية.
Abstract
القدرة علي عزل الخلايا العضلية البالغة القلب سمحت للباحثين بدراسة مجموعه متنوعة من امراض القلب علي مستوي الخلية الواحدة. وفي حين ان التقدم في الاصباغ الحساسة للكالسيوم قد سمح بالتسجيل البصري القوي لديناميات الكالسيوم أحاديه الخلية ، فقد ظل تسجيل إشارات الجهد البصري القوية عبر الغشاء صعبا. يمكن القول ، وهذا بسبب انخفاض نسبه واحد إلى الضوضاء ، والسمية الضوئية ، والتصوير الضوئي من الاصباغ التقليدية الجهد. ولذلك ، فان قياسات الجهد خليه واحده منذ فتره طويلة تقتصر علي تقنيه المشبك التصحيح الذي في حين ان معيار الذهب ، ويطالب من الناحية الفنية وانخفاض الانتاجيه. ومع ذلك ، مع تطور الاصباغ الجهد الرواية ، كبيره ، والاستجابات البصرية السريعة للتغيرات في الجهد يمكن الحصول عليها مع القليل إلى اي السمية الضوئية والتصوير الضوئي. يصف هذا البروتوكول بالتفصيل كيفيه عزل البويضات murine الكبار التي يمكن استخدامها لتقصير الخلوية ، والكالسيوم ، وقياسات الجهد البصري. وعلي وجه التحديد ، يصف البروتوكول كيفيه استخدام صبغه الكالسيوم التي يتم القياس عليها ، وصبغه الكالسيوم أحاديه الاثاره ، وصبغه الجهد الواحد الاثاره. ويمكن استخدام هذا النهج لتقييم السمية القلبية وأررهيثموجينيسيتي العوامل الكيميائية المختلفة. وفي حين ان السمية الضوئية لا تزال مشكله علي مستوي الخلية الواحدة ، فان المنهجية تناقش كيفيه الحد منها.
Introduction
من أجل دراسة القلب خلال الولايات الصحية والمرضية ، وغالبا ما يكون من المفيد فحص النمط الظاهري علي مستوي خليه واحده. في حين سمحت التقدم العلمي قياس قويه من ديناميات الكالسيوم خليه واحده ، ظلت قياسات الجهد البصري خليه واحده نادره1. يمكن القول ، وهذا بسبب انخفاض اشاره إلى نسبه الضوضاء (الاستخبارات) ، والسمية الضوئية ، والتصوير الضوئي من الاصباغ التقليدية الجهد2،3. ومع ذلك ، تم الحصول علي إمكانيات العمل البصرية المعزولة البويضات2،3،4. علاوة علي ذلك ، مع التقدم في الكيمياء والفيزياء من الاصباغ الحساسة الجهد ، وقد تحسنت الاستخبارات5. جديده غشاء تحقيقات محتمله (جدول المواد) يستجيب إلى تغيرات في غشاء امكانيه في [سوب-ميلي] ويتلقى [فلوتيروني] استجابه مدي من تقريبا 25% لكل 100 [مف]. علاوة علي ذلك ، فان الاثاره/الانبعاثات من الغشاء مجموعه المحتملة (علي سبيل المثال ، فلوفولت ؛ جدول المواد) المستخدمة في هذا البروتوكول يعمل مع معيار فلوريسئين ايزوثيسيانات (FITC) أو إعدادات البروتين الفلوري الأخضر (GFP)6.
تتداخل أطياف الاثاره والانبعاثات الخاصة ب FITC و GFP مع أطياف الكالسيوم7المنضمة إلى fluo-4. وقد استخدمت في الوقت نفسه الاستحواذ علي قياس الضوء الفلوري مع المقاييس الهندسية للخلايا الرقمية تقليديا للحصول في وقت واحد علي قياسات تقصير الكالسيوم والخلايا8. يصف هذا البروتوكول بالتفصيل كيفيه عزل الخلايا العضلية murine وكيفيه تسجيل إشارات الكالسيوم أو الجهد باستخدام إعدادات FITC القياسية. بالاضافه إلى ذلك ، فانه يصف كيف يمكن استخدام مفتاح بسيط في مرشحات الاثاره/الانبعاثات علي محطه العمل التصويرية للحصول علي الكالسيوم وتقصير القياسات باستخدام نسبه الكالسيوم المترية الصباغ fura-2. بالمقارنة مع فلوو-4 ، fura-2 لديه تقارب اعلي للكالسيوم ومقاومه نسبيا لتسرب الصور9. التالي ، باستخدام محطه عمل واحده هذا البروتوكول يسمح لفحص شامل من الخلايا العضلية منفردة الاثاره-اقتران الانكماش.
Protocol
وقد تمت الموافقة علي جميع الأساليب والإجراءات الموصوفة في هذا البروتوكول من قبل اللجنة المؤسسية لرعاية واستخدام الحيوانية (IACUC) من جامعه الاحتياطي الغربي القضية.
1. اعداد الحلول والاداات والشفتين
ملاحظه: يمكن استخدام حلول 1x لمده تصل إلى شهر.
- جعل 10x كريبس-Henseleit العازلة HEPES العازلة دون الكالسيوم (KHB-HB) عن طريق أضافه 68.96 غرام من كلوريد الصوديوم ، 3.57 غرام من KCl ، 59.58 غرام من HEPES ، 2.18 غرام من K2hpo4، 3.08 g من mgso4 و 19.82 g من الجلوكوز إلى 800 مل من الماء المقطر مزدوجة في قارورة 1,000 مل. بعد يذوب تماما المحتويات ، وجلب ما يصل إلى حجم في قارورة 1,000 mL الحجمي.
ملاحظه: الحل التقليدي كريبس Henseleit يستخدم بيكربونات الصوديوم كعازل والحل في هذا البروتوكول يستخدم الحل كريبس Henseleit مع العازلة HEPES. الحل هو مستقر لمده 6 أشهر إذا العقيمة تصفيتها. - جعل الحل 10x تيرودي باضافه 86.51 غرام من كلوريد الصوديوم ، 0.552 غرام من الجناح2PO4، 2.03 g من mgcl2، 9.91 g من الجلوكوز ، 4.03 غرام من Kcl ، 2.65 غرام من cacl2، و 35.76 g من hepes إلى 800 مل من الماء المقطر مزدوجة في قارورة 1000 مل. بعد يذوب تماما المحتويات ، وجلب ما يصل إلى حجم في قارورة 1000 mL الحجمي.
ملاحظه: الحل هو مستقر لمده 6 أشهر إذا العقيمة تصفيتها. - جعل 1x KHB-HB من خلال قياس 100 mL من الأسهم 10x وأضافه إلى 875 مل من الماء المقطر مزدوجة في قارورة 1,000 mL. وضع قارورة في 37 درجه مئوية حمام المياه. مره واحده وقد وصل الحل 37 درجه مئوية ، واستخدام NaOH لزيادة الحموضة إلى 7.39. بعد ضبط درجه الحموضة ، وتحقيق الحل لحجم في قارورة 1000 mL الحجمي. تصفيه معقمه الحل باستخدام نظام الترشيح فراغ.
- جعل الحل تيرودي 1x من خلال قياس 100 mL من الأسهم 10x وأضافه إلى 875 مل من الماء المقطر مزدوجة في قارورة 1,000 mL. وضع قارورة في 37 درجه مئوية حمام المياه. مره واحده وقد وصل الحل 37 درجه مئوية ، واستخدام NaOH لزيادة الحموضة إلى 7.39. بعد ضبط درجه الحموضة ، وتحقيق الحل لحجم في قارورة 1,000 mL الحجمي. فلتر معقم باستخدام نظام تنقيه الفراغ.
- جعل 1x تعديل تيرودي الحل عن طريق قياس 100 mL من الأسهم 10x وأضافه إلى 875 مل من الماء المقطر مزدوجة في قارورة 1,000 mL. تذوب 3.07 غرام من L-الجلوتاثيون خفضت في قارورة. وضع قارورة في 37 درجه مئوية حمام المياه. مره واحده وقد وصل الحل 37 درجه مئوية ، واستخدام NaOH لزيادة الحموضة إلى 7.39. بعد ضبط درجه الحموضة ، وتحقيق الحل لحجم في قارورة 1,000 mL الحجمي. تصفيه معقمه الحل باستخدام نظام الترشيح فراغ.
- جعل 100 mM الحل الأسهم blebbistatin باضافه 855 μl من ثنائي ميثيل سلفوكسيد (dmso) إلى 25 ملغ من مسحوق. إلى الخارج في 20 الزيادات μL وتخزينها في 80 درجه مئوية الفريزر لمده تصل إلى سته أشهر.
- جعل وقف العازلة عن طريق أضافه 2 غرام من الزلال المصل البقري (جيش الصرب البوسني) و 1 قارورة من الأسهم blebbistatin المنقولة إلى 100 mL من 1x KHB-HB وتصفيه معقمه الحل باستخدام نظام الترشيح فراغ.
- جعل العازلة الطلاء عن طريق أضافه 5 مل من المصل البقري الجنين و 1 قارورة من الأسهم blebbistatin إلى 95 mL من M199 HEPES. تصفيه معقمه الحل باستخدام نظام الترشيح فراغ.
- جعل الخلية العازلة ثقافة البويضة عن طريق أضافه واحد 1 قارورة من الأسهم blebbistatin المقتبسة و 4 mls البنسلين-ستربتوميسين إلى 396 مل من M199 (25 مم HEPES). تصفيه معقمه الحل باستخدام نظام الترشيح فراغ.
- الاوتوكلاف 2 أزواج من الملاقط دومونت ، 2 أزواج من المقص المنحني إيريس ، 2 الأرقاء ، زوج واحد من ملقط الجراحة التجميلية ، 6 اسود مضفر الحرير 4-0 الغرز التي رتبت لاستخدامها كعقده مزدوجة الجراحية رمي ، و 4 100 mL أكواب.
- تعقيم 22 × 22 مم2 زجاج الشفتين . الاولي ، ووضع المشارك واحد في كل بئر من سته لوحه جيدا. بعد ذلك ، مع أزاله الغطاء ، بدوره علي مصباح الاشعه فوق البنفسجية لمجلس الوزراء السلامة الاحيائيه وفضح الشفتين إلى ضوء الاشعه فوق البنفسجية لمده 1 ساعة.
- جعل العمل laminin الحل الأسهم من قبل ذوبان الزجاجة الاولي علي الجليد. أضافه محتويات زجاجه واحده إلى ما يكفي الباردة العقيمة الفوسفات-مخزنه المالحة (تلفزيوني) للوصول إلى التركيز النهائي من 0.04 ملغ/مل. Aliquot خارج 1.3 μL إلى تعقيم 1.5 mL أنابيب الطرد المركزي. يخزن عند-80 درجه مئوية.
ملاحظه: كل أنبوب لديه ما يكفي من الlaminin للوحه واحده سته جيدا. تجنب العديد من دورات ذوبان التجمد. - معطف معقمه كوفيرسليب من قبل الذوبان الأول حل laminin العمل علي الجليد. باستخدام ماصه P1000 ، يستنشق 200 μL من laminin. اسحب طرف الماصة برفق علي حافه واحده من المشبك للسماح للعمل الشعري بسحب كميه ضئيله من الlaminin لتسهيل التعلق المختلط بالصفيحة الستة الجيدة.
- ثم طرد الlaminin المتبقية في وسط الشفة. في حركه دائريه ، ونشر قطره laminin عبر الشفة. مكان في حاضنه 37 درجه مئوية علي الأقل 1 h وتصل إلى 24 ساعة قبل العزلة.
2-اعداد جهاز لانغندوروف
ملاحظه: يتم سرد المكونات الفردية لجهاز لانغندوروف المستخدم في هذا البروتوكول في جدول المواد.
- تشغيل حمام المياه المتداولة. تعيين درجه الحرارة بحيث perfusate لديه درجه حرارة 37 درجه مئوية.
ملاحظه: مع الخزانات الحل تعيين إلى ارتفاع 60 سم ، والولادة المائية المتداولة يحتاج إلى تعيين إلى 41 درجه مئوية ليكون perfusate يكون 37 درجه مئوية. وخلافا للبروتوكولات المبلغ عنها سابقا ، فان ارتفاع الخزان لا يحتاج إلى تغيير. - شطف جهاز لانغرندوف مع 70 ٪ الايثانول تليها اثنين من يشطف مع الماء المقطر مزدوجة الاوتوكلاف. بعد الشطف ، وملء الخزان مع KHB-HB والأوكسجين مع 100 ٪ الأكسجين.
- رئيس النظام من خلال السماح الأوكسيجين KHB-HB إلى التدفق الأول إلى كوب 100 mL. مره واحده 50 مل من الحل قد تدفقت إلى الكاس ، والتبديل موقف 3-الطريق وقف الديك لوقف التدفق من خزان KHB-HB. صب 50 مل من الأوكسيجين KHB-HB من الكاس في خزان كولاجيناز.
- السماح لل KHB-HB استنزاف من خزان الهضم حتى 5 مل لا يزال في خزان كولاجيناز. في حين فتيله الخزان كولاجيناز, التبديل 3-طريقه الديك وقف مرارا وتكرارا بين الخزانات للسماح للخطوط لأزاله الغاز. بعد ان تستعد النظام ، وتذكر لاستخدام فخ التفريغ تقع علي راس لفائف التدفئة للسماح لأي الهواء المتبقية للخروج من النظام.
- جعل حل كولاجيناز. للفئران الجمع بين 100 ملغ من النوع الثاني كولاجيناز ، 100 mL من الأوكسيجين KHB-HB ، و 2 قارورة من الأسهم blebbistain. للفئران ، الجمع بين 100 ملغ من النوع الثاني كولاجيناز ، 40 mL من الأوكسيجين KHB-HB ، و 2 قارورة من الأسهم blebbistain. مره واحده مختلطة ، يجب ان يكون الحل مستقره لمده 1 ساعة.
ملاحظه: يمكن ان تختلف قابليه الخلايا العضلية بين النوع الثاني كولاجيناز الكثير. الاستفادة من برنامج أخذ العينات كولاجيناز لاختبار الكثير قبل الطلب بالجملة.
3. الخلية العزلة
- حقن الحيوانية مع 1,000 U من الهيبارين. انتظر 5 دقائق.
ملاحظه: يمكن استخدام الفئران والجرذان في اي عمر. ومع ذلك ، بشكل عام كبار السن أو أكثر المريضة الحيوانية ، وانخفاض الغلة البويضة. - التضحية الحيوانية من قبل تخدير أولا مع ايزوفلوان باستخدام طريقه الإسقاط المفتوح (1 سم مكعب من ايزوفلونان في حجم 500 سم مكعب) قبل يوثانيزينج الحيوانية مع خليط بنتوباربيتال (150 مغ/كغ انترابيرتينيال).
- بسرعة المكوس القلب عن طريق الاستيلاء أولا علي الفراء فوق عمليه الخنجري. مع مقص القزحية ، وجعل شق صغير مباشره تحت عمليه الخنجري وسحب الفراء صعودا نحو الراس تعريض الجلد.
- الاستيلاء علي عمليه الخنجري وقطع الحجاب الحاجز تعريض التجويف الصدري. جعل شق باب فخ ، وسحب القص مره أخرى باستخدام الأرقاء ، واستخدام الملقط المنحني لمكوس القلب فوق الشريان الابهر التصاعدي ومكان في KHB-HB الباردة.
- تعليب القلب باستخدام مجهر ستيريو وعدد 5 ملقط. تاكد من غمرت القلب وكانت معده قني قبل الختان القلب لمنع emboli. تاكيد الوضع السليم لل قني عن طريق تصور غيض من قني ما يقرب من 1 مم فوق الادراج الابهري في البطين.
ملاحظه: أسرع وقت التعليب ، وأفضل الغلة البويضة. - بدء تدفق khb-HB عن طريق تناوب محبس علي لانغندوروف. قم بتوصيل الكانولا إلى لانغندوروف. Perfuse القلب لمده 5 دقائق.
ملاحظه: منذ يتم توفير ترويه من قبل نظام القائم علي الجاذبية ، وتدفق من خلال القلب سيكون وظيفة من الامتثال الشريان التاجي. - تبديل الانصهار من خزان KHB-HB إلى خزان الهضم العازلة. مره واحده العازلة الهضم تصل إلى القلب ، تعيين جهاز ضبط الوقت (5 دقيقه للماوس أو 15 دقيقه للفئران). تاكد من جمع perfusate في دورق معقم 100 mL. أعاده ملء خزان الهضم العازلة حسب الحاجة مع perfusate حتى انتهاء مده الهضم.
- بعد الهضم ، افصل غرف القلب مع ملقط ومقص القزحية في دورق معقم 100 مل. وضع كل غرفه في بئر منفصلة من سته لوحه جيدا. صب 5 مل من محلول كولاجيناز في كل بئر.
- أبدا علي الفور بفرم انسجه القلب باستخدام المقص. يجب ان تكون قطع الانسجه حوالي 1 مم3. باستخدام ماصات النقل المعقمة ، تريرات بلطف نسيج القلب المفروم. الحل يجب ان يتحول إلى غائم
- بمجرد ان تصبح قطع الانسجه بيضاء وريشية ، افحص الخلايا باستخدام المجهر المقلوب. إذا كان عدد الخلايا القابلة للحياة أكبر من 80 ٪ ، والمضي قدما لسلاله الخلايا في أنبوب مخروطي 50 mL باستخدام مصفاه الخلية 100 μm. استخدام أنبوب مختلف ومصفاه لكل غرفه من القلب.
- إذا كان عدد الخلايا القابلة للحياة اقل من 80 ٪ ، تحقق من الوقت الذي استغرقه لتعليب. إذا كان وقت التعليب أكثر من 5 دقائق ، حاول قلب آخر. إذا لم يكن كذلك ، فحص الكثير كولاجيناز الجديدة من خلال برنامج أخذ العينات كولاجيناز.
- بيليه الخلايا بواسطة يطرد في 215 x g لمده 2 دقيقه. بيليه يجب ان تكون مدمجه وليس فضفاضة. إذا كان بيليه فضفاضة ، واعداد يحتوي علي العديد من الخلايا الميتة. في غطاء النسيج الثقافي ، أعاده تعليق بيليه في 10 مل من إيقاف العازلة.
- بيليه الخلايا بواسطة يطرد في 215 x g لمده 2 دقيقه. بيليه يجب ان تكون مدمجه وليس فضفاضة. إذا كان بيليه فضفاضة ، واعداد يحتوي علي العديد من الخلايا الميتة.
- أعاده التعليق الخلايا في 5 مل من العازلة الطلاء. اجراء عدد خلايا. ضبط المليلتر من الطلاء العازلة للوصول إلى تركيز البويضة النهائية من 2 × 104 خلايا لكل مل.
- أزاله الشفتين laminin المغلفة من الحاضنة. يستنشق قطره laminin.
- لوحه 200 μL من تعليق الخلايا العضلية علي كل coverslip. مكان في حاضنه 37 درجه مئوية (21 ٪ O2، 5 ٪ CO2) ل 2 h للسماح المرفق. بعد 2 ح ، يستنشق الخلايا غير المرفقة ، أضافه 2 مل من وسائل الاعلام الثقافة ، والثقافة لمده تصل إلى 4 أيام.
4.fura-2 صبغ التحميل
- جعل 2 مم fura-2 اسيتوكسيميثيل استر (fura-2 صباحا) حل الأسهم عن طريق أضافه 25 μL من DMSO إلى 50 ميكروغرام من مسحوق fura-2 صباحا (1 فيال). إلى 6 ميكرولتر من الارصفه تاخذ 1 قسامه من fura-2 صباحا وأضافه إلى 6 مل من الطلاء المتوسطة. دوامه لخلط.
- أزاله 1 6 لوحه جيدا من الخلايا العضلية من الحاضنة. الشفط الإعلامي. أضف 1 مل من خليط الوسائط من fura-2 إلى كل بئر. تغطيه لوحه مع إحباط ، وترك لوحه في درجه حرارة الغرفة ، والانتظار 15 دقيقه.
- شفط الخليط الإعلامي fura-2 وأضافه 1 مل من حل تيرودي لكل بئر. تغطيه مع إحباط. انتظر 20 دقيقه في درجه حرارة الغرفة للسماح لصبغ تبييض قبل التصوير.
5. فلورو-4 صبغ التحميل
- جعل 1.82 mM فلوكسي ميثيل استر (fluo-4 AM) حل الأسهم باضافه 25 μL من DMSO إلى 50 ميكروغرام من مسحوق فلوو-4 AM (1 قارورة). Aliquot الخروج إلى 8.333 μL الaliquot. خذ 1 قسامه من الأوراق المالية fluo-4 AM وأضافه إلى 6 مل من الطلاء المتوسطة. دوامه لخلط.
- أزاله 1 6 لوحه جيدا من الخلايا العضلية من الحاضنة. الشفط الإعلامي. أضف 1 مل من خليط الوسائط من فلوو-4 صباحا إلى كل بئر. تغطيه لوحه مع إحباط ، وترك لوحه في درجه حرارة الغرفة ، والانتظار 15 دقيقه.
- يستنشق السائل الفلوري-4 AM مزيج الوسائط وأضافه 1 مل من حل تيرودي لكل بئر. تغطيه مع إحباط. انتظر 20 دقيقه في درجه حرارة الغرفة للسماح لصبغ تبييض قبل التصوير.
6. غشاء المحتملة صبغ التحميل
- أزاله المكون A والمكون B من مجموعه الغشاء المحتملة. في أنبوب مخروطي 15 مل ، الجمع بين 50 μL من المكون B و 5 μL من المكون ا. دوامه لخلط. أضافه 10 مل من وسائل الاعلام الطلاء إلى أنبوب مخروطي 15 مل التي تحتوي علي خليط صبغ الجهد. دوامه لخلط.
- أزاله 1 6 لوحه جيدا من الخلايا العضلية من الحاضنة. الشفط في وسائل الاعلام. أضافه 800 μL من الاغشيه المحتملة خليط صبغ لكل بئر. تغطيه لوحه مع إحباط ، وترك لوحه في درجه حرارة الغرفة ، والانتظار 15 دقيقه.
- يستنشق خليط وسائل الاعلام صبغ وأضافه 1 مل من الحل المعدلة-تيرودي لكل بئر. تغطيه مع إحباط.
7. القياس الضوئي والشحن الاجهزه المقترنة تسجيلات
- بدوره علي المعدات بالترتيب التالي: المجهر ، والقوس مصباح ، هايبرسويتش ، نظام واجهه الفلورية ، وإمدادات الطاقة Myocam ، ومحفز الميدان ، والكمبيوتر.
- تاكد من ان مجموعات مرشح الاثاره/الانبعاثات مناسبه لصبغه التصوير.
ملاحظه: هو متحمس Fura-2 في 340 nm و 380 nm من الضوء. تنبعث في 510 نانومتر من الضوء. ومتحمس fluo-4 وصبغ غشاء الجهد في 485 nm من الضوء وتنبعث منها في 520 nm من الضوء. - رئيس النظام عن طريق تشغيل الفراغ ، وفتح تماما المشبك خرطوم ، وتغرق بلطف كل حقنه 60 mL المستخدمة في مشعب. لتسجيلات الكالسيوم استخدام الحل تيرودي. لتسجيلات الجهد استخدام الحل تيرودي المعدلة.
- تشغيل سخان وضبط التدفق عن طريق ضبط المشبك الرول علي الأنابيب ترويه. جعل التسجيلات في 36 ± 1 درجه مئوية.
- افتح برنامج الاستحواذ. تاكد من تعيين المعلمات لصبغه التصوير الصحيحة.
- في الظلام ، وأزاله إحباط من لوحه البئر الستة ووضع كوفيرسليب في غرفه سرعه. تاكد من إيقاف المحفز اثناء هذه الخطوة. التركيز علي الخلايا العضلية باستخدام الهدف 10x.
- مره واحده في التركيز, بدء سرعه عن طريق تحفيز الميدان في 1 هرتز, 0.2 V. زيادة تدريجيا في الجهد حتى يتم الحصول علي سرعه 1:1. ثم زيادة الجهد حتى 1.5 x يتم الوصول إلى عتبه.
ملاحظه: لان اقتران انكماش الاثاره هو درجه الحرارة تعتمد ، تاكد من ان الخلايا قد تم perfused لمده 15 دقيقه قبل التسجيل. وهذا يسمح للخلايا للتعافي من صدمه من الانتقال من درجه حرارة الغرفة إلى 37 درجه مئوية ، فضلا عن الخلايا المرفقة فضفاضة لتطفو بعيدا. - التبديل من الهدف 10x إلى 40x الهدف. التركيز علي الخلية التي تتبع سرعه 1:1. ضبط ظلال البلاستيك حتى خليه واحده فقط في مجال الرؤية.
- باستخدام البرنامج ، ضع منطقه الفائدة مربع علي sarcomeres محدده جيدا. بدء تشغيل برنامج الاستحواذ لبدء ضوء الاثاره. باستخدام مرشحات الكثافة المحايدة ، اضبط اعداد الكثافة وفقا لذلك للحصول علي الاستخبارات الكافية.
النتائج
الشكل 1(ا ) يظهر جهاز لانغندوف. المكساج في خزان KHB-HB. الحل كولاجيناز هو في الوسط 60 mL الخزان حقنه. يتم توصيل خط التفريغ إلى خزان الحقنه 60 mL فارغه. بعد العزلة الناجحة ، يجب ان تكون معظم الخلايا علي شكل قضيب ومخططه. تحت هدف 40x ، يجب ان يكون معظم الخلايا العضلية الشريطية واضحة مرئية. الشكل 1ب ، ج يظهر أمثله من الخلايا العضلية الفئران صحية. وبمجرد عزل الخلايا ، يمكن زراعتها حتى 4 أيام مع الحفاظ علي خواصها المورفولوجية والكهربائية.
لقياس الاثاره--اقتران الانكماش ، ثم توضع الخلايا في غرفه سرعه ساخنه. لان الخلايا العضلية حساسة للتغيرات في درجه الحرارة ، من المهم السماح للكوفرليب لتتوازن لمده 15 دقيقه في الغرفة قبل التسجيل. للتسجيلات الفلورية ، يتم إنشاء الطول الموجي الاثاره بواسطة لمبة زينون-قوس 75 W. مصابيح زينون القوس تنتج طيفا خفيفا يحاكي أشعه الشمس الطبيعية. يتم التحكم في شده الضوء والطول الموجي بواسطة الكثافة المحايدة/الانبعاثات. الاثاره ضوء بعد ذلك يمر من خلال الهدف إلى الخلية. بعد ذلك يتم جمع الطول الموجي للانبعاثات بواسطة أنبوب فوتومودولتيبليير. باستخدام النظام الموصوف هنا ، كل من مرشحات الاثاره والانبعاثات تحتاج إلى تغيير يدويا.
يتم الحصول علي تقصير من ناحية أخرى من قبل تهمه جهاز استشعار إلى جانب. قياس في الوقت الحقيقي تصل إلى 1,000 مرات في الثانية الواحدة ، والبرمجيات الاستحواذ ينفذ متوسط الخطوط داخل منطقه الاهتمام لخلق نمط المخطط حلها بشكل جيد. ثم يتم احتساب تحويل سريع Fourier. تمثل الذروة داخل طيف الطاقة متوسط تباعد ساركوميري. ثم يتم رسم التغييرات في تباعد ساركومير اثناء السرعة ثم تحديدها كميا في وقت لاحق.
الشكل 2 يظهر الكالسيوم وتقصير اثار المسجلة من C57/B6 الماوس الخلية المحملة بصبغه الكالسيوم fura-2. البروتوكول سرعه تعديل من سرعه بروتوكولات يوصف سابقا10,11. يجب ان تكون خلايا الماوس السليمة قادره علي الإيقاع في معدل نبضات القلب الخاص بها 10 هرتز. الشكل 3 هو التقدير الكمي لانسيمبليد متوسط البيانات التي تم الحصول عليها من الفئران C57/B6 وأصحابها المعدلة وراثيا (TG) الذين لديهم طفرة نقطه إدخالها في قناه البوتاسيوم. لاحظ انه لا يوجد فرق بين المجموعات باستثناء وقت الاسترخاء بسرعة 10 هرتز.
علي عكس fura-2 الذي هو صبغ الاثاره المزدوجة ، وصبغه الجهد و fluo-4 هي واحده الاصباغ الاثاره الموجه التي تعمل الاثاره/الانبعاثات مع الاثاره FITC القياسية والطيف الانبعاثات (494/506 نانومتر). ولذلك ، يمكن الحصول علي تسجيلات الكالسيوم وتقصير ساركوميري أو الجهد وتقصير ساركوميري باستخدام هذا مجموعه مرشح.
يظهر الشكل 4a تتبع الجهد المسجلة من C57/B6 الماوس الخلية الخطية في 10 هرتز. بالمقارنة مع إشارات الكالسيوم ، والقصبات الجهد خلايا واحده أصغر في السعه وتحتاج إلى مرحله ما بعد المعالجة للحصول علي اشاره صالحه للاستعمال. ويبين الشكل 4(ب ) احتمالات العمل المتوسطة الانسيمبليده التي حققتها وكاله الانباء الجزائرية في الشكل 4(ا). الشكل 4C ، D يظهر انسيمبليد متوسط AP بعد تمريره منخفضه بترورث أو تم تطبيق فلتر الرقمية Savitzky-golay. ويجب توخي الحذر عند تصفيه الاشاره بحيث لا تشوه البيانات الحقيقية. لاحظ الاختلافات الدقيقة في شكل APs في الشكل 4B-D.
يظهر الشكل 5 الآثار المسجلة من الفئران الخلايا الخطية في 1 هرتز. بالاضافه إلى اشاره الجهد يجري اقل من اشاره الكالسيوم ، وحركيه الانكماش مختلفه كذلك. وهذا لان الكالسيوم الاصباغ العازلة الكالسيوم في حين لا الاصباغ الجهد.
كما هو الشان مع عابر الكالسيوم (الشكل 3) ، أظهرت الخلايا العضلية سرعه التغييرات التابعة في العمل البصري المدة المحتملة (apd) كذلك (الشكل 6). وفي حين ان اثار الانسيمبليد كانت متوسطه الحجم قبل ان يتم قياسها كميا ، فقد تمت تصفيه اثار الجهد الكهربي بمرشح تجانس متعدد الحدود سافيتزكي-غولاي (العرض 5 ، الأمر 2) قبل ان انسيمبليد المتوسط والكمي.
وكما تم تحديده كميا في الشكل 6 والشكل 7، الاضافه إلى إظهار التغيرات المستحثة بسرعة في الدليل ، فانها أظهرت أيضا أطاله المخدرات المستحثة بالعقاقير المضادة للافراد. في 4 هرتز سرعه, تركيز يعتمد حصار من التيار عابره ظاهريه ([اي]إلى) مع [4-امينوبيدودين] ينتج في أطاله من ال [أبد].
وأخيرا ، يجب توخي الحذر لتجنب التسمم بالخلايا. الشكل 8 هو آخر 11 s من تسجيل 20 ثانيه. تشير الأسهم الحمراء في الشكل 8، التعرض لفترات طويلة من الخلايا العضلية إلى الضوء الأزرق يؤدي إلى نشاط الناجمة.

الشكل 1: الضغط المستمر لجهاز لانغندوروف. (ا) جهاز لانغندوف مع كل مكون بحروف بيضاء. (ب) خلايا الفئران المعزولة التي ينظر اليها من خلال هدف 10x. (ج) خلايا الفئران المعزولة التي ينظر اليها من خلال هدف 40x. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
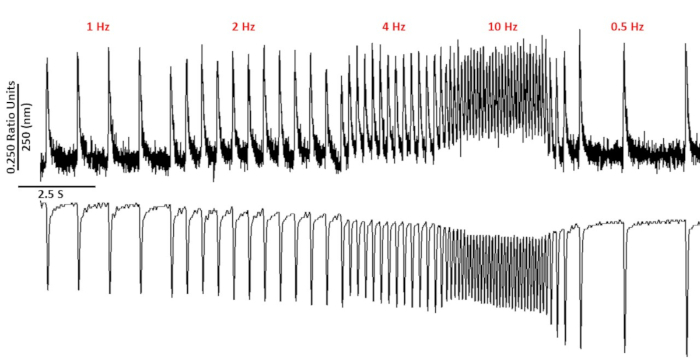
الشكل 2: الكالسيوم التمثيلي وأثار تقصير ساركوميري المسجلة من C57/B6 myoyctes باستخدام fura-2. الكالسيوم وأثار تقصير ساركوميري سجلت في 1, 2, 4, 10, 0.5 و 0.75 هرتز. الرجاء النقر هنا لعرض نسخه أكبر من هذا الرقم.
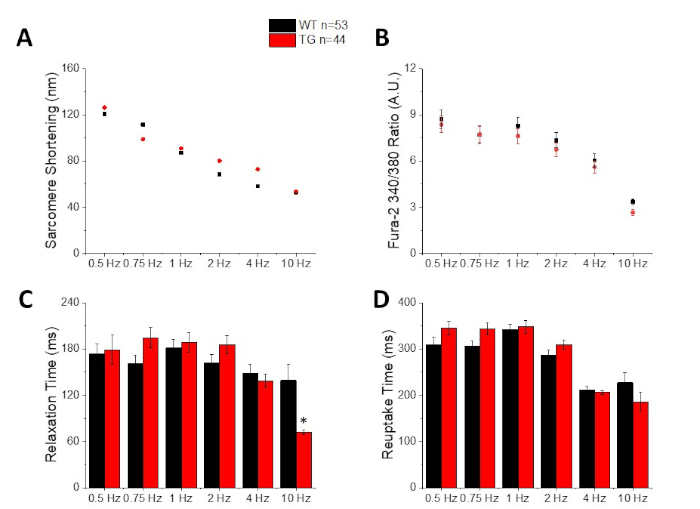
الشكل 3: القياس الكمي لتقصير ساركومير ، ذروه الكالسيوم ، وقت الاسترخاء ، ووقت الامتصاص المسجل من C57/B6 نوع البرية (WT) والوراثية (TG) الفئران. (ا) تقصير ساركوميري. (ب) ذروه الكالسيوم. (ج) وقت الاسترخاء يعرف بأنه 90% العودة إلى خط الأساس لأثر تقصير. (د) أعاده امتصاص الوقت المحدد علي انه 90% العودة إلى خط الأساس لتتبع الكالسيوم. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
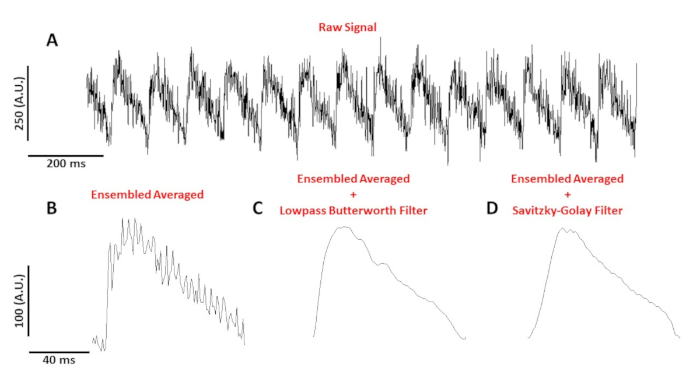
الشكل 4: العمل البصري المحتملة المسجلة من C57/B6 ماوس الخلية الخطية في 10 هرتز. (ا) الأثر غير المصفيلثانيهواحده. (ب) انسيمبليد متوسط القدرة علي العمل البصري. (ج) انسيمبليد متوسط القدرة علي العمل البصري بعد تطبيق فلتر بترورث المنخفض. (د) بلغ متوسط القدرة علي العمل البصري انسيمبليد بعد تطبيق فلتر تجانس متعدد الحدود سافيتزكي-غولاي. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
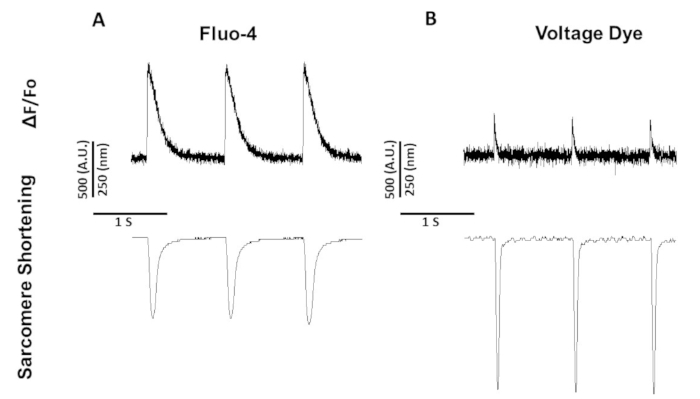
الشكل 5: الكالسيوم التمثيلي ، والجهد ، وأثار تقصير ساركوميري المسجلة من الفئران Sprague-Dawley الإيقاع في 1 هرتز. (ا) الكالسيوم وأثار تقصير ساركومير المسجلة في 1 هرتز سرعه باستخدام فلوو-4. (ب) الجهد وأثار تقصير ساركوميري سجلت في 1 هرتز سرعه باستخدام صبغه الجهد. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
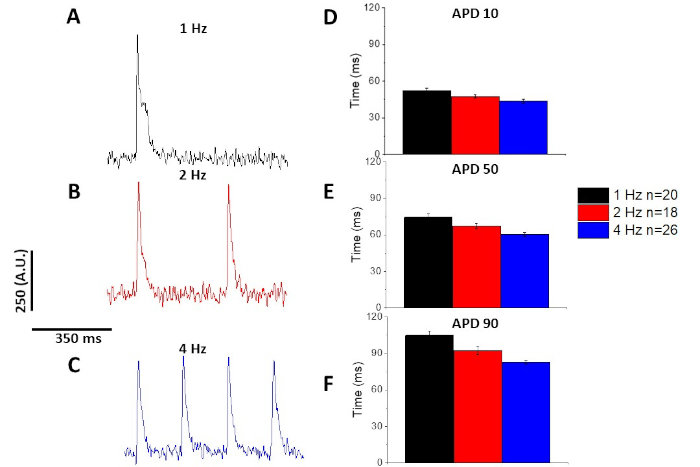
الشكل 6: إمكانات العمل البصرية المسجلة من الفئران Sprague-Dawley الخطي في 1 ، 2 ، و 4 هرتز سرعه. (ا) التتبع المصفي المسجل عند سرعه 1 هرتز. (B) تتبع المصفاة المسجلة بسرعة 2 هرتز. (C) تتبع المصفاة سجلت في سرعه 4 هرتز. (د) الإجراءات الممكنة المدة 10 ، مقيسة بنسبه 10 في المائة للعودة إلى خط الأساس. (ه) الإجراءات الزمنيه المحتملة 50 ، مقيسة بنسبه 50 في المائة بالعودة إلى خط الأساس. (و) الإجراءات الممكنة للفترة 90 ، مقيسة بنسبه 90 في المائة للعودة إلى خط الأساس. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
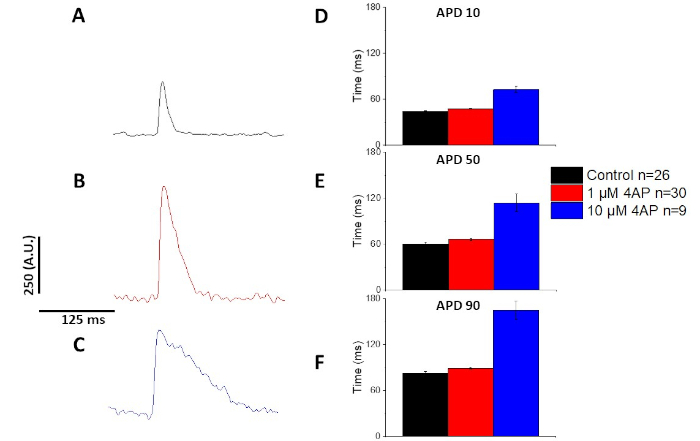
الشكل 7: اثار 4-aminopyridine علي الفئران Sprague-Dawley العمل البصرية القدرات المسجلة في سرعه 4 هرتز. (ا) انسيمبليد متوسط التتبع المسجلة في 4 هرتز سرعه مع عدم وجود 4-امينوبيدودين في الحل. (B) انسيمبليد متوسط التتبع المسجلة في 4 هرتز سرعه مع 1 μM 4-امينوبيدودين في الحل. (ج) انسيمبليد متوسط التتبع المسجلة في 4 هرتز سرعه مع 10 μM 4-امينوبيدودين في الحل. (د) الإجراءات الممكنة المدة 10 ، مقيسة بنسبه 10 في المائة للعودة إلى خط الأساس. (ه) الإجراءات الزمنيه المحتملة 50 ، مقيسة بنسبه 50 في المائة بالعودة إلى خط الأساس. (و) الإجراءات الممكنة للفترة 90 ، مقيسة بنسبه 90 في المائة للعودة إلى خط الأساس. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
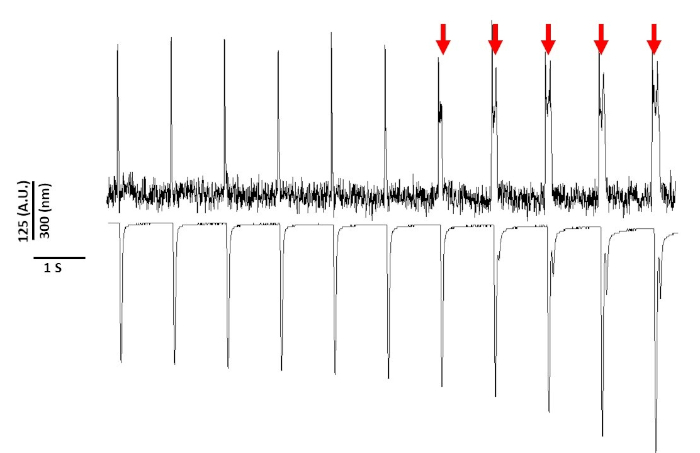
الشكل 8: صبغ الجهد المستحث بالتسمم الضوئي في الخلايا العضلية Sprague-Dawley بعد 20 ثانيه من التعرض المستمر للضوء. السهام الحمراء تشير إلى الاحداث السامة للخلايا. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
Discussion
ان القدرة علي عزل خلايا القلب هي طريقه قويه يمكن استخدامها لفهم فسيولوجيا القلب وعلم الامراض والسموم. في البروتوكول المذكور أعلاه ، وصفنا طريقه التي تستخدم ضغط الجاذبية المستمر جهاز لانغندوف للحصول علي الخلايا العضلية القلبية الواحدة. بعد ذلك ، وذلك باستخدام نظام القياس الضوئي مضان ، ونحن وصف كيفيه الحصول في وقت واحد اما الكالسيوم وتقصير أو الجهد وتقصير اثار.
بسبب حركيه مختلفه بين الاصباغ الكالسيوم ، يجب ان تؤخذ الرعاية علي الصبغة التي لتحديد. لهذا البروتوكول ، كل من fura-2 و fluo-4 المستخدمة تم هندستها مع استرات AM التي تستلزم خطوه الغسيل للسماح للوقت الاسترات داخل الخلايا ليلتصق المجموعة AM وفخ الصبغة في الخلية. في حين ان كلا من fura-2 و fluo-4 تعتبر الاصباغ الكالسيوم عاليه التقارب, دينار لل fura-2 هو 145 nM بالمقارنة مع 345 nM ل fluo-49. وعلاوة علي ذلك ، فان fura-2 هو القياس المصدق. وبسبب هذا, ويمكن استخدامه لقياس مستويات الكالسيوم داخل الخلايا9,12. Fluo-4 من ناحية أخرى هو مسبار الكالسيوم موجه واحده. ميزه استخدام fluo-4 هو انها تنتج اشاره فلوري أكثر إشراقا. بغض النسبة التي تستخدم صبغ الكالسيوم ، بالمقارنة مع صبغ الكالسيوم ، مجسات الجهد الغشائي لديها اقل الاستخبارات.
كما هو مبين في الشكل 4 والشكل 5، اثار الجهد بالمقارنة مع اثار الكالسيوم هي أصغر في السعه. وباستخدام التصفية الرقمية للتتبع الخاص بالبرنامج ، من الممكن زيادة المعلومات المتعلقة بالاستخبارات وتحديد حجم البيانات (الشكل 4 والشكل 7). وبمجرد تحديد الكمية ، فان كلا من عابري الكالسيوم والمواد البصرية المرئية تثبت الرد ، وتقصر مدتها بوتيرة أسرع (الشكل2، الشكل 3، الشكل 6، والشكل 7). أقصر APDs خلال دورات سرعه أسرع ضرورية للسماح بما يكفي من الوقت لملء البطين اثناء انبساط. ويعتقد ان التغييرات في هذه الظاهرة تدل علي زيادة خطر الأرريثمياس13و14و15و16. في حين ان التغييرات في APD يمكن ان يكون سببها المرض ، فانها يمكن ان تكون أيضا بسبب المواد الكيميائية. كما هو مبين في الشكل 7، عندما يتم حظر murine المهيمنة التيار البوتاسيوم ، وانال، هو مسدود ، والبصرية apd يصبح أطول.
لا يزال ، كما ذكر سابقا مع الاصباغ الحساسة الجهد ، وكثافة الضوء والمدة يمكن ان يغير apd2،5،17. ويعتقد ان هذا هو نتيجة لتوليد الأنواع المؤكسدة التفاعلية (ROS)5. سابقا, وقد ثبت ان أضافه مضادات الاكسده إلى حل تسجيل يمكن ان تمنع الجهد الحساسة صبغ الخلوية5. ونتيجة لذلك ، أضفنا مضادات الاكسده L-الجلوتاثيون (10 ملم) ، إلى حل تيرودي. يظهر في الشكل 8 آخر 11 s من تسجيل 20 s تم الحصول عليها بسرعة 1 هرتز. وكما هو مبين في الأسهم الحمراء ، لم تحدث التعديلات في السجل المذكور حتى 15 ثانيه في التسجيل ؛ لذلك ، في حين ان حل تيرودي المعدل لم يمنع السمية الضوئية فانه يؤخر ذلك بشكل كبير. باستخدام حل تيرودي المعدل ، باستخدام اعداد كثافة الضوء المنخفض والحفاظ علي مده التسجيل إلى اقل من 5 ليالي ، فمن الممكن لتجنب اي تعديلات التي يسببها صبغ في APD. وهذا أمر مهم لأنه بدون الحرص علي تجنب السمية الضوئية ، يمكن ان يساء تفسير البيانات علي انها تسبب في وقت مبكر أو يتاخر بعد الاستقطاب. الاضافه إلى الحد من التعرض للضوء الأزرق ، هناك احتياطات اضافيه يمكن اتخاذها لمنع سوء تفسير البيانات.
الأول هو تسجيل فقط من الخلايا التي تتبع واحد إلى واحد سرعه ويكون طول ساركومير يستريح أكبر من أو يساوي 1.75 μm. يتم أخذ قطع 1.75 μm من الملاحظة غوردون وآخرون18 ان التوتر ينخفض بسرعة بمجرد طول ساركومير اقل من هذا المبلغ. ومع ذلك ، قد تؤدي بعض الامراض في تغييرات كبيره في طول ساركومير يستريح. للتاكد من ان النمط الظاهري هو حقيقي وليس قطعه أثريه من العزلة ، وينبغي ان تؤخذ المشاكل التالية إطلاق النار النهج.
إذا كانت الخلايا العضلية باستمرار لا تتبع 1:1 سرعه ، ولها أطوال ساركوميري أدناه 1.75 μm ، الغشاء الثقيل التبييض ، أو لا البقاء علي قيد الحياة العزلة ، أول شيء للتحقق هو الوقت الذي استغرقه لتعليب القلب. ويعد وقت التعليب ، وانخفاض العائد سيكون. إذا كانت هناك حاجه لوقت طويل من التعليب ، يمكن تحسين القدرة علي البقاء عن طريق وضع القلب في الحل القلبي الرئوي19. ومع ذلك ، لان كولاجيناز هو انزيم ، والنشاط والخصوصية من تغيير الكثير محدده مع مرور الوقت. إذا كانت الغلة الاجماليه تزداد سوءا علي الرغم من الأوقات الجيدة لتعليب اللحوم ، فانه يجب التخفيف من الكميات الجديدة. في حين تم تحسين البروتوكول لدينا لتسجيلات 5 ليالي ، إذا كانت هناك حاجه إلى اثار أطول الجهد ، وسوف تحتاج إلى مرشحات كثافة محايده اضافيه ليتم شراؤها. النظام الموصوف في البروتوكول ياتي مع مرشحات الكثافة المحايدة التي تقلل من الضوء المرسل بنسبه 37 ٪ ، 50 ٪ ، 75 ٪ ، 90 ٪ ، و 95 ٪.
وباختصار ، وصفنا منهجيه التي سمحت للعزل الخلايا البطينية البطين البالغين التي تم استخدامها لقياس الكالسيوم والجهد ، و ساركوميري تقصير.
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
نشكر دانا مورجنتيرن علي التدقيق الدقيق للمخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25 Liter Water Jacketed Reservoir | Radnoti, LLC | 120142-025 | |
| 1 liter volumetric flask | Fisher Scientific | 10-205F | |
| 100 ml beaker | Fisher Scientific | FB-100-100 | |
| 100 ml graduated cylinder | Fisher Scientific | 08 562 5C | |
| 1000 ml flask | Fisher Scientific | FB-500-1000 | |
| 2-Bar Lab Stand with Stabilizer Bar and 24" Stainless Steel Rods | Radnoti, LLC | 159951-2 | |
| 4-Aminopyridine | Sigma-Aldrich | 275875 | |
| 40X Oly UApo/340 Non-Immersion Objective (NA 0.9, WD 0.2mm) | IonOptix | MSCP1-40 (b) | |
| 60-mL syringe, BD Luer-Lok tip | BD | 309650 | |
| Aortic Metal Cannulae | Harvard Apparatus | 73-0112 | |
| Bovine Serum Albumin | Fisher Scientific | BP9703-100 | |
| C-6 Standard Heating Circulator | Chemyx | A30006 | |
| CaCl2 | Fisher Scientific | BP510500 | |
| Cell framing adapter | IonOptix | CFA300 | |
| CellPr0 Vacuum Filtration System, 1 liter, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V100022 | |
| CellPro Vacuum Filtration System, 250mL, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V25022 | |
| CellPro Vacuum Filtration System, 500mL, 0.22µm,12/CS | Labratory Product Sales, Inc | V50022 | |
| CMC (mTCII) Temp Control w/ inline flow heater | IonOptix | TEMPC2 | |
| Cole-Parmer Large-bore 3-way, male-lock, stopcocks | Cole-Parmer | EW-30600-23 | |
| Cole-Parmer Luer fittings, Large-bore stopcocks, male lock, 4-way | Cole-Parmer | EW-30600-12 | |
| Cole-Parmer Stopcocks with Luer Connections; 1-way; male slip | Cole-Parmer | EW-30600-01 | |
| Collagenase Type II | Worthington | LS004177 | |
| Corning Sterile Cell Strainers | Fisher Scientific | 07-201-432 | |
| Dell Optiplex 790 mini-tower, 4G RAM, 250G HD, Windows 7 Pro | IonOptix | CPUD7M | |
| DMSO | Fisher Scientific | 50980367 | |
| Dumont Tweezers Style 5 | Amazon | B00F70ZDEQ | |
| FHD Rapid Change Stimulation Chamber | IonOptix | FHDRCC1 | |
| Fluo-3/4 Optics Package | IonOptix | IonOP-Fluo | |
| Fluorescence system interface – (w PCI-I/O card) | IonOptix | FSI700 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher Scientific | 15-140-122 | |
| Glucose | Fisher Scientific | D16-1 | |
| Hemostat, Curved 5-1/2" | Amazon | B00GGAAPD0 | |
| HEPES | Fisher Scientific | BP310500 | |
| HyperSwitch dual excitation light source | IonOptix | HSW400 | |
| Inverted Motic Fluorescence Microscope | IonOptix | MSCP1-40 (a) | |
| IonWizard Core + Analysis | IonOptix | IONWIZ | |
| Iris Scissors, curved | Amazon | B018KRRMY6 | |
| K2HPO4 | Fisher Scientific | P288-100 | |
| KCl | Fisher Scientific | BP3661 | |
| L-Glutathione reduced | Sigma-Aldrich | G4251 | |
| LOOK Silk Spool, Black Braided, 4-0, 100yds | SouthernAnesthesiaSurgical Inc. | SP116-EA | |
| M199 Media | Fisher Scientific | 12 340 030 | |
| MgCl2 | Fisher Scientific | MP021914215 | |
| MgSO4 | Fisher Scientific | BP2131 | |
| MyoCam-S Digital CCD video system | IonOptix | MCS100 | |
| MyoPacer Field Stimulator | IonOptix | MYP100 | |
| NaCl | Fisher Scientific | BP358212 | |
| NaH2PO4 | Fisher Scientific | 56-754-9250GM | |
| Oxygenator Bubbler with Fluid Inlet for 0.25 Liter | Radnoti, LLC | 140143-025 | |
| Photomultiplier sub-system | IonOptix | PMT400 | |
| PMT Acquisition add-on | IonOptix | PMTACQ | |
| Radnoti Heating Coil 5 mL with Degasing Trap | Radnoti, LLC | 158830 | |
| Ring Clamp 60 – 80mm Dia. for 250ml Reservoir | Radnoti, LLC | 120141-025 | |
| Ring Clamp for Bubble Trap Compliance Chamber | Radnoti, LLC | 120149RC | |
| Saint-Gobain ACF000010 5/32 in.9/32 in. | Fisher Scientific | 14-171-214 | |
| Saint-Gobain ACF000013 3/16 in.3/8 in. | Fisher Scientific | 14-171-217 | |
| Saint-Gobain ACF000016 1/4 in.5/16 in. | Fisher Scientific | 14-171-219 | |
| Saint-Gobain ACF000025 5/16 in.5/8 in. | Fisher Scientific | 14-171-226 | |
| Saint-Gobain ACF00003 1/16 in.3/16 in. | Fisher Scientific | 14-171-209 | |
| Saint-Gobain ACF00005 1/16 in.3/32 in. | Fisher Scientific | 14-171-210 | |
| Saint-Gobain ACF00009 5/32 in.7/32 in. | Fisher Scientific | 14-171-213 | |
| Sarcomere Length Recording add-on | IonOptix | SARACQ | |
| T/C Adson Tissue Platic Surgery Forceps 4.75" | Amazon | B00JDWRBGC | |
| VETUS Anti-Static Curved Tip Tweezers | Amazon | B07QMZC94J | |
| Vistek 3200 Motic Vibration Isolation Platform | IonOptix | ISO100 |
References
- Hagen, B. M., Boyman, L., Kao, J. P., Lederer, W. J. A comparative assessment of fluo Ca2+ indicators in rat ventricular myocytes. Cell Calcium. 52 (2), 170-181 (2012).
- Schaffer, P., Ahammer, H., Muller, W., Koidl, B., Windisch, H. Di-4-ANEPPS causes photodynamic damage to isolated cardiomyocytes. Pflügers Archiv: European Journal of Physiology. 426 (6), 548-551 (1994).
- Hardy, M. E., Lawrence, C. L., Standen, N. B., Rodrigo, G. C. Can optical recordings of membrane potential be used to screen for drug-induced action potential prolongation in single cardiac myocytes. Journal of Pharmacological and Toxicological Methods. 54 (2), 173-182 (2006).
- Tian, Q., et al. Optical action potential screening on adult ventricular myocytes as an alternative QT-screen. Cellular Physiology and Biochemistry. 27 (3-4), 281-290 (2011).
- Warren, M., et al. High-precision recording of the action potential in isolated cardiomyocytes using the near-infrared fluorescent dye di-4-ANBDQBS. The American Journal of Physiology-Heart and Circulatory Physiology. 299 (4), 1271-1281 (2010).
- FluoVolt™ Membrane Potential Kit. ThermoFisher Scientific Available from: https://assets.thermofisher.com/TFS-Assets/LSG/manuals/MAN0009668_FluoVolt_Membrane_Potential_Kit_UG.pdf (2018)
- Fluorescence SpectraViewer. ThermoFisher Scientific Available from: https://www.thermofisher.com/us/en/home/life-science/cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html (2019)
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Davis, J., et al. Diastolic dysfunction and thin filament dysregulation resulting from excitation-contraction uncoupling in a mouse model of restrictive cardiomyopathy. The Journal of Molecular and Cellular Cardiology. 53 (3), 446-457 (2012).
- Ren, J., Davidoff, A. J. Diabetes rapidly induces contractile dysfunctions in isolated ventricular myocytes. The American Journal of Physiology. 272, 148-158 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Goldhaber, J. I., et al. Action potential duration restitution and alternans in rabbit ventricular myocytes: the key role of intracellular calcium cycling. Circulation Research. 96 (4), 459-466 (2005).
- Weiss, J. N., et al. The dynamics of cardiac fibrillation. Circulation. 112 (8), 1232-1240 (2005).
- Baher, A., et al. Short-term cardiac memory and mother rotor fibrillation. The American Journal of Physiology-Heart and Circulatory Physiology. 292 (1), 180-189 (2007).
- Kleber, A. G., Rudy, Y. Basic mechanisms of cardiac impulse propagation and associated arrhythmias. Physiological Reviews. 84 (2), 431-488 (2004).
- McPheeters, M. T., Wang, Y. T., Werdich, A. A., Jenkins, M. W., Laurita, K. R. An infrared optical pacing system for screening cardiac electrophysiology in human cardiomyocytes. PLoS ONE. 12 (8), 0183761 (2017).
- Gordon, A. M., Huxley, A. F., Julian, F. J. The variation in isometric tension with sarcomere length in vertebrate muscle fibres. The Journal of Physiology. 184 (1), 170-192 (1966).
- Li, Y., et al. Three Preservation Solutions for Cold Storage of Heart Allografts: A Systematic Review and Meta-Analysis. The Journal of Artificial Organs. 40 (5), 489-496 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved