Method Article
Imágenes ópticas de miocitos ventriculares murinos aislados
En este artículo
Resumen
Presentamos la metodología para el aislamiento de miocitos murinos y cómo obtener trazas de voltaje o calcio simultáneamente con rastros de acortamiento de sarcomere utilizando fotometría de fluorescencia con mediciones simultáneas de geometría celular digital.
Resumen
La capacidad de aislar miocitos cardíacos adultos ha permitido a los investigadores estudiar una variedad de patologías cardíacas a nivel de una sola célula. Si bien los avances en los colorantes sensibles al calcio han permitido la grabación óptica robusta de la dinámica de calcio de una sola célula, el registro de señales de voltaje óptico transmembrana robustas ha seguido siendo difícil. Podría decirse que esto se debe a la baja relación entre soltero y ruido, fototoxicidad y fotoblanqueo de los colorantes potenciométricos tradicionales. Por lo tanto, las mediciones de voltaje de una sola célula se han limitado durante mucho tiempo a la técnica de abrazadera de parche que, si bien el estándar de oro, es técnicamente exigente y de bajo rendimiento. Sin embargo, con el desarrollo de nuevos colorantes potenciométricos, se pueden obtener respuestas ópticas grandes y rápidas a los cambios de voltaje con poca o ninguna fototoxicidad y fotoblanqueo. Este protocolo describe en detalle cómo aislar los miocitos murinos adultos que se pueden utilizar para mediciones de acortamiento celular, calcio y voltaje óptico. Específicamente, el protocolo describe cómo utilizar un tinte de calcio ratiométrico, un tinte de calcio de una sola excitación y un solo tinte de voltaje de excitación. Este enfoque se puede utilizar para evaluar la cardiotoxicidad y la arritmigenicidad de varios agentes químicos. Si bien la fototoxicidad sigue siendo un problema a nivel de una sola célula, se discute la metodología sobre cómo reducirla.
Introducción
Con el fin de estudiar el corazón durante estados sanos y patológicos, a menudo es útil examinar el fenotipo a nivel de una sola célula. Si bien los avances científicos han permitido la medición robusta de la dinámica de calcio de una sola célula, las mediciones de voltaje óptico de una sola célula han permanecido escasas1. Podría decirse que esto se debe a la baja relación señal/ruido (SNR), fototoxicidad y fotoblanqueo de los colorantes potenciométricos tradicionales2,3. No obstante, se han obtenido potenciales de acción óptica de miocitos aislados2,3,4. Además, con los avances en la química y la física de los dedos sensibles al voltaje, el SNR ha mejorado5. Las nuevas sondas potenciales de membrana(Tabla de materiales)responden a los cambios en el potencial de membrana en submilisegundos y tienen un rango de respuesta fluorogénica de aproximadamente 25% por 100 mV. Además, la excitación/emisión del kit potencial de membrana (por ejemplo, FluoVolt; Tabla de Materiales) utilizado en este protocolo funciona con los ajustes estándar de isotiocianato de fluoresceína (FITC) o proteína fluorescente verde (GFP)6.
Los espectros de excitación/emisión FITC y GFP se superponen con los espectros de límite de calcio fluo-47. La adquisición simultánea de fotometría de fluorescencia con mediciones de geometría de células digitales se ha utilizado tradicionalmente para la adquisición simultánea de medidas de calcio y acortamiento celular8. Este protocolo describe en detalle cómo aislar los miocitos murinos y cómo registrar señales de calcio o voltaje utilizando la configuración estándar de FITC. Además, describe cómo se puede utilizar un simple interruptor en los filtros de excitación/emisión en la estación de trabajo de imágenes para obtener mediciones de calcio y acortamiento utilizando la relación métrica de colorante de calcio fura-2. En comparación con fluo-4, fura-2 tiene una mayor afinidad por el calcio y es relativamente resistente al fotoblanqueo9. En consecuencia, utilizando una sola estación de trabajo, este protocolo permite un examen exhaustivo del acoplamiento de excitación-contracción de miocitos.
Protocolo
Todos los métodos y procedimientos descritos en este protocolo han sido aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de Case Western Reserve University.
1. Preparación de soluciones, instrumentos y covers
NOTA: 1x soluciones se pueden utilizar hasta un mes.
- Hacer 10x Krebs-Henseleit tampón HEPES tampón sin calcio (KHB-HB) mediante la adición de 68.96 g de NaCl, 3,57 g de KCl, 59,58 g de HEPES, 2,18 g de K2HPO4, 3,08 g de MgSO4 y 19,82 g de glucosa a 800 ml de agua destilada doble en un matraz de 1.000 ml. Una vez que el contenido esté completamente disuelto, suba al volumen en un matraz volumétrico de 1.000 ml.
NOTA: La solución tradicional Krebs Henseleit utiliza bicarbonato de sodio como tampón y la solución de este protocolo utiliza la solución Krebs Henseleit con búfer HEPES. La solución es estable durante 6 meses si se filtra estérilmente. - Hacer 10x solución de Tyrode añadiendo 86,51 g de NaCl, 0,552 g de NaH2PO4, 2,03 g de MgCl2, 9,91 g de glucosa, 4,03 g de KCl, 2,65 g de CaCl2y 35,76 g de HEPES a 800 ml de agua destilada doble en un lote de 100 ml. Después de que el contenido esté completamente disuelto, suba al volumen en un matraz volumétrico de 1000 ml.
NOTA: La solución es estable durante 6 meses si se filtra estérilmente. - Hacer 1x KHB-HB midiendo 100 ml del stock 10x y añadiendo a 875 ml de agua destilada doble en un matraz de 1.000 ml. Colocar el matraz en un baño de agua a 37oC. Una vez que la solución haya alcanzado los 37 oC, utilice NaOH para aumentar el pH a 7,39. Después de ajustar el pH, lleve la solución al volumen en un matraz volumétrico de 1000 ml. Filtrar estérilmente la solución utilizando un sistema de filtración al vacío.
- Haga la solución de 1x Tyrode midiendo 100 ml del stock 10x y añadiendo a 875 ml de agua destilada doble en un matraz de 1.000 ml. Colocar el matraz en un baño de agua a 37oC. Una vez que la solución haya alcanzado los 37 oC, utilice NaOH para aumentar el pH a 7,39. Después de ajustar el pH, lleve la solución al volumen en un matraz volumétrico de 1.000 ml. Filtro estéril mediante un sistema de filtración al vacío.
- Haga 1 solución modificada de Tyrode midiendo 100 ml del stock 10x y añadiendo a 875 ml de agua destilada doble en un matraz de 1.000 ml. Disolver 3,07 g de L-glutatión reducido en matraz. Colocar el matraz en un baño de agua a 37oC. Una vez que la solución haya alcanzado los 37 oC, utilice NaOH para aumentar el pH a 7,39. Después de ajustar el pH, lleve la solución al volumen en un matraz volumétrico de 1.000 ml. Filtrar estérilmente la solución utilizando un sistema de filtración al vacío.
- Hacer 100 mM de solución de stock de blebbistatin añadiendo 855 ml de dimetil sulfóxido (DMSO) a 25 mg de polvo. Alícuota en incrementos de 20 l y almacenar en un congelador de -80 oC durante un máximo de seis meses.
- Realice el tampón de parada añadiendo 2 g de albúmina sérica bovina (BSA) y 1 vial de blebbistatin alíclavado a 100 ml de 1x KHB-HB y filtre estérilmente la solución utilizando un sistema de filtración al vacío.
- Haga el tampón de chapado añadiendo 5 ml de suero bovino fetal y 1 vial de la reserva de blebbistatina alíccada a 95 ml de M199 HEPES. Filtrar estérilmente la solución utilizando un sistema de filtración al vacío.
- Realice el tampón de cultivo de miocitos añadiendo un vial de 1 vial del stock de blebbistatina alícteado y 4 mls de penicilina-estreptomicina a 396 ml de M199 (25 mM HEPES). Filtrar estérilmente la solución utilizando un sistema de filtración al vacío.
- Autoclave 2 pares de pinzas Dumont, 2 pares de tijeras curvas Iris, 2 hemostats, un par de fórceps de cirugía plástica, 6 suturas de seda trenzada negra 4-0 dispuestas para ser utilizadas como un nudo quirúrgico de doble tiro, y cuatro vasos de 100 ml.
- Esterilice 22 x 22 mm2 tapas de vidrio. En primer lugar, coloque una sola tapa en cada pocal de un plato de seis pocillos. Después, con la tapa quitada, encienda la lámpara UV del gabinete de bioseguridad y exponga los cubreobjetos a la luz UV durante 1 h.
- Haga que la solución de stock de laminina de trabajo descontece primero la botella sobre hielo. Añadir el contenido de una botella a suficiente salina estéril de fosfato (PBS) para alcanzar una concentración final de 0,04 mg/ml. Alícuota de 1,3 ml en tubos de centrífuga autoclave dosde de 1,5 ml. Conservar a -80oC.
NOTA: Cada tubo tiene suficiente laminin para una sola placa de seis pocillos. Evite múltiples ciclos de congelación de descongelación. - Cubra esterilizado con recubrimiento descongelando primero la solución laminina de trabajo sobre hielo. Usando una pipeta P1000, aspirar 200 l de laminina. Arrastre suavemente la punta de la pipeta a lo largo de un borde de la cubierta para permitir que la acción capilar extraiga una cantidad minúscula de laminina para facilitar la fijación del cubreobjetos a la placa de seis pocillos.
- Luego, expulse el laminin restante en el centro de la cubierta. En un movimiento circular, extienda la gota de laminina a través de la cubierta. Colocar en una incubadora de 37oC al menos 1 h y hasta 24 h antes del aislamiento.
2. Preparación del Aparato Langendorff
NOTA: Los componentes individuales del aparato Langendorff utilizados en este protocolo se enumeran en la Tabla de materiales.
- Encienda el baño de agua circulante. Ajuste la temperatura para que perfusate tenga una temperatura de 37 oC.
NOTA: Con los depósitos de solución ajustados a una altura de 60 cm, el agua circulante debe ajustarse a 41 oC para que el perfusado sea de 37 oC. A diferencia de los protocolos notificados anteriormente, no es necesario cambiar la altura del depósito. - Enjuague el aparato Langendorff con un 70% de etanol seguido de dos enjuagues con agua destilada doble autoclave. Después de enrestar, llene el depósito con KHB-HB y oxigene con 100% de oxígeno.
- Prepara el sistema permitiendo que el KHB-HB oxigenado fluya primero hacia un vaso de precipitados de 100 ml. Una vez que 50 ml de solución haya fluyedo en el vaso de precipitados, cambie la posición de parada de 3 vías para detener el flujo desde el depósito KHB-HB. Vierta 50 ml de KHB-HB oxigenado desde el vaso de precipitados en el depósito de colagenasa.
- Deje que el KHB-HB drene del depósito de digestión hasta que queden 5 ml en depósito de colagenasa. Mientras ceba el depósito de colagenasa, cambie la polla de parada de 3 vías repetidamente entre los reservorios para permitir que las líneas desgasifiquen. Después de que el sistema esté preparado, recuerde utilizar la trampa de desgasificación situada en la parte superior de la bobina de calentamiento para permitir que el aire restante salga del sistema.
- Hacer la solución de colagenasa. Para ratas combinan 100 mg de colágeno tipo II, 100 ml de KHB-HB oxigenado y 2 viales de la población de blebbistain. Para ratones, combine 100 mg de colagenasa tipo II, 40 ml de KHB-HB oxigenado y 2 viales de la población de blebbistain. Una vez mezclado, la solución debe ser estable durante 1 h.
NOTA: La viabilidad de los miocitos puede variar entre lotes de colagenasa tipo II. Aproveche un programa de muestreo de colagenasa para probar mucho antes de ordenar a granel.
3. Aislamiento de myocitos
- Inyectar al animal 1.000 U de heparina. Espere 5 minutos.
NOTA: Se pueden utilizar ratones y ratas de cualquier edad. Sin embargo, en general el animal mayor o más enfermo, menor es el rendimiento de los miocitos. - Sacrificar al animal anestesiando primero con isoflurano utilizando el método de gota abierta (1 cc de isoflurano por volumen de 500 cc) antes de eutanasiarlo con una mezcla pentobarbital (150 mg/kg intraperitoneal).
- Exbote rápidamente el corazón agarrando primero el pelaje por encima del proceso de xifoide. Con las tijeras de iris, haga una pequeña incisión inmediatamente debajo del proceso de xifoide y tire del pelaje hacia arriba hacia la cabeza exponiendo la piel.
- Coge el proceso de xifoide y corta el diafragma exponiendo la cavidad torácica. Haga una incisión de la trampilla, tire del esternón hacia atrás usando un hemostat, y use los fórceps curvos para extirpar el corazón por encima de la aorta ascendente y colóquelo en frío KHB-HB.
- Cannute el corazón con un microscopio estéreo y el nórforme número 5. Asegúrese de que el corazón esté sumergido y de que la cánula esté preparada antes de la escisión cardíaca para prevenir los émbolos. Confirme el posicionamiento adecuado de la cánula visualizando la punta de la cánula aproximadamente 1 mm por encima de la inserción aórtica en el ventrículo.
NOTA: Cuanto más rápido sea el tiempo de cannulación, mejor será el rendimiento de los miocitos. - Comience el flujo de KHB-HB girando el tapón en el Langendorff. Conecte la cánula al Langendorff. Perpecar el corazón durante 5 min.
NOTA: Dado que la perfusión es suministrada por un sistema basado en la gravedad, el flujo a través del corazón será una función del cumplimiento de las arterias coronarias. - Cambie la perfusión del depósito KHB-HB al depósito del búfer de digestión. Una vez que el tampón de digestión llegue al corazón, ajuste un temporizador (5 min para el ratón o 15 min para la rata). Asegúrese de recoger el perfusado en un vaso de precipitados estéril de 100 ml. Rellene el depósito del tampón de digestión según sea necesario con el perfusato hasta que el tiempo de digestión haya expirado.
- Después de la digestión, separar las cámaras del corazón con fórceps y las tijeras de iris en un vaso estéril de 100 ml. Coloque cada cámara en un pozo separado de una placa de seis pocillos. Vierta 5 ml de solución de colagenasa en cada poca.
- Comience inmediatamente a picar el tejido cardíaco con tijeras. Los trozos de tejido deben ser de aproximadamente 1 mm3. Con pipetas de transferencia estériles, triturar suavemente el tejido cardíaco picado. La solución debe volverse turbia.
- Una vez que los trozos de tejido se vuelvan blancos y emplumados, examine las células con un microscopio invertido. Si el número de células viables es superior al 80%, proceda a tensar las células en un tubo cónico de 50 ml utilizando un colador de células de 100 m. Utilice un tubo y un colador diferentes para cada cámara del corazón.
- Si el número de células viables es inferior al 80%, compruebe el tiempo que tardó en cándar. Si el tiempo de cannulación es de más de 5 min, prueba con otro corazón. Si no es así, ensayo nuevos lotes de colagenasa a través del programa de muestreo de colagenasa.
- Peletizar las células centrifugando a 215 x g durante 2 min. El pellet debe ser compacto y no suelto. Si el pellet está suelto, la preparación contiene muchas células muertas. En una capucha de cultivo de tejido, resuspenda el pellet en 10 ml de tampón de parada.
- Peletizar las células centrifugando a 215 x g durante 2 min. El pellet debe ser compacto y no suelto. Si el pellet está suelto, la preparación contiene muchas células muertas.
- Resuspenda las celdas en 5 ml de tampón de chapado. Realice un recuento de celdas. Ajuste los mililitros de tampón de chapado para alcanzar una concentración final de miocitos de 2 x 104 células por ml.
- Retire los revestimientos de laminina de la incubadora. Aspira rinde a la gota de laminina.
- Placa 200 l de suspensión de miocitos en cada cubreobjetos. Colocar en una incubadora de 37oC (21% O2, 5% CO2) durante 2 h para permitir la fijación. Después de 2 h, aspirar las celdas no conectadas, añadir 2 ml de medios de cultivo, y el cultivo durante un máximo de 4 días.
4. Carga de tinte Fura-2
- Hacer una solución de 2 mM de éster de acetoximetil fura-2 (fura-2 AM) añadiendo 25 ml de DMSO a 50 g de polvo fura-2 AM (1 vial). Alícuota en alícuotas de 6 l. Tomar 1 alícuota de fura-2 AM y añadir a 6 ml de medio de chapado. Vórtice para mezclar.
- Retire 1 placa de seis pocillos de la incubadora. Aspirar a los medios de comunicación. Añadir 1 ml de mezcla de medios fura-2 a cada poca. Cubra la placa con papel de aluminio, deje la placa a temperatura ambiente y espere 15 minutos.
- Aspirar la mezcla de medios fura-2 y añadir 1 ml de la solución de Tyrode a cada poca. Cubrir con papel de aluminio. Espere 20 minutos a temperatura ambiente para permitir el lavado de tinte antes de la toma de imágenes.
5. Carga de tinte Fluo-4
- Hacer una solución de éster de fluo-4 de 1,82 mM fluo-4 (fluo-4 AM) añadiendo 25 ml de DMSO a 50 g de polvo fluo-4 AM (1 vial). Alícuota en alícuotas de 8.333 ol. Tomar 1 alícuota de stock fluo-4 AM y añadir a 6 ml de medio de chapado. Vórtice para mezclar.
- Retire 1 placa de seis pocillos de la incubadora. Aspirar a los medios de comunicación. Agregue 1 ml de mezcla de medios fluo-4 AM a cada poca. Cubra la placa con papel de aluminio, deje la placa a temperatura ambiente y espere 15 minutos.
- Aspirar la mezcla de medios fluo-4 AM y añadir 1 ml de solución de Tyrode a cada poca. Cubrir con papel de aluminio. Espere 20 minutos a temperatura ambiente para permitir el lavado de tinte antes de la toma de imágenes.
6. Carga de tinte potencial de membrana
- Retire el componente A y el componente B del kit de potencial de membrana. En un tubo cónico de 15 ml, combine 50 ml del componente B y 5 l del componente A. Vortex para mezclar. Añadir 10 ml de soporte de chapado al tubo cónico de 15 ml que contiene la mezcla de tinte de tensión. Vórtice para mezclar.
- Retire 1 placa de seis pocillos de la incubadora. Aspira a los medios de comunicación. Añadir 800 l de la mezcla de colorante potencial de membrana a cada poca. Cubra la placa con papel de aluminio, deje la placa a temperatura ambiente y espere 15 minutos.
- Aspirar mezcla de medios de tinte y añadir 1 mL de solución de Tyrode modificado a cada poca. Cubrir con papel de aluminio.
7. Grabaciones de dispositivos acoplados de fotometría y carga
- Encienda el equipo en el siguiente orden: microscopio, lámpara de arco, hiperinterruptor, sistema de interfaz de fluorescencia, fuente de alimentación Myocam, estimulador de campo y ordenador.
- Asegúrese de que los conjuntos de filtros de excitación/emisión sean adecuados para el tinte de imagen.
NOTA: Fura-2 se excita a 340 nm y 380 nm de luz. Emite a 510 nm de luz. Fluo-4 y el tinte de membrana de voltaje se excitan a 485 nm de luz y emiten a 520 nm de luz. - Apriete el sistema encendiendo el vacío, abriendo completamente la abrazadera de la manguera y hundiendo suavemente cada jeringa de 60 ml que se utiliza en el colector. Para las grabaciones de calcio, utilice la solución de Tyrode. Para grabaciones de voltaje, utilice la solución modificada de Tyrode.
- Encienda el calentador y ajuste el flujo ajustando la abrazadera del rodillo en el tubo de perfusión. Realice grabaciones a 36 oC.
- Abra el software de adquisición. Asegúrese de que los parámetros están configurados para el tinte de imagen correcto.
- En la oscuridad, retire la lámina de la placa de seis pocillos y coloque un cubreobjetos en la cámara de ritmo. Asegúrese de que el estimulador esté apagado durante este paso. Concéntrese en los miocitos utilizando el objetivo 10x.
- Una vez enfocado, comience a ritmo estimulando el campo a 1 Hz, 0,2 V. Aumente gradualmente la tensión hasta obtener el ritmo 1:1. A continuación, aumente la tensión hasta que se alcance el umbral 1,5 veces.
NOTA: Debido a que el acoplamiento excitación-contracción depende de la temperatura, asegúrese de que las células se han perfundido durante 15 minutos antes de la grabación. Esto permite que los miocitos se recuperen del impacto de volver a la temperatura ambiente a 37 oC, así como que las células unidas libremente flotan. - Cambia del objetivo 10x al objetivo 40x. Concéntrese en una celda que está siguiendo un ritmo de 1:1. Ajuste las sombras de plástico para que solo haya una celda en el campo de visión.
- Usando el software, coloque el área de interés en sarcomeres bien definidos. Inicie el software de adquisición para iniciar la luz de excitación. Usando los filtros de densidad neutra, ajuste el ajuste de intensidad en consecuencia para obtener un SNR adecuado.
Resultados
La Figura 1A muestra el aparato Langendorff. El oxigenador está en el reservorio KHB-HB. La solución de colagenasa se encuentra en el depósito medio de la jeringa de 60 ml. La línea de desgasificación está conectada al depósito vacío de la jeringa de 60 ml. Después de un aislamiento exitoso, la mayoría de las células deben tener forma de varilla y estriada. Bajo un objetivo 40x, la mayoría de los miocitos deben tener estrías claras visibles. La Figura 1B,C muestra ejemplos de miocitos de ratas sanos. Una vez aisladas, las células se pueden cultivar hasta 4 días manteniendo su morfología y propiedades eléctricas.
Para medir el acoplamiento excitación-contracción, las células se colocan en una cámara de ritmo calentada. Debido a que los miocitos son sensibles a los cambios de temperatura, es importante permitir que el cubreobjetos se equilibre durante 15 minutos en la cámara antes de grabar. Para las grabaciones de fluorescencia, la longitud de onda de excitación es generada por una bombilla de arco de xenón de 75 W. Las bombillas de arco de xenón producen un espectro de luz que imita la luz solar natural. La intensidad de la luz y la longitud de onda están controladas por filetes neutros de densidad/emisión. La luz de excitación pasa a través del objetivo al miocito. La longitud de onda de emisión es recogida por un tubo fotomultiplicador. Utilizando el sistema descrito aquí, tanto los filtros de excitación como los filtros de emisión deben cambiarse manualmente.
El acortamiento, por otro lado, se obtiene mediante un sensor de dispositivo acoplado a la carga. Midiendo en tiempo real hasta 1.000 veces por segundo, el software de adquisición realiza un promedio de las líneas dentro de un área de interés para crear un patrón de estriación bien resuelto. A continuación, se calcula una transformación rápida de Fourier (FFT). El pico dentro del espectro de potencia representa el espaciado medio de sarcomere. Los cambios en el espaciado del sarcomere durante el ritmo se trazan y posteriormente se cuantifican.
La Figura 2 muestra los rastros de calcio y acortamiento registrados de un miocito de ratón C57/B6 cargado con el tinte de calcio fura-2. El protocolo de ritmo es una modificación de los protocolos de ritmo descritos anteriormente10,11. Los miocitos de ratón sanos deben poder ser capaces de ser ritmo a su frecuencia cardíaca en reposo 10 Hz. La Figura 3 es la cuantificación de los datos promediados en conjunto obtenidos de un ratones C57/B6 y sus littermates transgénicos (TG) que tuvieron una mutación puntual introducida en un canal de potasio. Observe que no hay diferencia entre los grupos excepto por el tiempo de relajación a 10 Hz de ritmo.
A diferencia de fura-2 que es un tinte de excitación dual, el tinte de voltaje y fluo-4 son tintes excitados de longitud de onda única cuyo trabajo de excitación/emisión con espectro de excitación y emisión FITC estándar (494/506 nm). Por lo tanto, las grabaciones de calcio y acortamiento de sarcomere o voltaje y acortamiento de sarcomere se pueden obtener utilizando este conjunto de filtros.
La Figura 4A muestra un seguimiento de voltaje registrado a partir de un miocito de ratón C57/B6 ritmo a 10 Hz. En comparación con las señales de calcio, los trazados de voltaje de una sola célula son de menor amplitud y necesitan postprocesamiento para obtener una señal útil. El cuadro 4B muestra un potencial de acción promediado (AP) en conjunto hecho de los AP en el cuadro 4A. La Figura 4C,D muestra un PROMEDIO AP en conjunto después de aplicar un filtro digital Butterworth de paso bajo o savitzky-Golay. Se debe tener cuidado al filtrar la señal para no distorsionar los datos reales. Observe las diferencias sutiles en la forma de los AP en el cuadro 4B-D.
La Figura 5 muestra los rastros registrados de los miocitos de ratas ritmos de 1 Hz. Además de que la señal de voltaje es más baja que la señal de calcio, la cinética de contracción también es diferente. Esto se debe a que los tensiodos de calcio amortiguan el calcio, mientras que los dedos de tensión no lo hacen.
Al igual que con el transitorio de calcio(Figura 3), los miocitos demostraron cambios dependientes del ritmo en su duración potencial de acción óptica (APD) también(Figura 6). Mientras que los rastros fura-2 fueron ensambles promediados antes de ser cuantificados, los rastros de voltaje fueron filtrados con un filtro de suavizado polinomio Savitzky-Golay (ancho 5, orden 2) antes de ser ensambles promediado y cuantificado.
Tal como se cuantifica en la Figura 6 y la Figura 7,además de demostrar los cambios inducidos por el ritmo en el APD, también demostraron la prolongación inducida por drogas del AP. A 4 Hz de ritmo, el bloqueo dependiente de la concentración de la corriente externa transitoria (I a ) con 4-aminopiridina dio lugarala prolongación del APD.
Por último, se debe tener cuidado para evitar la citotoxicidad. La Figura 8 es la última grabación de 11 s de un 20 s. Indicado por las flechas rojas en la Figura 8, la exposición prolongada de los miocitos a la luz azul conduce a la actividad activada.

Figura 1: Aparato Langendorff de presión constante. (A) El aparato Langendorff con cada componente etiquetado en letras blancas. (B) Miocitos aislados de ratas Sprague-Dawley vistos a través de un objetivo 10x. (C) Miocitos de ratas aislados vistos a través de un objetivo 40x. Haga clic aquí para ver una versión más grande de esta figura.
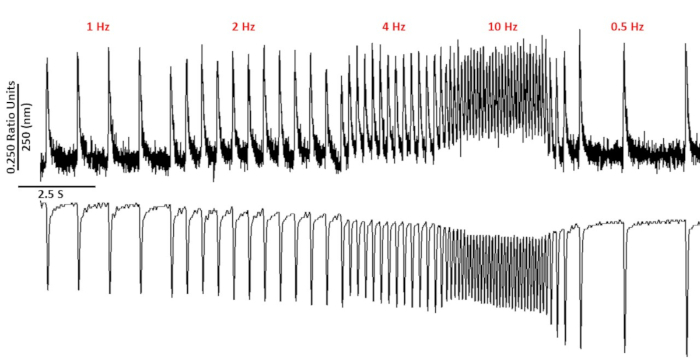
Figura 2: Seguimientos representativos de acortamiento de calcio y sarcomere registrados en mioyctes C57/B6 utilizando fura-2. Rastros de acortamiento de calcio y sarcomere registrados en 1, 2, 4, 10, 0.5 y 0.75 Hz. Haga clic aquí para ver una versión más grande de esta cifra.
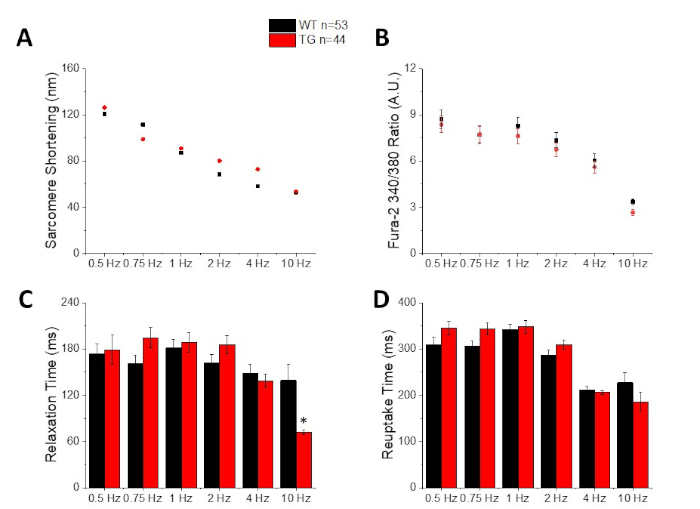
Figura 3: Cuantificación del acortamiento del sarcomere, el pico de calcio, el tiempo de relajación y el tiempo de retoma registrados a partir de un tipo silvestre C57/B6 (WT) y transgénicos (TG). (A) Acortamiento de Sarcomere. (B) Pico de calcio. (C) Tiempo de relajación definido como 90% volver a la línea de base de la traza de acortamiento. (D) Tiempo de retoma definido como 90% volver a la línea de base de la traza de calcio. Haga clic aquí para ver una versión más grande de esta figura.
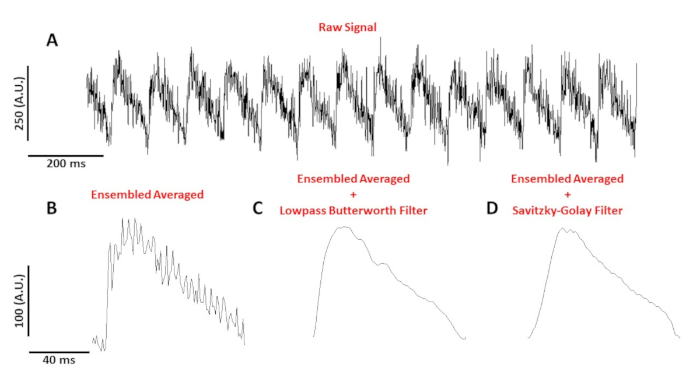
Figura 4: El potencial de acción óptica registrado a partir de un miocito de ratón C57/B6 ritmo a 10 Hz. (A) 1 segundo de traza sin filtrar. (B) Potencial de acción óptica promediado en sensamble. (C) Se promedió el potencial de acción óptica después de aplicar un filtro Butterworth de paso bajo. (D) Se promedió el potencial de acción óptica después de aplicar un filtro de suavizado polinomio Savitzky-Golay. Haga clic aquí para ver una versión más grande de esta figura.
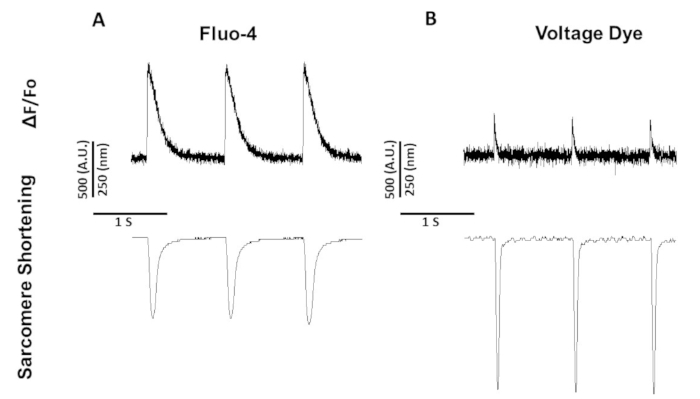
Figura 5: Los rastros representativos de calcio, voltaje y acortamiento de sarcomeres registrados en los miocitos de rata Sprague-Dawley ritmo según 1 Hz. (A) Trazas de acortamiento de calcio y sarcomere registradas a 1 Hz de ritmo utilizando fluo-4. (B) Seguimientos de acortamiento de voltaje y sarcomere registrados a 1 Hz de ritmo utilizando el tinte de tensión. Haga clic aquí para ver una versión más grande de esta figura.
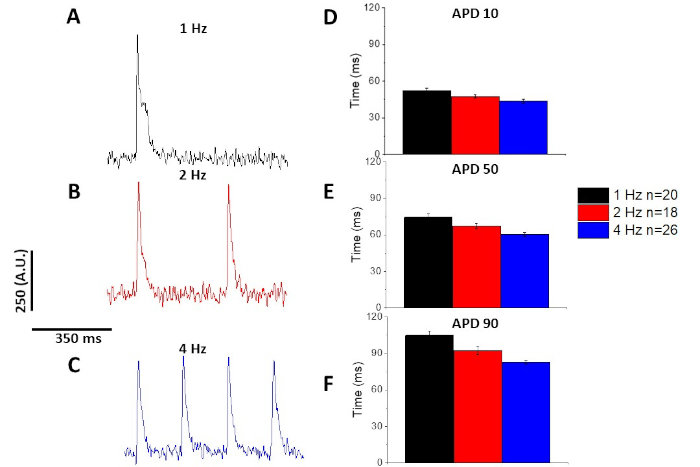
Figura 6: Los potenciales de acción óptica registrados a partir de miocitos de ratas Sprague-Dawley ritmo según 1, 2 y 4 Hz de ritmo. (A) Rastreo filtrado registrado a 1 Hz de ritmo. (B) Rastreo filtrado registrado a 2 Hz de ritmo. (C) Rastreo filtrado registrado a 4 Hz de ritmo. (D) Duración potencial de la acción 10, medida como 10% de retorno a la línea de base. (E) Duración potencial de la acción 50, medida como 50% de retorno a la línea de base. (F) Duración potencial de la acción 90, medida como 90% de retorno a la línea de base. Haga clic aquí para ver una versión más grande de esta figura.
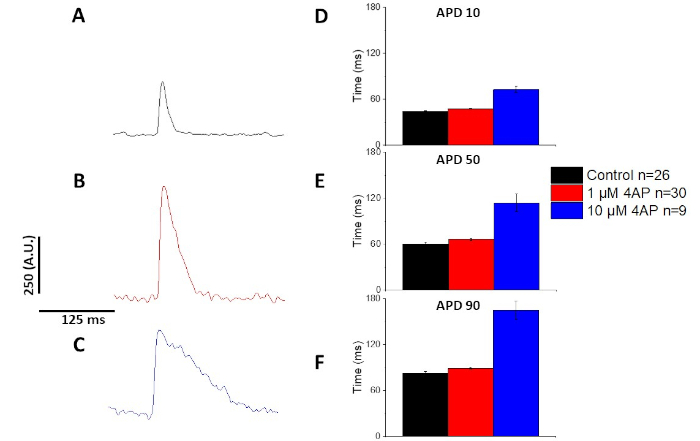
Figura 7: Los efectos de 4-aminopiridina en los potenciales de acción óptica de rata Sprague-Dawley registrados a 4 Hz de ritmo. (A) Traza promediada ensanada registrada a 4 Hz de ritmo sin 4-Aminopiridina en la solución. (B) Traza promediada ensacada registrada a 4 Hz de ritmo con 1 M 4-Aminopiridina en la solución. (C) Traza promediada ensacada registrada a 4 Hz de ritmo con 10 M 4-Aminopiridina en la solución. (D) Duración potencial de la acción 10, medida como 10% de retorno a la línea de base. (E) Duración potencial de la acción 50, medida como 50% de retorno a la línea de base. (F) Duración potencial de la acción 90, medida como 90% de retorno a la línea de base. Haga clic aquí para ver una versión más grande de esta figura.
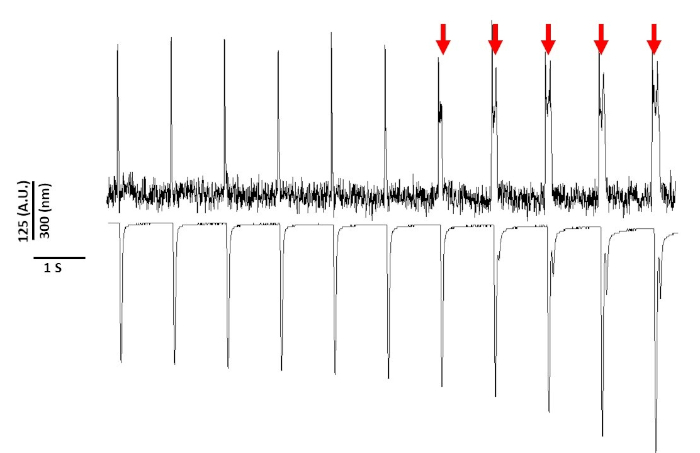
Figura 8: Fototoxicidad inducida por tinte de voltaje en miocitos de ratas Sprague-Dawley después de 20 s de exposición continua a la luz. Las flechas rojas indican eventos citotóxicos. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Ser capaz de aislar miocitos cardíacos es un método potente que se puede utilizar para entender la fisiología cardíaca, patología, y toxicología. En el protocolo anterior, describimos un método que utiliza un aparato Deformación arterial constante Langendorff para obtener miocitos cardíacos únicos. Después, utilizando el sistema de fotometría de fluorescencia, describimos cómo adquirir simultáneamente calcio y acortamiento o voltaje y trazas de acortamiento.
Debido a la diferente cinética entre los tintes de calcio, se debe tener cuidado con qué tinte seleccionar. Para este protocolo, tanto el fura-2 como el fluo-4 utilizados fueron diseñados con ésteres AM que requieren un paso de lavado para permitir que la esterasis intracelular tiempo para aplacar el grupo AM y atrapar el tinte en la célula. Mientras que tanto fura-2 como fluo-4 se consideran colorantes de calcio de alta afinidad, el Kd para fura-2 es de 145 nM en comparación con los 345 nM para fluo-49. Además, fura-2 es ratiométrico. Debido a esto, se puede utilizar para cuantificar los niveles de calcio intracelular9,12. Fluo-4 por otro lado es una sonda de calcio de una sola onda. La ventaja de usar fluo-4 es que produce una señal de fluorescencia más brillante. Independientemente del colorante de calcio que se utilice, en comparación con el tinte de calcio, las sondas de voltaje de membrana tienen un SNR más bajo.
Como se muestra en la Figura 4 y la Figura 5,las trazas de voltaje en comparación con las trazas de calcio son de menor amplitud. Utilizando el filtrado de seguimiento digital del software, es posible aumentar el SNR y cuantificar los datos(Figura 4 y Figura 7). Una vez cuantificados, tanto los transitorios de calcio como los AAP ópticos demuestran la restitución, acortando su duración a frecuencias de ritmo más rápidas(Figura 2, Figura 3, Figura 6y Figura 7). Los ATV más cortos durante ciclos de ritmo más rápidos son necesarios para permitir tiempo suficiente para el llenado ventricular durante la diástole. Se cree que las alteraciones en este fenómeno son indicativas de un aumento del riesgo de arrythmias13,14,15,16. Si bien las alteraciones en el TPA pueden ser causadas por enfermedades, también pueden ser causadas por productos químicos. Como se muestra en la Figura 7, cuando la corriente de potasio repolarizante murino predominante, Ia, está bloqueado, el APD óptico se hace más largo.
Sin embargo, como se informó anteriormente con los colorantes sensibles al voltaje, la intensidad de la luz y la duración pueden alterar el APD2,5,17. Esto se cree que es el resultado de la generación de especies oxidativas reactivas (ROS)5. Anteriormente, se ha demostrado que la adición de antioxidantes a la solución de grabación puede prevenir la citotoxicidad de tinte sensible al voltaje5. Como resultado, añadimos el antioxidante L-glutatión (10 mM), a la solución de Tyrode. En la Figura 8 se muestran los últimos 11 s de una grabación de 20 s obtenida a 1 Hz de ritmo. Como indican las flechas rojas, las alteraciones en el APD no se produjeron hasta 15 s en la grabación; por lo tanto, mientras que la solución modificada de Tyrode no previno la fototoxicidad, la retrasó significativamente. Utilizando la solución modificada de Tyrode, utilizando un ajuste de baja intensidad lumínica y manteniendo la duración de la grabación a menos de 5 s, es posible evitar cualquier alteración inducida por tinte en APD. Esto es importante porque sin tener cuidado de evitar la fototoxicidad, los datos podrían ser malinterpretados como causando temprano o retrasado después de las despolarizaciones. Además de limitar la exposición a la luz azul, hay precauciones adicionales que se pueden tomar para evitar la interpretación errónea de los datos.
La primera es registrar sólo de las células que siguen uno a uno de ritmo y tienen una longitud de sarcomere en reposo mayor o igual a 1,75 m. El límite de 1,75 m se toma de la observación de Gordon et al.18 de que la tensión disminuye rápidamente una vez que la longitud del sarcomere está por debajo de esta cantidad. Sin embargo, ciertas patologías pueden resultar en alteraciones significativas en la longitud del sarcomere en reposo. Para asegurarse de que el fenotipo es real y no un artefacto del aislamiento, se deben tomar los siguientes enfoques de disparo de problemas.
Si los miocitos no están constantemente siguiendo el ritmo 1:1, tienen longitudes de sarcomere por debajo de 1,75 m, manchas de membrana pesadas o no sobreviven al aislamiento, lo primero que se debe comprobar es el tiempo que tomó cándar el corazón. Cuanto más largo sea el tiempo de cannulación, menor será el rendimiento. Si se requiere un tiempo de cannulación largo, la viabilidad se puede mejorar colocando el corazón en una solución cardiopléjica19. Sin embargo, debido a que la colagenasa es una enzima, la actividad y especificidad de un lote específico cambian con el tiempo. Si los rendimientos globales empeoran progresivamente a pesar de los buenos tiempos de cannulación, se deben analizar nuevos lotes. Mientras que nuestro protocolo fue optimizado para grabaciones de 5 s, si se necesitan trazas de voltaje más largas, se necesitarán filtros de densidad neutra adicionales para ser comprados. El sistema descrito en el protocolo viene con filtros de densidad neutra que reducen la luz transmitida en un 37%, 50%, 75%, 90% y 95%.
En resumen, describimos una metodología que permitió el aislamiento de miocitos ventriculares murinos adultos que se utilizaron para mediciones de acortamiento de calcio, voltaje y sarcomere.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Dana Morgenstern por la cuidadosa corrección del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.25 Liter Water Jacketed Reservoir | Radnoti, LLC | 120142-025 | |
| 1 liter volumetric flask | Fisher Scientific | 10-205F | |
| 100 ml beaker | Fisher Scientific | FB-100-100 | |
| 100 ml graduated cylinder | Fisher Scientific | 08 562 5C | |
| 1000 ml flask | Fisher Scientific | FB-500-1000 | |
| 2-Bar Lab Stand with Stabilizer Bar and 24" Stainless Steel Rods | Radnoti, LLC | 159951-2 | |
| 4-Aminopyridine | Sigma-Aldrich | 275875 | |
| 40X Oly UApo/340 Non-Immersion Objective (NA 0.9, WD 0.2mm) | IonOptix | MSCP1-40 (b) | |
| 60-mL syringe, BD Luer-Lok tip | BD | 309650 | |
| Aortic Metal Cannulae | Harvard Apparatus | 73-0112 | |
| Bovine Serum Albumin | Fisher Scientific | BP9703-100 | |
| C-6 Standard Heating Circulator | Chemyx | A30006 | |
| CaCl2 | Fisher Scientific | BP510500 | |
| Cell framing adapter | IonOptix | CFA300 | |
| CellPr0 Vacuum Filtration System, 1 liter, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V100022 | |
| CellPro Vacuum Filtration System, 250mL, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V25022 | |
| CellPro Vacuum Filtration System, 500mL, 0.22µm,12/CS | Labratory Product Sales, Inc | V50022 | |
| CMC (mTCII) Temp Control w/ inline flow heater | IonOptix | TEMPC2 | |
| Cole-Parmer Large-bore 3-way, male-lock, stopcocks | Cole-Parmer | EW-30600-23 | |
| Cole-Parmer Luer fittings, Large-bore stopcocks, male lock, 4-way | Cole-Parmer | EW-30600-12 | |
| Cole-Parmer Stopcocks with Luer Connections; 1-way; male slip | Cole-Parmer | EW-30600-01 | |
| Collagenase Type II | Worthington | LS004177 | |
| Corning Sterile Cell Strainers | Fisher Scientific | 07-201-432 | |
| Dell Optiplex 790 mini-tower, 4G RAM, 250G HD, Windows 7 Pro | IonOptix | CPUD7M | |
| DMSO | Fisher Scientific | 50980367 | |
| Dumont Tweezers Style 5 | Amazon | B00F70ZDEQ | |
| FHD Rapid Change Stimulation Chamber | IonOptix | FHDRCC1 | |
| Fluo-3/4 Optics Package | IonOptix | IonOP-Fluo | |
| Fluorescence system interface – (w PCI-I/O card) | IonOptix | FSI700 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher Scientific | 15-140-122 | |
| Glucose | Fisher Scientific | D16-1 | |
| Hemostat, Curved 5-1/2" | Amazon | B00GGAAPD0 | |
| HEPES | Fisher Scientific | BP310500 | |
| HyperSwitch dual excitation light source | IonOptix | HSW400 | |
| Inverted Motic Fluorescence Microscope | IonOptix | MSCP1-40 (a) | |
| IonWizard Core + Analysis | IonOptix | IONWIZ | |
| Iris Scissors, curved | Amazon | B018KRRMY6 | |
| K2HPO4 | Fisher Scientific | P288-100 | |
| KCl | Fisher Scientific | BP3661 | |
| L-Glutathione reduced | Sigma-Aldrich | G4251 | |
| LOOK Silk Spool, Black Braided, 4-0, 100yds | SouthernAnesthesiaSurgical Inc. | SP116-EA | |
| M199 Media | Fisher Scientific | 12 340 030 | |
| MgCl2 | Fisher Scientific | MP021914215 | |
| MgSO4 | Fisher Scientific | BP2131 | |
| MyoCam-S Digital CCD video system | IonOptix | MCS100 | |
| MyoPacer Field Stimulator | IonOptix | MYP100 | |
| NaCl | Fisher Scientific | BP358212 | |
| NaH2PO4 | Fisher Scientific | 56-754-9250GM | |
| Oxygenator Bubbler with Fluid Inlet for 0.25 Liter | Radnoti, LLC | 140143-025 | |
| Photomultiplier sub-system | IonOptix | PMT400 | |
| PMT Acquisition add-on | IonOptix | PMTACQ | |
| Radnoti Heating Coil 5 mL with Degasing Trap | Radnoti, LLC | 158830 | |
| Ring Clamp 60 – 80mm Dia. for 250ml Reservoir | Radnoti, LLC | 120141-025 | |
| Ring Clamp for Bubble Trap Compliance Chamber | Radnoti, LLC | 120149RC | |
| Saint-Gobain ACF000010 5/32 in.9/32 in. | Fisher Scientific | 14-171-214 | |
| Saint-Gobain ACF000013 3/16 in.3/8 in. | Fisher Scientific | 14-171-217 | |
| Saint-Gobain ACF000016 1/4 in.5/16 in. | Fisher Scientific | 14-171-219 | |
| Saint-Gobain ACF000025 5/16 in.5/8 in. | Fisher Scientific | 14-171-226 | |
| Saint-Gobain ACF00003 1/16 in.3/16 in. | Fisher Scientific | 14-171-209 | |
| Saint-Gobain ACF00005 1/16 in.3/32 in. | Fisher Scientific | 14-171-210 | |
| Saint-Gobain ACF00009 5/32 in.7/32 in. | Fisher Scientific | 14-171-213 | |
| Sarcomere Length Recording add-on | IonOptix | SARACQ | |
| T/C Adson Tissue Platic Surgery Forceps 4.75" | Amazon | B00JDWRBGC | |
| VETUS Anti-Static Curved Tip Tweezers | Amazon | B07QMZC94J | |
| Vistek 3200 Motic Vibration Isolation Platform | IonOptix | ISO100 |
Referencias
- Hagen, B. M., Boyman, L., Kao, J. P., Lederer, W. J. A comparative assessment of fluo Ca2+ indicators in rat ventricular myocytes. Cell Calcium. 52 (2), 170-181 (2012).
- Schaffer, P., Ahammer, H., Muller, W., Koidl, B., Windisch, H. Di-4-ANEPPS causes photodynamic damage to isolated cardiomyocytes. Pflügers Archiv: European Journal of Physiology. 426 (6), 548-551 (1994).
- Hardy, M. E., Lawrence, C. L., Standen, N. B., Rodrigo, G. C. Can optical recordings of membrane potential be used to screen for drug-induced action potential prolongation in single cardiac myocytes. Journal of Pharmacological and Toxicological Methods. 54 (2), 173-182 (2006).
- Tian, Q., et al. Optical action potential screening on adult ventricular myocytes as an alternative QT-screen. Cellular Physiology and Biochemistry. 27 (3-4), 281-290 (2011).
- Warren, M., et al. High-precision recording of the action potential in isolated cardiomyocytes using the near-infrared fluorescent dye di-4-ANBDQBS. The American Journal of Physiology-Heart and Circulatory Physiology. 299 (4), 1271-1281 (2010).
- FluoVolt™ Membrane Potential Kit. ThermoFisher Scientific Available from: https://assets.thermofisher.com/TFS-Assets/LSG/manuals/MAN0009668_FluoVolt_Membrane_Potential_Kit_UG.pdf (2018)
- Fluorescence SpectraViewer. ThermoFisher Scientific Available from: https://www.thermofisher.com/us/en/home/life-science/cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html (2019)
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Davis, J., et al. Diastolic dysfunction and thin filament dysregulation resulting from excitation-contraction uncoupling in a mouse model of restrictive cardiomyopathy. The Journal of Molecular and Cellular Cardiology. 53 (3), 446-457 (2012).
- Ren, J., Davidoff, A. J. Diabetes rapidly induces contractile dysfunctions in isolated ventricular myocytes. The American Journal of Physiology. 272, 148-158 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Goldhaber, J. I., et al. Action potential duration restitution and alternans in rabbit ventricular myocytes: the key role of intracellular calcium cycling. Circulation Research. 96 (4), 459-466 (2005).
- Weiss, J. N., et al. The dynamics of cardiac fibrillation. Circulation. 112 (8), 1232-1240 (2005).
- Baher, A., et al. Short-term cardiac memory and mother rotor fibrillation. The American Journal of Physiology-Heart and Circulatory Physiology. 292 (1), 180-189 (2007).
- Kleber, A. G., Rudy, Y. Basic mechanisms of cardiac impulse propagation and associated arrhythmias. Physiological Reviews. 84 (2), 431-488 (2004).
- McPheeters, M. T., Wang, Y. T., Werdich, A. A., Jenkins, M. W., Laurita, K. R. An infrared optical pacing system for screening cardiac electrophysiology in human cardiomyocytes. PLoS ONE. 12 (8), 0183761 (2017).
- Gordon, A. M., Huxley, A. F., Julian, F. J. The variation in isometric tension with sarcomere length in vertebrate muscle fibres. The Journal of Physiology. 184 (1), 170-192 (1966).
- Li, Y., et al. Three Preservation Solutions for Cold Storage of Heart Allografts: A Systematic Review and Meta-Analysis. The Journal of Artificial Organs. 40 (5), 489-496 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados