Method Article
Optische Bildgebung von isolierten ventrikulären Myozyten
In diesem Artikel
Zusammenfassung
Wir stellen die Methodik zur Isolierung von murinen Myozyten vor und wie Spannungs- oder Kalziumspuren gleichzeitig mit Sarcomere-Verkürzungsspuren mittels Fluoreszenzphotometrie mit gleichzeitigen Messungen der digitalen Zellgeometrie erhalten werden können.
Zusammenfassung
Die Fähigkeit, adulte Herzmyozyten zu isolieren, hat es Forschern ermöglicht, eine Vielzahl von Herzpathologien auf einzelzellierebene zu untersuchen. Während Fortschritte bei kalziumempfindlichen Farbstoffen die robuste optische Aufzeichnung der einzelzelligen Calciumdynamik ermöglicht haben, ist die Aufzeichnung robuster transmembranoptischer Spannungssignale nach wie vor schwierig. Vermutlich liegt dies an dem geringen Verhältnis von Single zu Noise, der Phototoxizität und der Photobleaching traditioneller potentiometrischer Farbstoffe. Daher beschränken sich Einzelzellspannungsmessungen seit langem auf die Patchklemmtechnik, die zwar technisch anspruchsvoll und durchstöbeet ist. Mit der Entwicklung neuartiger potentiometrischer Farbstoffe können jedoch große, schnelle optische Reaktionen auf Spannungsänderungen ohne phototoxizität und Photobleaching erzielt werden. Dieses Protokoll beschreibt detailliert, wie erwachsene murine Myozyten isoliert werden können, die für zelluläre Verkürzung, Kalzium und optische Spannungsmessungen verwendet werden können. Insbesondere beschreibt das Protokoll, wie ein ratiometrischer Calciumfarbstoff, ein Calciumfarbstoff mit einer Anregung und ein einzelner Anregungsspannungsfarbstoff verwendet werden. Dieser Ansatz kann verwendet werden, um die Kardiotoxizität und Arrhythmogenität verschiedener chemischer Wirkstoffe zu bewerten. Während Phototoxizität immer noch ein Problem auf der Ebene der einzelnen Zellen ist, wird die Methodik diskutiert, wie sie reduziert werden kann.
Einleitung
Um das Herz in gesunden und pathologischen Zuständen zu untersuchen, ist es oft sinnvoll, den Phänotyp auf Einzelzellebene zu untersuchen. Während wissenschaftliche Fortschritte die robuste Messung der einzelzelligen Kalziumdynamik ermöglicht haben, sind einzellige optische Spannungsmessungen nach wie vor knapp1. Vermutlich liegt dies an dem niedrigen Signal-Rausch-Verhältnis (SNR), der Phototoxizität und der Photobleiche traditioneller potentiometrischer Farbstoffe2,3. Nichtsdestotrotz wurden isolierte optische Wirkungspotentiale für Myozyten erhalten2,3,4. Darüber hinaus hat sich der SNR mit Fortschritten in der Chemie und der Physik spannungsempfindlicher Farbstoffe verbessert5. Neuere Membran-Potentialsonden (Tabelle der Materialien) reagieren auf Veränderungen des Membranpotenzials in Submillisekunden und haben einen fluorogenen Ansprechbereich von ca. 25% pro 100 mV. Darüber hinaus ist die Anregung/Emission des Membranpotential-Kits (z. B. FluoVolt; Materialtabelle) in diesem Protokoll verwendet wird, arbeitet mit Standardfluoresceinisothiocyanat (FITC) oder grünen fluoreszierenden Proteinen (GFP) Einstellungen6.
Die FITC- und GFP-Erregungs-/Emissionsspektren überlappen sich mit den fluo-4 Calcium gebundenen Spektren7. Die gleichzeitige Erfassung der Fluoreszenzphotometrie mit messungen der digitalen Zellgeometrie wurde traditionell zur gleichzeitigen Erfassung von Kalzium- und Zellverkürzungsmessungen8eingesetzt. Dieses Protokoll beschreibt detailliert, wie man murine Myozyten isoliert und wie man Kalzium- oder Spannungssignale mit Standard-FITC-Einstellungen aufzeichnet. Darüber hinaus wird beschrieben, wie ein einfacher Schalter in Anregungs-/Emissionsfiltern am Bildgebungsarbeitsplatz verwendet werden kann, um Kalzium- und Verkürzungsmessungen mit dem Verhältnis metrischen Calciumfarbstoff fura-2 zu erhalten. Im Vergleich zu Fluo-4 hat Fura-2 eine höhere Affinität zu Kalzium und ist relativ resistent gegen Photobleichmittel9. Daher ermöglicht dieses Protokoll mit Hilfe einer einzigen Arbeitsstation eine gründliche Untersuchung der einzeln Myozyten-Anregungs-Kontraktionskopplung.
Protokoll
Alle in diesem Protokoll beschriebenen Methoden und Verfahren wurden vom Institutional Animal Care and Use Committee (IACUC) der Case Western Reserve University genehmigt.
1. Vorbereitung von Lösungen, Instrumenten und Coverlips
HINWEIS: 1x Lösungen können bis zu einem Monat verwendet werden.
- 10x Krebs-Henseleit Puffer HEPES Puffer ohne Kalzium (KHB-HB) durch Zugabe von 68,96 g NaCl, 3,57 g KCl, 59,58 g HEPES, 2,18 g K2HPO4, 3,08 g MgSO4 und 19,82 g Glukose bis 800 ml doppelt destilliertes Wasser in einem 1.000 ml Kolben. Nachdem der Inhalt vollständig aufgelöst ist, bringen Sie bis zu Volumen in einem 1.000 ml Volumetruhe.
HINWEIS: Die traditionelle Krebs Henseleit-Lösung verwendet Natriumbicarbonat als Puffer und die Lösung in diesem Protokoll verwendet Krebs Henseleit-Lösung mit HEPES-Puffer. Die Lösung ist für 6 Monate stabil, wenn sie steril gefiltert wird. - Machen Sie 10x Tyrodes Lösung durch Zugabe von 86,51 g NaCl, 0,552 g NaH2PO4, 2,03 g MgCl2, 9,91 g Glukose, 4,03 g KCl, 2,65 g CaCl2und 35,76 g HEPES bis 800 ml doppeldestilliertem Wasser in einem 1000 mLKolben. Nachdem der Inhalt vollständig aufgelöst ist, bringen Sie bis zu Volumen in einem 1000 ml Volumetruhe.
HINWEIS: Die Lösung ist 6 Monate lang stabil, wenn sie steril gefiltert wird. - Machen Sie 1x KHB-HB, indem Sie 100 ml des 10x Lagerbestands ausmessen und 875 ml doppelt destilliertes Wasser in einem 1.000 ml Kolben hinzufügen. Kolben in 37 °C Wasserbad legen. Sobald die Lösung 37 °C erreicht hat, verwenden Sie NaOH, um den pH-Wert auf 7,39 zu erhöhen. Nach der Einstellung des pH-Werts die Lösung in einem 1000 ml Volumetruhekolben aufbringen. Sterile Filter die Lösung mit einem Vakuumfiltrationssystem.
- Machen Sie 1x Tyrodes Lösung, indem Sie 100 ml des 10-fachen Lagerbestands messen und 875 ml doppelt destilliertes Wasser in einem 1.000 ml-Kolben hinzufügen. Kolben in 37 °C Wasserbad legen. Sobald die Lösung 37 °C erreicht hat, verwenden Sie NaOH, um den pH-Wert auf 7,39 zu erhöhen. Nach der Einstellung des pH-Werts die Lösung in einem 1.000 ml Volumetruhekolben aufbringen. Sterilfilter mit Vakuumfiltrationssystem.
- Machen Sie 1x modifizierte Tyrodes Lösung, indem Sie 100 ml des 10x-Lagers ausmessen und 875 ml doppelt destilliertes Wasser in einem 1.000 ml-Kolben hinzufügen. 3,07 g L-Glutathion im Kolben reduziert auflösen. Kolben in 37 °C Wasserbad legen. Sobald die Lösung 37 °C erreicht hat, verwenden Sie NaOH, um den pH-Wert auf 7,39 zu erhöhen. Nach der Einstellung des pH-Werts die Lösung in einem 1.000 ml Volumetruhekolben aufbringen. Sterile Filter die Lösung mit einem Vakuumfiltrationssystem.
- Machen Sie 100 mM Blebbistatin-Stammlösung, indem Sie 855 l Dimethylsulfoxid (DMSO) zu 25 mg Pulver hinzufügen. Aliquot in 20 L-Schritten heraus und bis zu sechs Monate in einem Gefrierschrank von -80 °C lagern.
- Machen Sie den Stopppuffer durch Zugabe von 2 g Rinderserumalbumin (BSA) und 1 Durchstechflasche mit aliquotedem Blebbistatin-Bestand zu 100 ml 1x KHB-HB und sterilen Filter der Lösung mit einem Vakuumfiltrationssystem.
- Herstellung eines Beschichtungspuffers durch Zugabe von 5 ml fetalem Rinderserum und 1 Durchstechflasche des aliquotedn Blebbistatin-Bestands zu 95 ml M199 HEPES. Sterile Filter die Lösung mit einem Vakuumfiltrationssystem.
- Machen Sie Myozytenkulturpuffer, indem Sie eine Durchstechflasche des aliquotedn Blebbistatin-Bestands und 4 mls Penicillin-Streptomycin zu 396 ml M199 (25 mM HEPES) hinzufügen. Sterile Filter die Lösung mit einem Vakuumfiltrationssystem.
- Autoklav 2 Paar Dumont Pinzette, 2 Paare von Iris gekrümmte Schere, 2 Hämostate, ein Paar plastische Chirurgie Zangen, 6 schwarze geflochtene Seide 4-0 Nähte angeordnet, um als chirurgische doppel-Wurf Knoten verwendet werden, und vier 100 ml Becher.
- Sterilisieren 22 x 22 mm2 Glasabdeckungen. Legen Sie zunächst einen einzigen Coverslip in jeden Brunnen einer sechs Brunnenplatte. Danach, mit dem Deckel entfernt, schalten Sie die UV-Lampe des Biosicherheitsschranks ein und setzen Sie die Abdeckungen für 1 h UV-Licht aus.
- Machen Sie funktionierende Laminin-Lager-Lösung, indem Sie zuerst die Flasche auf Eis auftauen. Fügen Sie den Inhalt einer Flasche zu genügend kaltsteriler Phosphat-gepufferter Saline (PBS) hinzu, um eine Endkonzentration von 0,04 mg/ml zu erreichen. Aliquot aus 1,3 l in autoklavierte 1,5 ml Zentrifugenrohre. Bei -80 °C lagern.
HINWEIS: Jedes Rohr hat genug Laminin für eine einzelne sechs Well-Platte. Vermeiden Sie mehrere Frost-Tau-Zyklen. - Mantel sterilisierter Deckelschlupf, indem Sie zuerst die arbeitende Lamininlösung auf Eis auftauen. Mit einer P1000 Pipette, aspirieren 200 l Laminin. Ziehen Sie die Pipettenspitze vorsichtig entlang einer Kante des Coverslip, damit die Kapillarwirkung eine winzige Menge Laminin herausziehen kann, um die Deckslipbefestigung an der sechs Brunnenplatte zu erleichtern.
- Dann vertreiben Sie das restliche Laminin in der Mitte des Deckels. In einer kreisförmigen Bewegung das Laminintröpfchen über den Deckelschieben verteilen. In einem 37 °C-Inkubator mindestens 1 h und bis zu 24 h vor der Isolierung platzieren.
2. Vorbereitung des Langendorff-Apparats
HINWEIS: Die einzelnen Komponenten des Langendorff-Geräts, die in diesem Protokoll verwendet werden, sind in der Tabelle der Materialienaufgeführt.
- Schalten Sie das zirkulierende Wasserbad ein. Stellen Sie die Temperatur so ein, dass Perfusate eine Temperatur von 37 °C hat.
HINWEIS: Bei einer Höhe von 60 cm müssen die Lösungsbehälter auf 41 °C eingestellt werden, damit die Perfusate 37 °C beträgt. Im Gegensatz zu zuvor gemeldeten Protokollen muss die Höhe des Reservoirs nicht geändert werden. - Spülen Sie das Langendorff-Gerät mit 70% Ethanol, gefolgt von zwei Spülungen mit autoklavierten doppeldestilliertem Wasser. Nach dem Spülen das Reservoir mit KHB-HB füllen und mit 100% Sauerstoff sauerstoffhaltigen Sauerstoff füllen.
- Primieren Sie das System, indem Sie sauerstoffhaltigen KHB-HB zuerst in einen 100 ml Becher fließen lassen. Sobald 50 ml Lösung in das Becherglas geflossen sind, schalten Sie die 3-Wege-Stop-Hahn-Position, um den Fluss aus dem KHB-HB-Reservoir zu stoppen. 50 ml mit Sauerstoff versorgtes KHB-HB aus dem Becherinker in das Kollagenasereservoir gießen.
- Lassen Sie den KHB-HB aus dem Verdauungsreservoir abtropfen, bis 5 ml im Kollagenase-Reservoir verbleiben. Während der Grundierung Kollagenase Reservoir, schalten Sie die 3-Wege-Stopp-Hahn wiederholt zwischen Reservoirs, damit die Linien zu entgasen. Nachdem das System grundiert ist, denken Sie daran, die Entgasungsfalle auf der Oberseite der Heizspule zu verwenden, damit die verbleibende Luft das System verlassen kann.
- Machen Sie die Kollagenase-Lösung. Für Ratten kombinieren 100 mg Typ II Kollagenase, 100 ml mit Sauerstoff KHB-HB und 2 Durchstechflaschen des Blebbistain-Bestands. Für Mäuse kombinieren Sie 100 mg Kollagennase typ II, 40 ml mit Sauerstoff gefülltem KHB-HB und 2 Durchstechflaschen des Blebbistain-Bestands. Einmal gemischt, sollte die Lösung für 1 h stabil sein.
HINWEIS: Die Myozytenlebensfähigkeit kann zwischen Denkolagenase-Lotsen typ II variieren. Nutzen Sie ein Collagenase-Sampling-Programm, um vor der Massenbestellung viel zu testen.
3. Myozytenisolation
- Injizieren Sie das Tier mit 1.000 U Heparin. Warten Sie 5 min.
HINWEIS: Mäuse und Ratten jeden Alters können verwendet werden. Im Allgemeinen jedoch, je älter oder mehr erkrankt das Tier, desto niedriger die Myozytenausbeute. - Opfern Sie das Tier, indem Sie es zuerst mit Isofluran mit der Open-Drop-Methode (1 cc Isofluran pro 500 ccm Volumen) anbemaßen, bevor Sie das Tier mit einer Pentobarbitalmischung einschläfern (150 mg/kg intraperitoneal).
- Schnell verbrauchen das Herz, indem Sie zuerst das Fell über dem xiphoiden Prozess greifen. Mit der Irisschere einen kleinen Schnitt direkt unterhalb des xiphoiden Prozesses machen und das Fell nach oben zum Kopf ziehen, der die Haut freilegt.
- Schnappen Sie sich den Xiphoid-Prozess und schneiden Sie das Zwerchfell, das die Brusthöhle freilegt. Machen Sie einen Falltürschnitt, ziehen Sie das Brustbein mit einem Hämostat zurück, und verwenden Sie die gekrümmten Zangen, um das Herz über der aufsteigenden Aorta zu verbrauchen und in kalteKHB-HB zu platzieren.
- Kanülieren Sie das Herz mit einem Stereomikroskop und der Nummer 5 Zangen. Stellen Sie sicher, dass das Herz untergetaucht ist und die Kanüle vor der Herzexzision grundiert wurde, um Emboli zu verhindern. Bestätigen Sie die richtige Positionierung der Kanüle, indem Sie die Spitze der Kanüle ca. 1 mm über dem Aorteneinsatz in den Ventrikel visualisieren.
ANMERKUNG: Je schneller die Cannulationszeit, desto besser die Myozytenausbeute. - Starten Sie den Fluss von KHB-HB, indem Sie den Stopphahn auf dem Langendorff drehen. Verbinden Sie die Kanüle mit dem Langendorff. Durchdringen Sie das Herz für 5 min.
HINWEIS: Da die Perfusion von einem schwerkraftbasierten System geliefert wird, wird der Fluss durch das Herz eine Funktion der koronaren Arterienkonformität sein. - Wechseln Sie die Perfusion vom KHB-HB-Reservoir zum Verdauungspufferreservoir. Sobald der Verdauungspuffer das Herz erreicht hat, stellen Sie einen Timer ein (5 min für die Maus oder 15 min für Ratte). Achten Sie darauf, die Perfusate in einem sterilen 100 ml Becher zu sammeln. Füllen Sie den Verdauungspufferbehälter nach Bedarf mit dem Perfusate nach, bis die Verdauungszeit abgelaufen ist.
- Nach der Verdauung die Herzkammern mit Zangen und der Irisschere in einem sterilen 100 ml Becher trennen. Legen Sie jede Kammer in einen separaten Brunnen einer sechs Brunnenplatte. Gießen Sie 5 ml Kollagennase-Lösung in jeden Brunnen.
- Sofort beginnen, das Herzgewebe mit einer Schere zu schneiden. Gewebestücke sollten ca. 1 mm3betragen. Mit sterilen Transferpipetten das gehackte Herzgewebe vorsichtig trituieren. Die Lösung sollte trüb werden.
- Sobald die Gewebestücke weiß und gefiedert werden, untersuchen Sie die Zellen mit einem invertierten Mikroskop. Wenn die Anzahl der lebensfähigen Zellen größer als 80 % ist, sollten Sie die Zellen mit einem 100 m Zellsieb in ein 50 ml konisches Rohr legen. Verwenden Sie für jede Kammer des Herzens eine andere Röhre und ein anderes Sieb.
- Wenn die Anzahl der lebensfähigen Zellen weniger als 80 % beträgt, überprüfen Sie die Zeit, die zum Cannulaten erforderlich war. Wenn die Cannulationszeit über 5 min beträgt, versuchen Sie es mit einem anderen Herzen. Wenn nicht, assay neue Kollagenase viel durch die Kollagenase Sampling-Programm.
- Pellet die Zellen durch Zentrifugieren bei 215 x g für 2 min. Das Pellet sollte kompakt und nicht locker sein. Wenn das Pellet lose ist, enthält das Präparat viele abgestorbene Zellen. In einer Gewebekulturhaube das Pellet in 10 ml Stopppuffer wieder aufsetzen.
- Pellet die Zellen durch Zentrifugieren bei 215 x g für 2 min. Das Pellet sollte kompakt und nicht locker sein. Wenn das Pellet lose ist, enthält das Präparat viele abgestorbene Zellen.
- Setzen Sie die Zellen in 5 ml Beschichtungspuffer wieder aus. Führen Sie eine Zellenanzahl aus. Passen Sie die Milliliter des Beschichtungspuffers an, um eine endgültige Myozytenkonzentration von 2 x 104 Zellen pro ml zu erreichen.
- Entfernen Sie die lamininbeschichteten Abdeckungen aus dem Inkubator. Aspirieren Sie das Laminintröpfchen.
- Platte 200 L Myozytenaufhängung auf jedem Deckel. In einen 37 °C-Inkubator (21% O2, 5% CO2) für 2 h legen, um eine Befestigung zu ermöglichen. Nach 2 h, aspirieren Sie die nicht angeschlossenen Zellen, fügen Sie 2 ml Kulturmedien und Kultur für bis zu 4 Tage hinzu.
4. Fura-2 Farbstoff Beladung
- Machen Sie eine 2 mM Fura-2 Acetoxymethylester (fura-2 AM) Stofflösung, indem Sie 25 l DMSO zu 50 g Fura-2 AM Pulver (1 Durchstechflasche) hinzufügen. Aliquot out in 6 L aliquots. Nehmen Sie 1 Aliquot von fura-2 AM und fügen Sie zu 6 ml Beschichtungsmedium hinzu. Wirbel zu mischen.
- Entfernen Sie 1 sechs Well-Platte von Myozyten aus dem Inkubator. Aspirat-Medien. Fügen Sie 1 ml Fura-2-Medienmischung zu jedem Brunnen hinzu. Deckplatte mit Folie abdecken, die Platte bei Raumtemperatur lassen und 15 min warten.
- Aspirieren Fura-2 Medienmischung und fügen Sie 1 ml Tyrodes Lösung zu jedem Brunnen hinzu. Abdeckung mit Folie. Warten Sie 20 min bei Raumtemperatur, um vor der Bildgebung farbstoffauswaschen zu können.
5. Fluo-4 Farbstoff Beladung
- Machen Sie eine 1,82 mM Fluo-4-Acetoxymethylester (fluo-4 AM) Stofflösung, indem Sie 25 l DMSO zu 50 g Fluo-4-AM-Pulver (1 Durchstechflasche) hinzufügen. Aliquot out in 8.333 'L aliquots. Nehmen Sie 1 Aliquot von Fluo-4 AM Vorrat und fügen Sie zu 6 ml Beschichtungsmedium hinzu. Wirbel zu mischen.
- Entfernen Sie 1 sechs Well-Platte von Myozyten aus dem Inkubator. Aspirat-Medien. Fügen Sie 1 ml Fluo-4 AM Medienmischung zu jedem Brunnen hinzu. Deckplatte mit Folie abdecken, die Platte bei Raumtemperatur lassen und 15 min warten.
- Aspirieren Fluo-4 AM Medienmischung und fügen Sie 1 ml Tyrodes Lösung zu jedem Brunnen hinzu. Abdeckung mit Folie. Warten Sie 20 min bei Raumtemperatur, um vor der Bildgebung farbstoffauswaschen zu können.
6. Membranpotenzial Farbstoff-Laden
- Entfernen Sie Komponente A und Komponente B aus dem Membranpotential-Kit. In einem 15 ml konischen Rohr 50 l Der Komponente B und 5 l der Komponente A. Vortex zum Mischen kombinieren. Fügen Sie dem 15 ml konischen Rohr, das das Spannungsfarbstoffgemisch enthält, 10 ml Beschichtungsmedien hinzu. Wirbel zu mischen.
- Entfernen Sie 1 sechs Well-Platte von Myozyten aus dem Inkubator. Aspirieren Sie die Medien. Fügen Sie jedem Brunnen 800 l des Membranpotential-Farbstoffgemisches hinzu. Deckplatte mit Folie abdecken, die Platte bei Raumtemperatur lassen und 15 min warten.
- Beschumen Sie die Medienmischung und fügen Sie jedem Brunnen 1 ml modifizierte Tyrodes Lösung hinzu. Abdeckung mit Folie.
7. Photometrie und Ladegekoppelte Geräteaufzeichnungen
- Schalten Sie das Gerät in der folgenden Reihenfolge ein: Mikroskop, Lichtbogenlampe, Hyperschalter, Fluoreszenzschnittstellensystem, Myocam-Netzteil, Feldstimulator und Computer.
- Stellen Sie sicher, dass die Anregungs-/Emissionsfiltersätze für den Bildfarber geeignet sind.
HINWEIS: Fura-2 ist bei 340 nm und 380 nm Licht aufgeregt. Es emittiert bei 510 nm Licht. Fluo-4 und der Spannungsmembranfarbstoff werden bei 485 nm Licht angeregt und emittieren bei 520 nm Licht. - Primieren Sie das System, indem Sie das Vakuum einschalten, die Schlauchklemme vollständig öffnen und jede 60 ml Spritze, die im Verteiler verwendet wird, sanft eintauchen. Für Kalziumaufnahmen verwenden Sie Die Tyrodes Lösung. Für Spannungsaufzeichnungen verwenden Sie modifizierte Tyrodes Lösung.
- Heizung einschalten und durch die Einstellung der Walzenklemme an den Perfusionsschläuchen einstellen. Machen Sie Aufnahmen bei 36 °C.
- Öffnen Sie die Erfassungssoftware. Stellen Sie sicher, dass die Parameter für den richtigen Bildfarbe färben.
- Im Dunkeln die Folie von der sechs Brunnenplatte entfernen und einen Deckelschlupf in die Schrittkammer legen. Stellen Sie sicher, dass der Stimulator in diesem Schritt ausgeschaltet ist. Konzentrieren Sie sich auf die Myozyten mit dem 10x Objektiv.
- Einmal im Fokus, beginnen Schritt durch Feld stimulierenbeit bei 1 Hz, 0,2 V. Schrittweise erhöhen die Spannung, bis 1:1 Schritt erreicht wird. Erhöhen Sie dann die Spannung, bis 1,5-fach der Schwellenwert erreicht ist.
HINWEIS: Da die Anregungs-Kontraktionskopplung temperaturabhängig ist, stellen Sie sicher, dass die Zellen 15 min lang durchdrungen wurden, bevor Sie aufgezeichnet werden. Dadurch können sich Myozyten von dem Schock erholen, von der Raumtemperatur zurück auf 37 °C zu gehen, sowie lose befestigte Zellen, um wegzuschwimmen. - Wechseln Sie vom 10x-Ziel zum 40x-Objektiv. Konzentrieren Sie sich auf eine Zelle, die einem 1:1-Tempo folgt. Passen Sie die Kunststofftöne so an, dass sich nur eine Zelle im Sichtfeld befindet.
- Mit der Software platzieren Sie den Interessenbereich auf klar definierten Sarcomeren. Starten Sie die Erfassungssoftware, um das Anregungslicht zu initiieren. Passen Sie die Intensitätseinstellung mithilfe der Neutraldichtefilter entsprechend an, um eine ausreichende SNR zu erhalten.
Ergebnisse
Abbildung 1A zeigt das Langendorff-Gerät. Der Sauerstoffator befindet sich im KHB-HB-Reservoir. Die Kollagenaselösung befindet sich im mittleren 60 ml Spritzenreservoir. Die Entgasungsleitung ist mit dem leeren 60 ml Spritzenbehälter verbunden. Nach erfolgreicher Isolierung sollten die meisten Zellen stabförmig und gestreift werden. Bei einem 40-fachen Ziel sollten die meisten Myozyten klare Streifen sichtbar haben. Abbildung 1B,C zeigt Beispiele für gesunde Ratte Myozyten. Einmal isoliert, können Zellen bis zu 4 Tage kultiviert werden, während ihre Morphologie und elektrischen Eigenschaften beibehalten werden.
Zur Messung der Anregungs-Kontraktionskopplung werden die Zellen dann in eine beheizte Schrittkammer gelegt. Da Myozyten empfindlich auf Temperaturänderungen reagieren, ist es wichtig, dass der Deckelrutsch vor der Aufnahme 15 min in der Kammer ausglich. Bei Fluoreszenzaufzeichnungen wird die Anregungswellenlänge durch eine 75 W Xenon-Arc-Lampe erzeugt. Xenon-Arc-Lampen erzeugen ein Lichtspektrum, das natürliches Sonnenlicht imitiert. Die Intensität des Lichts und die Wellenlänge werden durch neutrale Dichte-/Emissionsfiler gesteuert. Das Erregungslicht geht dann durch das Ziel zur Myozyten. Die Emissionswellenlänge wird dann durch ein Photomultiplierrohr gesammelt. Mit dem hier beschriebenen System müssen sowohl die Anregungs- als auch die Emissionsfilter manuell gewechselt werden.
Die Verkürzung erfolgt dagegen über einen aufgeladenen Gerätesensor. Die Erfassungssoftware misst in Echtzeit bis zu 1.000 Mal pro Sekunde und führt einen Durchschnitt der Linien innerhalb eines Interessenbereichs aus, um ein gut aufgelöstes Striationsmuster zu erstellen. Anschließend wird eine schnelle Fourier-Transformation (FFT) berechnet. Die Spitze innerhalb des Leistungsspektrums stellt den durchschnittlichen Sarcomere-Abstand dar. Änderungen im Sarcomere-Abstand während des Tempos werden dann geplottet und anschließend quantifiziert.
Abbildung 2 zeigt Kalzium- und Verkürzungsspuren, die von einer C57/B6-Mausmyozyten aufgezeichnet wurden, die mit dem Kalziumfarbstoff fura-2 beladen ist. Das Pacing-Protokoll ist eine Änderung der zuvor beschriebenen Pacing-Protokolle10,11. Gesunde Mausmyozyten sollten bei ihrer Ruheherzfrequenz von 10 Hz beschleunigt werden können. Abbildung 3 ist die Quantifizierung von ensembleierten gemittelten Daten, die von einem C57/B6-Mäusen und ihren transgenen (TG) Littermaten gewonnen wurden, deren Punktmutation in einen Kaliumkanal eingeführt wurde. Beachten Sie, dass es keinen Unterschied zwischen den Gruppen außer der Entspannungszeit bei 10 Hz Schritt.
Im Gegensatz zu fura-2, einem Dual-Erregungsfarbstoff, sind der Spannungsfarbstoff und Fluo-4 einwellige Anregungsfarbstoffe, deren Anregungs-/Emissionsarbeiten mit dem Standard-FITC-Anregungs- und Emissionsspektrum (494/506 nm) funktionieren. Daher können mit diesem Filtersatz Aufnahmen von Kalzium- und Sarcomere-Verkürzung oder Spannungs- und Sarcomere-Verkürzung erhalten werden.
Abbildung 4A zeigt eine Spannungsverfolgung, die von einer C57/B6-Mausmyozyten bei 10 Hz aufgezeichnet wurde. Im Vergleich zu Kalziumsignalen sind Einzelzellen-Spannungsverfolgungen in der Amplitude kleiner und benötigen nachbearbeitung, um ein verwendbares Signal zu erhalten. Abbildung 4B zeigt ein ensembleiertes gemitteltes Aktionspotenzial (AP) aus den APs in Abbildung 4A. Abbildung 4C,D zeigt einen ensembleierten durchschnittlichen AP, nachdem ein Tiefpass Butterworth oder ein Savitzky-Golay Digitalfilter angewendet wurde. Beim Filtern des Signals ist darauf zu achten, dass die realen Daten nicht verzerrt werden. Beachten Sie die feinen Unterschiede in der Form der APs in Abbildung 4B-D.
Abbildung 5 zeigt Spuren, die von Rattenmyozyten aufgezeichnet wurden, die bei 1 Hz gemessen wurden. Abgesehen davon, dass das Spannungssignal niedriger als das Kalziumsignal ist, ist auch die Kontraktiinetik unterschiedlich. Dies liegt daran, dass Kalziumfarbstoffe Kalzium puffern, spannungsgefärbt nicht.
Wie beim Kalziumtransienten (Abbildung 3) zeigten Myozyten auch in ihrer optischen Wirkungspotentialdauer (APD) tempoabhängige Veränderungen (Abbildung 6). Während die Fura-2-Spuren vor der Quantifizierung gemittelt wurden, wurden die Spannungsspuren mit einem Savitzky-Golay Polynomglättungsfilter (Breite 5, Ordnung 2) gefiltert, bevor sie gemittelt und quantifiziert wurden.
Wie in Abbildung 6 und Abbildung 7quantifiziert, zeigten sie neben dem Nachweis von pacing induzierten Veränderungen in APD auch eine drogeninduzierte Verlängerung des AP. Bei 4 Hz-Schritt führte eine konzentrationsabhängige Blockade des transienten Außenstroms (Ibis) mit 4-Aminopyridin zu einer Verlängerung der APD.
Schließlich ist darauf zu achten, zytotoxizität zu vermeiden. Abbildung 8 ist die letzten 11 s einer 20 s Aufnahme. Angezeigt durch die roten Pfeile in Abbildung 8führt eine längere Exposition von Myozyten gegenüber blauem Licht zu einer ausgelösten Aktivität.

Abbildung 1: Konstantdruck Langendorff-Gerät. (A) Der Langendorff-Apparat mit jeder Komponente, die mit weißem Schriftzug beschriftet ist. (B) Isolierte Sprague-Dawley Ratte Myozyten durch ein 10x Ziel betrachtet. (C) Isolierte Rattenmyozyten, die durch ein 40-faches Ziel betrachtet werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
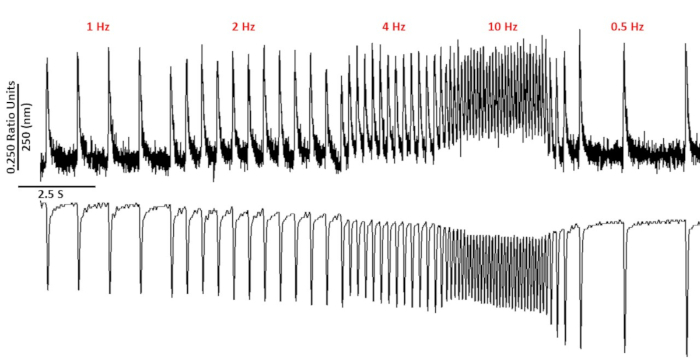
Abbildung 2: Repräsentative Kalzium- und Sarcomere-Verkürzungsspuren, die von C57/B6-Myoykten mit Fura-2 aufgezeichnet wurden. Calcium- und Sarcomere-Verkürzungsspuren, die bei 1, 2, 4, 10, 0,5 und 0,75 Hz aufgezeichnet wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
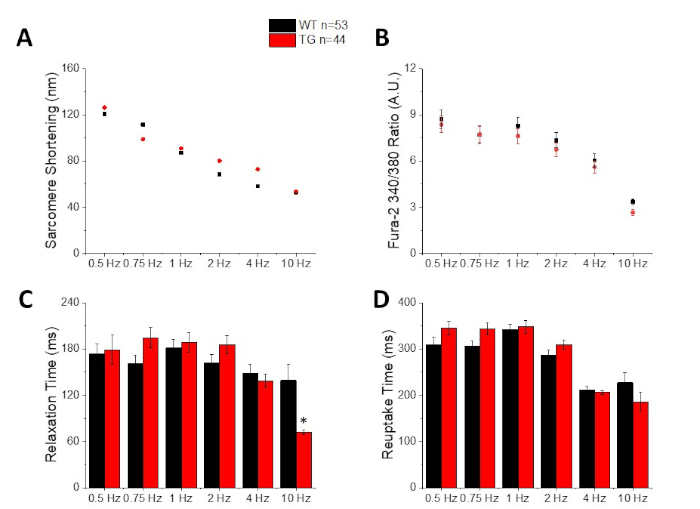
Abbildung 3: Quantifizierung von Sarcomere-Verkürzung, Peak-Calcium, Entspannungszeit und Rückaufnahmezeit, die von einem C57/B6-Wildtyp (WT) und transgenen (TG) Mäusen aufgezeichnet wurde. (A) Sarcomere Verkürzung. (B) Peak Calcium. (C) Entspannungszeit definiert als 90% Rückkehr zum Ausgangswert der Verkürzten Spur. (D) Rückaufnahmezeit definiert als 90% Rückkehr zum Ausgangswert der Kalziumspur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
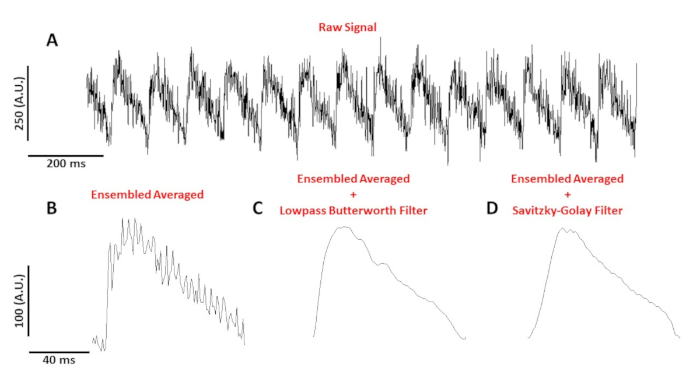
Abbildung 4: Optisches Aktionspotential, das von einem C57/B6-Mausmyozyten aufgezeichnet wurde, das bei 10 Hz liegt. (A) 1 Sekunde ungefilterte Ablaufverfolgung. (B) Ensembled gemitteltoptisches Aktionspotenzial. (C) Ensembled durchschnittliches optisches Aktionspotential nach einem Tiefpass-Butterworth-Filter. (D) Ensembled gemitteltoptisches Wirkungspotential nach einem Savitzky-Golay PolynomGlättungsfilter angewendet wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
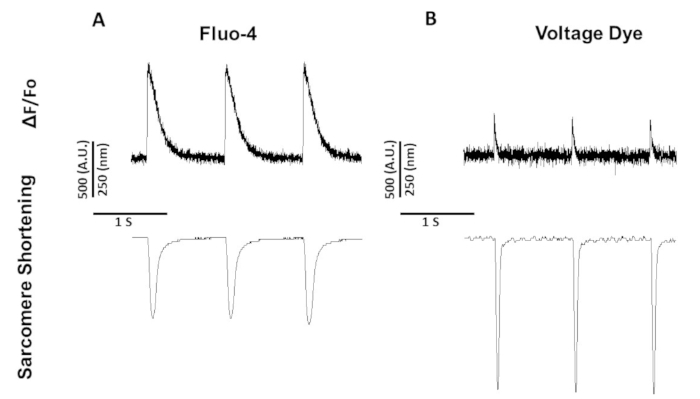
Abbildung 5: Repräsentative Kalzium-, Spannungs- und Sarcomere-Verkürzungsspuren, die von Sprague-Dawley-Rattenmyozyten aufgezeichnet wurden, schritten bei 1 Hz. (A) Calcium- und Sarcomere-Verkürzungsspuren, die bei 1 Hz-Takt mit Fluo-4 aufgezeichnet wurden. (B) Spannungs- und Sarcomere-Verkürzungsspuren, die bei 1 Hz Tempo mit dem Spannungsfarbstoff aufgezeichnet wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
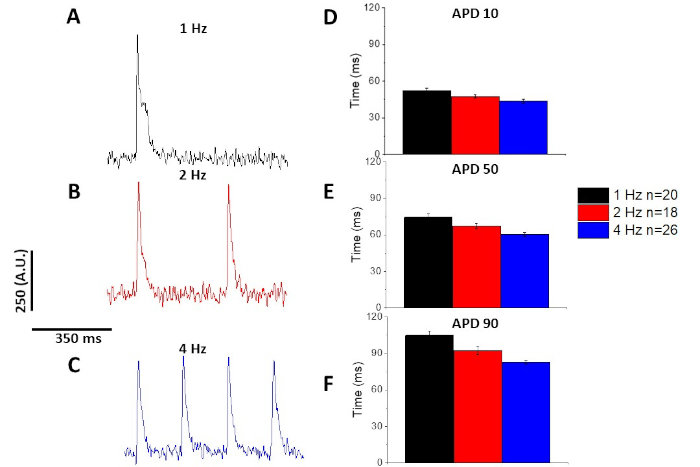
Abbildung 6: Optische Aktionspotentiale, die von Sprague-Dawley-Rattenmyozyten aufgezeichnet wurden, schritten bei Tempo 1, 2 und 4 Hz. (A) Gefilterte Spur, die bei 1 Hz-Schritt aufgezeichnet wurde. (B) Gefilterte Spur, die bei 2 Hz-Schritt aufgezeichnet wurde. (C) Gefilterte Spur, die bei 4 Hz-Takt aufgezeichnet wurde. (D) Aktionspotentialdauer 10, gemessen als 10% Rückkehr zum Ausgangswert. (E) Aktionspotentialdauer 50, gemessen als 50% Rückkehr zum Ausgangswert. (F) Aktionspotentialdauer 90, gemessen als 90% Rückkehr zum Ausgangswert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
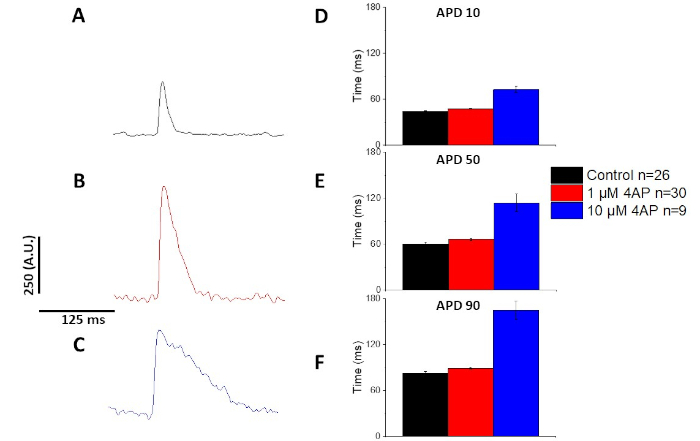
Abbildung 7: Die Auswirkungen von 4-Aminopyridin auf Sprague-Dawley Ratte optische Aktionspotentiale bei 4 Hz Schritt aufgezeichnet. (A) Ensembled gemittelte Spur aufgenommen bei 4 Hz Schritt mit ohne 4-Aminopyridin in der Lösung. (B) Ensembled averaged trace recorded at 4 Hz pacing with 1 'M 4-Aminopyridin in the solution. (C) Ensembled averaged trace recorded at 4 Hz pacing with 10 'M 4-Aminopyridin in the solution. (D) Aktionspotentialdauer 10, gemessen als 10% Rückkehr zum Ausgangswert. (E) Aktionspotentialdauer 50, gemessen als 50% Rückkehr zum Ausgangswert. (F) Aktionspotentialdauer 90, gemessen als 90% Rückkehr zum Ausgangswert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
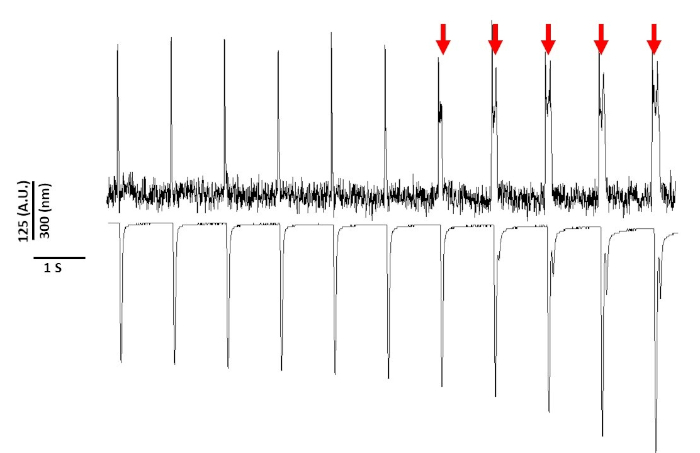
Abbildung 8: Spannungsfarbstoff induzierte Phototoxizität in Sprague-Dawley Ratte Myozyten nach 20 s kontinuierliche Lichtexposition. Rote Pfeile zeigen zytotoxische Ereignisse an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Fähigkeit, Herzmyozyten zu isolieren, ist eine leistungsfähige Methode, die verwendet werden kann, um Herzphysiologie, Pathologie und Toxikologie zu verstehen. Im obigen Protokoll beschrieben wir eine Methode, die einen konstanten Schwerkraftdruck Langendorff-Apparat verwendet, um einzelne Herzmyozyten zu erhalten. Anschließend beschreiben wir anhand des Fluoreszenzphotometriesystems, wie man gleichzeitig Kalzium und Verkürzung oder Spannung und Verkürzung von Spuren erfasst.
Aufgrund der unterschiedlichen Kinetik zwischen Denkalziumfarbstoffen ist zu beachten, welcher Farbstoff ausgewählt werden soll. Für dieses Protokoll wurden sowohl die verwendeten Fura-2- als auch fluo-4-Ester mit AM-Ester entwickelt, die einen Waschschritt erforderlich machten, um intrazelluläre Esterasen Zeit zu lassen, die AM-Gruppe zu spalten und den Farbstoff in der Zelle einzufangen. Während sowohl Fura-2 als auch Fluo-4 als kalziumreiche Farbstoffe mit hoher Affinität gelten, beträgt der Kd für Fura-2 145 nM im Vergleich zu 345 nM für Fluo-49. Darüber hinaus ist fura-2 ratiometrisch. Aus diesem Grund kann es verwendet werden, um intrazelluläre Kalziumspiegel9,12zu quantifizieren. Fluo-4 hingegen ist eine einwellige Calciumsonde. Der Vorteil der Verwendung von fluo-4 ist, dass es ein helleres Fluoreszenzsignal erzeugt. Unabhängig davon, welcher Kalziumfarbstoff verwendet wird, haben Membranspannungssonden im Vergleich zum Kalziumfarbstoff einen niedrigeren SNR.
Wie in Abbildung 4 und Abbildung 5dargestellt, sind Spannungsspuren im Vergleich zu Kalziumspuren in der Amplitude kleiner. Mit Der digitalen Ablaufverfolgungsfilterung der Software ist es möglich, den SNR zu erhöhen und die Daten zu quantifizieren (Abbildung 4 und Abbildung 7). Nach der Quantifizierung zeigen sowohl Kalziumtransienten als auch optische APDs restitutionsmittel und verkürzen ihre Dauer bei schnelleren Tempofrequenzen (Abbildung 2, Abbildung 3, Abbildung 6und Abbildung 7). Kürzere APDs während schnellerer Schrittzyklen sind notwendig, um genügend Zeit für die ventrikuläre Befüllung während der Diastole zu lassen. Veränderungen in diesem Phänomen wird angenommen, dass ein Hinweis auf eine Erhöhung des Risikos von Arrythmias13,14,15,16. Während Veränderungen in APD durch Krankheiten verursacht werden können, können sie auch durch Chemikalien verursacht werden. Wie in Abbildung 7gezeigt, wird die optische APD länger, wenn der vorherrschende murine repolarisierende Kaliumstrom, Ibis, blockiert ist.
Dennoch, wie bereits berichtet mit spannungsempfindlichen Farbstoffen, Lichtintensität und Dauer können die APD2,5,17ändern. Es wird angenommen, dass dies das Ergebnis der Erzeugung von reaktiven oxidativen Arten (ROS)5ist. Zuvor wurde gezeigt, dass die Zugabe von Antioxidantien zur Aufnahmelösung spannungsempfindliche Farbstoffzytotoxizität verhindern kann5. Als Ergebnis haben wir das Antioxidans L-Glutathion (10 mM) zu Tyrodes Lösung hinzugefügt. In Abbildung 8 ist die letzte 11 s einer 20 s Aufnahme erhalten bei 1 Hz Schritt. Wie durch die roten Pfeile angegeben, traten Änderungen in der APD erst nach 15 s in der Aufnahme auf; Die modifizierte Tyrodes Lösung verhinderte jedoch keine Phototoxizität, verzögerte sie jedoch erheblich. Mit modifizierter Tyrodes Lösung, mit einer niedrigen Lichtintensitätseinstellung und der Beibehaltung der Dauer der Aufnahme auf unter 5 s, ist es möglich, jegliche Farbstoff-induzierte Veränderungen in APD zu vermeiden. Dies ist wichtig, da die Daten ohne darauf zu achten, Phototoxizität zu vermeiden, fehlinterpretiert werden könnten, da sie nach Depolarisationen früh oder verzögert sind. Neben der Begrenzung der Exposition gegenüber blauem Licht gibt es zusätzliche Vorsichtsmaßnahmen, die getroffen werden können, um eine Fehlinterpretation der Daten zu verhindern.
Die erste besteht darin, nur zellen aufzuzeichnen, die eins zu eins folgen und eine ruhende Sarkome-Länge haben, die größer oder gleich 1,75 m ist. Der 1,75 m-Cutoff wird der Beobachtung von Gordon et al.18 entnommen, dass die Spannung rapide abnimmt, sobald die Sarcomere-Länge unter dieser Menge liegt. Dennoch können bestimmte Pathologien zu signifikanten Veränderungen der ruhenden Sarcomere-Länge führen. Um sicher zu sein, dass der Phänotyp real ist und kein Artefakt der Isolation ist, sollten die folgenden Problemaufnahmeansätze ergriffen werden.
Wenn Myozyten konsequent nicht dem Tempo 1:1 folgen, Sarcomerelängen unter 1,75 m haben, schwere Membranbimmern haben oder die Isolation nicht überleben, ist das erste, was überprüft werden muss, die Zeit, die es brauchte, um das Herz zu kanülieren. Je länger die Cannulationszeit, desto geringer ist die Ausbeute. Wenn eine lange Cannulationszeit erforderlich ist, kann die Lebensfähigkeit verbessert werden, indem das Herz in eine kardiopdioplegische Lösung19. Da die Kollagenase ein Enzym ist, ändern sich jedoch die Aktivität und Spezifität einer bestimmten Menge im Laufe der Zeit. Wenn sich die Gesamterträge trotz guter Cannulationszeiten allmählich verschlechtern, sollten neue Lose geprüft werden. Während unser Protokoll für 5 s Aufnahmen optimiert wurde, müssen zusätzliche Neutraldichtefilter angeschafft werden, wenn längere Spannungsspuren benötigt werden. Das im Protokoll beschriebene System verfügt über Neutraldichtefilter, die das übertragene Licht um 37 %, 50 %, 75 %, 90 % und 95 % reduzieren.
Zusammenfassend beschrieben wir eine Methode, die die Isolierung von erwachsenen murinvenventrikulären Myozyten ermöglichte, die für Kalzium-, Spannungs- und Sarcomere-Verkürzungsmessungen verwendet wurden.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken Dana Morgenstern für die sorgfältige Korrektur des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.25 Liter Water Jacketed Reservoir | Radnoti, LLC | 120142-025 | |
| 1 liter volumetric flask | Fisher Scientific | 10-205F | |
| 100 ml beaker | Fisher Scientific | FB-100-100 | |
| 100 ml graduated cylinder | Fisher Scientific | 08 562 5C | |
| 1000 ml flask | Fisher Scientific | FB-500-1000 | |
| 2-Bar Lab Stand with Stabilizer Bar and 24" Stainless Steel Rods | Radnoti, LLC | 159951-2 | |
| 4-Aminopyridine | Sigma-Aldrich | 275875 | |
| 40X Oly UApo/340 Non-Immersion Objective (NA 0.9, WD 0.2mm) | IonOptix | MSCP1-40 (b) | |
| 60-mL syringe, BD Luer-Lok tip | BD | 309650 | |
| Aortic Metal Cannulae | Harvard Apparatus | 73-0112 | |
| Bovine Serum Albumin | Fisher Scientific | BP9703-100 | |
| C-6 Standard Heating Circulator | Chemyx | A30006 | |
| CaCl2 | Fisher Scientific | BP510500 | |
| Cell framing adapter | IonOptix | CFA300 | |
| CellPr0 Vacuum Filtration System, 1 liter, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V100022 | |
| CellPro Vacuum Filtration System, 250mL, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V25022 | |
| CellPro Vacuum Filtration System, 500mL, 0.22µm,12/CS | Labratory Product Sales, Inc | V50022 | |
| CMC (mTCII) Temp Control w/ inline flow heater | IonOptix | TEMPC2 | |
| Cole-Parmer Large-bore 3-way, male-lock, stopcocks | Cole-Parmer | EW-30600-23 | |
| Cole-Parmer Luer fittings, Large-bore stopcocks, male lock, 4-way | Cole-Parmer | EW-30600-12 | |
| Cole-Parmer Stopcocks with Luer Connections; 1-way; male slip | Cole-Parmer | EW-30600-01 | |
| Collagenase Type II | Worthington | LS004177 | |
| Corning Sterile Cell Strainers | Fisher Scientific | 07-201-432 | |
| Dell Optiplex 790 mini-tower, 4G RAM, 250G HD, Windows 7 Pro | IonOptix | CPUD7M | |
| DMSO | Fisher Scientific | 50980367 | |
| Dumont Tweezers Style 5 | Amazon | B00F70ZDEQ | |
| FHD Rapid Change Stimulation Chamber | IonOptix | FHDRCC1 | |
| Fluo-3/4 Optics Package | IonOptix | IonOP-Fluo | |
| Fluorescence system interface – (w PCI-I/O card) | IonOptix | FSI700 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher Scientific | 15-140-122 | |
| Glucose | Fisher Scientific | D16-1 | |
| Hemostat, Curved 5-1/2" | Amazon | B00GGAAPD0 | |
| HEPES | Fisher Scientific | BP310500 | |
| HyperSwitch dual excitation light source | IonOptix | HSW400 | |
| Inverted Motic Fluorescence Microscope | IonOptix | MSCP1-40 (a) | |
| IonWizard Core + Analysis | IonOptix | IONWIZ | |
| Iris Scissors, curved | Amazon | B018KRRMY6 | |
| K2HPO4 | Fisher Scientific | P288-100 | |
| KCl | Fisher Scientific | BP3661 | |
| L-Glutathione reduced | Sigma-Aldrich | G4251 | |
| LOOK Silk Spool, Black Braided, 4-0, 100yds | SouthernAnesthesiaSurgical Inc. | SP116-EA | |
| M199 Media | Fisher Scientific | 12 340 030 | |
| MgCl2 | Fisher Scientific | MP021914215 | |
| MgSO4 | Fisher Scientific | BP2131 | |
| MyoCam-S Digital CCD video system | IonOptix | MCS100 | |
| MyoPacer Field Stimulator | IonOptix | MYP100 | |
| NaCl | Fisher Scientific | BP358212 | |
| NaH2PO4 | Fisher Scientific | 56-754-9250GM | |
| Oxygenator Bubbler with Fluid Inlet for 0.25 Liter | Radnoti, LLC | 140143-025 | |
| Photomultiplier sub-system | IonOptix | PMT400 | |
| PMT Acquisition add-on | IonOptix | PMTACQ | |
| Radnoti Heating Coil 5 mL with Degasing Trap | Radnoti, LLC | 158830 | |
| Ring Clamp 60 – 80mm Dia. for 250ml Reservoir | Radnoti, LLC | 120141-025 | |
| Ring Clamp for Bubble Trap Compliance Chamber | Radnoti, LLC | 120149RC | |
| Saint-Gobain ACF000010 5/32 in.9/32 in. | Fisher Scientific | 14-171-214 | |
| Saint-Gobain ACF000013 3/16 in.3/8 in. | Fisher Scientific | 14-171-217 | |
| Saint-Gobain ACF000016 1/4 in.5/16 in. | Fisher Scientific | 14-171-219 | |
| Saint-Gobain ACF000025 5/16 in.5/8 in. | Fisher Scientific | 14-171-226 | |
| Saint-Gobain ACF00003 1/16 in.3/16 in. | Fisher Scientific | 14-171-209 | |
| Saint-Gobain ACF00005 1/16 in.3/32 in. | Fisher Scientific | 14-171-210 | |
| Saint-Gobain ACF00009 5/32 in.7/32 in. | Fisher Scientific | 14-171-213 | |
| Sarcomere Length Recording add-on | IonOptix | SARACQ | |
| T/C Adson Tissue Platic Surgery Forceps 4.75" | Amazon | B00JDWRBGC | |
| VETUS Anti-Static Curved Tip Tweezers | Amazon | B07QMZC94J | |
| Vistek 3200 Motic Vibration Isolation Platform | IonOptix | ISO100 |
Referenzen
- Hagen, B. M., Boyman, L., Kao, J. P., Lederer, W. J. A comparative assessment of fluo Ca2+ indicators in rat ventricular myocytes. Cell Calcium. 52 (2), 170-181 (2012).
- Schaffer, P., Ahammer, H., Muller, W., Koidl, B., Windisch, H. Di-4-ANEPPS causes photodynamic damage to isolated cardiomyocytes. Pflügers Archiv: European Journal of Physiology. 426 (6), 548-551 (1994).
- Hardy, M. E., Lawrence, C. L., Standen, N. B., Rodrigo, G. C. Can optical recordings of membrane potential be used to screen for drug-induced action potential prolongation in single cardiac myocytes. Journal of Pharmacological and Toxicological Methods. 54 (2), 173-182 (2006).
- Tian, Q., et al. Optical action potential screening on adult ventricular myocytes as an alternative QT-screen. Cellular Physiology and Biochemistry. 27 (3-4), 281-290 (2011).
- Warren, M., et al. High-precision recording of the action potential in isolated cardiomyocytes using the near-infrared fluorescent dye di-4-ANBDQBS. The American Journal of Physiology-Heart and Circulatory Physiology. 299 (4), 1271-1281 (2010).
- FluoVolt™ Membrane Potential Kit. ThermoFisher Scientific Available from: https://assets.thermofisher.com/TFS-Assets/LSG/manuals/MAN0009668_FluoVolt_Membrane_Potential_Kit_UG.pdf (2018)
- Fluorescence SpectraViewer. ThermoFisher Scientific Available from: https://www.thermofisher.com/us/en/home/life-science/cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html (2019)
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Davis, J., et al. Diastolic dysfunction and thin filament dysregulation resulting from excitation-contraction uncoupling in a mouse model of restrictive cardiomyopathy. The Journal of Molecular and Cellular Cardiology. 53 (3), 446-457 (2012).
- Ren, J., Davidoff, A. J. Diabetes rapidly induces contractile dysfunctions in isolated ventricular myocytes. The American Journal of Physiology. 272, 148-158 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Goldhaber, J. I., et al. Action potential duration restitution and alternans in rabbit ventricular myocytes: the key role of intracellular calcium cycling. Circulation Research. 96 (4), 459-466 (2005).
- Weiss, J. N., et al. The dynamics of cardiac fibrillation. Circulation. 112 (8), 1232-1240 (2005).
- Baher, A., et al. Short-term cardiac memory and mother rotor fibrillation. The American Journal of Physiology-Heart and Circulatory Physiology. 292 (1), 180-189 (2007).
- Kleber, A. G., Rudy, Y. Basic mechanisms of cardiac impulse propagation and associated arrhythmias. Physiological Reviews. 84 (2), 431-488 (2004).
- McPheeters, M. T., Wang, Y. T., Werdich, A. A., Jenkins, M. W., Laurita, K. R. An infrared optical pacing system for screening cardiac electrophysiology in human cardiomyocytes. PLoS ONE. 12 (8), 0183761 (2017).
- Gordon, A. M., Huxley, A. F., Julian, F. J. The variation in isometric tension with sarcomere length in vertebrate muscle fibres. The Journal of Physiology. 184 (1), 170-192 (1966).
- Li, Y., et al. Three Preservation Solutions for Cold Storage of Heart Allografts: A Systematic Review and Meta-Analysis. The Journal of Artificial Organs. 40 (5), 489-496 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten