Method Article
הדמיה אופטית של מודציטים מבודדים המוח החדרית
In This Article
Summary
אנו מציגים את המתודולוגיה עבור בידוד של מוציטים מורטין וכיצד להשיג מתח או סימני הסידן במקביל עם הקיצור סרקומר באמצעות מכשירי האור הפלואורסצנטית עם מדידות הגיאומטריה הדיגיטלית בו.
Abstract
היכולת לבודד מיציטים לב מבוגרים התיר לחוקרים ללמוד מגוון של פתווגיות לב ברמת התא הבודד. בעוד ההתקדמות בצבעי סידן רגישים הרשו את ההקלטה האופטית חזק של הדינמיקה בודד של התאים הסידן, הקלטה של אותות חזקים חלבון טראנסממברנלי מתח אופטי נשאר קשה. לטעון, זה בגלל יחס נמוך יחיד לרעש, פוטורעילות, והלבנת של צבעים הפוטנציאל המסורתי. לכן, בודד תא מדידות מזמן כבר מוגבל לטכניקת מהדק תיקון אשר בעוד התקן הזהב, הוא דורש מבחינה טכנית ותפוקה נמוכה. עם זאת, עם התפתחות של צבעים בעלי פוטנציאל הרומן, גדול, תגובות אופטיות מהירות שינויים במתח ניתן להשיג עם מעט ללא רעילות והלבנת. פרוטוקול זה מתאר בפרוטרוט כיצד לבודד תאי מבוגר מסתורי שבו ניתן להשתמש עבור קיצור הסלולר, סידן, ומדידות מתח אופטי. באופן ספציפי, הפרוטוקול מתאר כיצד להשתמש בצבע סידן מומטרי, צבע סידן בעלי עירור יחיד, צבע מתח יחיד עירור. ניתן להשתמש בגישה זו כדי להעריך את הקרדיולוקסיניטי והפרעות קצב של גורמים כימיים שונים. בעוד פוטורעילות היא עדיין בעיה ברמת התא בודד, מתודולוגיה נדונה על איך להקטין אותו.
Introduction
כדי ללמוד את הלב במהלך מדינות בריאות ופתולוגי, הוא מועיל לעתים קרובות לבחון את הפנוטיפים במפלס התא הבודד. בעוד ההתקדמות המדעית אפשרה את המדידה החזקה של דינמיקה בודדת הסידן התאים, תא יחיד מדידות מתח אופטי נותרו נדירים1. ללא ספק, זה בגלל האות נמוך ליחס רעש (SNR), פוטורעילות, ו פוטולבנת של צבעים הפוטנציאל המסורתי2,3. עם זאת, מבודדים myocyte אופטי פעולה פוטנציאליות הושגו2,3,4. עוד, עם ההתקדמות בכימיה והפיזיקה של צבעים רגישים מתח, SNR השתפר5. ממברנה חדשה בדיקה פוטנציאליים (טבלה של חומרים) להגיב לשינויים בפוטנציאל ממברנה בתת-מילישניות יש טווח תגובה fluorogenic של כ -25% לכל 100 mV. עוד, עירור/פליטה של ערכת פוטנציאל הממברנה (למשל, FluoVolt ולט; רשימת חומרים) בשימוש בפרוטוקול זה עובד עם fluorescein רגיל isothiocyanate (FITC) או חלבון פלורסנט ירוק (GFP) הגדרות6.
הריגוש FITC ו-GFP העירור/פליטת הפליטה חפיפה עם fluo-4 סידן מאוגד ספקטרום7. רכישה מקבילה של מדידות הגיאומטריה של תאים דיגיטליים באופן מסורתי, שימשו לרכישה בו של מדידות הסידן והסלולר8. פרוטוקול זה מתאר בפרוטרוט כיצד לבודד את מיוזיציטים וכיצד להקליט אותות סידן או מתח באמצעות הגדרות FITC סטנדרטיות. בנוסף, הוא מתאר כיצד מתג פשוט ב מסנני עירור/פליטה על תחנת העבודה הדמיה ניתן להשתמש כדי להשיג סידן וקיצור מדידות באמצעות מדד הסידן לצבוע fura-2. לעומת fluo-4, fura-2 יש זיקה גבוהה יותר עבור סידן והוא עמיד יחסית כדי photobleaching לבנה9. כתוצאה מכך, שימוש בתחנת עבודה בודדת פרוטוקול זה מאפשר בדיקה יסודית של צימוד עירור התכווצות מיציט.
Protocol
כל השיטות וההליכים המתוארים בפרוטוקול זה אושרו על ידי הוועדה לטיפול בבעלי חיים מוסדיים (IACUC) של אוניברסיטת מילואים קייס ווסטרן.
1. הכנת פתרונות, כלים וכיסוי
הערה: ניתן להשתמש בפתרונות 1x עד חודש.
- הפוך 10x קרבס-Henseleit מאגר HEPES מאגר ללא סידן (KHB-HB) על ידי הוספת 68.96 g של הנרוג, 3.57 g של KCl, 59.58 g של HEPES, 2.18 g של K2hpo4, 3.08 g של mgso4 ו 19.82 g של גלוקוז כדי 800 ml של מים כפולים מזוקקים בבקבוקון לאחר התוכן הם התפרקה לחלוטין, להעלות את הנפח בבקבוקון 1,000 mL נפחי.
הערה: המסורתית Krebs Henseleit פתרון משתמש נתרן ביקרבונט כמאגר ואת הפתרון בפרוטוקול זה משתמש בפתרון Krebs Henseleit עם מאגר HEPES. הפתרון יציב למשך 6 חודשים אם מסונן סטרילי. - הפוך את הפתרון של 10x Tyrode על ידי הוספת 86.51 g של הנרוג, 0.552 g של נה2פו4, 2.03 g של mgcl2, 9.91 g של גלוקוז, 4.03 g של Kcl, 2.65 g של cacl2, ו 35.76 g של hepes כדי 800 ml של מים מזוקקים כפולים בבקבוקון של 1000 ml. לאחר התוכן הם התפרקה לחלוטין, להעלות את הנפח בבקבוקון 1000 mL נפחי.
הערה: הפתרון יציב למשך 6 חודשים אם מסונן סטרילי. - הפוך 1x KHB-HB על-ידי מדידת 100 mL של מלאי 10x והוספת 875 mL של מים כפולים מזוקקים בבקבוקון של 1,000 mL. מניחים בקבוקון ב 37 מעלות צלזיוס באמבט מים. לאחר הפתרון הגיע 37 ° c, השתמש NaOH כדי להגדיל את ה-pH כדי 7.39. לאחר התאמת ה-pH, להביא פתרון נפח בבקבוקון 1000 mL. המסנן הסטרילי מסנן את הפתרון בעזרת מערכת סינון ואקום.
- הפוך את הפתרון של 1x Tyrode על ידי מדידת 100 mL של מלאי 10x והוספת 875 mL של מים כפולים מזוקקים בבקבוקון של 1,000 mL. מניחים בקבוקון ב 37 מעלות צלזיוס באמבט מים. לאחר הפתרון הגיע 37 ° c, השתמש NaOH כדי להגדיל את ה-pH כדי 7.39. לאחר התאמת ה-pH, להביא פתרון נפח בבקבוקון 1,000 mL. מסנן סטרילי באמצעות מערכת סינון ואקום.
- לעשות 1x שונה הפתרון של Tyrode על ידי מדידת 100 mL של מלאי 10x והוספת 875 mL של מים כפולים מזוקקים בבקבוקון של 1,000 mL. התמוססות 3.07 גרם של L-גלוטתיון הופחת בבקבוקון. מניחים בקבוקון ב 37 מעלות צלזיוס באמבט מים. לאחר הפתרון הגיע 37 ° c, השתמש NaOH כדי להגדיל את ה-pH כדי 7.39. לאחר התאמת ה-pH, להביא פתרון נפח בבקבוקון 1,000 mL. המסנן הסטרילי מסנן את הפתרון בעזרת מערכת סינון ואקום.
- להפוך את הפתרון 100 mM בלייבסטטין מניות על ידי הוספת 855 μL של diמתיל סולפוקסיד (DMSO) כדי 25 מ ג של אבקה. מוחלקים החוצה ב 20 μL בהפרשים ולאחסן במקפיא 80 ° c עד שישה חודשים.
- הפוך את מאגר העצירה על-ידי הוספת 2 g של סרום הפרה אלבומין (BSA) ו-1 בקבוקון של מלאי בליבסטטין מצוטט ל100 mL של 1x KHB-HB ו סטרילי לסנן את הפתרון באמצעות מערכת סינון ואקום.
- להפוך מאגר ציפוי על ידי הוספת 5 מ ל של סרום העוברי העובר ו 1 בקבוקון של מלאי מצוטט בלייטסטטין ל95 mL של M199 HEPES. המסנן הסטרילי מסנן את הפתרון בעזרת מערכת סינון ואקום.
- הפוך את מאגר התרבות myocyte על-ידי הוספת אחד בקבוקון 1 של המניה מצוטט בליבלייסטטין ו 4 mls-סטרפטומיצין ל 396 mL של M199 (25 מ"מ HEPES). המסנן הסטרילי מסנן את הפתרון בעזרת מערכת סינון ואקום.
- אוטוקלב 2 זוגות של דומונט מלקחיים, 2 זוגות של מספריים איריס מעוקל, 2 הומוסטטיסטיקה, זוג אחד של מלקחיים כירורגיה פלסטית, 6 משי קלוע שחור 4-0 תפרים מסודרים לשמש כמו קשר כפול כירורגי לזרוק, ו 4 100 mL כוסות.
- לחטא 22 x 22 מ"מ2 כיסוי זכוכית. ראשית, הציבו שמיכות בודדות. בכל באר של שש צלחות לאחר מכן, כאשר המכסה הוסר, להדליק את המנורה uv של הקבינט אבטחה טיחות ולחשוף את הכיסויים לאור uv עבור 1 h.
- להפוך את העבודה למינציה בפתרון המניה על ידי הראשון להפשיר את הבקבוק על הקרח. הוסף תוכן של בקבוק אחד כדי מספיק קפוא פוספט מואגור מלוחים (PBS) כדי להגיע לריכוז הסופי של 0.04 mg/mL. מחלקים את 1.3 μl לתוך בלוק 1.5 מנורות צנטריפוגה mL. חנות ב-80 ° c.
הערה: לכל צינור יש מספיק למינציה לצלחת בודדת בת שש שנים. הימנע ממחזורים מרובים של הקפאת ההקפאה. - מעיל עיקור שמיכות על ידי היפנק הראשון עובד למינציה בפתרון על קרח. , שימוש בפיפטה P1000. מחלק 200 μL של למינציה בעדינות לגרור את העצה הפיפטה לאורך קצה אחד של coverslip כדי לאפשר פעולה קפילר להוציא כמות זעירה של למינציה כדי להקל על ההחזקה שמיכות לצלחת ששת הבאר.
- לאחר מכן, לגרש את שארית למינציה במרכז הכיסויים. בתנועה סיבובית, הפיצו את הלמינציה ב-droplet לרוחב הכיסויים. מניחים בחממה 37 ° c לפחות 1 h עד 24 שעות לפני הבידוד.
2. הכנת מנגנון לנגדורף
הערה: הרכיבים הבודדים של מנגנון הלנגדורף המשמשים בפרוטוקול זה מפורטים ברשימת החומרים.
- . תדליק את אמבטיית המים במחזור הגדר טמפרטורה כך שלמבשם יש טמפרטורה של 37 ° c.
הערה: כאשר מאגרי הפתרונות מוגדרים לגובה של 60 ס מ, יש להגדיר את לידת המים במחזור כדי 41 ° c כדי שהמענה יהיה 37 ° c. בניגוד לפרוטוקולים שדווחו קודם לכן, אין צורך לשנות את גובה המאגר. - שטפו את המנגנון לנגנדורף עם 70% אתנול ואחריו שני רינסים עם מים מזוקקים כפולים אוטוקלתיים. לאחר שטיפה, מילוי מאגר עם KHB-HB ו חמצן עם 100% חמצן.
- הממשלה את המערכת על ידי מתן מחמצן KHB-HB לזרום הראשון לתוך גביע 100 mL. לאחר 50 mL של הפתרון זרמו לתוך הגביע, להחליף את 3-הדרך לעצור-הזין עמדה להפסיק לזרום ממאגר KHB-HB. יוצקים 50 mL של KHB מחמצן-HB מתוך הגביע לתוך המאגר של הקולגן.
- תן את הניקוז KHB-HB מתוך מאגר העיכול עד 5 מ"ל נשאר במאגר מאגר הקולגן. בעוד לקרקע מאגר הקולגן, להחליף את התרנגול 3-הדרך להפסיק שוב ושוב בין מאגרים כדי לאפשר את הקווים לדגה. לאחר שהמערכת מופעלת, זכור להשתמש במלכודת המגנטיות הממוקמת על גבי סליל החימום, כדי לאפשר לשאר האוויר לצאת מהמערכת.
- . תעשה את הפתרון לקולגן עבור חולדות לשלב 100 מ ג של סוג II הקולגן, 100 mL של KHB-HB, ו 2 בבקבוקונים של המניות כתם כתמים. עבור עכברים, לשלב 100 מ"ג מסוג II הקולגן, 40 mL של KHB-HB, ו 2 בבקבוקונים של המניה כתם בלייב. פעם מעורבב, הפתרון צריך להיות יציב עבור 1 h.
הערה: יכולת הכדאיות של מיציט יכולה להשתנות בין הרבה מסוגי הקולגן. נצל את היתרונות של תוכנית דגימה הקולגן כדי לבדוק הרבה לפני הזמנת בצובר.
3. מיציט בידוד
- הכנס את בעל החיים עם 1,000. . חכה 5 דקות
הערה: ניתן להשתמש בעכברים וחולדות בכל גיל. עם זאת, באופן כללי החיה המבוגרת או החולה יותר, הנמוך ביותר היבול המיציט. - הקריבו את החיה באמצעות ההרדמה הראשונה באמצעות שיטת הפתיחה הפתוחה (1 cc isofלאנה ל500 cc) לפני המתת החסד של החיה עם תערובת פנטוברביטל (150 מ"ג/ק"ג בתוך הצפק).
- לבלו את הלב במהירות על ידי הראשון תופס את הפרווה מעל התהליך xiphoid. עם המספריים של הקשתית, עשו חתך קטן מיד מתחת לתהליך xiphoid ומשכו את הפרווה כלפי מעלה לכיוון הראש החושף את העור.
- לתפוס את התהליך xiphoid ולחתוך את הסרעפת חשיפת חלל החזה. לעשות חתך דלת מלכודת, למשוך את עצם החזה בחזרה באמצעות המעי, ולהשתמש מלקחיים מעוקל כדי לבלו את הלב מעל אב העורקים העולה ומקום קר KHB-HB.
- שימוש במיקרוסקופ סטריאו. ומלקחיים מספר 5 ודאו שהלב מתחת לפני השקוע והצינורית היתה מחומנת לפני הפיכת הלב כדי למנוע את האמבולי. לאשר מיקום נאות של הצינורית על ידי המחשה של קצה הצינורית בערך 1 מ"מ מעל החדרת אבי העורקים לתוך החדר.
הערה: ככל שזמן הצינורית מהיר יותר, כך יוציט התשואה טובה יותר. - התחילו את הזרימה של KHB-HB על-ידי סיבוב הסטואנדורף על הלנגנדורף. . חברו את הצינורית ללנגדורף מבשם הלב למשך 5 דקות.
הערה: מאחר והפרזיה מסופק על-ידי מערכת מבוססת כבידה, זרימה דרך הלב תהיה פונקציה של ציות עורק כלילי. - החלף את הפרזיה ממאגר KHB-HB למאגר מאגר העיכול. ברגע שחוצץ העיכול יגיע ללב, קבע שעון עצר (5 דקות לעכבר או 15 דקות לעכברוש). הקפד לאסוף את הגורם בגביע סטרילי 100 mL. ממלאים את מאגר מאגר העיכול לפי הצורך עם המכונה עד זמן העיכול פג.
- לאחר העיכול, להפריד את התאים של הלב עם מלקחיים ומספריים איריס בספל 100 mL סטרילי. הניחו כל חדר לתוך באר נפרדת של שש מיטב הצלחות. יוצקים 5 מ ל של התמיסה הקולגן לתוך כל טוב.
- מיד להתחיל לדחוף את רקמת הלב באמצעות מספריים. נתחי רקמות אמורים להיות בערך 1 מ"מ3. בעזרת פיפטות להעברה סטרילית, בעדינות. להשתמש ברקמת הלב הקצוצה הפתרון צריך להיות מעונן.
- ברגע שנתחי הרקמה הופכים ללבנים ונוצות, בחנו את התאים בעזרת מיקרוסקופ הפוך. אם מספר התאים הקיימא גדול מ-80%, המשך לאמץ את התאים לתוך צינור שפופרת של 50 mL באמצעות מסננת של תאים ב100 יקרומטר. השתמש שפופרת ומסננת שונים עבור כל חדר של הלב.
- אם מספר התאים הפעילים הוא קטן מ-80%, בדוק את הזמן הנדרש לצינורית. , אם זמן הצינורית מעל 5 דקות. נסה לב אחר אם לא, שיטת היישום החדש קולגן הרבה דרך תוכנית הדגימה הקולאז.
- גלולה את התאים על ידי תפרידו ב 215 x g עבור 2 דקות. הגלולה צריכה להיות קומפקטית ולא רופף. אם הגלולה רופפת, ההכנה מכילה תאים מתים רבים. במכסה של תרבית רקמות, השהה מחדש. את הגלולה ב -10 מ ל של מאגר העצירה
- גלולה את התאים על ידי תפרידו ב 215 x g עבור 2 דקות. הגלולה צריכה להיות קומפקטית ולא רופף. אם הגלולה רופפת, ההכנה מכילה תאים מתים רבים.
- השהה מחדש את התאים ב-5 מ ל של מאגר ציפוי. בצע ספירת תאים. כוונן את המיליטרים של מאגר ציפוי כדי להגיע לריכוז האחרון של myocyte של 2 x 104 תאים לכל mL.
- הסר את הכיסויים המילמינציה מהאינקובטור. . ומכה את הלמינציה ב-droplet
- צלחת 200 μL של השעיית הציט שלי על כל שמיכות. מקום בחממה 37 ° c (21% O2, 5% CO2) עבור 2 h כדי לאפשר מצורף. לאחר 2 שעות, הוסיפו את התאים הבלתי מחוברים, מוסיפים 2 מ ל של מדיית תרבות ותרבות עד 4 ימים.
4. fura-2 העמסה לצבוע
- הפוך את הפתרון מניות 2 mM fura-2 באמצעות הוספת 25 μL של DMSO כדי 50 μg של fura-2 AM אבקה (1 בקבוקון). . לתוך 6 מיקרומטר קח 1 גרם של fura-2 בבוקר ולהוסיף 6 מ ל של ציפוי מדיום. . מערבולת לערבב
- הסר 1 6 צלחת טובה של מייציטים מהאינקובטור. . מנושף מדיה הוסף 1 מ ל של תערובת מדיה fura-2 לכל טוב. לכסות את הצלחת עם נייר כסף, להשאיר את הצלחת בטמפרטורת החדר, ולחכות 15 דקות.
- משמת את תערובת המדיה ומוסיפה 1 מ ל מהפתרון של טירכבו לכל היותר. . כיסוי בנייר כסף המתן 20 דקות בטמפרטורת החדר כדי לאפשר כשלון צבע לפני הדמיה.
5. fluo-4 העמסה לצבוע
- הפוך את הפתרון מניות 1.82 mM fluo-4 (fluo-4 AM) על ידי הוספת 25 μL של DMSO כדי 50 μg של fluo-4 AM אבקה (1 בקבוקון). מוציא ל8.333 μL. קח 1 סדרת מחלקים של fluo-4 AM מלאי ולהוסיף 6 מ ל של ציפוי מדיום. . מערבולת לערבב
- הסר 1 6 צלחת טובה של מייציטים מהאינקובטור. . מנושף מדיה להוסיף 1 מ ל של fluo-4 מדיה תערובת לכל טוב. לכסות את הצלחת עם נייר כסף, להשאיר את הצלחת בטמפרטורת החדר, ולחכות 15 דקות.
- מוסיפים לתערובת מדיה של fluo-4 AM ומוסיפה 1 מ ל מהפתרון של טירודה לכל באר. . כיסוי בנייר כסף המתן 20 דקות בטמפרטורת החדר כדי לאפשר כשלון צבע לפני הדמיה.
6. ממברנה העמסה צבע פוטנציאלי
- הסר את הרכיב A ורכיב B מערכת הפוטנציאל של הממברנה. בשפופרת מתוך 15 מ"ל, שלב 50 μL של רכיב B ו-5 μL של רכיב A. מערבולת לערבב. הוסיפו 10 מ ל של מדיית ציפוי לצינורית החרוט בצבע של 15 מ"ל המכילה את תערובת המתח. . מערבולת לערבב
- הסר 1 6 צלחת טובה של מייציטים מהאינקובטור. . מרוב את התקשורת הוסף 800 μL של תערובת הצבע פוטנציאל הקרום לכל טוב. לכסות את הצלחת עם נייר כסף, להשאיר את הצלחת בטמפרטורת החדר, ולחכות 15 דקות.
- מנושף את תערובת המדיה לצבע ומוסיפים 1 מ ל הפתרון של השינוי-Tyrode לכל טוב. . כיסוי בנייר כסף
7. הקלטה ומטען מצמידים הקלטות התקן
- הפעל את הציוד בסדר הבא: מיקרוסקופ, מנורת קשת, hyperswitch, מערכת ממשק זריחה, ספק כוח Myocam, מגירוי בשדה ומחשב.
- ודא שערכות הסינון של עירור/פליטה מתאימות לצבע ההדמיה.
הערה: Fura-2 נרגש ב 340 ננומטר ו 380 nm של אור. . הוא פולט בשעה 510 nm של אור Fluo-4 ואת הצבע ממברנה מתח נרגשים ב 485 ננומטר של אור לפלוט ב 520 nm של אור. - הממשלה את המערכת על ידי הפעלת ואקום, לפתוח באופן מלא את מהדק צינור, בעדינות צולל כל 60 mL בשימוש סעפת. להקלטות הסידן משתמשים. בתמיסה של טירכבה עבור הקלטות מתח להשתמש שינוי הפתרון של Tyrode.
- הפעל את החימום והגדר את הזרימה על-ידי התאמת מהדק הגלגלת על אבובים הפרפיוז. הקלטות ב 36 ± 1 ° c.
- פתח את תוכנת הרכישה. ודא שהפרמטרים מוגדרים עבור צבע ההדמיה הנכון.
- בחושך, להסיר את רדיד הנייר מתוך שש צלחת הבאר ומניחים שמיכות בתא התנועה. ודא כי הגירוי מכובה במהלך שלב זה. התמקד במיציטים באמצעות המטרה 10x.
- פעם אחת בפוקוס, להתחיל לצעוד לפי שדה מגרה 1 הרץ, 0.2 V. בהדרגה להגדיל את המתח עד 1:1 התנועה מושגת. לאחר מכן הגדילו את המתח עד שיגיע הגבול עד 1.5 x.
הערה: מכיוון שצימוד התכווצות-כיווץ הוא תלוי בטמפרטורה, ודא שהתאים הופכים להיות מנוצלים במשך 15 דקות לפני ההקלטה. הדבר מאפשר לתאי הציטים להתאושש מההלם שעובר מטמפרטורת החדר בחזרה ל-37 ° צ', כמו גם תאים המחוברים באופן רופף כדי לרחף משם. - מעבר ממטרת 10x למטרה 40x. התמקד בתא העוקב אחר 1:1 צעדים. כוונן את גווני הפלסטיק כך שרק תא אחד יהיה בשדה התצוגה.
- באמצעות התוכנה, הצב את אזור הריבית על סרקוממרים מוגדרים היטב. הפעל את תוכנת הרכישה כדי ליזום את האור עירור. באמצעות מסנני דחיסות נייטרלית, להתאים את הגדרת העוצמה בהתאם כדי לקבל SNR נאותה.
תוצאות
איור 1מראה את מנגנון. הלנגדורף החמצן נמצא במאגר. המים של הח-HB הפתרון הקולגן הוא מאגר מזרק באמצע 60 mL. הקו המגנטיות מחובר למאגר הריק ממזרק 60 mL. לאחר בידוד מוצלח, רוב התאים צריכים להיות בצורת מוט ומלא. תחת מטרה של 40 x, רוב מיוציטים היו צריכים להיות ברורים לעין. איור 1ב, ג מראה דוגמאות של מיציטים עכברים בריאים. לאחר מבודד, תאים יכולים להיות מתורבתים עד 4 ימים תוך שמירה על שלהם תכונות חשמל ומורפולוגיה.
כדי למדוד צימוד התכווצות עירור, התאים מוצבים לאחר מכן בתא מחומם לוהט. מכיוון שתאי הציטים רגישים לשינויים בטמפרטורה, חשוב לאפשר לכיסויים להחליק ב -15 דקות בחדר לפני ההקלטה. עבור הקלטות הפלואורסצנטית, אורך הגל נוצר על ידי נורה 75 W קסנון-arc. נורות קסנון לייצר ספקטרום אור המחקה אור שמש טבעי. עוצמת האור ואורך הגל נשלטים על ידי מפרידי דחיסות נייטרלית/פליטת פליטה. האור העירור עובר במטרה להיות היציט. אורך הגל של הפליטה נאסף לאחר מכן על-ידי צינור פוטוסולפי. באמצעות המערכת המתוארת כאן, יש לשנות את העירור ואת מסנני הפליטה באופן ידני.
קיצור מצד שני מתקבל על ידי טעינה מצמידים חיישן המכשיר. מדידת בזמן אמת עד 1,000 פעמים בשנייה, תוכנת הרכישה מבצעת ממוצע של הקווים בתוך תחום של עניין כדי ליצור דפוס שנפתרה היטב. לאחר מכן מחושבת התמרת פורייה מהירה (FFT). השיא בטווח האנרגיה מייצג את המרווח הממוצע של סרקומר. לאחר מכן, שינויים בריווח סרקומר במהלך התנועה מותווים ולאחר מכן כימות.
איור 2 מראה סידן וקיצור עקבות שנרשמו מתוך C57/B6 העכבר מיציט טעון עם צבע הסידן fura-2. פרוטוקול התנועה מהווה שינוי בפרוטוקולי התנועה שתוארו בעבר10,11. עכבר בריא תאי צריך להיות מסוגל להיות הקצב בקצב הלב שלהם במנוחה 10 Hz. איור 3 הוא כימות של נתונים ensembled ממוצעים שהתקבלו מ C57/B6 עכברים ו הטרנסגניים שלהם (TG) החברים שהיה מוטציה נקודה הציג לתוך ערוץ אשלגן. שימו לב שאין הבדל בין הקבוצות למעט זמן ההרפיה בתנועה של 10 הרץ.
בניגוד fura-2 שהוא צבע עירור כפול, לצבוע מתח ו fluo-4 הם צבעים בעלי אורך גל יחיד עירור אשר עירור/פליטה לעבוד עם הריגוש FITC רגיל ספקטרום פליטה (494/506 nm). לכן, הקלטות של סידן ו סרקומר קיצור או מתח סרקומר קיצור ניתן להשיג באמצעות מסנן זה להגדיר.
איור 4הופעות מעקב מתח הוקלט מתוך עכבר C57/B6 בקצב של 10 Hz. לעומת איתותי סידן, בודד מעקב אחר מתח התא הם קטנים משרעת צריך לאחר עיבוד כדי לקבל אות שמיש. איור 4ב מראה הפוטנציאל פעולה ENSEMBLED ממוצעים (AP) עשוי מנקודת גישה באיור 4א. איור 4ג, D מציג AP ensembled ממוצע לאחר מעבר נמוך באטרסוורת ' או Savitzky-golay מסנן דיגיטלי הוחל. יש לנקוט טיפול בעת סינון האות כאשר לא לעוות את הנתונים האמיתיים. שימו לב להבדלים העדינים בצורת נקודות גישה באיור 4ב-D.
איור 5 מראה עקבות שנרשמו בקצב מיוציטים בשנת 1 הרץ. בנוסף לאות המתח הנמוך מאות הסידן, גם התכווצות קינטיקה שונה. זה בגלל הסידן צבע סידן מאגר בעוד צבעי מתח לא.
כמו עם הסידן חולף (איור 3), מיציטים הפגינו התנועה שינויים תלויים הפעולה האופטית שלהם הזמן הפוטנציאלי (apd) כמו גם (איור 6). בעוד העקבות fura-2 היו ensembled ממוצעים לפני לכמת, עקבות המתח סוננו עם מסנן החלקה פולינומיאלית Savitzky-Golay (רוחב 5, סדר 2) לפני היותו ensembled ממוצע וכימות.
ככמת באיור 6 ואיור 7, בנוסף הפגנת שינויים המושרה ב-apd, הם גם הפגינו הארכה התרופה המושרה של AP. ב -4 Hz, המצור תלוי בריכוז של הזרם החולף החוצה (אניto) עם 4-פמפרידין הביא להארכה של apd.
לבסוף, יש לנקוט טיפול כדי למנוע רעילות ציטוזה. איור 8 הוא 11 האחרונים של הקלטה 20 s. מצוין על-ידי החיצים האדומים באיור 8, חשיפה ממושכת של מייציטים לאור כחול מוביל לפעילות מופעלת.

איור 1: לחץ מתמיד על מנגנון לנגדורף. (א) מנגנון הלנגדורף עם כל רכיב המסומן באותיות לבנות. (ב) בודדים מלשן מג-דאולי שציטים הנצפים באמצעות מטרה 10x. (ג) עכברים מבודדים שצפו במטרה של 40 x. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
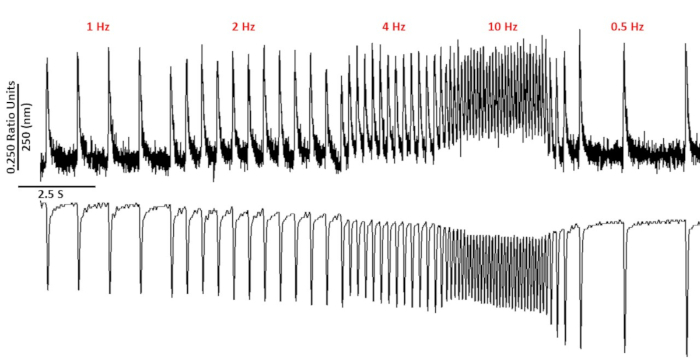
איור 2: סידן מייצג ו סרקומר קיצור עקבות שנרשמו מ C57/B6 myoyctes באמצעות fura-2. סידן ו סרקומר קיצור עקבות שנרשמו ב 1, 2, 4, 10, 0.5 ו 0.75 Hz. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
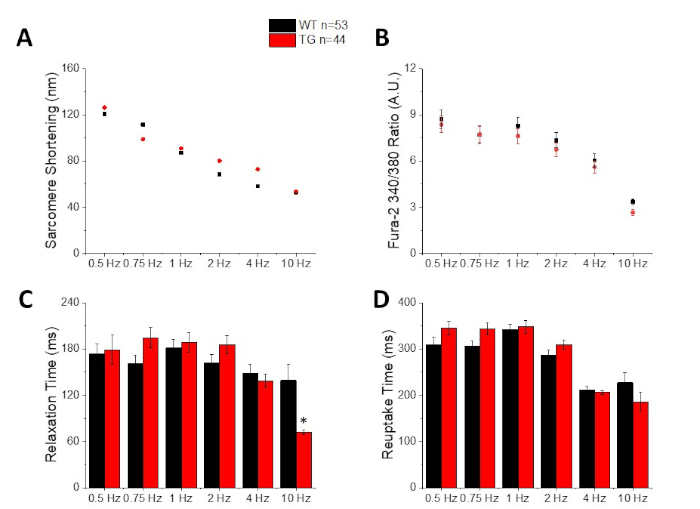
איור 3: הכמת של הקיצור סרקומר, שיא סידן, זמן הרפיה, וזמן ספיגה חוזרת נרשם מסוג C57/B6 פראי (WT) ו טרנסגניים (TG) עכברים. (א) קיצור משרה. (ב) שיא סידן. (ג) זמן הרפיה המוגדר כ 90% לחזור הבסיסית של מעקב קיצור. (ד) זמן ספיגה חוזרת המוגדר כ 90% לחזור הבסיסית של מעקב הסידן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
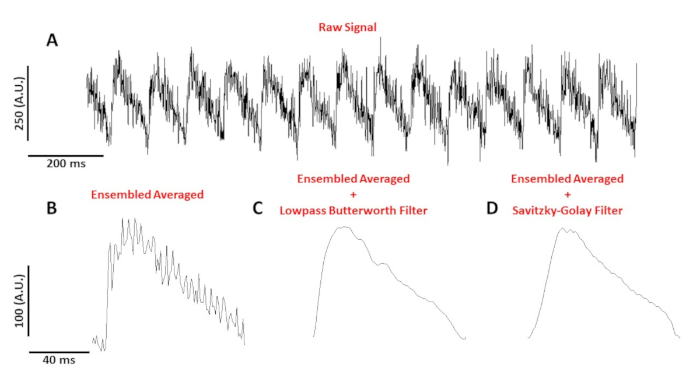
איור 4: הפוטנציאל האופטי של פעולה הוקלט מ-C57/B6 בקצב העכבר ב 10 הרץ. (A) מעקב שנייהלא מסונן. (ב) Ensembled הפוטנציאל האופטי בממוצע פעולה. (ג) Ensembled ממוצעים פעולה אופטי פוטנציאל לאחר lowpass מסנן באטרסוורת ' הוחל. (D) Ensembled בממוצע פעולה אופטית לאחר מסנן החלקה פולינומיאלית של Savitzky-golay הוחל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
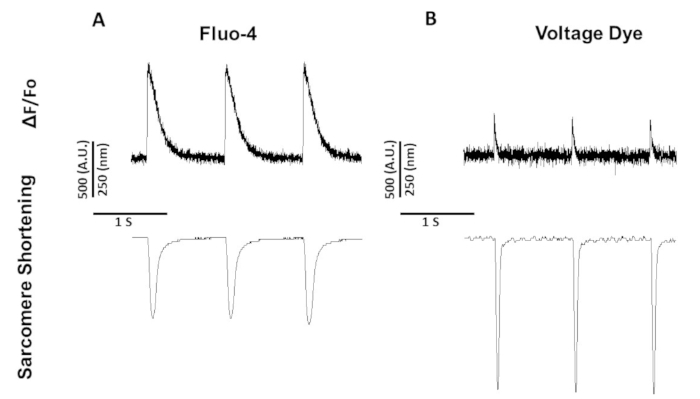
איור 5: המייצג סידן, מתח, ו סרקומר קיצור עקבות שנרשמו מתוך החולדה הג-דאולי העכבר המהיר 1 הרץ. (א) סידן וסארקומיר קיצור עקבות שנרשמו ב-1 הרץ הצועד באמצעות fluo-4. (ב) מתח ושרידי סימני הקלטה שנרשמו ב-1 הרץ הצועד באמצעות צבע המתח. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
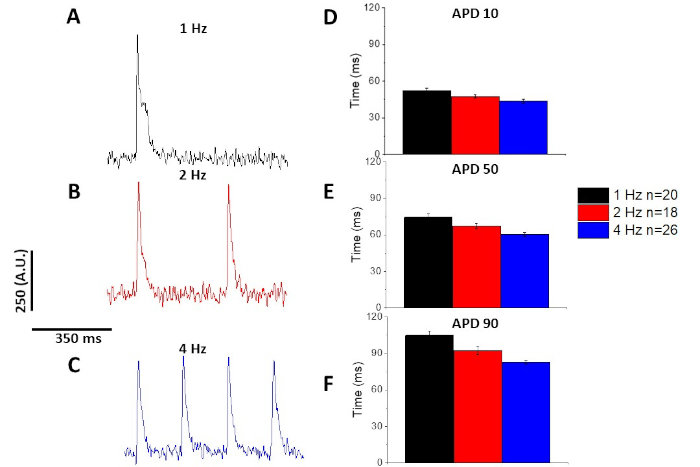
איור 6: פוטנציאל הפעולה האופטי הוקלט מתוך החולדה של הג-דאולי-ביציטים בקצב של 1, 2 ו -4 Hz. (א) מעקב מסונן שנרשםב-1 Hz. (ב) מעקב מסונן שנרשם ב-2 Hz. (ג) מעקב מסונן שנרשם ב-4 Hz. (ד) פעולה פוטנציאלית של משך 10, הנמדדת כ-10% חזרה לתוכנית הבסיסית. (ה) פעולה פוטנציאלית משך זמן 50, שנמדד כ 50% לחזור לתוכנית הבסיסית. (ו) פעולה פוטנציאלית משך זמן 90, שנמדד כ90% חזרה לתוכנית הבסיסית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
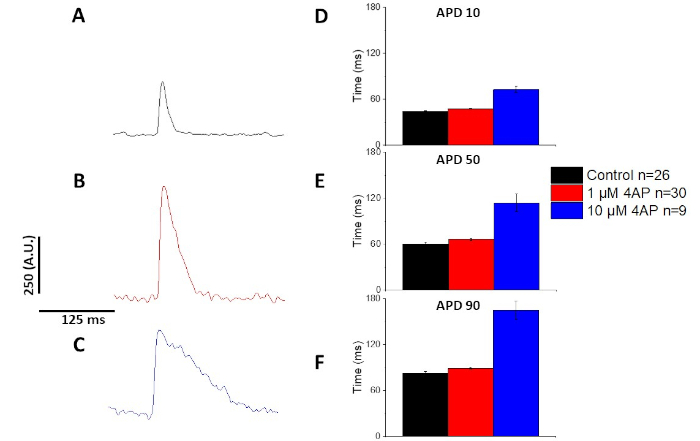
איור 7: ההשפעות של 4-פמפרידין על שבג-דאולי העכבר האופטי פעולה פוטנציאל הקליט 4 הרץ התנועה. (א) מEnsembledבממוצע הוקלט ב -4 Hz, ללא 4-פמפרידין בפתרון. (ב) מEnsembled בממוצע הוקלט ב-4 Hz הצועד עם 1 μm 4-פמפרידין בפתרון. (ג) מEnsembled ממוצעים הוקלטו ב -4 הרץ עם 10 μm 4-פמפרידין בפתרון. (ד) פעולה פוטנציאלית של משך 10, הנמדדת כ-10% חזרה לתוכנית הבסיסית. (ה) פעולה פוטנציאלית משך זמן 50, שנמדד כ 50% לחזור לתוכנית הבסיסית. (ו) פעולה פוטנציאלית משך זמן 90, שנמדד כ90% חזרה לתוכנית הבסיסית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
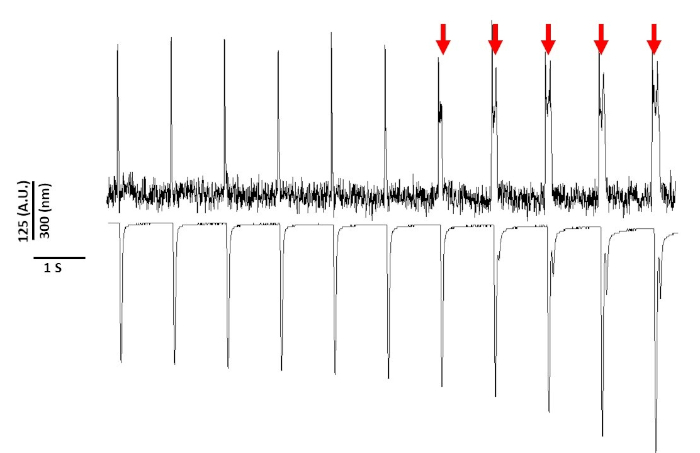
איור 8: צבע מתח הנגרמת על ידי פוטורעילות בג-דאולי חולדה מייציטים לאחר 20 s של חשיפה רציפה אור. חיצים אדומים מצביעים. על אירועים ציטוטוקסיים אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
היכולת לבודד מיזוציטים הלב היא שיטה רבת עוצמה שניתן להשתמש בה כדי להבין פיזיולוגיה לב, פתולוגיה, וטוקסיקולוגיה. בפרוטוקול הנ ל, תיארנו שיטה אשר משתמשת בלחץ הכבידה קבוע מנגנון לאנגדורף להשיג מייציטים לב יחיד. לאחר מכן, באמצעות מערכת האור הפלואורסצנטית, אנו מתארים כיצד בו לרכוש או סידן וקיצור או מתח וקיצור עקבות.
בגלל הקינטיקה השונה בין צבעי סידן, יש לקחת את הטיפול באיזה צבע לבחור. עבור פרוטוקול זה, הן fura-2 ו-fluo-4 בשימוש ההונדסים עם אסטרים של AM המחייב לשטוף את הצעד כדי לאפשר מחיקת הזמן לדבוק את הקבוצה AM וללכוד את הצבע בתא. בעוד fura-2 ו fluo-4 נחשבים צבע סידן אהדה גבוהה, Kd עבור fura-2 הוא 145 ננומטר לעומת 345 nM עבור fluo-49. עוד, fura -2 הוא טימטרי. בגלל זה, זה יכול לשמש לכמת רמות סידן תאיים9,12. Fluo-4 מצד שני הוא גל אחד לחקור סידן. היתרון של שימוש fluo-4 הוא מייצר אות זריחה בהיר יותר. ללא קשר לצבע הסידן משמש, בהשוואה לצבע הסידן, בבדיקות מתח ממברנה יש SNR נמוך יותר.
כפי שמוצג באיור 4 ואיור 5, עקבות מתח לעומת עקבות הסידן הם קטנים יותר משרעת. באמצעות סינון המעקב הדיגיטלי של התוכנה, ניתן להגדיל את SNR ולכמת את הנתונים (איור 4 ואיור 7). לאחר כימות, שני מעבר סידן ו-APDs אופטי להפגין פיצוי, קיצור המשך שלהם בתדרים הולכים מהר יותר (איור 2, איור 3, איור 6, איור 7). APDs קצר יותר במהלך מחזורי התנועה מהיר הכרחי כדי לאפשר מספיק זמן למילוי חדרית במהלך הדיאמדים. שינויים בתופעה זו נחשב לרמז על גידול בסיכון של הפרעה13,14,15,16. בעוד שינויים APD יכול להיגרם על ידי מחלה, הם יכולים גם להיגרם על ידי כימיקלים. כפי שמוצג באיור 7, כאשר ה, השולט הדומיננטי מקרין אשלגן, אניל, נחסם, ה-apd האופטי הופך לארוך יותר.
עדיין, כפי שדווח בעבר עם צבעים רגישים מתח, עוצמת אור ומשך יכול לשנות את apd2,5,17. זה הוא האמין להיות תוצאה של הדור של מינים חמצוני תגובתי (ROS)5. בעבר, זה כבר הוכח כי התוספת של נוגדי חמצון לפתרון ההקלטה יכול למנוע את המתח הרגיש ומתח הצבע5. כתוצאה מכך, הוספנו את ה-"נוגד חמצון" (10 מ"מ) לתמיסה של טירכבה. מוצג באיור 8 הוא 11 האחרונים של הקלטה של 20 שהתקבלו ב 1 הרץ התנועה. כפי שמצוין על ידי החצים האדומים, שינויים ב-APD לא התרחשה עד 15 s לתוך ההקלטה; לכן, בעוד הפתרון של Tyrode המתוקן לא מנע את הרעילות היא עיכבה אותו באופן משמעותי. באמצעות הפתרון של Tyrode שונה, באמצעות הגדרת עוצמת אור נמוכה ושמירה על משך ההקלטה מתחת 5 s, ניתן להימנע כל שינויים המושרה צבע ב-APD. זה חשוב כי מבלי לטפל להימנע מפני הרעלה, הנתונים יכול להיות מפורש כגורם מוקדם או מתעכב לאחר הדפולציות. בנוסף להגבלת החשיפה לאור כחול, ישנם אמצעי זהירות נוספים שניתן לנקוט כדי למנוע אי-פרשנות של הנתונים.
הראשון הוא להקליט רק מתאים שאחרי אחד אחד הצעדים יש אורך סרקומר מנוחה גדול או שווה 1.75 μm. הניתוק 1.75 יקרומטר נלקח מההתבוננות על ידי גורדון ואח '18 כי המתח מסרב במהירות לאחר אורך סרקומר הוא מתחת לסכום זה. למרות זאת, פתווגיות מסוימות עלול לגרום לשינויים משמעותיים באורך סרקומר מנוחה. כדי להיות בטוח כי הפנוטיפים אמיתי ולא פריט של הבידוד, הבעיות הבאות לירי גישות צריך להילקח.
אם הציטים שלי הם בעקביות לא בעקבות 1:1 הצעדים, יש סרקומר אורכי מתחת 1.75 μm, ממברנה כבדה מלתרים, או לא לשרוד את הבידוד, הדבר הראשון לבדוק הוא הזמן לקח כדי צינורית הלב. ככל שזמן הצינורית ארוך יותר, כך היבול יהיה נמוך יותר. אם נדרש זמן הצינורית ארוך, ניתן לשפר את הכדאיות על ידי הצבת הלב בפתרון קרדיואופציאלי19. ובכל זאת, בגלל שהקולגן הוא אנזים, הפעילות והספציפיות של שינוי מסוים של הרבה לאורך זמן. אם התשואות הכלליות הופכות לגרועות יותר למרות זמני הצינורית הטובים, יש לחייב הרבה מאוד דברים חדשים. בעוד הפרוטוקול שלנו היה אופטימיזציה עבור הקלטות 5 s, אם יש צורך במתח נוסף, מסנני דחיסות נייטרלית יש צורך לרכוש. המערכת המתוארת בפרוטוקול מגיעה עם מסנני דחיסות נייטרלית המקהירים את האור המשודר על-ידי 37%, 50%, 75%, 90% ו-95%.
לסיכום, תיארנו מתודולוגיה המותרת לבידוד של מיציטים חדרית מבוגרים ששימשו לשימוש בסידן, מתח ומדידות סרנקופה.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
אנו מודים לדנה מורגנשטרן על הגהה זהירה של כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25 Liter Water Jacketed Reservoir | Radnoti, LLC | 120142-025 | |
| 1 liter volumetric flask | Fisher Scientific | 10-205F | |
| 100 ml beaker | Fisher Scientific | FB-100-100 | |
| 100 ml graduated cylinder | Fisher Scientific | 08 562 5C | |
| 1000 ml flask | Fisher Scientific | FB-500-1000 | |
| 2-Bar Lab Stand with Stabilizer Bar and 24" Stainless Steel Rods | Radnoti, LLC | 159951-2 | |
| 4-Aminopyridine | Sigma-Aldrich | 275875 | |
| 40X Oly UApo/340 Non-Immersion Objective (NA 0.9, WD 0.2mm) | IonOptix | MSCP1-40 (b) | |
| 60-mL syringe, BD Luer-Lok tip | BD | 309650 | |
| Aortic Metal Cannulae | Harvard Apparatus | 73-0112 | |
| Bovine Serum Albumin | Fisher Scientific | BP9703-100 | |
| C-6 Standard Heating Circulator | Chemyx | A30006 | |
| CaCl2 | Fisher Scientific | BP510500 | |
| Cell framing adapter | IonOptix | CFA300 | |
| CellPr0 Vacuum Filtration System, 1 liter, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V100022 | |
| CellPro Vacuum Filtration System, 250mL, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V25022 | |
| CellPro Vacuum Filtration System, 500mL, 0.22µm,12/CS | Labratory Product Sales, Inc | V50022 | |
| CMC (mTCII) Temp Control w/ inline flow heater | IonOptix | TEMPC2 | |
| Cole-Parmer Large-bore 3-way, male-lock, stopcocks | Cole-Parmer | EW-30600-23 | |
| Cole-Parmer Luer fittings, Large-bore stopcocks, male lock, 4-way | Cole-Parmer | EW-30600-12 | |
| Cole-Parmer Stopcocks with Luer Connections; 1-way; male slip | Cole-Parmer | EW-30600-01 | |
| Collagenase Type II | Worthington | LS004177 | |
| Corning Sterile Cell Strainers | Fisher Scientific | 07-201-432 | |
| Dell Optiplex 790 mini-tower, 4G RAM, 250G HD, Windows 7 Pro | IonOptix | CPUD7M | |
| DMSO | Fisher Scientific | 50980367 | |
| Dumont Tweezers Style 5 | Amazon | B00F70ZDEQ | |
| FHD Rapid Change Stimulation Chamber | IonOptix | FHDRCC1 | |
| Fluo-3/4 Optics Package | IonOptix | IonOP-Fluo | |
| Fluorescence system interface – (w PCI-I/O card) | IonOptix | FSI700 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher Scientific | 15-140-122 | |
| Glucose | Fisher Scientific | D16-1 | |
| Hemostat, Curved 5-1/2" | Amazon | B00GGAAPD0 | |
| HEPES | Fisher Scientific | BP310500 | |
| HyperSwitch dual excitation light source | IonOptix | HSW400 | |
| Inverted Motic Fluorescence Microscope | IonOptix | MSCP1-40 (a) | |
| IonWizard Core + Analysis | IonOptix | IONWIZ | |
| Iris Scissors, curved | Amazon | B018KRRMY6 | |
| K2HPO4 | Fisher Scientific | P288-100 | |
| KCl | Fisher Scientific | BP3661 | |
| L-Glutathione reduced | Sigma-Aldrich | G4251 | |
| LOOK Silk Spool, Black Braided, 4-0, 100yds | SouthernAnesthesiaSurgical Inc. | SP116-EA | |
| M199 Media | Fisher Scientific | 12 340 030 | |
| MgCl2 | Fisher Scientific | MP021914215 | |
| MgSO4 | Fisher Scientific | BP2131 | |
| MyoCam-S Digital CCD video system | IonOptix | MCS100 | |
| MyoPacer Field Stimulator | IonOptix | MYP100 | |
| NaCl | Fisher Scientific | BP358212 | |
| NaH2PO4 | Fisher Scientific | 56-754-9250GM | |
| Oxygenator Bubbler with Fluid Inlet for 0.25 Liter | Radnoti, LLC | 140143-025 | |
| Photomultiplier sub-system | IonOptix | PMT400 | |
| PMT Acquisition add-on | IonOptix | PMTACQ | |
| Radnoti Heating Coil 5 mL with Degasing Trap | Radnoti, LLC | 158830 | |
| Ring Clamp 60 – 80mm Dia. for 250ml Reservoir | Radnoti, LLC | 120141-025 | |
| Ring Clamp for Bubble Trap Compliance Chamber | Radnoti, LLC | 120149RC | |
| Saint-Gobain ACF000010 5/32 in.9/32 in. | Fisher Scientific | 14-171-214 | |
| Saint-Gobain ACF000013 3/16 in.3/8 in. | Fisher Scientific | 14-171-217 | |
| Saint-Gobain ACF000016 1/4 in.5/16 in. | Fisher Scientific | 14-171-219 | |
| Saint-Gobain ACF000025 5/16 in.5/8 in. | Fisher Scientific | 14-171-226 | |
| Saint-Gobain ACF00003 1/16 in.3/16 in. | Fisher Scientific | 14-171-209 | |
| Saint-Gobain ACF00005 1/16 in.3/32 in. | Fisher Scientific | 14-171-210 | |
| Saint-Gobain ACF00009 5/32 in.7/32 in. | Fisher Scientific | 14-171-213 | |
| Sarcomere Length Recording add-on | IonOptix | SARACQ | |
| T/C Adson Tissue Platic Surgery Forceps 4.75" | Amazon | B00JDWRBGC | |
| VETUS Anti-Static Curved Tip Tweezers | Amazon | B07QMZC94J | |
| Vistek 3200 Motic Vibration Isolation Platform | IonOptix | ISO100 |
References
- Hagen, B. M., Boyman, L., Kao, J. P., Lederer, W. J. A comparative assessment of fluo Ca2+ indicators in rat ventricular myocytes. Cell Calcium. 52 (2), 170-181 (2012).
- Schaffer, P., Ahammer, H., Muller, W., Koidl, B., Windisch, H. Di-4-ANEPPS causes photodynamic damage to isolated cardiomyocytes. Pflügers Archiv: European Journal of Physiology. 426 (6), 548-551 (1994).
- Hardy, M. E., Lawrence, C. L., Standen, N. B., Rodrigo, G. C. Can optical recordings of membrane potential be used to screen for drug-induced action potential prolongation in single cardiac myocytes. Journal of Pharmacological and Toxicological Methods. 54 (2), 173-182 (2006).
- Tian, Q., et al. Optical action potential screening on adult ventricular myocytes as an alternative QT-screen. Cellular Physiology and Biochemistry. 27 (3-4), 281-290 (2011).
- Warren, M., et al. High-precision recording of the action potential in isolated cardiomyocytes using the near-infrared fluorescent dye di-4-ANBDQBS. The American Journal of Physiology-Heart and Circulatory Physiology. 299 (4), 1271-1281 (2010).
- FluoVolt™ Membrane Potential Kit. ThermoFisher Scientific Available from: https://assets.thermofisher.com/TFS-Assets/LSG/manuals/MAN0009668_FluoVolt_Membrane_Potential_Kit_UG.pdf (2018)
- Fluorescence SpectraViewer. ThermoFisher Scientific Available from: https://www.thermofisher.com/us/en/home/life-science/cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html (2019)
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Davis, J., et al. Diastolic dysfunction and thin filament dysregulation resulting from excitation-contraction uncoupling in a mouse model of restrictive cardiomyopathy. The Journal of Molecular and Cellular Cardiology. 53 (3), 446-457 (2012).
- Ren, J., Davidoff, A. J. Diabetes rapidly induces contractile dysfunctions in isolated ventricular myocytes. The American Journal of Physiology. 272, 148-158 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Goldhaber, J. I., et al. Action potential duration restitution and alternans in rabbit ventricular myocytes: the key role of intracellular calcium cycling. Circulation Research. 96 (4), 459-466 (2005).
- Weiss, J. N., et al. The dynamics of cardiac fibrillation. Circulation. 112 (8), 1232-1240 (2005).
- Baher, A., et al. Short-term cardiac memory and mother rotor fibrillation. The American Journal of Physiology-Heart and Circulatory Physiology. 292 (1), 180-189 (2007).
- Kleber, A. G., Rudy, Y. Basic mechanisms of cardiac impulse propagation and associated arrhythmias. Physiological Reviews. 84 (2), 431-488 (2004).
- McPheeters, M. T., Wang, Y. T., Werdich, A. A., Jenkins, M. W., Laurita, K. R. An infrared optical pacing system for screening cardiac electrophysiology in human cardiomyocytes. PLoS ONE. 12 (8), 0183761 (2017).
- Gordon, A. M., Huxley, A. F., Julian, F. J. The variation in isometric tension with sarcomere length in vertebrate muscle fibres. The Journal of Physiology. 184 (1), 170-192 (1966).
- Li, Y., et al. Three Preservation Solutions for Cold Storage of Heart Allografts: A Systematic Review and Meta-Analysis. The Journal of Artificial Organs. 40 (5), 489-496 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved