Method Article
Оптическое изображение изолированных морин желудочковых миоцитов
В этой статье
Резюме
Мы представляем методологию изоляции минурных миоцитов и как получить следы напряжения или кальция одновременно с саркомером, сокращающим следы с помощью флуоресцентной фотометрии с одновременными измерениями геометрии цифровых клеток.
Аннотация
Способность изолировать взрослых сердечных миоцитов позволила исследователям изучать различные сердечные патологии на уровне одной клетки. В то время как достижения в чувствительных к кальцию красителей позволили надежной оптической записи динамики кальция одноклеточных элементов, запись надежных трансмембранных оптических сигналов напряжения остается трудной. Возможно, это происходит из-за низкого соотношения между одинокими и шумовыми веществами, фототоксичности и фотоотбелевания традиционных потенциометрических красителей. Таким образом, измерения одноклеточного напряжения уже давно ограничиваются методом зажима патча, который в то время как золотой стандарт, является технически требовательным и низкой пропускной стоимостью. Однако, с развитием новых потенциометрических красителей, большие, быстрые оптические реакции на изменения напряжения могут быть получены практически без фототоксичности и фотоотбеления. Этот протокол подробно описывает, как изолировать взрослых миоцитов морижа, которые могут быть использованы для клеточного сокращения, кальция и оптических измерений напряжения. В частности, протокол описывает, как использовать соотношение метрического красителя кальция, одновозбуждающий краситель кальция, и один окрашивания напряжения. Этот подход может быть использован для оценки кардиотоксичности и аритмогенности различных химических агентов. В то время как фототоксичность по-прежнему является проблемой на уровне одной ячейки, обсуждается методология ее снижения.
Введение
Для изучения сердца во время здоровых и патологических состояний часто полезно исследовать фенотип на уровне одной клетки. В то время как научные достижения позволили надежного измерения динамики кальция одноклеточных элементов, одноклеточные оптические измерения напряжения остаются скудными1. Возможно, это происходит из-за низкого соотношения сигнала к шуму (SNR), фототоксичности и фотоотбелевания традиционных потентиометрических красителей2,3. Тем не менее, изолированные миоцитные оптические потенциалы действия были получены2,3,4. Кроме того, с достижениями в химии и физике напряжения чувствительных красителей, SNR улучшилась5. Новые мембранные потенциальные зонды(Таблица материалов) реагируют на изменения в мембранном потенциале в субмиллисекундах и имеют флюорогенный диапазон реакции примерно 25% на 100 мВ.. Кроме того, возбуждение/выброс мембранного потенциального комплекта (например, FluoVolt; Таблица материалов) используется в этом протоколе работает со стандартными флуоресцеина изотиоцианат (FITC) или зеленый флуоресцентный белок (GFP) настройки6.
FITC и GFP возбуждение / спектра выбросов перекрываются с фтор-4 кальция связаны спектра7. Одновременное приобретение флуоресценции фотометрии с цифровыми измерениями геометрии клеток традиционно используется для одновременного приобретения кальция и клеточных измерений сокращения8. Этот протокол подробно описывает, как изолировать миоциты мурин и как записывать сигналы кальция или напряжения с помощью стандартных настроек FITC. Кроме того, он описывает, как простой переключатель в возбуждение / выбросы фильтров на визуализации рабочей станции могут быть использованы для получения кальция и сокращения измерений с использованием соотношения метрики красителя кальция fura-2. По сравнению с фтором-4, фура-2 имеет более высокое сродство к кальцию и относительно устойчива к фотоотбелению9. Следовательно, с помощью одной рабочей станции этот протокол позволяет тщательно изучить познавательные миоцитные возбуждения-сокращения соединения.
протокол
Все методы и процедуры, описанные в этом протоколе, были одобрены Институциональным комитетом по уходу за животными и использованию (IACUC) Университета Кейс Вестерн Резерв.
1. Подготовка решений, инструментов и обложк
ПРИМЕЧАНИЕ: 1x решения могут быть использованы в течение месяца.
- Сделать 10x Кребс-Хенселейт буфер HEPES буфер без кальция (KHB-HB) путем добавления 68,96 г NaCl, 3,57 г KCl, 59,58 г HEPES, 2,18 г K2HPO4, 3,08 г MgSO4 и 19,82 г глюкозы до 800 мл двойной дистиллированной воды в колбе 1000 мл. После полного растворения содержимого довести до объема в объемной колбе объемом 1000 мл.
ПРИМЕЧАНИЕ: Традиционный раствор Krebs Henseleit использует бикарбонат натрия в качестве буфера, и в растворе в этом протоколе используется раствор Krebs Henseleit с буфером HEPES. Решение стабильно в течение 6 месяцев, если стерильный фильтр. - Сделать 10x Tyrode решение, добавив 86,51 г NaCl, 0,552 г2PO4, 2,03 г MgCl2, 9,91 г глюкозы, 4,03 г KCl, 2,65 г CaCl2, и 35,76 г HEPES до 800 мл двойной дистиллированной воды в fl0. После того, как содержимое полностью растворится, довести до объема в 1000 мл объемной колбы.
ПРИМЕЧАНИЕ: Решение стабильно в течение 6 месяцев, если стерильный фильтр. - Сделайте 1x KHB-HB, измеряя 100 мл 10x запасов и добавляя к 875 мл двойной дистиллированной воды в колбе 1000 мл. Поместите колбу в водяную ванну 37 градусов по Цельсию. После того, как раствор достиг 37 градусов по Цельсию, используйте NaOH, чтобы увеличить рН до 7,39. После регулировки рН доведите раствор до объема в объемной колбе объемом 1000 мл. Стерильный фильтр раствор с помощью системы фильтрации вакуума.
- Сделайте раствор 1x Tyrode, измерив 100 мл 10-x запаса и добавив к 875 мл двойной дистиллированной воды в колбе 1000 мл. Поместите колбу в водяную ванну 37 градусов по Цельсию. После того, как раствор достиг 37 градусов по Цельсию, используйте NaOH, чтобы увеличить рН до 7,39. После регулировки рН доведите раствор до объема в объемной колбе объемом 1000 мл. Стерильный фильтр с использованием системы вакуумной фильтрации.
- Сделайте 1x модифицированный раствор Tyrode, измеряя 100 мл 10x запаса и добавляя к 875 мл двойной дистиллированной воды в колбе 1000 мл. Растворите 3,07 г L-глутатиона, уменьшенного в колбе. Поместите колбу в водяную ванну 37 градусов по Цельсию. После того, как раствор достиг 37 градусов по Цельсию, используйте NaOH, чтобы увеличить рН до 7,39. После регулировки рН доведите раствор до объема в объемной колбе объемом 1000 мл. Стерильный фильтр раствор с помощью системы фильтрации вакуума.
- Сделать 100 мМ блеббистатина бульонного раствора, добавив 855 л диметилсульксида (DMSO) до 25 мг порошка. Aliquot в 20 мл шагом и хранить в морозильной камере -80 градусов по Цельсию в течение шести месяцев.
- Сделайте остановку буфера, добавив 2 г бычьего сыворотки альбумина (BSA) и 1 флакон алицитидного гербистатина до 100 мл 1x KHB-HB и стерильный фильтруйте раствор с помощью вакуумной системы фильтрации.
- Сделайте буфер покрытия, добавив 5 мл сыворотки крупного рогатого скота и 1 флакон аликотируемого запаса блеббистатина до 95 мл M199 HEPES. Стерильный фильтр раствор с помощью системы фильтрации вакуума.
- Сделайте буфер культуры миоцитов, добавив один 1 флакон аликота из алибистатина и 4 мл пенициллина-стрептомицина до 396 мл M199 (25 мм HEPES). Стерильный фильтр раствор с помощью системы фильтрации вакуума.
- Autoclave 2 пары Дюмон пинцет, 2 пары Iris изогнутые ножницы, 2 hemostats, одна пара пластической хирургии щипцы, 6 черных плетеных шелка 4-0 швы расположены для использования в качестве хирургического двойного броска узел, и четыре 100 мл клюв.
- Стерилизовать 22 х 22 мм2 стеклянные крышки. Во-первых, поместите один coverslip в каждом колодце из шести хорошо пластины. После этого, с снятой крышкой, включите ультрафиолетовую лампу шкафа биобезопасности и выставят крышки на ультрафиолетовый свет на 1 ч.
- Сделать рабочий раствор бульона ламинина путем первого оттаивания бутылки на льду. Добавьте содержимое одной бутылки к достаточно холодному стерильному фосфатно-буферизированному солину (PBS), чтобы достичь конечной концентрации 0,04 мг/мл. Aliquot из 1,3 л в автоклавированных 1,5 мл центрифуговых труб. Хранить при -80 градусах по Цельсию.
ПРИМЕЧАНИЕ: Каждая трубка имеет достаточно ламинина для одной шести хорошо пластины. Избегайте нескольких циклов замораживания оттепели. - Пальто стерилизовано, предварительно оттаивая рабочий раствор ламинина на льду. Используя пипетку P1000, аспир 200 л ламинина. Аккуратно перетащите кончик пипетки вдоль одного края крышки, чтобы капиллярное действие, чтобы вытащить мизерное количество ламинина, чтобы облегчить крепление крышки к шести скважинам.
- Затем выгоните оставшийся ламинин в центре крышки. Круговыми движениями разложите капли ламинина по всему обложению. Поместите в инкубатор 37 градусов по Цельсию не менее 1 ч и до 24 ч до изоляции.
2. Подготовка аппаратура Лангендорфа
ПРИМЕЧАНИЕ: Отдельные компоненты аппарата Langendorff, используемые в этом протоколе, перечислены в таблице материалов.
- Включите циркулирующую водяную ванну. Установите температуру так, чтобы перфусат имеет температуру 37 градусов по Цельсию.
ПРИМЕЧАНИЕ: С раствором резервуаров, установленных на высоту 60 см, циркулирующих вод должен быть установлен до 41 градусов по Цельсию, чтобы перфусат быть 37 градусов по Цельсию. В отличие от ранее заявленных протоколов, высота резервуара не нуждается в изменении. - Промыть аппарат Langendorff с 70% этанола следуют две полоскания с автоклавированной двойной дистиллированной воды. После промывоки заполните резервуар KHB-HB и оксигенизите 100% кислородом.
- Премьер системы, позволяя кислородом KHB-HB первый поток в 100 мл стакан. После того, как 50 мл раствора втеке в стакан, переключите 3-путь стоп-кок позиции, чтобы остановить поток из резервуара KHB-HB. Налейте 50 мл кислородом KHB-HB из стакана в коллагеназный резервуар.
- Пусть KHB-HB стекает из резервуара пищеварения до тех пор, пока 5 мл остается в коллагенерезервуаре. В то время как грунтовка коллагенеза резервуара, переключить 3-путь остановить петух неоднократно между резервуарами, чтобы линии дегазования. После того, как система загрунтована, не забудьте использовать дегазинговую ловушку, расположенную на верхней части нагревательной катушки, чтобы позволить любому оставшемуся воздуху выйти из системы.
- Сделать коллагенеза решение. Для крыс сочетают 100 мг коллагеназы II типа, 100 мл кислородом KHB-HB и 2 флакона из бульона блеббистаин. Для мышей, объединить 100 мг коллагенеза типа II, 40 мл кислорода KHB-HB, и 2 флакона из blebbistain фонда. После смешивания раствор должен быть стабильным в течение 1 ч.
ПРИМЕЧАНИЕ: Миоцит жизнеспособность может варьироваться между типа II коллагенеза много. Воспользуйтесь программой отбора проб коллагеназа, чтобы проверить много перед оптовым заказом.
3. Изоляция миоцитов
- Введите животное с 1000 U гепарина. Подождите 5 минут.
ПРИМЕЧАНИЕ: Мыши и крысы любого возраста могут быть использованы. Однако, в целом старше или более больной животное, тем ниже выход миоцитов. - Пожертвуйте животным, сначала обезболив его изофлюраном с помощью метода open-drop (1 см изиофруран на 500 куб.см объема) перед эвтанизацией животного пентобарбитальной смесью (150 мг/кг интраперитонеальной).
- Быстро акциз сердца, сначала захватмех меха выше процесса xiphoid. С ножницами радужной оболочки, сделать небольшой разрез непосредственно под процессxiphoid и потяните мех вверх к голове подвергая кожу.
- Захватите процесс xiphoid и вырезать диафрагмы подвергая грудной полости. Сделайте разрез люка, потяните грудину назад с помощью гемостата, и используйте изогнутые щипцы, чтобы вырезать сердце над восходящей аортой и поместить в холодный KHB-HB.
- Каннулять сердце с помощью стерео микроскопа и номер 5 щип. Убедитесь, что сердце погружено в воду и канюля была загрунтована до иссечения сердца, чтобы предотвратить эмболии. Подтвердите правильное позиционирование канюли, визуализируя кончик канюли примерно на 1 мм выше вставки аорты в желудочек.
ПРИМЕЧАНИЕ: Чем быстрее время консервации, тем лучше выход миоцитов. - Начните поток KHB-HB, вращая стоп-кок на Langendorff. Соедините канюлу с Лангендорфом. Пронизыруй сердце в течение 5 мин.
ПРИМЕЧАНИЕ: Поскольку перфузия поставляется системой на основе гравитации, поток через сердце будет функцией соответствия коронарных артерий. - Переключите перфузию из резервуара KHB-HB в резервуар буфера пищеварения. Как только буфер пищеварения достигает сердца, установите таймер (5 мин для мыши или 15 мин для крыс). Убедитесь в том, чтобы собрать перфусат в стерильных 100 мл стакана. Пополнить резервуар буфера пищеварения по мере необходимости с перфузатом, пока время пищеварения истекло.
- После пищеварения отделите камеры сердца щипками и ножницами радужной оболочки глаза в стерильных 100 мл стакана. Поместите каждую камеру в отдельный колодец из шести колодцев. Налейте 5 мл раствора коллагеназы в каждый колодец.
- Немедленно начните смягчать сердечную ткань ножницами. Ткань куски должны быть примерно 1 мм3. Используя стерильные переносные пипетки, аккуратно стригните фарш ткани сердца. Решение должно стать облачным.
- После того, как куски ткани становятся белыми и пернатыми, изучить клетки с помощью перевернутого микроскопа. Если количество жизнеспособных клеток превышает 80%, приступаем к деформации клеток в коническую трубку 50 мл с помощью 100 мкм-ситечко. Используйте различные трубки и ситечко для каждой камеры сердца.
- Если количество жизнеспособных клеток составляет менее 80%, проверьте время, необходимое для канюляции. Если время наклона составляет более 5 мин, попробуйте другое сердце. Если нет, то провести проверку новых лотов коллагеназы через программу отбора проб коллагеназы.
- Пелле клетки центрифуги при 215 х г в течение 2 мин. Гранулы должны быть компактными и не рыхлыми. Если гранулы свободны, препарат содержит много мертвых клеток. В капюшоне культуры ткани, resuspend гранулы в 10 мл остановки буфера.
- Пелле клетки центрифуги при 215 х г в течение 2 мин. Гранулы должны быть компактными и не рыхлыми. Если гранулы свободны, препарат содержит много мертвых клеток.
- Приостановите работу ячеек в 5 мл покрытия буфера. Выполните подсчет ячеек. Отрегулируйте миллилитров буфера покрытия, чтобы достичь окончательной концентрации миоцита 2 х 104 ячеек на мл.
- Удалите из инкубатора крышки с ламинином. Аспирируйте капли ламинина.
- Плита 200 л миоцитной подвески на каждом coverslip. Поместите в инкубатор 37 градусов по Цельсию (21% O2,5% CO2) на 2 ч, чтобы позволить вложение. После 2 ч, аспирировать незакрепленные клетки, добавить 2 мл культуры средств массовой информации, и культуры на срок до 4 дней.
4. Фура-2 Загрузка красителя
- Сделать 2 мМ фура-2 ацетоксиметил эстер (fura-2 AM) бульонный раствор, добавив 25 л DMSO до 50 мкг порошка fura-2 AM (1 флакон). Aliquot в несколько аликотов. Возьмите 1 аликот фура-2 AM и добавьте к 6 мл покрытия среднего. Вихрь смешать.
- Удалить 1 шесть хорошо пластины миоцитов из инкубатора. Аспирные сми. Добавьте 1 мл медиа-смеси фура-2 к каждому колодцу. Накрыть тарелку фольгой, оставить тарелку при комнатной температуре и подождать 15 минут.
- Аспирировать фура-2 медиа-смеси и добавить 1 мл раствора Tyrode к каждой скважине. Накрыть фольгой. Подождите 20 минут при комнатной температуре, чтобы позволить для смыва красителя перед визуализацией.
5. Fluo-4 Загрузка красителя
- Сделать 1,82 мм фтор-4 ацетоксиметил эстер (фто-4 AM) бульонный раствор, добавив 25 л ДМСО до 50 мкг порошка fluo-4 AM (1 флакон). Aliquot в 8,333 qL aliquots. Возьмите 1 аликот флукот-4 AM бульона и добавить к 6 мл покрытия среды. Вихрь смешать.
- Удалить 1 шесть хорошо пластины миоцитов из инкубатора. Аспирные сми. Добавьте 1 мл смеси флуко-4 AM мультимедиа к каждому колодцу. Накрыть тарелку фольгой, оставить тарелку при комнатной температуре и подождать 15 минут.
- Аспирировать фтор-4 AM медиа-смеси и добавить 1 мл раствора Tyrode к каждому хорошо. Накрыть фольгой. Подождите 20 минут при комнатной температуре, чтобы позволить для смыва красителя перед визуализацией.
6. Мембрана Потенциал красителя Загрузка
- Удалите компонент А и компонент B из мембранного потенциального комплекта. В конической трубке объемом 15 мл смешайте 50 кЛ компонента B и 5 зл компонента A. Vortex для смешивания. Добавьте 10 мл покрытий в коническую трубку объемом 15 мл, содержащую смесь красителя напряжения. Вихрь смешать.
- Удалить 1 шесть хорошо пластины миоцитов из инкубатора. Аспирируй средства массовой информации. Добавьте 800 л мембранной потенциальной смеси красителя к каждому колодцу. Накрыть тарелку фольгой, оставить тарелку при комнатной температуре и подождать 15 минут.
- Аспирировать красителя смеси и добавить 1 мл модифицированного раствора Tyrode к каждому колодцу. Накрыть фольгой.
7. Фотометрия и запись с парового устройства
- Включите оборудование в следующем порядке: микроскоп, дуговая лампа, гиперпереключатель, система интерфейса флуоресценции, блок питания Myocam, полевой стимулятор и компьютер.
- Убедитесь, что наборы фильтров для возбуждения/выбросов подходят для красителя изображений.
ПРИМЕЧАНИЕ: Fura-2 возбуждается при 340 нм и 380 нм света. Он излучает на 510 нм света. Fluo-4 и мембранный краситель напряжения возбуждаются при 485 нм света и излучают при 520 нм света. - Премьер системы, включив вакуум, полностью открывшись шланг зажим, и осторожно погружая каждый 60 мл шприц используется в многообразии. Для записи кальция используйте раствор Tyrode. Для записи напряжения используйте модифицированное решение Tyrode.
- Включите обогреватель и установите поток, регулируя зажим ролика на перфузионных трубках. Делайте записи по 36 и 1 кС.
- Откройте программное обеспечение для приобретения. Убедитесь, что параметры установлены для правильного красителя изображения.
- В темноте, удалить фольгу из шести хорошо пластины и место coverslip в темпе камеры. Убедитесь, что стимулятор выключен во время этого шага. Сосредоточьтесь на миоцитах, используя 10-кратную цель.
- Оказавшись в фокусе, начните ходить по полостимулирующим при 1 Гц, 0,2 В. Постепенно увеличивайте напряжение до 1:1. Затем увеличить напряжение до 1.5x порог достигается.
ПРИМЕЧАНИЕ: Потому что возбуждение-сокращение соединения зависит от температуры, убедитесь, что клетки были perfused в течение 15 минут перед записью. Это позволяет миоцитам оправиться от шока перехода от комнатной температуры до 37 градусов по Цельсию, а также слабо прикрепленные клетки уплыть. - Переход от 10-x цели к цели 40x. Сосредоточьтесь на ячейке, которая следует за темпом 1:1. Отрегулируйте пластиковые оттенки, чтобы только одна ячейка находится в поле зрения.
- Используя программное обеспечение, поместите область интереса поле на четко определенные саркомера. Запустите программное обеспечение приобретения, чтобы инициировать возбуждение света. Используя фильтры нейтральной плотности, отрегулируйте настройки интенсивности соответствующим образом, чтобы получить адекватный SNR.
Результаты
На рисунке 1А показан аппарат Лангендорфа. Оксигенатор находится в водохранилище KHB-HB. Раствор коллагеназа находится в середине 60 мл шприца резервуара. Линия дегазования соединена с пустым резервуаром шприцев 60 мл. После успешной изоляции, большинство клеток должны быть стержня формы и полосатые. Под 40x целью, большинство миоцитов должны иметь четкие striations видны. На рисунке 1B,C показаны примеры здорового миоцита крысиных. После изоляции, клетки могут быть культивированы до 4 дней при сохранении их морфологии и электрических свойств.
Для измерения связок возбуждения-сокращения клетки помещаются в нагретую камеру. Поскольку миоциты чувствительны к изменениям температуры, важно, чтобы coverslip уравновесить в течение 15 минут в камере перед записью. Для флуоресценции записи, волновой длины возбуждения генерируется 75 W ксенон-дуговой лампы. Лампы Ксенон-дуга производят световой спектр, имитирующий естественный солнечный свет. Интенсивность света и длина волны контролируются нейтральной плотностью/излучением. Возбуждение света затем проходит через цель к миоциту. Длина волны эмиссии затем собирается фотомультипликатором трубки. Используя описанную здесь систему, необходимо изменить фильтры для возбуждения и выбросов вручную.
Сокращение, с другой стороны, получается с помощью датчика зарядного устройства. Измерение в режиме реального времени до 1000 раз в секунду, приобретение программного обеспечения выполняет в среднем линий в области, представляющие интерес для создания хорошо решена схема полоса. Затем рассчитывается быстрая трансформация Fourier (FFT). Пик в спектре мощности представляет собой среднее расстояние саркомера. Изменения в интервале саркомера во время темпа затем накладываются и впоследствии количественно.
На рисунке 2 показаны кальций и укороченные следы, записанные с миоцита мыши C57/B6, загруженного кальцийным красительом fura-2. Протокол шага представляет собой модификацию протоколов, описанных ранее10,11. Здоровые мыши миоциты должны быть в состоянии быть в состоянии ходить на их отдыха сердечного приступа 10 Гц. Рисунок 3 является количественной оценки ансамбль усредненные данные, полученные от C57/B6 мышей и их трансгенных (TG) littermates, которые точка мутации введены в калийный канал. Обратите внимание, нет никакой разницы между группами, за исключением времени релаксации на 10 Гц ходить.
В отличие от фура-2, который является двойным возбужданием красителя, краситель напряжения и флоу-4 являются одной длины волны возбуждания красителей, возбуждение / выбросы работы со стандартным FITC возбуждение и спектр выбросов (494/506 нм). Таким образом, записи кальция и саркоме сокращения или напряжения и саркомера сокращения могут быть получены с помощью этого набора фильтров.
На рисунке 4А показана трассировка напряжения, записанная с миоцита мыши C57/B6, темпируемого на 10 Гц. По сравнению с сигналами кальция, отслеживание напряжения одного элемента клеток меньше в амплитуде и нуждается в постобработке для получения используемого сигнала. На рисунке 4B показан ансамбльный усредненный потенциал действия (AP), сделанный из APs на рисунке 4A. Рисунок 4C, D показывает ансамбль среднем AP после низкого прохода Butterworth или Савицкий-Голей цифровой фильтр был применен. При фильтрации сигнала необходимо проявлять осторожность, с тем чтобы не искажать реальные данные. Обратите внимание на тонкие различия в форме APs на рисунке 4B-D.
На рисунке 5 показаны следы, записанные с миоцитов крысы, темпом на 1 Гц. В дополнение к сигналу напряжения быть более низким чем сигнал кальция, кинетика сужения друг также. Это потому, что кальций красителей кальция буфера кальция в то время как напряжение красителей нет.
Как и в случае с кальцием переходных (Рисунок 3), миоциты продемонстрировали темп зависимых изменений в их оптического действия потенциальной продолжительности (APD), а также (Рисунок 6). В то время как следы фура-2 были усреднены перед количественной оценкой, следы напряжения были отфильтрованы с помощью полиномального сглаживающего фильтра Савицкого-Голай (ширина 5, порядок 2) перед тем, как ансамбль усредненный и количественный.
Как количественно на рисунке 6 и рисунок 7, в дополнение к демонстрации темп индуцированных изменений в APD, они также продемонстрировали наркотиков индуцированной пролонгации AP. На 4 Гц ходить, концентрация зависимой блокады переходного внешнего течения (Iк) с 4-аминопиридин привело к продлению APD.
Наконец, необходимо проявлять осторожность, чтобы избежать цитотоксичности. Рисунок 8 — это последние 11 с 20-х с записи. Показано красными стрелками на рисунке 8, длительное воздействие миоцитов на синий свет приводит к срабатыванию активности.

Рисунок 1: Постоянное давление аппарат Лангендорф. (A) Аппарат Langendorff с каждым компонентом помечены белыми надписи. (B) Изолированные Sprague-Dawley крысиные миоциты рассматривается через 10x цели. (C) Изолированные миоциты крысы рассматривается через 40x цели. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
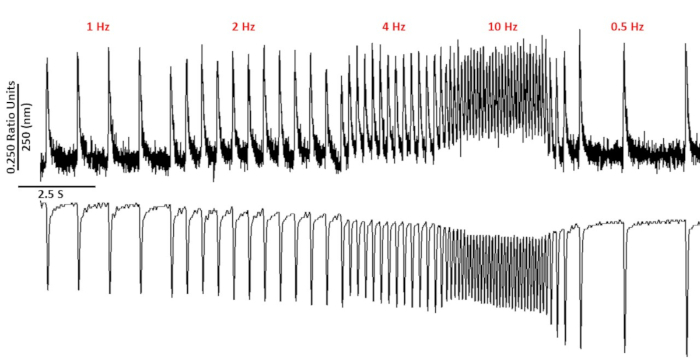
Рисунок 2: Представитель кальция и саркомера сокращения следов, записанных из C57/B6 myoyctes с использованием фура-2. Кальций и саркомере сокращения следов, записанных на 1, 2, 4, 10, 0,5 и 0,75 Гц. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
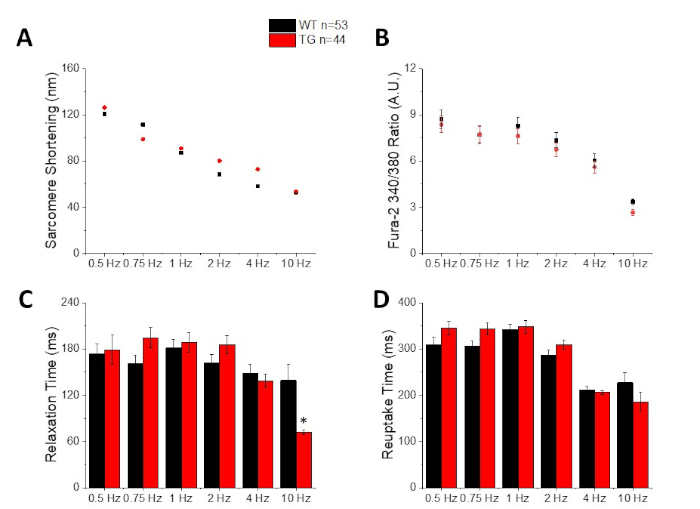
Рисунок 3: Количественная оценка сокращения саркомера, пикового кальция, времени релаксации и времени повторного отправления, зарегистрированного у диких мышей C57/B6 (WT) и трансгенных (TG). (A) Саркосер сокращения. (B) Пик кальция. (C)Время релаксации определяется как 90% вернуться к исходной линии сокращения следа. (D) Время повторного отработки определяется как 90% вернуться к исходной линии кальция следа. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
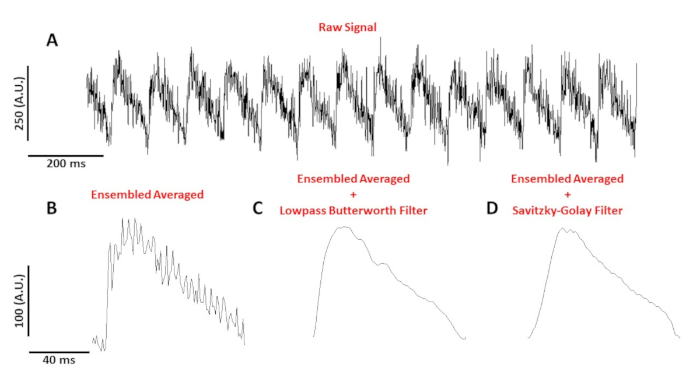
Рисунок 4: Оптический потенциал действия, записанный с миоцита мыши C57/B6, ходил на 10 Гц. (A) 1 секунда нефильтрованного следа. (B) Ансамбль усредненный оптический потенциал действия. (C) Ансамбль усредненный потенциал оптического действия после lowpass Фильтр Butterworth был применен. (D) Ансамбль усредненный потенциал оптического действия после Савицкого-Голай полиномиального сглаживающего фильтра был применен. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
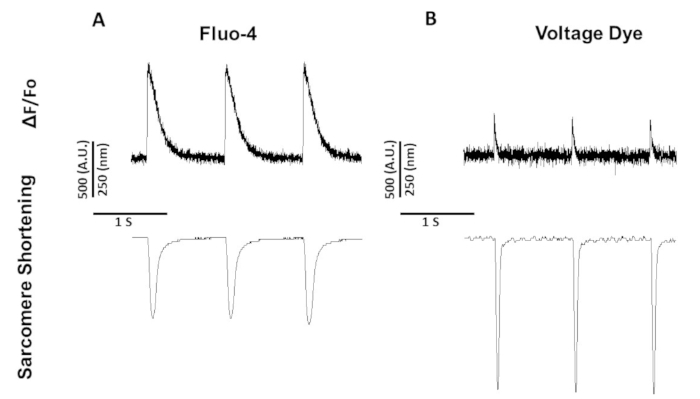
Рисунок 5: Представитель кальция, напряжения, и саркомере сокращения следов, записанных из Sprague-Dawley крысиных миоцитов темп на 1 Гц. (A) Кальций и саркомере сокращения следов, зарегистрированных на 1 Гц ходить с помощью фтор-4. (B) Напряжение и саркомере сокращения следов, записанных на 1 Гц ходить с помощью напряжения красителя. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
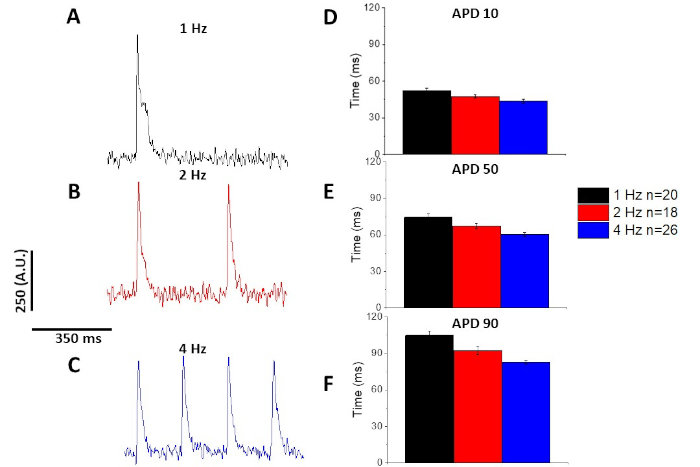
Рисунок 6: Оптические потенциалы действия, записанные из Sprague-Dawley крысиных миоцитов, шагали на 1, 2 и 4 Гц. (A) Фильтровированный след, записанный на 1 Гц ходить. (B) Фильтрованный след, записанный на 2 Гц ходить. (C) Фильтрованный след, записанный на 4 Гц ходить. (D) Действие потенциальная продолжительность 10, измеряется как 10% вернуться к базовому. (E) Действие потенциальная продолжительность 50, измеряется как 50% вернуться к базовому. (F) Действие потенциальная продолжительность 90, измеряется как 90% вернуться к базовому. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
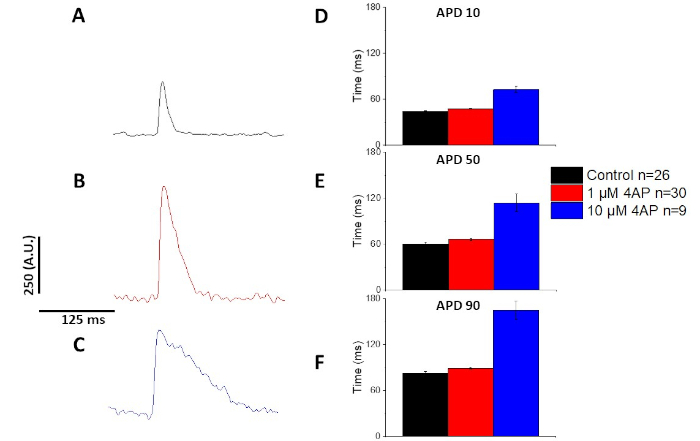
Рисунок 7: Эффекты 4-аминопиридин на Sprague-Dawley крысы оптических потенциалов действия, записанные на 4 Гц ходить. (A) Ансамбль усредненный след записан на 4 Гц ходить без 4-aminopyridine в растворе. (B) Ансамбль усредненный след, записанный на 4 Гц ходить с 1 ММ 4-Аминопиридин в растворе. (C) Ансамбль усредненный след, записанный на 4 Гц ходить с 10 ММ 4-Аминопиридин в растворе. (D) Действие потенциальная продолжительность 10, измеряется как 10% вернуться к базовому. (E) Действие потенциальная продолжительность 50, измеряется как 50% вернуться к базовому. (F) Действие потенциальная продолжительность 90, измеряется как 90% вернуться к базовому. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
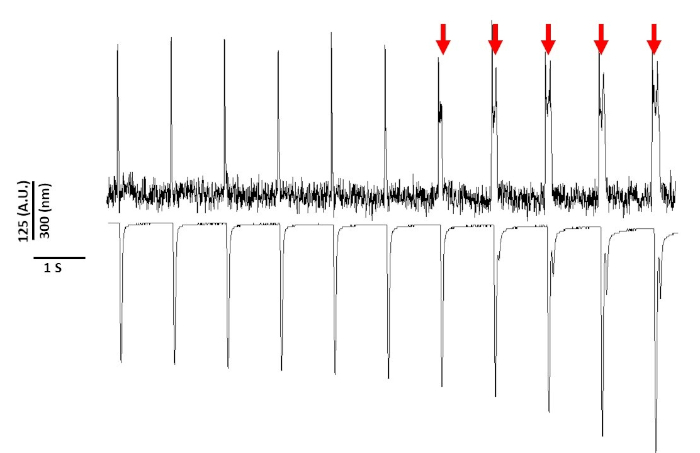
Рисунок 8: Напряжение красителя индуцированной фототоксичности в Sprague-Dawley крысиных миоцитов после 20 с непрерывного воздействия света. Красные стрелки указывают на цитотоксические явления. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Возможность изолировать сердечные миоциты является мощным методом, который может быть использован для понимания сердечной физиологии, патологии и токсикологии. В вышеупомянутом протоколе мы описали метод, который использует постоянное гравитационное давление аппарата Langendorff для получения одного сердечного миоцита. После этого, используя систему фотометрии флуоресценции, мы описываем, как одновременно приобретать кальций и укорочение или напряжение и укорочение следов.
Из-за различных кинетики между красителями кальция, необходимо принять меры, на которых краситель выбрать. Для этого протокола, как фура-2 и fluo-4 используется были разработаны с AM эфиров, требующих мыть шаг, чтобы внутриклеточные эстеразы время, чтобы расщеплять группу AM и ловушки красителя в клетке. В то время как фура-2 и фтор-4 считаются высоким сродством красителей кальция, Kd для фура-2 составляет 145 нм по сравнению с 345 нм для фтор-49. Кроме того, фура-2 является коэффициентетрией. Из-за этого, он может быть использован для количественной оценки внутриклеточного уровня кальция9,12. Fluo-4, с другой стороны, является одной волны кальция зонда. Преимущество использования fluo-4 заключается в том, что он производит более яркий сигнал флуоресценции. Независимо от того, какой краситель кальция используется, по сравнению с красителя кальция, мембранные зонды напряжения имеют более низкий SNR.
Как показано на рисунке 4 и рисунке 5,следы напряжения по сравнению со следами кальция меньше в амплитуде. Используя цифровую фильтрацию микростанций программного обеспечения, можно увеличить SNR и количественно определить данные(рисунок 4 и рисунок 7). После количественной оценки, как кальций переходных и оптических APDs продемонстрировать реституцию, сокращая их продолжительность на более быстрой ходьбе частоты(Рисунок 2, Рисунок 3, Рисунок 6, и Рисунок 7). Более короткие APDs во время более быстрых циклов шага необходимы для того чтобы позволить достаточное время для заполнения желудочка во время diastole. Изменения в этом явлении, как полагают, свидетельствует об увеличении риска арритмии13,14,15,16. Хотя изменения в APD могут быть вызваны болезнью, они также могут быть вызваны химическими веществами. Как показано на рисунке 7, когда преобладающий мурин repolarizing калийного тока,я,блокируется, оптический APD становится длиннее.
Тем не менее, как сообщалось ранее с напряжением чувствительных красителей, интенсивность света и продолжительность может изменить APD2,5,17. Считается, что это результат генерации реактивных окислительных видов (ROS)5. Ранее было показано, что добавление антиоксидантов в раствор записи может предотвратить напряжение чувствительных красителя цитотоксичность5. В результате мы добавили антиоксидант L-глутатион (10 мМ) в раствор Tyrode. Показано на рисунке 8 является последние 11 с 20 с записи, полученные на 1 Гц ходить. Как указано красными стрелками, изменения в APD не происходили до 15 с в записи; поэтому, хотя модифицированное решение Tyrode не предотвратило фототоксичность, оно значительно его задержало. Используя модифицированное решение Tyrode, используя настройки низкой интенсивности света и сохраняя продолжительность записи до менее 5 с, можно избежать любых изменений, индуцированных красителями в APD. Это важно, потому что, не заботясь о том, чтобы избежать фототоксичности, данные могут быть неправильно истолкованы как вызывающие раннюю или задержку после деполяризации. В дополнение к ограничению воздействия синего света, Существуют дополнительные меры предосторожности, которые могут быть приняты для предотвращения неправильного толкования данных.
Во-первых, только запись из клеток, которые следуют один к одному ходить и отдыха явки саркометра длина больше или равна 1,75 мкм. Отсечение 1,75 мкм взято из наблюдения Гордона и др.18, что напряжение быстро снижается, как только длина саркомера ниже этого количества. Тем не менее, некоторые патологии могут привести к значительным изменениям в длине отдыха саркомера. Чтобы убедиться, что фенотип реален, а не артефакт изоляции, следует принять следующие подходы к съемке проблемы.
Если миоциты постоянно не следуют 1:1 темп, имеют саркометра длиной ниже 1,75 мкм, тяжелые мембраны blebbing, или не выжить изоляции, первое, что нужно проверить это время, необходимое, чтобы сканировать сердце. Чем дольше время наклона, тем ниже будет выход. Если требуется длительное время наклона, жизнеспособность может быть улучшена путем размещения сердца в кардиоплегическое решение19. Тем не менее, поскольку коллагенеза является ферментом, активность и специфика определенной партии меняются с течением времени. Если общие урожаи постепенно ухудшаются, несмотря на хорошие времена консервации, следует провести проверку новыми лотами. В то время как наш протокол был оптимизирован для 5-s записей, если необходимы более длительные следы напряжения, необходимо будет приобрести дополнительные фильтры нейтральной плотности. Система, описанная в протоколе, поставляется с фильтрами нейтральной плотности, которые уменьшают передаваемый свет на 37%, 50%, 75%, 90% и 95%.
Таким образом, мы описали методологию, которая позволила для изоляции взрослых морин желудочковми миоцитами, которые были использованы для кальция, напряжения и саркомера сокращения измерений.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим Дану Моргенштерн за тщательное прочтение рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.25 Liter Water Jacketed Reservoir | Radnoti, LLC | 120142-025 | |
| 1 liter volumetric flask | Fisher Scientific | 10-205F | |
| 100 ml beaker | Fisher Scientific | FB-100-100 | |
| 100 ml graduated cylinder | Fisher Scientific | 08 562 5C | |
| 1000 ml flask | Fisher Scientific | FB-500-1000 | |
| 2-Bar Lab Stand with Stabilizer Bar and 24" Stainless Steel Rods | Radnoti, LLC | 159951-2 | |
| 4-Aminopyridine | Sigma-Aldrich | 275875 | |
| 40X Oly UApo/340 Non-Immersion Objective (NA 0.9, WD 0.2mm) | IonOptix | MSCP1-40 (b) | |
| 60-mL syringe, BD Luer-Lok tip | BD | 309650 | |
| Aortic Metal Cannulae | Harvard Apparatus | 73-0112 | |
| Bovine Serum Albumin | Fisher Scientific | BP9703-100 | |
| C-6 Standard Heating Circulator | Chemyx | A30006 | |
| CaCl2 | Fisher Scientific | BP510500 | |
| Cell framing adapter | IonOptix | CFA300 | |
| CellPr0 Vacuum Filtration System, 1 liter, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V100022 | |
| CellPro Vacuum Filtration System, 250mL, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V25022 | |
| CellPro Vacuum Filtration System, 500mL, 0.22µm,12/CS | Labratory Product Sales, Inc | V50022 | |
| CMC (mTCII) Temp Control w/ inline flow heater | IonOptix | TEMPC2 | |
| Cole-Parmer Large-bore 3-way, male-lock, stopcocks | Cole-Parmer | EW-30600-23 | |
| Cole-Parmer Luer fittings, Large-bore stopcocks, male lock, 4-way | Cole-Parmer | EW-30600-12 | |
| Cole-Parmer Stopcocks with Luer Connections; 1-way; male slip | Cole-Parmer | EW-30600-01 | |
| Collagenase Type II | Worthington | LS004177 | |
| Corning Sterile Cell Strainers | Fisher Scientific | 07-201-432 | |
| Dell Optiplex 790 mini-tower, 4G RAM, 250G HD, Windows 7 Pro | IonOptix | CPUD7M | |
| DMSO | Fisher Scientific | 50980367 | |
| Dumont Tweezers Style 5 | Amazon | B00F70ZDEQ | |
| FHD Rapid Change Stimulation Chamber | IonOptix | FHDRCC1 | |
| Fluo-3/4 Optics Package | IonOptix | IonOP-Fluo | |
| Fluorescence system interface – (w PCI-I/O card) | IonOptix | FSI700 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher Scientific | 15-140-122 | |
| Glucose | Fisher Scientific | D16-1 | |
| Hemostat, Curved 5-1/2" | Amazon | B00GGAAPD0 | |
| HEPES | Fisher Scientific | BP310500 | |
| HyperSwitch dual excitation light source | IonOptix | HSW400 | |
| Inverted Motic Fluorescence Microscope | IonOptix | MSCP1-40 (a) | |
| IonWizard Core + Analysis | IonOptix | IONWIZ | |
| Iris Scissors, curved | Amazon | B018KRRMY6 | |
| K2HPO4 | Fisher Scientific | P288-100 | |
| KCl | Fisher Scientific | BP3661 | |
| L-Glutathione reduced | Sigma-Aldrich | G4251 | |
| LOOK Silk Spool, Black Braided, 4-0, 100yds | SouthernAnesthesiaSurgical Inc. | SP116-EA | |
| M199 Media | Fisher Scientific | 12 340 030 | |
| MgCl2 | Fisher Scientific | MP021914215 | |
| MgSO4 | Fisher Scientific | BP2131 | |
| MyoCam-S Digital CCD video system | IonOptix | MCS100 | |
| MyoPacer Field Stimulator | IonOptix | MYP100 | |
| NaCl | Fisher Scientific | BP358212 | |
| NaH2PO4 | Fisher Scientific | 56-754-9250GM | |
| Oxygenator Bubbler with Fluid Inlet for 0.25 Liter | Radnoti, LLC | 140143-025 | |
| Photomultiplier sub-system | IonOptix | PMT400 | |
| PMT Acquisition add-on | IonOptix | PMTACQ | |
| Radnoti Heating Coil 5 mL with Degasing Trap | Radnoti, LLC | 158830 | |
| Ring Clamp 60 – 80mm Dia. for 250ml Reservoir | Radnoti, LLC | 120141-025 | |
| Ring Clamp for Bubble Trap Compliance Chamber | Radnoti, LLC | 120149RC | |
| Saint-Gobain ACF000010 5/32 in.9/32 in. | Fisher Scientific | 14-171-214 | |
| Saint-Gobain ACF000013 3/16 in.3/8 in. | Fisher Scientific | 14-171-217 | |
| Saint-Gobain ACF000016 1/4 in.5/16 in. | Fisher Scientific | 14-171-219 | |
| Saint-Gobain ACF000025 5/16 in.5/8 in. | Fisher Scientific | 14-171-226 | |
| Saint-Gobain ACF00003 1/16 in.3/16 in. | Fisher Scientific | 14-171-209 | |
| Saint-Gobain ACF00005 1/16 in.3/32 in. | Fisher Scientific | 14-171-210 | |
| Saint-Gobain ACF00009 5/32 in.7/32 in. | Fisher Scientific | 14-171-213 | |
| Sarcomere Length Recording add-on | IonOptix | SARACQ | |
| T/C Adson Tissue Platic Surgery Forceps 4.75" | Amazon | B00JDWRBGC | |
| VETUS Anti-Static Curved Tip Tweezers | Amazon | B07QMZC94J | |
| Vistek 3200 Motic Vibration Isolation Platform | IonOptix | ISO100 |
Ссылки
- Hagen, B. M., Boyman, L., Kao, J. P., Lederer, W. J. A comparative assessment of fluo Ca2+ indicators in rat ventricular myocytes. Cell Calcium. 52 (2), 170-181 (2012).
- Schaffer, P., Ahammer, H., Muller, W., Koidl, B., Windisch, H. Di-4-ANEPPS causes photodynamic damage to isolated cardiomyocytes. Pflügers Archiv: European Journal of Physiology. 426 (6), 548-551 (1994).
- Hardy, M. E., Lawrence, C. L., Standen, N. B., Rodrigo, G. C. Can optical recordings of membrane potential be used to screen for drug-induced action potential prolongation in single cardiac myocytes. Journal of Pharmacological and Toxicological Methods. 54 (2), 173-182 (2006).
- Tian, Q., et al. Optical action potential screening on adult ventricular myocytes as an alternative QT-screen. Cellular Physiology and Biochemistry. 27 (3-4), 281-290 (2011).
- Warren, M., et al. High-precision recording of the action potential in isolated cardiomyocytes using the near-infrared fluorescent dye di-4-ANBDQBS. The American Journal of Physiology-Heart and Circulatory Physiology. 299 (4), 1271-1281 (2010).
- FluoVolt™ Membrane Potential Kit. ThermoFisher Scientific Available from: https://assets.thermofisher.com/TFS-Assets/LSG/manuals/MAN0009668_FluoVolt_Membrane_Potential_Kit_UG.pdf (2018)
- Fluorescence SpectraViewer. ThermoFisher Scientific Available from: https://www.thermofisher.com/us/en/home/life-science/cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html (2019)
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Davis, J., et al. Diastolic dysfunction and thin filament dysregulation resulting from excitation-contraction uncoupling in a mouse model of restrictive cardiomyopathy. The Journal of Molecular and Cellular Cardiology. 53 (3), 446-457 (2012).
- Ren, J., Davidoff, A. J. Diabetes rapidly induces contractile dysfunctions in isolated ventricular myocytes. The American Journal of Physiology. 272, 148-158 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Goldhaber, J. I., et al. Action potential duration restitution and alternans in rabbit ventricular myocytes: the key role of intracellular calcium cycling. Circulation Research. 96 (4), 459-466 (2005).
- Weiss, J. N., et al. The dynamics of cardiac fibrillation. Circulation. 112 (8), 1232-1240 (2005).
- Baher, A., et al. Short-term cardiac memory and mother rotor fibrillation. The American Journal of Physiology-Heart and Circulatory Physiology. 292 (1), 180-189 (2007).
- Kleber, A. G., Rudy, Y. Basic mechanisms of cardiac impulse propagation and associated arrhythmias. Physiological Reviews. 84 (2), 431-488 (2004).
- McPheeters, M. T., Wang, Y. T., Werdich, A. A., Jenkins, M. W., Laurita, K. R. An infrared optical pacing system for screening cardiac electrophysiology in human cardiomyocytes. PLoS ONE. 12 (8), 0183761 (2017).
- Gordon, A. M., Huxley, A. F., Julian, F. J. The variation in isometric tension with sarcomere length in vertebrate muscle fibres. The Journal of Physiology. 184 (1), 170-192 (1966).
- Li, Y., et al. Three Preservation Solutions for Cold Storage of Heart Allografts: A Systematic Review and Meta-Analysis. The Journal of Artificial Organs. 40 (5), 489-496 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены