Method Article
分离的月毛心室肌细胞的光学成像
摘要
我们介绍了分离鼠肌细胞的方法,以及如何使用荧光光度测量与同时进行数字细胞几何测量,同时获得电压或钙痕迹。
摘要
分离成人心肌细胞的能力使研究人员能够在单细胞水平上研究各种心脏病变。虽然钙敏感染料的进步使得单细胞钙动力学具有强大的光学记录,但强大的跨膜光电压信号的记录仍然很困难。可以说,这是因为传统电位染料的低单噪声比、光毒性和光漂白。因此,单单元电压测量长期以来一直局限于贴片钳技术,而该技术虽然是金本位,但技术要求高,吞吐量低。然而,随着新型电位染料的发展,只需很少或没有光毒性和光漂白,就可以获得对电压变化的较大、快速的光响应。该协议详细介绍了如何分离可用于细胞缩短、钙和光电压测量的成年肌细胞。具体来说,该协议描述了如何使用比例钙染料、单激励钙染料和单激励电压染料。这种方法可用于评估各种化学制剂的心肌毒性和心律失常性。虽然光毒性在单细胞水平上仍然是一个问题,但讨论如何减少光毒性。
引言
为了研究心脏在健康和病理状态,它往往是有用的检查表型在单细胞水平。虽然科学的进步使得单细胞钙动力学的可靠测量得以进行,但单细胞光电压测量仍然很少。可以说,这是因为低信噪比(SNR),光毒性,以及传统电位染料2,3的光漂白。尽管如此,孤立的肌细胞光学作用电位已经获得了2,3,4。此外,随着电压敏感染料的化学和物理学的进步,SNR 提高了5。较新的膜电位探针(材料表)对亚毫秒内膜电位的变化作出反应,其荧光反应范围约为每100 mV25%。此外,膜电位试剂盒的激发/发射(例如,FluoVolt;材料表)该协议中使用的标准荧光素等西洋酸酯 (FITC) 或绿色荧光蛋白 (GFP) 设置6。
FITC和GFP激励/发射光谱与氟-4钙结合光谱7重叠。荧光光度测量与数字细胞几何测量同步采集传统上一直用于同时采集钙和细胞缩短测量8。该协议详细介绍了如何分离肌细胞,以及如何使用标准的FITC设置记录钙或电压信号。此外,它还描述了如何使用成像工作站上的激励/发射过滤器中的简单开关,使用公制钙染料 fura-2 的比例获得钙和缩短测量。与荧光-4相比,fura-2对钙的亲和力更高,对光漂白9具有相对的抵抗力。因此,使用单个工作站,该协议允许单独彻底检查肌细胞激发-收缩耦合。
研究方案
本议定书中描述的所有方法和程序均已获得凯斯西储大学机构动物护理和使用委员会(IACUC)的批准。
1. 准备解决方案、仪器和封面
注:1x 解决方案可使用长达一个月。
- 通过在 1000m L 的蒸馏水中加入 68.96 g 的 NaCl、3.57 g KCl、59.58 g 的 HEPES、2.18 g 的 K2HPO 4、3.08 g MgSO4和 19.82 g 葡萄糖到 800 mL 的双蒸馏水,使 10x Krebs-Henseleit 缓冲液 HEPES 缓冲液不带钙 (KHB-HB)。内容物完全溶解后,在 1,000 mL 体积烧瓶中调高体积。
注:传统的Krebs亨塞利特溶液使用碳酸氢钠作为缓冲液,该协议中的溶液使用带有HEPES缓冲液的Krebs亨塞利特溶液。如果无菌过滤,溶液稳定6个月。 - 通过在 1000 mL 的烧瓶中加入 86.51 g 的 NaCl、0.552 g 的 NaH2PO 4、2.03 g MgCl2、9.91g 葡萄糖、4.03 g KCl、2.65 g CaCl2和 35.76 g HEPES 到 800 mL 的双蒸馏水,使 Tyrode 的解决方案达到 10 倍 Tydd。内容物完全溶解后,在 1000 mL 体积烧瓶中调高体积。
注:如果无菌过滤,溶液稳定6个月。 - 通过测量出 10x 库存的 100 mL 并在 1,000 mL 烧瓶中加入 875 mL 的双蒸馏水,使 1x KHB-HB。将烧瓶放入37°C水浴中。一旦溶液达到37°C,使用NaOH将pH值提高到7.39。调整 pH 后,在 1000 mL 体积烧瓶中将溶液引入体积。使用真空过滤系统对溶液进行无菌过滤。
- 通过在 1000 mL 烧瓶中测量出 100 mL,并在 1,000 mL 瓶中加入 875 mL 的双蒸馏水,实现 1x Tyrode 的解决方案。将烧瓶放入37°C水浴中。一旦溶液达到37°C,使用NaOH将pH值提高到7.39。调整 pH 后,在 1,000 mL 体积烧瓶中引入溶液。使用真空过滤系统的无菌过滤器。
- 通过测量出 10x 库存的 100 mL 并在 1,000 mL 烧瓶中加入 875 mL 的双蒸馏水,使 Tyrode 的溶液经过 1 倍改进。溶解在烧瓶中减少的3.07克L-谷胱甘肽。将烧瓶放入37°C水浴中。一旦溶液达到37°C,使用NaOH将pH值提高到7.39。调整 pH 后,在 1,000 mL 体积烧瓶中引入溶液。使用真空过滤系统对溶液进行无菌过滤。
- 在25mg粉末中加入855μL的二甲基亚硫酸盐(DMSO),使100m bbbisatin库存溶液。以 20 μL 的增量进行加法,并储存在 -80°C 冷冻室中长达六个月。
- 将2克牛血清白蛋白(BSA)和1小瓶的副报价白蛋白储存到100 mL的1x KHB-HB,并使用真空过滤系统对溶液进行无菌过滤,从而进行停止缓冲。
- 将5 mL的胎儿牛血清和1小瓶的副报价的bbbisatin储存到M199 HEPES的95 mL,使电镀缓冲液。使用真空过滤系统对溶液进行无菌过滤。
- 使肌细胞培养缓冲,通过添加一个1小瓶的脂肪双苯丁股票和4毫升青霉素-链霉素到396毫升M199(25 mM HEPES)。使用真空过滤系统对溶液进行无菌过滤。
- 高压灭菌器 2 对杜蒙特钳子, 2 对虹膜弯曲剪刀, 2 节形, 一对整形手术钳, 6 黑色编织丝 4-0 缝合线安排用作手术双掷结, 和四个 100 mL 烧杯.
- 消毒 22 x 22 mm2玻璃盖玻片。首先,在六个孔板的每个井中放置一个盖玻片。之后,取下盖子后,打开生物安全柜的紫外线灯,将盖玻片暴露在紫外线下 1 小时。
- 首先在冰上解冻瓶子,使工作拉明宁库存溶液。将一瓶中的内容添加到足够的冷无菌磷酸盐缓冲盐水(PBS)中,最终浓度达到0.04mg/mL。将1.3 μL压入1.5 mL离心管中。储存在-80°C。
注:每根管子都有足够的层宁,用于一个单六孔板。避免多个冻结解冻周期。 - 通过先在冰上解冻工作层压面溶液来涂覆消毒盖玻片。使用 P1000 移液器,吸出 200 μL 的层宁。沿着盖玻片的一个边缘轻轻拖动移液器尖端,让毛细管动作拉出微量的层宁,以方便盖玻片连接到六个孔板。
- 然后,将盖玻片中心剩余的拉明宁排出。在圆周运动中,将层压滴铺过盖玻片。在隔离前至少1小时和24小时放入37°C培养箱中。
2. 兰根多夫仪器的准备
注:本议定书中使用的兰根多夫装置的各个部件列在材料表中。
- 打开循环水浴。设定温度,使渗透温度为 37°C。
注:当溶液储液罐设置为60厘米的高度时,循环水出生需要设置为41°C,使渗透液为37°C。与之前报告的协议不同,无需更改储层的高度。 - 用 70% 乙醇冲洗 Langendorff 设备,然后用高压灭二代双蒸馏水冲洗两次。洗水后,向储层中填充KHB-HB,并含氧100%氧。
- 通过允许含氧 KHB-HB 首先流入 100 mL 烧杯来为系统提供先给。当 50 mL 溶液流入烧杯后,切换 3 路停止旋塞位置以停止来自 KHB-HB 储液罐的流量。将 50 mL 的含氧 KHB-HB 从烧杯倒入胶原酶储液罐中。
- 让KHB-HB从消化池排出,直到5 mL留在胶原酶储液罐中。在注动胶原酶储液罐时,在储层之间反复切换 3 向止动孔,使管路脱气。系统注油后,请记住使用位于加热线圈顶部的脱气疏水阀,让任何剩余的空气离开系统。
- 制作胶原酶溶液。对于大鼠,结合100毫克的II型胶原酶,100mL的含氧KHB-HB,和2小瓶的乙苯基。对于小鼠,结合100毫克II型胶原酶、40mL含氧KHB-HB和2小瓶的乙苯基酶。混合后,溶液应稳定1小时。
注: 肌细胞的生存能力可能因 II 型胶原酶而不同。利用胶原酶取样程序,在批量订购前进行大量测试。
3. 肌细胞隔离
- 给动物注射1000U的肝素。等待 5 分钟。
注:可以使用任何年龄的老鼠和大鼠。然而,一般来说,年龄越大或患病越多的动物,肌细胞产量就越低。 - 在用五巴比妥混合物(150mg/kg腹管内)对动物实施安乐死之前,首先使用开滴法(每500cc体积1cc的异二烯1cc)对动物进行麻醉,从而牺牲动物。
- 通过首先抓住西波叶工艺上方的毛皮,迅速消耗心脏。用虹膜剪刀,在西香处理下做一个小切口,将毛皮向上拉向露出皮肤的头部。
- 抓住西风处理,并削减暴露胸腔的隔膜。做一个陷阱门切口,用一个夹板拉回胸骨,并使用弯曲的钳子切除心脏上方的上升主塔,并放置在寒冷的KHB-HB。
- 使用立体显微镜和5号钳子对心脏进行分光。确保心脏被淹没,在心脏切除之前,将管状物放在表面,以防止emboli。通过在主动脉插入心室上方约 1 mm 的导管尖端进行可视化,确认管芯的正确定位。
注:凝固时间越快,肌细胞产量越好。 - 通过在兰根多夫上旋转止动孔,启动 KHB-HB 的流量。将导管连接到兰根多夫。注入心脏5分钟。
注:由于灌注由基于重力的系统提供,流经心脏将是冠状动脉依从功能。 - 将灌注从 KHB-HB 储液罐切换到消化缓冲液储液罐。一旦消化缓冲液到达心脏,设置一个计时器(小鼠5分钟或大鼠15分钟)。确保在无菌的 100 mL 烧杯中收集渗透剂。根据需要用渗透液重新填充消化缓冲液,直到消化时间过期。
- 消化后,用钳子和虹膜剪刀在无菌的100 mL烧杯中分离心脏腔室。将每个腔室放入六孔板的单独井中。将5 mL的胶原酶溶液倒入每个井中。
- 立即开始用剪刀切碎心脏组织。组织块应约为1毫米3。使用无菌转移移液器,轻轻三聚碎的心脏组织。解决方案应变为多云。
- 一旦组织块变成白色和羽毛状,使用倒置显微镜检查细胞。如果活细胞数量大于80%,则使用100μm细胞滤网将细胞应变成50 mL锥形管。对心脏的每个腔室使用不同的管子和滤网。
- 如果活细胞的数量小于80%,请检查它需要时间。如果罐期超过5分钟,尝试另一颗心脏。如果不是,通过胶原酶取样程序检测新的胶原酶。
- 在215 x g下离心2分钟,将细胞压离。颗粒应紧凑且不松动。如果颗粒松动,制剂包含许多死细胞。在组织培养罩中,将颗粒重新悬浮在10 mL的停止缓冲液中。
- 在215 x g下离心2分钟,将细胞压离。颗粒应紧凑且不松动。如果颗粒松动,制剂包含许多死细胞。
- 在 5 mL 的电镀缓冲液中重新悬浮电池。执行单元格计数。调整电镀缓冲液的毫升,以达到每毫升2 x 104细胞的最终肌细胞浓度。
- 从培养箱中取出层宁涂层盖玻片。吸气层宁滴。
- 在每个盖玻上,肌细胞悬浮液的板 200 μL。放入37°C培养箱(21%O2,5%CO2)2小时,以允许附件。2小时后,吸出未连接的细胞,加入2 mL的培养培养物,并培养长达4天。
4. Fura-2 染料加载
- 将 25 μL 的 DMSO 添加到 50 μg 的 fura-2 AM 粉末(1 小瓶)中,制作 2 mM fura-2 乙氧甲基酯(fura-2 AM)库存溶液。与分配额为 6 μL 等分。取 1 个 fura-2 AM 的等分,并加入 6 mL 的电镀介质。漩涡混合。
- 从培养箱中取出1 6孔肌细胞。吸气介质。在每个井中加入 1 mL 的 fura-2 介质混合物。用铝箔盖板,在室温下离开板,等待 15 分钟。
- 吸气 Fura-2 介质混合物,并在每个井中加入 1 mL 的 Tyrode 溶液。用铝箔盖住。在室温下等待 20 分钟,以便在成像前冲洗染料。
5. 氟-4染料加载
- 将 25 μL 的 DMSO 添加到 50 μg 的氟-4 AM 粉末(1 瓶),制作 1.82 mM 氟-4 乙氧基酯(氟-4 AM)库存溶液。与分量为 8.333 μL 等分。取 1 个等分的氟-4 AM 库存,并加入 6 mL 的电镀介质。漩涡混合。
- 从培养箱中取出1 6孔肌细胞。吸气介质。在每个井中加入 1 mL 的氟-4 AM 介质混合物。用铝箔盖板,在室温下离开板,等待 15 分钟。
- 吸气荧光-4 AM介质混合物,并在每口井中加入1mL的Tyrode溶液。用铝箔盖住。在室温下等待 20 分钟,以便在成像前冲洗染料。
6. 膜电位染料加载
- 从膜电位套件中取出组件 A 和组件 B。在 15 mL 锥形管中,将 50 μL 的组分 B 和 5 μL 的组分 A. 涡流混合。在含有电压染料混合物的 15 mL 锥形管中加入 10 mL 的电镀介质。漩涡混合。
- 从培养箱中取出1 6孔肌细胞。吸气介质。在每个井中加入800 μL的膜电位染料混合物。用铝箔盖板,在室温下离开板,等待 15 分钟。
- 吸气染料介质混合物,并在每口井中加入1 mL的改性Tyrode溶液。用铝箔盖住。
7. 光度测量和电荷耦合设备录制
- 按以下顺序打开设备:显微镜、电弧灯、超开关、荧光接口系统、Myocam 电源、现场刺激器和计算机。
- 确保激励/发射滤光片组适合成像染料。
注:Fura-2 在 340 nm 和 380 nm 的光线下激发。它在510nm的光下发射。Fluo-4 和电压膜染料在 485 nm 的光线下激发,在 520 nm 的光线下发射。 - 打开真空,完全打开软管夹,轻轻将歧管中使用的每个 60 mL 注射器压下,从而为系统注入先压。对于钙记录,请使用泰洛德的溶液。对于电压记录,请使用经过修改的 Tyrode 解决方案。
- 通过调整灌注管上的滚子夹,打开加热器并设置流量。在 36 ± 1 °C 下进行录制。
- 打开采集软件。确保为正确的成像染料设置参数。
- 在黑暗中,从六个井板上取下铝箔,并在起搏室中放置一个盖玻片。确保在此步骤中刺激器已关闭。使用 10 倍目标关注肌细胞。
- 一旦进入对焦,开始以1赫兹,0.2 V的现场刺激起搏。 逐渐增加电压,直到获得1:1起搏。然后增加电压,直到达到阈值的 1.5 倍。
注:由于激励收缩耦合与温度相关,因此在记录前确保细胞已注入15分钟。这允许肌细胞从室温回到37°C的冲击中恢复过来,以及松散附着的细胞漂浮。 - 从 10 倍目标切换到 40 倍目标。专注于遵循 1:1 起搏的单元格。调整塑料阴影,以便视图中只有一个单元格。
- 使用该软件,将兴趣框放在定义明确的沙康器上。启动采集软件以启动激励指示灯。使用中性密度滤波器,相应地调整强度设置,以获得足够的SNR。
结果
图 1A显示了兰根多夫装置。氧气器位于 KHB-HB 储液罐中。胶原酶溶液位于60mL注射器储液罐中。脱气管线连接到空的 60 mL 注射器储液罐。成功分离后,大多数细胞应杆形和纹状。在40x目标下,大多数肌细胞应该有可见的清晰的条纹。图1B,C显示了健康的大鼠肌细胞的例子。一旦分离,细胞可以培养长达4天,同时保持其形态和电特性。
为了测量激励收缩耦合,然后将细胞放置在加热的起搏室中。由于肌细胞对温度变化敏感,因此在记录之前,让盖玻片在腔室中平衡 15 分钟非常重要。对于荧光记录,激发波长由 75 W 的 Xenon-arc 灯泡生成。Xenon-arc 灯泡产生模仿自然阳光的光谱。光的强度和波长由中性密度/发射文件控制。然后,激发光穿过目标进入肌细胞。然后,通过光电倍增管收集发射波长。使用此处描述的系统,需要手动更换激励和排放滤波器。
另一方面,通过电荷耦合器件传感器获得缩短。采集软件可实时测量高达每秒 1,000 次,在感兴趣的区域内执行平均线路,以创建解决良好的条纹模式。然后计算快速傅立叶变换 (FFT)。功率谱中的峰值表示平均沙康距离间距。然后绘制和随后量化起搏过程中沙康雷间距的变化。
图2显示了从装有钙染料fura-2的C57/B6小鼠肌细胞中记录的钙和缩短痕迹。起搏协议是前面描述的第10、11条对起搏协议的修改。健康的小鼠肌细胞应该能够以10赫兹的静息心率的速度步调。图3是从C57/B6小鼠及其转基因(TG)杂物中获取的合成平均数据的量化,这些小鼠的点突变引入钾通道。请注意,除了 10 Hz 起搏的放松时间外,组之间没有区别。
与双激励染料 Fura-2 不同,电压染料和荧光-4 是单波长激励染料,其激发/发射与标准 FITC 激发和发射光谱 (494/506 nm) 配合。因此,可以使用该滤波器集获得钙和沙科雷缩短或电压和沙科雷缩短的录音。
图4A显示了从C57/B6小鼠肌细胞在10Hz处键定的速度记录的电压跟踪。 与钙信号相比,单单元电压跟踪的振幅较小,需要经过后处理才能获得可利用的信号。图 4B显示了从图 4A中的 AP 产生的集合平均行动电位 (AP)。图 4C,D显示了应用低通布特沃斯或萨维茨基-戈莱数字滤波器后的整体平均 AP。过滤信号时必须小心,不要扭曲真实数据。请注意图 4B-D中 AP 形状的细微差异。
图 5显示了从以 1 Hz 速度的大鼠肌细胞记录的痕迹。除了电压信号低于钙信号外,收缩动力学也不同。这是因为钙染料缓冲钙,而电压染料没有。
与钙瞬态(图3)一样,肌细胞也显示出其光学作用电量潜在持续时间(APD)的起搏相关变化(图6)。虽然 fura-2 轨迹在量化之前是一共平均的,但电压痕迹在进行平均和量化之前,使用 Savitzky-Golay 多项式平滑滤波器(宽度 5,顺序 2)进行过滤。
如图6和图7的量化,除了演示APD的起搏诱导变化外,他们还演示了药物诱导AP的延长。在4 Hz起搏时,对瞬态外电流(I到)的浓度依赖性封锁,4-氨基苯丙胺导致APD的延长。
最后,必须注意避免细胞毒性。图 8是 20 s 录制的最后 11 个 s。图8中的红色箭头指示,肌细胞长时间暴露在蓝光下会导致触发活动。

图1:恒压兰根多夫装置。(A) 兰根多夫装置,每个组件都标有白色字母。(B) 孤立的斯普拉格-道利大鼠肌细胞通过10倍目标观察。(C) 通过40倍目标观察分离的老鼠肌细胞。请点击此处查看此图的较大版本。
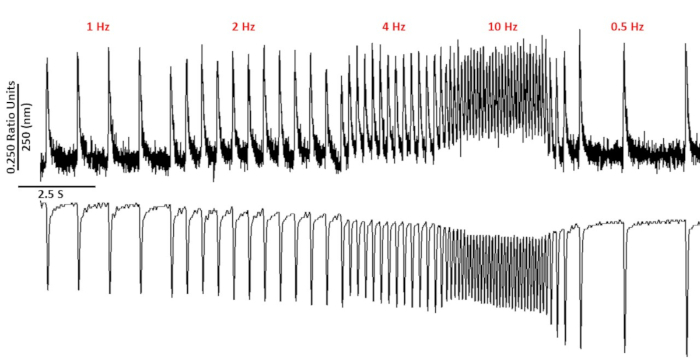
图2:使用fura-2从C57/B6 myoycts记录的代表性钙和沙科梅缩短痕迹。钙和沙科美尔缩短痕迹记录在1,2,4,10,0.5和0.75赫兹。请点击这里查看这个数字的较大版本。
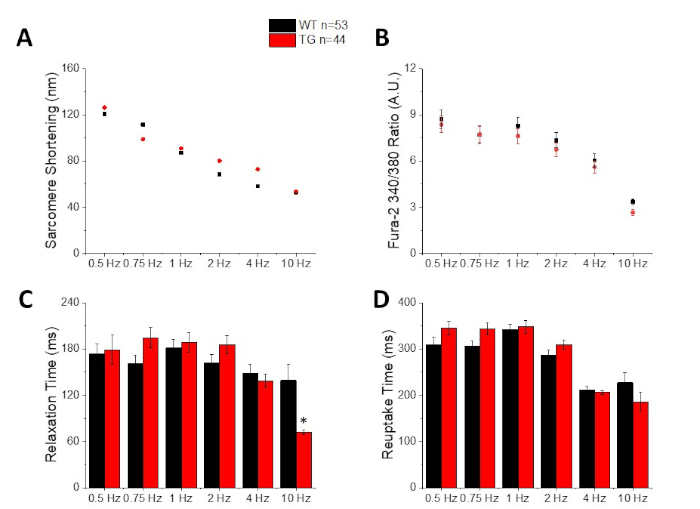
图3:从C57/B6野生型(WT)和转基因(TG)小鼠中记录的沙科雷缩短、钙峰、放松时间和再摄取时间的定量。(A) 萨科雷缩短。(B) 峰值钙。(C) 放松时间定义为 90% 返回到缩短轨迹的基线。(D) 重取时间定义为 90% 返回钙痕量基线。请点击此处查看此图的较大版本。
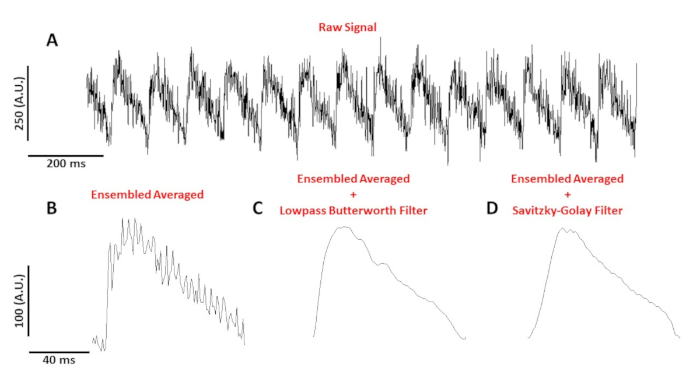
图 4:从 C57/B6 小鼠肌细胞以 10 Hz 的速度步调记录的光学动作电位。(A) 1 秒未过滤的跟踪.(B) 集合平均光学作用电位.(C) 应用低通巴特沃斯滤波器后,集合平均光学作用电位。(D) 应用萨维茨基-戈莱多项式平滑滤波器后,集合平均光学作用电位。请点击此处查看此图的较大版本。
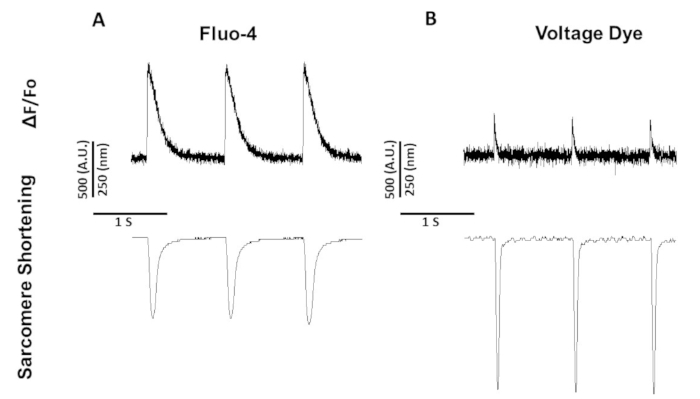
图5:代表性的钙、电压和沙科默缩短痕迹记录从斯普拉格-道利大鼠肌细胞在1赫兹。(A) 使用荧光-4在1Hz起搏时记录的钙和沙康美缩短痕迹。(B) 使用电压染料记录在 1 Hz 起搏处的电压和沙康美缩短轨迹。请点击此处查看此图的较大版本。
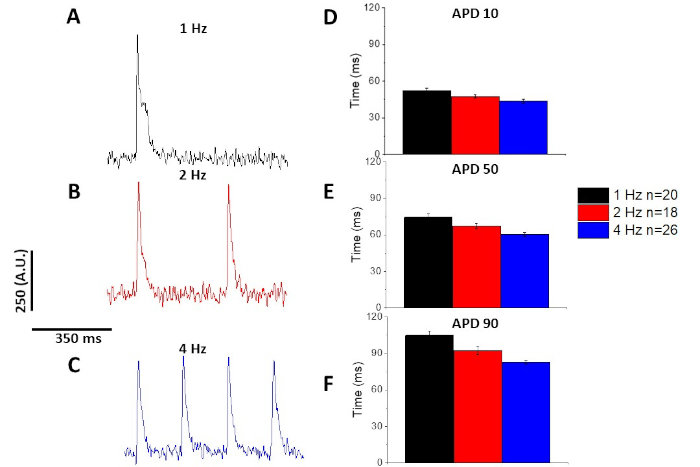
图6:斯普拉格-道利大鼠肌细胞记录的光学动作电位在1、2和4赫兹起搏时步调。(A) 以 1 Hz 起搏记录的过滤跟踪。(B) 以 2 Hz 起搏记录的过滤跟踪。(C) 以 4 Hz 起搏记录的过滤跟踪。(D) 行动潜在持续时间 10,以 10% 的基线返回。(E) 行动潜在持续时间 50,以 50% 的基线返回。(F) 行动潜在持续时间 90,以 90% 的基线返回。请点击此处查看此图的较大版本。
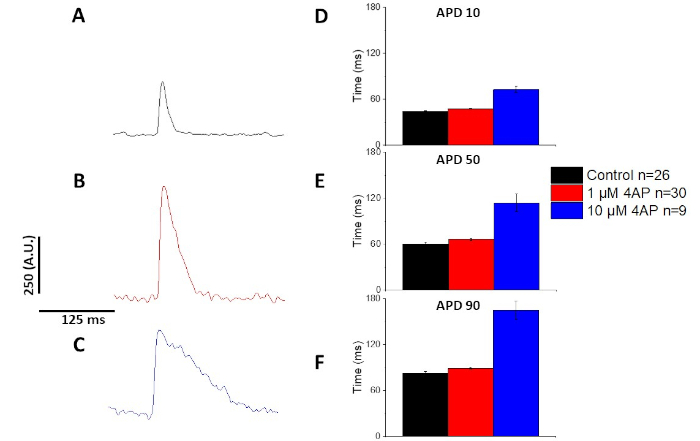
图7:4-氨基苯丙胺对斯普拉格-道利大鼠光学作用电位的影响,记录在4赫兹起搏。(A) 在4Hz起搏时记录的合成平均跟踪,溶液中没有4-阿米诺皮里丁。(B) 在4Hz起搏时记录的合成平均跟踪,溶液中为1μM 4-氨基丙氨酸。(C) 在4Hz起搏时记录的平均跟踪,溶液中记录10μM 4-氨基丙氨酸。(D) 行动潜在持续时间 10,以 10% 的基线返回。(E) 行动潜在持续时间 50,以 50% 的基线返回。(F) 行动潜在持续时间 90,以 90% 的基线返回。请点击此处查看此图的较大版本。
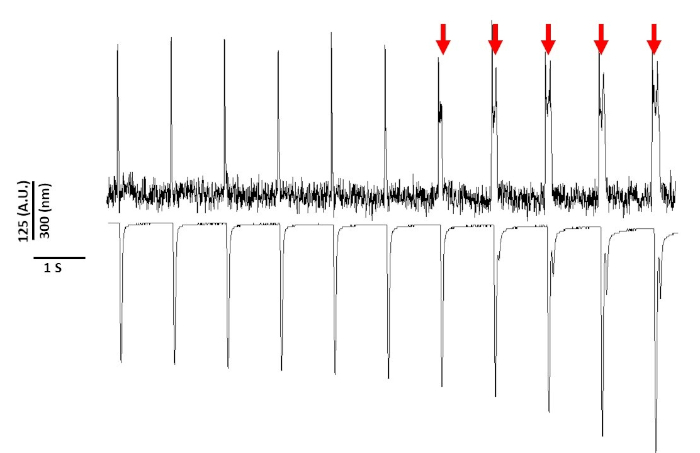
图8:电压染料在连续光照射20小时后引起斯普拉格-道利大鼠肌细胞的光毒性。红色箭头表示细胞毒性事件。请点击此处查看此图的较大版本。
讨论
能够分离心细胞是一种强大的方法,可用于了解心脏生理学、病理学和毒理学。在上述协议中,我们描述了一种利用恒定重力压力兰根多夫装置获得单心肌细胞的方法。之后,利用荧光光度测定系统,描述了如何同时获得钙和缩短或电压和缩短痕迹。
由于钙染料之间的动力学不同,必须注意选择哪种染料。对于此协议,使用的 fura-2 和荧光-4 均采用 AM 酯设计,需要洗涤步骤,以便细胞内酯酸时间将 AM 组切下并捕获细胞中的染料。虽然Fura-2和氟-4都被认为是高亲和力钙染料,但Fura-2的Kd为145 nM,而荧光-49为345 nM。此外,fura-2 是比率的。因此,它可以用来量化细胞内钙水平9,12。另一方面是单波钙探针。4号是单波钙探针。使用荧光-4的优点是它产生更亮的荧光信号。无论使用哪种钙染料,与钙染料相比,膜电压探头的SNR较低。
如图4和图5所示,与钙痕量相比,电压痕迹的振幅较小。使用软件的数字跟踪滤波,可以增加SNR和量化数据(图4和图7)。一旦量化,钙瞬变和光学AD都表现出恢复性,以更快的起搏频率缩短其持续时间(图2,图3,图6和图7)。在更快的起搏周期中,需要更短的 AD,以便在隔膜期间留出足够的时间进行心室填充。这种现象的变化被认为是表明阿瑞特米亚斯13,14,15,16的风险增加。虽然APD的改变可以由疾病引起,但它们也可能由化学物质引起。如图7所示,当主要的鼠酸钾电流(I到)被阻塞时,光学APD变长。
然而,正如之前用电压敏感染料报道的那样,光强度和持续时间可以改变APD2,5,17。这被认为是反应性氧化物种(ROS)5产生的结果。此前已经表明,在记录溶液中加入抗氧化剂可以防止电压敏感染料细胞毒性5。因此,我们在Tyrode的溶液中添加了抗氧化剂L-谷胱甘肽(10 mM)。图8中所示是 1 Hz 起搏时获得的 20 s 录制的最后 11 s。如红色箭头所示,APD 的更改直到 15 s 进入录制;因此,虽然改良的Tyrode溶液不能防止光毒性,但它大大延缓了光毒性。使用经过改进的 Tyrode 解决方案,使用低光强度设置并将录制时间保持在 5 s 以下,可以避免 APD 中任何染料引起的更改。这一点很重要,因为如果不注意避免光毒性,数据可能被误解为在脱极化后导致早期或延迟。除了限制蓝光照射外,还可以采取其他预防措施,以防止对数据的误解。
第一种是只记录从细胞跟随一对一的起搏,并且休息的沙科梅长度大于或等于1.75μm。1.75 μm截止值取自戈登等人18的观察,即一旦沙科梅长度低于这个量,张力就会迅速下降。尽管如此,某些病理学可能会导致休息沙科梅长的显著改变。为了确保表型是真实的,而不是隔离的伪影,应采取以下故障排除方法。
如果肌细胞始终不遵循1:1起搏,沙棘长度低于1.75μm,重膜颤动,或无法生存的隔离,首先要检查的是它花了时间,以可以使心脏。罐期越长,产量越低。如果需要长时间的排泄时间,可以通过将心脏置于心电图溶液19来提高生存能力。然而,由于胶原酶是一种酶,特定批次的活性和特异性会随着时间而改变。如果整体收益率在保持良好收高时间的情况下逐渐恶化,则应对新手数进行测定。虽然我们的协议针对 5 s 录像进行了优化,但如果需要更长的电压曲线,则需要购买额外的中性密度滤波器。协议中描述的系统附带中性密度滤波器,可将透射光减少 37%、50%、75%、90% 和 95%。
总之,我们描述了一种方法,允许分离用于钙、电压和沙科梅雷缩短测量的成年鼠心室肌细胞。
披露声明
作者没有什么可透露的。
致谢
我们感谢达娜·摩根斯坦仔细校对手稿。
材料
| Name | Company | Catalog Number | Comments |
| 0.25 Liter Water Jacketed Reservoir | Radnoti, LLC | 120142-025 | |
| 1 liter volumetric flask | Fisher Scientific | 10-205F | |
| 100 ml beaker | Fisher Scientific | FB-100-100 | |
| 100 ml graduated cylinder | Fisher Scientific | 08 562 5C | |
| 1000 ml flask | Fisher Scientific | FB-500-1000 | |
| 2-Bar Lab Stand with Stabilizer Bar and 24" Stainless Steel Rods | Radnoti, LLC | 159951-2 | |
| 4-Aminopyridine | Sigma-Aldrich | 275875 | |
| 40X Oly UApo/340 Non-Immersion Objective (NA 0.9, WD 0.2mm) | IonOptix | MSCP1-40 (b) | |
| 60-mL syringe, BD Luer-Lok tip | BD | 309650 | |
| Aortic Metal Cannulae | Harvard Apparatus | 73-0112 | |
| Bovine Serum Albumin | Fisher Scientific | BP9703-100 | |
| C-6 Standard Heating Circulator | Chemyx | A30006 | |
| CaCl2 | Fisher Scientific | BP510500 | |
| Cell framing adapter | IonOptix | CFA300 | |
| CellPr0 Vacuum Filtration System, 1 liter, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V100022 | |
| CellPro Vacuum Filtration System, 250mL, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V25022 | |
| CellPro Vacuum Filtration System, 500mL, 0.22µm,12/CS | Labratory Product Sales, Inc | V50022 | |
| CMC (mTCII) Temp Control w/ inline flow heater | IonOptix | TEMPC2 | |
| Cole-Parmer Large-bore 3-way, male-lock, stopcocks | Cole-Parmer | EW-30600-23 | |
| Cole-Parmer Luer fittings, Large-bore stopcocks, male lock, 4-way | Cole-Parmer | EW-30600-12 | |
| Cole-Parmer Stopcocks with Luer Connections; 1-way; male slip | Cole-Parmer | EW-30600-01 | |
| Collagenase Type II | Worthington | LS004177 | |
| Corning Sterile Cell Strainers | Fisher Scientific | 07-201-432 | |
| Dell Optiplex 790 mini-tower, 4G RAM, 250G HD, Windows 7 Pro | IonOptix | CPUD7M | |
| DMSO | Fisher Scientific | 50980367 | |
| Dumont Tweezers Style 5 | Amazon | B00F70ZDEQ | |
| FHD Rapid Change Stimulation Chamber | IonOptix | FHDRCC1 | |
| Fluo-3/4 Optics Package | IonOptix | IonOP-Fluo | |
| Fluorescence system interface – (w PCI-I/O card) | IonOptix | FSI700 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher Scientific | 15-140-122 | |
| Glucose | Fisher Scientific | D16-1 | |
| Hemostat, Curved 5-1/2" | Amazon | B00GGAAPD0 | |
| HEPES | Fisher Scientific | BP310500 | |
| HyperSwitch dual excitation light source | IonOptix | HSW400 | |
| Inverted Motic Fluorescence Microscope | IonOptix | MSCP1-40 (a) | |
| IonWizard Core + Analysis | IonOptix | IONWIZ | |
| Iris Scissors, curved | Amazon | B018KRRMY6 | |
| K2HPO4 | Fisher Scientific | P288-100 | |
| KCl | Fisher Scientific | BP3661 | |
| L-Glutathione reduced | Sigma-Aldrich | G4251 | |
| LOOK Silk Spool, Black Braided, 4-0, 100yds | SouthernAnesthesiaSurgical Inc. | SP116-EA | |
| M199 Media | Fisher Scientific | 12 340 030 | |
| MgCl2 | Fisher Scientific | MP021914215 | |
| MgSO4 | Fisher Scientific | BP2131 | |
| MyoCam-S Digital CCD video system | IonOptix | MCS100 | |
| MyoPacer Field Stimulator | IonOptix | MYP100 | |
| NaCl | Fisher Scientific | BP358212 | |
| NaH2PO4 | Fisher Scientific | 56-754-9250GM | |
| Oxygenator Bubbler with Fluid Inlet for 0.25 Liter | Radnoti, LLC | 140143-025 | |
| Photomultiplier sub-system | IonOptix | PMT400 | |
| PMT Acquisition add-on | IonOptix | PMTACQ | |
| Radnoti Heating Coil 5 mL with Degasing Trap | Radnoti, LLC | 158830 | |
| Ring Clamp 60 – 80mm Dia. for 250ml Reservoir | Radnoti, LLC | 120141-025 | |
| Ring Clamp for Bubble Trap Compliance Chamber | Radnoti, LLC | 120149RC | |
| Saint-Gobain ACF000010 5/32 in.9/32 in. | Fisher Scientific | 14-171-214 | |
| Saint-Gobain ACF000013 3/16 in.3/8 in. | Fisher Scientific | 14-171-217 | |
| Saint-Gobain ACF000016 1/4 in.5/16 in. | Fisher Scientific | 14-171-219 | |
| Saint-Gobain ACF000025 5/16 in.5/8 in. | Fisher Scientific | 14-171-226 | |
| Saint-Gobain ACF00003 1/16 in.3/16 in. | Fisher Scientific | 14-171-209 | |
| Saint-Gobain ACF00005 1/16 in.3/32 in. | Fisher Scientific | 14-171-210 | |
| Saint-Gobain ACF00009 5/32 in.7/32 in. | Fisher Scientific | 14-171-213 | |
| Sarcomere Length Recording add-on | IonOptix | SARACQ | |
| T/C Adson Tissue Platic Surgery Forceps 4.75" | Amazon | B00JDWRBGC | |
| VETUS Anti-Static Curved Tip Tweezers | Amazon | B07QMZC94J | |
| Vistek 3200 Motic Vibration Isolation Platform | IonOptix | ISO100 |
参考文献
- Hagen, B. M., Boyman, L., Kao, J. P., Lederer, W. J. A comparative assessment of fluo Ca2+ indicators in rat ventricular myocytes. Cell Calcium. 52 (2), 170-181 (2012).
- Schaffer, P., Ahammer, H., Muller, W., Koidl, B., Windisch, H. Di-4-ANEPPS causes photodynamic damage to isolated cardiomyocytes. Pflügers Archiv: European Journal of Physiology. 426 (6), 548-551 (1994).
- Hardy, M. E., Lawrence, C. L., Standen, N. B., Rodrigo, G. C. Can optical recordings of membrane potential be used to screen for drug-induced action potential prolongation in single cardiac myocytes. Journal of Pharmacological and Toxicological Methods. 54 (2), 173-182 (2006).
- Tian, Q., et al. Optical action potential screening on adult ventricular myocytes as an alternative QT-screen. Cellular Physiology and Biochemistry. 27 (3-4), 281-290 (2011).
- Warren, M., et al. High-precision recording of the action potential in isolated cardiomyocytes using the near-infrared fluorescent dye di-4-ANBDQBS. The American Journal of Physiology-Heart and Circulatory Physiology. 299 (4), 1271-1281 (2010).
- FluoVolt™ Membrane Potential Kit. ThermoFisher Scientific Available from: https://assets.thermofisher.com/TFS-Assets/LSG/manuals/MAN0009668_FluoVolt_Membrane_Potential_Kit_UG.pdf (2018)
- Fluorescence SpectraViewer. ThermoFisher Scientific Available from: https://www.thermofisher.com/us/en/home/life-science/cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html (2019)
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Davis, J., et al. Diastolic dysfunction and thin filament dysregulation resulting from excitation-contraction uncoupling in a mouse model of restrictive cardiomyopathy. The Journal of Molecular and Cellular Cardiology. 53 (3), 446-457 (2012).
- Ren, J., Davidoff, A. J. Diabetes rapidly induces contractile dysfunctions in isolated ventricular myocytes. The American Journal of Physiology. 272, 148-158 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Goldhaber, J. I., et al. Action potential duration restitution and alternans in rabbit ventricular myocytes: the key role of intracellular calcium cycling. Circulation Research. 96 (4), 459-466 (2005).
- Weiss, J. N., et al. The dynamics of cardiac fibrillation. Circulation. 112 (8), 1232-1240 (2005).
- Baher, A., et al. Short-term cardiac memory and mother rotor fibrillation. The American Journal of Physiology-Heart and Circulatory Physiology. 292 (1), 180-189 (2007).
- Kleber, A. G., Rudy, Y. Basic mechanisms of cardiac impulse propagation and associated arrhythmias. Physiological Reviews. 84 (2), 431-488 (2004).
- McPheeters, M. T., Wang, Y. T., Werdich, A. A., Jenkins, M. W., Laurita, K. R. An infrared optical pacing system for screening cardiac electrophysiology in human cardiomyocytes. PLoS ONE. 12 (8), 0183761 (2017).
- Gordon, A. M., Huxley, A. F., Julian, F. J. The variation in isometric tension with sarcomere length in vertebrate muscle fibres. The Journal of Physiology. 184 (1), 170-192 (1966).
- Li, Y., et al. Three Preservation Solutions for Cold Storage of Heart Allografts: A Systematic Review and Meta-Analysis. The Journal of Artificial Organs. 40 (5), 489-496 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。