Method Article
Imagerie optique des myocytes ventriculaires murines isolés
Dans cet article
Résumé
Nous présentons la méthodologie pour l'isolement des myocytes murines et comment obtenir des traces de tension ou de calcium simultanément avec des traces de raccourcissement sarcome à l'aide de la photométrie fluorescence avec des mesures numériques simultanées de géométrie cellulaire.
Résumé
La capacité d'isoler les myocytes cardiaques adultes a permis aux chercheurs d'étudier une variété de pathologies cardiaques au niveau des cellules individuelles. Tandis que les progrès dans les colorants sensibles au calcium ont permis l'enregistrement optique robuste de la dynamique de calcium de cellules simples, l'enregistrement des signaux optiques robustes de tension optique de transmembrane est resté difficile. On peut dire que c'est en raison du faible rapport single/bruit, de la phototoxicité et du photoblanchiment des colorants potentiométriques traditionnels. Par conséquent, les mesures de tension à cellule unique ont longtemps été confinées à la technique de pince de correction qui, bien que l'étalon-or, est techniquement exigeante et faible débit. Cependant, avec le développement de nouveaux colorants potentiométriques, de grandes réponses optiques rapides aux changements de tension peuvent être obtenues avec peu ou pas de phototoxicité et de photoblanchiment. Ce protocole décrit en détail comment isoler les myocytes murines adultes qui peuvent être utilisés pour le raccourcissement cellulaire, le calcium et les mesures de tension optique. Plus précisément, le protocole décrit comment utiliser un colorant calométrique de calcium, un colorant de calcium à excitation unique, et un colorant de tension d'excitation unique. Cette approche peut être utilisée pour évaluer la cardiotoxicité et l'arythmie de divers agents chimiques. Bien que la phototoxicité soit toujours un problème au niveau des cellules individuelles, la méthodologie est discutée sur la façon de la réduire.
Introduction
Afin d'étudier le cœur pendant les états sains et pathologiques, il est souvent utile d'examiner le phénotype au niveau de la cellule unique. Alors que les progrès scientifiques ont permis la mesure robuste de la dynamique du calcium à cellule unique, les mesures de tension optique à cellule unique sont restées rares1. Sans doute, c'est en raison du faible rapport signal/bruit (SNR), de la phototoxicité et du photoblanchiment des colorants potentiométriques traditionnels2,3. Néanmoins, des potentiels d'action optique de myocyte isolé ont été obtenus2,3,4. En outre, avec les progrès dans la chimie et la physique des colorants sensibles à la tension, le SNR s'est amélioré5. Les sondes potentielles de membrane plus neuves(tableau des matériaux)répondent aux changements du potentiel membranaire en sous-millisecondes et ont une plage de réponse fluorogénique d'environ 25 % par 100 mV. De plus, l'excitation/émission du kit potentiel de membrane (p. ex., FluoVolt; Tableau des matériaux) utilisé dans ce protocole fonctionne avec la fluorescéine standard isothiocyanate (FITC) ou vert fluorescent (GFP) paramètres6.
Les spectres d'excitation/émission FITC et GFP se chevauchent avec les spectres liés au calcium fluo-47. L'acquisition simultanée de la photométrie de fluorescence avec des mesures numériques de géométrie cellulaire a traditionnellement été utilisée pour l'acquisition simultanée de mesures de réduction du calcium etcellulaire8. Ce protocole décrit en détail comment isoler les myocytes murines et comment enregistrer les signaux de calcium ou de tension en utilisant les paramètres standard FITC. En outre, il décrit comment un simple commutateur dans les filtres d'excitation/émission sur le poste de travail d'imagerie peut être utilisé pour obtenir des mesures de calcium et de raccourcissement en utilisant le rapport métrique de colorant de calcium fura-2. Comparé au fluo-4, le fura-2 a une plus grande affinité pour le calcium et est relativement résistant au photoblanchiment9. Par conséquent, en utilisant un seul poste de travail, ce protocole permet un examen approfondi de l'accouplement d'excitation-contraction myocyte singly.
Protocole
Toutes les méthodes et procédures décrites dans ce protocole ont été approuvées par le Comité institutionnel de soins et d'utilisation des animaux (IACUC) de l'Université Case Western Reserve.
1. Préparation de solutions, d'instruments et de fiches de couverture
REMARQUE : Les solutions 1x peuvent être utilisées jusqu'à un mois.
- Faire 10x Krebs-Henseleit tampon HEPES tampon sans calcium (KHB-HB) en ajoutant 68,96 g de NaCl, 3,57 g de KCl, 59,58 g de HEPES, 2,18 g de K2HPO4, 3,08 g de MgSO4 et 19,82 g de glucose à 800 ml d'eau distillée double dans un flacon de 1 000 ml. Une fois le contenu complètement dissous, porter jusqu'au volume dans un flacon volumétrique de 1 000 ml.
REMARQUE : La solution traditionnelle Krebs Henseleit utilise le bicarbonate de sodium comme tampon et la solution dans ce protocole utilise la solution Krebs Henseleit avec tampon HEPES. La solution est stable pendant 6 mois si stérilefiltrée. - Faire la solution de 10x Tyrode en ajoutant 86,51 g de NaCl, 0,552 g de NaH2PO4, 2,03 g de MgCl2, 9,91 g de glucose, 4,03 g de KCl, 2,65 g de CaCl2, et 35,76 g de HEPES à 800 ml d'eau distillée double dans un flacon de 1000 ml. Une fois le contenu complètement dissous, porter jusqu'au volume dans un flacon volumétrique de 1000 ml.
REMARQUE : La solution est stable pendant 6 mois si stérilefiltrée. - Faire 1x KHB-HB en mesurant 100 ml du stock 10x et en ajoutant à 875 ml d'eau double distillée dans un flacon de 1 000 ml. Placer le flacon dans un bain d'eau de 37 oC. Une fois que la solution a atteint 37 oC, utilisez NaOH pour augmenter le pH à 7,39. Après ajustement du pH, apportez la solution au volume dans un flacon volumétrique de 1000 ml. Filtre stérile la solution à l'aide d'un système de filtration sous vide.
- Faire 1x Tyrode solution en mesurant 100 ml du stock 10x et en ajoutant à 875 ml d'eau double distillée dans un flacon de 1000 ml. Placer le flacon dans un bain d'eau de 37 oC. Une fois que la solution a atteint 37 oC, utilisez NaOH pour augmenter le pH à 7,39. Après ajustement du pH, apportez la solution au volume dans un flacon volumétrique de 1 000 ml. Filtre stérile à l'aide d'un système de filtration sous vide.
- Faire 1x modifié la solution de Tyrode en mesurant 100 ml du stock 10x et en ajoutant à 875 ml d'eau double distillée dans un flacon de 1 000 ml. Dissoudre 3,07 g de L-glutathion réduit en flacon. Placer le flacon dans un bain d'eau de 37 oC. Une fois que la solution a atteint 37 oC, utilisez NaOH pour augmenter le pH à 7,39. Après ajustement du pH, apportez la solution au volume dans un flacon volumétrique de 1 000 ml. Filtre stérile la solution à l'aide d'un système de filtration sous vide.
- Faire 100 mM de blebbistatin solution de stock en ajoutant 855 L de sulfoxide de diméthyle (DMSO) à 25 mg de poudre. Aliquot sorti par incréments de 20 L et conserver dans un congélateur de -80 oC jusqu'à six mois.
- Faire l'arrêt tampon en ajoutant 2 g d'albumine de sérum bovin (BSA) et 1 flacon de stock de blebbistatin aliquoted à 100 ml de 1x KHB-HB et filtre stérile la solution à l'aide d'un système de filtration sous vide.
- Faire tampon de placage en ajoutant 5 ml de sérum bovin fœtal et 1 flacon du stock de blebbistatin aliquoted à 95 ml de M199 HEPES. Filtre stérile la solution à l'aide d'un système de filtration sous vide.
- Faire tampon de culture de myocyte en ajoutant un 1 flacon du stock de blebbistatin aliquoted et 4 mls pénicilline-streptomycine à 396 ml de M199 (25 mM HEPES). Filtre stérile la solution à l'aide d'un système de filtration sous vide.
- Autoclave 2 paires de pinces Dumont, 2 paires de ciseaux incurvés Iris, 2 hemostats, une paire de forceps de chirurgie plastique, 6 sutures noires tressées en soie 4-0 disposées pour être utilisées comme noeud chirurgical à double jet, et quatre béchers de 100 ml.
- Stériliser les couvercles en verre de 22 x 22 mm2. Tout d'abord, placez un seul bordereau dans chaque puits d'une plaque de six puits. Ensuite, avec le couvercle enlevé, allumez la lampe UV de l'armoire de biosécurité et exposez les couvercles à la lumière UV pendant 1 h.
- Faire la solution de bouillon de lamininde de travail en dégelant d'abord la bouteille sur la glace. Ajoutez le contenu d'une bouteille à suffisamment de saline stérile à phosphate froide (PBS) pour atteindre une concentration finale de 0,04 mg/mL. Aliquot sorti 1,3 L dans des tubes de centrifugeuse de 1,5 mL autoclaved. Conserver à -80 oC.
REMARQUE: Chaque tube a assez de lamininin pour une seule plaque de six puits. Évitez les cycles de dégel multiples. - Enrober la couverture stérilisée en dégelant d'abord la solution de laminine de travail sur la glace. À l'aide d'une pipette P1000, aspirez 200 l de laminin. Faites glisser doucement la pointe de la pipette le long d'un bord de la glissière de couverture pour permettre à l'action capillaire de retirer une minuscule quantité de lamininin pour faciliter l'attachement de la feuille de couverture à la plaque de six puits.
- Ensuite, expulsez le laminin restant au centre de la couverture. Dans un mouvement circulaire, étaler la gouttelette de laminin sur la feuille de couverture. Placer dans un incubateur de 37 oC au moins 1 h et jusqu'à 24 h avant l'isolement.
2. Préparation de l'Apparatus Langendorff
REMARQUE : Les composants individuels de l'appareil Langendorff utilisés dans ce protocole sont énumérés dans le Tableau des matériaux.
- Allumez le bain d'eau en circulation. Définir la température de sorte que le perfusate ait une température de 37 oC.
REMARQUE : Une fois les réservoirs de solution réglés à une hauteur de 60 cm, la nappe phréacine en circulation doit être fixée à 41 oC pour que le perfusat e soit de 37 oC. Contrairement aux protocoles précédemment signalés, la hauteur du réservoir n'a pas besoin d'être modifiée. - Rincer l'appareil Langendorff avec 70% d'éthanol suivi de deux rinçants avec de l'eau double distillée autoclave. Après le rinçant, remplissez le réservoir de KHB-HB et oxygénez avec 100% d'oxygène.
- Primer le système en permettant à KHB-HB oxygéné de s'écouler d'abord dans un bécher de 100 ml. Une fois que 50 ml de solution s'est déversé dans le bécher, changez la position à trois voies du stop-cock pour arrêter le débit du réservoir KHB-HB. Verser 50 ml de KHB-HB oxygéné du bécher dans le réservoir de collagène.
- Laissez le KHB-HB s'écouler du réservoir de digestion jusqu'à ce que 5 mL reste dans le réservoir de collagène. Pendant l'amorçage du réservoir de collagène, changez le coq d'arrêt à 3 voies à plusieurs reprises entre les réservoirs pour permettre aux lignes de se dégazer. Une fois le système amorcé, n'oubliez pas d'utiliser le piège de dégazage situé au-dessus de la bobine chauffante pour permettre à tout air restant de sortir du système.
- Faire la solution de collagène. Pour les rats combinent 100 mg de collagène de type II, 100 ml de KHB-HB oxygéné et 2 flacons du stock de blebbistain. Pour les souris, mélanger 100 mg de collagène de type II, 40 ml de KHB-HB oxygéné et 2 flacons du stock de blebbistain. Une fois mélangée, la solution doit être stable pendant 1 h.
REMARQUE : La viabilité du myocyte peut varier entre les lots de collagène de type II. Profitez d'un programme d'échantillonnage de collagène pour tester beaucoup avant de commander en vrac.
3. Isolement de Myocyte
- Injecter à l'animal 1 000 U d'héparine. Attendez 5 min.
REMARQUE : Les souris et les rats de tout âge peuvent être utilisés. Cependant, en général, plus l'animal est âgé ou plus malade, plus le myocyte est faible. - Sacrifiez l'animal en l'anesthésiant d'abord avec de l'isoflurane à l'aide de la méthode à goutte ouverte (1 cc d'Isoflurane pour un volume de 500 cm3) avant d'euthanasier l'animal avec un mélange de pentobarbital (150 mg/kg intrapéritone).
- Excisez rapidement le cœur en saisissant d'abord la fourrure au-dessus du processus xiphoïde. Avec les ciseaux d'iris, faire une petite incision immédiatement au-dessous du processus de xiphoïde et tirer la fourrure vers le haut vers la tête exposant la peau.
- Prenez le processus de xiphoïde et coupez le diaphragme exposant la cavité thoracique. Faire une incision de porte de piège, tirer le sternum en arrière à l'aide d'un hemostat, et utiliser les forceps incurvés pour exciser le cœur au-dessus de l'aorte ascendante et placer dans le froid KHB-HB.
- Cannulelement du cœur à l'aide d'un microscope stéréo et de forceps numéro 5. Assurez-vous que le cœur est submergé et la canule a été amorcée avant l'excision cardiaque pour prévenir les embolies. Confirmer le bon positionnement de la canule en visualisant la pointe de la canule à environ 1 mm au-dessus de l'insertion aortique dans le ventricule.
REMARQUE : Plus le temps de cannulation est rapide, meilleur est le rendement du myocyte. - Démarrer le flux de KHB-HB en tournant le stopcock sur le Langendorff. Connectez la canule au Langendorff. Persévisser le cœur pendant 5 min.
REMARQUE : Puisque la perfusion est fournie par un système basé sur la gravité, le flux par le coeur sera une fonction de la conformité d'artère coronaire. - Passez la perfusion du réservoir KHB-HB au réservoir tampon de digestion. Une fois que le tampon de digestion atteint le cœur, définir une minuterie (5 min pour la souris ou 15 min pour le rat). Assurez-vous de recueillir le perfusate dans un bécher stérile de 100 ml. Remplissez le réservoir tampon de digestion au besoin avec le perfusate jusqu'à ce que le temps de digestion ait expiré.
- Après la digestion, séparer les chambres du cœur avec des forceps et les ciseaux d'iris dans un bécher stérile de 100 ml. Placer chaque chambre dans un puits séparé d'une plaque de six puits. Verser 5 ml de solution de collagène dans chaque puits.
- Immédiatement commencer à hacher le tissu cardiaque à l'aide de ciseaux. Les morceaux de tissu doivent être d'environ 1 mm3. À l'aide de pipettes de transfert stériles, trituratez délicatement le tissu cardiaque haché. La solution devrait devenir trouble.
- Une fois que les morceaux de tissu deviennent blancs et plumeux, examinez les cellules à l'aide d'un microscope inversé. Si le nombre de cellules viables est supérieur à 80 %, procédez à la tension entre les cellules dans un tube conique de 50 ml à l'aide d'une passoire cellulaire de 100 m. Utilisez un tube et une passoire différents pour chaque chambre du cœur.
- Si le nombre de cellules viables est inférieur à 80%, vérifiez le temps qu'il a fallu pour cannuler. Si le temps de cannulation est plus de 5 min, essayez un autre coeur. Si ce n'est pas le cas, aspirez à de nouveaux lots de collagène dans le cadre du programme d'échantillonnage de collagène.
- Pelleter les cellules en centrifugeant à 215 x g pendant 2 min. Le granule doit être compact et ne pas lâcher. Si le granule est lâche, la préparation contient de nombreuses cellules mortes. Dans une hotte de culture tissulaire, resuspendre la pastille en 10 ml de tampon d'arrêt.
- Pelleter les cellules en centrifugeant à 215 x g pendant 2 min. Le granule doit être compact et ne pas lâcher. Si le granule est lâche, la préparation contient de nombreuses cellules mortes.
- Resuspendre les cellules dans 5 ml de tampon de placage. Effectuez un comptage cellulaire. Ajuster les millilitres de tampon de placage pour atteindre une concentration finale de myocytes de 2 x 104 cellules par mL.
- Retirer les couvercles recouverts de laminin de l'incubateur. Aspirez la gouttelette de laminin.
- Plaque de 200 l de suspension de myocyte sur chaque bordereau. Placer dans un incubateur de 37 oC (21 % O2, 5 % CO2) pendant 2 h pour permettre l'attachement. Après 2 h, aspirer les cellules non attachées, ajouter 2 mL de médias de culture, et la culture pour un jusqu'à 4 jours.
4. Chargement de teinture Fura-2
- Faire une solution de stock de 2 mM de fura-2 en acéoxyméthyle (fura-2 AM) en ajoutant 25 L de DMSO à 50 g de poudre de fura-2 AM (1 flacon). Aliquot en 6 aliquots L. Prendre 1 aliquot de fura-2 AM et ajouter à 6 ml de milieu de placage. Vortex à mélanger.
- Retirer 1 six plaques de myocytes de puits de l'incubateur. Aspirez les médias. Ajouter 1 ml de mélange de mélange de temps fura-2 à chaque puits. Couvrir la plaque de papier d'aluminium, laisser la plaque à température ambiante et attendre 15 min.
- Aspirez le mélange de médias fura-2 et ajoutez 1 ml de la solution de Tyrode à chaque puits. Couvrir de papier d'aluminium. Attendre 20 min à température ambiante pour permettre le lavage des teintures avant l'imagerie.
5. Chargement de teinture Fluo-4
- Faire une solution de stock de 1,82 mM de fluo-4 acétoxithyle (fluo-4 AM) en ajoutant 25 L de DMSO à 50 g de poudre de fluo-4 AM (1 flacon). Aliquot en 8.333 aliquots L. Prendre 1 aliquot de bouillon fluo-4 AM et ajouter à 6 ml de milieu de placage. Vortex à mélanger.
- Retirer 1 six plaques de myocytes de puits de l'incubateur. Aspirez les médias. Ajouter 1 ml de mélange de fluo-4 AM à chaque puits. Couvrir la plaque de papier d'aluminium, laisser la plaque à température ambiante et attendre 15 min.
- Aspirez le mélange de médias fluo-4 AM et ajoutez 1 ml de la solution de Tyrode à chaque puits. Couvrir de papier d'aluminium. Attendre 20 min à température ambiante pour permettre le lavage des teintures avant l'imagerie.
6. Chargement potentiel de teinture de membrane
- Retirez le composant A et le composant B du kit potentiel de membrane. Dans un tube conique de 15 ml, mélanger 50 l de composant B et 5 l de composant A. Vortex pour mélanger. Ajouter 10 ml de support de placage au tube conique de 15 ml contenant le mélange de colorant de tension. Vortex à mélanger.
- Retirer 1 six plaques de myocytes de puits de l'incubateur. Aspirez les médias. Ajouter 800 l l du mélange de colorant potentiel de membrane à chaque puits. Couvrir la plaque de papier d'aluminium, laisser la plaque à température ambiante et attendre 15 min.
- Aspirez le mélange de médias de colorant et ajoutez 1 ml de la solution modifiée-Tyrode à chaque puits. Couvrir de papier d'aluminium.
7. Photométrie et charge d'enregistrements couplés d'appareils
- Allumez l'équipement dans l'ordre suivant : microscope, lampe d'arc, hyperswitch, système d'interface de fluorescence, alimentation myocam, stimulateur de champ, et ordinateur.
- Assurez-vous que les ensembles de filtres d'excitation/émission sont appropriés pour le colorant d'imagerie.
REMARQUE: Fura-2 est excité à 340 nm et 380 nm de lumière. Il émet à 510 nm de lumière. Fluo-4 et le colorant de membrane de tension sont excités à 485 nm de lumière et émettent à 520 nm de lumière. - Primer le système en allumant le vide, en ouvrant complètement la pince du tuyau et en plongeant doucement chaque seringue de 60 ml utilisée dans le collecteur. Pour les enregistrements de calcium, utilisez la solution de Tyrode. Pour les enregistrements de tension, utilisez la solution modifiée de Tyrode.
- Allumez le chauffe-eau et réglez le débit en ajustant la pince à rouleaux sur le tube de perfusion. Faites des enregistrements à 36 '1 'C.
- Ouvrez le logiciel d'acquisition. Assurez-vous que les paramètres sont réglés pour le colorant d'imagerie correct.
- Dans l'obscurité, retirer le papier d'aluminium de la plaque de six puits et placer un bordereau dans la chambre de stimulation. Assurez-vous que le stimulateur est éteint pendant cette étape. Concentrez-vous sur les myocytes en utilisant l'objectif 10x.
- Une fois au point, commencez à arpenter en stimulant le champ à 1 Hz, 0.2 V. Augmentez graduellement la tension jusqu'à ce que 1:1 rythme est obtenu. Ensuite, augmentez la tension jusqu'à 1,5x le seuil est atteint.
REMARQUE : Étant donné que le couplage excitation-contraction dépend de la température, assurez-vous que les cellules ont été perflées pendant 15 minutes avant l'enregistrement. Cela permet aux myocytes de se remettre du choc de la température ambiante à 37 oC ainsi que des cellules lâchement attachées pour flotter. - Passer de l'objectif 10x à l'objectif 40x. Concentrez-vous sur une cellule qui suit un rythme 1:1. Ajustez les nuances en plastique de sorte qu'une seule cellule est dans le champ de vision.
- À l'aide du logiciel, placez la zone d'intérêt sur des sarcoques bien définis. Démarrer le logiciel d'acquisition pour initier la lumière d'excitation. À l'aide des filtres à densité neutre, ajustez le réglage de l'intensité en conséquence pour obtenir un SNR adéquat.
Résultats
La figure 1A montre l'appareil Langendorff. L'oxygénateur se trouve dans le réservoir KHB-HB. La solution de collagène se trouve au milieu du réservoir de seringues de 60 ml. La ligne de dégazage est reliée au réservoir vide de seringues de 60 ml. Après un isolement réussi, la plupart des cellules doivent être en forme de tige et striées. Dans le cadre d'un objectif 40x, la plupart des myocytes devraient avoir des stries claires visibles. Figure 1B,C montre des exemples de myocytes de rat sains. Une fois isolées, les cellules peuvent être cultivées jusqu'à 4 jours tout en conservant leur morphologie et leurs propriétés électriques.
Pour mesurer le couplage excitation-contraction, les cellules sont ensuite placées dans une chambre de stimulation chauffée. Étant donné que les myocytes sont sensibles aux changements de température, il est important de permettre au bordereau d'équilibre pendant 15 minutes dans la chambre avant l'enregistrement. Pour les enregistrements de fluorescence, la longueur d'onde d'excitation est générée par une ampoule de 75 W au xénon-arc. Les ampoules à arc de xénon produisent un spectre lumineux qui imite la lumière naturelle du soleil. L'intensité de la lumière et la longueur d'onde sont contrôlées par des déclarants de densité/émission neutres. La lumière d'excitation passe alors à travers l'objectif au myocyte. La longueur d'onde des émissions est ensuite recueillie par un tube photomultiplicateur. En utilisant le système décrit ici, les filtres d'excitation et d'émission doivent être changés manuellement.
Le raccourcissement est obtenu par un capteur d'appareil couplé de charge. Mesurant en temps réel jusqu'à 1 000 fois par seconde, le logiciel d'acquisition effectue une moyenne des lignes dans une zone d'intérêt pour créer un modèle de striation bien résolu. Une transformation rapide de Fourier (FFT) est alors calculée. Le pic dans le spectre de puissance représente l'espacement moyen de sarcomere. Les changements dans l'espacement sarcoque pendant le rythme sont ensuite tracés et quantifiés par la suite.
La figure 2 montre le calcium et les traces de raccourcissement enregistrées à partir d'un myocyte de souris C57/B6 chargé du colorant de calcium fura-2. Le protocole de rythme est une modification des protocoles de rythme décritprécédemments'il 10,11. Les myocytes sains de souris devraient pouvoir être rythmés à leur fréquence cardiaque au repos 10 Hz. Figure 3 est quantification des données moyennes ensembleobtenues obtenues à partir d'une souris C57/B6 et de leurs compagnons transgéniques (TG) qui ont eu une mutation de point introduite dans un canal de potassium. Notez qu'il n'y a pas de différence entre les groupes, sauf pour le temps de relaxation à 10 Hz rythme.
Contrairement au fura-2 qui est un colorant à double excitation, le colorant de tension et le fluo-4 sont des colorants d'excitation à longueur d'onde unique dont l'excitation/émission fonctionne avec le spectre standard d'excitation et d'émission FITC (494/506 nm). Par conséquent, des enregistrements de réduction de calcium et de sarcome respirateur ou de tension et de raccourcissement de sarcomere peuvent être obtenus à l'aide de cet ensemble de filtres.
La figure 4A montre un traçage de tension enregistré à partir d'un myocyte de souris C57/B6 rythmé à 10 Hz. Comparé aux signaux de calcium, les traçages de tension à cellule unique sont plus petits en amplitude et ont besoin de post-traitement pour obtenir un signal utilisable. La figure 4B montre un potentiel d'action moyen (AP) réalisé à partir des AP à la figure 4A. Figure 4C,D montre un AP moyen ensemble après un faible passage Butterworth ou un filtre numérique Savitzky-Golay a été appliqué. Il faut faire attention au filtrage du signal pour ne pas fausser les données réelles. Remarquez les différences subtiles dans la forme des AP dans la figure 4B-D.
La figure 5 montre des traces enregistrées à partir de myocytes de rats rythmés à 1 Hz. En plus du signal de tension étant plus bas que le signal de calcium, la cinétique de contraction sont différentes aussi bien. C'est parce que les colorants de calcium tampon calcium tandis que les colorants de tension ne sont pas.
Comme pour le transitoire de calcium (figure 3), les myocytes ont démontré des changements dépendants de rythme dans leur durée potentielle d'action optique (APD) aussi bien (figure 6). Alors que les traces de fura-2 ont été ensembleées en moyenne avant d'être quantifiées, les traces de tension ont été filtrées à l'avec un filtre de lissage polynomial Savitzky-Golay (largeur 5, ordre 2) avant d'être ensembles en moyenne et quantifiées.
Comme quantifié dans la figure 6 et la figure 7, en plus de démontrer des changements induits par le rythme dans la DPA, ils ont également démontré la prolongation induite par la drogue de l'AP. À 4 Hz arpentage, le blocus dépendant de concentration du courant extérieur transitoire (Ià) avec 4-aminopyridine a eu comme conséquence la prolongation de l'APD.
Enfin, il faut prendre soin d'éviter la cytotoxicité. La figure 8 est le dernier 11 s d'un enregistrement de 20 s. Indiqué par les flèches rouges dans la figure 8, l'exposition prolongée des myocytes à la lumière bleue conduit à l'activité déclenchée.

Figure 1 : Appareil Langendorff à pression constante. (A) L'Apparatus Langendorff avec chaque composant étiqueté en lettrage blanc. (B) Myocytes isolés de rat de Sprague-Dawley vus par un objectif 10x. (C) Myocytes de rat isolés vus à travers un objectif 40x. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
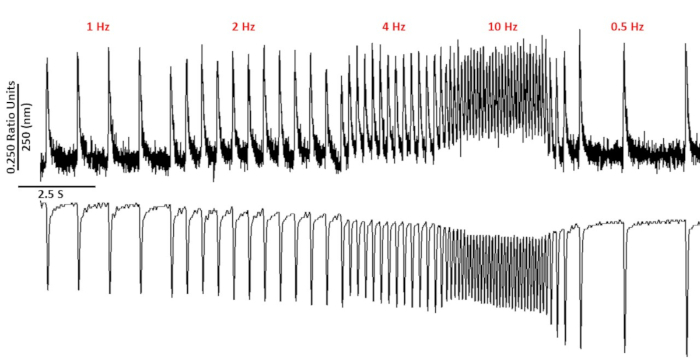
Figure 2 : Traces de réduction du calcium et des sarcognes représentatives enregistrées à partir des myoyctes C57/B6 à l'aide du fura-2. Traces de réduction du calcium et du sarcome enregistrées à 1, 2, 4, 10, 0,5 et 0,75 Hz. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
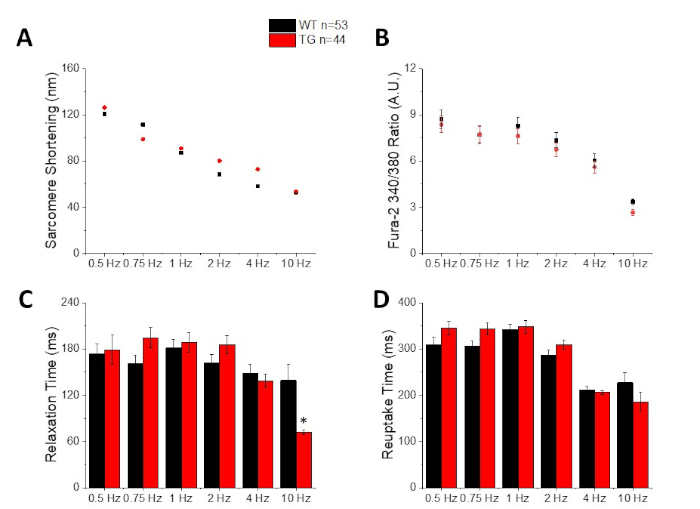
Figure 3 : Quantification du raccourcissement des sarcoques, du pic de calcium, du temps de relaxation et du temps de reuptake enregistrés à partir d'une souris de type sauvage C57/B6 (WT) et transgénique (TG). (A) Raccourcir Sarcome. (B) Pic de calcium. (C) Temps de relaxation défini comme 90% retour à la ligne de base de la trace de raccourcissement. (D) Temps de reuptake défini comme 90% retour à la ligne de base de la trace de calcium. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
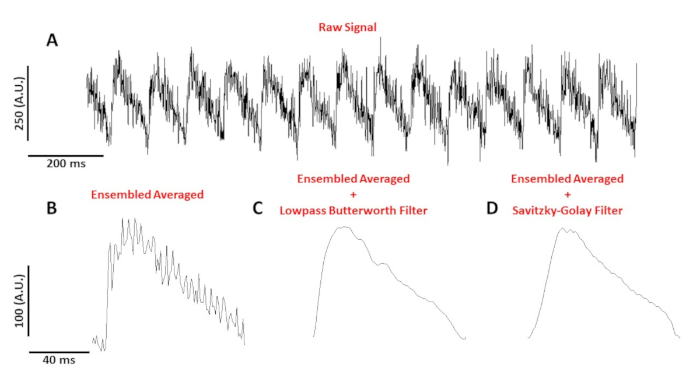
Figure 4 : Potentiel d'action optique enregistré à partir d'un myocyte de souris C57/B6 rythmé à 10 Hz. (A) 1 seconde trace non filtrée. (B) Ensembled averaged optical action potential. (C) Ensembled averaged optical action potential after a lowpass Butterworth filter was applied. (D) Potentiel d'action optique moyen d'ensemble après l'application d'un filtre de lissage polynomial Savitzky-Golay. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
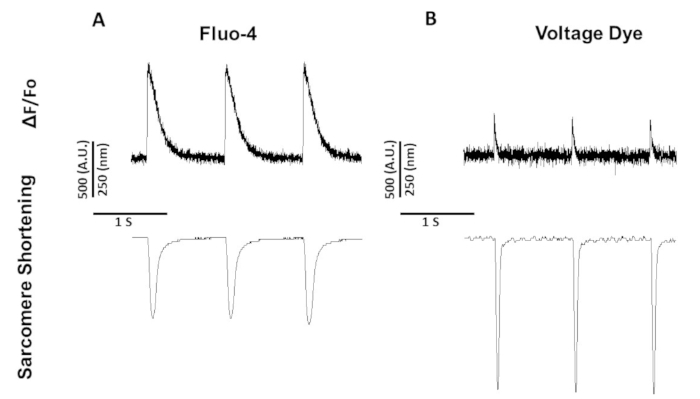
Figure 5 : Traces de réduction du calcium, de la tension et du sarcome rectifiant esquissantes de Sprague-Dawley enregistrées à partir des myocytes de rat de Sprague-Dawley rythmés à 1 Hz. (A) Traces de réduction du calcium et du sarcome rectifiant enregistrées à 1 Hz à l'aide du fluo-4. (B) Les traces de raccourcissement de tension et de sarcome ont été enregistrées à 1 Hz à l'aide du colorant de tension. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
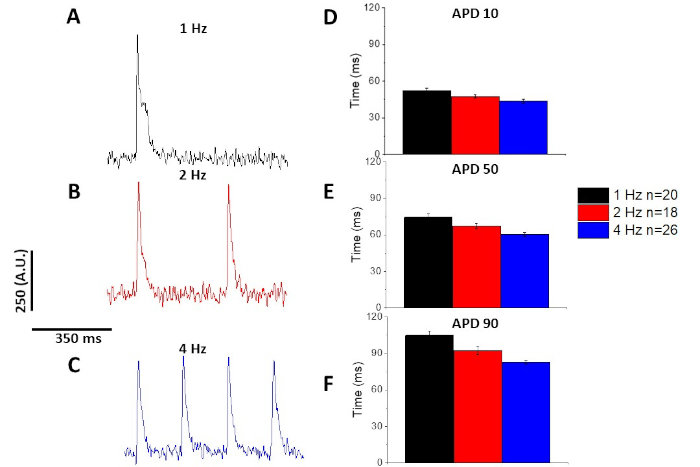
Figure 6 : Potentiels d'action optique enregistrés à partir des myocytes rat sprague-Dawley rythmés à 1, 2 et 4 Hz. (A) Trace filtrée enregistrée à 1 Hz. (B) Trace filtrée enregistrée à 2 Hz. (C) Trace filtrée enregistrée à 4 Hz. (D) Durée potentielle d'action 10, mesurée comme 10 % de retour à la ligne de base. (E) Durée potentielle d'action 50, mesurée à 50 % de retour à la ligne de base. (F) Durée potentielle d'action 90, mesurée à 90 % de retour à la ligne de base. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
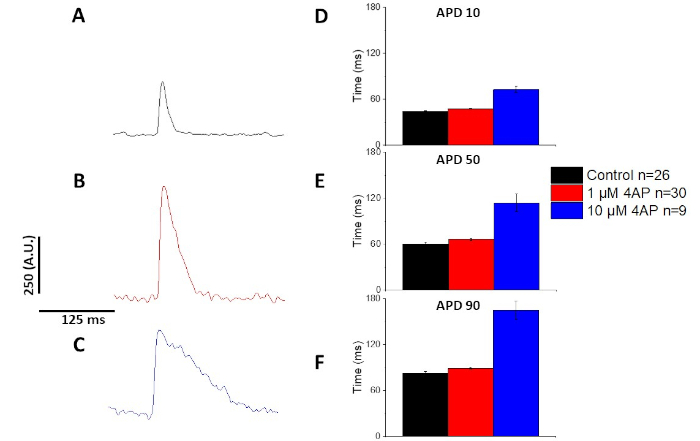
Figure 7 : Effets de la 4-aminopyridine sur les potentiels d'action optique des rats Sprague-Dawley enregistrés à 4 Hz. (A) Trace moyenne d'ensemble enregistrée à 4 Hz arpentage sans 4-Aminopyridine dans la solution. (B) Trace moyenne d'ensemble enregistrée à 4 Hz arpentage avec 1 M 4-Aminopyridine dans la solution. (C) Trace moyenne d'ensemble enregistrée à 4 Hz arpentage avec 10 M 4-Aminopyridine dans la solution. (D) Durée potentielle d'action 10, mesurée comme 10 % de retour à la ligne de base. (E) Durée potentielle d'action 50, mesurée à 50 % de retour à la ligne de base. (F) Durée potentielle d'action 90, mesurée à 90 % de retour à la ligne de base. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
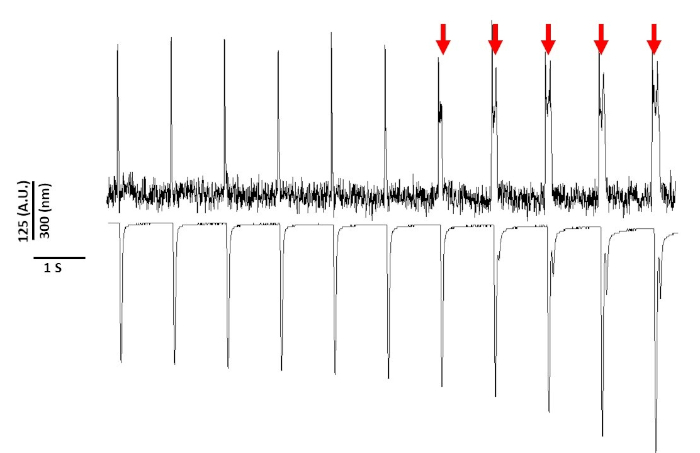
Figure 8 : La phototoxicité induite par le colorant de tension dans les myocytes de rat de Sprague-Dawley après 20 s d'exposition continue de lumière. Les flèches rouges indiquent des événements cytotoxiques. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Pouvoir isoler les myocytes cardiaques est une méthode puissante qui peut être employée pour comprendre la physiologie cardiaque, la pathologie, et la toxicologie. Dans le protocole ci-dessus, nous avons décrit une méthode qui utilise un appareil langendorff à pression de gravité constante pour obtenir des myocytes cardiaques uniques. Ensuite, à l'aide du système de photométrie par fluorescence, nous décrivons comment acquérir simultanément du calcium et un raccourcissement ou une tension et des traces de raccourcissement.
En raison des différentes cinétiques entre les colorants de calcium, il faut prendre soin de la teinture à sélectionner. Pour ce protocole, le fura-2 et le fluo-4 utilisés ont été conçus avec des esters AM nécessitant une étape de lavage pour permettre aux esterases intracellulaires le temps de couper le groupe AM et de piéger le colorant dans la cellule. Tandis que le fura-2 et le fluo-4 sont considérés des colorants de calcium d'affinité élevée, le Kd pour le fura-2 est 145 nM comparé à le 345 nM pour le fluo-49. En outre, fura-2 est ratiometric. Pour cette raison, il peut être utilisé pour quantifier les niveaux de calcium intracellulaire9,12. Fluo-4 d'autre part est une sonde de calcium à ondes uniques. L'avantage de l'utilisation du fluo-4 est qu'il produit un signal de fluorescence plus lumineux. Indépendamment du colorant de calcium utilisé, par rapport au colorant de calcium, les sondes de tension de membrane ont un SNR inférieur.
Comme le montre la figure 4 et la figure 5,les traces de tension par rapport aux traces de calcium sont plus petites en amplitude. À l'aide du filtrage numérique des traces du logiciel, il est possible d'augmenter le RNS et de quantifier les données(figure 4 et figure 7). Une fois quantifiés, les transitoires de calcium et les APD optiques démontrent la restitution, raccourcissant leur durée à des fréquences de stimulation plus rapides(Figure 2, Figure 3, Figure 6, et Figure 7). Des APD plus courts pendant des cycles de rythme plus rapides sont nécessaires pour prévoir suffisamment de temps pour le remplissage ventriculaire pendant le diastole. Les modifications de ce phénomène sont considérées comme révélatrices d'une augmentation du risque d'arrythmias13,14,15,16. Bien que les altérations de la DPA puissent être causées par la maladie, elles peuvent aussi être causées par des produits chimiques. Comme le montre la figure 7, lorsque le courant de potassium prédominant de repolarisation de la murine, ià, est bloqué, l'APD optique devient plus longue.
Pourtant, comme indiqué précédemment avec les colorants sensibles à la tension, l'intensité lumineuse et la durée peuvent modifier l'APD2,5,17. On pense que c'est le résultat de la génération d'espèces oxydantes réactives (ROS)5. Précédemment, il a été démontré que l'ajout d'antioxydants à la solution d'enregistrement peut empêcher la cytotoxicité sensible de colorant de tension5. En conséquence, nous avons ajouté l'antioxydant L-glutathion (10 mM), à la solution de Tyrode. La figure 8 est représentée par les 11 dernières s d'un enregistrement de 20 s obtenu à 1 Hz. Comme l'indiquent les flèches rouges, les modifications de la DPA ne se sont produites qu'à 15 s dans l'enregistrement; par conséquent, bien que la solution modifiée de Tyrode n'ait pas empêché la phototoxicité, elle l'a retardée de manière significative. En utilisant la solution modifiée de Tyrode, en utilisant un réglage de faible intensité lumineuse et en maintenant la durée de l'enregistrement à moins de 5 s, il est possible d'éviter toute altération induite par le colorant dans l'APD. Ceci est important parce que sans prendre soin d'éviter la phototoxicité, les données pourraient être mal interprétées comme causant tôt ou retardé après des dépolarisations. En plus de limiter l'exposition à la lumière bleue, il existe des précautions supplémentaires qui peuvent être prises pour prévenir une mauvaise interprétation des données.
La première consiste à enregistrer uniquement à partir de cellules qui suivent un à un rythme et ont une longueur de sarcome au repos supérieure ou égale à 1,75 m. La coupure de 1,75 m est tirée de l'observation de Gordon et coll.18 selon laquelle la tension diminue rapidement une fois que la longueur du sarcome est inférieure à cette quantité. Néanmoins, certaines pathologies peuvent entraîner des altérations significatives de la longueur des sarques au repos. Pour être sûr que le phénotype est réel et non un artefact de l'isolement, les approches suivantes de tir de difficulté doivent être prises.
Si les myocytes ne suivent pas toujours le rythme 1:1, ont des longueurs de sarcomere au-dessous de 1,75 m, le blebbing lourd de membrane, ou ne survivent pas à l'isolement, la première chose à vérifier est le temps qu'il a fallu pour cannuler le coeur. Plus le temps de cannulation est long, plus le rendement sera faible. Si un long temps de cannulation est nécessaire, la viabilité peut être améliorée en plaçant le cœur dans une solution cardioplégique19. Néanmoins, parce que la collagène est une enzyme, l'activité et la spécificité d'un lot spécifique changent au fil du temps. Si les rendements globaux s'aggravent progressivement malgré de bonnes périodes de cannulation, de nouveaux lots devraient être mis en point. Alors que notre protocole a été optimisé pour les enregistrements de 5 s, si des traces de tension plus longues sont nécessaires, des filtres de densité neutre supplémentaires devront être achetés. Le système décrit dans le protocole est livré avec des filtres à densité neutre qui réduisent la lumière transmise de 37%, 50%, 75%, 90% et 95%.
En résumé, nous avons décrit une méthodologie qui a permis l'isolement des myocytes ventriculaires murines adultes qui ont été employés pour des mesures de raccourcissement de calcium, de tension, et de sarcomere.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Nous remercions Dana Morgenstern pour la relecture minutieuse du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| 0.25 Liter Water Jacketed Reservoir | Radnoti, LLC | 120142-025 | |
| 1 liter volumetric flask | Fisher Scientific | 10-205F | |
| 100 ml beaker | Fisher Scientific | FB-100-100 | |
| 100 ml graduated cylinder | Fisher Scientific | 08 562 5C | |
| 1000 ml flask | Fisher Scientific | FB-500-1000 | |
| 2-Bar Lab Stand with Stabilizer Bar and 24" Stainless Steel Rods | Radnoti, LLC | 159951-2 | |
| 4-Aminopyridine | Sigma-Aldrich | 275875 | |
| 40X Oly UApo/340 Non-Immersion Objective (NA 0.9, WD 0.2mm) | IonOptix | MSCP1-40 (b) | |
| 60-mL syringe, BD Luer-Lok tip | BD | 309650 | |
| Aortic Metal Cannulae | Harvard Apparatus | 73-0112 | |
| Bovine Serum Albumin | Fisher Scientific | BP9703-100 | |
| C-6 Standard Heating Circulator | Chemyx | A30006 | |
| CaCl2 | Fisher Scientific | BP510500 | |
| Cell framing adapter | IonOptix | CFA300 | |
| CellPr0 Vacuum Filtration System, 1 liter, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V100022 | |
| CellPro Vacuum Filtration System, 250mL, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V25022 | |
| CellPro Vacuum Filtration System, 500mL, 0.22µm,12/CS | Labratory Product Sales, Inc | V50022 | |
| CMC (mTCII) Temp Control w/ inline flow heater | IonOptix | TEMPC2 | |
| Cole-Parmer Large-bore 3-way, male-lock, stopcocks | Cole-Parmer | EW-30600-23 | |
| Cole-Parmer Luer fittings, Large-bore stopcocks, male lock, 4-way | Cole-Parmer | EW-30600-12 | |
| Cole-Parmer Stopcocks with Luer Connections; 1-way; male slip | Cole-Parmer | EW-30600-01 | |
| Collagenase Type II | Worthington | LS004177 | |
| Corning Sterile Cell Strainers | Fisher Scientific | 07-201-432 | |
| Dell Optiplex 790 mini-tower, 4G RAM, 250G HD, Windows 7 Pro | IonOptix | CPUD7M | |
| DMSO | Fisher Scientific | 50980367 | |
| Dumont Tweezers Style 5 | Amazon | B00F70ZDEQ | |
| FHD Rapid Change Stimulation Chamber | IonOptix | FHDRCC1 | |
| Fluo-3/4 Optics Package | IonOptix | IonOP-Fluo | |
| Fluorescence system interface – (w PCI-I/O card) | IonOptix | FSI700 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher Scientific | 15-140-122 | |
| Glucose | Fisher Scientific | D16-1 | |
| Hemostat, Curved 5-1/2" | Amazon | B00GGAAPD0 | |
| HEPES | Fisher Scientific | BP310500 | |
| HyperSwitch dual excitation light source | IonOptix | HSW400 | |
| Inverted Motic Fluorescence Microscope | IonOptix | MSCP1-40 (a) | |
| IonWizard Core + Analysis | IonOptix | IONWIZ | |
| Iris Scissors, curved | Amazon | B018KRRMY6 | |
| K2HPO4 | Fisher Scientific | P288-100 | |
| KCl | Fisher Scientific | BP3661 | |
| L-Glutathione reduced | Sigma-Aldrich | G4251 | |
| LOOK Silk Spool, Black Braided, 4-0, 100yds | SouthernAnesthesiaSurgical Inc. | SP116-EA | |
| M199 Media | Fisher Scientific | 12 340 030 | |
| MgCl2 | Fisher Scientific | MP021914215 | |
| MgSO4 | Fisher Scientific | BP2131 | |
| MyoCam-S Digital CCD video system | IonOptix | MCS100 | |
| MyoPacer Field Stimulator | IonOptix | MYP100 | |
| NaCl | Fisher Scientific | BP358212 | |
| NaH2PO4 | Fisher Scientific | 56-754-9250GM | |
| Oxygenator Bubbler with Fluid Inlet for 0.25 Liter | Radnoti, LLC | 140143-025 | |
| Photomultiplier sub-system | IonOptix | PMT400 | |
| PMT Acquisition add-on | IonOptix | PMTACQ | |
| Radnoti Heating Coil 5 mL with Degasing Trap | Radnoti, LLC | 158830 | |
| Ring Clamp 60 – 80mm Dia. for 250ml Reservoir | Radnoti, LLC | 120141-025 | |
| Ring Clamp for Bubble Trap Compliance Chamber | Radnoti, LLC | 120149RC | |
| Saint-Gobain ACF000010 5/32 in.9/32 in. | Fisher Scientific | 14-171-214 | |
| Saint-Gobain ACF000013 3/16 in.3/8 in. | Fisher Scientific | 14-171-217 | |
| Saint-Gobain ACF000016 1/4 in.5/16 in. | Fisher Scientific | 14-171-219 | |
| Saint-Gobain ACF000025 5/16 in.5/8 in. | Fisher Scientific | 14-171-226 | |
| Saint-Gobain ACF00003 1/16 in.3/16 in. | Fisher Scientific | 14-171-209 | |
| Saint-Gobain ACF00005 1/16 in.3/32 in. | Fisher Scientific | 14-171-210 | |
| Saint-Gobain ACF00009 5/32 in.7/32 in. | Fisher Scientific | 14-171-213 | |
| Sarcomere Length Recording add-on | IonOptix | SARACQ | |
| T/C Adson Tissue Platic Surgery Forceps 4.75" | Amazon | B00JDWRBGC | |
| VETUS Anti-Static Curved Tip Tweezers | Amazon | B07QMZC94J | |
| Vistek 3200 Motic Vibration Isolation Platform | IonOptix | ISO100 |
Références
- Hagen, B. M., Boyman, L., Kao, J. P., Lederer, W. J. A comparative assessment of fluo Ca2+ indicators in rat ventricular myocytes. Cell Calcium. 52 (2), 170-181 (2012).
- Schaffer, P., Ahammer, H., Muller, W., Koidl, B., Windisch, H. Di-4-ANEPPS causes photodynamic damage to isolated cardiomyocytes. Pflügers Archiv: European Journal of Physiology. 426 (6), 548-551 (1994).
- Hardy, M. E., Lawrence, C. L., Standen, N. B., Rodrigo, G. C. Can optical recordings of membrane potential be used to screen for drug-induced action potential prolongation in single cardiac myocytes. Journal of Pharmacological and Toxicological Methods. 54 (2), 173-182 (2006).
- Tian, Q., et al. Optical action potential screening on adult ventricular myocytes as an alternative QT-screen. Cellular Physiology and Biochemistry. 27 (3-4), 281-290 (2011).
- Warren, M., et al. High-precision recording of the action potential in isolated cardiomyocytes using the near-infrared fluorescent dye di-4-ANBDQBS. The American Journal of Physiology-Heart and Circulatory Physiology. 299 (4), 1271-1281 (2010).
- FluoVolt™ Membrane Potential Kit. ThermoFisher Scientific. , Available from: https://assets.thermofisher.com/TFS-Assets/LSG/manuals/MAN0009668_FluoVolt_Membrane_Potential_Kit_UG.pdf (2018).
- Fluorescence SpectraViewer. ThermoFisher Scientific. , Available from: https://www.thermofisher.com/us/en/home/life-science/cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html (2019).
- Calcium and Contractility in Isolated Myocytes. IonOptix. , Available from: http://www.ionoptix.com/product/myocyte-calcium-and-contractility-recording-system/ (2019).
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Davis, J., et al. Diastolic dysfunction and thin filament dysregulation resulting from excitation-contraction uncoupling in a mouse model of restrictive cardiomyopathy. The Journal of Molecular and Cellular Cardiology. 53 (3), 446-457 (2012).
- Ren, J., Davidoff, A. J. Diabetes rapidly induces contractile dysfunctions in isolated ventricular myocytes. The American Journal of Physiology. 272, 1 Pt 2 148-158 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Goldhaber, J. I., et al. Action potential duration restitution and alternans in rabbit ventricular myocytes: the key role of intracellular calcium cycling. Circulation Research. 96 (4), 459-466 (2005).
- Weiss, J. N., et al. The dynamics of cardiac fibrillation. Circulation. 112 (8), 1232-1240 (2005).
- Baher, A., et al. Short-term cardiac memory and mother rotor fibrillation. The American Journal of Physiology-Heart and Circulatory Physiology. 292 (1), 180-189 (2007).
- Kleber, A. G., Rudy, Y. Basic mechanisms of cardiac impulse propagation and associated arrhythmias. Physiological Reviews. 84 (2), 431-488 (2004).
- McPheeters, M. T., Wang, Y. T., Werdich, A. A., Jenkins, M. W., Laurita, K. R. An infrared optical pacing system for screening cardiac electrophysiology in human cardiomyocytes. PLoS ONE. 12 (8), 0183761(2017).
- Gordon, A. M., Huxley, A. F., Julian, F. J. The variation in isometric tension with sarcomere length in vertebrate muscle fibres. The Journal of Physiology. 184 (1), 170-192 (1966).
- Li, Y., et al. Three Preservation Solutions for Cold Storage of Heart Allografts: A Systematic Review and Meta-Analysis. The Journal of Artificial Organs. 40 (5), 489-496 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon