Method Article
単離マウス心室筋細胞の光学イメージング
要約
マウス筋細胞の単離の方法論と、同時デジタル細胞幾何学的測定と蛍光光光測定を用いたサルコメア短縮トレースと同時に電圧またはカルシウムの痕跡を得る方法を提示する。
要約
成人の心臓筋細胞を単離する能力は、研究者が単一細胞レベルで様々な心臓病理を研究することを可能にした。カルシウム感受性染料の進歩は、単一細胞カルシウムダイナミクスの堅牢な光学記録を可能にしているが、堅牢な膜貫通光学電圧信号の記録は困難なままである。おそらく、これは、従来のポテンショメトリック色素の低い単一対雑音比、光毒性、および光漂白のためです。したがって、単一セル電圧測定は、長い間、ゴールドスタンダードであるパッチクランプ技術に限定されてきましたが、技術的に要求が厳しく、スループットが低くなっています。しかし、新規のポテンショメトリック色素の開発に伴い、電圧の変化に対する大きく高速な光学応答は、光毒性や光漂白をほとんどまたは全く得られない。このプロトコルは、細胞短縮、カルシウム、および光電圧測定に使用できる成人マウス筋細胞を分離する方法を詳細に説明します。具体的には、このプロトコルは、レシオメトリックカルシウム色素、単発性カルシウム色素、および単一励起電圧色素の使用方法を記述する。このアプローチは、様々な化学薬品の心毒性および不整脈性を評価するために使用することができる。光毒性は単一細胞レベルでは依然として問題であるが、それを減らす方法について方法論が議論されている。
概要
健康および病理学的状態の間に心臓を研究するために、単一細胞レベルで表現型を調べることはしばしば有用である。科学の進歩は単一細胞カルシウムダイナミクスの堅牢な測定を可能にしているが、単一細胞の光学電圧測定は不足したままである1.間違いなく、これは低信号対雑音比(SNR)、光毒性、および従来のポテンショメトリック色素2、3の光漂白のためです。それにもかかわらず、単離された筋細胞光学作用電位は2、3、4が得られた。また、化学と電圧感受性染料の物理学の進歩に伴い、SNRは5を改善した。新しい膜電位プローブ(材料表)は、サブミリ秒で膜電位の変化に応答し、100mVあたり約25%の蛍光応答範囲を有する。また、膜電位キットの励起/放出(例えば、FluoVolt;材料表)このプロトコルで使用される標準的なフルオレセインイソチオシアネート(FITC)または緑色蛍光タンパク質(GFP)設定6で動作します。
FITCおよびGFP励起/発光スペクトルは、フルオ-4カルシウム結合スペクトル7と重複する。従来、デジタル細胞幾何学測定による蛍光光測定の同時取得は、カルシウムおよび細胞短縮測定の同時取得に使用されてきた8。このプロトコルでは、マウスの筋細胞を分離する方法と、標準的なFITC設定を使用してカルシウムまたは電圧信号を記録する方法について詳しく説明します。さらに、イメージングワークステーション上の励起/発光フィルタの単純なスイッチを使用して、比メトリックカルシウム色素のフラ-2を使用してカルシウムと短縮測定を得る方法について説明します。fluo-4と比較して、fura-2はカルシウムに対する親和性が高く、光漂白9に対して比較的耐性があります。したがって、単一のワークステーションを使用して、このプロトコルは、単独で筋細胞励起収縮カップリングの徹底的な検査を可能にします。
プロトコル
このプロトコルに記載されているすべての方法と手順は、ケースウェスタンリザーブ大学の制度動物ケアと使用委員会(IACUC)によって承認されています。
1. ソリューション、インスツルメンツ、カバースリップの作成
注:1xソリューションは、最大1ヶ月間使用することができます。
- 68.96 gのNaClを加えることで、カルシウムを含まない10xクレブス・ヘンセレイト緩衝液HEPES緩衝液(KHB-HB)を作り、 KClの3.57g、HEPESの59.58 g、K2 HPO4の2.18 g、MgSO4および19.82 gのグルコースの3.08gから1,000mLフラスコ中の二重蒸留水の800 mLに。内容物が完全に溶解したら、1,000mLの容積フラスコで体積に持ち出します。
注:従来のクレブスヘンセレイト溶液は、バッファーとして重炭酸ナトリウムを使用し、このプロトコルのソリューションは、HEPESバッファーとクレブスヘンゼイト溶液を使用しています。溶液は滅菌濾過すれば6ヶ月間安定である。 - NaClの86.51 g、NaH2PO4の0.552 g、MgCl2の2.03 g、ブドウ糖の9.91 g、KClの4.03 g、CaCl2の2.65 g、および35.76 gのHEPESを800mLに加えて10.76gのHEPESを100mLで二重蒸留水の800mLに加えて10.76gを作ります。内容物が完全に溶解したら、1000 mL体積フラスコで体積に持ち出します。
注:溶液は、滅菌濾過した場合、6ヶ月間安定です。 - 10xストックの100 mLを測定し、1,000 mLフラスコに875mLの二重蒸留水を加えて1x KHB-HBを作ります。37°水浴中にフラスコを置きます。溶液が37°Cに達したら、NaOHを使用してpHを7.39に増やします。pHを調整した後、溶液を1000 mL体積フラスコで体積に持ち込みます。真空ろ過システムを使用して溶液を滅菌する。
- 10倍のストックの100 mLを測定し、1,000 mLのフラスコに875mLの二重蒸留水を加えて、1xタイローデの溶液を作ります。37°水浴中にフラスコを置きます。溶液が37°Cに達したら、NaOHを使用してpHを7.39に増やします。pHを調整した後、溶液を1,000mLの容積フラスコで体積に持ち込みます。真空ろ過システムを使用した滅菌フィルター。
- 10倍のストックの100 mLを測定し、1,000 mLのフラスコに875mLの二重蒸留水を加えて、1x改質タイローデ溶液を作ります。L-グルタチオンの3.07gをフラスコに還元溶解する。37°水浴中にフラスコを置きます。溶液が37°Cに達したら、NaOHを使用してpHを7.39に増やします。pHを調整した後、溶液を1,000mLの容積フラスコで体積に持ち込みます。真空ろ過システムを使用して溶液を滅菌する。
- 25mgの粉末にジメチルスルホキシド(DMSO)の855 μLを加えて、100 mMブレビスタチン原液を作ります。アリクォートは20°L刻みで出て、-80°Cの冷凍庫で最大6ヶ月間保存します。
- ウシ血清アルブミン(BSA)の2gとアリクォートブレブスタチンストックの1バイアルを1x KHB-HBの100 mLに添加して停止緩衝液を作り、真空濾過システムを用いて溶液を滅菌する。
- 5 mL の胎児ウシ血清とアリクォートされたブレビスタチンストックの 1 バイアルを M199 HEPES の 95 mL に加えてめっきバッファーを作成します。真空ろ過システムを使用して溶液を滅菌する。
- M199(25 mM HEPES)の396 mLにアリクォートブレビスタチンストックの1バイアルと4mlsペニシリンストレプトマイシンを1つの1バイアルを加えることによって筋細胞培養緩衝液を作る。真空ろ過システムを使用して溶液を滅菌する。
- オートクレーブ2ペアのデュモンピンセット、アイリス湾曲ハサミ2組、ヘモスタット2組、整形手術鉗子1組、6つの黒編みシルク4-0縫合糸、外科ダブルスローノットとして使用するように配置された縫合糸、および4つの100 mLビーカー。
- 22 x 22 mm2ガラスカバースリップを滅菌します。まず、6つの井戸プレートの各ウェルにカバースリップを1枚置きます。その後、蓋を取り外した後、バイオセーフティキャビネットのUVランプをオンにし、カバーリップを1時間UVライトにさらします。
- 最初に氷の上にボトルを解凍することにより、作業ラミニンストックソリューションを作ります。1本のボトルの内容物を十分な冷たい無菌リン酸緩衝生理食塩水中(PBS)に加え、最終濃度0.04mg/mLに達します。アリクォートは1.3μLをオートクレーブ処理された1.5 mL遠心管に出す。-80°Cで保管してください。
注:各チューブは、単一の6ウェルプレートのための十分なラミニンを持っています。複数の凍結解凍サイクルを避けてください。 - 最初に氷上の作業ラミニン溶液を解凍することによって、コーティング殺菌されたカバースリップ。P1000ピペットを使用して、ラミニンの200°Lを吸引する。カバースリップの一端に沿ってピペット先端をゆっくりとドラッグして、キャピラリーアクションが6つのウェルプレートへのカバースリップアタッチメントを容易にするために、微小な量のラミニンを引き出せるようにします。
- 次いで、カバースリップの中央に残ったラミニンを排出する。円形の動きで、ラミニン液滴をカバースリップ全体に広げます。37°Cのインキュベーターに少なくとも1時間、最大24時間を単離する前に置きます。
2. ランゲンドルフ装置の準備
注: このプロトコルで使用されるランゲンドルフ装置の個々のコンポーネントは、材料の表にリストされています。
- 循環水浴をオンにします。排煙が37°Cの温度になるように温度を設定します。
注:溶液貯留部の高さを60cmに設定した場合、排液を37°Cにするには循環水産を41°Cに設定する必要があります。以前に報告されたプロトコルとは異なり、貯水池の高さを変更する必要はありません。 - 70%エタノールでランゲンドルフ装置をすすいで、続いてオートクレーブ二重蒸留水で2本のリンスを行います。すすがった後、貯蔵所をKHB-HBで満たし、100%酸素で酸素化します。
- 酸素化されたKHB-HBが最初に100 mLビーカーに流れるようにしてシステムをプライムします。50 mLの溶液がビーカーに流れたら、3ウェイストップコック位置を切り替えてKHB-HB貯留部からの流れを止めます。ビーカーから50mLの酸素化KHB-HBをコラゲナーゼ貯蔵所に注ぎます。
- KHB-HBは、コラゲナーゼ貯留層に5mLが残るまで消化貯蔵所から排出します。コラゲナーゼ貯蔵所をプライミングしながら、ラインがドガを可能にするために、貯水池の間で3ウェイストップコックを繰り返し切り替えます。システムがプライミングされた後、加熱コイルの上にある脱気トラップを使用して、残りの空気がシステムを終了できるようにします。
- コラゲアゲネアゲ液を作ります。ラットの場合、100mgのII型コラゲナーゼ、100mLの酸素化KHB-HB、およびブレビステインストックの2バイアルを組み合わせたもの。マウスの場合は、100mgのII型コラゲナーゼ、40mLの酸素化KHB-HB、およびブレビステインストックの2バイアルを組み合わせる。一度混合すると、溶液は1時間安定でなければなりません。
注:筋細胞の生存率は、II型コラゲターゼロットによって異なる場合があります。コラゲラゲアゼサンプリングプログラムを利用して、バルクオーダーの前に多くのテストを行います。
3. 筋細胞分離
- ヘパリン1,000Uで動物を注入します。5分待ちます。
注:任意の年齢のマウスとラットを使用することができます。しかしながら、一般に、動物は古い以上の疾患を有し、筋細胞収率が低いほど低い。 - ペントバルビタール混合物(150mg/kg腹腔内)で動物を安楽死させる前に、オープンドロップ法(500cc体積あたり1ccのアイソフルラン)を使用してイソフルランで最初に麻酔することによって動物を犠牲にします。
- 最初にxiphoidプロセスの上に毛皮をつかんで心臓を急速に励起する。虹彩はさみで、xiphoidプロセスのすぐ下に小さな切開を行い、毛皮を皮膚を露出させる頭部に向かって上向きに引っ張ります。
- キシホイドプロセスをつかみ、胸腔を露出する横隔膜をカットします。トラップドア切開を行い、胸骨を止め、上行大弦波の上の心臓を切除し、冷たいKHB-HBに置くために湾曲した鉗子を使用します。
- ステレオ顕微鏡と5番目の鉗子を使用して心臓をカニューレします。心臓が水没し、塞栓を防ぐために切除前にカニューレがプライミングされていることを確認してください。カニューレの先端を心室に約1mm上に可視化してカニューレの適切な位置を確認する。
注:カノレーション時間が速いほど、筋細胞の収率が良くなります。 - ランゲンドルフのストップコックを回転させてKHB-HBの流れを開始します。カニューレをランゲンドルフに接続します。心臓を5分間熟読しなさい。
注:灌流は重力ベースのシステムによって供給されるため、心臓を通る流れは冠状動脈コンプライアンスの機能となります。 - KHB-HB貯留部から消化バッファー貯蔵所への灌流を切り替える。消化バッファーが心臓に到達したら、タイマーを設定します (マウスの場合は 5 分、ラットの場合は 15 分)。滅菌100mLビーカーで含まれるのを必ず回収してください。消化時間が経過するまで、必要に応じて消化バッファー貯蔵所を含み、浸透液を補充します。
- 消化後、心臓のチャンバーを鉗子で分離し、虹彩はさみ、無菌の100 mLビーカーでシーブをする。各チャンバーを6つの井戸板の別々の井戸に入れます。各ウェルにコラゲラーゼ溶液を5mL注ぎます。
- すぐにはさみを使用して心臓組織のミンチを開始します。組織チャンクは約1mm3でなければなりません。滅菌転写ピペットを使用して、ひき肉の心臓組織を穏やかにトリチュレートします。ソリューションは曇りになるはずです。
- 組織の塊が白く羽状になったら、反転顕微鏡で細胞を調べます。生存細胞の数が80%を超える場合は、100μmの細胞ストレーナーを用いて細胞を50mL円錐管に歪化する。心臓の部屋ごとに異なるチューブとストレーナーを使用してください。
- 生存細胞の数が80%未満の場合は、カニューレにかかった時間を確認してください。カンナレーション時間が5分を超える場合は、別の心臓を試してみてください。そうでない場合は、アッセイ新しいコラゲアゲ過多は、コラゲアゲ様サンプリングプログラムを介してロット。
- 215 x gで2分間遠心分離して細胞をペレット化する。ペレットはコンパクトで、緩んではいけないようにしてください。ペレットが緩んでいる場合、調製物には多くの死細胞が含まれる。組織培養フードで、停止緩衝液のペレットを10mLで再中断する。
- 215 x gで2分間遠心分離して細胞をペレット化する。ペレットはコンパクトで、緩んではいけないようにしてください。ペレットが緩んでいる場合、調製物には多くの死細胞が含まれる。
- 5 mL のめっきバッファーで細胞を再中断します。セル数を実行します。めっきバッファーのミリリットルを調整して、mLあたり2 x 104細胞の最終的な筋細胞濃度に達します。
- ラミニンコーティングされたカバーリップをインキュベーターから取り外します。ラミニン液滴を吸引する。
- 各カバースリップ上の筋細胞懸濁液のプレート200μL。37°Cのインキュベーター(21%O2、5%CO2)を2時間取り付けて取り付けを許可します。2時間後、未結合細胞を吸引し、2mLの培養媒を加え、最大4日間培養した。
4. ふらは-2 染料の積み込み
- 2 mMフラ-2アセトキシメチルエステル(フラ-2 AM)の原液を作り、25μLのDMSOを50μgのフラ2 AM粉末(1バイアル)に加えて作ります。アリコートを6μLアリコートにアウト。フラ-2 AMのアリコートを1個取り、めっき培地を6mLに加えます。混ぜる渦。
- インキュベーターから筋細胞の6つのウェルプレートを取り除きます。吸引メディア。各ウェルに1 mLのフラ2メディア混合物を加えます。ホイルでプレートを覆い、プレートを室温に残し、15分間待ちます。
- 吸引フラ2メディア混合物を吸引し、各井戸にタイローデの溶液の1 mLを追加します。ホイルで覆う。イメージングする前に色素の洗い流しを可能にするために、室温で20分間待ちます。
5. フルオ4染料ローディング
- 1.82 mM fluo-4 アセトキシメチルエステル(fluo-4 AM)の原液を、25μLのDMSOを50μgのフルオ4 AMパウダー(1バイアル)に加えて作ります。アリコートを8.333μLアリコートにアウト。Fluo-4 AMストックのアリコートを1個取り、めっき培地を6mLに加えます。混ぜる渦。
- インキュベーターから筋細胞の6つのウェルプレートを取り除きます。吸引メディア。各ウェルにfluo-4 AMメディア混合物の1 mLを追加します。ホイルでプレートを覆い、プレートを室温に残し、15分間待ちます。
- 吸引フルオ-4 AMメディア混合物を吸引し、各井戸にタイローデ溶液の1 mLを追加します。ホイルで覆う。イメージングする前に色素の洗い流しを可能にするために、室温で20分間待ちます。
6. 膜電位染料のローディング
- 膜電位キットからコンポーネント A とコンポーネント B を取り外します。15 mL円錐管で、成分Bの50μLと5μLの成分A.ボルテックスを組み合わせて混合します。電圧染料混合物を含む15 mL円錐管に10mLのめっき媒体を加えます。混ぜる渦。
- インキュベーターから筋細胞の6つのウェルプレートを取り除きます。メディアを吸引する。膜電位色素混合物の800°Lを各ウェルに加えます。ホイルでプレートを覆い、プレートを室温に残し、15分間待ちます。
- 吸引染料媒体混合物を加え、各ウェルに1mLの変性タイローデ溶液を加える。ホイルで覆う。
7. フォトメトリーと充電結合デバイスの記録
- 顕微鏡、アークランプ、ハイパースイッチ、蛍光インターフェースシステム、ミオカム電源、電界刺激装置、コンピュータの順に装置の電源を入れます。
- 励起/放出フィルタセットがイメージング染料に適していることを確認します。
注:Fura-2は340 nmと380 nmの光で励起されます。それは光の510 nmで発する。Fluo-4と電圧膜色素は485nmの光で励起され、520nmの光で放出されます。 - 真空をオンにし、ホースクランプを完全に開き、マニホールドに使用されている各60 mLシリンジを穏やかに突き刺すことによって、システムをプライムします。カルシウムの記録のためにタイロードの溶液を使用します。電圧記録の場合は、変更されたタイローデの溶液を使用します。
- ヒーターをオンにし、灌流チューブのローラークランプを調整して流れを設定します。36 ± 1 °Cで録音を行います。
- 取得ソフトウェアを開きます。正しいイメージング色素のパラメータが設定されていることを確認します。
- 暗闇の中で、6つの井戸プレートからホイルを取り出し、ペーシングチャンバーにカバースリップを置きます。このステップでは、刺激装置がオフになっていることを確認します。10倍の目的を使用して筋細胞に焦点を当てます。
- 焦点が合うと、1Hzで刺激する場でペーシングを開始し、0.2V.1ペーシングが得られるまで徐々に電圧を上げます。次に、しきい値に達するまで電圧を上げます。
メモ:励起収縮カップリングは温度に依存するため、記録する前に細胞が15分間浸透していることを確認してください。これにより、筋細胞は室温から37°Cに戻るショックから回復し、ゆるやかに取り付けられた細胞を浮かび上がらすことができる。 - 10 倍の目標から 40 倍の目標に切り替えます。1:1 ペーシングに従うセルに焦点を当てます。1 つのセルだけが視野に入るように、プラスチックの色合いを調整します。
- ソフトウェアを使用して、適切に定義されたサルコメアに対象の領域ボックスを配置します。励起光を開始するために、集録ソフトウェアを起動します。ニュートラル密度フィルタを使用して、それに応じて強度設定を調整し、適切な SNR を得る。
結果
図1Aはランゲンドルフ装置を示す。酸素供給器はKHB-HB貯蔵所にある。コラゲラーエーゼ溶液は、中央60 mLシリンジ貯蔵所にある。脱気ラインは空の60 mLシリンジの貯蔵所に接続される。正常な分離の後、細胞のほとんどはロッドの形をし、縞を引き起ぐ必要があります。40倍の目的では、ほとんどの筋細胞は明確な縞を目に見える必要があります。図1B,Cは、健康なラットの筋細胞の例を示す。いったん単離されると、細胞は形態や電気的特性を維持しながら4日間まで培養することができる。
励起収縮カップリングを測定するために、細胞は加熱されたペーシングチャンバーに配置される。筋細胞は温度の変化に敏感であるため、カバースリップが記録する前にチャンバー内で15分間平衡化できるようにすることが重要です。蛍光記録の場合、励起波長は75 Wキセノンアーク電球によって生成されます。キセノンアーク電球は、自然の太陽光を模倣する光スペクトルを生成します。光と波長の強度は、中性密度/発光ファイラーによって制御されます。励起光は、その後、筋細胞に目的を通過します。発光波長は光電子増倍管によって収集されます。ここで説明するシステムを使用して、励起フィルタと放出フィルタの両方を手動で変更する必要があります。
一方、短縮は、電荷結合デバイスセンサによって得られる。1秒間に最大1,000回までリアルタイムで測定し、集録ソフトウェアは、適切に解決されたストリエーションパターンを作成するために、対象領域内のラインの平均を実行します。その後、高速フーリエ変換 (FFT) が計算されます。パワースペクトル内のピークは、平均サルコメア間隔を表します。ペーシング中のサルコメア間隔の変化がプロットされ、その後定量化されます。
図2は、カルシウム色素のフラ-2を装填したC57/B6マウス筋細胞から記録されたカルシウムおよび短縮トレースを示す。ペーシングプロトコルは、前の10,11で説明したペーシング プロトコルの変更です。健康なマウスの筋細胞は、安静時心拍数10Hzでペースを上げることができるはずです。図3は、C57/B6マウスから得られたアンサンブル平均データと、カリウムチャネルに導入されたポイント突然変異を有するそれらのトランスジェニック(TG)リッターメイトの定量です。10 Hz ペーシング時の緩和時間を除き、グループ間に違いはありません。
二重励起色素であるふら-2とは異なり、電圧色素とfluo-4は、標準のFITC励起および発光スペクトル(494/506 nm)で励起/発光動作を行う単一波長励起染料です。従って、このフィルタセットを用いてカルシウム及びサルコメア短縮又はサーコメレ短縮の記録が得られる。
図4Aは、10Hzでペースを速めたC57/B6マウス筋細胞から記録された電圧トレースを示しています。図 4Bは、図4A の AP から作成されたアンサンブル平均アクションポテンシャル(AP)を示しています。図4C,Dは、ローパスバターワースまたはサビツキーゴレイデジタルフィルタが適用された後のアンサンブル平均APを示しています。実際のデータを歪めないように信号をフィルタリングする場合は注意が必要です。図 4B-Dの AP の形状の微妙な違いに注目してください。
図5は、1Hzでペース化したラット筋細胞から記録された痕跡を示す。電圧信号がカルシウム信号よりも低いことに加えて、収縮動態も異なります。これは、カルシウム染料がカルシウムを緩衝する一方で、電圧染料が含まないからです。
一過性カルシウム(図3)と同様に、筋細胞は光学作用電位持続時間(APD)のペーシング依存的変化も実証した(図6)。フラ2トレースは、定量される前に平均的にアンサンブルされたが、電圧トレースは、平均化および定量される前に、Savitzky-Golay多項式平滑化フィルタ(幅5、順序2)でフィルタリングされた。
図6および図7で定量化したように、APDにおけるペーシング誘導変化の実証に加えて、APの薬物誘発延長も実証した。4Hzペーシングでは、4-アミノピリジンを用いた一過性外流(I〜)の濃度依存的遮断により、APDが延長された。
最後に、細胞傷害性を避けるために注意する必要があります。図 8は、20 s の記録の最後の 11 s です。図8の赤い矢印で示され、青色光への筋細胞の長期暴露は、引き起こされる活性をもたらす。

図1:定圧ランゲンドルフ装置(A) 各コンポーネントが白い文字でラベル付けされたランゲンドルフ装置。(B)10倍の目的を通して見た孤立したスプレイグ・ドーリーラット筋細胞。(C)40倍の目的を通して見た単離ラット筋細胞。この図の大きなバージョンを表示するには、ここをクリックしてください。
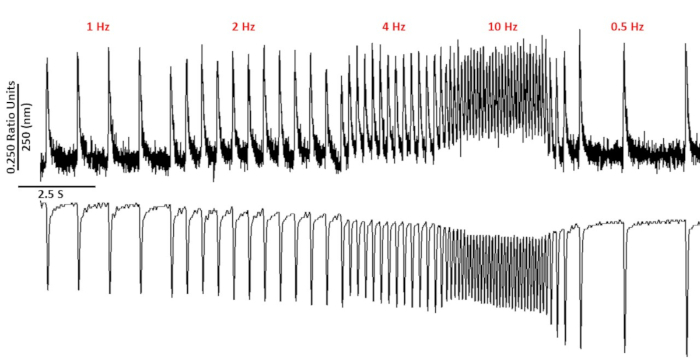
図2:代表的なカルシウムおよびサルコメア短縮トレースは、フラ-2を用いてC57/B6筋膜から記録した。1、2、4、10、0.5、0.75 Hzで記録されたカルシウムとサルコメアの短縮痕跡はこちらをクリックして、この図の大きなバージョンを表示してください。
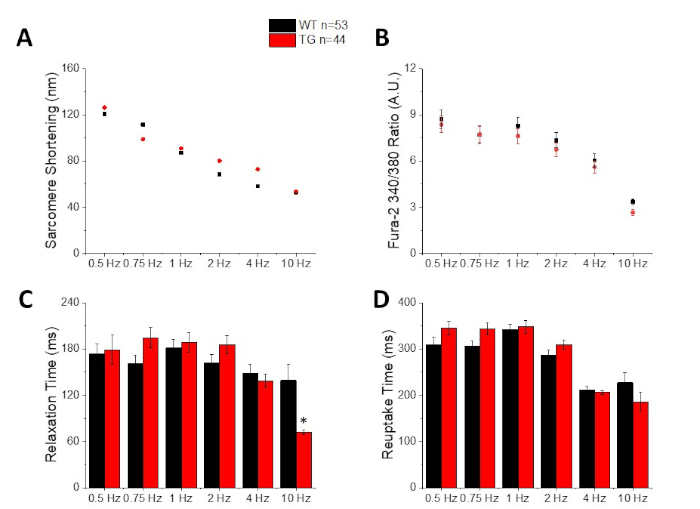
図3:サルコメア短縮、ピークカルシウム、弛緩時間、およびC57/B6野生型(WT)およびトランスジェニック(TG)マウスから記録された再取り込み時間の定量。(A) サルコメア短縮。(B) ピークカルシウム。(C) 短縮トレースのベースラインに 90% 戻ると定義される緩和時間。(D) カルシウムトレースのベースラインに90%戻ると定義された再取り込み時間。この図の大きなバージョンを表示するには、ここをクリックしてください。
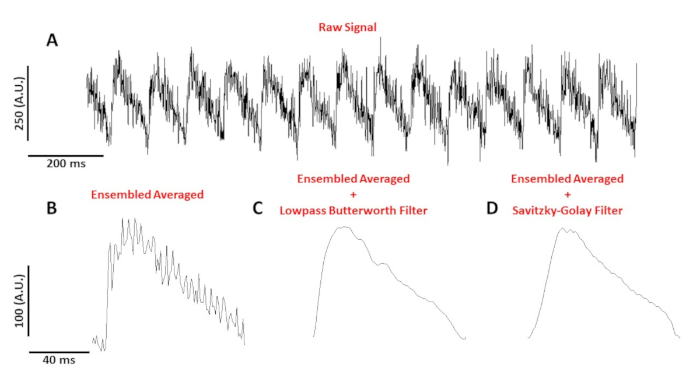
図4:C57/B6マウス筋細胞から記録された光学作用電位は10Hzでペースを上げた。(A) 1 秒のフィルター処理されていないトレース。(B) アンサンブル平均光学作用電位。(C)低パスバターワースフィルタを適用した後のアンサンブル平均光学作用電位。(D)サビツキー・ゴレイ多項式平滑化フィルタを適用した後のアンサンブル平均光学作用電位。この図の大きなバージョンを表示するには、ここをクリックしてください。
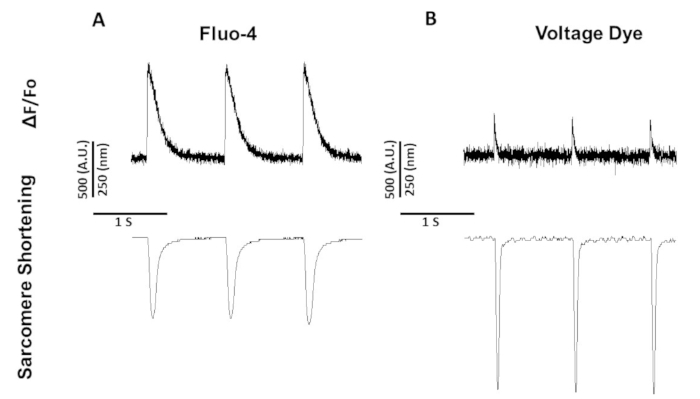
図5:スプレイグ・ドーリーラット筋細胞から記録された代表的なカルシウム、電圧、およびサルコメア短縮トレースは、1Hzでペースを上げました。(A)フルオ-4を用いて1Hzペーシングで記録されたカルシウムおよびサルコメア短縮トレース。(B)電圧色素を用いて1Hzペーシング時に記録された電圧およびサルコメア短縮トレース。この図の大きなバージョンを表示するには、ここをクリックしてください。
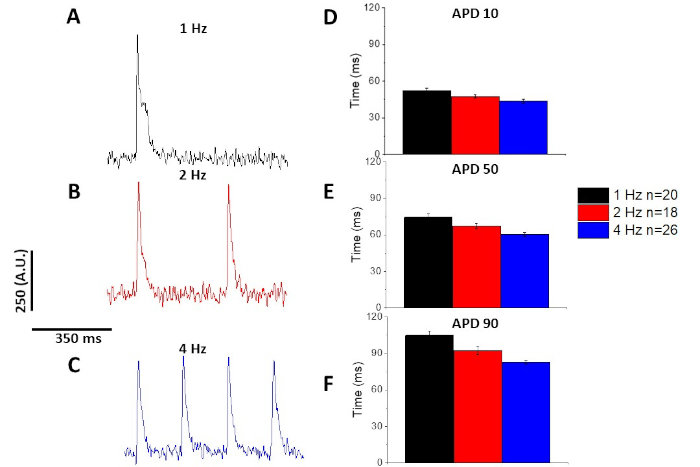
図6:スプレイグ・ドーリーラット筋細胞から記録された光学作用電位は、1、2、4Hzペーシングでペースを上げる。(A) 1 Hz ペーシング時に記録されたフィルタリングされたトレース。(B) 2 Hz ペーシング時に記録されたフィルタリングされたトレース。(C) 4 Hz ペーシング時に記録されたフィルタリングされたトレース。(D)作用電位持続時間10は、ベースラインに10%戻るとして測定される。(E)アクション電位期間 50, 50% ベースラインに戻るとして測定.(F) 作用電位持続時間90は、ベースラインに90%戻るとして測定される。この図の大きなバージョンを表示するには、ここをクリックしてください。
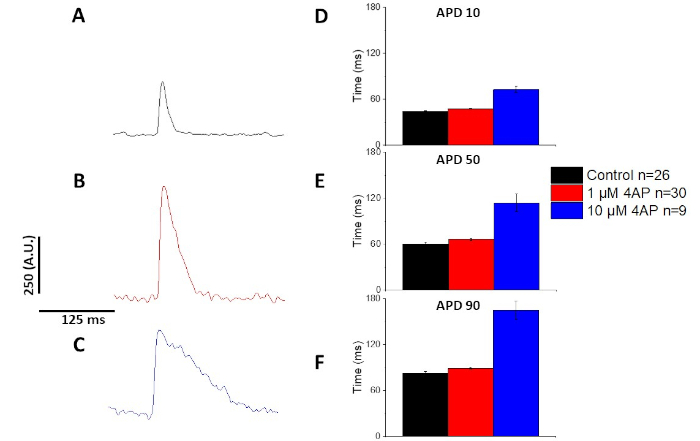
図7:4Hzペーシング時に記録されたスプレイグ・ドーリーラット光作用電位に対する4-アミノピリジンの影響(A)アンサンブル平均トレースは、溶液中に4-アミノピリジンを含たない4Hzペーシングで記録された。(B)アンサンブル平均トレースは、溶液中に1μM 4-アミノピリジンを有する4Hzペーシングで記録された。(C)アンサンブル平均トレースは、溶液中に10μM 4-アミノピリジンを有する4Hzペーシングで記録された。(D)作用電位持続時間10は、ベースラインに10%戻るとして測定される。(E)アクション電位期間 50, 50% ベースラインに戻るとして測定.(F) 作用電位持続時間90は、ベースラインに90%戻るとして測定される。この図の大きなバージョンを表示するには、ここをクリックしてください。
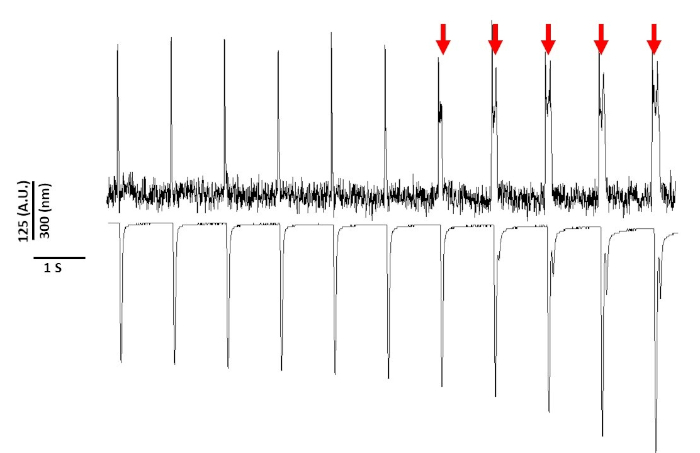
図8:連続光暴露の20s後のスプレイグ・ドーリーラット筋細胞における電圧色素誘導光毒性。赤い矢印は、細胞傷害性イベントを示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
心臓筋細胞を分離できることは、心臓生理学、病理学、毒物学を理解するために使用できる強力な方法です。上記プロトコルでは、一定の重力ランゲンドルフ装置を利用して単一の心臓筋細胞を得る方法について説明した。その後、蛍光フォトメトリーシステムを用いて、カルシウムと短くまたは電圧と短縮トレースを同時に取得する方法について説明します。
カルシウム染料の間の動態が異なるため、どの染料を選択する必要があります。このプロトコルでは、使用したフラ-2とfluo-4の両方を、AM基を切断し、細胞内の色素をトラップする細胞内エステラーゼ時間を可能にするために洗浄工程を必要とするAMエステルで設計された。フラ2とフルオ-4の両方が高親和性カルシウム色素と考えられているが、フラ-2のKdはfluo-49の345nMと比較して145nMである。また、フラ-2はレシオメトリックである。このため、細胞内カルシウムレベル9、12を定量するために用いることができる。一方、Fluo-4は単波カルシウムプローブである。fluo-4を使用する利点は、より明るい蛍光シグナルを生成することです。どのカルシウム色素が使用されているかに関わらず、カルシウム色素と比較して、膜電圧プローブはSNRが低い。
図4および図5に示すように、カルシウムトレースと比較した電圧トレースは振幅が小さくなります。ソフトウェアのデジタルトレースフィルタリングを使用すると、SNRを増やし、データを定量化することが可能です(図4と図7)。定量化すると、カルシウム過渡型と光APDの両方が返還を実証し、ペーシング周波数の高速化で持続時間を短縮します(図2、図3、図6、図7)。より速いペーシングサイクルの間に短いAPDは、拡張期の間に心室充填のための十分な時間を可能にするために必要である。この現象の変化は、アリストリアス13、14、15、16のリスクの増加を示していると考えられている。APDの変化は病気によって引き起こされるが、それらはまた化学物質によって引き起こされる。図7に示すように、カリウム電流を主なマウス再偏光にすると、Iが遮断され、光学APDが長くなる。
それでも、電圧感受性染料で以前に報告したように、光の強度および持続時間はAPD2、5、17を変えることができる。これは反応性酸化種(ROS)5の生成の結果であると考えられている。これまで、記録液に抗酸化剤を添加すると、電圧感受性色素細胞傷害性5を防止できることが示されていた。その結果、タイローデ溶液に抗酸化L-グルタチオン(10mM)を加えた。図8に示すのは、1Hzペーシングで得られた20s記録の最後の11sである。赤い矢印で示されているように、APDの変更は15 sまで記録に入りませんでした。したがって、改変されたタイローデの溶液は光毒性を防止しなかったが、それは有意に遅れた。変更されたタイローデ溶液を使用して、低光強度設定を使用し、記録の持続時間を5s以下に保ち、APDにおける色素誘導変化を回避することができる。光毒性を避けるように注意を払わなければ、データが早い段階で原因と誤解されたり、脱分極後に遅延したりする可能性があるため、これは重要です。青色光への暴露を制限することに加えて、データの誤解釈を防ぐために取ることができる追加の予防措置があります。
1 つ目は、1 から 1 つのペーシングに続き、休止中のサルコメア長が 1.75 μm 以上のセルからのみ記録することです。1.75μmのカットオフは、サルコメア長がこの量を下回ると緊張が急速に低下するというゴードンら18の観察から取られる。それにもかかわらず、特定の病理は、サルコメアの長さを休ませる際に有意な変化をもたらす可能性がある。表現型が本物であり、孤立のアーティファクトではないことを確認するには、次のトラブルシューティングアプローチを取る必要があります。
筋細胞が一貫して1:1ペーシングに従っていない場合、1.75μm未満のサルコメア長、重膜ブレビング、または単離を生き残らない場合、最初にチェックするのは心臓をカニュールするのにかかった時間です。カンナレーション時間が長いほど、歩留まりは低くなります。長いカノネーション時間が必要な場合、心臓を心電性溶液19に入れることにより生存率を向上させることができる。それにもかかわらず、コラゲアゲ酵素は酵素であるため、特定のロットの活性および特異性は時間の経過とともに変化する。全体的な収量が良好なカニューレーション時間にもかかわらず徐々に悪化する場合は、新しいロットがアッセイされるべきです。当社のプロトコルは5sの録音用に最適化されていますが、より長い電圧トレースが必要な場合は、追加のニュートラル密度フィルタを購入する必要があります。プロトコルに記載されているシステムには、透過光を37%、50%、75%、90%、95%削減する中性密度フィルタが付属しています。
要約すると、カルシウム、電圧、サルコメレ短縮測定に用いた成人マウス心室筋細胞の単離を可能にする方法論について述べた。
開示事項
著者たちは何も開示する必要はない。
謝辞
原稿を注意深く校正してくれたダナ・モルゲンシュテルンに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.25 Liter Water Jacketed Reservoir | Radnoti, LLC | 120142-025 | |
| 1 liter volumetric flask | Fisher Scientific | 10-205F | |
| 100 ml beaker | Fisher Scientific | FB-100-100 | |
| 100 ml graduated cylinder | Fisher Scientific | 08 562 5C | |
| 1000 ml flask | Fisher Scientific | FB-500-1000 | |
| 2-Bar Lab Stand with Stabilizer Bar and 24" Stainless Steel Rods | Radnoti, LLC | 159951-2 | |
| 4-Aminopyridine | Sigma-Aldrich | 275875 | |
| 40X Oly UApo/340 Non-Immersion Objective (NA 0.9, WD 0.2mm) | IonOptix | MSCP1-40 (b) | |
| 60-mL syringe, BD Luer-Lok tip | BD | 309650 | |
| Aortic Metal Cannulae | Harvard Apparatus | 73-0112 | |
| Bovine Serum Albumin | Fisher Scientific | BP9703-100 | |
| C-6 Standard Heating Circulator | Chemyx | A30006 | |
| CaCl2 | Fisher Scientific | BP510500 | |
| Cell framing adapter | IonOptix | CFA300 | |
| CellPr0 Vacuum Filtration System, 1 liter, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V100022 | |
| CellPro Vacuum Filtration System, 250mL, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V25022 | |
| CellPro Vacuum Filtration System, 500mL, 0.22µm,12/CS | Labratory Product Sales, Inc | V50022 | |
| CMC (mTCII) Temp Control w/ inline flow heater | IonOptix | TEMPC2 | |
| Cole-Parmer Large-bore 3-way, male-lock, stopcocks | Cole-Parmer | EW-30600-23 | |
| Cole-Parmer Luer fittings, Large-bore stopcocks, male lock, 4-way | Cole-Parmer | EW-30600-12 | |
| Cole-Parmer Stopcocks with Luer Connections; 1-way; male slip | Cole-Parmer | EW-30600-01 | |
| Collagenase Type II | Worthington | LS004177 | |
| Corning Sterile Cell Strainers | Fisher Scientific | 07-201-432 | |
| Dell Optiplex 790 mini-tower, 4G RAM, 250G HD, Windows 7 Pro | IonOptix | CPUD7M | |
| DMSO | Fisher Scientific | 50980367 | |
| Dumont Tweezers Style 5 | Amazon | B00F70ZDEQ | |
| FHD Rapid Change Stimulation Chamber | IonOptix | FHDRCC1 | |
| Fluo-3/4 Optics Package | IonOptix | IonOP-Fluo | |
| Fluorescence system interface – (w PCI-I/O card) | IonOptix | FSI700 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher Scientific | 15-140-122 | |
| Glucose | Fisher Scientific | D16-1 | |
| Hemostat, Curved 5-1/2" | Amazon | B00GGAAPD0 | |
| HEPES | Fisher Scientific | BP310500 | |
| HyperSwitch dual excitation light source | IonOptix | HSW400 | |
| Inverted Motic Fluorescence Microscope | IonOptix | MSCP1-40 (a) | |
| IonWizard Core + Analysis | IonOptix | IONWIZ | |
| Iris Scissors, curved | Amazon | B018KRRMY6 | |
| K2HPO4 | Fisher Scientific | P288-100 | |
| KCl | Fisher Scientific | BP3661 | |
| L-Glutathione reduced | Sigma-Aldrich | G4251 | |
| LOOK Silk Spool, Black Braided, 4-0, 100yds | SouthernAnesthesiaSurgical Inc. | SP116-EA | |
| M199 Media | Fisher Scientific | 12 340 030 | |
| MgCl2 | Fisher Scientific | MP021914215 | |
| MgSO4 | Fisher Scientific | BP2131 | |
| MyoCam-S Digital CCD video system | IonOptix | MCS100 | |
| MyoPacer Field Stimulator | IonOptix | MYP100 | |
| NaCl | Fisher Scientific | BP358212 | |
| NaH2PO4 | Fisher Scientific | 56-754-9250GM | |
| Oxygenator Bubbler with Fluid Inlet for 0.25 Liter | Radnoti, LLC | 140143-025 | |
| Photomultiplier sub-system | IonOptix | PMT400 | |
| PMT Acquisition add-on | IonOptix | PMTACQ | |
| Radnoti Heating Coil 5 mL with Degasing Trap | Radnoti, LLC | 158830 | |
| Ring Clamp 60 – 80mm Dia. for 250ml Reservoir | Radnoti, LLC | 120141-025 | |
| Ring Clamp for Bubble Trap Compliance Chamber | Radnoti, LLC | 120149RC | |
| Saint-Gobain ACF000010 5/32 in.9/32 in. | Fisher Scientific | 14-171-214 | |
| Saint-Gobain ACF000013 3/16 in.3/8 in. | Fisher Scientific | 14-171-217 | |
| Saint-Gobain ACF000016 1/4 in.5/16 in. | Fisher Scientific | 14-171-219 | |
| Saint-Gobain ACF000025 5/16 in.5/8 in. | Fisher Scientific | 14-171-226 | |
| Saint-Gobain ACF00003 1/16 in.3/16 in. | Fisher Scientific | 14-171-209 | |
| Saint-Gobain ACF00005 1/16 in.3/32 in. | Fisher Scientific | 14-171-210 | |
| Saint-Gobain ACF00009 5/32 in.7/32 in. | Fisher Scientific | 14-171-213 | |
| Sarcomere Length Recording add-on | IonOptix | SARACQ | |
| T/C Adson Tissue Platic Surgery Forceps 4.75" | Amazon | B00JDWRBGC | |
| VETUS Anti-Static Curved Tip Tweezers | Amazon | B07QMZC94J | |
| Vistek 3200 Motic Vibration Isolation Platform | IonOptix | ISO100 |
参考文献
- Hagen, B. M., Boyman, L., Kao, J. P., Lederer, W. J. A comparative assessment of fluo Ca2+ indicators in rat ventricular myocytes. Cell Calcium. 52 (2), 170-181 (2012).
- Schaffer, P., Ahammer, H., Muller, W., Koidl, B., Windisch, H. Di-4-ANEPPS causes photodynamic damage to isolated cardiomyocytes. Pflügers Archiv: European Journal of Physiology. 426 (6), 548-551 (1994).
- Hardy, M. E., Lawrence, C. L., Standen, N. B., Rodrigo, G. C. Can optical recordings of membrane potential be used to screen for drug-induced action potential prolongation in single cardiac myocytes. Journal of Pharmacological and Toxicological Methods. 54 (2), 173-182 (2006).
- Tian, Q., et al. Optical action potential screening on adult ventricular myocytes as an alternative QT-screen. Cellular Physiology and Biochemistry. 27 (3-4), 281-290 (2011).
- Warren, M., et al. High-precision recording of the action potential in isolated cardiomyocytes using the near-infrared fluorescent dye di-4-ANBDQBS. The American Journal of Physiology-Heart and Circulatory Physiology. 299 (4), 1271-1281 (2010).
- FluoVolt™ Membrane Potential Kit. ThermoFisher Scientific. , Available from: https://assets.thermofisher.com/TFS-Assets/LSG/manuals/MAN0009668_FluoVolt_Membrane_Potential_Kit_UG.pdf (2018).
- Fluorescence SpectraViewer. ThermoFisher Scientific. , Available from: https://www.thermofisher.com/us/en/home/life-science/cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html (2019).
- Calcium and Contractility in Isolated Myocytes. IonOptix. , Available from: http://www.ionoptix.com/product/myocyte-calcium-and-contractility-recording-system/ (2019).
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Davis, J., et al. Diastolic dysfunction and thin filament dysregulation resulting from excitation-contraction uncoupling in a mouse model of restrictive cardiomyopathy. The Journal of Molecular and Cellular Cardiology. 53 (3), 446-457 (2012).
- Ren, J., Davidoff, A. J. Diabetes rapidly induces contractile dysfunctions in isolated ventricular myocytes. The American Journal of Physiology. 272, 1 Pt 2 148-158 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Goldhaber, J. I., et al. Action potential duration restitution and alternans in rabbit ventricular myocytes: the key role of intracellular calcium cycling. Circulation Research. 96 (4), 459-466 (2005).
- Weiss, J. N., et al. The dynamics of cardiac fibrillation. Circulation. 112 (8), 1232-1240 (2005).
- Baher, A., et al. Short-term cardiac memory and mother rotor fibrillation. The American Journal of Physiology-Heart and Circulatory Physiology. 292 (1), 180-189 (2007).
- Kleber, A. G., Rudy, Y. Basic mechanisms of cardiac impulse propagation and associated arrhythmias. Physiological Reviews. 84 (2), 431-488 (2004).
- McPheeters, M. T., Wang, Y. T., Werdich, A. A., Jenkins, M. W., Laurita, K. R. An infrared optical pacing system for screening cardiac electrophysiology in human cardiomyocytes. PLoS ONE. 12 (8), 0183761(2017).
- Gordon, A. M., Huxley, A. F., Julian, F. J. The variation in isometric tension with sarcomere length in vertebrate muscle fibres. The Journal of Physiology. 184 (1), 170-192 (1966).
- Li, Y., et al. Three Preservation Solutions for Cold Storage of Heart Allografts: A Systematic Review and Meta-Analysis. The Journal of Artificial Organs. 40 (5), 489-496 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved