Method Article
Imaging ottico di miociti Murine Ventricolari isolati
In questo articolo
Riepilogo
Presentiamo la metodologia per l'isolamento dei miociti murini e come ottenere tracce di tensione o calcio contemporaneamente con tracce di accorciamento sarcomero utilizzando la fotometria a fluorescenza con misurazioni simultanee della geometria cellulare digitale.
Abstract
La capacità di isolare i miociti cardiaci adulti ha permesso ai ricercatori di studiare una varietà di patologie cardiache a livello di singola cellula. Mentre i progressi nei coloranti sensibili al calcio hanno permesso la robusta registrazione ottica della dinamica del calcio a singola cellula, la registrazione di robusti segnali di tensione ottica transmembrana è rimasta difficile. Probabilmente, questo è a causa del basso rapporto singolo/rumore, fototossicità, e fotosbiancamento di coloranti potentiometrici tradizionali. Pertanto, le misurazioni della tensione a cella singola sono state a lungo limitate alla tecnica di morsetto che, mentre lo standard d'oro, è tecnicamente impegnativa e bassa produttività. Tuttavia, con lo sviluppo di nuovi coloranti potentiometrici, grandi e veloci risposte ottiche ai cambiamenti di tensione possono essere ottenute con poca o nessuna fototossicità e fotosbiancamento. Questo protocollo descrive in dettaglio come isolare i miociti murini adulti che possono essere utilizzati per le misurazioni di accorciamento cellulare, calcio e tensione ottica. In particolare, il protocollo descrive come utilizzare un colorante di calcio ratiometrico, un colorante di calcio a singola eccitazione e un singolo colorante di tensione di eccitazione. Questo approccio può essere utilizzato per valutare la cardiotossicità e l'aritmia di vari agenti chimici. Mentre la fototossicità è ancora un problema a livello di singola cellula, la metodologia è discussa su come ridurla.
Introduzione
Al fine di studiare il cuore durante gli stati sani e patologici, è spesso utile esaminare il fenotipo a livello di singola cellula. Mentre i progressi scientifici hanno permesso la robusta misurazione della dinamica del calcio a singola cellula, le misurazioni della tensione ottica a singola cellula sono rimaste scarse1. Probabilmente, questo è a causa del basso rapporto segnale-rumore (SNR), fototossicità, e fotosbiancamento di tradizionali coloranti potentiometrici2,3. Ciò nonostante, i potenziali di azione ottica miocite isolati sono stati ottenuti2,3,4. Inoltre, con i progressi nella chimica e nella fisica dei coloranti sensibili alla tensione, la SNR è migliorata5. Le sonde potenziali di membrana più recenti (Tabella dei materiali) rispondono ai cambiamenti nel potenziale della membrana nei submillisecondi e hanno un intervallo di risposta fluorogenico di circa il 25% per 100 mV. Inoltre, l'eccitazione/emissione del kit potenziale di membrana (ad esempio, FluoVolt; Tabella dei materiali) utilizzato in questo protocollo funziona con le impostazioni standard dell'isotoniocianato (FITC) o delle proteine fluorescenti verdi (GFP)6.
Gli spettri di eccitazione/emissione FITC e GFP si sovrappongono agli spettri fluo-4 legati al calcio7. L'acquisizione simultanea di fotometria a fluorescenza con misurazioni della geometria cellulare digitale è stata tradizionalmente utilizzata per l'acquisizione simultanea di misurazioni di accorciamento cellulare e del calcio8. Questo protocollo descrive in dettaglio come isolare i miociti murini e come registrare i segnali di calcio o tensione utilizzando le impostazioni FITC standard. Inoltre, descrive come un semplice interruttore nei filtri di eccitazione/emissione sulla postazione di lavoro di imaging può essere utilizzato per ottenere le misurazioni del calcio e dell'accorciamento utilizzando il rapporto metrico del tintura di calcio fura-2. Rispetto al fluo-4, il fura-2 ha una maggiore affinità per il calcio ed è relativamente resistente al fotosbiancamento9. Di conseguenza, utilizzando un'unica postazione di lavoro questo protocollo consente un esame approfondito dell'accoppiamento di contrazione eccitazione-contrazione del miocito.
Protocollo
Tutti i metodi e le procedure descritti in questo protocollo sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) della Case Western Reserve University.
1. Preparazione di soluzioni, strumenti e coverlips
NOTA: 1x soluzioni possono essere utilizzate per un massimo di un mese.
- Fare 10x Krebs-Henseleit tampone HEPES buffer senza calcio (KHB-HB) con l'aggiunta di 68,96 g di NaCl, 3,57 g di KCl, 59,58 g di HEPES, 2,18 g di K2HPO4, 3,08 g di MgSO4 e 19,82 g di glucosio a 800 mL di acqua doppiettata in un pallone da 1.000 ml. Dopo che il contenuto è completamente sciolto, portare fino a volume in un flacone volumetrico da 1.000 ml.
NOTA: La soluzione tradizionale Krebs Henseleit utilizza il bicarbonato di sodio come buffer e la soluzione in questo protocollo utilizza la soluzione Krebs Henseleit con buffer HEPES. La soluzione è stabile per 6 mesi se sterile filtrato. - Rendere la soluzione di 10x Tyrode aggiungendo 86,51 g di NaCl, 0,552 g di NaH2PO4, 2,03 g di MgCl2, 9,91 g di glucosio, 4,03 g di KCl, 2,65 g di CaCl2e 35,76 g di HEPES a 800 mL di acqua doppia distillata in un pallone da 1000 mL. Dopo che il contenuto è completamente sciolto, portare fino a volume in un flacone volumetrico da 1000 ml.
NOTA: La soluzione è stabile per 6 mesi se sterile filtrato. - Fare 1x KHB-HB misurando 100 mL del brodo 10x e aggiungendo a 875 mL di acqua doppia distillata in un flacone da 1.000 mL. Mettere il flacone nel bagno d'acqua a 37 gradi centigradi. Una volta che la soluzione ha raggiunto i 37 gradi centigradi, utilizzare NaOH per aumentare il pH a 7,39. Dopo aver regolato il pH, portare la soluzione a volume in un flacone volumetrico da 1000 ml. Sterile filtrare la soluzione utilizzando un sistema di filtrazione sottovuoto.
- Crea la soluzione 1x Tyrode misurando 100 mL del brodo 10x e aggiungendo a 875 mL di acqua doppia distillata in un flacone da 1.000 mL. Mettere il flacone nel bagno d'acqua a 37 gradi centigradi. Una volta che la soluzione ha raggiunto i 37 gradi centigradi, utilizzare NaOH per aumentare il pH a 7,39. Dopo aver regolato il pH, portare la soluzione a volume in un flacone volumetrico da 1.000 ml. Filtro sterile utilizzando un sistema di filtrazione sottovuoto.
- Crea 1x modificata della soluzione di Tyrode misurando 100 mL del brodo 10x e aggiungendo a 875 mL di acqua doppia distillata in un flacone da 1.000 mL. Sciogliere 3,07 g di L-glutathione ridotto in fiaschetta. Mettere il flacone nel bagno d'acqua a 37 gradi centigradi. Una volta che la soluzione ha raggiunto i 37 gradi centigradi, utilizzare NaOH per aumentare il pH a 7,39. Dopo aver regolato il pH, portare la soluzione a volume in un flacone volumetrico da 1.000 ml. Sterile filtrare la soluzione utilizzando un sistema di filtrazione sottovuoto.
- Fare 100 mM di soluzione di scorta di blebbistatin aggiungendo 855 L di solforo dimetilo (DMSO) a 25 mg di polvere. Aliquota in incrementi di 20 l e conservare in un congelatore a -80 gradi centigradi per un massimo di sei mesi.
- Fare in modo che l'arresto buffer aggiungendo 2 g di albumina siero bovina (BSA) e 1 fiala di scarichetto di peliere e di 100 mL di 1x KHB-HB e filtro sterile della soluzione utilizzando un sistema di filtrazione a vuoto.
- Fare tampone di placcatura aggiungendo 5 mL di siero bovino fetale e 1 fiala dello stock di blebbistatin macchiato a 95 mL di M199 HEPES. Sterile filtrare la soluzione utilizzando un sistema di filtrazione sottovuoto.
- Fare buffer coltura miocite con l'aggiunta di una fiala 1 del brodo di blebbistatin e 4 mls penicillina-streptomycin a 396 mL di M199 (25 mHe HEPES). Sterile filtrare la soluzione utilizzando un sistema di filtrazione sottovuoto.
- Autoclave 2 paia di pinzette Dumont, 2 paia di forbici curve Iris, 2 hemostats, un paio di pinze chirurgiche plastiche, 6 suture di seta intrecciata nera 4-0 disposte per essere utilizzate come nodo chirurgico a doppio lancio e quattro becher da 100 mL.
- Sterilizzare 22 x 22 mm2 coperture in vetro. In primo luogo, posizionare una singola coverslip in ogni pozzo di un sei pozzetti. Successivamente, con il coperchio rimosso, accendere la lampada UV dell'armadio di biosicurezza ed esporre i copricoperture alla luce UV per 1 h.
- Rendere la soluzione di supporto laminale di lavoro scongelando prima la bottiglia sul ghiaccio. Aggiungere il contenuto di una bottiglia a un numero sufficiente di salina sterile con buffer di fosfato (PBS) per raggiungere una concentrazione finale di 0,04 mg/mL. Aliquota 1,3 l in tubi di centrifuga autoclavi da 1,5 ml. Conservare a -80 gradi centigradi.
NOTA: Ogni tubo ha abbastanza laminina per un singolo piatto a sei pozzetto. Evitare più cicli di congelamento del blocco. - Cappotto in vetcino sterilizzato scongelando prima la soluzione di laminina di lavoro sul ghiaccio. Utilizzando una pipetta P1000, aspirare 200 l di laminina. Trascinare delicatamente la punta della pipetta lungo un bordo della coverslip per consentire all'azione capillare di estrarre una minuscola quantità di lamina per facilitare l'attaccamento coverslip alla piastra sei pozzetti.
- Quindi, espellere la laminina rimanente al centro della coverslip. Con un movimento circolare, stendete la goccia di laminina sulla vesserata. Mettere in un'incubatrice di 37 gradi centigradi almeno 1 h e fino a 24 h prima dell'isolamento.
2. Preparazione del Langendorff Apparatus
NOTA: i singoli componenti dell'apparato Langendorff utilizzati in questo protocollo sono elencati nella Tabella dei materiali.
- Accendere il bagno d'acqua circolante. Impostare la temperatura in modo che il perfusate abbia una temperatura di 37 gradi centigradi.
NOTA: Con i serbatoi di soluzione impostati ad un'altezza di 60 cm, il parto in acqua circolante deve essere impostato a 41 gradi centigradi per far in modo che il perfusate sia di 37 gradi centigradi. A differenza dei protocolli precedentemente riportati, l'altezza del serbatoio non deve essere modificata. - Risciacquare l'apparato Langendorff con il 70% di etanolo seguito da due risciacquo con acqua a doppia distillata autoclata. Dopo il risciacquo, riempire il serbatoio con KHB-HB e ossigenare con ossigeno 100%.
- Prime il sistema permettendo a KHB-HB ossigenato di fluire per la prima volta in un becher da 100 mL. Una volta che 50 mL di soluzione è fluito nel becher, passare la posizione stop-cock a 3 vie per fermare il flusso dal serbatoio KHB-HB. Versare 50 mL di KHB-HB ossigenato dal becher nel serbatoio di collagenae.
- Lasciare lo scarico KHB-HB dal serbatoio di digestione fino a 5 mL rimane nel serbatoio di collagenae. Durante l'innesco serbatoio di collagenae, passare il cazzo arresto a 3 vie ripetutamente tra i serbatoi per consentire alle linee di degas. Dopo che il sistema è innescato, ricordarsi di utilizzare la trappola di degassamento situata sulla parte superiore della bobina di riscaldamento per consentire all'aria rimanente di uscire dal sistema.
- Rendere la soluzione collagenasi. Per i ratti combinano 100 mg di collagenae di tipo II, 100 mL di KHB-HB ossigenato e 2 fiale dello stock di blebbistain. Per i topi, combinare 100 mg di collagenasi di tipo II, 40 mL di KHB-HB ossigenato e 2 fiale dello stock di blebbistain. Una volta miscelata, la soluzione dovrebbe essere stabile per 1 h.
NOTA: La fattibilità dei miociti può variare tra i lotti di collagenasi di tipo II. Approfitta di un programma di campionamento di collagenasi per testare molto prima dell'ordine in blocco.
3. Isolamento dei miociti
- Iniettare all'animale 1.000 U di eparina. Attendere 5 min.
NOTA: È possibile utilizzare topi e ratti di qualsiasi età. Tuttavia, in generale l'animale più vecchio o più malato, minore è la resa dei miociti. - Sacrificare l'animale anestizzandolo con isoflurane utilizzando il metodo open-drop (1 cc di Isoflurane per volume 500 cc) prima di eutanasia l'animale con una miscela pentobarbitale (150 mg/kg intraperitoneale).
- Rapidamente eccitare il cuore afferrando prima la pelliccia sopra il processo xifoideo. Con le forbici iride, fare una piccola incisione immediatamente sotto il processo xifoide e tirare la pelliccia verso l'alto verso la testa esponendo la pelle.
- Afferrare il processo xifoideo e tagliare il diaframma esponendo la cavità toracica. Fare un'incisione porta trappola, tirare indietro lo sterno utilizzando un estrostato, e utilizzare le pinze curve per eccitare il cuore sopra l'aorta ascendente e posto in freddo KHB-HB.
- Cannula il cuore usando un microscopio stereo e le pinze numero 5. Assicurarsi che il cuore sia sommerso e che la cannula sia stata innescata prima dell'escissione cardiaca per prevenire gli emboli. Confermare il corretto posizionamento della cannula visualizzando la punta della cannula circa 1 mm sopra l'inserimento aortico nel ventricolo.
NOTA: più veloce è il tempo di conulazione, migliore è la resa del miocito. - Avviare il flusso di KHB-HB ruotando il tappo sul Langendorff. Collega la cannula al Langendorff. Confondere il cuore per 5 min.
NOTA: Poiché la perfusione è fornita da un sistema basato sulla gravità, il flusso attraverso il cuore sarà una funzione della conformità coronarica. - Passare alla perfusione dal serbatoio KHB-HB al serbatoio del tampone di digestione. Una volta che il buffer di digestione raggiunge il cuore, impostare un timer (5 min per il topo o 15 min per il ratto). Assicurarsi di raccogliere il perfusate in uno sterile becher da 100 mL. Ricaricare il serbatoio del buffer di digestione in base alle esigenze con il perfusate fino alla scadenza del tempo di digestione.
- Dopo la digestione, separare le camere del cuore con le pinze e le forbici dell'iride in uno sterile becher da 100 mL. Mettere ogni camera in un pozzo separato di un piatto di sei pozze. Versare 5 mL di soluzione di collagenasi in ogni pozzo.
- Iniziare immediatamente a mincing il tessuto cardiaco utilizzando le forbici. I pezzi di tessuto devono essere di circa 1 mm3. Utilizzando sterili pipette di trasferimento, triturare delicatamente il tessuto cardiaco macinato. La soluzione dovrebbe diventare nuvolosa.
- Una volta che i pezzi di tessuto diventano bianchi e piumati, esaminare le cellule utilizzando un microscopio invertito. Se il numero di cellule vitali è superiore all'80%, procedere a filtrare le cellule in un tubo conico da 50 mL utilizzando un colino cellulare di 100 m. Utilizzare un tubo e un colino diversi per ogni camera del cuore.
- Se il numero di cellule vitali è inferiore all'80%, controllare il tempo necessario per cannulare. Se il tempo di canonulazione è superiore a 5 min, provare un altro cuore. In caso contrario, risalutar nuovi lotti di collagenasi attraverso il programma di campionamento del collagena.
- Pellet le cellule da centrifugiare a 215 x g per 2 min. Il pellet deve essere compatto e non sciolto. Se il pellet è allentato, la preparazione contiene molte cellule morte. In un cofano di coltura tissutale, risospendere il pellet in 10 mL di arresto tampone.
- Pellet le cellule da centrifugiare a 215 x g per 2 min. Il pellet deve essere compatto e non sciolto. Se il pellet è allentato, la preparazione contiene molte cellule morte.
- Risospendere le celle in 5 mL di tampone di placcatura. Eseguire un conteggio delle celle. Regolare i millilitri di tampone di placcatura per raggiungere una concentrazione finale di miociti di 2 x 104 cellule per mL.
- Togliere i coperchi rivestiti di laminina dall'incubatrice. Aspirare la goccia di laminin.
- Piastra 200 -L di sospensione miocyte su ogni coverslip. Mettere in un incubatore di 37 gradi centigradi (21% O2, 5% CO2)per 2 h per consentire l'attaccamento. Dopo 2 h, aspirare le celle non attaccate, aggiungere 2 mL di supporti di coltura e coltura per un massimo di 4 giorni.
4. Fura-2 Caricamento coloranti
- Fare una soluzione di stock da 2 mm fura-2 acetoxymethyl ester (fura-2 AM) aggiungendo 25 -L di DMSO a 50 g di polvere di fura-2 AM (1 fiala). Aliquota in 6 aliquote ll. Prendere 1 aliquota di fura-2 AM e aggiungere a 6 mL di mezzo di placcatura. Vortice da mescolare.
- Rimuovere 1 sei pozzetto di miociti dall'incubatrice. Media aspirati. Aggiungere 1 mL di miscela di supporti fura-2 ad ogni pozzo. Coprire la piastra con un foglio, lasciare la piastra a temperatura ambiente e attendere 15 min.
- Aspirate miscela di supporti e aggiungere 1 mL della soluzione di Tyrode ad ogni pozzo. Coprire con un foglio. Attendere 20 min a temperatura ambiente per consentire il lavaggio dei tini prima dell'imaging.
5. Caricamento dye Fluo-4
- Fare una soluzione di riserva di 1,82 mM di fluo-4 acetoxymethyl ester (fluo-4 AM) aggiungendo 25 L di DMSO a 50 g di polvere di fluo-4 AM (1 fiala). Aliquota in 8.333 l'aliquota. Prendere 1 aliquota di scorta di fluo-4 AM e aggiungere a 6 mL di mezzo di placcatura. Vortice da mescolare.
- Rimuovere 1 sei pozzetto di miociti dall'incubatrice. Media aspirati. Aggiungere 1 mL di miscela di sfumino-4 AM ad ogni pozzo. Coprire la piastra con un foglio, lasciare la piastra a temperatura ambiente e attendere 15 min.
- Aspirate miscela di supporti fluo-4 AM e aggiungere 1 mL della soluzione di Tyrode ad ogni pozzo. Coprire con un foglio. Attendere 20 min a temperatura ambiente per consentire il lavaggio dei tini prima dell'imaging.
6. Caricamento del potenziale della membrana
- Rimuovere il componente A e il componente B dal kit potenziale della membrana. In un tubo conico da 15 mL, unire 50 -L del componente B e 5 l del componente A. Vortex da mescolare. Aggiungere 10 mL di supporto di placcatura al tubo conico da 15 mL contenente la miscela di colorante di tensione. Vortice da mescolare.
- Rimuovere 1 sei pozzetto di miociti dall'incubatrice. Aspirare i media. Aggiungete 800 l della miscela di tintura potenziale della membrana ad ogni pozzo. Coprire la piastra con un foglio, lasciare la piastra a temperatura ambiente e attendere 15 min.
- Aspirare miscela di supporti coloranti e aggiungere 1 mL di soluzione modificata-Tyrode ad ogni pozzo. Coprire con un foglio.
7. Fotometria e carica Registrazioni dispositivo accoppiato
- Accendere l'apparecchiatura nel seguente ordine: microscopio, lampada ad arco, iperinterruttore, sistema di interfaccia a fluorescenza, alimentazione Myocam, stimolatore sul campo e computer.
- Assicurarsi che i set di filtri di eccitazione/emissione siano appropriati per il tinrito di imaging.
NOTA: Fura-2 è entusiasta a 340 nm e 380 nm di luce. Emette a 510 nm di luce. Fluo-4 e il coloranti a membrana di tensione sono entusiasti a 485 nm di luce ed emettono a 520 nm di luce. - Prime il sistema accendendo il vuoto, aprendo completamente il morsetto del tubo flessibile e immergendo delicatamente ogni siringa da 60 mL utilizzata nel collettore. Per le registrazioni di calcio utilizzare la soluzione di Tyrode. Per le registrazioni di tensione utilizzare la soluzione di Tyrode modificata.
- Accendere il riscaldatore e impostare il flusso regolando il morsetto del rullo sul tubo perfusione. Effettuare registrazioni a 36 x 1 gradi centigradi.
- Aprire il software di acquisizione. Assicurarsi che i parametri siano impostati per il tinrito di imaging corretto.
- Al buio, rimuovere la pellicola dalla piastra sei pozzo e posizionare un coperchio nella camera di stimolazione. Assicurarsi che lo stimolatore sia spento durante questo passaggio. Concentrati sui miociti usando l'obiettivo 10x.
- Una volta a fuoco, iniziare a camminare stimolando il campo a 1 Hz, 0,2 V. Aumentare gradualmente la tensione fino a ottenere il ritmo 1:1. Quindi aumentare la tensione fino a 1,5x viene raggiunta la soglia.
NOTA: Poiché l'accoppiamento di contrazione eccitazione dipende dalla temperatura, assicurarsi che le cellule siano state perfuse per 15 min prima della registrazione. Questo permette ai miociti di riprendersi dallo shock di passare dalla temperatura ambiente a 37 gradi centigradi, così come le cellule vagamente attaccate a galleggiare via. - Passare dall'obiettivo 10x all'obiettivo 40x. Concentrarsi su una cella che segue una stimolazione 1:1. Regolare le sfumature di plastica in modo che solo una cella sia nel campo visivo.
- Utilizzando il software, posizionare l'area di interesse box su sarcomere ben definiti. Avviare il software di acquisizione per avviare la luce di eccitazione. Utilizzando i filtri a densità neutra, regolare di conseguenza l'impostazione dell'intensità per ottenere un SNR adeguato.
Risultati
Figura 1A mostra l'apparato Langendorff. L'ossigenatore si trova nel serbatoio KHB-HB. La soluzione di collagenasi è nel serbatoio di siringa da 60 mL centrale. La linea di degassamento è collegata al serbatoio di siringa vuoto da 60 mL. Dopo un isolamento di successo, la maggior parte delle cellule dovrebbe essere a forma di asta e striated. Sotto un obiettivo 40x, la maggior parte dei miociti dovrebbe avere striature chiare visibili. Figura 1B,C mostra esempi di miociti di ratto sani. Una volta isolate, le cellule possono essere coltivate fino a 4 giorni mantenendo la loro morfologia e le proprietà elettriche.
Per misurare l'accoppiamento eccitazione-contrazione, le cellule vengono poi collocate in una camera di stimolazione riscaldata. Poiché i miociti sono sensibili ai cambiamenti di temperatura, è importante consentire al coperchio di eclacazione per 15 min nella camera prima della registrazione. Per le registrazioni di fluorescenza, la lunghezza d'onda dell'eccitazione è generata da una lampadina ad arco xeno da 75 W. Le lampadine Xenon-arc producono uno spettro luminoso che imita la luce solare naturale. L'intensità della luce e la lunghezza d'onda sono controllate da filer di densità/emissione neutri. La luce di eccitazione passa poi attraverso l'obiettivo al miocito. La lunghezza d'onda di emissione viene quindi raccolta da un tubo fotomoltiplicatore. Utilizzando il sistema qui descritto, sia i filtri di eccitazione che quelli di emissione devono essere modificati manualmente.
L'accorciamento, d'altra parte, è ottenuto da un sensore di dispositivo accoppiato a carica. Misurando in tempo reale fino a 1.000 volte al secondo, il software di acquisizione esegue una media delle linee all'interno di un'area di interesse per creare un modello di striatura ben risolto. Viene quindi calcolata una trasformazione Fourier veloce (FFT). Il picco all'interno dello spettro di potenza rappresenta la spaziatura media dei sarcomeri. I cambiamenti nella spaziatura del sarcomere durante la stimolazione vengono quindi tracciati e successivamente quantificati.
La figura 2 mostra le tracce di calcio e accorciamento registrate da un miocito di topo C57/B6 caricato con il colorante di calcio fura-2. Il protocollo di stimolazione è una modifica dei protocolli di stimolazione descritti in precedenza10,11. I miociti di topi sani dovrebbero essere in grado di essere sostenuti alla loro frequenza cardiaca a riposo di 10 Hz. La figura 3 è la quantificazione dei dati medi approfonditi ottenuti da un topo C57/B6 e dalle loro cucciolate transgeniche (TG) che hanno avuto una mutazione puntiforme introdotta in un canale di potassio. Si noti che non c'è differenza tra i gruppi tranne che per il tempo di rilassamento a 10 Hz stimolazione.
A differenza del fura-2, che è un coloranti a doppia eccitazione, il colornte di tensione e il fluo-4 sono coloranti di eccitazione a singola lunghezza d'onda la cui attività di eccitazione/emissione con lo spettro standard di eccitazione ed emissione FITC (494/506 nm). Pertanto, le registrazioni di accorciamento di calcio e sarcomero o tensione e riduzione sarcomere possono essere ottenute utilizzando questo set di filtri.
Figura 4A mostra una traccia di tensione registrata da un miocito del mouse C57/B6 ritmo a 10 Hz. Rispetto ai segnali di calcio, le tracce di tensione a singola cellula sono più piccole in ampiezza e hanno bisogno di post-elaborazione per ottenere un segnale utilizzabile. Figura 4B mostra un potenziale di azione media complessa (AP) realizzato dai PA in Figura 4A. Figura 4C,D mostra un AP media complessa dopo un passaggio basso Butterworth o un filtro digitale Savitzky-Golay è stato applicato. È necessario prestare attenzione quando si filtra il segnale per non distorcere i dati reali. Si notino le sottili differenze nella forma dei punti di accesso nella figura 4B-D.
Figura 5 Mostra tracce registrate da miociti ratto ritmo a 1 Hz. Oltre al segnale di tensione inferiore al segnale di calcio, anche la cinetica di contrazione è diversa. Questo perché i coloranti di calcio tamponano il calcio mentre i coloranti di tensione non lo fanno.
Come per il calcio transitorio (Figura 3), i miociti hanno dimostrato cambiamenti dipendenti dal ritmo nella loro durata potenziale di azione ottica (APD) e (Figura 6). Mentre le tracce di fura-2 sono state raggruppate in media prima di essere quantificate, le tracce di tensione sono state filtrate con un filtro di levigatura polinomiale Savitzky-Golay (larghezza 5, ordine 2) prima di essere ingenere mediate e quantificate.
Come quantificato nella Figura 6 e Figura 7, oltre a dimostrare i cambiamenti indotti dal ritmo nell'APD, hanno anche dimostrato il prolungamento indotto dall'AP indotto da farmaci. A 4 Hz di stimolazione, il blocco dipendente dalla concentrazione della corrente transitoria verso l'esterno(i to) con 4-aminopiridina ha provocato il prolungamento dell'APD.
Infine, occorre prestare attenzione per evitare la citotossicità. Figura 8 è gli ultimi 11 s di una registrazione 20 s. Indicato dalle frecce rosse in Figura 8, l'esposizione prolungata dei miociti alla luce blu porta all'attività innescata.

Figura 1: Apparato Langendorff a pressione costante. (A) L'Apparato Langendorff con ogni componente etichettato in caratteri bianchi. (B) I miociti di ratto Sprague-Dawley isolati sono stati osservati attraverso un obiettivo di 10 volte. (C) Miociti di ratto isolati visti attraverso un obiettivo 40x. Fare clic qui per visualizzare una versione più grande di questa figura.
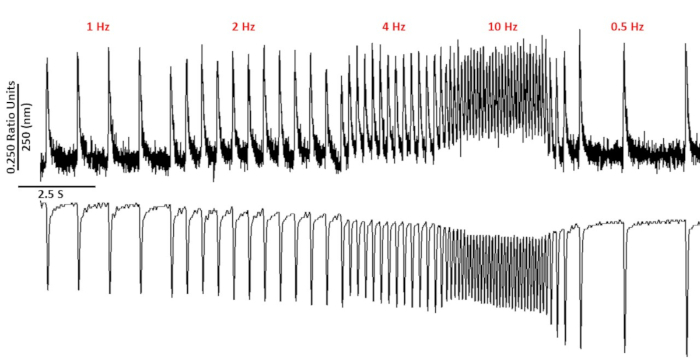
Figura 2: Tracce di accorciamento di calcio e sarcomere rappresentative registrate da mioycte C57/B6 che utilizzano fura-2. Calcium e sarcomere accorciano le tracce registrate a 1, 2, 4, 10, 0,5 e 0,75 Hz.
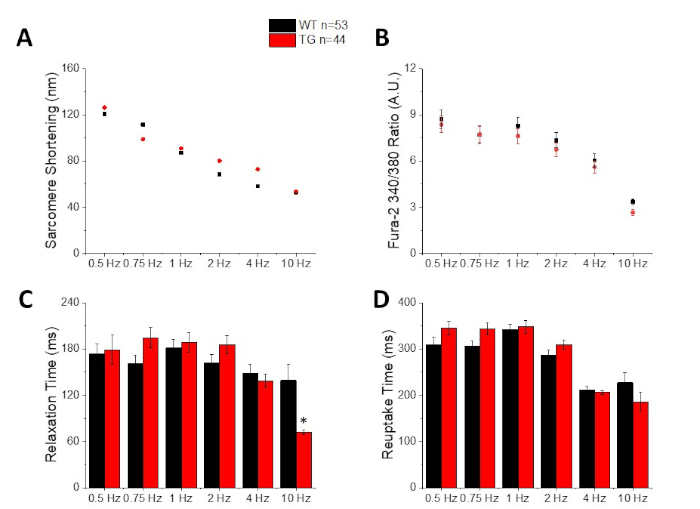
Figura 3: Quantificazione dell'accorciamento dei sarcomeri, calcio di picco, tempo di rilassamento e tempo di ripresa registrati da un tipo selvatico C57/B6 (WT) e topi transgenici (TG). (A) Riduzione dei sarcomeri. (B) Calcio di picco. (C) Tempo di rilassamento definito come 90% ritorno alla linea di base della traccia di accorciamento. (D) Il tempo di ripresa definito come 90% torna alla linea di base della traccia di calcio. Fare clic qui per visualizzare una versione più grande di questa figura.
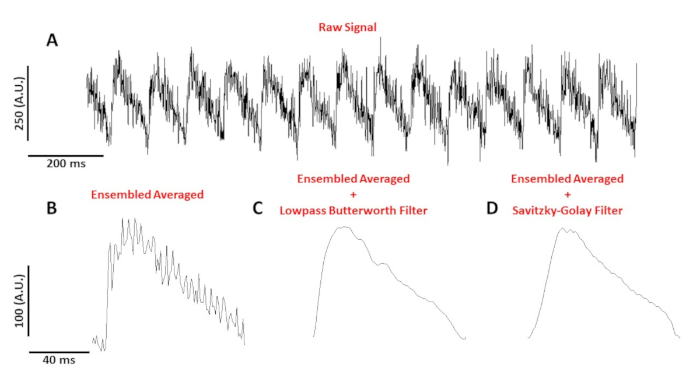
Figura 4: Potenziale di azione ottica registrato da un miocito del mouse C57/B6 ritmo a 10 Hz. (A) Traccia non filtrata di 1 secondo. (B) Complesso mediato potenziale di azione ottica. (C) Ensembled ha mediato il potenziale di azione ottica dopo l'applicazione di un filtro Butterworth lowpass. (D) Ensembled ha mediato il potenziale di azione ottica dopo l'applicazione di un filtro di levigazione polinomiale Savitzky-Golay. Fare clic qui per visualizzare una versione più grande di questa figura.
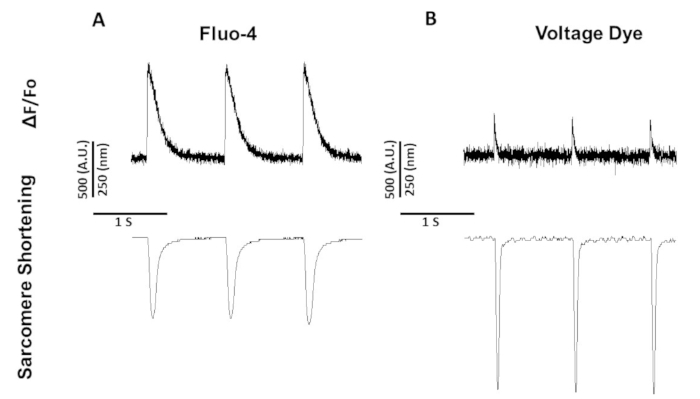
Figura 5: Le tracce di accorciamento di calcio, tensione e sarcomero rappresentative registrate dai miociti di ratto Sprague-Dawley hanno oscillato a 1 Hz. (A) Le tracce di accorciamento del calcio e del sarcomere registrate a 1 Hz con fluo-4. (B) Le tracce di accorciamento di tensione e sarcomere registrate a 1 Hz di stimolazione utilizzando il tintura di tensione. Fare clic qui per visualizzare una versione più grande di questa figura.
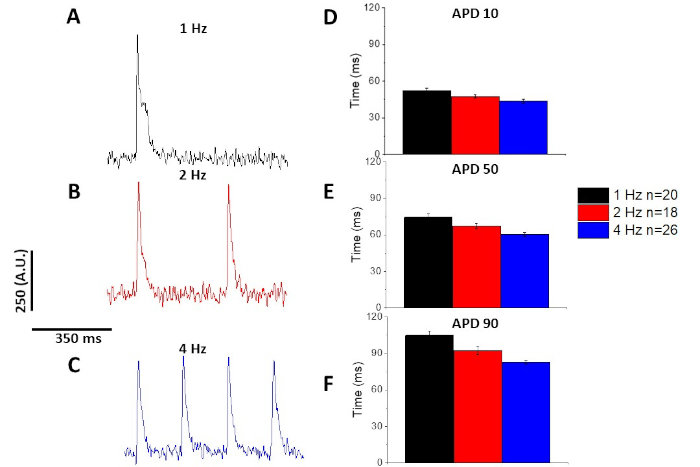
Figura 6: I potenziali di azione ottica registrati dai miociti di ratto Sprague-Dawley hanno oscillato a 1, 2 e 4 Hz di ritmo. (A) Traccia filtrata registrata a 1 Hz di stimolazione. (B) Traccia filtrata registrata a 2 Hz di stimolazione. (C) Traccia filtrata registrata a 4 Hz di stimolazione. (D) Durata potenziale d'azione 10, misurata come 10% di ritorno al basale. (E) Durata potenziale d'azione 50, misurata come 50% di ritorno al basale. (F) Durata potenziale d'azione 90, misurata come 90% di ritorno al basale. Fare clic qui per visualizzare una versione più grande di questa figura.
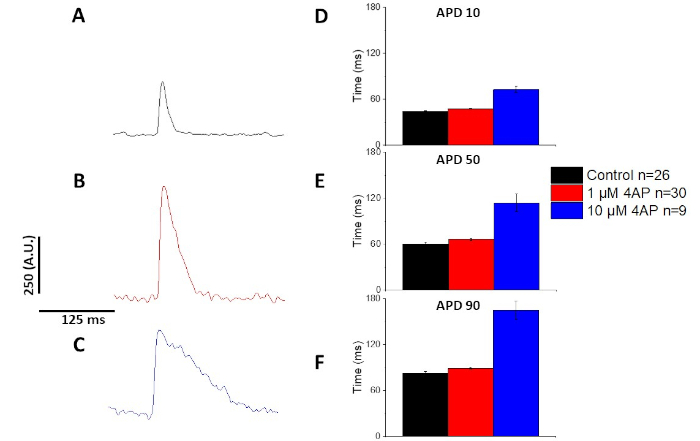
Figura 7: Gli effetti della 4-aminopirridina sui potenziali di azione ottica del ratto Sprague-Dawley registrati a 4 Hz di stimolazione. (A) Ensembled traccia media registrata a 4 Hz stimolazione senza 4-Aminopirridina nella soluzione. (B) Ensembled traccia media registrata a 4 Hz stimolazione con 1 M 4-Aminopyridine nella soluzione. (C) Ensembled traccia media registrata a 4 Hz stimolazione con 10 M 4-Aminopyridine nella soluzione. (D) Durata potenziale d'azione 10, misurata come 10% di ritorno al basale. (E) Durata potenziale d'azione 50, misurata come 50% di ritorno al basale. (F) Durata potenziale d'azione 90, misurata come 90% di ritorno al basale. Fare clic qui per visualizzare una versione più grande di questa figura.
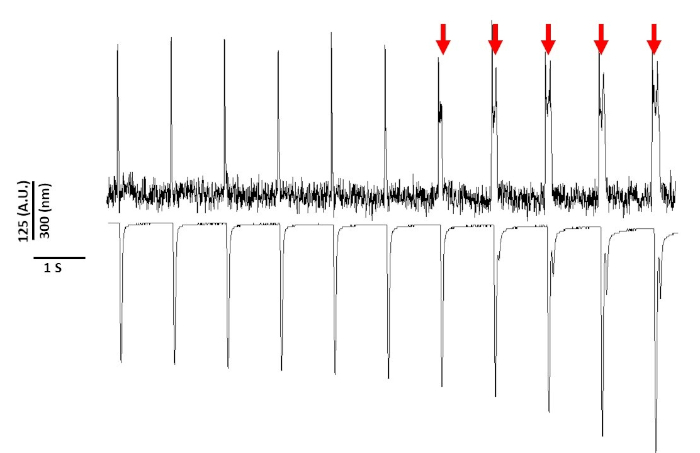
Figura 8: Colorante di tensione indotto fototossicità in Sprague-Dawley ratto miociti dopo 20 s di esposizione continua alla luce. Le frecce rosse indicano eventi citotossici. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Essere in grado di isolare i miociti cardiaci è un metodo potente che può essere utilizzato per comprendere la fisiologia cardiaca, la patologia e la tossicologia. Nel protocollo di cui sopra, abbiamo descritto un metodo che utilizza una pressione di gravità costante apparato Langendorff per ottenere single cardiaco miociti. Successivamente, utilizzando il sistema di fotometria a fluorescenza, descriviamo come acquisire contemporaneamente calcio e accorciamento o tensione e accorciamento delle tracce.
A causa delle diverse cinetiche tra coloranti di calcio, è necessario prestare attenzione a quale colorante selezionare. Per questo protocollo, sia il fura-2 che il fluo-4 utilizzati sono stati progettati con gli esteri AM che richiedono un passo di lavaggio per consentire agli ariedi intracellulari il tempo di fendere il gruppo AM e intrappolare il colorante nella cella. Mentre sia fura-2 che fluo-4 sono considerati coloranti di calcio ad alta affinità, il Kd per fura-2 è 145 nM rispetto al 345 nM per fluo-49. Inoltre, il fura-2 è ratiometrico. Per questo motivo, può essere utilizzato per quantificare i livelli di calcio intracellulare9,12. Fluo-4 d'altra parte è una sonda di calcio a singola onda. Il vantaggio di utilizzare fluo-4 è che produce un segnale di fluorescenza più luminoso. Indipendentemente dal tinrito di calcio utilizzato, rispetto al tinrito di calcio, sonde di tensione a membrana hanno un SNR inferiore.
Come illustrato nella Figura 4 e Figura 5, le tracce di tensione rispetto alle tracce di calcio sono più piccole in ampiezza. Utilizzando il filtro di traccia digitale del software, è possibile aumentare il SNR e quantificare i dati (Figura 4 e Figura 7). Una volta quantificati, sia i transitori di calcio che gli APO ottici dimostrano la restituzione, accorciandone la durata a frequenze di ritmo più veloci (Figura 2, Figura 3, Figura 6e Figura 7). API più brevi durante i cicli di stimolazione più veloci sono necessari per concedere tempo sufficiente per il riempimento ventricolare durante la diastole. Si ritiene che le alterazioni di questo fenomeno siano indicative di un aumento del rischio di arrythmias13,14,15,16. Mentre le alterazioni in APD possono essere causate da malattia, possono anche essere causate da sostanze chimiche. Come mostrato nella Figura 7, quando la corrente di potassio murina dominante, da Ia, è bloccata, l'APD ottico diventa più lungo.
Tuttavia, come riportato in precedenza con coloranti sensibili alla tensione, l'intensità della luce e la durata possono alterare l'APD2,5,17. Si ritiene che questo sia il risultato della generazione di specie ossidative reattive (ROS)5. In precedenza, è stato dimostrato che l'aggiunta di antiossidanti alla soluzione di registrazione può prevenire la tensione sensibile al citotossicità del citotossicisia5. Di conseguenza, abbiamo aggiunto l'antiossidante L-glutathione (10 mM), alla soluzione di Tyrode. Nella Figura 8 sono riportate le ultime 11 s di una registrazione di 20 s ottenuta a 1 Hz di stimolazione. Come indicato dalle frecce rosse, le alterazioni nell'APD non si sono verificate fino a 15 s nella registrazione; pertanto, mentre la soluzione di Tyrode modificata non ha impedito la fototossicità, ha ritardato significativamente. Utilizzando la soluzione di Tyrode modificata, utilizzando un'impostazione di bassa intensità luminosa e mantenendo la durata della registrazione a meno di 5 s, è possibile evitare qualsiasi alterazione indotta dal tinto nell'APD. Questo è importante perché senza fare attenzione a evitare la fototossicità, i dati potrebbero essere erroneamente interpretati come causa precoce o ritardata dopo la depolarizzazione. Oltre a limitare l'esposizione alla luce blu, ci sono ulteriori precauzioni che possono essere prese per prevenire un'errata interpretazione dei dati.
Il primo è quello di registrare solo da celle che seguono uno a uno stimolazione e hanno una lunghezza sarcomere a riposo maggiore o uguale a 1,75 m. Il taglio di 1,75 m è tratto dall'osservazione di Gordon et al.18 che la tensione diminuisce rapidamente una volta che la lunghezza del sarcomero è inferiore a tale importo. Tuttavia, alcune patologie possono provocare alterazioni significative nella lunghezza del sarcomere a riposo. Per essere sicuri che il fenotipo sia reale e non un artefatto dell'isolamento, devono essere adottati i seguenti approcci di tiro a fuoco problematici.
Se i miociti non seguono costantemente il ritmo 1:1, hanno lunghezze di sarcomero inferiori a 1,75 m, sbiancamento di membrana pesante, o non sopravvivono all'isolamento, la prima cosa da controllare è il tempo necessario per cannulare il cuore. Più lungo è il tempo di connolazione, minore sarà la resa. Se è necessario un lungo tempo di concanonazione, la vitalità può essere migliorata posizionando il cuore in una soluzione cardioplegica19. Ciò nonostante, perché il collagenasi è un enzima, l'attività e la specificità di un lotto specifico cambiano nel tempo. Se i rendimenti complessivi si aggravano progressivamente nonostante i buoni tempi di conservificazione, nuovi lotti dovrebbero essere stilati. Mentre il nostro protocollo è stato ottimizzato per le registrazioni a 5 s, se sono necessarie tracce di tensione più lunghe, sarà necessario acquistare ulteriori filtri di densità neutra. Il sistema descritto nel protocollo è dotato di filtri a densità neutra che riducono la luce trasmessa del 37%, 50%, 75%, 90% e 95%.
In sintesi, abbiamo descritto una metodologia che ha permesso l'isolamento di miociti ventricolari murini adulti che sono stati utilizzati per le misurazioni di accorciamento di calcio, tensione e sarcomero.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Dana Morgenstern per un'attenta correzione a bozze del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.25 Liter Water Jacketed Reservoir | Radnoti, LLC | 120142-025 | |
| 1 liter volumetric flask | Fisher Scientific | 10-205F | |
| 100 ml beaker | Fisher Scientific | FB-100-100 | |
| 100 ml graduated cylinder | Fisher Scientific | 08 562 5C | |
| 1000 ml flask | Fisher Scientific | FB-500-1000 | |
| 2-Bar Lab Stand with Stabilizer Bar and 24" Stainless Steel Rods | Radnoti, LLC | 159951-2 | |
| 4-Aminopyridine | Sigma-Aldrich | 275875 | |
| 40X Oly UApo/340 Non-Immersion Objective (NA 0.9, WD 0.2mm) | IonOptix | MSCP1-40 (b) | |
| 60-mL syringe, BD Luer-Lok tip | BD | 309650 | |
| Aortic Metal Cannulae | Harvard Apparatus | 73-0112 | |
| Bovine Serum Albumin | Fisher Scientific | BP9703-100 | |
| C-6 Standard Heating Circulator | Chemyx | A30006 | |
| CaCl2 | Fisher Scientific | BP510500 | |
| Cell framing adapter | IonOptix | CFA300 | |
| CellPr0 Vacuum Filtration System, 1 liter, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V100022 | |
| CellPro Vacuum Filtration System, 250mL, 0.22µm,Cs/12 | Labratory Product Sales, Inc | V25022 | |
| CellPro Vacuum Filtration System, 500mL, 0.22µm,12/CS | Labratory Product Sales, Inc | V50022 | |
| CMC (mTCII) Temp Control w/ inline flow heater | IonOptix | TEMPC2 | |
| Cole-Parmer Large-bore 3-way, male-lock, stopcocks | Cole-Parmer | EW-30600-23 | |
| Cole-Parmer Luer fittings, Large-bore stopcocks, male lock, 4-way | Cole-Parmer | EW-30600-12 | |
| Cole-Parmer Stopcocks with Luer Connections; 1-way; male slip | Cole-Parmer | EW-30600-01 | |
| Collagenase Type II | Worthington | LS004177 | |
| Corning Sterile Cell Strainers | Fisher Scientific | 07-201-432 | |
| Dell Optiplex 790 mini-tower, 4G RAM, 250G HD, Windows 7 Pro | IonOptix | CPUD7M | |
| DMSO | Fisher Scientific | 50980367 | |
| Dumont Tweezers Style 5 | Amazon | B00F70ZDEQ | |
| FHD Rapid Change Stimulation Chamber | IonOptix | FHDRCC1 | |
| Fluo-3/4 Optics Package | IonOptix | IonOP-Fluo | |
| Fluorescence system interface – (w PCI-I/O card) | IonOptix | FSI700 | |
| Gibco Penicillin-Streptomycin (10,000 U/mL) | Fisher Scientific | 15-140-122 | |
| Glucose | Fisher Scientific | D16-1 | |
| Hemostat, Curved 5-1/2" | Amazon | B00GGAAPD0 | |
| HEPES | Fisher Scientific | BP310500 | |
| HyperSwitch dual excitation light source | IonOptix | HSW400 | |
| Inverted Motic Fluorescence Microscope | IonOptix | MSCP1-40 (a) | |
| IonWizard Core + Analysis | IonOptix | IONWIZ | |
| Iris Scissors, curved | Amazon | B018KRRMY6 | |
| K2HPO4 | Fisher Scientific | P288-100 | |
| KCl | Fisher Scientific | BP3661 | |
| L-Glutathione reduced | Sigma-Aldrich | G4251 | |
| LOOK Silk Spool, Black Braided, 4-0, 100yds | SouthernAnesthesiaSurgical Inc. | SP116-EA | |
| M199 Media | Fisher Scientific | 12 340 030 | |
| MgCl2 | Fisher Scientific | MP021914215 | |
| MgSO4 | Fisher Scientific | BP2131 | |
| MyoCam-S Digital CCD video system | IonOptix | MCS100 | |
| MyoPacer Field Stimulator | IonOptix | MYP100 | |
| NaCl | Fisher Scientific | BP358212 | |
| NaH2PO4 | Fisher Scientific | 56-754-9250GM | |
| Oxygenator Bubbler with Fluid Inlet for 0.25 Liter | Radnoti, LLC | 140143-025 | |
| Photomultiplier sub-system | IonOptix | PMT400 | |
| PMT Acquisition add-on | IonOptix | PMTACQ | |
| Radnoti Heating Coil 5 mL with Degasing Trap | Radnoti, LLC | 158830 | |
| Ring Clamp 60 – 80mm Dia. for 250ml Reservoir | Radnoti, LLC | 120141-025 | |
| Ring Clamp for Bubble Trap Compliance Chamber | Radnoti, LLC | 120149RC | |
| Saint-Gobain ACF000010 5/32 in.9/32 in. | Fisher Scientific | 14-171-214 | |
| Saint-Gobain ACF000013 3/16 in.3/8 in. | Fisher Scientific | 14-171-217 | |
| Saint-Gobain ACF000016 1/4 in.5/16 in. | Fisher Scientific | 14-171-219 | |
| Saint-Gobain ACF000025 5/16 in.5/8 in. | Fisher Scientific | 14-171-226 | |
| Saint-Gobain ACF00003 1/16 in.3/16 in. | Fisher Scientific | 14-171-209 | |
| Saint-Gobain ACF00005 1/16 in.3/32 in. | Fisher Scientific | 14-171-210 | |
| Saint-Gobain ACF00009 5/32 in.7/32 in. | Fisher Scientific | 14-171-213 | |
| Sarcomere Length Recording add-on | IonOptix | SARACQ | |
| T/C Adson Tissue Platic Surgery Forceps 4.75" | Amazon | B00JDWRBGC | |
| VETUS Anti-Static Curved Tip Tweezers | Amazon | B07QMZC94J | |
| Vistek 3200 Motic Vibration Isolation Platform | IonOptix | ISO100 |
Riferimenti
- Hagen, B. M., Boyman, L., Kao, J. P., Lederer, W. J. A comparative assessment of fluo Ca2+ indicators in rat ventricular myocytes. Cell Calcium. 52 (2), 170-181 (2012).
- Schaffer, P., Ahammer, H., Muller, W., Koidl, B., Windisch, H. Di-4-ANEPPS causes photodynamic damage to isolated cardiomyocytes. Pflügers Archiv: European Journal of Physiology. 426 (6), 548-551 (1994).
- Hardy, M. E., Lawrence, C. L., Standen, N. B., Rodrigo, G. C. Can optical recordings of membrane potential be used to screen for drug-induced action potential prolongation in single cardiac myocytes. Journal of Pharmacological and Toxicological Methods. 54 (2), 173-182 (2006).
- Tian, Q., et al. Optical action potential screening on adult ventricular myocytes as an alternative QT-screen. Cellular Physiology and Biochemistry. 27 (3-4), 281-290 (2011).
- Warren, M., et al. High-precision recording of the action potential in isolated cardiomyocytes using the near-infrared fluorescent dye di-4-ANBDQBS. The American Journal of Physiology-Heart and Circulatory Physiology. 299 (4), 1271-1281 (2010).
- FluoVolt™ Membrane Potential Kit. ThermoFisher Scientific Available from: https://assets.thermofisher.com/TFS-Assets/LSG/manuals/MAN0009668_FluoVolt_Membrane_Potential_Kit_UG.pdf (2018)
- Fluorescence SpectraViewer. ThermoFisher Scientific Available from: https://www.thermofisher.com/us/en/home/life-science/cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html (2019)
- Paredes, R. M., Etzler, J. C., Watts, L. T., Zheng, W., Lechleiter, J. D. Chemical calcium indicators. Methods. 46 (3), 143-151 (2008).
- Davis, J., et al. Diastolic dysfunction and thin filament dysregulation resulting from excitation-contraction uncoupling in a mouse model of restrictive cardiomyopathy. The Journal of Molecular and Cellular Cardiology. 53 (3), 446-457 (2012).
- Ren, J., Davidoff, A. J. Diabetes rapidly induces contractile dysfunctions in isolated ventricular myocytes. The American Journal of Physiology. 272, 148-158 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Goldhaber, J. I., et al. Action potential duration restitution and alternans in rabbit ventricular myocytes: the key role of intracellular calcium cycling. Circulation Research. 96 (4), 459-466 (2005).
- Weiss, J. N., et al. The dynamics of cardiac fibrillation. Circulation. 112 (8), 1232-1240 (2005).
- Baher, A., et al. Short-term cardiac memory and mother rotor fibrillation. The American Journal of Physiology-Heart and Circulatory Physiology. 292 (1), 180-189 (2007).
- Kleber, A. G., Rudy, Y. Basic mechanisms of cardiac impulse propagation and associated arrhythmias. Physiological Reviews. 84 (2), 431-488 (2004).
- McPheeters, M. T., Wang, Y. T., Werdich, A. A., Jenkins, M. W., Laurita, K. R. An infrared optical pacing system for screening cardiac electrophysiology in human cardiomyocytes. PLoS ONE. 12 (8), 0183761 (2017).
- Gordon, A. M., Huxley, A. F., Julian, F. J. The variation in isometric tension with sarcomere length in vertebrate muscle fibres. The Journal of Physiology. 184 (1), 170-192 (1966).
- Li, Y., et al. Three Preservation Solutions for Cold Storage of Heart Allografts: A Systematic Review and Meta-Analysis. The Journal of Artificial Organs. 40 (5), 489-496 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon