A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أحادي ة الحرمان البصري والبصري قياس الدونة الهيمنة في القشرة البصرية الابتدائية الماوس
* These authors contributed equally
In This Article
Summary
هنا ، نقدم بروتوكولات مفصلة للحرمان البصري الأحادي وتحليل اللدونة الهيمنة العين ، وهي طرق مهمة لدراسة الآليات العصبية لللدونة البصرية خلال الفترة الحرجة وآثار جينات محددة على التنمية البصرية.
Abstract
الحرمان البصري الأحادي هو نموذج تجريبي ممتاز للحث على اللدونة الاستجابة القشرية البصرية الأولية. بشكل عام ، فإن استجابة القشرة للعين الكامنية للتحفيز أقوى بكثير من استجابة العين الباسيفية في الجزء المناظير من قشرة الفأر البصرية الأولية (V1). خلال الفترة الحرجة الثدييات، خياطة العين المتطابقة سيؤدي إلى فقدان سريع للاستجابة من خلايا V1 لتحفيز العين المتطابقة. مع التطور المستمر للتكنولوجيات المعدلة وراثيا، المزيد والمزيد من الدراسات تستخدم الفئران المعدلة وراثيا كنماذج تجريبية لدراسة آثار جينات محددة على هيمنة العين (OD) اللدونة. في هذه الدراسة، ونحن نقدم بروتوكولات مفصلة للحرمان البصرية أحادية وحساب التغيير في اللدونة OD في V1 الماوس. بعد الحرمان الأحادي (MD) لمدة 4 أيام خلال الفترة الحرجة ، يتم قياس منحنيات ضبط الاتجاه لكل خلية عصبية ، ويتم مقارنة منحنيات ضبط الطبقة الأربعة في V1 بين تحفيز العينين الغير مرئية والتناقضية. يمكن حساب مؤشر التحيز المقابل (CBI) باستخدام درجة OD العينية لكل خلية للإشارة إلى درجة لدونة OD. هذه التقنية التجريبية مهمة لدراسة الآليات العصبية للدونة OD خلال الفترة الحرجة ومسح أدوار جينات محددة في التطور العصبي. القيد الرئيسي هو أن الدراسة الحادة لا يمكن التحقيق في التغيير في اللدونة العصبية لنفس الماوس في وقت مختلف.
Introduction
الحرمان البصري الأحادي هو نموذج تجريبي ممتاز لفحص اللدونة V1. لدراسة أهمية الخبرة البصرية في التنمية العصبية, ديفيد هوبل وتورستن ويزل1,2 حرمان القطط من الرؤية الطبيعية في عين واحدة في نقاط زمنية مختلفة ولفترات متفاوتة من الزمن. ثم لاحظوا التغيرات في شدة الاستجابة في V1 للعيون المحرومة وغير المحرومة. وأظهرت نتائجها انخفاض عدد الخلايا العصبية بشكل غير طبيعي رد فعل على العين التي تم خياطة مغلقة في الأشهر الثلاثة الأولى. ومع ذلك ، ظلت الردود من الخلايا العصبية في القطط متطابقة من جميع النواحي لتلك العين القط البالغ العادي الذي تم خياطة مغلقة لمدة عام ، والقطط لم تتعافى. MD في القطط البالغة لا يمكن أن تحفز اللدونة OD. لذلك ، فإن تأثير التجربة البصرية على أسلاك V1 قوي خلال مرحلة قصيرة ومحددة جيدًا من التطوير ، قبل وبعد ذلك يكون لنفس المحفزات تأثير أقل. مثل هذه المرحلة من زيادة التعرض للمدخلات البصرية يعرف باسم الفترة الحرجة في القشرة البصرية.
على الرغم من أن الماوس هو الحيوان nocturnal، الخلايا العصبية الفردية في V1 الماوس لها خصائص مماثلة للخلايا العصبية الموجودة في القطط3،4،5. في السنوات الأخيرة ، مع التطور السريع للتكنولوجيا المعدلة وراثيا ، استخدم عدد متزايد من الدراسات في علم الأعصاب البصري الفئران كنموذج تجريبي6،7،8. في الدراسات البصرية الماوس، يستخدم علماء الأعصاب المسوخ وخطوط الماوس بالضربة القاضية، والتي تسمح بالتحكم في التركيب الجيني للفئران. على الرغم من أن الفئران V1 تفتقر إلى أعمدة OD ، فإن الخلايا العصبية المفردة في منطقة مناظير V1 تظهر خصائص OD كبيرة. على سبيل المثال، تستجيب معظم الخلايا بقوة أكبر للتحفيز المعوّض من التحفيز الغيري. الإغلاق المؤقت لعين واحدة خلال الفترة الحرجة يؤدي إلى تحول كبير في توزيع مؤشر OD9،10،11. لذلك ، يمكن استخدام MD لإنشاء نموذج لدونة OD للتحقيق في كيفية تأثير الجينات المشاركة في اضطرابات النمو العصبية على اللدونة القشرية في الجسم الحي.
هنا ، نقدم طريقة تجريبية لMD ونقترح طريقة شائعة الاستخدام (التسجيل الكهروفيزيولوجي) لتحليل التغيير في اللدونة OD أثناء الحرمان البصري الأحادي. وقد استخدمت هذه الطريقة على نطاق واسع في العديد من المختبرات لأكثر من 20 عاما12،13،14،15،16. هناك طرق أخرى تستخدم في قياس اللدونة OD كذلك ، مثل إمكانات الاستحضار البصرية المزمنة (VEP) تسجيل17، والتصوير البصري الجوهري (IOI)18. الميزة الكبيرة لهذه الطريقة الحادة هي أنه من السهل اتباعها ، والنتائج موثوقة بشكل ملحوظ.
Access restricted. Please log in or start a trial to view this content.
Protocol
في هذا البروتوكول، تم الحصول على الفئران C57Bl/6 الذكور من معهد الحيوانات المختبرية من أكاديمية سيتشوان للعلوم الطبية ومستشفى الشعب مقاطعة سيتشوان. وقد وافقت اللجنة المؤسسية لرعاية الحيوانات واستخدامها بجامعة العلوم والتكنولوجيا الالكترونية فى الصين على جميع اجراءات رعاية الحيوانات والتجارب .
1. الحرمان الأحادي (MD) في يوم ما بعد الولادة 28 في الفئران
- وضع الأدوات الجراحية، وإبرة خياطة (قطرها 0.25 مم، وسلسلة قطرها 0.07 مم) ومسحات القطن في صندوق الألومنيوم والأوتوكلاف لهم في 120 درجة مئوية لمدة 0.5 ساعة تعقيم غطاء محرك السيارة مع الإيثانول 75٪. تجفيف الأدوات الجراحية في فرن التجفيف.
- إعداد محلول أغروس 2٪، وضعه في حمام مائي في 75 درجة مئوية لتجنب ترسيخ.
- استخدام الايزووفران اتتزج مع الاوكسجين لتحريض الفأرة (2% تحريض و1.2-1.5% صيانة). إصلاح الماوس على جهاز stereotaxic واستخدام جهاز تنظيم الحرارة للحفاظ على درجة حرارة جسم الماوس في 37 درجة مئوية ومنع انخفاض حرارة الجسم.
- تطبيق طبقة رقيقة من مرهم العين المستندة إلى النفط لكلا العينين.
- تحت المجهر التشريحي مع الإضاءة، خياطة الجفن على عين واحدة. جعل تمرير الإبرة على الرغم من كلا الجانبين من الجفن 2x(الشكل 1A)وجعل حوالي أربع غرز.
- عقدة الموضوع 2-3x ومن ثم تقليم الموضوع. تطبيق 3 ميكرولتر من الغراء التجفيف الفوري على العقدة لزيادة استقرارها. ثم قطع الخيط خياطة اضافية.
- توفير حقنة داخل العينية من البوبرينورفين (1 ملغ / كجم) إلى الماوس.
- نقل الماوس على وسادة التدفئة للحفاظ على درجة حرارة الجسم في 37 درجة مئوية ومنع انخفاض حرارة الجسم ومراقبته حتى يستعيد وعيه.
- عندما يكون الماوس مستيقظا تماما وضعه في قفص عقد منفصلة.
- تحقق من الجفون يوميًا للتأكد من أنها تظل مغلقة وغير مصابة. استبعاد الماوس إذا تم العثور على فتحة جفن.
- قبل التسجيل الكهروفيزيولوجية، استخدم الإيوفلوران الممزوج بالأكسجين لتحريض الفأر (2% تحريضي وصيانة 1.2-1.5%).
- إزالة غرز مع مقص العين لفضح مقلة العين. تقليم بعناية أغطية العين.
- مسح العين مع حل العدسة والتحقق من العين تحت المجهر للوضوح. استبعاد الفئران مع opacities القرنية أو علامات العدوى.
2. قحف في منطقة منظار الماوس V1 بعد الحرمان أحادي ة في اليوم 4
- بعد تخدير الفأر، تحقق من عمق التخدير بسبب عدم الاستجابة لقرصة إصبع القدم.
- وضع وإصلاح الماوس على جهاز stereotaxic. ضبط ارتفاع شريط الأذن وقضيب الأسنان للحفاظ على الدماغ مسطحة ومستقرة.
- استخدام وسادة التدفئة للحفاظ على درجة حرارة الجسم.
- تطبيق مرهم العين المستندة إلى النفط على سطح العينين للحفاظ على رطوبة.
- إزالة الشعر على رأس الماوس لفضح الجلد. فرك الجلد مع الدعك بالتناوب من اليود والإيثانول 70٪ 3x.
- تُقطع منطقة 8 × 8 مم من الجلد بين الأذنين لكشف الجمجمة وإزالة أنسجة فروة الرأس. ثم إزالة النسيج الضام ة فوق مع بيروكسيد الهيدروجين 30٪.
- حفر ثقب 1 × 1 ملم في الجمجمة فوق المخيخ. لصق المسمار العظام الصغيرة في الحفرة كمرجع.
- إجراء عملية استئصال قحف صغيرة بقطر 1 مم في منطقة مناظير V1 من نصف الكرة الأرضية المقابل للعين المحرومة(الشكل 1B, A-P: lambda -0.51-lambda +1.67 مم؛ M-L: -2.6 - -3.0 مم; D-V: 0-1 مم). قم بإزالة جزء الجمجمة بعناية دون أن تؤذي الدماغ.
- تغطية السطح القشري المكشوف مع 75 ميكرولتر من 2٪ أغاروز في 40 درجة مئوية لمنع التجفيف.
- إصلاح قطب التنغستن على الإطار stereotaxic. ضع قطب التنغستن عموديًا على سطح القشرة المكشوفة ، وهي منطقة المناظير V1 ، للتأكد من أن الخلايا التي يتم تسجيلها تتفاعل مع كلتا العينين.
- استخدام مسحات القطن لإزالة جل العين وتطبيق زيت السيليكون على العين كل 2 ساعة.
3. التحفيز البصري والتسجيل الكهروفيزيلوجي
- قناع العين الواحدة مع لوحة بلاستيكية غير شفافة. ضع شاشة LCD على بعد 23 سم من عين الفأرة.
- تقليل التخدير إلى 0.5-0.8٪ عندما يتم تخدير الماوس بالكامل.
- تقدم القطب القطب الصغير ببطء مع micromanipulator النفط الهيدروليكية. توقف عن ذلك عند ملاحظة نسبة عالية من الإشارة إلى الضوضاء ومتقدمة القطب إلى الطبقة 4(الشكل 1C،ما يقرب من 250-450 ميكرومتر في العمق). تأكد من تعيين عامل التضخيم عند 1000، وعامل التصفية عند 300-100 هرتز، ومعدل العينة عند 40 هرتز.
- تقديم صريف جيبي متحرك كامل المجال(الشكل 1D، 12 اتجاهًا ، تباين 100٪ ، 2 هرتز من التردد المؤقت ، 0.04 دورات لكل درجة من التردد المكاني) على شاشة LED.
- قياس استجابة الخلية عن طريق تحفيز العين ipsilateral وcontralateral بشكل منفصل. مجموع 3-5x الحالي.
- قياس استجابات من خمس إلى ثماني خلايا في كل اختراق. تنفيذ أربعة إلى ستة اختراقات في كل فأرة.
- بعد التسجيل، ضبط معدل تدفق الإيفورلوران إلى 5٪ أو أكثر، ومواصلة التعرض isoflurane لمدة 1 دقيقة، ومن ثم إجراء خلع عنق الرحم.
ملاحظة: تم تباعد الاختراقات المنفصلة على الأقل 200 ميكرومتر في منطقة مناظير V1.
4. خارج الخط ارتفاع الفرز وتحليل البيانات
- الكشف عن المسامير عندما تعبر الإشارة الخام مستوى عتبة. محاذاة المسامير الملتقطة على أول ذروة إيجابية أو سلبية. استخدام البرامج للكشف عن المسامير من خلايا مختلفة.
- تعيين مؤشرين: واحد للإيجابية والآخر للانحراف السلبي. تعيين قالب المسمار(الشكل 2A). تعيين منطقة القالب إلى ذلك مع الاختلاف الأكثر أهمية بين فئات مختلفة من المسامير.
- استخدم تحليل المكون الرئيسي لفصلها إلى مجموعات. يمكن أن تختلف طرق التجميع بين المختبرات المختلفة.
- تصنيف ارتفاع الحدود باستخدام خوارزمية K-الوسائل.
- ربط الاتجاه مع ارتفاع معدل اطلاق النار ومؤامرة منحنيات ضبط الاتجاه للعين ipsilateral وcontralateral.
- حساب مؤشر OD للوحدة الواحدة، والذي يمثل نسبة قوة الاستجابة المواجهة/ipsilateral:
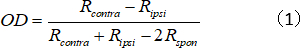
حيث Rكونترا وRipsi هي استجابة الخلية المثلى للعين المواجهة وipsilateral، على التوالي، وRspon هو النشاط التلقائي للخلية. - تعيين درجات OD إلى 1-7 على النحو التالي: - 1 إلى −0.75 = 1؛ −0.75 إلى −0.45 = 2; −0.45 إلى −0.15 = 3; −0.15 إلى 0.15 = 4; 0.15 إلى 0.45 = 5؛ 0.45 إلى 0.75 = 6؛ و0.75 إلى 1 = 7.
- حساب مؤشر التحيز المتوافق (CBI):
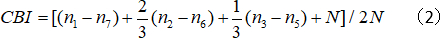
حيث N هو رقم الخلية، وnx يساوي رقم الخلية مع درجات OD يساوي x.
Access restricted. Please log in or start a trial to view this content.
النتائج
تمكن النتائج التجريبية الموصوفة هنا من قياسات الدونة MD و OD الناجحة من فأر محروم وغير محروم خلال الفترة الحرجة (P19-P32). يوضح الشكل 1 كيفية إجراء تسجيلات وحدة واحدة في الطبقة 4 من V1 منطقة المناظير لمقارنة الاستجابات في العين ipsilateral والعين الكامنية بعد 4 أيام من MD. ويبين
Access restricted. Please log in or start a trial to view this content.
Discussion
نقدم بروتوكول مفصل لMD وقياس اللدونة OD عن طريق تسجيل وحدة واحدة. ويستخدم هذا البروتوكول على نطاق واسع في علم الأعصاب البصري. على الرغم من أن بروتوكول MD ليس معقدًا ، فهناك بعض العمليات الجراحية الحرجة التي يجب اتباعها بعناية. أولا، هناك نوعان من التفاصيل الهامة ضمان جودة خياطة. الخياطة مستقر...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ويعلن صاحبا البلاغ أنه ليس لهما مصالح مالية متنافسة.
Acknowledgements
تم دعم هذه الدراسة من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (81571770، 81771925، 81861128001).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 502 glue | M&G Chenguang Stationery Co., Ltd. | AWG97028 | |
| Acquizition card | National Instument | PCI-6250 | |
| Agarose | Biowest | G-10 | |
| Amplifier | A-M system | Model 1800 | |
| Atropine | Aladdin Bio-Chem Technology Co., Ltd | A135946-5 | |
| Brain Stereotaxic Apparatus | RWD Life Science Co.,Ltd | 68001 | |
| Cohan-Vannas spring scissors | Fine Science Tools | 15000-02 | |
| Contact Lenses Solutions | Beijing Dr. Lun Eye Care Products Co., Ltd. | GM17064 | |
| Cotton swabs | Henan Guangderun Medical Instruments Co.,Ltd | ||
| Fine needle holder | SuZhou Stronger Medical Instruments Co.,Ltd | CZQ1370 | |
| Forcep | 66 Vision Tech Co., Ltd. | 53320A | |
| Forcep | 66 Vision Tech Co., Ltd. | 53072 | |
| Forcep | 66 Vision Tech Co., Ltd. | #5 | |
| Heating pad | Stryker | TP 700 T | |
| Illuminator | Motic China Group Co., Ltd. | MLC-150C | |
| Isoflurane | RWD Life Science Co.,Ltd | R510-22 | |
| LCD monitor | Philips (China) Investment Co., Ltd. | 39PHF3251/T3 | |
| Microscope | SOPTOP | SZMT1 | |
| Noninvasive Vital Signs Monitor | Mouseox | ||
| Oil hydraulic micromanipulator | NARISHIGE International Ltd. | PC-5N06022 | |
| Petrolatum Eye Gel | Dezhou Yile Disinfection Technology Co., Ltd. | 17C801 | |
| Spike2 | Cambridge Electronic Design, Cambridge, UK | Spike2 Version 9 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54010 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54002 | |
| Suture Needle | Ningbo Medical Co.,Ltd | 3/8 arc 2.5*8 | |
| Tungsten Electrode | FHC, Inc | L504-01B | |
| Xylocaine | Huaqing |
References
- Hubel, D. H., Wiesel, T. N. Effects of monocular deprivation in kittens. Naunyn-Schmiedebergs Archiv für experimentelle Pathologie und Pharmakologie. 248 (6), 492-497 (1964).
- Daw, N. W., Fox, K., Sato, H., Czepita, D. Critical period for monocular deprivation in the cat visual cortex. Journal of Neurophysiology. 67 (1), 197-202 (1992).
- Guire, E. S., Lickey, M. E., Gordon, B. Critical period for the monocular deprivation effect in rats: assessment with sweep visually evoked potentials. Journal of Neurophysiology. 81 (1), 121-128 (1999).
- Wang, L., Sarnaik, R., Rangarajan, K. V., Liu, X., Cang, J. Visual receptive field properties of neurons in the superficial superior colliculus of the mouse. Journal of Neuroscience. 30 (49), 16573-16584 (2010).
- Niell, C. M. Cell Types, circuits, and receptive fields in the mouse visual cortex. Annual Review of Neuroscience. 38 (1), 413-431 (2015).
- Lee, S. H., et al. Activation of specific interneurons improves V1 feature selectivity and visual perception. Nature. 488 (8), 379-383 (2012).
- Cossell, L., et al. Functional organization of excitatory synaptic strength in primary visual cortex. Nature. 518 (2), 399-403 (2015).
- Lacaruso, M. F., Gasler, L. T., Hofer, S. B. Synaptic organization of visual space in primary visual cortex. Nature. 547 (7), 449-452 (2017).
- Metin, C., Godement, P., Imbert, M. The primary visual cortex in the mouse: Receptive field properties and functional organization. Experimental Brain Research. 69 (3), 594-612 (1988).
- Marshel, J. H., Garrett, M. E., Nauhaus, I., Callaway, E. M. Functional specialization of seven mouse visual cortical areas. Neuron. 72 (6), 1040-1054 (2011).
- Gordon, J. A., Stryker, M. P. Experience-dependent plasticity of binocular responses in the primary visual cortex of the mouse. The Journal of Neuroscience. 16 (10), 3274-3286 (1996).
- McGee, A. W., Yang, Y., Fischer, Q. S., Daw, N. W., Strittmatter, S. M. Experience-driven plasticity of visual cortex limited by myelin and Nogo receptor. Science. 309 (5744), 2222-2226 (2005).
- Sawtell, N. B., et al. NMDA receptor-dependent ocular dominance plasticity in adult visual cortex. Neuron. 38 (6), 977-985 (2003).
- Hofer, S. B., Mrsic-Flogel, T. D., Bonhoeffer, T., Hubener, M. Prior experience enhances plasticity in adult visual cortex. Nature Neuroscience. 9 (12), 127-132 (2006).
- Crozier, R. A., Wang, Y., Liu, C., Bear, M. F. Deprivation-induced synaptic depression by distinct mechanisms in different layers of mouse visual cortex. Proceedings of the National Academy of Sciences. 104 (4), 1383-1388 (2007).
- Tagawa, Y., Kanold, P. O., Majdan, M., Shatz, C. J. Multiple periods of functional ocular dominance plasticity in mouse visual cortex. Nature Neuroscience. 8 (3), 380-388 (2005).
- Lickey, M. E., Pham, T. A., Gordon, B. Swept contrast visual evoked potentials and their plasticity following monocular deprivation in mice. Vision Research. 44, 3381-3387 (2004).
- Cang, J., Kalatsky, V. A., Lowel, S., Stryker, M. P. Optical imaging of the intrinsic signal as a measure of cortical plasticity in the mouse. Vision Neuroscience. 22 (5), 685-691 (2005).
- Khan, I. U., et al. Evaluation of different suturing techniques for cystotomy closure in canines. Journal of Animal & Plant Sciences. 23 (4), 981-985 (2013).
- Weisman, D. L., Smeak, D. D., Birchard, S. J., Zweigart, S. L. Comparison of a continuous suture pattern with a simple interrupted pattern for enteric closure in dogs and cats: 83 cases (1991-1997). Journal of the American Veterinary Medical Association. 214 (10), 1507-1510 (1999).
- Heneghan, C. P. H., Thornton, C., Navaratnarajah, M., Jones, J. G. Effect of isoflurane on the auditory evoked response in man. BJA: British Journal of Anaesthesia. 59 (3), 277-282 (1987).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomenal. Physiological Reviews. 65 (1), 37-100 (1985).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved