JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스 1 차 적인 시각 피 질에 있는 단안 시각 박탈 및 안구 우세 가소성 측정
* 이 저자들은 동등하게 기여했습니다
요약
여기에서, 우리는 중요한 기간 도중 시각 가소성의 신경 기계장치를 공부하기 위한 중요한 방법인 단안 시각 박탈 및 안구 지배적 가소성 분석을 위한 상세한 프로토콜을 제시하고 특정 유전자의 효력에 시각적 인 개발.
초록
단안 시각적 박탈은 1 차적인 시각적 피질 반응 가소성을 유도하는 우수한 실험 패러다임입니다. 일반적으로, 자극에 대한 반대측 눈에 대한 피질의 반응은 마우스 1차 시각 피질(V1)의 쌍안경 세그먼트에서의 원소 눈의 반응보다 훨씬 강하다. 포유류 임계 기간 동안, 반대쪽 눈을 봉합하는 것은 반대쪽 눈 자극에 V1 세포의 반응성의 급속한 손실을 초래할 것이다. 형질전환 기술의 지속적인 발달로, 점점 더 많은 연구가 안구 우도 (OD) 가소성에 특정 유전자의 효력을 검토하기 위하여 실험적인 모형으로 형질전환 마우스를 이용하고 있습니다. 이 연구에서는 단안 시각 박탈에 대한 자세한 프로토콜을 소개하고 마우스 V1의 OD 가소성의 변화를 계산합니다. 임계 기간 동안 4일 동안 단각 박탈(MD) 후, 각 뉴런의 배향 튜닝 곡선이 측정되고, V1에서 4개의 뉴런층의 튜닝 곡선이 동측 및 반대눈의 자극 과 반대눈의 자극 사이에서 비교된다. 반대편 바이어스 지수(CBI)는 각 셀의 안구 OD 점수를 사용하여 OD 가소성의 정도를 나타내기 위해 계산할 수 있습니다. 이 실험 기술은 중요한 기간 동안 OD 가소성의 신경 메커니즘을 연구하고 신경 발달에서 특정 유전자의 역할을 조사하는 데 중요합니다. 주요 제한은 급성 연구가 다른 시간에 동일한 마우스의 신경 가소성의 변화를 조사 할 수 없다는 것입니다.
서문
단안 시각적 박탈은 V1 가소성을 검사하는 우수한 실험 패러다임입니다. 신경 발달에 있는 시각적 경험의 중요성을 공부하기 위하여, 데이비드 Hubel와 Torsten Wiesel1,2 는 다양한 시간 시점에서 그리고 시간의 다양한 기간에 대하여 한 쪽 눈에서 정상 시력의 박탈된 새끼 고양이. 그(것)들은 박탈되고 박탈되지 않은 눈을 위한 V1에 있는 반응 강렬에 있는 변경을 관찰했습니다. 그들의 결과는 처음 3 달에서 닫힌 봉합된 눈에 반응하는 신경의 비정상적으로 낮은 수를 보여주었습니다. 그러나, 새끼 고양이의 뉴런의 반응은 1 년 동안 봉합 된 일반 성인 고양이의 눈과 모든 면에서 동일하게 유지되었으며 새끼 고양이는 회복되지 않았습니다. 성인 고양이의 MD는 OD 가소성을 유발할 수 없습니다. 따라서 V1 배선에 대한 시각적 경험의 영향은 동일한 자극이 덜 영향을 미치기 전과 후에 개발의 짧고 잘 정의된 단계에서 강합니다. 시각적 입력에 대한 감수성의 이러한 단계는 시각적 피질에서 중요한 기간으로 알려져 있다.
마우스는 야행성 동물이지만, 마우스 V1의 개별 뉴런은 고양이3,4,5에서발견되는 뉴런과 유사한 특성을 가지고 있다. 최근에는 형질전환 기술의 급속한 발전과 함께 시각 신경 과학에 대한 연구가 증가함에 따라 마우스를 실험 모델6,7,8로사용하고 있다. 마우스 시각 연구에서 신경 과학자들은 돌연변이와 마우스 라인을 녹아웃하여 마우스의 유전 적 구성을 제어 할 수 있습니다. 마우스 V1에는 OD 컬럼이 없지만 V1 쌍안경 영역의 단일 뉴런은 상당한 OD 특성을 보여줍니다. 예를 들어, 대부분의 세포는 입시측 자극보다 반대측 자극에 더 강하게 반응합니다. 임계 기간 동안 한쪽 눈을 일시적으로 폐쇄하면 OD 지수분포9,10,11에서상당한 변화를 유도한다. 따라서, MD는 신경 발달 장애에 관여하는 유전자가 생체 내에서 피질 가소성에 어떻게 영향을 미치는지 조사하기 위해 OD 가소성 모델을 확립하는 데 사용될 수 있다.
여기서, MD에 대한 실험방법을 소개하고, 단안시각박탈 시 OD 가소성의 변화를 분석하기 위해 일반적으로 사용되는 방법(전기생리학적 기록)을 제안한다. 이 방법은 20 년 이상 많은 실험실에서 널리 사용되어 왔다12,13,14,15,16. 만성 영상 유발 전위(VEP)기록(VEP) 기록(17)및 본질광학 이미징(IOI)18과같은 OD 가소성을 측정하는 데 사용되는 다른 방법도 있다. 이 급성 방법의 중요한 장점은 따라하기 쉽고 결과가 현저하게 신뢰할 수 있다는 것입니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
이 프로토콜에서, 남성 C57Bl/6 마우스는 사천 의학 아카데미와 쓰촨 성 인민 병원의 실험실 동물 연구소에서 얻은. 모든 동물 관리 및 실험 절차는 중국 전자 과학 기술 대학의 기관 동물 관리 및 사용 위원회에 의해 승인되었습니다.
1. 생후 28일째 에 단안 박탈 (MD) 마우스
- 수술 도구, 봉합바늘 (직경 0.25 mm, 문자열 직경 0.07 mm) 및 면봉을 알루미늄 상자에 넣고 0.5 시간 동안 120 °C에서 오토 클레이브. 75 % 에탄올로 후드를 살균하십시오. 수술 도구를 건조 오븐에서 건조시.
- 응고를 피하기 위해 75 °C에서 수조에 넣어, 2 % 아가로즈 용액을 준비합니다.
- 마우스를 마취하기 위해 산소와 혼합 된 이소플루란을 사용합니다 (2 % 유도 및 1.2-1.5 % 유지 보수). 입체 전도 장치에 마우스를 고정하고 37 °C에서 마우스 체온을 유지하고 저체온증을 방지하기 위해 열 조절 장치를 사용합니다.
- 두 눈에 석유 기반 눈 연고의 얇은 층을 적용합니다.
- 조명이 있는 해부학적 현미경 아래에서 한쪽 눈의 눈꺼풀을 봉합합니다. 바늘을 두면 2x(그림 1A)를통과하고 약 4 개의 바늘을 만듭니다.
- 스레드를 2-3x 매듭한 다음 스레드를 잘라내세요. 매듭에 3 μL의 즉각적인 건조 접착제를 적용하여 안정성을 높입니다. 그런 다음 여분의 봉합 스레드를 잘라냅니다.
- 마우스에 부프레노르핀(1 mg/kg)의 복강 내 주사를 제공합니다.
- 37 °C에서 체온을 유지하고 저체온증을 방지하고 의식을 회복 할 때까지 모니터링 하기 위해 가열 패드에 마우스를 전송합니다.
- 마우스가 완전히 깨어있을 때 별도의 보유 케이지에 놓습니다.
- 매일 눈꺼풀이 닫혀 있고 감염되지 않았는지 확인하십시오. 눈꺼풀이 열리면 마우스를 제외합니다.
- 전기 생리학적 기록 전에 산소와 혼합된 이소플루란을 사용하여 마우스를 마취시요(2% 유도 및 1.2-1.5% 유지).
- 눈 가위로 바늘을 제거하여 안구를 노출시다. 눈꺼풀을 조심스럽게 다듬습니다.
- 렌즈 용액으로 눈을 씻어 내고 현미경으로 눈을 확인하여 선명도를 확인하십시오. 각막 불투명도 또는 감염의 징후가있는 마우스를 제외하십시오.
2. 4 일째에 단안 박탈 후 마우스 V1 쌍안경 영역에서 개두술
- 마우스를 마취 한 후 발가락 핀치에 대한 반응이 부족하여 마취의 깊이를 확인하십시오.
- 마우스를 입체 전지 장치에 놓고 고정합니다. 이어 바와 치아 막대의 높이를 조정하여 뇌를 평평하고 안정적으로 유지합니다.
- 체온을 유지하기 위해 가열 패드를 사용합니다.
- 눈 표면에 석유 계 눈 연고를 바르고 촉촉하게 유지하십시오.
- 마우스 머리의 머리카락을 제거하여 피부를 노출시다. 요오드와 70 % 에탄올 3 배의 교대로 스크럽으로 피부를 문질러.
- 두개골을 노출하고 두피 조직을 제거하기 위해 귀 사이의 피부 의 8 x 8mm 영역을 절개. 그런 다음 과산화수소 30 %로 겹친 결합 조직을 제거하십시오.
- 소뇌 위의 두개골에 1 x 1mm 구멍을 뚫습니다. 구멍에 작은 뼈 나사를 참조로 부착합니다.
- V1 쌍안경 영역에서 박탈된 눈까지의 V1 쌍안경 영역에서 직경 1 mm의 작은 개두술을 수행합니다(그림1B,A-P: 람다 -0.51-람다 +1.67 mm; M-L: -2.6 – -3.0 mm; D-V: 0-1 mm). 조심스럽게 뇌를 다치게하지 않고 두개골 조각을 제거합니다.
- 노출된 피질 표면을 건조를 방지하기 위해 40°C에서 2% 아가로즈 75 μL로 덮습니다.
- 스테레오탁스 프레임에 텅스텐 전극을 고정합니다. 텅스텐 전극을 V1의 쌍안경 영역인 노출된 피질의 표면에 수직으로 놓아 기록된 세포가 두 눈에 반응하는지 확인합니다.
- 면봉을 사용하여 아이 젤을 제거하고 2 시간마다 눈에 실리콘 오일을 바하십시오.
3. 시각 자극 및 전기 생리적 기록
- 한쪽 눈을 불투명한 플라스틱 판으로 가릴 수 있습니다. LCD 모니터를 마우스 눈에서 23cm 떨어진 위치에 놓습니다.
- 마우스가 완전히 마취될 때 마취를 0.5-0.8%로 줄입니다.
- 오일 유압 마이크로 조작기로 마이크로 전극을 천천히 진행합니다. 높은 신호 대 잡음 비가 관찰되고 전극이 레이어4(그림 1C,깊이 약 250-450μm)로 진보되면 중지합니다. 증폭 계수가 1,000으로 설정되어 있는지, 필터를 300-100Hz로 설정하고, 샘플 속도를 40Hz로 설정해야 합니다.
- LED 모니터에 전체 필드 이동 정현파격자(그림 1D,12방향, 100% 대비, 임시 주파수 2Hz, 공간 주파수 도당 0.04사이클)를 제공합니다.
- 따로 입시및 반대측 눈을 자극하여 세포의 반응을 측정합니다. 현재 총 3-5배.
- 각 침투에서 5~8개의 셀의 반응을 측정합니다. 각 마우스에서 4~6개의 침투를 수행합니다.
- 기록 후, 이소플루란 유량을 5% 이상으로 조정하고, 이소플루란 노출을 1분 동안 계속한 다음, 자궁 경부 탈구를 수행한다.
참고: V1 쌍안경 영역에서 별도의 관통은 적어도 200 μm 간격으로 배치되었습니다.
4. 오프라인 스파이크 정렬 및 데이터 분석
- 원시 신호가 임계값 레벨을 초과할 때 스파이크를 감지합니다. 캡처한 스파이크를 첫 번째 양수 또는 음수 피크에 정렬합니다. 소프트웨어를 사용하여 다른 셀의 스파이크를 감지합니다.
- 두 개의 커서를 설정합니다: 하나는 양수이고 다른 하나는 음의 편향입니다. 스파이크 템플릿을설정합니다(그림 2A). 다른 클래스 의 스파이크 간에 가장 큰 차이가 있는 템플릿 영역을 설정합니다.
- 주 성분 분석을 사용하여 클러스터로 구분합니다. 클러스터링 방법은 서로 다른 실험실마다 다를 수 있습니다.
- K-means 알고리즘을 사용하여 경계의 스파이크를 분류합니다.
- 방향과 스파이크 발사 속도의 상관 관계를 지정하고 입시측및 반대눈의 방향 튜닝 곡선을 플로팅합니다.
- 반대측/측문측 응답 강도 비율을 나타내는 단일 단위의 OD 인덱스를 계산합니다.
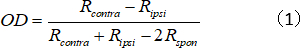
여기서 R콘트라와 Ripsi는 각각 반대측 및 입시 측눈을 위한 세포의 최적 반응이고, R스폰은 세포의 자발적인 활동이다. - 다음과 같이 1-7에 OD 점수를 할당 : - 1 - -0.75 = 1; -0.75 ~ -0.45 = 2; -0.45 ~ -0.15 = 3; -0.15 ~ 0.15 = 4; 0.15 ~ 0.45 = 5; 0.45 ~ 0.75 = 6; 및 0.75 ~ 1 = 7.
- 반대 편심 지수 (CBI)를 계산합니다.
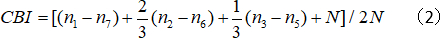
여기서 N은 셀 번호이고nx는 셀 번호와 OD 점수가 x와 같습니다.
Access restricted. Please log in or start a trial to view this content.
결과
여기에 설명된 실험 결과는 중요한 기간 동안 박탈되고 박탈되지 않은 마우스로부터 성공적인 MD 및 OD 가소성 측정을 가능하게 합니다(P19-P32). 도 1은 MD 후 4일 후 의 원소 및 반대쪽 눈의 반응을 비교하기 위한 쌍안경 영역 V1로부터의 층 4에서 단일 단위 기록을 수행하는 방법을 나타낸다. 그림 2는 입시및 반대측 눈을 자극하기 위한 스파이크 정렬 및 ?...
Access restricted. Please log in or start a trial to view this content.
토론
우리는 MD에 대한 상세한 프로토콜을 제시하고 단일 단위 기록에 의해 OD 가소성을 측정합니다. 이 프로토콜은 시각 신경 과학에 널리 사용됩니다. MD 프로토콜은 복잡하지 않지만 신중하게 따라야하는 몇 가지 중요한 수술 절차가 있습니다. 첫째, 스티치의 품질을 보장하는 두 가지 중요한 세부 사항이 있습니다. 바늘이 눈꺼풀의 내측 부분에 집중되어있는 경우 봉합사는 충분히 안정적입니다. 또?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 그들이 경쟁 적인 재정적 이익이 없다고 선언합니다.
감사의 말
이 연구는 중국 국립 자연 과학 재단에 의해 지원 되었다 (81571770, 81771925, 81861128001).
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 502 glue | M&G Chenguang Stationery Co., Ltd. | AWG97028 | |
| Acquizition card | National Instument | PCI-6250 | |
| Agarose | Biowest | G-10 | |
| Amplifier | A-M system | Model 1800 | |
| Atropine | Aladdin Bio-Chem Technology Co., Ltd | A135946-5 | |
| Brain Stereotaxic Apparatus | RWD Life Science Co.,Ltd | 68001 | |
| Cohan-Vannas spring scissors | Fine Science Tools | 15000-02 | |
| Contact Lenses Solutions | Beijing Dr. Lun Eye Care Products Co., Ltd. | GM17064 | |
| Cotton swabs | Henan Guangderun Medical Instruments Co.,Ltd | ||
| Fine needle holder | SuZhou Stronger Medical Instruments Co.,Ltd | CZQ1370 | |
| Forcep | 66 Vision Tech Co., Ltd. | 53320A | |
| Forcep | 66 Vision Tech Co., Ltd. | 53072 | |
| Forcep | 66 Vision Tech Co., Ltd. | #5 | |
| Heating pad | Stryker | TP 700 T | |
| Illuminator | Motic China Group Co., Ltd. | MLC-150C | |
| Isoflurane | RWD Life Science Co.,Ltd | R510-22 | |
| LCD monitor | Philips (China) Investment Co., Ltd. | 39PHF3251/T3 | |
| Microscope | SOPTOP | SZMT1 | |
| Noninvasive Vital Signs Monitor | Mouseox | ||
| Oil hydraulic micromanipulator | NARISHIGE International Ltd. | PC-5N06022 | |
| Petrolatum Eye Gel | Dezhou Yile Disinfection Technology Co., Ltd. | 17C801 | |
| Spike2 | Cambridge Electronic Design, Cambridge, UK | Spike2 Version 9 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54010 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54002 | |
| Suture Needle | Ningbo Medical Co.,Ltd | 3/8 arc 2.5*8 | |
| Tungsten Electrode | FHC, Inc | L504-01B | |
| Xylocaine | Huaqing |
참고문헌
- Hubel, D. H., Wiesel, T. N. Effects of monocular deprivation in kittens. Naunyn-Schmiedebergs Archiv für experimentelle Pathologie und Pharmakologie. 248 (6), 492-497 (1964).
- Daw, N. W., Fox, K., Sato, H., Czepita, D. Critical period for monocular deprivation in the cat visual cortex. Journal of Neurophysiology. 67 (1), 197-202 (1992).
- Guire, E. S., Lickey, M. E., Gordon, B. Critical period for the monocular deprivation effect in rats: assessment with sweep visually evoked potentials. Journal of Neurophysiology. 81 (1), 121-128 (1999).
- Wang, L., Sarnaik, R., Rangarajan, K. V., Liu, X., Cang, J. Visual receptive field properties of neurons in the superficial superior colliculus of the mouse. Journal of Neuroscience. 30 (49), 16573-16584 (2010).
- Niell, C. M. Cell Types, circuits, and receptive fields in the mouse visual cortex. Annual Review of Neuroscience. 38 (1), 413-431 (2015).
- Lee, S. H., et al. Activation of specific interneurons improves V1 feature selectivity and visual perception. Nature. 488 (8), 379-383 (2012).
- Cossell, L., et al. Functional organization of excitatory synaptic strength in primary visual cortex. Nature. 518 (2), 399-403 (2015).
- Lacaruso, M. F., Gasler, L. T., Hofer, S. B. Synaptic organization of visual space in primary visual cortex. Nature. 547 (7), 449-452 (2017).
- Metin, C., Godement, P., Imbert, M. The primary visual cortex in the mouse: Receptive field properties and functional organization. Experimental Brain Research. 69 (3), 594-612 (1988).
- Marshel, J. H., Garrett, M. E., Nauhaus, I., Callaway, E. M. Functional specialization of seven mouse visual cortical areas. Neuron. 72 (6), 1040-1054 (2011).
- Gordon, J. A., Stryker, M. P. Experience-dependent plasticity of binocular responses in the primary visual cortex of the mouse. The Journal of Neuroscience. 16 (10), 3274-3286 (1996).
- McGee, A. W., Yang, Y., Fischer, Q. S., Daw, N. W., Strittmatter, S. M. Experience-driven plasticity of visual cortex limited by myelin and Nogo receptor. Science. 309 (5744), 2222-2226 (2005).
- Sawtell, N. B., et al. NMDA receptor-dependent ocular dominance plasticity in adult visual cortex. Neuron. 38 (6), 977-985 (2003).
- Hofer, S. B., Mrsic-Flogel, T. D., Bonhoeffer, T., Hubener, M. Prior experience enhances plasticity in adult visual cortex. Nature Neuroscience. 9 (12), 127-132 (2006).
- Crozier, R. A., Wang, Y., Liu, C., Bear, M. F. Deprivation-induced synaptic depression by distinct mechanisms in different layers of mouse visual cortex. Proceedings of the National Academy of Sciences. 104 (4), 1383-1388 (2007).
- Tagawa, Y., Kanold, P. O., Majdan, M., Shatz, C. J. Multiple periods of functional ocular dominance plasticity in mouse visual cortex. Nature Neuroscience. 8 (3), 380-388 (2005).
- Lickey, M. E., Pham, T. A., Gordon, B. Swept contrast visual evoked potentials and their plasticity following monocular deprivation in mice. Vision Research. 44, 3381-3387 (2004).
- Cang, J., Kalatsky, V. A., Lowel, S., Stryker, M. P. Optical imaging of the intrinsic signal as a measure of cortical plasticity in the mouse. Vision Neuroscience. 22 (5), 685-691 (2005).
- Khan, I. U., et al. Evaluation of different suturing techniques for cystotomy closure in canines. Journal of Animal & Plant Sciences. 23 (4), 981-985 (2013).
- Weisman, D. L., Smeak, D. D., Birchard, S. J., Zweigart, S. L. Comparison of a continuous suture pattern with a simple interrupted pattern for enteric closure in dogs and cats: 83 cases (1991-1997). Journal of the American Veterinary Medical Association. 214 (10), 1507-1510 (1999).
- Heneghan, C. P. H., Thornton, C., Navaratnarajah, M., Jones, J. G. Effect of isoflurane on the auditory evoked response in man. BJA: British Journal of Anaesthesia. 59 (3), 277-282 (1987).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomenal. Physiological Reviews. 65 (1), 37-100 (1985).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유