A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מניעת ויזואלי מונוטוני ושליטה העין הפלסטיות מדידה העכבר קליפת הראיה העיקרית
* These authors contributed equally
In This Article
Summary
כאן, אנו מציגים פרוטוקולים מפורטים עבור מניעת ויזואלי מונוטוני וניתוח השליטה בעין הפלסטיות, שהם שיטות חשובות לחקר המנגנונים העצביים של הפלסטיות החזותית במהלך התקופה הקריטית ואת ההשפעות של גנים ספציפיים על פיתוח ויזואלי.
Abstract
מניעת ראייה מונוקלית היא פרדיגמה ניסיונית מעולה כדי לגרום לפלסטיות העיקרי התגובה החזותית האופטית. באופן כללי, התגובה של הקליפה לעין הצלעות הגירוי הוא הרבה יותר חזק מאשר התגובה של העין הלסילבית בקטע המשקפת של קליפת העכבר העיקרית החזותית (V1). במהלך התקופה הקריטית של היונקים, העין המועלת הצלעות תגרום לאובדן מהיר של התגובה של תאים V1 כדי גירוי העין המקבילה. עם התפתחות מתמשכת של טכנולוגיות טרנסגניים, יותר ויותר מחקרים משתמשים בעכברים טרנסגניים כמו מודלים ניסיוניים לבחון את ההשפעות של גנים ספציפיים על הדומיננטיות העינית (OD) הפלסטיות. במחקר זה, אנו מציגים פרוטוקולים מפורטים עבור חסך חזותי מונוטוני ולחשב את השינוי הפלסטיות הפלסטיות בעכבר V1. לאחר מניעת מונוטוני (MD) עבור 4 ימים במהלך התקופה הקריטית, האוריינטציה כוונון עקומות של כל תא העצב נמדד, ואת עקומות כוונון של שכבה ארבעה נוירונים ב V1 מושווים בין גירוי של העין המוסילתית ואת העיניים שרירי. ניתן לחשב את מדד ההטיה באמצעות הטיה (לח ק) באמצעות הניקוד העינית של כל תא כדי לציין את מידת הפלסטיות של OD. טכניקה ניסיונית זו חשובה ללימוד המנגנונים העצביים של הפלסטיות במהלך התקופה הקריטית ולצורך מדידות התפקידים של גנים ספציפיים בהתפתחות העצבית. המגבלה העיקרית היא שהמחקר החריף אינו יכול לחקור את השינוי בפלסטיות העצבית של אותו עכבר בזמן שונה.
Introduction
מניעת ראייה חד-מולקולרית היא פרדיגמה ניסיונית מצוינת לבדיקת הפלסטיות הV1. כדי ללמוד את חשיבותה של החוויה החזותית בהתפתחות העצבית, דוד הובל וטורסטן ויזל1,2 מונעים מחתולים של ראייה רגילה בעין אחת בנקודות זמן שונות ובמשך פרקי זמן שונים. לאחר מכן הם הבחינו בשינויים בעוצמת התגובה ב-V1 עבור העיניים המקופחים והלא מונעים. התוצאות שלהם הראו מספר נמוך באופן חריג של נוירונים מגיבים לעין שהיה סגור למעלה בשלושת החודשים הראשונים. עם זאת, התגובות של הנוירונים בחתלתולים נשארו זהות בכל המובנים לאלה של עין של חתול בוגר נורמלי שנסגר במשך שנה, והגורים לא התאושש. MD אצל חתולים מבוגרים לא יכול לגרום לפלסטיות. לכן, ההשפעה של החוויה החזותית על החיווט V1 היא חזקה במהלך שלב קצר, מוגדר היטב של פיתוח, לפני ואחריו גירויים אותו יש פחות השפעה. שלב כזה של רגישות מוגברת לקלט חזותי ידוע כתקופה קריטית בקליפת הראייה.
למרות העכבר הוא חיה לילית, נוירונים בודדים בעכבר V1 יש תכונות דומות לנוירונים שנמצאו אצל חתולים3,4,5. בשנים האחרונות, עם ההתפתחות המהירה של הטכנולוגיה הטרנסגנית, מספר גדל והולך של מדעי המוח ויזואלית השתמשו בעכברים כמודל ניסיוני6,7,8. במחקרים חזותיים העכבר, נוירומדענים להשתמש במוטציות קווי העכבר, אשר מאפשרים שליטה על האיפור הגנטי של העכברים. למרות שעכברים V1 מחסור בעמודות OD, נוירונים בודדים באזור המשקפת V1 להראות משמעותי מאפייני OD. לדוגמה, רוב התאים מגיבים חזק יותר לגירוי הצלעות שלהן מאשר לגירוי שצלעות. סגירה זמנית של עין אחת במהלך התקופה הקריטית משרה משמרת משמעותית בהתפלגות המדד OD9,10,11. לכן, MD יכול לשמש כדי ליצור מודל הפלסטיות של OD כדי לחקור כיצד גנים המעורבים בהפרעות התפתחותיות עצביות להשפיע על הפלסטיות הקורטיקלית ב vivo.
כאן, אנו מציגים שיטה ניסיונית ל-MD ומציעים שיטה בשימוש נפוץ (הקלטה אלקטרופיסיולוגית) כדי לנתח את השינוי בפלסטיות של OD במהלך חסך חזותי מונוטוני. השיטה היתה בשימוש נרחב במעבדות רבות במשך יותר מ 20 שנים12,13,14,15,16. ישנן שיטות אחרות המשמשות למדידת הפלסטיות של OD, כמו גם, כגון פוטנציאל כרוני ויזואלי מעורר (VEP) הקלטה17, ו הדמיה אופטית פנימית (ioi)18. היתרון המשמעותי של שיטה חריפה זו הוא שקל לעקוב אחריו, והתוצאות אמינות במידה ניכרת.
Access restricted. Please log in or start a trial to view this content.
Protocol
בפרוטוקול זה, זכר C57Bl/6 עכברים התקבלו מהמכון של בעלי חיים מעבדה של האקדמיה בסצ למדעי הרפואה והאנשים הפרובינציאלי של סצ'ואן החולים. כל טיפול בעלי חיים והליכים ניסיוניים אושרו על ידי הוועדה לטיפול בבעלי חיים מוסדיים והשתמש, אוניברסיטת המדע האלקטרוני וטכנולוגיה של סין.
1. מניעת חד-ממדי (MD) ביום לאחר הלידה 28 בעכברים
- לשים את הכלים כירורגי, את המחט תפר (0.25 מ"מ קוטר, קוטר מחרוזת 0.07 מ"מ) וכותנה בתוך תיבת אלומיניום והוא החיטוי אותם ב 120 ° צ' עבור 0.5 h. לחטא את המכסה עם 75% אתנול. מייבשים את כלי הניתוח בתנור ייבוש.
- הכינו פתרון של 2% הנחה, הכניסו אותו לאמבט מים ב-75 ° צ' כדי להימנע מחיזוק.
- השימוש isofלאנה מעורבב עם חמצן כדי להחטיף את העכבר (2% אינדוקציה ו 1.2 – 1.5% תחזוקה). תקן את העכבר על המנגנון הסטריאוטקאני והשתמש במכשיר חום הוויסות לשמירה על טמפרטורת גוף העכבר ב-37 ° צ' ולמניעת היפותרמיה.
- החלת שכבה דקה של משחת העין המבוססת על נפט לשתי העיניים.
- תחת מיקרוסקופ אנטומי עם תאורה, תפר את העפעף על עין אחת. הפוך את המחט לעבור למרות שני הצדדים של העפעף 2x (איור 1א) ולעשות בערך ארבעה תפרים.
- קשר את הפתיל 2 – 3x ולאחר מכן לקצץ את החוט. החל 3 μL של דבק ייבוש מיידית על הקשר כדי להגביר את יציבותו. לאחר מכן לגזור את החוט הנוסף תפירה.
- לספק הזרקה תוך הצפק של בופרנורפין (1 מ"ג/ק"ג) לעכבר.
- העבר את העכבר על משטח חימום כדי לשמור על טמפרטורת הגוף שלו ב-37 ° c ולמנוע היפותרמיה ולנטר אותו עד שיגיע להכרתו.
- כאשר העכבר הוא ער לחלוטין למקם אותו לתוך כלוב החזקה נפרד.
- בדוק את העפעפיים מדי יום כדי לוודא שהם נשארים סגור ולא נגוע. הוצא את העכבר אם נמצא פתח עפעף.
- לפני הקלטה אלקטרולוגית, השימוש isofלוריאן מעורבב עם חמצן כדי להחטיף את העכבר (2% אינדוקציה ו 1.2 – 1.5% תחזוקה).
- להסיר את התפרים עם מספריים העין כדי לחשוף את גלגל העין. בזהירות לחתוך את עפעפיים העין.
- ריקון העין עם פתרון עדשה ולבדוק את העין תחת מיקרוסקופ לבהירות. לא לכלול עכברים עם אטימות הקרנית או סימנים של זיהום.
2. פיום גולגולת באזור המשקפת של V1 העכבר לאחר מניעת מולקולרית ביום ה -4
- לאחר להרדמה העכבר, לבדוק את עומק ההרדמה על ידי חוסר תגובה צביטה בבוהן.
- מניחים ומתקנים את העכבר על המנגנון הסטריאוטקאני. התאימו את גובה האוזן ואת מוט השיניים כדי לשמור על המוח שטוח ויציב.
- השתמש במשטח חימום כדי לשמור על טמפרטורת הגוף.
- להחיל משחה העין המבוססת על הנפט על פני השטח של העיניים כדי לשמור אותם לח.
- להסיר את השיער על ראשו של העכבר כדי לחשוף את עורו. לשפשף את העור עם חלוק לסירוגין של יוד ו 70% אתנול 3x.
- במקום 8 x 8 מ"מ שטח של העור בין האוזניים כדי לחשוף את הגולגולת ולהסיר את רקמת הקרקפת. ואז להסיר את רקמת החיבור שמעליה עם 30% חמצן מימן.
- לקדוח חור בעובי 1 מילימטר. בגולגולת מעל המוח הראשי מוספית בורג עצם קטן בחור כהפניה.
- בצע פתיחת גולגולת קטן בקוטר 1 מ"מ באזור המשקפת V1 מן המחצית החצי הצלעות אל העין משולל (איור 1B, a-P: למדא-0.51 – למדא + 1.67 מ"מ; M-L:-2.6 – 3.0 מ"מ; D-V: 0 – 1 מ"מ). הסר בזהירות את רסיס הגולגולת מבלי לפגוע במוח.
- לכסות את המשטח בקליפת האדמה נחשף עם 75 μL של 2% agarose ב 40 ° צ' כדי למנוע ייבוש.
- לתקן אלקטרודות טונגסטן על המסגרת סטריאוטקאית. מניחים את האלקטרודה טונגסטן אנכית על פני השטח של קליפת חשופה, האזור המשקפת של V1, כדי לוודא כי התאים מוקלטים להגיב לשתי העיניים.
- השתמש מטליות כותנה כדי להסיר את ג'ל העין ולהחיל שמן סיליקון לעין כל 2 h.
3. גירוי חזותי והקלטה אלקטרופיסיולוגית
- מסווה את העין האחת. עם צלחת פלסטיק שאינה שקופה מקמו צג LCD 23 ס מ מעין העכבר.
- להקטין את ההרדמה ל 0.5 – 0.8% כאשר העכבר מורדם לחלוטין.
- לקדם את האלקטרודה המיקרואלקטרודה לאט עם שמן הידראולי מיקרומניפולציה. להפסיק את זה כאשר יחס האות לרעש גבוה הוא נצפתה האלקטרודה מתקדמת לשכבה 4 (איור 1ג, כ 250 – 450 יקרומטר לעומק). ודא שפקטור הגברה מוגדר ב-1,000, המסנן ב-300-100 הרץ ובקצב הדגימה ב-40 Hz.
- הצגת sinusoidal פומפיה הנעה בשדה מלא (איור 1D, 12 כיוונים, 100% ניגודיות, 2 הרץ של תדר זמני, 0.04 מחזורים לרמה של תדר מרחבי) על צג ה-LED.
- למדוד את התגובה של התא על ידי גירוי העין מוסילמה ובאופן בלתי צלעות בנפרד. הווה 3 – 5x סך הכל.
- למדוד את התגובות של חמישה עד שמונה תאים בכל חדירה. בצע ארבע עד שש חדירות בכל עכבר.
- לאחר ההקלטה, כוונן את קצב הזרימה של isofלוריאן ל-5% או יותר, המשך בחשיפה למשך 1 דקות ולאחר מכן בצע את הפריקה הצווארי.
הערה: חדירות נפרדות היו מרווחים לפחות 200 יקרומטר מלבד באזור המשקפת של V1.
4. מיון דקר מחוץ לשורה וניתוח נתונים
- מזהים דוקרנים כשהאות הגולמי חוצה את רמת הסף. יישר קוצים שנלכדו בפסגה החיובית או השלילית הראשונה. השתמש בתוכנה כדי לזהות קוצים מתאים שונים.
- הגדר שני סמנים: אחד עבור חיובי והאחר עבור הטיה שלילית. הגדר את תבנית הדקר (איור 2א). הגדר את אזור התבנית לזה עם הווריאציה המשמעותית ביותר בין מחלקות שונות של קוצים.
- השתמש בניתוח רכיבים ראשיים כדי להפריד ביניהן לאשכולות. שיטות התקבצות יכולות להשתנות בין מעבדות שונות.
- סווג את היתד של גבול באמצעות אלגוריתם K-אמצעים.
- לתאם את הכיוון עם שיעור ירי היתד ולהתוות את האוריינטציה כוונון עקומות עבור העין מוסילמה והעיניים בעלת הצלעות.
- חשב את אינדקס ה-OD עבור היחידה היחידה, המייצגת את יחס הכוח הכולל של התגובה/הצלעות:
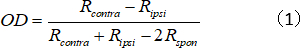
כאשר rקונטרה ו- ripsi הם התגובה האופטימלית של התא לקבלת צלעות והעין, בהתאמה, ו Rב הוא הפעילות הספונטנית של התא. - הקצה ציונים של OD ל-1 – 7 כדלקמן:-1 עד 0.75 = 1; -0.75 עד 0.45 = 2; -0.45 עד 0.15 = 3; -0.15 עד 0.15 = 4; 0.15 עד 0.45 = 5; 0.45 עד 0.75 = 6; ו 0.75-1 = 7.
- חשב את מדד הטיה הצלעות (לח ק):
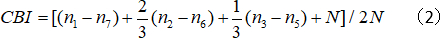
כאשר n הוא מספר התאים ו- nx שווה למספר התאים עם הניקוד השווה ל-x.
Access restricted. Please log in or start a trial to view this content.
תוצאות
התוצאות הנסיוניות המתוארות כאן מאפשרות מדידות מוצלחות של MD ו-OD מעכבר שאינו משולל מצוקה במהלך התקופה הקריטית (P19 – P32). איור 1 מראה כיצד לבצע הקלטות יחידה יחידה בשכבה 4 מ V1 האזור המשקפת להשוואת התגובות העין והצלעות מוסדרות 4 ימים לאחר MD. איור 2 מראה את המיון ספיי...
Access restricted. Please log in or start a trial to view this content.
Discussion
אנו מציגים פרוטוקול מפורט עבור MD ומדידת הפלסטיות של OD על ידי הקלטה יחידה אחת. פרוטוקול זה נמצא בשימוש נרחב במדעי המוח החזותי. למרות פרוטוקול MD אינו מסובך, יש כמה הליכים כירורגיים קריטיים שיש לעקוב בזהירות. ראשית, ישנם שני פרטים חשובים המבטיחים את איכות התפרים. תפר הוא יציב מספיק אם התפרים מ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים כי אין להם אינטרסים פיננסיים מתחרים.
Acknowledgements
מחקר זה היה נתמך על ידי הקרן הלאומית למדעי הטבע של סין (81571770, 81771925, 81861128001).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 502 glue | M&G Chenguang Stationery Co., Ltd. | AWG97028 | |
| Acquizition card | National Instument | PCI-6250 | |
| Agarose | Biowest | G-10 | |
| Amplifier | A-M system | Model 1800 | |
| Atropine | Aladdin Bio-Chem Technology Co., Ltd | A135946-5 | |
| Brain Stereotaxic Apparatus | RWD Life Science Co.,Ltd | 68001 | |
| Cohan-Vannas spring scissors | Fine Science Tools | 15000-02 | |
| Contact Lenses Solutions | Beijing Dr. Lun Eye Care Products Co., Ltd. | GM17064 | |
| Cotton swabs | Henan Guangderun Medical Instruments Co.,Ltd | ||
| Fine needle holder | SuZhou Stronger Medical Instruments Co.,Ltd | CZQ1370 | |
| Forcep | 66 Vision Tech Co., Ltd. | 53320A | |
| Forcep | 66 Vision Tech Co., Ltd. | 53072 | |
| Forcep | 66 Vision Tech Co., Ltd. | #5 | |
| Heating pad | Stryker | TP 700 T | |
| Illuminator | Motic China Group Co., Ltd. | MLC-150C | |
| Isoflurane | RWD Life Science Co.,Ltd | R510-22 | |
| LCD monitor | Philips (China) Investment Co., Ltd. | 39PHF3251/T3 | |
| Microscope | SOPTOP | SZMT1 | |
| Noninvasive Vital Signs Monitor | Mouseox | ||
| Oil hydraulic micromanipulator | NARISHIGE International Ltd. | PC-5N06022 | |
| Petrolatum Eye Gel | Dezhou Yile Disinfection Technology Co., Ltd. | 17C801 | |
| Spike2 | Cambridge Electronic Design, Cambridge, UK | Spike2 Version 9 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54010 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54002 | |
| Suture Needle | Ningbo Medical Co.,Ltd | 3/8 arc 2.5*8 | |
| Tungsten Electrode | FHC, Inc | L504-01B | |
| Xylocaine | Huaqing |
References
- Hubel, D. H., Wiesel, T. N. Effects of monocular deprivation in kittens. Naunyn-Schmiedebergs Archiv für experimentelle Pathologie und Pharmakologie. 248 (6), 492-497 (1964).
- Daw, N. W., Fox, K., Sato, H., Czepita, D. Critical period for monocular deprivation in the cat visual cortex. Journal of Neurophysiology. 67 (1), 197-202 (1992).
- Guire, E. S., Lickey, M. E., Gordon, B. Critical period for the monocular deprivation effect in rats: assessment with sweep visually evoked potentials. Journal of Neurophysiology. 81 (1), 121-128 (1999).
- Wang, L., Sarnaik, R., Rangarajan, K. V., Liu, X., Cang, J. Visual receptive field properties of neurons in the superficial superior colliculus of the mouse. Journal of Neuroscience. 30 (49), 16573-16584 (2010).
- Niell, C. M. Cell Types, circuits, and receptive fields in the mouse visual cortex. Annual Review of Neuroscience. 38 (1), 413-431 (2015).
- Lee, S. H., et al. Activation of specific interneurons improves V1 feature selectivity and visual perception. Nature. 488 (8), 379-383 (2012).
- Cossell, L., et al. Functional organization of excitatory synaptic strength in primary visual cortex. Nature. 518 (2), 399-403 (2015).
- Lacaruso, M. F., Gasler, L. T., Hofer, S. B. Synaptic organization of visual space in primary visual cortex. Nature. 547 (7), 449-452 (2017).
- Metin, C., Godement, P., Imbert, M. The primary visual cortex in the mouse: Receptive field properties and functional organization. Experimental Brain Research. 69 (3), 594-612 (1988).
- Marshel, J. H., Garrett, M. E., Nauhaus, I., Callaway, E. M. Functional specialization of seven mouse visual cortical areas. Neuron. 72 (6), 1040-1054 (2011).
- Gordon, J. A., Stryker, M. P. Experience-dependent plasticity of binocular responses in the primary visual cortex of the mouse. The Journal of Neuroscience. 16 (10), 3274-3286 (1996).
- McGee, A. W., Yang, Y., Fischer, Q. S., Daw, N. W., Strittmatter, S. M. Experience-driven plasticity of visual cortex limited by myelin and Nogo receptor. Science. 309 (5744), 2222-2226 (2005).
- Sawtell, N. B., et al. NMDA receptor-dependent ocular dominance plasticity in adult visual cortex. Neuron. 38 (6), 977-985 (2003).
- Hofer, S. B., Mrsic-Flogel, T. D., Bonhoeffer, T., Hubener, M. Prior experience enhances plasticity in adult visual cortex. Nature Neuroscience. 9 (12), 127-132 (2006).
- Crozier, R. A., Wang, Y., Liu, C., Bear, M. F. Deprivation-induced synaptic depression by distinct mechanisms in different layers of mouse visual cortex. Proceedings of the National Academy of Sciences. 104 (4), 1383-1388 (2007).
- Tagawa, Y., Kanold, P. O., Majdan, M., Shatz, C. J. Multiple periods of functional ocular dominance plasticity in mouse visual cortex. Nature Neuroscience. 8 (3), 380-388 (2005).
- Lickey, M. E., Pham, T. A., Gordon, B. Swept contrast visual evoked potentials and their plasticity following monocular deprivation in mice. Vision Research. 44, 3381-3387 (2004).
- Cang, J., Kalatsky, V. A., Lowel, S., Stryker, M. P. Optical imaging of the intrinsic signal as a measure of cortical plasticity in the mouse. Vision Neuroscience. 22 (5), 685-691 (2005).
- Khan, I. U., et al. Evaluation of different suturing techniques for cystotomy closure in canines. Journal of Animal & Plant Sciences. 23 (4), 981-985 (2013).
- Weisman, D. L., Smeak, D. D., Birchard, S. J., Zweigart, S. L. Comparison of a continuous suture pattern with a simple interrupted pattern for enteric closure in dogs and cats: 83 cases (1991-1997). Journal of the American Veterinary Medical Association. 214 (10), 1507-1510 (1999).
- Heneghan, C. P. H., Thornton, C., Navaratnarajah, M., Jones, J. G. Effect of isoflurane on the auditory evoked response in man. BJA: British Journal of Anaesthesia. 59 (3), 277-282 (1987).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomenal. Physiological Reviews. 65 (1), 37-100 (1985).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved