このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウス初等視覚皮質における単眼視外剥離と眼優位可塑性測定
* これらの著者は同等に貢献しました
要約
ここでは、臨界期の視覚可塑性の神経機構と特定遺伝子の影響を研究するための重要な方法である単眼視欠損および眼優位可塑性解析のための詳細なプロトコルを紹介します。ビジュアル開発。
要約
単眼視欠乏は、一次視覚皮質応答可塑性を誘導する優れた実験的パラダイムである。一般に、刺激に対する眼の対眼に対する皮質の応答は、マウスの主要視覚皮質(V1)の両眼セグメントにおける眼の眼の応答よりもはるかに強い。哺乳類の臨界期に、対側眼を縫合すると、V1細胞の対側眼刺激に対する応答性が急速に失われる。トランスジェニック技術の開発が続く中、トランスジェニックマウスを実験モデルとして用いて、特定の遺伝子が眼優位(OD)可塑性に及ぼす影響を調べる研究が増えています。本研究では、単眼視欠乏に関する詳細なプロトコルを紹介し、マウスV1におけるOD可塑性の変化を計算する。臨界期の4日間の単眼欠損(MD)の後、各ニューロンの向きの調整曲線を測定し、V1の層4ニューロンのチューニング曲線を、眼の両側と眼の両側の刺激との間で比較する。反側バイアス指数(CBI)は、各細胞の眼のODスコアを使用して、OD可塑性の程度を示すために計算することができる。この実験技術は、臨界期におけるOD可塑性の神経機構を研究し、神経発達における特定の遺伝子の役割を調査する上で重要である。大きな制限は、急性研究が異なる時間に同じマウスの神経可塑性の変化を調査できないことです。
概要
単眼視欠乏は、V1可塑性を調べる優れた実験パラダイムである。神経発達における視覚体験の重要性を研究するために、デビッド・フーベルとTorsten Wiesel1,2様々な時点で、様々な期間のために片目で正常な視力の子猫を奪った。その後、奪われた目と奪われた目に対するV1の応答強度の変化を観察した。彼らの結果は、最初の3ヶ月間に閉じられていた目に反応するニューロンの数が異常に少ないことを示した。しかし、子猫のニューロンからの反応は、1年間閉じられた正常な成虫の猫の目のものとすべての点で同じままであり、子猫は回復しませんでした。成虫猫のMDは、OD可塑性を誘導することはできません。したがって、視覚経験がV1配線に及ぼす影響は、短く明確に定義された開発段階で強く、その前後に同じ刺激の影響が少ない。視覚入力に対する感受性の増加のこのような段階は、視覚皮質における臨界期として知られている。
マウスは夜行性動物であるが、マウスV1の個々のニューロンは、猫3、4、5に見られるニューロンと同様の特性を有する。近年、トランスジェニック技術の急速な発展に伴い、視覚神経科学における研究の増加は、実験モデル6、7、8としてマウスを使用している。マウスの視覚研究では、神経科学者は突然変異体とノックアウトマウスラインを使用し、マウスの遺伝的構成を制御することができます。マウスV1はODカラムを欠いているが、V1双眼ゾーンの単一ニューロンは有意なOD特性を示す。例えば、ほとんどの細胞は、ipsilateral刺激よりも対側刺激に対してより強く反応する。臨界期中に片目を一時的に閉じ、OD指数分布9,10,11の有意な変化を誘発する。したがって、MDは、神経発達障害に関与する遺伝子が生体内の皮質可塑性にどのように影響するかを調べるためのOD可塑性モデルを確立するために使用することができる。
ここでは、MDの実験方法を紹介し、単眼視欠乏時のOD可塑性の変化を解析する一般的な方法(電気生理学的記録)を提案する。この方法は、20年以上20年以上の12年、13年、14、15、16年のために多くの研究室で広く使用されています。OD可塑性の測定にも用いられる他の方法があり、慢性視覚誘発電位(VEP)記録17、および固有光学イメージング(IOI)18などがある。この鋭い方法の重要な利点は、それが従うのが容易であり、結果が非常に信頼性が高いということです。
Access restricted. Please log in or start a trial to view this content.
プロトコル
このプロトコルでは、雄C57Bl/6マウスは、四川省医学アカデミーと四川省人民病院実験動物研究所から得られた。すべての動物のケアと実験手順は、中国の電子科学技術大学の動物ケアと使用委員会によって承認されました。
1. マウスの出生後28日目の単眼剥奪(MD)
- 手術用具、縫合針(直径0.25mm、ひも径0.07mm)と綿棒をアルミニウムボックスに入れ、120°Cで0.5時間オートクレーブします。乾燥オーブンで外科用具を乾燥させる。
- 2%のアガロース溶液を調製し、固化を避けるために75°Cの水浴に入れます。
- マウスを麻酔するために酸素と混合イソファフルランを使用してください(2%誘導と1.2-1.5%のメンテナンス)。ステレオタキシック装置でマウスを固定し、熱調節装置を使用してマウスの体温を37 °Cに保ち、低体温を防ぎます。
- 両眼に石油系眼軟膏の薄い層を塗布します。
- 解剖顕微鏡の下で照明を用いて、片目に眼瞼を縫合する。まぶた2xの両側(図1A)を通して針を通し、約4針を作ります。
- スレッドを 2 ~ 3 倍ノットし、スレッドをトリムします。結び目に3μLの瞬間乾燥接着剤を塗布して安定性を高める。その後、余分な縫合糸をカットします。
- ブプレノルフィン(1 mg/kg)の腹腔内注射をマウスに与える。
- マウスを加熱パッドに移し、体温を37°Cに保ち、低体温を予防し、意識を取り戻すまで監視します。
- マウスが完全に目を覚ましているときは、別の保持ケージに入れます。
- 毎日まぶたをチェックして、閉じて感染していない状態を確認します。まぶたが見つかった場合は、マウスを除外します。
- 電気生理学的記録の前に、マウスを麻酔するために酸素と混合イセフルランを使用してください(2%の誘導および1.2-1.5%の維持)。
- 目のはさみでステッチを取り外し、眼球を露出します。目の蓋を慎重にトリミングします。
- レンズ溶液で目を洗い流し、顕微鏡で目を確認して明快さを確認してください。角膜の不透明性または感染の兆候を有するマウスを除外する。
2. 4日目の単眼脱退後のマウスV1双眼鏡領域の開頭術
- マウスを麻酔した後、つま先のピンチに対する応答の欠如によって麻酔の深さをチェックします。
- ステレオタキシー装置にマウスを置き、固定します。耳のバーと歯の棒の高さを調整して、脳を平らに安定に保ちます。
- 体温を維持するために加熱パッドを使用してください。
- 目の表面に石油系の目の軟膏を塗り、湿らせておきます。
- マウスの頭の毛を取り除き、皮膚を露出させます。ヨウ素と70%エタノール3倍の交互のスクラブで皮膚をこすります。
- 耳の間に皮膚の8×8mmの領域を切開して頭蓋骨を露出させ、頭皮組織を取り除きます。次に、30%過酸化水素で上に付いた結合組織を除去する。
- 小脳の上の頭蓋骨に1×1mmの穴を開けます。穴に小さな骨ネジを参考に貼り付けます。
- V1双眼領域の直径1mmの小さな開頭術を、逆半球から奪われた眼へ(図1B、A-P:λ -0.51-λ +1.67mm;M-L: -2.6 – -3.0 mm;D-V: 0– 1 mm)。脳を傷つけることなく、慎重に頭蓋骨の断片を取り除きます。
- 40°Cで75μLのアガロースで露出した皮質表面を覆い、乾燥を防ぎます。
- 立体タックスフレームにタングステン電極を固定します。露出した皮質の表面にタングステン電極を垂直に置き、V1の両眼領域は、記録された細胞が両眼に反応することを確認する。
- 綿棒を使用して目のゲルを取り除き、シリコンオイルを2時間ごとに目に塗布します。
3. 視覚刺激と電気生理学的記録
- 透明でないプラスチック板で片目をマスクします。マウスの目から液晶モニターを23cmに置きます。
- マウスが完全に麻酔されたとき、麻酔を0.5~0.8%に減らします。
- 油式マイクロマニピュレーターを使用して、微小電極電極をゆっくりと進めます。高い信号対ノイズ比が観測され、電極が層4に進んだ時に止めてください(図1C、深さ約250~450μm)。増幅率が1,000、フィルタが300~100Hz、サンプルレートが40Hzであることを確認します。
- LEDモニタ上にフルフィールド移動の大二乗格子(図1D、12方向、100%コントラスト、一時的な周波数の2つのHz、空間周波数の度合いあたり0.04サイクル)を提示します。
- イプシ側眼と反眼を別々に刺激することによって細胞の応答を測定する。現在の合計は3~5倍です。
- 各浸透で5〜8個の細胞の応答を測定します。各マウスで4~6回の貫入を行います。
- 記録後、イソファフルランの流量を5%以上に調整し、イソファフルラン曝露を1分間継続し、次いで頸椎転位を行う。
注:V1双眼鏡ゾーンでは、別々の貫通が200μm以上離れていました。
4. オフラインスパイクソートとデータ分析
- 未加工の信号がしきい値レベルを超えたときにスパイクを検出します。キャプチャしたスパイクを最初の正または負のピークに揃えます。ソフトウェアを使用して、異なるセルからのスパイクを検出します。
- 2 つのカーソルを設定します: 1 つは正向きで、もう 1 つは負のたわみ用です。スパイクテンプレートを設定します(図2A)。異なるクラスのスパイク間で最も大きな変化を伴うテンプレート領域を設定します。
- 主成分分析を使用して、それらをクラスターに分割します。クラスタリング方法は、研究室によって異なる場合があります。
- K-means アルゴリズムを使用して境界のスパイクを分類します。
- 向きをスパイク発射速度と相関させ、ipsilater および反側眼の向きの調整曲線をプロットします。
- 単一ユニットの OD インデックスを計算します。
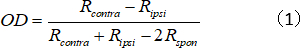
ここでRcontraとRipsiは、それぞれ、対側眼とイプシレーター眼に対する細胞の最適応答であり、Rスポンは細胞の自発的な活性である。 - OD スコアを次のように 1 ~ 7 に割り当てます: -1 ~ -0.75 = 1。−0.75 から−0.45 = 2;−0.45 から−0.15 = 3;−0.15~ 0.15 = 4;0.15 から 0.45 = 5;0.45 から 0.75 = 6;0.75 から 1 = 7 にします。
- 反側バイアス指数(CBI)を計算します。
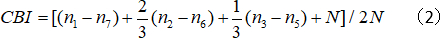
ここで、Nはセル番号、nxは OD スコアが x に等しいセル番号と等しくなります。
Access restricted. Please log in or start a trial to view this content.
結果
ここで説明する実験結果は、重要な期間(P19-P32)の間に奪われたマウスと奪われたマウスからのMDおよびOD可塑性の測定を成功させる。図1は、MDの4日後にイプシラナル眼と反眼の応答を比較するための双眼ゾーンをV1から層4で単一ユニット記録を行う方法を示す。図 2は、ipsilater および contralateral 目を刺激するためのスパイクの並べ替えと方位調整?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
MDと測定の可塑性を単一ユニット記録で詳細に説明します。このプロトコルは視覚神経科学で広く使用されています。MDプロトコルは複雑ではありませんが、慎重に従わなければならないいくつかの重要な外科的処置があります。まず、ステッチの品質を確保する2つの重要な詳細があります。縫合は、縫合がまぶたの内側部分に集中している場合に十分に安定である。さらに、結び目の頭部?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、彼らが競合する財政的利益を持っていないと宣言する。
謝辞
この研究は、中国国立自然科学財団(81571770、81771925、81861128001)によって支持されました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 502 glue | M&G Chenguang Stationery Co., Ltd. | AWG97028 | |
| Acquizition card | National Instument | PCI-6250 | |
| Agarose | Biowest | G-10 | |
| Amplifier | A-M system | Model 1800 | |
| Atropine | Aladdin Bio-Chem Technology Co., Ltd | A135946-5 | |
| Brain Stereotaxic Apparatus | RWD Life Science Co.,Ltd | 68001 | |
| Cohan-Vannas spring scissors | Fine Science Tools | 15000-02 | |
| Contact Lenses Solutions | Beijing Dr. Lun Eye Care Products Co., Ltd. | GM17064 | |
| Cotton swabs | Henan Guangderun Medical Instruments Co.,Ltd | ||
| Fine needle holder | SuZhou Stronger Medical Instruments Co.,Ltd | CZQ1370 | |
| Forcep | 66 Vision Tech Co., Ltd. | 53320A | |
| Forcep | 66 Vision Tech Co., Ltd. | 53072 | |
| Forcep | 66 Vision Tech Co., Ltd. | #5 | |
| Heating pad | Stryker | TP 700 T | |
| Illuminator | Motic China Group Co., Ltd. | MLC-150C | |
| Isoflurane | RWD Life Science Co.,Ltd | R510-22 | |
| LCD monitor | Philips (China) Investment Co., Ltd. | 39PHF3251/T3 | |
| Microscope | SOPTOP | SZMT1 | |
| Noninvasive Vital Signs Monitor | Mouseox | ||
| Oil hydraulic micromanipulator | NARISHIGE International Ltd. | PC-5N06022 | |
| Petrolatum Eye Gel | Dezhou Yile Disinfection Technology Co., Ltd. | 17C801 | |
| Spike2 | Cambridge Electronic Design, Cambridge, UK | Spike2 Version 9 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54010 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54002 | |
| Suture Needle | Ningbo Medical Co.,Ltd | 3/8 arc 2.5*8 | |
| Tungsten Electrode | FHC, Inc | L504-01B | |
| Xylocaine | Huaqing |
参考文献
- Hubel, D. H., Wiesel, T. N. Effects of monocular deprivation in kittens. Naunyn-Schmiedebergs Archiv für experimentelle Pathologie und Pharmakologie. 248 (6), 492-497 (1964).
- Daw, N. W., Fox, K., Sato, H., Czepita, D. Critical period for monocular deprivation in the cat visual cortex. Journal of Neurophysiology. 67 (1), 197-202 (1992).
- Guire, E. S., Lickey, M. E., Gordon, B. Critical period for the monocular deprivation effect in rats: assessment with sweep visually evoked potentials. Journal of Neurophysiology. 81 (1), 121-128 (1999).
- Wang, L., Sarnaik, R., Rangarajan, K. V., Liu, X., Cang, J. Visual receptive field properties of neurons in the superficial superior colliculus of the mouse. Journal of Neuroscience. 30 (49), 16573-16584 (2010).
- Niell, C. M. Cell Types, circuits, and receptive fields in the mouse visual cortex. Annual Review of Neuroscience. 38 (1), 413-431 (2015).
- Lee, S. H., et al. Activation of specific interneurons improves V1 feature selectivity and visual perception. Nature. 488 (8), 379-383 (2012).
- Cossell, L., et al. Functional organization of excitatory synaptic strength in primary visual cortex. Nature. 518 (2), 399-403 (2015).
- Lacaruso, M. F., Gasler, L. T., Hofer, S. B. Synaptic organization of visual space in primary visual cortex. Nature. 547 (7), 449-452 (2017).
- Metin, C., Godement, P., Imbert, M. The primary visual cortex in the mouse: Receptive field properties and functional organization. Experimental Brain Research. 69 (3), 594-612 (1988).
- Marshel, J. H., Garrett, M. E., Nauhaus, I., Callaway, E. M. Functional specialization of seven mouse visual cortical areas. Neuron. 72 (6), 1040-1054 (2011).
- Gordon, J. A., Stryker, M. P. Experience-dependent plasticity of binocular responses in the primary visual cortex of the mouse. The Journal of Neuroscience. 16 (10), 3274-3286 (1996).
- McGee, A. W., Yang, Y., Fischer, Q. S., Daw, N. W., Strittmatter, S. M. Experience-driven plasticity of visual cortex limited by myelin and Nogo receptor. Science. 309 (5744), 2222-2226 (2005).
- Sawtell, N. B., et al. NMDA receptor-dependent ocular dominance plasticity in adult visual cortex. Neuron. 38 (6), 977-985 (2003).
- Hofer, S. B., Mrsic-Flogel, T. D., Bonhoeffer, T., Hubener, M. Prior experience enhances plasticity in adult visual cortex. Nature Neuroscience. 9 (12), 127-132 (2006).
- Crozier, R. A., Wang, Y., Liu, C., Bear, M. F. Deprivation-induced synaptic depression by distinct mechanisms in different layers of mouse visual cortex. Proceedings of the National Academy of Sciences. 104 (4), 1383-1388 (2007).
- Tagawa, Y., Kanold, P. O., Majdan, M., Shatz, C. J. Multiple periods of functional ocular dominance plasticity in mouse visual cortex. Nature Neuroscience. 8 (3), 380-388 (2005).
- Lickey, M. E., Pham, T. A., Gordon, B. Swept contrast visual evoked potentials and their plasticity following monocular deprivation in mice. Vision Research. 44, 3381-3387 (2004).
- Cang, J., Kalatsky, V. A., Lowel, S., Stryker, M. P. Optical imaging of the intrinsic signal as a measure of cortical plasticity in the mouse. Vision Neuroscience. 22 (5), 685-691 (2005).
- Khan, I. U., et al. Evaluation of different suturing techniques for cystotomy closure in canines. Journal of Animal & Plant Sciences. 23 (4), 981-985 (2013).
- Weisman, D. L., Smeak, D. D., Birchard, S. J., Zweigart, S. L. Comparison of a continuous suture pattern with a simple interrupted pattern for enteric closure in dogs and cats: 83 cases (1991-1997). Journal of the American Veterinary Medical Association. 214 (10), 1507-1510 (1999).
- Heneghan, C. P. H., Thornton, C., Navaratnarajah, M., Jones, J. G. Effect of isoflurane on the auditory evoked response in man. BJA: British Journal of Anaesthesia. 59 (3), 277-282 (1987).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomenal. Physiological Reviews. 65 (1), 37-100 (1985).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved