È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Deprivazione visiva monoculare e misurazione della plasticità della dominanza oculare nella Corteccia visiva primaria del mouse
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, presentiamo protocolli dettagliati per la deprivazione visiva monoculare e l'analisi della plasticità della dominanza oculare, che sono metodi importanti per studiare i meccanismi neurali della plasticità visiva durante il periodo critico e gli effetti di geni specifici su sviluppo visivo.
Abstract
La privazione visiva monoculare è un eccellente paradigma sperimentale per indurre la plasticità della risposta corticale visiva primaria. In generale, la risposta della corteccia all'occhio contralaterale a uno stimolo è molto più forte della risposta dell'occhio ipsilaterale nel segmento binoculare della corteccia visiva primaria del topo (V1). Durante il periodo critico dei mammiferi, suturare l'occhio contralaterale si tradurrà in una rapida perdita di reattività delle cellule V1 alla stimolazione oculare contralaterale. Con il continuo sviluppo di tecnologie transgeniche, sempre più studi utilizzano topi transgenici come modelli sperimentali per esaminare gli effetti di specifici geni sulla plasticità della dominanza oculare (OD). In questo studio, introduciamo protocolli dettagliati per la privazione visiva monoculare e calcoliamo il cambiamento nella plasticità OD nel mouse V1. Dopo la deprivazione monoculare (MD) per 4 giorni durante il periodo critico, vengono misurate le curve di accordatura dell'orientamento di ogni neurone e le curve di accordatura dei neuroni di strato quattro in V1 vengono confrontate tra la stimolazione degli occhi ipsilaterali e contralaterale. L'indice di distorsione cotralaterale (CBI) può essere calcolato utilizzando il punteggio OD oculare di ogni cella per indicare il grado di plasticità OD. Questa tecnica sperimentale è importante per studiare i meccanismi neurali della plasticità OD durante il periodo critico e per esaminare i ruoli di geni specifici nello sviluppo neurale. La limitazione principale è che lo studio acuto non può studiare il cambiamento nella plasticità neurale dello stesso topo in un momento diverso.
Introduzione
La privazione visiva monoculare è un eccellente paradigma sperimentale per esaminare la plasticità V1. Per studiare l'importanza dell'esperienza visiva nello sviluppo neurale, David Hubel e Torsten Wiesel1,2 gattini privati della visione normale in un occhio in vari punti temporali e per diversi periodi di tempo. Hanno poi osservato i cambiamenti nell'intensità di risposta in V1 per gli occhi privati e non privati. I loro risultati hanno mostrato un numero anormalmente basso di neuroni che reagiscono all'occhio che era stato suturato chiuso nei primi tre mesi. Tuttavia, le risposte dei neuroni nei gattini sono rimaste identiche sotto tutti gli aspetti a quelle dell'occhio di un gatto adulto normale che è stato suturato chiuso per un anno, e i gattini non si sono ripresi. La MD nei gatti adulti non può indurre la plasticità OD. Pertanto, l'impatto dell'esperienza visiva sul cablaggio V1 è forte durante una breve fase di sviluppo ben definita, prima e dopo la quale gli stessi stimoli hanno meno influenza. Tale fase di maggiore suscettibilità all'input visivo è nota come periodo critico nella corteccia visiva.
Anche se il topo è un animale notturno, i singoli neuroni nel topo V1 hanno proprietà simili ai neuroni presenti nei gatti3,4,5. Negli ultimi anni, con il rapido sviluppo della tecnologia transgenica, un numero crescente di studi in neuroscienze visive ha utilizzato i topi come modello sperimentale6,7,8. Negli studi visivi sui topi, i neuroscienziati usano mutanti e linee di topo da urlo, che consentono il controllo sulla composizione genetica dei topi. Anche se i topi V1 mancano di colonne OD, singoli neuroni nella zona binoculare V1 mostrano proprietà OD significative. Ad esempio, la maggior parte delle cellule risponde più fortemente alla stimolazione contralaterale che alla stimolazione ipsilaterale. La chiusura temporanea di un occhio durante il periodo critico induce un cambiamento significativo nella distribuzione dell'indice OD9,10,11. Pertanto, MD può essere utilizzato per stabilire un modello di plasticità OD per studiare come i geni coinvolti nei disturbi dello sviluppo neurale influenzano la plasticità corticale in vivo.
Qui, introduciamo un metodo sperimentale per MD e suggeriamo un metodo comunemente usato (registrazione elettrofisiologica) per analizzare il cambiamento nella plasticità OD durante la privazione visiva monoculare. Il metodo è stato ampiamente utilizzato in molti laboratori per più di 20 anni12,13,14,15,16. Ci sono altri metodi utilizzati per misurare la plasticità OD pure, come la registrazione cronica visual e evoked potential (VEP)17, e l'imaging ottico intrinseco (IOI)18. Il vantaggio significativo di questo metodo acuto è che è facile da seguire e i risultati sono straordinariamente affidabili.
Access restricted. Please log in or start a trial to view this content.
Protocollo
In questo protocollo, i topi maschi C57Bl/6 sono stati ottenuti dall'Istituto di Animali da Laboratorio dell'Accademia di Scienze Mediche del Sichuan e dall'Ospedale Popolare Provinciale del Sichuan. Tutte le procedure di cura e sperimentale per gli animali sono state approvate dall'Institutional Animal Care and Use Committee dell'Università di Electronic Science and Technology of China.
1. Privazione monoculare (MD) al giorno postnatale 28 nei topi
- Mettere gli utensili chirurgici, l'ago di sutura (0,25 mm di diametro, diametro delle corde 0,07 mm) e i tamponi di cotone in una scatola di alluminio e autoclarli a 120 gradi centigradi per 0,5 h. Sterilizzare il cofano con il 75% di etanolo. Asciugare gli utensili chirurgici in un forno di essiccazione.
- Preparare una soluzione di 2% agarose, metterla in un bagno d'acqua a 75 gradi centigradi per evitare di solidificarsi.
- Utilizzare isoflurane mescolato con ossigeno per anestesizzare il topo (2% induzione e 1.2–1.5% manutenzione). Fissare il mouse sull'apparato stereotassico e utilizzare un dispositivo di regolazione del calore per mantenere la temperatura corporea del mouse a 37 gradi centigradi e prevenire l'ipotermia.
- Applicare un sottile strato di unguento oculare a base di petrolio su entrambi gli occhi.
- Sotto il microscopio anatomico con illuminazione, suturare la palpebra su un occhio. Fare passare l'ago attraverso entrambi i lati della palpebra 2x (Figura 1A) e fare circa quattro punti.
- Annotare il filo 2–3x e quindi tagliare il filo. Applicare 3 -L di colla di essiccazione istantanea sul nodo per aumentarne la stabilità. Quindi tagliare il filo di sutura supplementare.
- Fornire un'iniezione intraperitoneale di buprenorfine (1 mg/kg) al topo.
- Trasferire il mouse su una piastra di riscaldamento per mantenere la temperatura corporea a 37 gradi centigradi e prevenire l'ipotermia e monitorarlo fino a quando non riprende conoscenza.
- Quando il mouse è completamente sveglio posizionarlo in una gabbia di detenzione separata.
- Controllare le palpebre ogni giorno per assicurarsi che rimangano chiuse e non infettate. Escludere il mouse se viene trovata un'apertura della palpebra.
- Prima della registrazione elettrofisiologica, utilizzare l'isoflurane mescolato con ossigeno per anesizzare il topo (2% di induzione e 1,2–1,5% di manutenzione).
- Rimuovere i punti con le forbici per gli occhi per esporre il bulbo oculare. Tagliare con attenzione i coperchi degli occhi.
- Sciacquare l'occhio con la soluzione delle lenti e controllare l'occhio al microscopio per maggiore chiarezza. Escludere i topi con opacità corneale o segni di infezione.
2. Craniotomia nella regione binoculare V1 del topo dopo la privazione monoculare il quarto giorno
- Dopo aver anestesizzato il mouse, controllare la profondità dell'anestesia dalla mancanza di risposta a un pizzico di punta.
- Posizionare e fissare il mouse sull'apparato stereotassico. Regolare l'altezza della barra dell'orecchio e dell'asta dentale per mantenere il cervello piatto e stabile.
- Utilizzare una piastra di riscaldamento per mantenere la temperatura corporea.
- Applicare un unguento per gli occhi a base di petrolio sulla superficie degli occhi per mantenerli umidi.
- Rimuovere i capelli sulla testa del mouse per esporre la sua pelle. Strofinare la pelle con scrub alternati di iodio e 70% di etanolo 3x.
- Incise un'area 8 x 8 mm della pelle tra le orecchie per esporre il cranio e rimuovere il tessuto del cuoio capelluto. Quindi rimuovere il tessuto connettivo sovrastante con 30% di perossido di idrogeno.
- Forare un foro di 1 x 1 mm nel cranio sopra il cervelletto. Fissare una piccola vite ossea nel foro come riferimento.
- Eseguire una piccola craniotomia di 1 mm di diametro nella regione binoculare V1 dall'emisfero contralaterale all'occhio privato (Figura 1B, A-P: lambda -0,51–lambda 1,67 mm; M-L: -2,6– -3,0 mm; D-V: 0-1 mm). Rimuovere con attenzione il frammento del cranio senza danneggiare il cervello.
- Coprire la superficie corticale esposta con 75 gradi ll un'agarosa del 2% a 40 gradi centigradi per evitare l'essiccazione.
- Fissare un elettrodo di tungsteno sul telaio stereotassico. Posizionare l'elettrodo di tungsteno verticalmente sulla superficie della corteccia esposta, la regione binoculare di V1, per assicurarsi che le cellule registrate reagiscano a entrambi gli occhi.
- Utilizzare tamponi di cotone per rimuovere il gel per gli occhi e applicare olio di silicio all'occhio ogni 2 h.
3. Stimolazione visiva e registrazione elettrofisiologica
- Mascherare un occhio con una piastra di plastica non trasparente. Posizionare un monitor LCD a 23 cm dall'occhio del mouse.
- Ridurre l'anestesia allo 0,5–0,8% quando il topo è completamente anestesizzato.
- Far avanzare lentamente l'elettrodo del microelettrodo con un micromanipolatore idraulico ad olio. Fermarlo quando si osserva un elevato rapporto segnale-rumore e l'elettrodo è avanzato allo strato 4(Figura 1C, circa 250–450 m di profondità). Assicurarsi che il fattore di amplificazione sia impostato su 1.000, il filtro a 300-100 Hz e la frequenza di campionamento a 40 Hz.
- Presentare una griglia sinusoidale in movimento a pieno campo (Figura 1D, 12 direzioni, 100% di contrasto, 2 Hz di frequenza temporanea, 0,04 cicli per grado di frequenza spaziale) sul monitor LED.
- Misurare la risposta della cellula stimolando separatamente l'occhio ipsilaterale e contralaterale. Presente 3-5x totale.
- Misurare le risposte di cinque-otto cellule in ogni penetrazione. Esegui da quattro a sei penetrazioni in ogni mouse.
- Dopo la registrazione, regolare la portata dell'isoflurane al 5% o superiore, continuare l'esposizione all'isoflurane per 1 min, quindi eseguire la lussazione cervicale.
NOTA: nella zona binoculare V1 sono state distanziate almeno 200 m di distanza.
4. Ordinamento dei picchi off-line e analisi dei dati
- Rileva i picchi quando il segnale grezzo supera un livello di soglia. Allineare i picchi catturati sul primo picco positivo o negativo. Utilizzare il software per rilevare i picchi da celle diverse.
- Impostare due cursori: uno per positivo e l'altro per la deflessione negativa. Impostare il modello di picco (Figura 2A). Impostare l'area del modello su quella con la variazione più significativa tra le diverse classi di picchi.
- Utilizzare l'analisi dei componenti principali per separarli in cluster. I metodi di clustering possono variare da un laboratorio all'altro.
- Classificare il picco di un limite utilizzando l'algoritmo K-means.
- Correlare l'orientamento con il tasso di cottura del picco e tracciare le curve di regolazione dell'orientamento per l'occhio ipsilaterale e contralaterale.
- Calcolare l'indice OD per la singola unità, che rappresenta il rapporto di forza della risposta contralaterale/ipsilaterale:
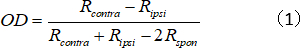
dove Rcontra e Ripsi sono la risposta ottimale della cellula per l'occhio contralaterale e ipsilaterale, rispettivamente, e Rspon è l'attività spontanea della cellula. - Assegnare i punteggi OD a 1-7 nel modo seguente: : da 1 a 0,75 x 1; da 0,75 a 0,45 USD e 2; Da 0,45 a 0,15 USD per 3; Da 0,15 a 0,15 x 4; da 0,15 a 0,45 x 5; da 0,45 a 0,75 x 6; e da 0,75 a 1 .
- Calcolare l'indice di distorsione contralaterale (CBI):
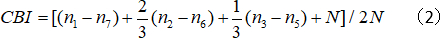
dove N è il numero di cella e nx è uguale al numero di cella con punteggi OD uguali a x.
Access restricted. Please log in or start a trial to view this content.
Risultati
I risultati sperimentali qui descritti consentono misurazioni di plasticità MD e OD di successo da un topo privato e non privo durante il periodo critico (P19-P32). Nella Figura 1 viene illustrato come eseguire registrazioni di unità singole nello strato 4 di V1 la zona binoculare per confrontare le risposte nell'occhio ipsilaterale e contralaterale 4 giorni dopo MD. La figura 2 mostra le misurazioni di sintonizzazione dei picchi e dell'orientamento per stimol...
Access restricted. Please log in or start a trial to view this content.
Discussione
Vi presentiamo un protocollo dettagliato per MD e la misurazione della plasticità OD per singola unità di registrazione. Questo protocollo è ampiamente utilizzato nelle neuroscienze visive. Anche se il protocollo MD non è complicato, ci sono alcune procedure chirurgiche critiche che devono essere seguite con attenzione. In primo luogo, ci sono due dettagli importanti che garantiscono la qualità delle cuciture. La sutura è sufficientemente stabile se i punti sono concentrati nella parte mediale della palpebra. Inolt...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Questo studio è stato sostenuto dalla National Natural Science Foundation of China (81571770, 81771925, 81861128001).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 502 glue | M&G Chenguang Stationery Co., Ltd. | AWG97028 | |
| Acquizition card | National Instument | PCI-6250 | |
| Agarose | Biowest | G-10 | |
| Amplifier | A-M system | Model 1800 | |
| Atropine | Aladdin Bio-Chem Technology Co., Ltd | A135946-5 | |
| Brain Stereotaxic Apparatus | RWD Life Science Co.,Ltd | 68001 | |
| Cohan-Vannas spring scissors | Fine Science Tools | 15000-02 | |
| Contact Lenses Solutions | Beijing Dr. Lun Eye Care Products Co., Ltd. | GM17064 | |
| Cotton swabs | Henan Guangderun Medical Instruments Co.,Ltd | ||
| Fine needle holder | SuZhou Stronger Medical Instruments Co.,Ltd | CZQ1370 | |
| Forcep | 66 Vision Tech Co., Ltd. | 53320A | |
| Forcep | 66 Vision Tech Co., Ltd. | 53072 | |
| Forcep | 66 Vision Tech Co., Ltd. | #5 | |
| Heating pad | Stryker | TP 700 T | |
| Illuminator | Motic China Group Co., Ltd. | MLC-150C | |
| Isoflurane | RWD Life Science Co.,Ltd | R510-22 | |
| LCD monitor | Philips (China) Investment Co., Ltd. | 39PHF3251/T3 | |
| Microscope | SOPTOP | SZMT1 | |
| Noninvasive Vital Signs Monitor | Mouseox | ||
| Oil hydraulic micromanipulator | NARISHIGE International Ltd. | PC-5N06022 | |
| Petrolatum Eye Gel | Dezhou Yile Disinfection Technology Co., Ltd. | 17C801 | |
| Spike2 | Cambridge Electronic Design, Cambridge, UK | Spike2 Version 9 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54010 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54002 | |
| Suture Needle | Ningbo Medical Co.,Ltd | 3/8 arc 2.5*8 | |
| Tungsten Electrode | FHC, Inc | L504-01B | |
| Xylocaine | Huaqing |
Riferimenti
- Hubel, D. H., Wiesel, T. N. Effects of monocular deprivation in kittens. Naunyn-Schmiedebergs Archiv für experimentelle Pathologie und Pharmakologie. 248 (6), 492-497 (1964).
- Daw, N. W., Fox, K., Sato, H., Czepita, D. Critical period for monocular deprivation in the cat visual cortex. Journal of Neurophysiology. 67 (1), 197-202 (1992).
- Guire, E. S., Lickey, M. E., Gordon, B. Critical period for the monocular deprivation effect in rats: assessment with sweep visually evoked potentials. Journal of Neurophysiology. 81 (1), 121-128 (1999).
- Wang, L., Sarnaik, R., Rangarajan, K. V., Liu, X., Cang, J. Visual receptive field properties of neurons in the superficial superior colliculus of the mouse. Journal of Neuroscience. 30 (49), 16573-16584 (2010).
- Niell, C. M. Cell Types, circuits, and receptive fields in the mouse visual cortex. Annual Review of Neuroscience. 38 (1), 413-431 (2015).
- Lee, S. H., et al. Activation of specific interneurons improves V1 feature selectivity and visual perception. Nature. 488 (8), 379-383 (2012).
- Cossell, L., et al. Functional organization of excitatory synaptic strength in primary visual cortex. Nature. 518 (2), 399-403 (2015).
- Lacaruso, M. F., Gasler, L. T., Hofer, S. B. Synaptic organization of visual space in primary visual cortex. Nature. 547 (7), 449-452 (2017).
- Metin, C., Godement, P., Imbert, M. The primary visual cortex in the mouse: Receptive field properties and functional organization. Experimental Brain Research. 69 (3), 594-612 (1988).
- Marshel, J. H., Garrett, M. E., Nauhaus, I., Callaway, E. M. Functional specialization of seven mouse visual cortical areas. Neuron. 72 (6), 1040-1054 (2011).
- Gordon, J. A., Stryker, M. P. Experience-dependent plasticity of binocular responses in the primary visual cortex of the mouse. The Journal of Neuroscience. 16 (10), 3274-3286 (1996).
- McGee, A. W., Yang, Y., Fischer, Q. S., Daw, N. W., Strittmatter, S. M. Experience-driven plasticity of visual cortex limited by myelin and Nogo receptor. Science. 309 (5744), 2222-2226 (2005).
- Sawtell, N. B., et al. NMDA receptor-dependent ocular dominance plasticity in adult visual cortex. Neuron. 38 (6), 977-985 (2003).
- Hofer, S. B., Mrsic-Flogel, T. D., Bonhoeffer, T., Hubener, M. Prior experience enhances plasticity in adult visual cortex. Nature Neuroscience. 9 (12), 127-132 (2006).
- Crozier, R. A., Wang, Y., Liu, C., Bear, M. F. Deprivation-induced synaptic depression by distinct mechanisms in different layers of mouse visual cortex. Proceedings of the National Academy of Sciences. 104 (4), 1383-1388 (2007).
- Tagawa, Y., Kanold, P. O., Majdan, M., Shatz, C. J. Multiple periods of functional ocular dominance plasticity in mouse visual cortex. Nature Neuroscience. 8 (3), 380-388 (2005).
- Lickey, M. E., Pham, T. A., Gordon, B. Swept contrast visual evoked potentials and their plasticity following monocular deprivation in mice. Vision Research. 44, 3381-3387 (2004).
- Cang, J., Kalatsky, V. A., Lowel, S., Stryker, M. P. Optical imaging of the intrinsic signal as a measure of cortical plasticity in the mouse. Vision Neuroscience. 22 (5), 685-691 (2005).
- Khan, I. U., et al. Evaluation of different suturing techniques for cystotomy closure in canines. Journal of Animal & Plant Sciences. 23 (4), 981-985 (2013).
- Weisman, D. L., Smeak, D. D., Birchard, S. J., Zweigart, S. L. Comparison of a continuous suture pattern with a simple interrupted pattern for enteric closure in dogs and cats: 83 cases (1991-1997). Journal of the American Veterinary Medical Association. 214 (10), 1507-1510 (1999).
- Heneghan, C. P. H., Thornton, C., Navaratnarajah, M., Jones, J. G. Effect of isoflurane on the auditory evoked response in man. BJA: British Journal of Anaesthesia. 59 (3), 277-282 (1987).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomenal. Physiological Reviews. 65 (1), 37-100 (1985).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon