Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure de la plasticité de la chirurgie visuelle monoculaire et de la dominance oculaire dans le cortex visuel primaire de la souris
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous présentons des protocoles détaillés pour la privation visuelle monoculaire et l’analyse de plasticité de dominance oculaire, qui sont des méthodes importantes pour étudier les mécanismes neuronaux de plasticité visuelle pendant la période critique et les effets des gènes spécifiques sur développement visuel.
Résumé
La privation visuelle monoculaire est un excellent paradigme expérimental pour induire la plasticité corticale visuelle primaire de réponse. En général, la réponse du cortex à l’œil contralatéral à un stimulus est beaucoup plus forte que la réponse de l’oeil ipsilatéral dans le segment binoculaire du cortex visuel primaire de souris (V1). Pendant la période critique des mammifères, la suture de l’œil contralatéral entraînera une perte rapide de réactivité des cellules V1 à la stimulation oculaire contralatérale. Avec le développement continu des technologies transgéniques, de plus en plus d’études utilisent des souris transgéniques comme modèles expérimentaux pour examiner les effets de gènes spécifiques sur la plasticité de la dominance oculaire (OD). Dans cette étude, nous introduisons des protocoles détaillés pour la privation visuelle monoculaire et calculons le changement dans la plasticité d’OD dans la souris V1. Après la privation monoculaire (MD) pendant 4 jours pendant la période critique, les courbes d’orientation de tuning de chaque neurone sont mesurées, et les courbes de tuning de la couche quatre neurones dans V1 sont comparées entre la stimulation des yeux ipsilateral et contralatéral. L’indice de biais contralatéral (CBI) peut être calculé en utilisant le score oculaire d’OD de chaque cellule pour indiquer le degré de plasticité d’OD. Cette technique expérimentale est importante pour l’étude des mécanismes neuronaux de la plasticité oD pendant la période critique et pour l’étude des rôles de gènes spécifiques dans le développement neuronal. La principale limitation est que l’étude aigue ne peut pas étudier le changement de plasticité neuronale de la même souris à un moment différent.
Introduction
La privation visuelle monoculaire est un excellent paradigme expérimental pour examiner la plasticité V1. Pour étudier l’importance de l’expérience visuelle dans le développement neuronal, David Hubel et Torsten Wiesel1,2 chatons privés de vision normale dans un œil à différents moments et pour des périodes variables de temps. Ils ont ensuite observé les changements dans l’intensité de réponse en V1 pour les yeux privés et non privés. Leurs résultats ont montré un nombre anormalement bas de neurones réagissant à l’oeil qui avait été suturefermé dans les trois premiers mois. Cependant, les réponses des neurones dans les chatons sont restées identiques à tous égards à ceux de l’oeil d’un chat adulte normal qui a été suturefermé fermé pendant un an, et les chatons n’ont pas récupéré. MD chez les chats adultes ne peut pas induire la plasticité OD. Par conséquent, l’impact de l’expérience visuelle sur le câblage V1 est fort au cours d’une brève phase de développement bien définie, avant et après quoi les mêmes stimuli ont moins d’influence. Une telle phase de susceptibilité accrue à l’entrée visuelle est connue comme la période critique dans le cortex visuel.
Bien que la souris soit un animal nocturne, les neurones individuels de la souris V1 ont des propriétés similaires aux neurones trouvés chez les chats3,4,5. Ces dernières années, avec le développement rapide de la technologie transgénique, un nombre croissant d’études en neurosciences visuelles ont utilisé des souris comme modèle expérimental6,7,8. Dans les études visuelles de souris, les neuroscientifiques emploient des mutants et des lignes de souris knock-out, qui permettent le contrôle sur la constitution génétique des souris. Bien que les souris V1 manquent de colonnes OD, neurones simples dans la zone binoculaire V1 montrent des propriétés importantes OD. Par exemple, la plupart des cellules réagissent plus fortement à la stimulation contralatérale qu’à la stimulation ipsilatérale. La fermeture temporaire d’un œil pendant la période critique induit un changement significatif dans la distribution de l’indice OD9,10,11. Par conséquent, MD peut être utilisé pour établir un modèle de plasticité OD pour étudier comment les gènes impliqués dans les troubles du développement neuronal influencent la plasticité corticale in vivo.
Ici, nous introduisons une méthode expérimentale pour MD et suggérons une méthode couramment utilisée (enregistrement électrophysiologique) pour analyser le changement dans la plasticité d’OD pendant la privation visuelle monoculaire. La méthode a été largement utilisée dans de nombreux laboratoires depuis plus de 20 ans12,13,14,15,16. Il existe d’autres méthodes utilisées pour mesurer la plasticité de l’OD ainsi, tels que le potentiel visuel chronique évoqué (VEP) enregistrement17, et l’imagerie optique intrinsèque (IOI)18. L’avantage significatif de cette méthode aigue est qu’elle est facile à suivre, et les résultats sont remarquablement fiables.
Access restricted. Please log in or start a trial to view this content.
Protocole
Dans ce protocole, des souris mâles C57Bl/6 ont été obtenues de l’Institut des animaux de laboratoire de l’Académie des sciences médicales du Sichuan et de l’hôpital populaire provincial du Sichuan. Toutes les procédures de soins et d’expérimentation des animaux ont été approuvées par le Comité institutionnel de soins et d’utilisation des animaux de l’Université des sciences électroniques et de la technologie de Chine.
1. Privation monoculaire (MD) au jour postnatal 28 chez les souris
- Mettre les outils chirurgicaux, l’aiguille de suture (0,25 mm de diamètre, le diamètre de la corde 0,07 mm) et les cotons-tiges dans une boîte en aluminium et les autoclaver à 120 oC pendant 0,5 h. Stérilisez le capot avec 75 % d’éthanol. Séchez les outils chirurgicaux dans un four à sec.
- Préparer une solution d’agarose de 2%, la mettre dans un bain d’eau à 75 oC pour éviter de se solidifier.
- Utiliser l’isoflurane mélangé à de l’oxygène pour anesthésier la souris (2 % d’induction et 1,2 à 1,5 % d’entretien). Fixez la souris sur l’appareil stéréotaxique et utilisez un dispositif de régulation de la chaleur pour maintenir la température corporelle de la souris à 37 oC et prévenir l’hypothermie.
- Appliquer une fine couche d’onduleur à base de pétrole sur les deux yeux.
- Sous le microscope anatomique avec éclairage, suturer la paupière sur un œil. Faire passer l’aiguille si les deux côtés de la paupière 2x (Figure 1A) et faire environ quatre points de suture.
- Nouez le fil 2-3x et puis couper le fil. Appliquer 3 ll de colle de séchage instantanée sur le noeud pour augmenter sa stabilité. Ensuite, couper le fil de suture supplémentaire.
- Fournir une injection intrapéritonéale de buprénorphine (1 mg/kg) à la souris.
- Transférer la souris sur un coussin chauffant pour maintenir sa température corporelle à 37 oC et prévenir l’hypothermie et la surveiller jusqu’à ce qu’elle retrouve conscience.
- Lorsque la souris est complètement éveillée, placez-la dans une cage de retenue séparée.
- Vérifiez les paupières tous les jours pour s’assurer qu’elles restent fermées et non infectées. Exclure la souris si une ouverture de paupière est trouvée.
- Avant l’enregistrement électrophysiologique, l’utilisation d’isoflurane mélangé à de l’oxygène pour anesthésier la souris (2 % d’induction et 1,2 à 1,5 % d’entretien).
- Retirez les points de suture avec des ciseaux pour exposer le globe oculaire. Couper soigneusement les paupières.
- Rincer l’œil avec la solution de lentille et vérifier l’œil sous un microscope pour plus de clarté. Exclure les souris présentant des opacités cornéennes ou des signes d’infection.
2. Craniotomy dans la région binoculaire de souris V1 après la privation monoculaire le 4ème jour
- Après l’anesthésie de la souris, vérifiez la profondeur de l’anesthésie par l’absence de réponse à une pincée d’orteil.
- Placez et fixez la souris sur l’appareil stéréotaxique. Ajustez la hauteur de la barre d’oreille et de la tige de dent pour maintenir le cerveau plat et stable.
- Utilisez un coussin chauffant pour maintenir la température corporelle.
- Appliquer une pommade à base de pétrole sur la surface des yeux pour les garder humides.
- Enlever les cheveux sur la tête de la souris pour exposer sa peau. Frotter la peau avec des gommages alternés d’iode et 70% d’éthanol 3x.
- Inciser une zone de 8 x 8 mm de la peau entre les oreilles pour exposer le crâne et enlever le tissu du cuir chevelu. Retirez ensuite le tissu conjonctif sus-susaire avec 30 % de peroxyde d’hydrogène.
- Percer un trou de 1 x 1 mm dans le crâne au-dessus du cervelet. Affix une petite vis d’os dans le trou comme référence.
- Effectuer une petite craniotomie de 1 mm de diamètre dans la région binoculaire V1 de l’hémisphère contralatéral à l’œil démuni(Figure 1B, A-P: lambda -0.51-lambda 1,67 mm; M-L: -2.6 '-3.0 mm; D-V: 0 x 1 mm). Enlevez soigneusement le fragment de crâne sans blesser le cerveau.
- Couvrir la surface corticale exposée avec 75 'L de 2% d’agarose à 40 oC pour éviter le séchage.
- Fixer une électrode de tungstène sur le cadre stéréotaxique. Placez l’électrode de tungstène verticalement sur la surface du cortex exposé, la région binoculaire de V1, pour s’assurer que les cellules qui sont enregistrées réagissent aux deux yeux.
- Utilisez des cotons-tiges pour enlever le gel pour les yeux et appliquez de l’huile de silicium à l’œil tous les 2 h.
3. Stimulation visuelle et enregistrement électrophysiologique
- Masquez l’œil avec une plaque en plastique non transparente. Placez un moniteur LCD à 23 cm de l’œil de la souris.
- Réduire l’anesthésie à 0,5 à 0,8 % lorsque la souris est entièrement anesthésiée.
- Avancez lentement l’électrode de microélectrode avec un micromanipulateur hydraulique d’huile. Arrêtez-le lorsqu’un rapport signal-bruit élevé est observé et que l’électrode est avancée jusqu’à la couche 4(figure 1C, environ 250 à 450 m de profondeur). Assurez-vous que le facteur d’amplification est fixé à 1 000, le filtre à 300 à 100 Hz et le taux d’échantillonnage à 40 Hz.
- Présenter une grille sinusoïdale en plein champ(Figure 1D, 12 directions, contraste de 100%, 2 Hz de fréquence temporaire, 0,04 cycles par degré de fréquence spatiale) sur le moniteur LED.
- Mesurez la réponse de la cellule en stimulant séparément l’œil ipsilatéral et contralatéral. Présent 3-5x total.
- Mesurer les réponses de cinq à huit cellules dans chaque pénétration. Effectuer quatre à six pénétrations dans chaque souris.
- Après l’enregistrement, ajuster le débit d’isoflurane à 5% ou plus, continuer l’exposition à l’isoflurane pendant 1 min, puis effectuer la luxation cervicale.
REMARQUE : Des pénétrations séparées ont été espacées d’au moins 200 m dans la zone binoculaire V1.
4. Tri de pointe hors ligne et analyse de données
- Détectez les pics lorsque le signal brut franchit un seuil. Aligner les pointes capturées sur le premier pic positif ou négatif. Utilisez un logiciel pour détecter les pointes de différentes cellules.
- Définir deux curseurs : l’un pour le positif et l’autre pour la déviation négative. Définir le modèle de pointe (Figure 2A). Définir la zone de modèle à celle avec la variation la plus significative entre les différentes classes de pointes.
- Utilisez l’analyse des composants principaux pour les séparer en grappes. Les méthodes de regroupement peuvent varier d’un laboratoire à l’autre.
- Classez le pic d’une limite à l’aide de l’algorithme K-moyens.
- Comparez l’orientation avec le taux de tir de pointe et tracez les courbes d’orientation pour l’œil ipsilatéral et contralatéral.
- Calculer l’indice OD pour l’unité unique, qui représente le rapport de force de réponse contralatéral/ipsilatéral :
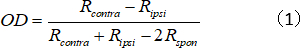
où Rcontra et Ripsi sont la réponse optimale de la cellule pour l’œil contralatéral et ipsilatéral, respectivement, et Rspon est l’activité spontanée de la cellule. - Attribuez les scores d’OD à 1 à 7 comme suit : 1 à 0,75 à 0,75 ; de 0,75 à 0,45 euro, 2 euros; de 0,45 à 0,15 à 3 euros; de 0,15 à 0,15 à 4; 0,15 à 0,45 à 5; 0,45 à 0,75 à 6; et de 0,75 à 1 à 7.
- Calculer l’indice de biais contralatéral (ICB) :
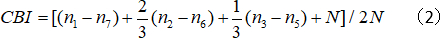
où N est le numéro de cellule, et nx égale le nombre de cellules avec des scores OD égale à x.
Access restricted. Please log in or start a trial to view this content.
Résultats
Les résultats expérimentaux décrits ici permettent des mesures réussies de plasticité de MD et d’OD d’une souris privée et non privée pendant la période critique (P19-P32). La figure 1 montre comment effectuer des enregistrements d’une seule unité dans la couche 4 de V1 la zone binoculaire pour comparer les réponses dans l’œil ipsilatéral et contralatéral 4 jours après MD. La figure 2 montre les mesures de tri des pointes et de tuning d’o...
Access restricted. Please log in or start a trial to view this content.
Discussion
Nous présentons un protocole détaillé pour MD et mesurant la plasticité d’OD par enregistrement d’unité simple. Ce protocole est largement utilisé en neurosciences visuelles. Bien que le protocole MD n’est pas compliqué, il ya quelques procédures chirurgicales critiques qui doivent être suivies avec soin. Tout d’abord, il ya deux détails importants assurant la qualité de la couture. La suture est suffisamment stable si les points sont concentrés dans la partie médiane de la paupière. De plus, 3 ll d...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents.
Remerciements
Cette étude a été soutenue par la National Natural Science Foundation of China (81571770, 81771925, 81861128001).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 502 glue | M&G Chenguang Stationery Co., Ltd. | AWG97028 | |
| Acquizition card | National Instument | PCI-6250 | |
| Agarose | Biowest | G-10 | |
| Amplifier | A-M system | Model 1800 | |
| Atropine | Aladdin Bio-Chem Technology Co., Ltd | A135946-5 | |
| Brain Stereotaxic Apparatus | RWD Life Science Co.,Ltd | 68001 | |
| Cohan-Vannas spring scissors | Fine Science Tools | 15000-02 | |
| Contact Lenses Solutions | Beijing Dr. Lun Eye Care Products Co., Ltd. | GM17064 | |
| Cotton swabs | Henan Guangderun Medical Instruments Co.,Ltd | ||
| Fine needle holder | SuZhou Stronger Medical Instruments Co.,Ltd | CZQ1370 | |
| Forcep | 66 Vision Tech Co., Ltd. | 53320A | |
| Forcep | 66 Vision Tech Co., Ltd. | 53072 | |
| Forcep | 66 Vision Tech Co., Ltd. | #5 | |
| Heating pad | Stryker | TP 700 T | |
| Illuminator | Motic China Group Co., Ltd. | MLC-150C | |
| Isoflurane | RWD Life Science Co.,Ltd | R510-22 | |
| LCD monitor | Philips (China) Investment Co., Ltd. | 39PHF3251/T3 | |
| Microscope | SOPTOP | SZMT1 | |
| Noninvasive Vital Signs Monitor | Mouseox | ||
| Oil hydraulic micromanipulator | NARISHIGE International Ltd. | PC-5N06022 | |
| Petrolatum Eye Gel | Dezhou Yile Disinfection Technology Co., Ltd. | 17C801 | |
| Spike2 | Cambridge Electronic Design, Cambridge, UK | Spike2 Version 9 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54010 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54002 | |
| Suture Needle | Ningbo Medical Co.,Ltd | 3/8 arc 2.5*8 | |
| Tungsten Electrode | FHC, Inc | L504-01B | |
| Xylocaine | Huaqing |
Références
- Hubel, D. H., Wiesel, T. N. Effects of monocular deprivation in kittens. Naunyn-Schmiedebergs Archiv für experimentelle Pathologie und Pharmakologie. 248 (6), 492-497 (1964).
- Daw, N. W., Fox, K., Sato, H., Czepita, D. Critical period for monocular deprivation in the cat visual cortex. Journal of Neurophysiology. 67 (1), 197-202 (1992).
- Guire, E. S., Lickey, M. E., Gordon, B. Critical period for the monocular deprivation effect in rats: assessment with sweep visually evoked potentials. Journal of Neurophysiology. 81 (1), 121-128 (1999).
- Wang, L., Sarnaik, R., Rangarajan, K. V., Liu, X., Cang, J. Visual receptive field properties of neurons in the superficial superior colliculus of the mouse. Journal of Neuroscience. 30 (49), 16573-16584 (2010).
- Niell, C. M. Cell Types, circuits, and receptive fields in the mouse visual cortex. Annual Review of Neuroscience. 38 (1), 413-431 (2015).
- Lee, S. H., et al. Activation of specific interneurons improves V1 feature selectivity and visual perception. Nature. 488 (8), 379-383 (2012).
- Cossell, L., et al. Functional organization of excitatory synaptic strength in primary visual cortex. Nature. 518 (2), 399-403 (2015).
- Lacaruso, M. F., Gasler, L. T., Hofer, S. B. Synaptic organization of visual space in primary visual cortex. Nature. 547 (7), 449-452 (2017).
- Metin, C., Godement, P., Imbert, M. The primary visual cortex in the mouse: Receptive field properties and functional organization. Experimental Brain Research. 69 (3), 594-612 (1988).
- Marshel, J. H., Garrett, M. E., Nauhaus, I., Callaway, E. M. Functional specialization of seven mouse visual cortical areas. Neuron. 72 (6), 1040-1054 (2011).
- Gordon, J. A., Stryker, M. P. Experience-dependent plasticity of binocular responses in the primary visual cortex of the mouse. The Journal of Neuroscience. 16 (10), 3274-3286 (1996).
- McGee, A. W., Yang, Y., Fischer, Q. S., Daw, N. W., Strittmatter, S. M. Experience-driven plasticity of visual cortex limited by myelin and Nogo receptor. Science. 309 (5744), 2222-2226 (2005).
- Sawtell, N. B., et al. NMDA receptor-dependent ocular dominance plasticity in adult visual cortex. Neuron. 38 (6), 977-985 (2003).
- Hofer, S. B., Mrsic-Flogel, T. D., Bonhoeffer, T., Hubener, M. Prior experience enhances plasticity in adult visual cortex. Nature Neuroscience. 9 (12), 127-132 (2006).
- Crozier, R. A., Wang, Y., Liu, C., Bear, M. F. Deprivation-induced synaptic depression by distinct mechanisms in different layers of mouse visual cortex. Proceedings of the National Academy of Sciences. 104 (4), 1383-1388 (2007).
- Tagawa, Y., Kanold, P. O., Majdan, M., Shatz, C. J. Multiple periods of functional ocular dominance plasticity in mouse visual cortex. Nature Neuroscience. 8 (3), 380-388 (2005).
- Lickey, M. E., Pham, T. A., Gordon, B. Swept contrast visual evoked potentials and their plasticity following monocular deprivation in mice. Vision Research. 44, 3381-3387 (2004).
- Cang, J., Kalatsky, V. A., Lowel, S., Stryker, M. P. Optical imaging of the intrinsic signal as a measure of cortical plasticity in the mouse. Vision Neuroscience. 22 (5), 685-691 (2005).
- Khan, I. U., et al. Evaluation of different suturing techniques for cystotomy closure in canines. Journal of Animal & Plant Sciences. 23 (4), 981-985 (2013).
- Weisman, D. L., Smeak, D. D., Birchard, S. J., Zweigart, S. L. Comparison of a continuous suture pattern with a simple interrupted pattern for enteric closure in dogs and cats: 83 cases (1991-1997). Journal of the American Veterinary Medical Association. 214 (10), 1507-1510 (1999).
- Heneghan, C. P. H., Thornton, C., Navaratnarajah, M., Jones, J. G. Effect of isoflurane on the auditory evoked response in man. BJA: British Journal of Anaesthesia. 59 (3), 277-282 (1987).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomenal. Physiological Reviews. 65 (1), 37-100 (1985).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon