需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鼠主视觉皮质中的单眼视觉剥夺和眼部优势可塑性测量
* 这些作者具有相同的贡献
摘要
本文提出了单眼视觉剥夺和眼主导性可塑性分析的详细方案,是研究关键时期视觉可塑性的神经机制和特定基因对视觉发展。
摘要
单目视觉剥夺是诱导原发性视觉皮质反应可塑性的一个很好的实验范式。一般来说,皮层对反向眼睛对刺激的反应比小鼠主要视觉皮层(V1)的双目部分的侧边眼的反应要强得多。在哺乳动物的关键时期,缝合反向眼睛将导致V1细胞对反向眼部刺激的反应迅速丧失。随着转基因技术的不断发展,越来越多的研究利用转基因小鼠作为实验模型,研究特定基因对眼部支配力(OD)可塑性的影响。在这项研究中,我们介绍了单目视觉剥夺的详细方案,并计算了小鼠V1中OD可塑性的变化。在关键时期单眼剥夺(MD)4天后,测量每个神经元的方向调谐曲线,并比较V1中第四层神经元的调谐曲线。可使用每个细胞的眼部 OD 评分来计算反向偏置指数 (CBI),以指示 OD 可塑性的程度。该实验技术对于研究关键时期OD可塑性的神经机制和特定基因在神经发育中的作用具有重要意义。主要局限性是,急性研究无法研究同一小鼠在不同时间的神经可塑性变化。
引言
单目视觉剥夺是检验V1可塑性的绝佳实验范例。为了研究视觉体验在神经发育中的重要性,大卫·胡贝尔和托斯滕·威塞尔1,2在不同时间点和不同时间段的一只眼睛中剥夺正常视力的小猫。然后,他们观察了贫困和非贫困眼睛V1反应强度的变化。他们的结果显示,在头三个月里,对眼睛有异常低反应的神经元数量是被缝合的。然而,小猫的神经元在各方面的反应仍然与正常成年猫的眼睛的反应相同,而正常成年猫的眼睛被缝合了一年,小猫没有恢复。MD在成年猫不能诱导OD可塑性。因此,视觉体验对 V1 布线的影响在短暂、明确定义的开发阶段非常强烈,前后相同的刺激影响较小。这种对视觉输入的易感性增加的阶段被称为视觉皮层的关键时期。
虽然小鼠是夜间动物,但小鼠V1中的单个神经元具有与猫3、4、5的神经元相似的特性。近年来,随着转基因技术的飞速发展,越来越多的视觉神经科学研究将小鼠作为实验模型6、7、8。在小鼠视觉研究中,神经科学家使用突变体和敲除小鼠线,从而控制小鼠的基因组成。尽管小鼠 V1 缺少 OD 柱,但 V1 双目区域中的单个神经元显示出显著的 OD 属性。例如,大多数细胞对反向刺激的反应比对边侧刺激的反应更强烈。在关键时期暂时关闭一只眼睛,导致OD指数分布9、10、11发生显著变化。因此,MD可用于建立OD可塑性模型,以研究神经发育障碍中涉及的基因如何影响体内皮质可塑性。
本文介绍了一种医学实验方法,并推荐了一种常用的方法(电生理记录),用于分析单眼视觉剥夺期间OD可塑性的变化。该方法已广泛应用于许多实验室超过20年12,13,14,15,16。在测量OD可塑性时也使用其他方法,如慢性视觉唤起电位(VEP)记录17,和内在光学成像(IOI)18 。这种急性方法的显著优点是易于遵循,结果非常可靠。
Access restricted. Please log in or start a trial to view this content.
研究方案
本方案从四川省医学科学院实验动物研究所和四川省人民医院获得雄性C57Bl/6小鼠。所有动物护理和实验程序均获得中国电子科技大学动物护理与使用委员会的批准。
1. 小鼠产后第28天的单眼剥夺(MD)
- 将手术工具、缝合针(直径0.25毫米,弦直径0.07毫米)和棉签放入铝盒中,在120°C下高压灭菌,用75%乙醇消毒发动机罩。在干燥炉中干燥手术工具。
- 制备2%的甘蔗溶液,在75°C下放入水浴中,避免凝固。
- 使用与氧气混合的胶合物对小鼠进行麻醉(2% 感应和 1.2-1.5% 维护)。将鼠标固定在立体装置上,并使用热调节装置将小鼠体温保持在37°C,防止体温过低。
- 在双眼涂上一层薄薄的石油眼膏。
- 在带照明的解剖显微镜下,将眼睑缝合在一只眼睛上。使针穿过眼睑的两侧2x(图1A),并做约四针。
- 将螺纹连接 2⁄3x,然后修剪螺纹。在结上涂上3μL的即时干燥胶,以增加其稳定性。然后切割额外的缝合线。
- 向小鼠提供丁丙诺啡(1mg/kg)的腹内注射。
- 将鼠标转移到加热垫上,使其体温保持在 37°C,并防止体温过低并监测,直到其恢复知觉。
- 当鼠标完全清醒时,将其放入单独的保持笼中。
- 每天检查眼睑,确保它们保持闭上并未感染。如果找到眼睑开口,则排除鼠标。
- 在电生理记录之前,使用与氧气混合的胶质对小鼠进行麻醉(2%感应和1.2~1.5%的维护)。
- 用剪刀取出缝合,露出眼球。小心修剪眼睑。
- 用透镜溶液冲洗眼睛,并在显微镜下检查眼睛是否清晰。排除角膜不和或感染迹象的小鼠。
2. 小鼠V1双目区域第4天单目剥夺后颅骨切除术
- 麻醉小鼠后,检查麻醉的深度,因为对脚趾捏没有反应。
- 将鼠标放在立体装置上并固定。调整耳杆和牙棒的高度,以保持大脑平坦和稳定。
- 使用加热垫保持体温。
- 在眼睛表面涂上石油基眼膏,使其保持湿润。
- 去除鼠标头上的头发,露出它的皮肤。用交替擦洗碘和70%乙醇3x擦皮肤。
- 在耳朵之间切开一个8 x 8毫米的皮肤区域,露出头骨并去除头皮组织。然后用30%过氧化氢去除覆盖结缔组织。
- 在小脑上方的头骨上钻一个1 x 1毫米的孔。在孔中固定一个小骨螺钉作为参考。
- 在V1双目区域从对立半球到贫困眼进行直径为1毫米的小颅切除术(图1B,A-P:lambda -0.51_lambda ±1.67 mm;M-L: -2.6* -3.0 毫米;D-V: 0⁄1 毫米)。小心地取出头骨碎片,而不会伤害大脑。
- 在40°C下用75μL的2%角质甘蔗覆盖裸露的皮质表面,以防止干燥。
- 将钨电极固定在立体框架上。将钨电极垂直放置在暴露的皮层表面,即V1的双目区域,以确保被记录的细胞对两只眼睛有反应。
- 使用棉签去除眼凝胶,每 2 小时向眼睛涂抹硅油。
3. 视觉刺激和电生理记录
- 用不透明的塑料板遮住一只眼睛。将液晶显示器放置在距鼠标眼睛 23 厘米的位置。
- 当小鼠完全麻醉时,麻醉降低至0.5~0.8%。
- 使用油液压微操作器缓慢推进微电极。当观察到高信噪比,电极被推进到第4层(图1C,深度约为250~450μm)时,停止它。确保放大系数设置为 1,000,滤波器设置为 300*100 Hz,采样速率设置为 40 Hz。
- 在 LED 监视器上呈现一个全场移动正弦光栅(图 1D,12方向,100% 对比度,2 Hz 临时频率,每度空间频率 0.04 周期)。
- 通过分别刺激侧侧和反向眼来测量细胞的反应。呈现总计 3~5 倍。
- 测量每个穿透中五到八个细胞的响应。在每只鼠标中执行四到六次穿透。
- 记录后,将异苯可图的流速调整到5%或以上,继续异苯二苯暴露1分钟,然后进行宫颈脱位。
注:在V1双目区域中,单独的穿透力间隔至少200μm。
4. 离线尖峰排序和数据分析
- 当原始信号超过阈值电平时检测峰值。在第一个正峰值或负峰值上对齐捕获的峰值。使用软件检测来自不同单元的峰值。
- 设置两个光标:一个用于正,另一个用于负偏转。设置尖峰模板 (图 2A.将模板区域设置为不同类别的尖峰之间变化最大的区域。
- 使用主组件分析将它们分隔成群集。聚类方法可能因实验室而异。
- 使用 K 均值算法对边界的尖峰进行分类。
- 将方向与尖峰射击速率相关联,并绘制侧向和反向眼的方向调整曲线。
- 计算单个单位的 OD 指数,该指数表示反向/边面响应强度比:
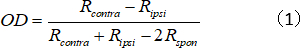
其中R逆和Ripsi分别是细胞对反向和益边眼的最佳反应,而Rspon是细胞的自发活动。 - 将 OD 分数分配到 1+7,如下所示: = 1 到 +0.75 = 1;±0.75 至 ±0.45 = 2;±0.45 至 ±0.15 = 3;±0.15 至 0.15 = 4;0.15 到 0.45 = 5;0.45 到 0.75 = 6;和 0.75 到 1 = 7。
- 计算反向偏置指数 (CBI):
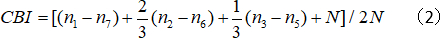
其中N是单元格数,nx等于 OD 分数等于 x 的单元格编号。
Access restricted. Please log in or start a trial to view this content.
结果
此处描述的实验结果使被剥夺和非剥夺小鼠在关键时期(P19_P32)成功进行了MD和OD可塑性测量。图 1显示了如何在 V1 的双目区域的第 4 层中执行单单元录像,以比较 MD 后 4 天在益边眼和反向眼中的响应。图 2显示了用于刺激侧边和反向眼睛的尖峰排序和方向调谐测量值。对于尖峰排序,通过聚类尖峰的主要组件权重建立了尖峰模板。例如(
Access restricted. Please log in or start a trial to view this content.
讨论
我们提出了一个详细的协议,MD和测量OD可塑性通过单单元记录。该协议在视觉神经科学中得到了广泛的应用。虽然MD协议并不复杂,但有一些关键的外科手术必须小心遵循。首先,有两个重要的细节,以确保缝合的质量。如果缝合集中在眼睑的中段,缝合线就足够稳定。此外,3 μL的胶水被涂在结的头部,以增加结的稳定性,以防止眼睛重新开放。其次,应采取一些关键步骤改善伤口愈合,减少?...
Access restricted. Please log in or start a trial to view this content.
披露声明
提交人宣称,他们没有相互竞争的经济利益。
致谢
这项研究得到了国家自然科学基金(81571770、81771925、81861128001)的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 502 glue | M&G Chenguang Stationery Co., Ltd. | AWG97028 | |
| Acquizition card | National Instument | PCI-6250 | |
| Agarose | Biowest | G-10 | |
| Amplifier | A-M system | Model 1800 | |
| Atropine | Aladdin Bio-Chem Technology Co., Ltd | A135946-5 | |
| Brain Stereotaxic Apparatus | RWD Life Science Co.,Ltd | 68001 | |
| Cohan-Vannas spring scissors | Fine Science Tools | 15000-02 | |
| Contact Lenses Solutions | Beijing Dr. Lun Eye Care Products Co., Ltd. | GM17064 | |
| Cotton swabs | Henan Guangderun Medical Instruments Co.,Ltd | ||
| Fine needle holder | SuZhou Stronger Medical Instruments Co.,Ltd | CZQ1370 | |
| Forcep | 66 Vision Tech Co., Ltd. | 53320A | |
| Forcep | 66 Vision Tech Co., Ltd. | 53072 | |
| Forcep | 66 Vision Tech Co., Ltd. | #5 | |
| Heating pad | Stryker | TP 700 T | |
| Illuminator | Motic China Group Co., Ltd. | MLC-150C | |
| Isoflurane | RWD Life Science Co.,Ltd | R510-22 | |
| LCD monitor | Philips (China) Investment Co., Ltd. | 39PHF3251/T3 | |
| Microscope | SOPTOP | SZMT1 | |
| Noninvasive Vital Signs Monitor | Mouseox | ||
| Oil hydraulic micromanipulator | NARISHIGE International Ltd. | PC-5N06022 | |
| Petrolatum Eye Gel | Dezhou Yile Disinfection Technology Co., Ltd. | 17C801 | |
| Spike2 | Cambridge Electronic Design, Cambridge, UK | Spike2 Version 9 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54010 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54002 | |
| Suture Needle | Ningbo Medical Co.,Ltd | 3/8 arc 2.5*8 | |
| Tungsten Electrode | FHC, Inc | L504-01B | |
| Xylocaine | Huaqing |
参考文献
- Hubel, D. H., Wiesel, T. N. Effects of monocular deprivation in kittens. Naunyn-Schmiedebergs Archiv für experimentelle Pathologie und Pharmakologie. 248 (6), 492-497 (1964).
- Daw, N. W., Fox, K., Sato, H., Czepita, D. Critical period for monocular deprivation in the cat visual cortex. Journal of Neurophysiology. 67 (1), 197-202 (1992).
- Guire, E. S., Lickey, M. E., Gordon, B. Critical period for the monocular deprivation effect in rats: assessment with sweep visually evoked potentials. Journal of Neurophysiology. 81 (1), 121-128 (1999).
- Wang, L., Sarnaik, R., Rangarajan, K. V., Liu, X., Cang, J. Visual receptive field properties of neurons in the superficial superior colliculus of the mouse. Journal of Neuroscience. 30 (49), 16573-16584 (2010).
- Niell, C. M. Cell Types, circuits, and receptive fields in the mouse visual cortex. Annual Review of Neuroscience. 38 (1), 413-431 (2015).
- Lee, S. H., et al. Activation of specific interneurons improves V1 feature selectivity and visual perception. Nature. 488 (8), 379-383 (2012).
- Cossell, L., et al. Functional organization of excitatory synaptic strength in primary visual cortex. Nature. 518 (2), 399-403 (2015).
- Lacaruso, M. F., Gasler, L. T., Hofer, S. B. Synaptic organization of visual space in primary visual cortex. Nature. 547 (7), 449-452 (2017).
- Metin, C., Godement, P., Imbert, M. The primary visual cortex in the mouse: Receptive field properties and functional organization. Experimental Brain Research. 69 (3), 594-612 (1988).
- Marshel, J. H., Garrett, M. E., Nauhaus, I., Callaway, E. M. Functional specialization of seven mouse visual cortical areas. Neuron. 72 (6), 1040-1054 (2011).
- Gordon, J. A., Stryker, M. P. Experience-dependent plasticity of binocular responses in the primary visual cortex of the mouse. The Journal of Neuroscience. 16 (10), 3274-3286 (1996).
- McGee, A. W., Yang, Y., Fischer, Q. S., Daw, N. W., Strittmatter, S. M. Experience-driven plasticity of visual cortex limited by myelin and Nogo receptor. Science. 309 (5744), 2222-2226 (2005).
- Sawtell, N. B., et al. NMDA receptor-dependent ocular dominance plasticity in adult visual cortex. Neuron. 38 (6), 977-985 (2003).
- Hofer, S. B., Mrsic-Flogel, T. D., Bonhoeffer, T., Hubener, M. Prior experience enhances plasticity in adult visual cortex. Nature Neuroscience. 9 (12), 127-132 (2006).
- Crozier, R. A., Wang, Y., Liu, C., Bear, M. F. Deprivation-induced synaptic depression by distinct mechanisms in different layers of mouse visual cortex. Proceedings of the National Academy of Sciences. 104 (4), 1383-1388 (2007).
- Tagawa, Y., Kanold, P. O., Majdan, M., Shatz, C. J. Multiple periods of functional ocular dominance plasticity in mouse visual cortex. Nature Neuroscience. 8 (3), 380-388 (2005).
- Lickey, M. E., Pham, T. A., Gordon, B. Swept contrast visual evoked potentials and their plasticity following monocular deprivation in mice. Vision Research. 44, 3381-3387 (2004).
- Cang, J., Kalatsky, V. A., Lowel, S., Stryker, M. P. Optical imaging of the intrinsic signal as a measure of cortical plasticity in the mouse. Vision Neuroscience. 22 (5), 685-691 (2005).
- Khan, I. U., et al. Evaluation of different suturing techniques for cystotomy closure in canines. Journal of Animal & Plant Sciences. 23 (4), 981-985 (2013).
- Weisman, D. L., Smeak, D. D., Birchard, S. J., Zweigart, S. L. Comparison of a continuous suture pattern with a simple interrupted pattern for enteric closure in dogs and cats: 83 cases (1991-1997). Journal of the American Veterinary Medical Association. 214 (10), 1507-1510 (1999).
- Heneghan, C. P. H., Thornton, C., Navaratnarajah, M., Jones, J. G. Effect of isoflurane on the auditory evoked response in man. BJA: British Journal of Anaesthesia. 59 (3), 277-282 (1987).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomenal. Physiological Reviews. 65 (1), 37-100 (1985).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。