Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Monokulare visuelle Deprivation und Ocular Dominance Plastizitätsmessung in der Maus primäre visuelle Kortex
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir detaillierte Protokolle für monokulare sehische Entbehrung und Augendominanz Plastizitätsanalyse, die wichtige Methoden zur Untersuchung der neuronalen Mechanismen der visuellen Plastizität während der kritischen Periode und die Auswirkungen von spezifischen Genen auf visuelle Entwicklung.
Zusammenfassung
Monokulare visuelle Entbehrung ist ein ausgezeichnetes experimentelles Paradigma, um primäre visuelle kortikale Reaktion Plastizität zu induzieren. Im Allgemeinen ist die Reaktion des Kortex auf das kontralaterale Auge auf einen Stimulus viel stärker als die Reaktion des ipsilateralen Auges im binokularen Segment des primären visuellen Kortex der Maus (V1). Während der kritischen Phase des Säugetiers führt die Nähe des kontralateralen Auges zu einem schnellen Verlust der Reaktionsfähigkeit von V1-Zellen auf kontralaterale Augenstimulation. Mit der Weiterentwicklung transgener Technologien nutzen immer mehr Studien transgene Mäuse als experimentelle Modelle, um die Auswirkungen spezifischer Gene auf die Plastizität der Augendominanz (OD) zu untersuchen. In dieser Studie führen wir detaillierte Protokolle für monokulare visuelle Entbehrung ein und berechnen die Veränderung der OD-Plastizität in Maus V1. Nach monokularer Entbehrung (MD) für 4 Tage während der kritischen Periode werden die Orientierungsabstimmungskurven jedes Neurons gemessen und die Stimmkurven der Schicht vier Neuronen in V1 zwischen stimulation der ipsilateralen und kontralateralen Augen verglichen. Der kontralaterale Bias-Index (CBI) kann mit dem okulären OD-Score jeder Zelle berechnet werden, um den Grad der OD-Plastizität anzugeben. Diese experimentelle Technik ist wichtig für die Untersuchung der neuronalen Mechanismen der OD-Plastizität während der kritischen Periode und für die Vermessung der Rolle bestimmter Gene in der neuronalen Entwicklung. Die Hauptbeschränkung ist, dass die akute Studie die Veränderung der neuronalen Plastizität derselben Maus zu einem anderen Zeitpunkt nicht untersuchen kann.
Einleitung
Monokulare visuelle Entbehrung ist ein ausgezeichnetes experimentelles Paradigma, um Die Plastizität von V1 zu untersuchen. Um die Bedeutung der visuellen Erfahrung in der neuronalen Entwicklung zu untersuchen, David Hubel und Torsten Wiesel1,2 beraubt Kätzchen des normalen Sehens in einem Auge an verschiedenen Zeitpunkten und für unterschiedliche Zeiträume. Sie beobachteten dann die Veränderungen der Reaktionsintensität in V1 für die benachteiligten und nicht benachteiligten Augen. Ihre Ergebnisse zeigten eine ungewöhnlich geringe Anzahl von Neuronen, die auf das Auge reagierten, das in den ersten drei Monaten geschlossen vernässt worden war. Allerdings blieben die Reaktionen der Neuronen bei den Kätzchen in jeder Hinsicht identisch mit denen einer normalen erwachsenen Katze Auge, die für ein Jahr geschlossen war, und die Kätzchen nicht erholt. MD bei erwachsenen Katzen kann keine OD Plastizität induzieren. Daher ist der Einfluss der visuellen Erfahrung auf die V1-Verdrahtung während einer kurzen, genau definierten Entwicklungsphase, vor und nach der die gleichen Reize weniger Einfluss haben, stark. Eine solche Phase erhöhter Anfälligkeit für visuelle Eingaben wird als kritische Periode im visuellen Kortex bezeichnet.
Obwohl die Maus ein nachtdrehendes Tier ist, haben einzelne Neuronen in Maus V1 ähnliche Eigenschaften wie Neuronen bei Katzengefunden 3,4,5. In den letzten Jahren, mit der schnellen Entwicklung der transgenen Technologie, eine wachsende Anzahl von Studien in der visuellen Neurowissenschaft haben Mäuse als experimentelles Modell6,7,8verwendet. In visuellen Studien mit Mäusen verwenden Neurowissenschaftler Mutanten und Knockout-Mauslinien, die die Kontrolle über die genetische Zusammensetzung der Mäuse ermöglichen. Obwohl Mäusen V1 OD-Säulen fehlen, zeigen einzelne Neuronen in der V1-Fernglaszone signifikante OD-Eigenschaften. Zum Beispiel reagieren die meisten Zellen stärker auf kontralaterale Stimulation als auf ipsilaterale Stimulation. Die vorübergehende Schließung eines Auges während der kritischen Periode führt zu einer signifikanten Verschiebung der OD-Indexverteilung9,10,11. Daher kann MD verwendet werden, um ein OD-Plastizitätsmodell zu erstellen, um zu untersuchen, wie Gene, die an neuronalen Entwicklungsstörungen beteiligt sind, die kortikale Plastizität in vivo beeinflussen.
Hier führen wir eine experimentelle Methode für MD ein und schlagen eine häufig verwendete Methode (elektrophysiologische Aufzeichnung) vor, um die Veränderung der OD-Plastizität während der monokulären visuellen Deprivation zu analysieren. Die Methode ist weit verbreitet in vielen Laboratorien seit mehr als 20 Jahren12,13,14,15,16. Es gibt auch andere Methoden zur Messung der OD-Plastizität, wie z. B. das chronische visuelle evozierte Potential (VEP) mit der Aufzeichnung17und die intrinsische optische Bildgebung (IOI)18. Der wesentliche Vorteil dieser akuten Methode ist, dass sie leicht zu befolgen ist, und die Ergebnisse sind bemerkenswert zuverlässig.
Protokoll
In diesem Protokoll wurden männliche C57Bl/6-Mäuse vom Institut für Labortiere der Sichuan Academy of Medical Sciences und des Sichuan Provincial People es Hospital gewonnen. Alle Tierpflege- und Versuchsverfahren wurden vom Institutional Animal Care and Use Committee, University of Electronic Science and Technology of China, genehmigt.
1. Monokulare Benachteiligung (MD) am postnatalen Tag 28 bei Mäusen
- Legen Sie die chirurgischen Werkzeuge, die Nahtnadel (0,25 mm Durchmesser, Stringdurchmesser 0,07 mm) und Wattestäbchen in eine Aluminiumbox und autoklavieren Sie sie bei 120 °C für 0,5 h. Sterilisieren Sie die Haube mit 75% Ethanol. Trocknen Sie die chirurgischen Werkzeuge in einem Trockenschrank.
- Bereiten Sie eine 2% Agarose-Lösung vor, legen Sie sie in ein Wasserbad bei 75 °C, um eine Erstarrung zu vermeiden.
- Verwenden Sie Isofluran mit Sauerstoff gemischt, um die Maus zu anästhesieren (2% Induktion und 1,2–1,5% Wartung). Befestigen Sie die Maus am stereotaxic-Gerät und verwenden Sie ein Wärmeregelgerät, um die Körpertemperatur der Maus bei 37 °C zu halten und Unterkühlung zu verhindern.
- Tragen Sie eine dünne Schicht von Petroleum-basierte Augensalbe auf beide Augen auf.
- Unter dem anatomischen Mikroskop mit Beleuchtung, Naht das Augenlid auf einem Auge. Machen Sie die Nadel durch beide Seiten des Augenlids 2x (Abbildung 1A) und machen Sie etwa vier Stiche.
- Knoten Sie den Faden 2–3x und schneiden Sie dann den Faden. Tragen Sie 3 l Instant-Trocknungskleber auf den Knoten auf, um seine Stabilität zu erhöhen. Dann schneiden Sie den zusätzlichen Nährfaden.
- Geben Sie der Maus eine intraperitoneale Injektion von Buprenorphin (1 mg/kg) an.
- Übertragen Sie die Maus auf ein Heizkissen, um ihre Körpertemperatur bei 37 °C zu halten und Unterkühlung zu verhindern und sie zu überwachen, bis sie das Bewusstsein wiedererlangt.
- Wenn die Maus vollständig wach ist, legen Sie sie in einen separaten Haltekäfig.
- Überprüfen Sie die Augenlider täglich, um sicherzustellen, dass sie geschlossen und nicht infiziert bleiben. Schließen Sie die Maus aus, wenn eine Augenlidöffnung gefunden wird.
- Vor der elektrophysiologischen Aufzeichnung wird Isofluran mit Sauerstoff gemischt, um die Maus zu anästhesieren (2% Induktion und 1,2–1,5% Wartung).
- Entfernen Sie die Stiche mit einer Augenschere, um den Augapfel freizulegen. Trimmen Sie die Augenlider vorsichtig.
- Spülen Sie das Auge mit Linsenlösung und überprüfen Sie das Auge unter dem Mikroskop auf Klarheit. Auszuschließen Mäuse mit Hornhauttrübungen oder Anzeichen einer Infektion.
2. Craniotomie in der Maus V1 Binokularregion nach monokularem Entzug am 4. Tag
- Nach der Anästhesisierung der Maus, überprüfen Sie auf die Tiefe der Anästhesie durch die fehlende Reaktion auf eine Zehenprise.
- Platzieren und fixieren Sie die Maus auf dem stereotaxic-Gerät. Passen Sie die Höhe der Ohrstange und der Zahnstange an, um das Gehirn flach und stabil zu halten.
- Verwenden Sie ein Heizkissen, um die Körpertemperatur zu halten.
- Tragen Sie eine auf Erdöl basierende Augensalbe auf die Oberfläche der Augen auf, um sie feucht zu halten.
- Entfernen Sie das Haar auf dem Kopf der Maus, um seine Haut zu belichten. Reiben Sie die Haut mit abwechselnden Peelings von Jod und 70% Ethanol 3x.
- Incise einen 8 x 8 mm Bereich der Haut zwischen den Ohren, um den Schädel zu belichten und das Kopfhautgewebe zu entfernen. Entfernen Sie dann das darüber liegende Bindegewebe mit 30% Wasserstoffperoxid.
- Bohren Sie ein 1 x 1 mm Loch in den Schädel über dem Kleinhirn. Befestigen Sie eine kleine Knochenschraube im Loch als Referenz.
- Führen Sie eine kleine Kraniotomie von 1 mm Durchmesser im V1-Binokularbereich von der kontralateralen Hemisphäre bis zum benachteiligten Auge durch(Abbildung 1B, A-P: Lambda -0,51–Lambda +1,67 mm; M-L: -2,6– -3,0 mm; D-V: 0–1 mm). Entfernen Sie vorsichtig das Schädelfragment, ohne das Gehirn zu verletzen.
- Bedecken Sie die freiliegende kortikale Oberfläche mit 75 l 2% Agarose bei 40 °C, um eine Trocknung zu verhindern.
- Fix eine Wolframelektrode auf dem stereotaxic Rahmen. Legen Sie die Wolframelektrode vertikal auf die Oberfläche des exponierten Kortex, der binokularen Region von V1, um sicherzustellen, dass die Zellen, die aufgezeichnet werden, auf beide Augen reagieren.
- Verwenden Sie Wattestäbchen, um das Augengel zu entfernen und alle 2 Stunden Silikonöl auf das Auge aufzutragen.
3. Visuelle Stimulation und elektrophysiologische Aufzeichnung
- Maskieren Sie das eine Auge mit einer nicht transparenten Kunststoffplatte. Positionieren Sie einen LCD-Monitor 23 cm vom Mausauge entfernt.
- Reduzieren Sie die Anästhesie auf 0,5–0,8 %, wenn die Maus vollständig beästhesiert ist.
- Fördern Sie die Mikroelektrodenelektrode langsam mit einem ölhydraulischen Mikromanipulator. Stoppen Sie es, wenn ein hohes Signal-Rausch-Verhältnis beobachtet wird und die Elektrode auf Schicht 4 vorgerückt ist (Abbildung 1C, ca. 250–450 m tief). Stellen Sie sicher, dass der Verstärkungsfaktor auf 1.000, der Filter auf 300–100 Hz und die Abtastrate auf 40 Hz eingestellt ist.
- Präsentieren Sie ein vollfeldbewegtes sinusförmiges Gitter(Abbildung 1D, 12 Richtungen, 100% Kontrast, 2 Hz temporäre Frequenz, 0,04 Zyklen pro Grad der räumlichen Frequenz) auf dem LED-Monitor.
- Messen Sie die Reaktion der Zelle, indem Sie das ipsilaterale und das kontralaterale Auge separat stimulieren. Präsentieren 3-5x gesamt.
- Messen Sie die Antworten von fünf bis acht Zellen in jeder Penetration. Führen Sie vier bis sechs Penetrationen in jeder Maus durch.
- Nach der Aufnahme stellen Sie den Isofluran-Durchfluss auf 5% oder mehr ein, setzen Sie die Isofluran-Exposition für 1 min fort und führen Sie dann die Zervixdislokation durch.
HINWEIS: In der Fernglaszone V1 wurden separate Eindringungen im Abstand von mindestens 200 m abstand festgestellt.
4. Off-Line-Spike-Sortierung und Datenanalyse
- Erkennen Sie Spitzen, wenn das Rohsignal einen Schwellenwert überschreitet. Richten Sie erfasste Spitzen auf der ersten positiven oder negativen Spitze aus. Verwenden Sie Software, um Spitzen aus verschiedenen Zellen zu erkennen.
- Legen Sie zwei Cursor fest: einen für positiv und den anderen für negative Verformung. Legen Sie die Spike-Vorlage fest (Abbildung 2A). Legen Sie den Vorlagenbereich mit der größten Streuung zwischen verschiedenen Spitzenklassen auf diesen vor.
- Verwenden Sie die Hauptkomponentenanalyse, um sie in Cluster zu trennen. Clustering-Methoden können zwischen den verschiedenen Laboratorien variieren.
- Klassifizieren Sie die Spitze einer Grenze mithilfe des K-Means-Algorithmus.
- Korrelieren Sie die Ausrichtung mit der Spike-Feuerrate und zeichnen Sie die Ausrichtungs-Tuning-Kurven für das ipsilaterale und kontralaterale Auge.
- Berechnen Sie den OD-Index für die Einheit, der das kontralaterale/ipsilaterale Antwortstärkeverhältnis darstellt:
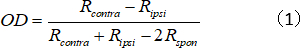
wobei Rcontra und Ripsi die optimale Reaktion der Zelle für das kontralaterale bzw. ipsilaterale Auge sind und Rspon die spontane Aktivität der Zelle ist. - Weisen Sie OD-Scores wie folgt 1–7 zu: 1 bis 0,75 = 1; 0,75 bis 0,45 € = 2; 0,45 bis 0,15 € = 3; 0,15 bis 0,15 = 4; 0,15 bis 0,45 = 5; 0,45 bis 0,75 = 6; und 0,75 bis 1 = 7.
- Berechnen Sie den kontralateralen Bias-Index (CBI):
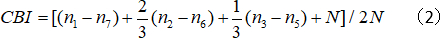
wobei N die Zellennummer ist und nx der Zellenzahl entspricht, wobei OD-Werte gleich x sind.
Ergebnisse
Die hier beschriebenen experimentellen Ergebnisse ermöglichen erfolgreiche MD- und OD-Plastizitätsmessungen von einer benachteiligten und nicht benachteiligten Maus während der kritischen Periode (P19–P32). Abbildung 1 zeigt, wie Einzelaufnahmen in Schicht 4 aus V1 der binokularen Zone zum Vergleich von Reaktionen im ipsilateralen und kontralateralen Auge 4 Tage nach MD durchgeführt werden. Abbildung 2 zeigt die Spike-Sortier- und Orientierungsabstimmungsm...
Diskussion
Wir präsentieren ein detailliertes Protokoll zur MD-Messung und Messung der OD-Plastizität durch Einzelaufnahme. Dieses Protokoll ist weit verbreitet in der visuellen Neurowissenschaft verwendet. Obwohl das MD-Protokoll nicht kompliziert ist, gibt es einige kritische chirurgische Verfahren, die sorgfältig befolgt werden müssen. Erstens gibt es zwei wichtige Details, die die Qualität der Nähte gewährleisten. Die Naht ist ausreichend stabil, wenn die Stiche im medialen Teil des Augenlids konzentriert sind. Darüber ...
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Diese Studie wurde von der National Natural Science Foundation of China (81571770, 81771925, 81861128001) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 502 glue | M&G Chenguang Stationery Co., Ltd. | AWG97028 | |
| Acquizition card | National Instument | PCI-6250 | |
| Agarose | Biowest | G-10 | |
| Amplifier | A-M system | Model 1800 | |
| Atropine | Aladdin Bio-Chem Technology Co., Ltd | A135946-5 | |
| Brain Stereotaxic Apparatus | RWD Life Science Co.,Ltd | 68001 | |
| Cohan-Vannas spring scissors | Fine Science Tools | 15000-02 | |
| Contact Lenses Solutions | Beijing Dr. Lun Eye Care Products Co., Ltd. | GM17064 | |
| Cotton swabs | Henan Guangderun Medical Instruments Co.,Ltd | ||
| Fine needle holder | SuZhou Stronger Medical Instruments Co.,Ltd | CZQ1370 | |
| Forcep | 66 Vision Tech Co., Ltd. | 53320A | |
| Forcep | 66 Vision Tech Co., Ltd. | 53072 | |
| Forcep | 66 Vision Tech Co., Ltd. | #5 | |
| Heating pad | Stryker | TP 700 T | |
| Illuminator | Motic China Group Co., Ltd. | MLC-150C | |
| Isoflurane | RWD Life Science Co.,Ltd | R510-22 | |
| LCD monitor | Philips (China) Investment Co., Ltd. | 39PHF3251/T3 | |
| Microscope | SOPTOP | SZMT1 | |
| Noninvasive Vital Signs Monitor | Mouseox | ||
| Oil hydraulic micromanipulator | NARISHIGE International Ltd. | PC-5N06022 | |
| Petrolatum Eye Gel | Dezhou Yile Disinfection Technology Co., Ltd. | 17C801 | |
| Spike2 | Cambridge Electronic Design, Cambridge, UK | Spike2 Version 9 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54010 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54002 | |
| Suture Needle | Ningbo Medical Co.,Ltd | 3/8 arc 2.5*8 | |
| Tungsten Electrode | FHC, Inc | L504-01B | |
| Xylocaine | Huaqing |
Referenzen
- Hubel, D. H., Wiesel, T. N. Effects of monocular deprivation in kittens. Naunyn-Schmiedebergs Archiv für experimentelle Pathologie und Pharmakologie. 248 (6), 492-497 (1964).
- Daw, N. W., Fox, K., Sato, H., Czepita, D. Critical period for monocular deprivation in the cat visual cortex. Journal of Neurophysiology. 67 (1), 197-202 (1992).
- Guire, E. S., Lickey, M. E., Gordon, B. Critical period for the monocular deprivation effect in rats: assessment with sweep visually evoked potentials. Journal of Neurophysiology. 81 (1), 121-128 (1999).
- Wang, L., Sarnaik, R., Rangarajan, K. V., Liu, X., Cang, J. Visual receptive field properties of neurons in the superficial superior colliculus of the mouse. Journal of Neuroscience. 30 (49), 16573-16584 (2010).
- Niell, C. M. Cell Types, circuits, and receptive fields in the mouse visual cortex. Annual Review of Neuroscience. 38 (1), 413-431 (2015).
- Lee, S. H., et al. Activation of specific interneurons improves V1 feature selectivity and visual perception. Nature. 488 (8), 379-383 (2012).
- Cossell, L., et al. Functional organization of excitatory synaptic strength in primary visual cortex. Nature. 518 (2), 399-403 (2015).
- Lacaruso, M. F., Gasler, L. T., Hofer, S. B. Synaptic organization of visual space in primary visual cortex. Nature. 547 (7), 449-452 (2017).
- Metin, C., Godement, P., Imbert, M. The primary visual cortex in the mouse: Receptive field properties and functional organization. Experimental Brain Research. 69 (3), 594-612 (1988).
- Marshel, J. H., Garrett, M. E., Nauhaus, I., Callaway, E. M. Functional specialization of seven mouse visual cortical areas. Neuron. 72 (6), 1040-1054 (2011).
- Gordon, J. A., Stryker, M. P. Experience-dependent plasticity of binocular responses in the primary visual cortex of the mouse. The Journal of Neuroscience. 16 (10), 3274-3286 (1996).
- McGee, A. W., Yang, Y., Fischer, Q. S., Daw, N. W., Strittmatter, S. M. Experience-driven plasticity of visual cortex limited by myelin and Nogo receptor. Science. 309 (5744), 2222-2226 (2005).
- Sawtell, N. B., et al. NMDA receptor-dependent ocular dominance plasticity in adult visual cortex. Neuron. 38 (6), 977-985 (2003).
- Hofer, S. B., Mrsic-Flogel, T. D., Bonhoeffer, T., Hubener, M. Prior experience enhances plasticity in adult visual cortex. Nature Neuroscience. 9 (12), 127-132 (2006).
- Crozier, R. A., Wang, Y., Liu, C., Bear, M. F. Deprivation-induced synaptic depression by distinct mechanisms in different layers of mouse visual cortex. Proceedings of the National Academy of Sciences. 104 (4), 1383-1388 (2007).
- Tagawa, Y., Kanold, P. O., Majdan, M., Shatz, C. J. Multiple periods of functional ocular dominance plasticity in mouse visual cortex. Nature Neuroscience. 8 (3), 380-388 (2005).
- Lickey, M. E., Pham, T. A., Gordon, B. Swept contrast visual evoked potentials and their plasticity following monocular deprivation in mice. Vision Research. 44, 3381-3387 (2004).
- Cang, J., Kalatsky, V. A., Lowel, S., Stryker, M. P. Optical imaging of the intrinsic signal as a measure of cortical plasticity in the mouse. Vision Neuroscience. 22 (5), 685-691 (2005).
- Khan, I. U., et al. Evaluation of different suturing techniques for cystotomy closure in canines. Journal of Animal & Plant Sciences. 23 (4), 981-985 (2013).
- Weisman, D. L., Smeak, D. D., Birchard, S. J., Zweigart, S. L. Comparison of a continuous suture pattern with a simple interrupted pattern for enteric closure in dogs and cats: 83 cases (1991-1997). Journal of the American Veterinary Medical Association. 214 (10), 1507-1510 (1999).
- Heneghan, C. P. H., Thornton, C., Navaratnarajah, M., Jones, J. G. Effect of isoflurane on the auditory evoked response in man. BJA: British Journal of Anaesthesia. 59 (3), 277-282 (1987).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomenal. Physiological Reviews. 65 (1), 37-100 (1985).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten