Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fare Birincil Görsel Kortekste Monoküler Görme Yoksunluğu ve Oküler Baskınlık Plastisite Ölçümü
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, kritik dönemde görsel plastisitenin nöral mekanizmalarının incelenmesinde önemli yöntemler olan monoküler görme yoksunluğu ve oküler hakimiyet plastisite analizi için ayrıntılı protokoller ve spesifik genlerin görsel gelişim.
Özet
Monoküler görme yoksunluğu primer görsel kortikal yanıt plastisite indüklemek için mükemmel bir deneysel paradigmadır. Genel olarak, korteksin bir uyarıcıya karşı kontralateral göze tepkisi, farenin birincil görsel korteksinin (V1) binoküler segmentindeki ipsilateral gözün tepkisinden çok daha güçlüdür. Memelikritik dönemde, kontralateral göz dikiş contralateral göz stimülasyonu V1 hücrelerinin hızlı bir yanıt kaybına neden olacaktır. Transgenik teknolojilerin sürekli gelişimi ile, daha fazla çalışma oküler hakimiyeti belirli genlerin etkilerini incelemek için deneysel modeller olarak transgenik fareler kullanıyor (OD) plastisite. Bu çalışmada, monoküler görme yoksunluğu için ayrıntılı protokoller sunmakta ve Fare V1'de OD plastisitedeki değişimi hesaplıyoruz. Kritik dönemde 4 gün boyunca monoküler yoksunluk (MD) sonrası, her nöronun oryantasyon ayar eğrileri ölçülür ve V1'deki dört nöronun tuning eğrileri ipsilateral ve kontralateral gözlerin uyarılması arasında karşılaştırılır. Kontralateral sapma indeksi (CBI) OD plastisite derecesini belirtmek için her hücrenin oküler OD puanı kullanılarak hesaplanabilir. Bu deneysel teknik kritik dönemde OD plastisiten nöral mekanizmalarının incelenmesi ve nöral gelişimde belirli genlerin rollerinin incelenmesi için önemlidir. En önemli sınırlama, akut çalışmanın aynı farenin nöral plastisitedeki değişimi farklı bir zamanda araştırmayamaz olmasıdır.
Giriş
Monoküler görme yoksunluğu V1 plastisiteyi incelemek için mükemmel bir deneysel paradigmadır. Nöral gelişimde görsel deneyimin önemini incelemek için, David Hubel ve Torsten Wiesel1,2 çeşitli zaman noktalarında ve zaman değişen dönemlerde bir göz normal görme yoksun kedi yavruları. Daha sonra v1'de yoksun ve yoksun olmayan gözler için tepki yoğunluğundaki değişiklikleri gözlemlediler. Sonuçları, ilk üç ay içinde kapatılan göze tepki veren anormal derecede düşük sayıda nöron olduğunu gösterdi. Ancak, yavru nöronlar gelen tepkiler bir yıl boyunca kapalı dikişli normal bir yetişkin kedi gözü ile her bakımdan aynı kaldı, ve yavru kurtarıldı değildi. Erişkin kedilerde MD OD plastisite neden olamaz. Bu nedenle, V1 kablolama üzerinde görsel deneyim etkisi geliştirme kısa, iyi tanımlanmış aşamasında güçlüdür, önce ve sonra aynı uyaranların daha az etkisi var. Görsel girişe yatkınlığın arttığı bir evre, görsel kortekste kritik dönem olarak bilinir.
Fare bir nokturnal hayvan olmasına rağmen, fare V1 bireysel nöronlar kedilerde bulunan nöronlar benzer özelliklere sahip3,4,5. Son yıllarda, transgenik teknolojinin hızlı gelişimi ile, görsel nörobilim çalışmaların giderek artan sayıda deneysel bir model olarak fareler kullanmış6,7,8. Fare görsel çalışmalarda, nörologlar farelerin genetik makyaj üzerinde kontrol sağlayan mutantlar ve nakavt fare hatları kullanın. Farelerv1 od kolonları olmamasına rağmen, V1 dürbün bölgesindeki tek nöronlar önemli OD özellikleri göstermektedir. Örneğin, çoğu hücre ipsilateral stimülasyon daha kontralateral stimülasyon daha güçlü yanıt. Kritik dönemde bir gözün geçici olarak kapanması OD indeksdağılımında9,10,11'deönemli bir değişime neden olur. Bu nedenle, MD nöral gelişimsel bozukluklar dahil genlerin in vivo kortikal plastisite nasıl etkilediğini araştırmak için bir OD plastisite modeli kurmak için kullanılabilir.
Burada, MD için deneysel bir yöntem sokulduk ve monoküler görme yoksunluğu sırasında OD plastisitedeki değişimi analiz etmek için yaygın olarak kullanılan bir yöntem (elektrofizyolojik kayıt) öneriyoruz. Yöntem yaygın 20 yılı aşkın bir süredir birçok laboratuvarda12,13,14,15,16için kullanılmaktadır. Kronik görsel uyarılmış potansiyel (VEP) kayıt17ve içsel optik görüntüleme (IOI)18gibi OD plastisite ölçümünde kullanılan diğer yöntemler de vardır. Bu akut yöntemin önemli avantajı takip etmek kolay olmasıdır, ve sonuçlar son derece güvenilir.
Protokol
Bu protokolde Erkek C57Bl/6 fareler, Sichuan Tıp Bilimleri Akademisi Laboratuvar Hayvanları Enstitüsü ve Sichuan İl Halk Hastanesi'nden temin edilmiştir. Tüm hayvan bakımı ve deneysel prosedürler Kurumsal Hayvan Bakım ve Kullanım Komitesi, Çin Elektronik Bilimler ve Teknoloji Üniversitesi tarafından onaylandı.
1. Farelerde doğum sonrası 28 günde monoküler yoksunluk (MD)
- Cerrahi aletler, dikiş iğnesi (0,25 mm çap, dize çapı 0,07 mm) ve pamuklu bezleri alüminyum bir kutuya koyun ve 120 °C'de 0,5 saat boyunca otoklavlayın. Cerrahi aletleri kurutma fırınında kurutun.
- %2 agarose çözeltisi hazırlayın, katılaşmayı önlemek için 75 °C'de bir su banyosuna koyun.
- Fareyi anestezik oksijenle karıştırılmış isofluran kullanın (%2 indüksiyon ve %1.2-1.5 bakım). Stereotaksik cihaz üzerinde fare yi düzeltin ve farenin vücut sıcaklığını 37 °C'de tutmak ve hipotermiyi önlemek için ısı düzenleyici bir cihaz kullanın.
- Her iki göze de ince bir yağ bazlı göz merhemi uygulayın.
- Aydınlatma ile anatomik mikroskop altında, bir göz üzerinde göz kapağı dikiş. Göz kapağı 2x her iki tarafında olsa iğne geçmek olun(Şekil 1A) ve yaklaşık dört dikiş yapmak.
- Düğüm iplik 2-3x ve sonra iplik kırpma. Stabilitesini artırmak için düğüme 3 μL instant kurutma tutkalı uygulayın. Sonra ekstra dikiş iplik kesti.
- Fareye intraperitoneal buprenorfin (1 mg/kg) enjeksiyonu sağlayın.
- Fareyi vücut ısısını 37 °C'de korumak ve hipotermiyi önlemek ve bilincini geri kazanana kadar izlemek için bir ısıtma yastığına aktarın.
- Fare tamamen uyanık olduğunda ayrı bir tutma kafesi içine yerleştirin.
- Kapalı ve enfekte olmadığından emin olmak için göz kapaklarını günlük olarak kontrol edin. Göz kapağı açıklığı bulunursa fareyi hariç tut.
- Elektrofizyolojik kayıttan önce fareyi anestezik oksijenle karıştırılmış isofluran kullanın (%2 indüksiyon ve %1.2-1.5 bakım).
- Göz küresini ortaya çıkarmak için göz makası ile dikiş çıkarın. Göz kapaklarını dikkatlice kırpın.
- Gözü mercek solüsyonuyla temizleyin ve netlik için mikroskop altında gözü kontrol edin. Kornea opacities veya enfeksiyon belirtileri olan fareler hariç.
2. 4. gün monoküler yoksunluk sonra fare V1 dürbün bölgesinde kraniotomi
- Fareyi anestezi ettikten sonra, bir parmak ucuna yanıt olmadığı için anestezinin derinliğini kontrol edin.
- Fareyi stereotaksik aparata yerleştirin ve düzeltin. Beyni düz ve stabil tutmak için kulak çubuğunun ve diş çubuğunun yüksekliğini ayarlayın.
- Vücut ısısını korumak için bir ısıtma yastığı kullanın.
- Onları nemli tutmak için göz yüzeyine bir petrol bazlı göz merhemi uygulayın.
- Cildini ortaya çıkarmak için farenin kafasındaki saçı çıkarın. İyot ve% 70 etanol 3x alternatif scrubs ile cilt ovmak.
- Kafatasıortaya çıkarmak ve kafa derisi dokusukaldırmak için kulaklar arasında derinin 8 x 8 mm alan eğim. Sonra% 30 hidrojen peroksit ile örten bağ dokusu kaldırın.
- Beyincik üzerinde kafatasında 1 x 1 mm delik delin. Referans olarak deliğe küçük bir kemik vida yapıştırın.
- V1 dürbün bölgesinde, kontralateral yarımküreden yoksun göze kadar 1 mm çapında küçük bir kraniyotomi gerçekleştirin(Şekil 1B, A-P: lambda -0.51–lambda +1.67 mm; M-L: -2.6- -3.0 mm; D-V: 0-1 mm). Dikkatle beyin zarar vermeden kafatası parçası çıkarın.
- Kurumasını önlemek için 40 °C'de %2'lik 75°L'lik agarose ile açık kortikal yüzeyi kapatın.
- Stereotaksik çerçeve üzerinde bir tungsten elektrot düzeltmek. Tungsten elektrotunu, kaydedilen hücrelerin her iki göze de tepki verdiğinden emin olmak için, V1'in dürbün bölgesi olan açık korteksin yüzeyine dikey olarak yerleştirin.
- Göz jeli kaldırmak ve her 2 saat göze silikon yağı uygulamak için pamuklu bezler kullanın.
3. Görsel uyarılma ve elektrofizyolojik kayıt
- Tek gözünü şeffaf olmayan plastik plakayla maskeleyin. Farenin gözünden 23 cm uzaklıktaki bir LCD monitör yerleştirin.
- Fare tamamen anestezi aldığında anesteziyi %0,5-0,8'e düşürün.
- Bir yağ hidrolik mikromanipülatör ile mikroelektrot elektrot yavaş yavaş ilerletin. Yüksek sinyal-gürültü oranı gözlendiğinde ve elektrot 4. Amplifikasyon faktörünün 1.000, filtrenin 300-100 Hz ve numune oranının 40 Hz olarak ayarlandığından emin olun.
- LED monitörde tam alan hareketli sinüzoidal ızgara(Şekil 1D, 12 yön, %100 kontrast, 2 Hz geçici frekans, mekansal frekans derecesi başına 0,04 döngü) sunun.
- Hücrenin yanıtını ipsilateral ve kontralateral gözü ayrı ayrı uyararak ölçün. Mevcut 3-5x toplam.
- Her penetrasyonda beş ila sekiz hücrenin yanıtlarını ölçün. Her farede dört ila altı penetrasyon gerçekleştirin.
- Kayıttan sonra, isofluran akış hızını %5 veya daha fazlaya ayarlayın, 1 dakika boyunca isofluran maruziyetini devam edin ve servikal çıkığı gerçekleştirin.
NOT: Ayrı penetrasyonlar V1 dürbün bölgesinde en az 200 μm arayla aralıklı edildi.
4. Off-line başak sıralama ve veri analizi
- Ham sinyal bir eşik seviyesini geçtiğinde ani artışları algıla. Yakalanan ani artışları ilk pozitif veya negatif tepede hizala. Farklı hücrelerden ani artışlar algılamak için yazılım kullanın.
- İki imleç ayarlayın: biri pozitif, diğeri negatif sapma için. Başak şablonu ayarlama (Şekil 2A). Şablon alanını, farklı ani artış sınıfları arasındaki en önemli varyasyonla birlikte buna ayarlayın.
- Kümeler halinde ayırmak için ana bileşen çözümlemesi kullanın. Kümeleme yöntemleri farklı laboratuvarlar arasında farklılık gösterebilir.
- K-anlamına gelir algoritmasını kullanarak bir sınırın başak sınıflandırmak.
- Oryantasyonu başak atış hızıyla ilişkilendirin ve ipsilateral ve kontralateral göz için oryantasyon akort eğrilerini çizin.
- Kontralateral/ipsilateral tepki mukavemet oranını temsil eden tek birim için OD indeksini hesaplayın:
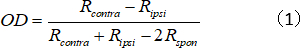
Rkontra ve Ripsi kontralateral ve ipsilateral göz için hücrenin en uygun yanıt, ve Rspon hücrenin spontan aktivitesi dir. - OD puanlarını aşağıdaki şekilde 1-7'ye atayın: − 1 - −0,75 = 1; −0,75 ile −0,45 = 2; −0,45 ile −0,15 = 3; −0,15 ile 0,15 = 4; 0,15 ile 0,45 = 5 arası; 0,45 ile 0,75 = 6 arası; ve 0,75 ile 1 = 7 arasında dır.
- Kontralateral sapma indeksi (CBI) hesaplamak:
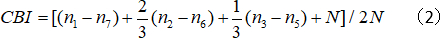
n hücre numarası dır ve nx od puanları x'e eşit olan hücre sayısına eşittir.
Sonuçlar
Burada açıklanan deneysel sonuçlar, kritik dönemde (P19-P32) yoksun ve yoksun bir fareden başarılı MD ve OD plastisite ölçümleri sağlar. Şekil 1, MD'den 4 gün sonra ipsilateral ve kontralateral gözdeki yanıtları karşılaştırmak için binoküler bölge V1'den 4. Şekil 2, ipsilateral ve kontralateral gözleri uyaran başak sıralama ve oryantasyon alet ölçümlerini gösterir. Başak sıralama için, başak şablonu ani ana bileşen ağırlık...
Tartışmalar
Biz MD ve ölçüm OD plastisite için tek bir birim kayıt ile ayrıntılı bir protokol sıyoruz. Bu protokol görsel nörolojide yaygın olarak kullanılmaktadır. MD protokolü karmaşık olmasa da, dikkatle takip edilmesi gereken bazı kritik cerrahi prosedürler vardır. İlk olarak, dikiş kalitesini sağlayan iki önemli ayrıntı vardır. Dikişler göz kapağının medial kısmında yoğunlaşmışsa dikiş yeterince kararlıdır. Ayrıca, gözün yeniden açılmasını önlemek için düğümün stabilitesini ...
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları olduğunu beyan.
Teşekkürler
Bu çalışma Çin Ulusal Doğa Bilimleri Vakfı (81571770, 81771925, 81861128001) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 502 glue | M&G Chenguang Stationery Co., Ltd. | AWG97028 | |
| Acquizition card | National Instument | PCI-6250 | |
| Agarose | Biowest | G-10 | |
| Amplifier | A-M system | Model 1800 | |
| Atropine | Aladdin Bio-Chem Technology Co., Ltd | A135946-5 | |
| Brain Stereotaxic Apparatus | RWD Life Science Co.,Ltd | 68001 | |
| Cohan-Vannas spring scissors | Fine Science Tools | 15000-02 | |
| Contact Lenses Solutions | Beijing Dr. Lun Eye Care Products Co., Ltd. | GM17064 | |
| Cotton swabs | Henan Guangderun Medical Instruments Co.,Ltd | ||
| Fine needle holder | SuZhou Stronger Medical Instruments Co.,Ltd | CZQ1370 | |
| Forcep | 66 Vision Tech Co., Ltd. | 53320A | |
| Forcep | 66 Vision Tech Co., Ltd. | 53072 | |
| Forcep | 66 Vision Tech Co., Ltd. | #5 | |
| Heating pad | Stryker | TP 700 T | |
| Illuminator | Motic China Group Co., Ltd. | MLC-150C | |
| Isoflurane | RWD Life Science Co.,Ltd | R510-22 | |
| LCD monitor | Philips (China) Investment Co., Ltd. | 39PHF3251/T3 | |
| Microscope | SOPTOP | SZMT1 | |
| Noninvasive Vital Signs Monitor | Mouseox | ||
| Oil hydraulic micromanipulator | NARISHIGE International Ltd. | PC-5N06022 | |
| Petrolatum Eye Gel | Dezhou Yile Disinfection Technology Co., Ltd. | 17C801 | |
| Spike2 | Cambridge Electronic Design, Cambridge, UK | Spike2 Version 9 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54010 | |
| Surgical scissors | 66 Vision Tech Co., Ltd. | 54002 | |
| Suture Needle | Ningbo Medical Co.,Ltd | 3/8 arc 2.5*8 | |
| Tungsten Electrode | FHC, Inc | L504-01B | |
| Xylocaine | Huaqing |
Referanslar
- Hubel, D. H., Wiesel, T. N. Effects of monocular deprivation in kittens. Naunyn-Schmiedebergs Archiv für experimentelle Pathologie und Pharmakologie. 248 (6), 492-497 (1964).
- Daw, N. W., Fox, K., Sato, H., Czepita, D. Critical period for monocular deprivation in the cat visual cortex. Journal of Neurophysiology. 67 (1), 197-202 (1992).
- Guire, E. S., Lickey, M. E., Gordon, B. Critical period for the monocular deprivation effect in rats: assessment with sweep visually evoked potentials. Journal of Neurophysiology. 81 (1), 121-128 (1999).
- Wang, L., Sarnaik, R., Rangarajan, K. V., Liu, X., Cang, J. Visual receptive field properties of neurons in the superficial superior colliculus of the mouse. Journal of Neuroscience. 30 (49), 16573-16584 (2010).
- Niell, C. M. Cell Types, circuits, and receptive fields in the mouse visual cortex. Annual Review of Neuroscience. 38 (1), 413-431 (2015).
- Lee, S. H., et al. Activation of specific interneurons improves V1 feature selectivity and visual perception. Nature. 488 (8), 379-383 (2012).
- Cossell, L., et al. Functional organization of excitatory synaptic strength in primary visual cortex. Nature. 518 (2), 399-403 (2015).
- Lacaruso, M. F., Gasler, L. T., Hofer, S. B. Synaptic organization of visual space in primary visual cortex. Nature. 547 (7), 449-452 (2017).
- Metin, C., Godement, P., Imbert, M. The primary visual cortex in the mouse: Receptive field properties and functional organization. Experimental Brain Research. 69 (3), 594-612 (1988).
- Marshel, J. H., Garrett, M. E., Nauhaus, I., Callaway, E. M. Functional specialization of seven mouse visual cortical areas. Neuron. 72 (6), 1040-1054 (2011).
- Gordon, J. A., Stryker, M. P. Experience-dependent plasticity of binocular responses in the primary visual cortex of the mouse. The Journal of Neuroscience. 16 (10), 3274-3286 (1996).
- McGee, A. W., Yang, Y., Fischer, Q. S., Daw, N. W., Strittmatter, S. M. Experience-driven plasticity of visual cortex limited by myelin and Nogo receptor. Science. 309 (5744), 2222-2226 (2005).
- Sawtell, N. B., et al. NMDA receptor-dependent ocular dominance plasticity in adult visual cortex. Neuron. 38 (6), 977-985 (2003).
- Hofer, S. B., Mrsic-Flogel, T. D., Bonhoeffer, T., Hubener, M. Prior experience enhances plasticity in adult visual cortex. Nature Neuroscience. 9 (12), 127-132 (2006).
- Crozier, R. A., Wang, Y., Liu, C., Bear, M. F. Deprivation-induced synaptic depression by distinct mechanisms in different layers of mouse visual cortex. Proceedings of the National Academy of Sciences. 104 (4), 1383-1388 (2007).
- Tagawa, Y., Kanold, P. O., Majdan, M., Shatz, C. J. Multiple periods of functional ocular dominance plasticity in mouse visual cortex. Nature Neuroscience. 8 (3), 380-388 (2005).
- Lickey, M. E., Pham, T. A., Gordon, B. Swept contrast visual evoked potentials and their plasticity following monocular deprivation in mice. Vision Research. 44, 3381-3387 (2004).
- Cang, J., Kalatsky, V. A., Lowel, S., Stryker, M. P. Optical imaging of the intrinsic signal as a measure of cortical plasticity in the mouse. Vision Neuroscience. 22 (5), 685-691 (2005).
- Khan, I. U., et al. Evaluation of different suturing techniques for cystotomy closure in canines. Journal of Animal & Plant Sciences. 23 (4), 981-985 (2013).
- Weisman, D. L., Smeak, D. D., Birchard, S. J., Zweigart, S. L. Comparison of a continuous suture pattern with a simple interrupted pattern for enteric closure in dogs and cats: 83 cases (1991-1997). Journal of the American Veterinary Medical Association. 214 (10), 1507-1510 (1999).
- Heneghan, C. P. H., Thornton, C., Navaratnarajah, M., Jones, J. G. Effect of isoflurane on the auditory evoked response in man. BJA: British Journal of Anaesthesia. 59 (3), 277-282 (1987).
- Mitzdorf, U. Current source-density method and application in cat cerebral cortex: investigation of evoked potentials and EEG phenomenal. Physiological Reviews. 65 (1), 37-100 (1985).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır