Method Article
تقنيات الكيمياء الهيستولوجية المناعية لتحليل الانتشار الخلوي وتكوين الخلايا العصبية في الفئران باستخدام Thymidine Analog BrdU
* These authors contributed equally
In This Article
Summary
تقدم هذه الورقة أربعة من أكثر التقنيات شيوعا لتصور الخلايا الإيجابية BrdU لقياس تكوين الخلايا العصبية البالغة في الفئران. يتضمن هذا العمل تعليمات لإعداد الكاشف ، وإدارة الثيميدين التناظرية ، والتروية عبر القلب ، وإعداد الأنسجة ، والتفاعل الكيميائي المناعي للبيروكسيديز ، والتألق المناعي ، وتضخيم الإشارة ، والتلوين المضاد ، والتصوير المجهري ، وتحليل الخلايا.
Abstract
أحد أهم الأشياء في مجال تكوين الخلايا العصبية الحصينية للبالغين (AHN) هو تحديد الخلايا المولدة حديثا. الكشف المناعي لنظائر الثيميدين (مثل 5-Bromo-2'-deoxyuridine (BrdU)) هو تقنية قياسية تستخدم لتصور هذه الخلايا المولدة حديثا. لذلك ، عادة ما يتم حقن BrdU في الحيوانات الصغيرة داخل الصفاق ، لذلك يتم دمج نظير الثيميدين في الخلايا المنقسمة أثناء تخليق الحمض النووي. يتم الكشف عن طريق التحليل المناعي الكيميائي لشرائح الدماغ. يمكن لكل مجموعة بحثية تستخدم هذه التقنية أن تقدر أنها تتطلب اهتماما خاصا بالتفاصيل الدقيقة لتحقيق بقعة ناجحة. على سبيل المثال ، خطوة مهمة هي تمسخ الحمض النووي باستخدام حمض الهيدروكلوريك ، مما يسمح له بالوصول إلى نواة الخلية لتلطيخها. ومع ذلك ، فإن التقارير العلمية الحالية تصف عددا قليلا جدا من هذه الخطوات بالتفصيل. لذلك ، فإن توحيد التقنية يمثل تحديا للمختبرات الجديدة حيث قد يستغرق الأمر عدة أشهر لتحقيق نتائج إيجابية وناجحة. الغرض من هذا العمل هو وصف وتوضيح الخطوات للحصول على نتائج إيجابية وناجحة لتقنية التلوين المناعي بالتفصيل عند العمل مع الثيميدين التناظري BrdU. يتضمن البروتوكول إعداد الكاشف وإعداده ، وإدارة نظير الثيميدين في القوارض ، والتروية عبر القلب ، وإعداد الأنسجة ، والتفاعل الكيميائي المناعي للبيروكسيديز ، واستخدام مجمع أفيدين بيوتين ، والتألق المناعي ، والتلطيخ المضاد ، والتصوير المجهري ، وتحليل الخلايا.
Introduction
فكرة أن الخلايا العصبية الجديدة تتولد في الدماغ البشري البالغ طوال العمر قد فتنت المجتمع العلمي لعقود. تم تحقيق المعرفة بأن الدماغ يولد خلايا عصبية جديدة طوال عمره من خلال الكشف عن الخلايا تحت القسم 1,2. تم تحديد اكتشاف الخلايا العصبية المولدة حديثا في الدماغ البالغ لأول مرة عن طريق حقن الثيميدين داخل الجمجمة (ثيميدين-H3) في الفئران واكتشاف الخلايا في دورة الخلية عن طريق التصوير الإشعاعي الذاتي 1,2. تم الإبلاغ عن انقسام الخلايا الدبقية ووجود الخلايا العصبية ، والتي كانت أول بيانات واعدة عن تكوين الخلايا العصبيةبعد الولادة 1. ومع ذلك ، فإن استخدام واكتشاف ثيميدين-H3 يعني استخدام النشاط الإشعاعي ، والذي يمكن أن يكون ضارا للأشخاص الذين يديرونه. ظهر أول جهد لفحص مدى ملاءمة الكيمياء الهيستولوجية المناعية BrdU في دراسة انتشار الخلايا وهجرتها وأصلها في الجهاز العصبي في عام 1988 بواسطة Miller and Nowakowski3. في عام 1998 ، أظهرت ورقة نشرها إريكسون وزملاؤه أنه تم تصور خلايا عصبية جديدة بعد الوفاة في دماغ الإنسان البالغ للمرضى الذين تم حقنهم ب 5-Bromo-2′-deoxyuridine (BrdU)4. تلقى هؤلاء المرضى حقن BrdU (250 ملغ في الوريد) لتسمية نمو الأورام4. تم اعتماد هذه التقنية في النماذج الحيوانية. كان إدخال هذه الأساليب بمثابة علامة فارقة في هذا المجال لأن هذا سمح بالكشف عن الخلايا المولدة حديثا دون استخدام المركبات المشعة. أصبح هذا الإجراء المعيار الذهبي لقياس تكاثر الخلايا في منافذ الدماغ البالغة لتعزيز المزيد من البحث في هذا المجال.
الحد من تقنية التناظرية ثيميدين هو أنها لا تسمح بتحديد الهوية الخلوية للخلايا التي تم إنشاؤها حديثا. ومع ذلك ، تسمح لنا الكيمياء الهيستولوجية المناعية بتنفيذ تقنية وضع العلامات المزدوجة أو الثلاثية لنفس الخلية ، والتي تتحقق من صحة المصير الخلوي للخلايا المولدة حديثا وحتى مراحل نضجها ، مما يؤدي إلى مزيد من التطور في المجال. تميزت هذه الطريقة بتمييز الخلايا المولدة حديثا إلى خلايا دبقية أو خلايا عصبية غير متمايزة أو خلية حبيبية ناضجة تماما ، وحتى لتحديد ما إذا كانت تشارك بنشاط في الدوائر. كان هناك اختراق آخر في هذا المجال هو استخدام النماذج المعدلة وراثيا لتحديد الخلايا غير المتمايزة تحت مجال العش. تعبر الفئران المعدلة وراثيا nestin-GFP عن بروتين فلوري أخضر محسن (GFP) ، والذي يخضع لسيطرة مروج العش. Nestin هو خيوط وسيطة تتميز بالخلايا السلفية5. سمحت الفئران المعدلة وراثيا nestin-GFP بإنشاء خطوات تنموية مبكرة تشارك في تكوين الخلايا العصبية6. ومع ذلك ، فإن أحد القيود الكبيرة هو القدرة على الحفاظ على مستعمرة الفئران المعدلة وراثيا nestin-GFP في ظل ظروف خاصة في مرفق مختبري يصبح فعالا من حيث التكلفة لبعض المجموعات العلمية ، وخاصة تلك من البلدان النامية.
التقنيات المذكورة أعلاه لها مزايا وعيوب. ومع ذلك ، فإن تحديد الخلايا المتكاثرة بواسطة الكيمياء الهيستولوجية المناعية (IHC) وإمكانية تنفيذ تقنية وضع العلامات المزدوجة أو الثلاثية عن طريق التألق المناعي لتحديد مرحلة نضج الخلية أو مصير الخلية يمثل الطريقة الأكثر جدوى لقياس تكوين الخلايا العصبية للبالغين ، حتى الآن. تتكون عملية التحديد باستخدام الكيمياء الهيستولوجية المناعية من وضع العلامات على البروتينات أو مجال البروتين أو النيوكليوتيدات بجسم مضاد محدد يسمح بالتعرف عليها يعرف باسم الجسم المضاد الأساسي. يتم التعرف على هذا الأخير من خلال الجسم المضاد الثانوي ، والذي يتميز بكروموجين (على سبيل المثال ، بيروكسيديز الفجل) أو فلوروكروم (على سبيل المثال ، FITC) إلى جانب الجسم المضاد الثانوي. يمكن للمجاهر اكتشاف كل من إشارات الكروموجينات والفلوروكروم. باستخدام IHC ، من الممكن تحديد البروتينات الغشائية أو بروتينات الهيكل الخلوي أو المكونات النووية مثل BrdU. من ناحية أخرى ، يمكن العثور على BrdU في النواة الخلوية لأنه مدمج في الحمض النووي خلال المرحلة S عن طريق المنافسة. لذلك ، فإن الخطوة الحاسمة هي تمسخ الحمض النووي باستخدام حمض الهيدروكلوريك ، والذي يفتح روابط الحمض النووي للسماح للأجسام المضادة BrdU بالوصول إلى BrdU داخل الحمض النووي. من الضروري معرفة أن BrdU موجود بتركيز مشبع في الفئران ومصل الفئران لمدة 15 و 60 دقيقة على التوالي ، بعد تناوله داخل الصفاق ، ثم ينخفض بسرعة إلى مستويات لا يمكن اكتشافها عند 60 و 120 دقيقة على التوالي7.
هنا ، نصف أربع تقنيات مختلفة ولكنها وثيقة الصلة ب IHC: الكشف غير المباشر الكروموجيني باستخدام تفاعل بيروكسيديز الفجل (HRP) مع DAB (3،3'-diaminobenzidine) بدون تضخيم إشارة (الخطوة 4.1) ، تضخيم مركب avidin-biotin (ABC) (الخطوة 4.1) ، الكشف المناعي غير المباشر بدون تضخيم الإشارة (الخطوة 4.4) وتضخيم الستربتافيدين - البيوتين (LSAB) المسمى (الخطوة 4.3). كل طريقة لها مزايا وعيوب ويمكن أن تكون مفيدة لمتطلبات الأنسجة المحددة (انظر الجدول 1). قررنا اتباع طرق ICH غير المباشرة نظرا لقدرتها على تحمل التكاليف وبساطتها لإجراء تغييرات من طرق الكشف عن الكروموجين إلى طرق الكشف عن الفلورسنت عند استخدام الأجسام المضادة الأولية غير المقترنة. نهج HRP هو طريقة IHC شائعة الاستخدام نظرا لقدرتها على تحمل التكاليف ، والاستقرار العالي ، ومعدل الدوران المرتفع ، والتوافر الكامل للركائز. ومع ذلك ، نوصي باستخدام عنصر تحكم إيجابي للتأكد من أن طريقة التلوين تعمل بدقة واستخدام التحكم السلبي لاختبار وظيفة الأجسام المضادة بشكل فعال. تعد البقع المناعية المتعددة أو طرق IHC المتعددة (انظر الخطوة 6) أدوات فعالة للحصول على كميات كبيرة من البيانات من قسم الأنسجة في تجربة واحدة. هذه التقنية مهمة بشكل خاص عندما يكون توافر العينات محدودا. ميزة أخرى هي إمكانية تحديد بروتينات معينة في وقت واحد يتم التعبير عنها في نفس الفضاء الخلوي مع الحفاظ على سلامة الأنسجة. يسمح Multiplex بتلطيخ علامات مختلفة يتم التعبير عنها خلال مراحل تكاثرية محددة (على سبيل المثال ، nestin و GFAP و DCX و Ki-67) ، مما يمكننا من الوصول إلى بحث أكثر تفصيلا عن الانتشار والتمايز8. من الأهمية بمكان اختيار الأجسام المضادة المتوافقة مع تقنية التثبيت المستخدمة لتجنب التفاعل المتبادل. نوصي باختبار كل جسم مضاد جديد (بما في ذلك BrdU) بشكل فردي لضبط الطريقة وتحسينها. بعد ذلك ، أدخل التلوين المتسلسل المزدوج ، وأخيرا ، ابدأ عملية التلطيخ المناعي المتزامنة عندما تهيمن الطريقة المتسلسلة تماما. من الأهمية بمكان اختيار الأجسام المضادة الثانوية المناسبة لهذه الطريقة.
| أسلوب | طريقة محددة | مزايا | مساوئ |
| طريقة الكشف غير المباشر | تفاعل البيروكسيديز مع DAB | 1. حساسية أعلى من طريقة الكشف المباشر والتألق غير المباشر. 2. مقاومة أعلى للتبييض الضوئي من الفلوروكروم. 3. تكلفة أقل من طريقة الكشف عن مضان | 1. من الصعب تعدد الإرسال مع عدد أقل من الأصباغ الملونة. 2. معقدة للأهداف المعبر عنها بشكل مشترك في نفس الفضاء الخلوي. 3. انخفاض النطاق الديناميكي للأهداف النادرة والعالية الوفيرة في وقت واحد على نفس النسيج. |
| استشعاع | 1. الأفضل والأسهل لتعدد الإرسال مع المزيد من الأصباغ الملونة. 2. الأفضل للأهداف المعبر عنها بشكل مشترك في نفس الفضاء الخلوي. 3. نطاق ديناميكي أفضل لأهداف نادرة وعالية الوفرة في وقت واحد على نفس النسيج. 4. لا توجد خطوات إضافية. | 1. حساسية أقل من تفاعل البيروكسيديز غير المباشر مع طريقة DAB. 2. ضعف مقاومة التبييض الضوئي مع مرور الوقت. 3. أكثر تكلفة. | |
| طريقة تضخيم الإشارة | مجمع أفيدين بيوتين (ABC) | 1. حساسية أعلى من طريقة الكشف المباشر وغير المباشر. 2. تقليل الخلفية | 1. خطوات إضافية. 2. أكثر تكلفة من عدم التضخيم. |
| المسمى ستربتافيدين بيوتين (LSAB) | 1. حساسية أعلى من طريقة الكشف المباشر وغير المباشر. 2. اختراق الأنسجة أكثر جوهرية من طريقة ABC. 3. تقليل الخلفية | 1. خطوات إضافية. 2. أغلى من طريقة ABC. | |
| ليست طريقة تضخيم إضافية | 1. تكلفة أقل. 2. لا توجد خطوات إضافية. 3. مثالية للأهداف عالية وفيرة. | 1. حساسية أقل: إشكالية مع عدم وجود أهداف وفيرة. |
الجدول 1: مزايا / عيوب تقنيات IHC. يوضح هذا الجدول مزايا / عيوب طرق الكشف غير المباشر: تفاعل البيروكسيديز مع (3،3'-ديامينوبينزيدين) DAB والتألق. وطرق تضخيم الإشارة: مجمع أفيدين بيوتين (ABC) ، المسمى ستربتافيدين بيوتين (LSAB) ، وليس طريقة تضخيم إضافية.
تعد الصورة عالية الدقة أمرا أساسيا لإجراء التحليل المناسب وتقديم النتائج. هناك طريقتان لتحسين الدقة: 1) استخدام تصميم مجهر أفضل (على سبيل المثال ، بؤري ، متعدد الفوتون) أو 2) عكس عملية التعتيم عدديا لتحسين الصور باستخدام deconvolution9. لسوء الحظ ، فإن الفحص المجهري متحد البؤر ليس ميسور التكلفة بسبب ارتفاع تكاليف المعدات وخدمتها10. يوفر مجهر التألق واسع المجال وإزالة الالتفاف اللاحقة لصور z-stack بديلا مناسبا ومنخفض التكلفة للفحص المجهري متحد البؤر 8,9. كما هو مذكور أعلاه ، فإن هدف إزالة الالتفاف هو استعادة الإشارة الأصلية التي تدهورت بواسطة نظام الاكتساب9 ، عن طريق تقليل الضبابية والضباب خارج التركيز والتشويه الموضح في الصورة التي تم الحصول عليها بواسطة مجهر فوق الفلور أو مجهر متحد البؤر باستخدام خوارزميات الإزالة الرياضية10. يمكن نمذجة الصورة غير الواضحة المكتسبة رياضيا كنتيجة لدمج الكائنات المرصودة مع وظيفة انتشار نقطة 3D (PSF). PSF هو نمط حيود نظري لنقاط الضوء المنبعثة من عينة الأنسجة والتي يجمعها المجهر. يتم إنشاء ملف PSF مع شروط محددة لكل صورة، مثل تباعد خلية اتفاقية مكافحة التصحر من الكاميرا، معامل الانكسار من وسائل الإعلام المستخدمة، والفتحة العددية للعدسة موضوعية، والطول الموجي انبعاث الفلوروفور، وأحجام الصور، وعدد الصور في طريقة معالجة z-stack والمسافة بينهما (انظر المواصفات الفنية في الجدول 2). وبعبارة أخرى، يلخص ملف PSF آثار إعداد التصوير على ملاحظات المجهر9. ومع ذلك ، فإننا نستخدم المكون الإضافي PSF 3D للحيود (https://imagej.net/Diffraction_PSF_3D) لإنشاء ملف PSF الخاص بنا لكل صورة z-stack. صور Z-stack عبارة عن سلسلة من المقاطع البصرية الرقمية من أعماق محددة (المحور z) في نفس موقع XY للشريحة. يقوم الكمبيوتر بتجميع المعلومات التي تم الحصول عليها من مستوى التركيز عن طريق إعادة تعيين الإشارات التي نشأت من كائنات موجودة في مستويات بؤرية أخرى. لإنشاء صور z-stack ، من الضروري التقاط صور من طبقات مركزة مختلفة من الشرائح (على سبيل المثال ، عشر صور مختلفة لنفس منطقة XY كل عمق 1 ميكرومتر). بعد ذلك ، نستخدم برنامج الفحص المجهري المقدم من الشركة المصنعة أو فيجي لإنشاء صورة z-stack أو 3D. ستكون النتيجة ملف صورة مكدس واحد (على سبيل المثال ، عشر صور ذات بؤر مختلفة). هناك العديد من الأدوات والحلول البرمجية الخاصة بالعميل ، مثل البرامج مفتوحة المصدر للفحص المجهري لإزالة الالتفاف. سنعرض مخرجات عملية إزالة الالتفاف باستخدام DeconvolutionLab29 وهو مكون إضافي فيجي11 (توزيع ImageJ12). سيساعد فك الالتفاف على تحسين دقة الصور المجهرية النهائية (انظر الشكل 1B ، C). لمزيد من المعلومات والتعليمات ، نوصي بشدة بقراءة المرجع13.
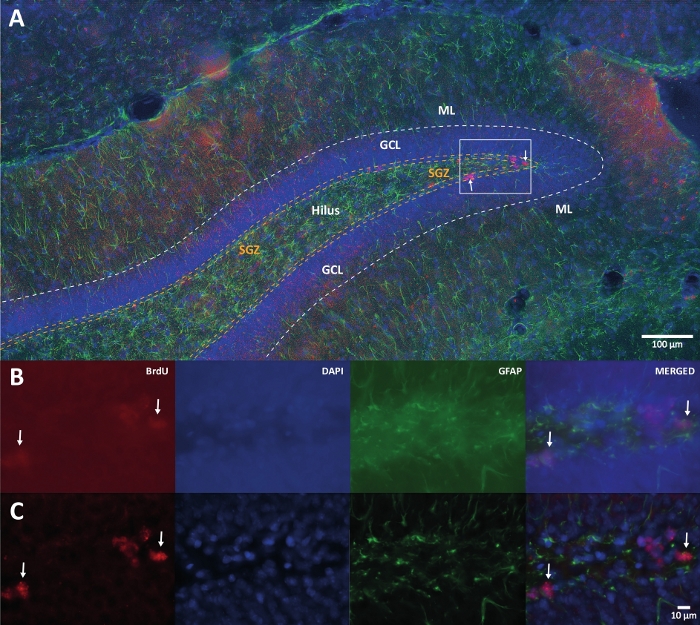
الشكل 1: صورة تمثيلية لفك الالتفاف ثلاثي الأبعاد لقنوات ألوان متعددة. (أ) DG عند التكبير المنخفض. (ب) صور z-stack الأصلية لكل قناة والصورة المدمجة. (C) صور z-stack غير معقدة 3D لكل قناة والصورة المدمجة. كان هذا الدماغ من الفئران التي كانت جزءا من مجموعة النشاط البدني. تم استخدام طريقة تضخيم الستربتافيدين البيوتين (LSAB) المسمى. أظهر الجسم المضاد المترافق Cy3 streptavidin للإشارة إلى BrdU (أحمر) ، DAPI كمضاد (أزرق) ، وبروتين حمضي ليفي دبقي (GFAP) كعلامة نجمية (أخضر). ML = الطبقة الجزيئية ؛ GCL = طبقة الخلية الحبيبية ؛ SGZ = المنطقة تحت الحبيبية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الغرض من هذا العمل هو تقديم وصف مفصل لخطوات الحصول على نتائج إيجابية وناجحة مع التلوين المناعي وسرد الخطوات الشائعة الاستخدام في الدراسات القائمة على BrdU ، دون استخدام مجهر متحد البؤر. تلطيخ BrdU هو تقنية تتطلب عدة خطوات يجب اتباعها بعناية لتحقيق وصمة عار ناجحة. عادة ما يستغرق توحيد تقنيات التلوين هذه شهورا ويتطلب وقتا وموارد. توقعنا أن توفر هذه المقالة معلومات للمجموعات التي تبدأ في هذا المجال عن طريق تقليل الوقت والأخطاء.
Protocol
تتبع جميع الإجراءات دليل المعاهد الوطنية للصحة لرعاية واستخدام المختبر (منشورات المعاهد الوطنية للصحة رقم 8023 ، المنقحة في عام 1978) والقوانين المكسيكية المحلية لتقليل عدد الحيوانات المستخدمة ومعاناتها. وافقت لجنة الأخلاقيات في الجامعة الأيبيرية الأمريكية على البروتوكولات التجريبية لاستخدام الحيوانات في هذه الدراسة.
1. إعداد الكاشف والإعداد
ملاحظة: يمكن تحضير معظم الحلول قبل أيام من الاستخدام ما لم ينص على خلاف ذلك.
- حل BrdU
- استرجع محلول BrdU من الفريزر -20 درجة مئوية واتركه يتوازن في درجة حرارة الغرفة (RT).
- احسب كتلة BrdU اللازمة لجرعة 50 مجم / كجم وفقا لوزن جسم الفئران. احسب حجم محلول ملحي 0.9٪ (0.9 جم كلوريد الصوديوم في 100 مل من H2O المعقم) اللازم لمحلول عمل مقداره 20 ملغم/مل. تحضير فائض لتوفير ما لا يقل عن 0.5 مل لكل فأر لكل حقنة.
ملاحظة: يجب أن تكون الجرعة المعطاة لحيوانات التجارب آمنة ، مع الحد الأدنى من الآثار الجانبية ، وفعالة. تم الإبلاغ عن أن مدة التلوين ب 100 مجم / كجم BrdU لا تفوق السمية الأعلى المحتملة مقارنة بجرعة 50 مجم / كجم7. لم يتم العثور على فروق ذات دلالة إحصائية في عدد الخلايا الموسومة BrdU / مم3 ل 50 و 100 ملغم / كغم i.p. في الفئران7. يفضل حقن جرعة صغيرة لتقليل معاناة الحيوانات. - قم بوزن محلول BrdU وأضفه إلى المحلول الملحي في أنبوب مخروطي ودوامة.
ملاحظة: سخني المحلول الملحي مسبقا على حرارة 45-50 درجة مئوية في حمام مائي لأحجام أكبر من 1 مل. - ضع الأنبوب في حمام مائي على حرارة 50 درجة مئوية لمدة 10-15 دقيقة ودوامة كل 2-3 دقيقة حتى يذوب تماما. تصفية الحل مع مرشح حقنة للحقن المعقمة. قم بتغطية الأنبوب بورق القصدير ، وقم بتبريده في درجة حرارة الغرفة واستخدمه على الفور.
تنبيه: محلول BrdU سام ويحتمل أن يكون مسرطنا. إعداده في غطاء الدخان. يجب التعامل مع حل BrdU بمعدات الحماية المناسبة (PPE). يوصى بإعداد المحلول مباشرة قبل الاستخدام. ومع ذلك ، فإن الحل مستقر لمدة 24 ساعة تحت RT. يرجى حمايته من الضوء.
- لتحضير 1 لتر من محلول ملحي مخزن بالفوسفات 0.1 M (PBS) عند درجة حموضة 7.4 ، أضف 240 مجم من فوسفات البوتاسيوم أحادي القاعدة (KH 2 PO 4) ، 1.44 جم من فوسفات الصوديوم ثنائي القاعدة (Na 2 HPO4) ، 200 مجم من كلوريد البوتاسيوم (KCl) ، و 8 جم من كلوريد الصوديوم (NaCl) إلى 800 مل من الماء المقطر المزدوج (ddH2O) تحت التحريك المستمر. اضبط الرقم الهيدروجيني على 7.4 وأضف H2O المقطر المزدوج حتى الحجم الإجمالي 1 لتر. يخزن في درجة حرارة 4 درجات مئوية لمدة تصل إلى أسبوع واحد.
- للحصول على 100 مل من PBS + ، أضف 3٪ (3 مل) من مصل الحصان العادي و 0.3٪ (300 ميكرولتر) من Triton X-100 إلى 0.1 M PBS (درجة الحموضة 7.4). يخزن في 20-50 مل في درجة حرارة -20 درجة مئوية لمدة تصل إلى 3 أشهر.
ملاحظة: بدلا من ذلك ، يمكن استخدام TBS بدلا من PBS. أي مصل آخر مختلف عن الأجسام المضادة للمضيف والأنسجة التجريبية مناسب. - للحصول على 100 مل من PBS ++ ، أضف 10٪ (10 مل) من مصل الحصان العادي و 0.3٪ (300 ميكرولتر) من Triton X-100 إلى 0.1 M PBS pH 7.4. يخزن في 20-50 مل في درجة حرارة -20 درجة مئوية لمدة تصل إلى 3 أشهر.
- للحصول على 1 لتر من محلول الحماية من البرودة ، امزج 250 مل من جلايكول الإيثيلين و 250 مل من الجلسرين ، وحركه باستمرار حتى يختلط. جلب ببطء إلى 1 لتر مع برنامج تلفزيوني. مرشح بورق ترشيح من الدرجة 4 (20-25 ميكرومتر). يحفظ في درجة حرارة 4 درجة مئوية أو RT لمدة تصل إلى 1 سنة.
- تحضير 4 ٪ بارافورمالدهيد في 0.1 M PBS (محلول PFA) على النحو التالي. بالنسبة إلى 1 لتر من المحلول، أضف 40 جم من مسحوق بارافورمالدهيد ببطء إلى 800 مل من 60-65 درجة مئوية 0.1 مليون PBS مع التحريك المستمر. يقلب حتى يذوب بارافورمالدهيد تماما مع التحكم في درجة الحرارة (60-65 درجة مئوية). إذا لزم الأمر ، أضف بضع قطرات من 1 M NaOH لتوضيح الحل. عندما يصل المحلول إلى درجة حرارة الغرفة ، قم بالتصفية باستخدام ورق ترشيح من الدرجة 4 (20-25 ميكرومتر).
تنبيه: بارافورمالدهيد سام ويشتبه في كونه مادة مسرطنة ، استعد في غطاء الدخان. يحفظ في درجة حرارة 4 درجات مئوية ويفضل استخدامه في غضون 2 يوم. حل PFA الجاهز للاستخدام متاح تجاريا. - للحصول على 1 لتر من محلول سترات الصوديوم 10 mM (SCB) عند الرقم الهيدروجيني 6 ، أضف 1.204 جم من سترات الصوديوم (ثنائي الهيدرات) ، و 1.134 جم من حمض الستريك إلى 800 مل من H2O المقطر المزدوج مع التحريك المستمر. اضبط الرقم الهيدروجيني على 6.0 وأضف ddH2O حتى 1 لتر. يحفظ في درجة حرارة 4 درجات مئوية لمدة تصل إلى 6 أشهر.
- قم بإعداد 50 مل من 2 N HCl عن طريق إضافة 8.25 مل من 12 N HCl (محلول مخزون مركز) ببطء إلى 41.75 mL من ddH2O مع التقليب المستمر.
تنبيه: الاستعداد في غطاء الدخان. يجب تحضير المحلول مباشرة قبل الاستخدام.
ملاحظة: سيتم استخدام 2 N HCl لتمسخ الحمض النووي ، وهي خطوة حاسمة. نظرا لأن BrdU مدمج في الحمض النووي ، يتم استخدام HCl لفتح روابط الحمض النووي مما يسمح للأجسام المضادة BrdU بالوصول إلى BrdU داخل الحمض النووي. - تحضير محلول حجب البيروكسيديز الداخلي على النحو التالي. تحضير 100 مل من بيروكسيد الهيدروجين 0.6٪ عن طريق خلط 2 مل من 30٪ بيروكسيد الهيدروجين مع 98 مل من ddH2O تحت التحريك المستمر.
ملاحظة: يجب تحضير المحلول مباشرة قبل الاستخدام. احتفظ بها في الظلام لأن H 2 O2حساس للضوء. يمكن استخدام PBS أو TBS بدلا من الماء. - تحضير محلول مركب أفيدين بيوتين (ABC) وفقا لتعليمات الشركة المصنعة. للحصول على 5 مل من ABC في 0.1 M PBS ، أضف قطرتين (≈100 ميكرولتر) من الكاشف A واخلطه ، ثم أضف قطرتين (≈100 ميكرولتر) من الكاشف B واخلطه.
ملاحظة: يجب تحضير المحلول والسماح له باللف لمدة 20-30 دقيقة قبل الاستخدام. - قم بإعداد ركيزة DAB (ديامينوبنزيدين) بيروكسيديز (HRP) باستخدام المجموعة باتباع تعليمات الشركة المصنعة. إلى 5 مل من ddH 2 O ، أضف قطرتين (≈ 84 ميكرولتر) من الكاشف 1 واخلطه ، أضف 4 قطرات (≈ 100 ميكرولتر) من الكاشف2واخلطه ، ثم أضف قطرتين (≈ 80 ميكرولتر) من الكاشف 3 واخلطه. أخيرا ، إذا رغبت في ذلك ، أضف قطرتين (≈ 80 ميكرولتر) من الكاشف 4 (النيكل) واخلطه.
ملاحظة: يجب تحضير المحلول مباشرة قبل الاستخدام.
تنبيه: DAB سام ويحتمل أن يكون مسرطنا. يجب التعامل معها بعناية والتخلص منها وفقا للوائح النفايات الخطرة في كل مؤسسة. لتعطيل DAB ، أضف عدة قطرات من التبييض (هيبوكلوريت الصوديوم) ؛ سوف يتحول الحل إلى اللون الأسود. - تحضير 100 مل من محلول الكريسيل البنفسجي بإضافة 100 ملغ من أسيتات الكريسيل البنفسجي و 250 ميكرولتر من حمض الخليك إلى 80 مل من ddH2O عند 55-60 درجة مئوية. اضبط مستوى الصوت على 100 مل ، وقم بالتصفية ، وخزنه عند 4 درجات مئوية في وعاء داكن اللون.
ملاحظة: يتم تشجيع المستخدم على اختبار تركيزات مختلفة من محلول الكريسيل البنفسجي قبل استخدامه على عينات الأنسجة القيمة. قد تكون النتيجة أغمق بالنسبة للتلطيخ المضاد مع بعض عينات الأنسجة ، مما قد يقلل من القدرة على حساب الخلايا الإيجابية BrdU بدقة.
2. ثيميدين التناظرية إدارة BrdU
- كبح جماح التجارب (على سبيل المثال ، ذكر فأر Wistar البالغ من العمر 90 يوما ويزن 350 جم) ، عن طريق شل حركة تجويف البطن السفلي.
- تطبيق محلول BrdU (50 ملغ/كغ) داخل الصفاق (i.p.) باستخدام إبرة 23G وحقنة 1 مل.
ملاحظة: اضبط حجم الحقن حسب وزن الحيوان. استخدم إبرة 23-27 جم وحقنة 1-5 مل للفئران البالغة. الحد الأقصى المسموح به لحجم الحقن داخل الصفاق في الفئران البالغة هو 10 مل. يمكن استخدام طرق مختلفة لإدارة حل BrdU14. على سبيل المثال ، الحقن داخل الصفاق أو تناوله عن طريق الفم من خلال مياه الشرب.
3. إعداد الأنسجة
ملاحظة: سمح للفئران البالغة من العمر ثلاثة أشهر بالوصول إلى النشاط البدني (عجلة لا نهاية لها) لمدة سبعة أيام. في اليوم 6 ، تم حقن الفئران مع BrdU (الخطوة 2) 3 مرات على فترات 12 ساعة. نفذ الخطوات في القسم 3 بعد 8 ساعات من آخر حقنة BrdU.
- حقن بنتوباربيتال (50 ملغ/كغ من البيت) وانتظر بضع دقائق حتى يتم تخدير الحيوان بعمق.
ملاحظة: تأكد من تخدير الحيوان بالكامل قبل المتابعة. قرصة بعناية واحدة من الساقين أو الذيل. إذا كان الحيوان يتفاعل مع التحفيز ، انتظر بضع دقائق أخرى. إذا لم يتفاعل الحيوان مع القرص ، فانتقل إلى الخطوة التالية. - كشف القلب عن طريق قطع جلد تجويف البطن أسفل عظمة الصدر ، وتفكيك الأضلاع ، وقطع الحجاب الحاجز.
- تثبيت التروية عبر القلب
- أدخل إبرة في البطين الأيسر وقم بعمل شق صغير في الأذين الأيمن. باستخدام مضخة أو جاذبية ، قم بعمل فيوز (معدل التدفق 5-7 مل / دقيقة) 0.1 M PBS حتى يتم تصريف الدم بالكامل ، ويصبح المحلول واضحا.
- باستخدام مضخة أو جاذبية ، قم بإجراء التروية الباردة (معدل التدفق 5-7 مل / دقيقة) باستخدام محلول PFA لإصلاح الأنسجة حتى يصبح الذيل صلبا.
ملاحظة: عادة ، يتطلب الجرذ 300 غرام حوالي 100-150 مل من محلول PFA. تثبيت الأنسجة اختياري. وبالتالي ، يمكن استخراج الدماغ لاستخدامه في عمليات مختلفة لتقليل استخدام الحيوانات في التجارب.
- التشريح وما بعد التثبيت
- قطع رأس الحيوان ، واستخراج الدماغ بلطف من الجمجمة. اغمر الدماغ في أنبوب مخروطي يحتوي على محلول PFA (~ 40 مل لفأر 250 مجم) لمدة 1-2 يوما عند 4 درجات مئوية.
ملاحظة: لا تفرط في التثبيت (أكثر من 48 ساعة) ، لأن هذا يمكن أن يستنفد تلطيخ الأنسجة بسبب عدم توفر المستضدات. - تحضير 100 مل من محلول السكروز 30 ٪ ، إضافة 30 غرام من السكروز إلى 70 مل من محلول 0.1 M PBS تحت التحريك المستمر. أضف محلول 0.1 M PBS إلى 100 مل. اغمر الدماغ في أنبوب مخروطي بمحلول سكروز 30٪ (35 مل) لمدة 1-2012 يوما تقريبا عند 4 درجات مئوية حتى يغرق الدماغ في قاع الأنبوب.
- قطع رأس الحيوان ، واستخراج الدماغ بلطف من الجمجمة. اغمر الدماغ في أنبوب مخروطي يحتوي على محلول PFA (~ 40 مل لفأر 250 مجم) لمدة 1-2 يوما عند 4 درجات مئوية.
- قطع أقسام الدماغ الإكليلية
ملاحظة: يتطلب استخدام ميكروتوم cryostat-microtome التوجيه والتدريب. للحصول على تعليمات مفصلة ، انظر المرجع15.- اغمر الدماغ كله في إيزو بنتان عند -80 درجة مئوية واحتفظ به عند -80 درجة مئوية لمدة 10 دقائق. ضع الدماغ في مصفوفة تضمين على لوحة ميكروتوم كريوستات.
ملاحظة: في ظل ظروف معينة ، يمكن أن يتسبب التجميد السريع للدماغ عند -80 درجة مئوية في حدوث كسر أو تلف في الأنسجة. يجب أن يكون المستخدم على دراية بهذه المشكلة. إذا كانت هذه هي الحالة ، استخدم -20 °C iso-pentane لتجميد الدماغ. - باستخدام cryostat-microtome (درجة الحرارة عند -25 إلى -20 درجة مئوية) قطع المقاطع الإكليلية بسمك 40 ميكرومتر. انقل الأقسام بالتتابع إلى لوحة زراعة خلايا مكونة من 24 بئرا باستخدام محلول الحماية من التبريد باتباع الدليل الموضح في الشكل 2. يحفظ في درجة حرارة -20 درجة مئوية حتى الاستخدام، لمدة تصل إلى بضعة أشهر.
ملاحظة: بعد ذلك ، قم بمعالجة جميع الأنسجة في أقسام تسلسلية عائمة حرة تبلغ 40 ميكرومتر في ألواح ذات 12 بئرا مع إدخالات شبكية في تحريض لطيف ومستمر (10 دورة في الدقيقة). من الممكن تخزين أقسام الدماغ لسنوات في ظل الظروف المناسبة.
- اغمر الدماغ كله في إيزو بنتان عند -80 درجة مئوية واحتفظ به عند -80 درجة مئوية لمدة 10 دقائق. ضع الدماغ في مصفوفة تضمين على لوحة ميكروتوم كريوستات.
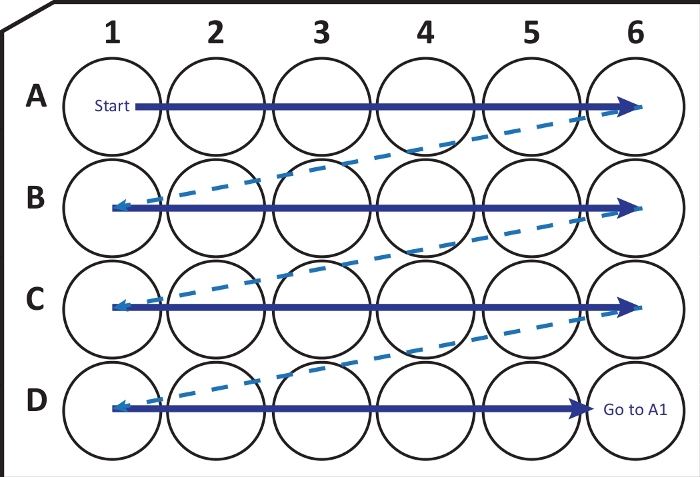
الشكل 2: رسم تخطيطي لنقل المقاطع بالتتابع من cryostat-microtome إلى لوحة زراعة خلية مكونة من 24 بئرا مع محلول الحماية من التبريد. ابدأ من بئر A1 وضع الشرائح التالية في الصف A ؛ بعد A6-well الانتقال إلى الصف التالي B ، وهكذا. عند الوصول إلى D6 ، عد إلى A1 واستمر. يسمح هذا الترتيب بالقياس الكمي لقسم Nth (على سبيل المثال ، السادس لتكوين الخلايا العصبية ، أي ما يعادل محتوى عمود واحد) لمنطقة الدماغ بأكملها. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
4. التلوين المناعي
ملاحظة: انظر الجدول 1 للحصول على ملخص لمزايا وعيوب كل تقنية.
- الكشف عن BrdU باستخدام تفاعل البيروكسيديز مع DAB
ملاحظة: قم بتنفيذ الخطوات من 4.1.1 إلى 4.1.5 في اليوم الأول.- انقل الشرائح من محلول الحماية من التبريد إلى 0.1 M PBS في درجة حرارة الغرفة. شطف ثلاث مرات لمدة 10 دقائق لكل منهما ، مع 0.1 M PBS.
- احتضن شرائح لمدة 30 دقيقة في محلول حجب البيروكسيديز الداخلي لتعطيل البيروكسيديز الداخلي. شطف 3 مرات ، 10 دقائق لكل منهما ، مع 0.1 M PBS. اختياريا ، قم بإجراء استرجاع المستضد (انظر القسم 5). احتضن شرائح لمدة 20 دقيقة مع 2 N حمض الهيدروكلوريك عند 37 درجة مئوية. شطف في 0.1 M بورات عازلة (8.5 درجة الحموضة) لمدة 10 دقائق. شطف 3 مرات لمدة 10 دقائق لكل منهما ، مع الثلج البارد 0.1 M PBS.
- احتضان شرائح لمدة 2 ساعة في درجة حرارة الغرفة مع PBS ++ (حل حجب). احتضان مع الجسم المضاد الأولي المضاد BrdU (مضيف الماوس) بتركيز 1: 250 في PBS + بين عشية وضحاها عند 4 درجات مئوية.
- في اليوم الثاني ، اشطف الشرائح 3 مرات لمدة 10 دقائق لكل منها ب 0.1 M PBS.
- احتضان مع 1: 250 جسم مضاد ثانوي مقترن HRP (مضاد للفأر) في PBS + لمدة 2-4 ساعة في درجة حرارة الغرفة. شطف 3 مرات لمدة 10 دقائق لكل منها مع 0.1 M PBS.
- انقل الشرائح إلى محلول الركيزة DAB Peroxidase (HRP) واحتضانها لمدة 2-10 دقيقة. عندما تصبح الشرائح رمادية داكنة ، تصور الأنسجة باستخدام عدسة مكبرة أو مجهر. في حالة وجود خلايا إيجابية ، اشطفها 3 مرات (لمدة 15 دقيقة لكل منها) بماء الصنبور (لتقليل الخلفية). اغسل 3 مرات لمدة 10 دقائق لكل منها 0.1 M PBS.
- قم بتركيب الشرائح بعناية على شرائح جيلاتينية باستخدام فرشاة ناعمة ، وجففها في الهواء طوال الليل في درجة حرارة الغرفة. Counterstain (انظر القسم 7.1) ، أضف وسيط تثبيت دائم وضع أغطية السقوط. يحفظ في درجة حرارة 4 درجات مئوية لمدة تصل إلى 6 أشهر.
- الكشف عن BrdU باستخدام تفاعل البيروكسيديز مع مركب أفيدين بيوتين بيروكسيديز
ملاحظة: قم بتنفيذ الخطوات من 4.2.1 إلى 4.2.5 في اليوم الأول.- انقل الشرائح من محلول الحماية من التبريد إلى 0.1 M PBS لإحضارها إلى درجة حرارة الغرفة. شطف 3 مرات لمدة 10 دقائق لكل منها مع 0.1 M PBS.
- احتضان لمدة 30 دقيقة مع محلول حجب البيروكسيديز الذاتية لتعطيل البيروكسيديز الداخلي. شطف 3 مرات لمدة 10 دقائق لكل منها في 0.1 M PBS. اختياريا ، قم بإجراء استرجاع المستضد (انظر القسم 5).
- احتضان لمدة 20 دقيقة مع 2 N حمض الهيدروكلوريك عند 37 درجة مئوية. شطف في 0.1 M بورات عازلة (درجة الحموضة 8.5) لمدة 10 دقائق. اغسل 3 مرات لمدة 10 دقائق لكل منها بالثلج البارد 0.1 M PBS.
- احتضان لمدة 2 ساعة في درجة حرارة الغرفة في PBS ++ (حل حجب).
- احتضان مع الجسم المضاد الأساسي المضاد BrdU (مضيف الماوس) 1: 250 في PBS + بين عشية وضحاها عند 4 درجات مئوية.
- في اليوم الثاني ، شطف 3 مرات لمدة 10 دقائق لكل منها مع 0.1 M PBS.
- احتضان مع 1: 250 الجسم المضاد الثانوي بيوتينيل (مضاد للفأر) في PBS + لمدة 2-4 ساعة في درجة حرارة الغرفة. شطف 3 مرات لمدة 10 دقائق لكل منها مع 0.1 M PBS.
- احتضان في حل ABC لمدة 1 ساعة في درجة حرارة الغرفة. شطف 3 مرات لمدة 10 دقائق لكل منها مع 0.1 M PBS.
- انقل الشرائح إلى محلول ركيزة البيروكسيديز DAB (HRP) واحتضانها لمدة 2-10 دقيقة. عندما تصبح الشرائح رمادية داكنة ، تصور الأنسجة باستخدام عدسة مكبرة أو مجهر. في حالة وجود خلايا إيجابية ، اشطفها 3 مرات (15 دقيقة لكل منها) بماء الصنبور (لتقليل الخلفية) متبوعة 3 مرات بغسل 0.1 M PBS لمدة 10 دقائق لكل منهما.
ملاحظة: يجب تحضير المحلول مباشرة قبل الاستخدام. يجب توخي الحذر لتجنب التصاق شرائح الدماغ ببعضها البعض بسبب البقع الداكنة غير المنتظمة في الأنسجة. - قم بتركيب الشرائح بعناية على شرائح جيلاتينية باستخدام فرشاة ناعمة ثم جففها في الهواء طوال الليل في درجة حرارة الغرفة.
- قم بتغطية الصبغة إذا لزم الأمر (انظر الخطوة 7.1) ، أضف وسيط تثبيت دائم وضع أغطية الأغطاء. يحفظ في درجة حرارة 4 درجات مئوية لمدة تصل إلى 6 أشهر.
- الكشف عن BrdU عن طريق التألق المناعي باستخدام تضخيم Streptavidin-Biotin (LSAB) المسمى
ملاحظة: قم بتنفيذ الخطوات من 4.3.1 إلى 4.3.4 في اليوم الأول.- انقل الشرائح من محلول الحماية من التبريد إلى 0.1 M PBS في درجة حرارة الغرفة. شطف 3 مرات لمدة 10 دقائق لكل منها مع 0.1 M PBS. اختياريا ، قم بإجراء استرجاع المستضد (انظر القسم 5).
- احتضان لمدة 20 دقيقة في 2 N حمض الهيدروكلوريك عند 37 درجة مئوية. شطف في 0.1 M بورات عازلة (8.5 درجة الحموضة) لمدة 10 دقائق. شطف 3 مرات لمدة 10 دقائق لكل منها في الجليد البارد 0.1 M PBS.
- احتضان لمدة 2 ساعة في درجة حرارة الغرفة في PBS ++ (حل حجب). احتضان مع 1: 250 الجسم المضاد الأساسي المضاد BrdU (مضيف الماوس) في PBS + بين عشية وضحاها عند 4 درجات مئوية.
- في اليوم الثاني ، شطف 3 مرات لمدة 10 دقائق لكل منها مع 0.1 M PBS.
- احتضان مع 1: 250 الجسم المضاد الثانوي بيوتينيل (مضاد للفأر) في PBS + لمدة 2-4 ساعة في درجة حرارة الغرفة. شطف 3 مرات لمدة 10 دقائق لكل منها مع 0.1 M PBS. احتضان مع 1: 250 ستربتافيدين مترافق بالفلوروكروم (Cy3) في برنامج تلفزيوني (لا تستخدم المصل) لمدة 1-2 ساعة في درجة حرارة الغرفة. شطف 3 مرات لمدة 10 دقائق لكل منها مع 0.1 M PBS.
ملاحظة: يمكن أن يحتوي المصل على البيوتين ويجب عدم إضافته إلى المواد المخففة. بدلا من ذلك ، استخدم PBS الذي يحتوي على 0.3٪ من Triton X-100. - قم بتركيب الشرائح بعناية على شرائح جيلاتينية باستخدام فرشاة ناعمة ، أو جففها في الهواء طوال الليل في درجة حرارة الغرفة ، أو قم بتركيبها على الفور باستخدام وسيط تركيب مناسب. Counterstain (انظر الخطوة 7.2) ، أضف وسيط تثبيت دائم وضع أغطية الغطاء. يحفظ في درجة حرارة 4 درجات مئوية لمدة تصل إلى 6 أشهر.
- الكشف عن BrdU عن طريق التألق المناعي غير المباشر
ملاحظة: قم بتنفيذ الخطوات 4.4.1 إلى 4.4.4 في اليوم الأول.- انقل الشرائح من محلول الحماية من التبريد إلى 0.1 M PBS حتى تصل إلى درجة حرارة الغرفة. شطف 3 مرات لمدة 10 دقائق لكل منها مع 0.1 M PBS. قم بإجراء استرجاع المستضد إذا لزم الأمر (اختياري ، انظر القسم 5).
- احتضان لمدة 20 دقيقة في 2 N حمض الهيدروكلوريك عند 37 درجة مئوية. شطف في 0.1 M بورات عازلة (8.5 درجة الحموضة) لمدة 10 دقائق. شطف 3 مرات لمدة 10 دقائق لكل منها مع الجليد البارد 0.1 M PBS. احتضان لمدة 2 ساعة في درجة حرارة الغرفة مع PBS ++ (حل حجب). احتضان مع 1: 250 الجسم المضاد الأساسي المضاد BrdU (مضيف الماوس) في PBS + بين عشية وضحاها عند 4 درجات مئوية.
- في اليوم الثاني ، شطف 3 مرات لمدة 10 دقائق لكل منها مع 0.1 M PBS.
- احتضان مع 1: 250 الجسم المضاد الثانوي المترافق بالفلوروكروم (مضاد للفأر) في PBS + لمدة 2-4 ساعة في درجة حرارة الغرفة. شطف 3 مرات لمدة 10 دقائق لكل منها مع 0.1 M PBS.
- قم بتركيب الشرائح بعناية على شرائح جيلاتينية باستخدام فرشاة ناعمة ، أو جففها في الهواء طوال الليل في درجة حرارة الغرفة ، أو قم بتركيبها على الفور باستخدام وسيط تركيب مناسب. Counterstain (انظر الخطوة 7.2) ، أضف وسيط تثبيت دائم وضع أغطية الغطاء. يحفظ في درجة حرارة 4 درجات مئوية لمدة تصل إلى 6 أشهر.
5. استرجاع المستضد (اختياري)
ملاحظة: استرجاع المستضد هو خطوة اختيارية تهدف إلى تصحيح فقدان المستضدية الناجم عن التثبيت الذي يعدل البنية الثلاثية والرباعية للعديد من المستضدات ، مما يجعلها غير قابلة للكشف بواسطة الأجسام المضادة. يمكن إضافة هذه الخطوة إلى البروتوكول الأصلي.
- في الميكروويف أو حمام مائي ، قم بالتسخين المسبق لمحلول الأس الهيدروجيني 6 10 مللي مول من محلول سترات الصوديوم (SCB) إلى 90-95 درجة مئوية (اعتمادا على الارتفاع ، يبدأ المحلول في الغليان حول درجة الحرارة هذه). املأ 80٪ من أنبوب مخروطي سعة 50 مل (40 مل) ب SCB المسخن مسبقا. نقل شرائح إلى إدراج شبكة في أنبوب مخروطي مع SCB. قم بتغطية الأنبوب بغطاء لولبي به ثقوب مصنوعة بإبرة 18-20 جم.
- احتفظ بالشرائح لمدة 30 دقيقة في SCB عند 80-85 درجة مئوية بالتناوب مع دورات التسخين في الميكروويف عند أدنى مستوى طاقة. إذا لزم الأمر ، أعد ملء الأنبوب المخروطي ب SCB. انقل الشرائح مباشرة بعد ذلك مع إدخالات الشبكة إلى 0.1 M PBS المثلج واشطفها 3 مرات لمدة 10 دقائق لكل منها.
6. مناعة متعددة (اختياري)
ملاحظة: راجع قسم المقدمة للحصول على الأساس المنطقي وراء هذه الخطوة.
- تلطيخ مناعي متعدد متزامن
- قم بإعداد كوكتيل مع الأجسام المضادة الأولية للهدف (على سبيل المثال ، الماوس anti-BrdU ، والأرانب المضادة -GFAP) في PBS +. استخدم مضيفات مختلفة لكل جسم مضاد أساسي مستخدم. احتضان بين عشية وضحاها عند 4 درجات مئوية. تابع نفس الخطوات التالية لكل بروتوكول.
- قم بإعداد كوكتيل مع الأجسام المضادة الثانوية المقابلة لكل جسم مضاد أساسي مستخدم (على سبيل المثال ، FITC المضاد للفأر الماعز ، TRITC المضاد للأرانب) في نفس المحلول المخفف لكل بروتوكول. تابع نفس الخطوات التالية لكل بروتوكول. من الناحية المثالية ، استخدم الأجسام المضادة الثانوية التي تأتي من نفس المضيفين لتجنب التفاعل المتبادل.
- تلطيخ مناعي متعدد متسلسل.
- اتبع البروتوكول الخاص بالهدف الأول للجسم المضاد (على سبيل المثال ، الماوس المضاد ل BrdU) وتوقف قبل تركيب الشرائح. احتضان لمدة 2 ساعة في درجة حرارة الغرفة مع PBS ++ (حل حجب).
- احتضان الجسم المضاد الأساسي الثاني (على سبيل المثال ، مضاد الأرانب -GFAP) في PBS + طوال الليل عند 4 درجات مئوية. اتبع الخطوات التالية لكل بروتوكول ، بما في ذلك حضانة الجسم المضاد الثانوي الثاني (على سبيل المثال ، TRITC المضاد للأرانب الماعز). تابع الخطوات التالية لكل بروتوكول حتى النهاية.
7. تلطيخ (اختياري)
- بالنسبة للبروتوكولات التي تستخدم تفاعل البيروكسيديز ، قم بتسخين محلول الكريسيل البنفسجي مسبقا إلى 60 درجة مئوية. رطب الشرائح باستخدام ddH2O لمدة 1 دقيقة. احتضان الشرائح في محلول الكريسيل البنفسجي الساخن لمدة 5-20 دقيقة.
- شطف الشرائح مع ddH2O لمدة 1 دقيقة. اشطف الشرائح بنسبة 70٪ و 80٪ و 90٪ و 100٪ من الكحول الإيثيلي لمدة 1-3 دقيقة لكل منها. اشطف الشرائح بالزيلين لمدة 1-3 دقيقة.
- أضف وسيط تركيب دائم كاره للماء وضع أغطية الأغطية .
ملاحظة: يحفظ في درجة حرارة 4 درجات مئوية لمدة تصل إلى 6 أشهر. يمكن استخدام وسيط تركيب عصامي يحتوي على PVA (كحول بولي فينيل) - DABCO.
- بالنسبة للبروتوكولات التي تستخدم التألق المناعي ، أضف حجما صغيرا (25-50 ميكرولتر) من وسط التركيب المحب للماء مع DAPI أو يوديد البروبيديوم أو ما شابه ذلك. ختم حول محيط مع طلاء الأظافر أو تسرب البلاستيك. يحفظ في درجة حرارة 4 درجات مئوية لمدة تصل إلى 6 أشهر.
8. التصوير والتحليل
ملاحظة: انظر الجدول 2 لمعرفة مواصفات إعداد المجهر. عادة ، يتم عد الخلايا الجديدة الملطخة باستخدام شرائح تفاعل البيروكسيديز الملطخة (طريقة أرخص) ، ولكن يمكن أيضا إجراؤها باستخدام التألق المناعي.
- لتحديد الخلايا ، أولا ، حدد التلفيف المسنن بشكل صحيح باستخدام عدسة التكبير 4x (لمزيد من التعليمات حول التفاصيل التشريحية DG ، انظر Amaral et al.16).
- ابحث في طبقة الخلايا الحبيبية للتلفيف المسنن عن النوى الموسومة ب BrdU (باستخدام عدسة التكبير 40x). قم بإجراء بحث شامل عن الخلايا على طول المحور z حيث يمكن توزيع الخلايا الجديدة في طبقات مختلفة (انظر الفيديو 1).
- حدد قسما فاصلا للبحث عن الخلايا في جميع أنحاء التلفيف المسنن (على سبيل المثال ، كل قسم 6 من الأنسجة ، أي ما يعادل كل 240 ميكرومتر).
- عد جميع الخلايا الإيجابية BrdU. يمكن أن يتغير مورفولوجيا النواة المصنفة اعتمادا على مقدار BrdU الذي أدمجته الخلية (انظر الشكل 3 كدليل). تحرك ببطء فوق المحور z لتحديد جميع النوى العديدة التي تدمج الكتلة (انظر الفيديو 2).
- اضرب العدد الإجمالي للخلايا التي تم حسابها مع تحديد قسم الفاصل الزمني (على سبيل المثال ، 6) لتقدير العدد الإجمالي للخلايا الجديدة المصنفة ب BrdU.
- من الناحية المثالية ، في تجربة منتظمة ، عد ما لا يقل عن عشرة أقسام لكل وخمسة على الأقل لكل مجموعة.
- فك التفاف الصورة (اختياري)
ملاحظة: راجع قسم المقدمة للحصول على معلومات هامة حول هذه الخطوة. يحتاج هذا الإجراء إلى صور أحادية اللون (تدرج الرمادي). تحويل الصور الملونة إلى درجات رمادية. إذا كانت الصور مركبة RGB، فقم أولا بتقسيم القنوات ودمجها كصورة واحدة (غير مركبة)، ثم قم بتحويلها إلى تدرج رمادي 8 بت.- قم بإنشاء ملف z-stack من الصور المجهرية.
- قم بإنشاء ملف دالة انتشار النقاط (PSF) لفتح المكون الإضافي Diffraction PSF 3D (https://imagej.net/Diffraction_PSF_3D) من قائمة الإضافات الاختيارية. املأ جميع البيانات المطلوبة (انظر الجدول 2). اضغط على موافق واحفظ الملف.
- افتح المكون الإضافي DeconvolutionLab29 من قائمة الإضافات (http://bigwww.epfl.ch/deconvolution/deconvolutionlab2/). اسحب صورة z-stack المتطابقة وملف PDF إلى فتحة النافذة المقابلة.
- حدد خوارزمية فك الالتفاف (على سبيل المثال ، ريتشاردسون-لوسي) وعدد التكرارات (على سبيل المثال ، 20). اضغط على RUN.
- ادمج الصور غير المعقدة في صورة z-stack واحدة مع تحديد Stacks من قائمة الصور في الأعلى. ثم انقر فوق مشروع Z. حدد الحد الأقصى للكثافة من القائمة المنسدلة نوع العرض ، اضغط على OK واحفظ الملف.
- قم بإنشاء صورة RGB باستخدام ملف صورة z-stack الفردي الذي تم إنشاؤه في الخطوة أعلاه مع تحديد اللون الزائف المطلوب اللون من قائمة الصورة في الأعلى. ثم انقر فوق دمج القنوات. اضبط الصورة المقابلة على قناة اللون المطلوبة من القائمة المنسدلة. قم بإلغاء تحديد المربع إنشاء مركب ، اضغط على موافق واحفظ الملف (انظر الشكل 4).
- إذا كان هناك أكثر من صورة قناة واحدة، كرر الخطوات 8.2.1-2.5. قم بإنشاء ملف صورة RGB باتباع الخطوة 8.2.6 ، وفتح ملفين على الأقل للصور وتحديد قنوات ألوان مختلفة لكل ملف صورة (انظر الشكل 4).
النتائج
تم تطبيق الطرق الموضحة أعلاه لتحديد خلايا حديثي الولادة في قرن آمون الفئران البالغة بعد النشاط البدني الطوعي ، على عكس المجموعة الضابطة دون أي نشاط بدني إضافي. استخدمنا الحصين الفئران بعد الولادة كعنصر تحكم إيجابي. كانت الفئران الذكور التي تبلغ من العمر 3 أشهر تحت بروتوكول النشاط البدني الطوعي (عجلة لا نهاية لها) لمدة سبعة أيام. في اليوم 6 ، تم حقن الفئران ب BrdU (القسم 2) ، وكل 12 ساعة بعد ثلاث حقن كاملة. لإكمال ثلاثة أقسام دورة الخلية ، تم تخلل الحيوانات عبر القلب (القسم 3) 8 ساعات بعد آخر حقن BrdU. تم استخدام نفس الإجراء على الفئران البالغة من العمر ثلاثة أشهر والتي لم تخضع لنشاط بدني لاستخدامها كعنصر تحكم مقارن. كعنصر تحكم إيجابي ، تم حقن جراء الفئران البالغة من العمر يوما واحدا (يوم ما بعد الولادة 1) ب BrdU مرة واحدة ، كما هو موضح في القسم 2 أعلاه. بعد يوم واحد من الحقن (يوم ما بعد الولادة 2) ، تم القتل الرحيم للجراء ، وتم غمر رؤوسهم في محلول PFA ، كما هو موضح في الخطوة 3.4. تم تخدير الفئران البالغة بعمق (الخطوة 3.1) ، وتخدير عبر القلب ، كما هو موضح في الخطوة 3.2. تم تشريح الأدمغة وتثبيتها بعد ذلك (الخطوة 3.4). تم تقطيع الأدمغة إلى أقسام إكليلية 40 ميكرومتر (الخطوة 3.5). تمت معالجة الأقسام للكيمياء الهيستولوجية المناعية BrdU ، كما هو موضح في الخطوة 4.
استخدمنا تفاعل بيروكسيديز الفجل مع DAB IHC للتلطيخ (الخطوة 4.1) وعد الخلايا الإيجابية BrdU في DG. يوضح الشكل 5 مقطع DG به خلايا تحمل علامة BrdU. يوضح الشكل 5C ، D جزءا تمثيليا من قسم DG بتكبير أعلى. أظهرت الخلايا المصنفة تلطيخا داكنا شديدا ، تم تمييزه بالسهام. يظهر الجزء الداخلي متوسط عدد الخلايا المصنفة في المجموعتين التجريبية والضابطة (الخلايا الموجبة المحسوبة مضروبة في ستة كما هو موضح في الخطوة 8.1). كشف اختبار t للطالب عن اختلافات في الدلالة بين أعداد الخلايا الإيجابية BrdU (t (10) = 2.704 ، p = 0.0222). أظهرت المجموعة الضابطة التي لم تخضع للنشاط البدني 2040 ± 314 خلية (ن = 6 فئران). وبالمقارنة ، أظهرت مجموعة النشاط البدني ، في المتوسط ، 3,606 ± 486 (ن = 6 فئران) خلايا إيجابية BrdU. كما لوحظ ، يزيد التعرض للنشاط البدني من الخلايا الإيجابية ل BrdU. لذلك ، تتوافق هذه النتائج مع النتائج الأخرى المبلغ عنها والتي تظهر أن النشاط البدني زاد من الانتشار الخلوي في التلفيف المسننالبالغ 17.
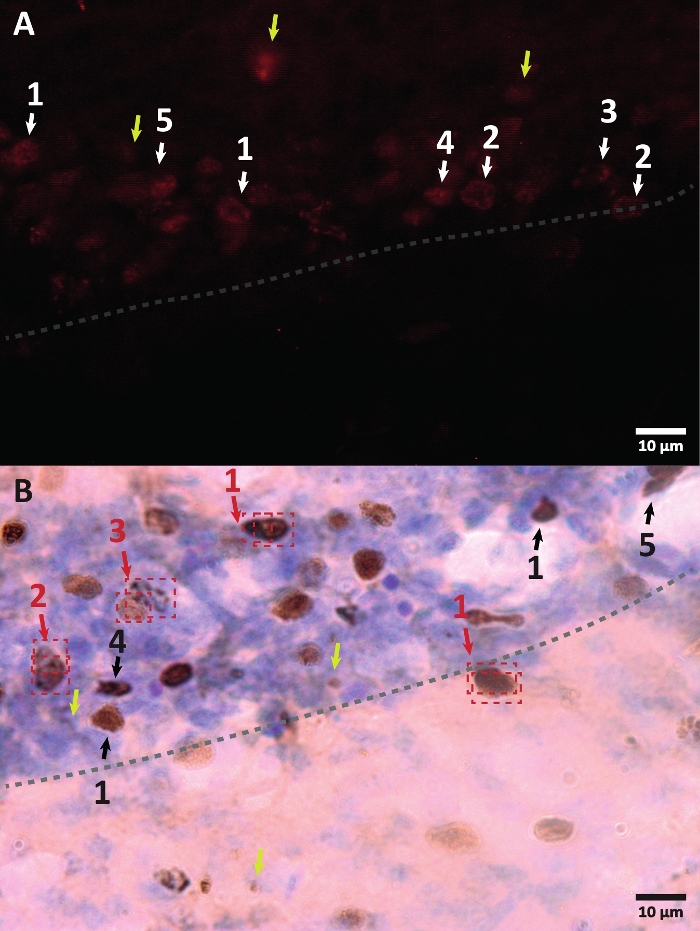
الشكل 3: أمثلة على الأشكال المختلفة لنواة الخلية الموسومة ب BrdU. BrdU هي علامة تخليق الحمض النووي التي تسمي النواة. في منطقة الحصين ، كان للنوى الإيجابية BrdU شكل شبه بيضاوي يقع في المنطقة الحبيبية الفرعية للتلفيف المسنن. نظرا لأن BrdU يتم دمجه من خلال المنافسة ، فإن الكمية المدمجة لكل خلية سيكون لها اختلاف سينعكس لاحقا في كيفية تصور النواة. أ: صورة التألق المناعي. (ب) صورة تستخدم تفاعل البيروكسيديز بدون طريقة تضخيم إضافية. تظهر الأسهم الصفراء القطع الأثرية والإشارات غير المحددة. تظهر الأسهم السوداء أو البيضاء خلايا BrdU +. 1- نواة ملفوفة بالكامل، شبه بيضاوية نوى ملونة للغاية. 2 – النوى ذات النقاط ، يتم تمييز حدود النوى ولها عدة نقاط بداخلها. 3 - النوى ذات النقاط القليلة ، يتم تمييز حدود النوى ولها عدد قليل من النقاط بداخلها. 4 - النواة الصغيرة هي خلايا محتملة في مرحلة تمايز مختلفة ولكنها لا تزال جزءا من مكانتها. 5 - المجموعات هي خلايا سلائف تحت الانقسام ، لذلك يمكن ملاحظة عدة خلايا معا في مجموعات مكثفة. ضمن هذه المجموعات ، يجب إجراء العد بعناية خاصة لتجنب تسمية الخلايا الإيجابية بشكل خاطئ. تظهر الأسهم الحمراء النواة تحت الانقسام التي يمكن الخلط بينها لتكون خلية واحدة. يتم وضع كل خلية في صندوق ويمكن تمييزها في مستوى المحور Z في الوقت الفعلي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
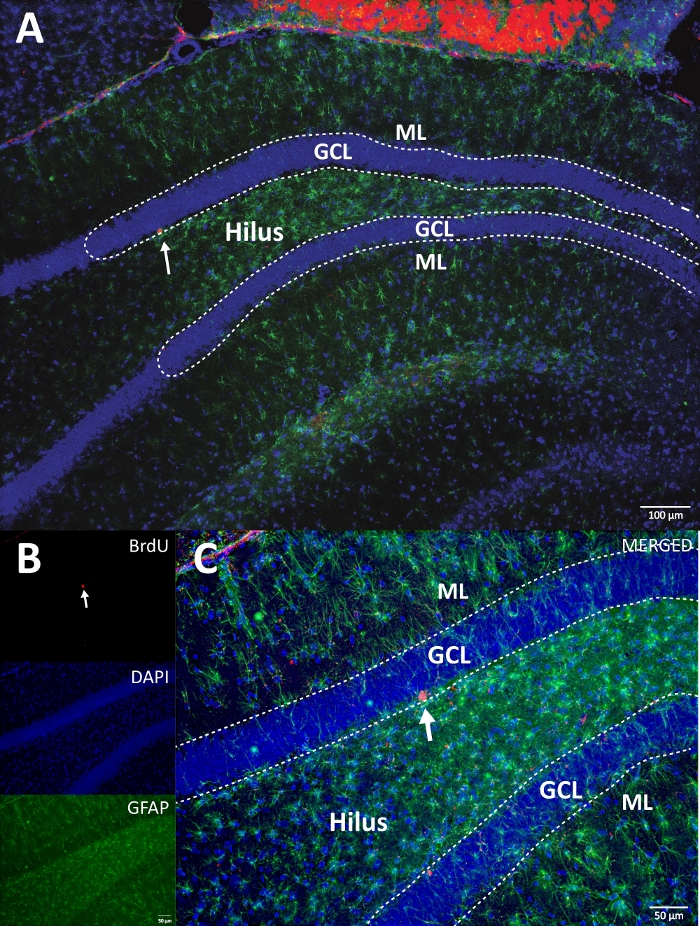
الشكل 4: صورة RGB تمثيلية للقنوات الفردية والمدمجة. تعرض الصورة العلوية صورة z-stack الأصلية ، وتظهر الصورة السفلية صورة z-stack غير الملتوية 3D. (أ) تكبير منخفض للمدير العام. (B) صورة RGB لكل قناة، و (C) صورة RGB مدمجة. كان هذا دماغا من المجموعة الضابطة. تم استخدام التألق المناعي بدون طريقة تضخيم إضافية. BrdU (أحمر) ، DAPI كمضاد (أزرق) ، و GFAP (بروتين حمضي ليفي دبقي) كعلامة نجمية (أخضر). ML = الطبقة الجزيئية ؛ GCL = طبقة الخلية الحبيبية ؛ SGZ = المنطقة تحت الحبيبية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
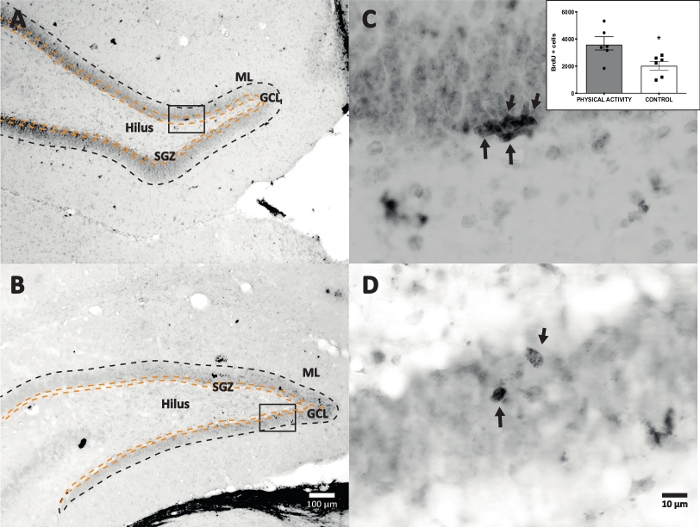
الشكل 5: قسم DG التمثيلي مع خلايا تحمل علامة BrdU (مظلمة شديدة) لكل مجموعة تجريبية. تم استخدام تفاعل البيروكسيديز مع طريقة تضخيم مركب avidin-biotin-peroxidase. (أ، ب) إظهار تكبير منخفض ل DG ، و (C ، D) إظهار منطقة المربع بتكبير أعلى. اللوحتان A و C هما أنسجة من مجموعة النشاط البدني ، واللوحات B و D من المجموعة الضابطة. يوضح الجزء الداخلي متوسط عدد الخلايا المصنفة في مجموعات النشاط البدني والمجموعة الضابطة (الخلايا الموجبة المحسوبة مضروبة في ستة كما هو موضح في الخطوة 8.1). ML = الطبقة الجزيئية ؛ GCL = طبقة الخلية الحبيبية ؛ SGZ = المنطقة تحت الحبيبية ؛ تشير الأسهم إلى خلايا BrdU +. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
فيديو 1: فيديو يظهر تركيزا مختلفا للخلايا الموجبة على طول المحور z موزعة في طبقات مختلفة. الرجاء الضغط هنا لتحميل هذا الفيديو.
فيديو 2: فيديو يظهر تركيزا مختلفا لمجموعات الخلايا الموجبة على طول المحور z موزعة في طبقات مختلفة. تحرك ببطء فوق المحور z لتحديد جميع النوى العديدة التي تدمج العنقود. الرجاء الضغط هنا لتحميل هذا الفيديو.
| نوع المجهر: | مجهر التألق أوليمبوس BX53 | ||||
| مصدر الضوء: | مصباح قوس زئبقي عالي الضغط بقوة 130 واط (U-HGLGPS) | ||||
| برامج الاستحواذ: | سيل سينس ستاندرد | ||||
| مجموعات المرشحات: | رقم الكتالوج | نطاق الإثارة | مرآة ثنائية اللون | نطاق قمع | |
| يو فوو | 340 - 490 نيوتن متر | 410 نيوتن متر | 420 نيوتن متر | ||
| يو إف بي دبليو | 460 - 495 نيوتن متر | 505 نيوتن متر | 510 نيوتن متر | ||
| يو إف جي دبليو | 530 - 550 نيوتن متر | 570 نيوتن متر | 575 نيوتن متر | ||
| كاميرا: | نموذج: | CCD - كاميرا UC50 | |||
| النطاق الطيفي: | 290 – 1000 نيوتن متر | ||||
| حجم رقاقة اتفاقية مكافحة التصحر: | 2/3 بوصة ، 2588 (العرض * 7) × 1960 (الارتفاع * 8) بكسل | ||||
| حجم بكسل: | 3.4 × 3.4 ميكرومتر | ||||
| الفلوروكروم: | اسم | الطول الموجي للإثارة (نانومتر) | الانبعاث * 3 الطول الموجي (نانومتر) | لون الانبعاث | |
| 4 ، 6-دياميدينو -2-فينيل إندول HCI (DAPI) | 345 | 455 | أزرق | ||
| رباعي ميثيل رودامين-إيزوثيوسيانات (TRITC) | 541 | 572 | أحمر | ||
| فلوريسئين-أيزوثيوسيانات (FITC) | 494 | 519 | أخضر | ||
| سي 3 | 552 | 565 | أحمر | ||
| تصاعد المتوسطة وزيت الغمر: | اسم | فهرس انكسار الوسائط *1 | |||
| الهواء (لا شيء بين الشريحة والعدسة) | 1.00029 | ||||
| وسيط تركيب مضاد للتلاشي مع DAPI | 1.45 | ||||
| بيرماونت تصاعد المتوسطة | 1.519 | ||||
| زيت غمر منخفض التألق الذاتي (MOIL-30 Type F) | 1.518 | ||||
| عدسة التكبير (خطة الفلوريت) | التكبير | الفتحة العددية (NA) *2 | القرار (ميكرومتر) | تباعد بكسل الصورة (نانومتر) *5 | تباعد الشرائح المحور Z (نانومتر) *6 |
| 4 أضعاف | 0.13 | 2.12 | 850 | 3000 | |
| 10 أضعاف | 0.3 | 0.92 | 340 | 3000 | |
| 20 ضعفا | 0.5 | 0.55 | 170 | 2000 | |
| 40 ضعفا | 0.75 | 0.37 | 85 | 1000 | |
| 100 مرة | 1.3 | 0.21 | 34 | 1000 | |
الجدول 2: مواصفات إعداد المجهر ومتطلبات إنشاء ملف وظيفة انتشار النقطة (PSF). هناك 11 فتحة في نافذة البرنامج المساعد PSF 3D الحيود لإنشاء ملف PSF. يتم وصف كل فتحة على النحو التالي: *1 - مؤشر انكسار الوسائط: مؤشر الانكسار للوسط بين الشريحة والعدسة (على سبيل المثال، الهواء = 1.00029). *2 - فتحة العدسة العددية: NA للعدسة المستخدمة (يجب تصحيحها عند استخدام وسائط غمر مختلفة وتعيين العدسة لها). *3 - الطول الموجي: أقصى طول موجي لانبعاث فلوروكروم (نانومتر). *4 - الانحراف الكروي الطولي: 0.00. *5 - تباعد بيكسل الصورة: حجم بيكسل CCD (نانومتر)/تكبير (على سبيل المثال، عدسة 3.4 ميكرومتر و100X، 3400/100 = 34 نانومتر). *6 - المسافة بين الصور على المحور Z. *7 - العرض: أدخل عرض الصورة المراد فك تلفها بالبكسل. *8 - الارتفاع: أدخل ارتفاع الصورة المراد فك تلفها بالبكسل. *9 - العمق، الشرائح: عدد الصور في z-stack. *10 - التطبيع: مجموع قيم البكسل = 1. *11 - العنوان: الاسم المطلوب لملف PSF. يجب أن يتطابق الملف مع صورة z-stack الفريدة المحددة.
Discussion
تكوين الخلايا العصبية للبالغين هو عملية تحدث بشكل متكرر في منافذ خلايا السلائف العصبية البالغة التي لديها القدرة على توليد خلايا عصبية جديدة طوال حياتها. يستخدم وضع العلامات على برومودوكيوريدين (BrdU) على نطاق واسع في علم المناعة لتوصيف عدد الخلايا المولدة حديثا في دماغ البالغين. سيتم دمج BrdU بشكل أساسي في خلايا مناطق الدماغ المنفصلة (المناطق العصبية). تقع هذه الخلايا في المنطقة تحت البطينية (SVZ) ، التلفيف المسنن للحصين - بين الخلايا الحبيبية والخلايا الحبيبية المعروفة باسم المنطقة شبه الحبيبية (SGZ) 1،2،18. علاوة على ذلك ، هناك مناطق دماغية مختلفة تتميز بقدرة تكاثرية أقل في مرحلة البلوغ ، بما في ذلك منطقة ما تحت المهاد ، والمخطط ، والقشرة المخية الحديثة ، واللوزة19. كما ذكرنا من قبل ، فإن تلطيخ BrdU هو الطريقة الشائعة الاستخدام لأبحاث تكوين الخلايا العصبية للبالغين للكشف عن تكاثر الخلايا. ومع ذلك ، فإن استخدام BrdU كعلامة له قيود ومطبات. الأول هو أن BrdU هي علامة دورة الخلية. لذلك ، يجب إجراء تلطيخ مزدوج أو ثلاثي لتحديد مصير الخلية وتضمين علامات الخلية للكشف عن مرحلة النمو المحددة للخلايا الموسومة. مصدر قلق آخر حول BrdU هو أنه محلول سام ومطفرة يعدل استقرار الحمض النووي قد يغير الوظيفة الخلوية ودورات الخلية. وينبغي إيلاء الاعتبار للمعلومات السابقة عند اتخاذ قرار باتباع بروتوكول الإعطاء وجرعات الإعطاء (50-600 مغ/كغ). ميزة أخرى حاسمة هي أن BrdU هو علامة تخليق الحمض النووي ، وليس علامة تكاثر الخلايا14. لذلك ، من المهم التمييز بين تكاثر الخلايا والأحداث الأخرى مثل إصلاح الحمض النووي ، وإعادة دخول دورة الخلية المجهضة ، وتكرار الجينات. يجب على الباحثين اتباع الضوابط المناسبة لضمان الاستخدام المناسب ل BrdU. للحصول على مناقشة أكثر تفصيلا حول هذه المشاكل والقيود ، نوصي بمراجعة عمل توبين14. يمكن أن تكون عملية توحيد بروتوكول الكيمياء الهيستولوجية المناعية بطيئة وصعبة. في هذا العمل ، قدمنا جميع الخطوات العامة لإدارة بروتوكول IHC ناجح. ومع ذلك ، نوصي بأن تقوم كل مجموعة بحثية باختبار وتقييم الأنسجة والأجسام المضادة والظروف مسبقا. يجب إجراء الاختبارات والتقييمات مع ثلاثة مستويات مختلفة على الأقل من الحضانة وخطوات الغسيل ونقاط القوة لكل جسم مضاد وأنسجة تم اختبارها. نوصي أيضا بأن يقوم الباحثون بمراجعة البروتوكولات الإضافية ليتمكنوا من اختيار أفضل ما يلبي الاحتياجات والمتطلبات المحددة20،21،22،23،24،25.
كما ذكرنا سابقا ، يتضمن الإجراء العديد من الخطوات والاعتبارات المنهجية التي يشيع استخدامها وذكرها في المقالات العلمية ، والتي سيتم مناقشتها لاحقا. نوصي الباحثين باختيار الأجسام المضادة بعناية وبشكل صحيح من حيث التقنية والميزانية والمعدات والإعداد والهدف البحثي الرئيسي. يجب اختبار الأجسام المضادة بنفس نوع الأنسجة التي سيتم اختبارها لاحقا في التجربة. نوصي أيضا باستخدام جسم مضاد تم اختباره لنفس الغرض (IHC) (أي ليس فقط في تقنيات قياس اللطخة الغربية أو التدفق الخلوي) لاختبار توافقه مع تقنية التثبيت. يمكن استخدام طرق مختلفة لإدارة تلطيخ BrdU مثل الحقن داخل الصفاق ، أو التسريب داخل الصفاق ، أو الابتلاع عن طريق الفم ، أو التسريب داخل البطيني (للحصول على وصف أكثر تفصيلا لكل تقنية ، انظر المرجع26). إذا تم اختيار الحقن داخل الصفاق ، تأكد من إعطاء BrdU في التجويف البريتوني مع تجنب منطقة الأمعاء. نظرا لأن الأمعاء تحتوي على العديد من الخلايا المكررة التي يمكن أن تستنفد BrdU قبل أن تصل إلى الدماغ مما سيؤثر على عدد الخلايا الموصوفة. من الأهمية بمكان الحصول على أقسام رقيقة لأنها تسمح باختراق أفضل للحلول. تم قطع شرائح إكليلية بسمك 40 ميكرومتر بشكل ذيلي وتم نقلها إلى صفيحة زراعة خلية مكونة من 24 بئرا ، باتباع الإجراء المجسم الذي اقترحه Kempermann et al.27. يمكن إجراء الكيمياء الهيستولوجية المناعية باستخدام أنسجة مثبتة على شرائح أو كأقسام عائمة حرة. نظرا لأن BrdU يقع في عمق نوى الخلايا ، فإنه يسمح باختراق الحلول في الأقسام العائمة الحرة مما يوفر نتائج أفضل ووصولا أفضل إلى منطقة الاهتمام. من المهم فتح روابط الحمض النووي (تمسخ الحمض النووي) للسماح بوصول الأجسام المضادة الأولية المضادة ل BrdU. في هذا العمل ، قمنا بتنفيذ هذه الإجراءات المحددة باستخدام حضانة HCI. من ناحية أخرى ، سمحت عملية حظر الحلقات غير المحددة بتحديد أكثر دقة لإشارة الخلية.
تسمح نفاذية الغشاء الجيدة للأجسام المضادة باختراق منطقة الاهتمام بشكل صحيح. تؤدي إضافة جهاز اختراق مثل Triton X-100 إلى حلول PBS ++ و PBS + إلى تحسين نفاذية الغشاء. يمكن استخدام كل من كواشف PBS و Tris-buffered Saline (TBS) في هذا البروتوكول. من حيث الميزانية ، يمكن أن تكون TBS أرخص نسبيا من PBS. ومع ذلك ، يمكن أن يتداخل برنامج تلفزيوني مع الأجسام المضادة المضادة للفوسفات ويمنع الأجسام المضادة القلوية المترافقة بالفوسفاتيز ، لذا تجنب استخدام PBS إذا تم تعديل الهدف بعد الترجمة عن طريق الفسفرة (أي الفسفرة). استخدمنا PBS لهذا العمل ، واكتشفنا أن خطوات غسل الأنسجة أعطت إشارة أكثر تحديدا. نوصي الباحثين أيضا بإجراء ثلاث دورات غسيل على الأقل باستخدام TBS o PBS. يجب أن تكون الحلول طازجة. استرجاع المستضد (AR) هو طريقة تهدف إلى تقليل فقدان المستضدات الناجم عن التثبيت الذي يعدل بنية المستضدات الثلاثية والرباعية. هذا التخفيض يجعل المستضدات غير قابلة للكشف بواسطة الأجسام المضادة28,29. حاول استرجاع الحاتم الناجم عن الحرارة (HIER) المستخدم في هذا البروتوكول عكس التفاعلات الكيميائية بين الفورمالديهايد والبروتينات عن طريق درجة حرارة عالية أو تحلل قلوي قوي (مع محاليل عازلة أخرى مثل EDTA pH 8.5 أو Tris pH 9.5). من الضروري اختبار الأجسام المضادة الجديدة ببروتوكولات AR مختلفة لمقارنة النتائج واختيار الأفضل للبروتوكول. قد تكون هذه الخطوة الأخيرة اختيارية في بروتوكول عادي. ومع ذلك ، قمنا بمعالجة الأنسجة ببروتوكول استرجاع المستضد لتقديم نتائج أفضل لهذا البروتوكول.
من الأهمية بمكان اختيار اللون المتباين النهائي الصحيح وتقنية التلوين المضاد مع مراعاة لون التلوين الأساسي والطريقة المستخدمة لجعل بنية غير ملطخة مرئية وتجنب إخفاء لون التلوين الأساسي من رد الفعل المناعي. بالنسبة للفحص المجهري الفلوري ، فإن DAPI (4 '، 6-diamidino-2-phenylindole) هو مضاد نووي وكروموسوم شائع جدا ينبعث منه مضان أزرق (الامتصاص: 360 نانومتر ، الانبعاث: 460 نانومتر) عند الارتباط بمناطق AT من الحمض النووي. يتوفر وسيط تركيب يحتوي على DAPI وهو سهل الاستخدام ؛ يوفر هذا احتفاظا ممتازا بالإشارة للحصول على الصور. بالنسبة لتفاعل البيروكسيد ، كان IHC متاحا في خيارات مختلفة مثل الكريسيل البنفسجي أو الهيماتوكسيلين أو الأحمر المحايد أو تلطيخ الميثيل الأخضر. بالنسبة لتقنيات التلوين المناعي المتعددة ، من الضروري اختيار جسم مضاد متوافق مع تقنية التثبيت المستخدمة لتجنب التفاعل المتبادل30. عندما يتم حل المشكلات والمضاعفات المتعلقة بالتلوين الفردي ، قم بإدارة تلطيخ لون آخر حسب الضرورة. من الأهمية بمكان التحكم في الارتباط غير المحدد بين الأجسام المضادة الثانوية. يمكن القيام بذلك عن طريق تشبع الأجسام المضادة الأولية قبل استخدام جسم مضاد ثانوي ينتج في نفس النوع المضيف من الأجسام المضادة الأولية. على سبيل المثال ، عند استخدام مضاد للفأر المنتج في الأرانب ومضاد للأرانب المنتج في الأجسام المضادة الثانوية للماعز ، يجب استخدام مضاد الأرنب المنتج في الجسم المضاد للماعز قبل مضاد الفأر المنتج في الجسم المضاد للأرانب. عندما تهيمن الطريقة المتسلسلة تماما ، يمكن بدء عملية التلوين المناعي المتزامنة. في هذه الطريقة ، من الضروري اختيار الأجسام المضادة الثانوية بشكل مناسب. من الناحية المثالية ، يجب أن تأتي كل هذه الأجسام المضادة من نفس الحيوان المضيف لتجنب التفاعل المتبادل. نوصي بإجراء تحكم إيجابي للتأكد من أن طريقة التلوين تعمل بدقة في أنسجة الحصين بعد الولادة (تكوين عصبي وفير في هذا العمر). إذا أظهرت أنسجة التحكم الإيجابية مشاكل في التلوين ، فقم بمراجعة الإجراء ومراجعته ، وقم بإجراء التصحيحات والتعديلات ، وكرر حتى يتم إنتاج تلطيخ جيد. بعد ذلك ، قم بتشغيل عنصر تحكم سلبي لاختبار أن الجسم المضاد يعمل بشكل صحيح عن طريق حذف أو استبدال جسم مضاد أولي معين بمصل طبيعي (نفس نوع الجسم المضاد الأساسي). كما هو مذكور في المقدمة ، يعد إزالة التفاف الصورة أداة قوية ويوفر بديلا عندما لا يتوفر مجهر متحد البؤر. يمكنه تطبيق فك التفاف الصورة على جميع الصور المكتسبة باستخدام المجال الساطع للضوء المرسل ، ومضان المجال الواسع ، والفحص المجهري الفلوري متحد البؤر. الغرض النهائي من فك التفاف الصورة هو إعادة بناء الإشارة الأصلية بأن نظام الاستحواذ يتدهور10.
باختصار ، فإن تحديد الخلايا المولدة حديثا التي تم تصورها بواسطة الكشف المناعي للثيميدين التناظري BrdU هو تقنية معقدة ولكنها قوية. هذا العمل هو محاولة لمساعدة العلماء ، لا سيما في مجال تكوين الخلايا العصبية الحصينية البالغة ، لتحديد الخلايا الجديدة بشكل أكثر دقة. نأمل أن يكون هذا الجهد مفيدا للمجتمع العلمي ويجعل من السهل ضبط دراسة تكاثر الخلايا بواسطة تقنية الكيمياء المناعية.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
ونود أن نشكر السيد ميغيل بورغوس وغوستافو لاغو على تقديم المساعدة التقنية. كما نود أن نشكر الدكتورة كلوريندا أرياس والدكتورة كارلا هيرنانديز والدكتور أوسكار غاليسيا على دعمهم الكريم في توفير الكواشف والمواد. ونشكر أيضا شعبة التحقيق والثروة السمكية التابعة للجامعة الأيبيرية الأمريكية في المكسيك على توفير التمويل لأداء هذا العمل ولتغطية نفقات إنتاج الفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| REAGENT PREPARATION AND SETUP | |||
| Donor Horse Serum | BioWest | S0900 | Blocking and incubation solutions in PBS |
| Paraformaldehyde reagent grade, crystalline (PFA) | Sigma-Aldrich | P6148 | toxic, flammable |
| Potassium Chloride | Sigma-Aldrich | 746436-500G | |
| Potassium Phosphate, monobasic | J.T Bker | 3246-01 | |
| Sacarose | J.T Baker | 4072-01 | |
| Sodium Chloride | Meyer | 2365-500G | |
| Sodium Hydroxide | Sigma-Aldrich | S5881-500G | Corrisive, to calibrate pH |
| Sodium Phophate Dibasic | Sigma-Aldrich | S9763-5KG | |
| Triton-x 100 | Sigma-Aldrich | T8787 | |
| THYMIDINE ANALOGUE BRDU ADMINISTRATION | |||
| 5-Bromo-2′-deoxyuridine, BrdU | Sigma-Aldrich | B9285 | toxic (mutagenic, teratogenic) |
| 23–27G hypodermic needle | BD PrecisionGlide | ||
| Saline solution | PiSA | 30130032 | |
| Syringes 1 mL | NIPRO | ||
| TISSUE PREPARATION | |||
| 15-ml polypropylene conical tube | Thermo Scientific | 339650 | |
| 50-ml polypropylene conical tube | Thermo Scientific | 339652 | |
| Dissecting tools | |||
| Guillotine | Stoelting | ||
| Microtome Cryostat | MICROM | HM525 | |
| Netwell 15 mm polyester mesh membrane inserts | Corning | 3477 | pre-loaded in 12-well culture plates |
| Netwell plastic 12-well carrier kit | Corning | 3520 | for 15 mm polyester mesh membrane inserts |
| Netwell plastic 6-well carrier kit | Corning | 3521 | |
| Perfusion pump | Cole-Parmer | 7553-70 | |
| Shaker | IKA | ROKCER 3D Digital | |
| IMMUNOSTAINING | |||
| Cresyl violet | Sigma-Aldrich | C5042 | 1%, Light sensitive |
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | Vector Laboratories | SK-4100 | carcinogenic, light sensitive |
| Hydochloric Acid | J.T.Baker | 9535-05 | Corrosive, to calibrate pH |
| Hydrogen Peroxide, 50% | Meyer | 5375-1L | Toxic, oxidative |
| Permount Mounting Medium | Fisher Chemical | SP15-500 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | Light sensitive |
| VECTASTAIN® Elite® ABC Kit Peroxidase (HRP) | Vector Laboratories | PK-6100 | enzymatic, avidin/biotin based amplification system |
| Primary antibodies | |||
| Anti-GFAP antibody produced in rabbit | Sigma-Aldrich | HPA056030 | 1:500 |
| Monoclonal Anti-BrdU antibody produced in Mouse | Sigma-Aldrich | B2531 | 1:250 |
| Secondary antibodies | |||
| Biotin-SP (long spacer) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-065-151 | 1:250 |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, HRP | Invitrogen | G-21040 | 1:1000 |
| Goat Anti-Mouse IgG (whole molecule), TRITC | Sigma-Aldrich | T5393 | 1:250 |
| Goat Anti-Rabbit IgG (H+L) Cross-Adsorbed, FITC | Invitrogen | F-2765 | 1:250 |
| Streptavidin, Cy3 | Vector Laboratories | SA-1300 | 1:250 |
| IMAGING AND ANALYSIS | |||
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| CCD-camera | Olympus | UC50 | |
| CellSens Standard software | Olympus | cellSens Standard Edition | Acquisition Software |
| Epifluorescent microscope | Olympus | BX53 | |
| High-pressure 130 W mercury arc lamp | Olympus | U-HGLGPS | |
| low autofluorescence immersion oil | Olympus | MOIL-30 Type F | |
| Micro cover-glasses (VWR, cat no 48404 454; 24 60 mm) | |||
| Microscope slides (VWR, cat no 48323-185; 76 26 mm) | |||
| U-FBW filter cube | Olympus | U-FBW | excitation 460 - 495 nm, dichroic mirror 505 nm, suppression 510 nm |
| U-FGW filter cube | Olympus | U-FGW | excitation 530 - 550 nm, dichroic mirror 570 nm, suppression 575 nm |
| U-FUW filter cube | Olympus | U-FUW | excitation 340 - 490 nm, dichroic mirror 410 nm, suppression 420 nm |
References
- Altman, J. Are new neurons formed in the brains of adult mammals. Science. 135 (3509), 1127-1128 (1962).
- Altman, J., Das, G. D. Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. The Journal of Comparative Neurology. 124 (3), 319-335 (1965).
- Miller, M. W., Nowakowski, R. S. Use of bromodeoxyuridine-immunohistochemistry to examine the proliferation, migration and time of origin of cells in the central nervous system. Brain Research. 457 (1), 44-52 (1988).
- Eriksson, P. S., et al. Neurogenesis in the adult human hippocampus. Nature Medicine. 4 (11), 1313-1317 (1998).
- Filippov, V., et al. Subpopulation of nestin-expressing progenitor cells in the adult murine hippocampus shows electrophysiological and morphological characteristics of astrocytes. Molecular and Cellular Neuroscience. 23 (3), 373-382 (2003).
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends in Neurosciences. 27 (8), 447-452 (2004).
- Matiašová, A., et al. Flow cytometric determination of 5-bromo-2'-deoxyuridine pharmacokinetics in blood serum after intraperitoneal administration to rats and mice. Histochemistry and Cell Biology. 142 (6), 703-712 (2014).
- Von Bohlen Und Halbach, O. Immunohistological markers for proliferative events, gliogenesis, and neurogenesis within the adult hippocampus. Cell and Tissue Research. 345 (1), 1-19 (2011).
- Sage, D., et al. DeconvolutionLab2: An open-source software for deconvolution microscopy. Methods. 115, 28-41 (2017).
- Manz, W., Arp, G., Schumann-Kindel, G., Szewzyk, U., Reitner, J. Widefield deconvolution epifluorescence microscopy combined with fluorescence in situ hybridization reveals the spatial arrangement of bacteria in sponge tissue. Journal of Microbiological Methods. 40 (2), 125-134 (2000).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with imageJ. Biophotonics International. 11 (7), 36-41 (2004).
- Giannini, A., Giannini, J. 2D and 3D Fluorescence Deconvolution Manual. , Available from: https://pages.stolaf.edu/wp-content/uploads/sites/803/2016/12/Giannini_Giannini_Deconvolution_Manual_20161215.p (2016).
- Taupin, P. BrdU immunohistochemistry for studying adult neurogenesis: Paradigms, pitfalls, limitations, and validation. Brain Research Reviews. 53 (1), 198-214 (2007).
- Revilla, V., Jones, A. Cryostat sectioning of brains. International Review of Neurobiology. 47, 61-70 (2002).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in brain research. 163, 3-22 (2007).
- Eadie, B. D., Redila, V. A., Christie, B. R. Voluntary exercise alters the cytoarchitecture of the adult dentate gyrus by increasing cellular proliferation, dendritic complexity, and spine density. Journal of Comparative Neurology. 486 (1), 39-47 (2005).
- Leal-Galicia, P., Romo-Parra, H., Rodríguez-Serrano, L. M., Buenrostro-Jáuregui, M. Regulation of adult hippocampal neurogenesis exerted by sexual, cognitive and physical activity: An update. Journal of Chemical Neuroanatomy. 101, 101667(2019).
- Gould, E. How widespread is adult neurogenesis in mammals. Nature Reviews Neuroscience. 8 (6), 481-488 (2007).
- Ngwenya, L. B., Peters, A., Rosene, D. L. Light and electron microscopic immunohistochemical detection of bromodeoxyuridine-labeled cells in the brain: Different fixation and processing protocols. Journal of Histochemistry and Cytochemistry. 53 (7), 821-832 (2005).
- Ansorg, A., Bornkessel, K., Witte, O. W., Urbach, A. Immunohistochemistry and multiple labeling with antibodies from the same host species to study adult hippocampal neurogenesis. Journal of Visualized Experiments. (98), e52551(2015).
- Tuttle, A. H., et al. Immunofluorescent detection of two thymidine analogues (CldU and IdU) in primary tissue. Journal of Visualized Experiments. (46), e2166(2010).
- Tischler, A. S. Triple immunohistochemical staining for bromodeoxyuridine and catecholamine biosynthetic enzymes using microwave antigen retrieval. Journal of Histochemistry and Cytochemistry. 43 (1), 1-4 (1995).
- Taupin, P. Protocols for studying adult neurogenesis: Insights and recent developments. Regenerative Medicine. 2 (1), 51-62 (2007).
- Leuner, B., Glasper, E. R., Gould, E. Thymidine analog methods for studies of adult neurogenesis are not equally sensitive. Biosystems. 517 (2), 123-133 (2010).
- Magavi, S. S., MacKlis, J. D. Identification of newborn cells by BrdU labeling and immunocytochemistry in vivo. Methods in Molecular Biology. 438, 335-343 (2008).
- Kempermann, G., Gast, D., Kronenberg, G., Yamaguchi, M., Gage, F. H. Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice. Development. , 391-399 (2003).
- Ramos-Vara, J. A., Beissenherz, M. E. Optimization of immunohistochemical methods using two different antigen retrieval methods on formalin-fixed, paraffin-embedded tissues: Experience with 63 markers. Journal of Veterinary Diagnostic Investigation. 12 (4), 307-311 (2000).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Wojtowicz, J. M., Kee, N. BrdU assay for neurogenesis in rodents. Nature Protocols. 1 (3), 1399-1405 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved