Method Article
Tecniche di immunoistochimica per analizzare la proliferazione cellulare e la neurogenesi nei ratti utilizzando l'analogo della timidina BrdU
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo presenta quattro delle tecniche più comuni per visualizzare le cellule BrdU positive per misurare la neurogenesi adulta nei ratti. Questo lavoro include istruzioni per la preparazione del reagente, la somministrazione di analoghi della timidina, la perfusione transcardica, la preparazione dei tessuti, la reazione immunoistochimica della perossidasi, l'immunofluorescenza, l'amplificazione del segnale, la controcolorazione, l'imaging al microscopio e l'analisi cellulare.
Abstract
Una delle cose più importanti nel campo della neurogenesi ippocampale adulta (AHN) è l'identificazione delle cellule appena generate. L'immunorilevazione di analoghi della timidina (come la 5-Bromo-2'-deossiuridina (BrdU)) è una tecnica standard utilizzata per visualizzare queste cellule appena generate. Pertanto, BrdU viene solitamente iniettato in piccoli animali per via intraperitoneale, quindi l'analogo della timidina viene incorporato nelle cellule in divisione durante la sintesi del DNA. Il rilevamento viene eseguito mediante analisi immunoistochimica delle fette di cervello. Ogni gruppo di ricerca che ha utilizzato questa tecnica può apprezzare che richiede un'attenzione particolare ai minimi dettagli per ottenere una macchia di successo. Ad esempio, un passo importante è la denaturazione del DNA con HCl, che gli consente di raggiungere il nucleo cellulare per colorarlo. Tuttavia, le relazioni scientifiche esistenti descrivono in dettaglio pochissimi di tali passaggi. Pertanto, standardizzare la tecnica è una sfida per i nuovi laboratori in quanto possono essere necessari diversi mesi per produrre risultati positivi e di successo. Lo scopo di questo lavoro è quello di descrivere ed elaborare i passaggi per ottenere risultati positivi e di successo della tecnica di immunocolorazione in dettaglio quando si lavora con l'analogo della timidina BrdU. Il protocollo include la preparazione e la configurazione del reagente, la somministrazione dell'analogo della timidina in un roditore, la perfusione transcardica, la preparazione dei tessuti, la reazione immunoistochimica della perossidasi, l'uso del complesso avidina-biotina, l'immunofluorescenza, la controcolorazione, l'imaging al microscopio e l'analisi cellulare.
Introduzione
L'idea che nuovi neuroni siano generati nel cervello umano adulto per tutta la durata della vita ha affascinato la comunità scientifica per decenni. La conoscenza che il cervello genera nuovi neuroni per tutta la sua durata di vita è stata raggiunta attraverso la rilevazione di cellule sotto la divisione 1,2. Il rilevamento di neuroni di nuova generazione nel cervello adulto è stato identificato per la prima volta iniettando per via intracranica timidina tritiata (timidina-H3) nei ratti e rilevando le cellule nel ciclo cellulare mediante autoradiogrammi 1,2. È stata riportata la divisione cellulare della glia e la presenza di neuroblasti, che sono stati i primi dati promettenti sulla neurogenesi postnatale1. Tuttavia, l'uso e il rilevamento di timidina-H3 implicavano l'uso di radioattività, che può essere dannosa per le persone che lo gestiscono. Il primo sforzo che esamina l'idoneità dell'immunoistochimica BrdU nello studio della proliferazione, migrazione e origine delle cellule nel sistema nervoso è apparso nel 1988 da Miller e Nowakowski3. Nel 1998, un articolo pubblicato da Eriksson e colleghi ha mostrato che nuovi neuroni sono stati visualizzati postmortem nel cervello adulto umano di pazienti iniettati con 5-Bromo-2′-deossiuridina (BrdU)4. Questi pazienti hanno ricevuto l'iniezione di BrdU (250 mg per via endovenosa) per etichettare la crescita dei tumori4. Questa tecnica è stata adottata in modelli animali. L'introduzione di questi metodi ha segnato una pietra miliare per il campo poiché ciò ha permesso il rilevamento di cellule appena generate senza l'uso di composti radioattivi. Questa procedura è diventata il gold standard per misurare la proliferazione cellulare nelle nicchie cerebrali adulte per promuovere ulteriori ricerche sul campo.
Il limite della tecnica analogica della timidina è che non consente la determinazione dell'identità cellulare per le cellule appena generate. Tuttavia, l'immunoistochimica ci consente di eseguire la tecnica di doppia o tripla marcatura della stessa cellula, che convalida il destino cellulare delle cellule appena generate e persino le loro fasi di maturazione, portando a un'ulteriore evoluzione del campo. Questo metodo è stato caratterizzato per differenziare le cellule appena generate in glia, neuroni indifferenziati o una cellula granulare completamente matura, e anche per determinare se partecipano attivamente ai circuiti. Un altro passo avanti nel campo è stato l'uso di modelli transgenici per identificare cellule indifferenziate sotto il dominio della nestina. I topi transgenici nestin-GFP esprimono una proteina fluorescente verde potenziata (GFP), che è sotto il controllo del promotore della nestina. La nestina è un filamento intermedio caratterizzato da cellule progenitrici5. I topi transgenici nestin-GFP hanno permesso di stabilire le prime fasi dello sviluppo coinvolte nella neurogenesi6. Tuttavia, una limitazione significativa è quella di essere in grado di mantenere una colonia di topi transgenici nestin-GFP in condizioni speciali in una struttura di laboratorio che diventa conveniente per alcuni gruppi scientifici, in particolare quelli dei paesi in via di sviluppo.
Le tecniche sopra menzionate presentano vantaggi e svantaggi. Tuttavia, l'identificazione delle cellule proliferanti mediante immunoistochimica (IHC) e la possibilità di effettuare una tecnica di doppia o tripla marcatura mediante immunofluorescenza per identificare lo stadio di maturazione cellulare o il destino cellulare rappresenta il modo più fattibile per misurare la neurogenesi adulta, finora. Il processo di identificazione mediante immunoistochimica consiste nella marcatura di proteine, dominio proteico o nucleotidi con un anticorpo specifico che consente il loro riconoscimento noto come anticorpo primario. Quest'ultimo è riconosciuto dall'anticorpo secondario, che è marcato con un cromogeno (ad esempio, perossidasi di rafano) o un fluorocromo (ad esempio, FITC) accoppiato con l'anticorpo secondario. I microscopi possono rilevare sia i segnali cromogeni che quelli fluorocromici. Utilizzando IHC, è possibile identificare proteine di membrana, proteine del citoscheletro o componenti nucleari come BrdU. D'altra parte, BrdU può essere trovato nel nucleo cellulare poiché è incorporato nel DNA durante la fase S per competizione. Pertanto, un passo cruciale è la denaturazione del DNA con HCl, che apre legami DNA per consentire all'anticorpo BrdU di accedere a BrdU all'interno del DNA. È essenziale sapere che BrdU è presente in una concentrazione satura nel siero di topi e ratto per 15 e 60 minuti rispettivamente, dopo somministrazione intraperitoneale, quindi scende rapidamente a livelli non rilevabili rispettivamente a 60 e 120 minuti7.
Qui, descriviamo quattro tecniche IHC diverse ma strettamente correlate: rilevazione indiretta cromogenica mediante reazione di perossidasi di rafano (HRP) con DAB (3,3'-diaminobenzidina) senza amplificazione del segnale (fase 4.1), amplificazione del complesso avidina-biotina (ABC) (fase 4.1), rilevazione di immunofluorescenza indiretta senza amplificazione del segnale (fase 4.4) e amplificazione marcata streptavidina-biotina (LSAB) (fase 4.3). Ogni metodo presenta vantaggi e svantaggi e potrebbe essere utile per specifiche esigenze tissutali (vedi Tabella 1). Abbiamo deciso di seguire i metodi ICH indiretti a causa della loro convenienza e semplicità per apportare modifiche dai metodi di rilevamento cromogenici a quelli fluorescenti quando si utilizzano anticorpi primari non coniugati. L'approccio HRP è un metodo IHC comunemente usato grazie alla sua convenienza, elevata stabilità, alto tasso di rotazione e piena disponibilità dei substrati. Tuttavia, si consiglia di utilizzare un controllo positivo per confermare che il metodo di colorazione funziona accuratamente e l'uso del controllo negativo per testare efficacemente la funzione degli anticorpi. Le immunocolorazioni multiple o i metodi IHC multiplex (vedi fase 6) sono strumenti potenti per acquisire grandi quantità di dati dalla sezione tissutale in un singolo esperimento. Questa tecnica è particolarmente importante quando la disponibilità di campioni è limitata. Un altro vantaggio è la possibilità di identificare simultaneamente proteine specifiche co-espresse nello stesso spazio cellulare preservando l'integrità dei tessuti. Multiplex permette di colorare diversi marcatori espressi durante specifici stadi proliferativi (es. nestina, GFAP, DCX, Ki-67), permettendo di raggiungere una ricerca più dettagliata sulla proliferazione e differenziazione8. È fondamentale scegliere anticorpi compatibili con la tecnica di fissazione utilizzata per evitare la cross-reattività. Si consiglia di testare ogni nuovo anticorpo (incluso BrdU) individualmente per regolare e perfezionare il metodo. Quindi, introdurre la doppia colorazione sequenziale e, infine, avviare il processo di immunocolorazione simultanea quando il metodo sequenziale è interamente dominato. È fondamentale scegliere anticorpi secondari appropriati per questo metodo.
| Metodo | Metodo specifico | Vantaggi | Difetto |
| Metodo di rilevamento indiretto | Reazione della perossidasi con DAB | 1. Maggiore sensibilità rispetto al metodo di rivelazione diretta e fluorescenza indiretta. 2. Maggiore resistenza al fotosbiancamento rispetto ai fluorocromi. 3. Costo inferiore rispetto al metodo di rilevamento a fluorescenza | 1. Difficile per il multiplexing con meno coloranti. 2. Complicato per bersagli co-espressi nello stesso spazio cellulare. 3. Gamma dinamica ridotta per bersagli simultanei scarsi e ad alta abbondanza sullo stesso tessuto. |
| Fluorescenza | 1. Migliore e più facile per il multiplexing con più coloranti. 2. Migliore per obiettivi co-espressi nello stesso spazio cellulare. 3. Migliore gamma dinamica per bersagli simultanei scarsi e ad alta abbondanza sullo stesso tessuto. 4. Nessun passaggio aggiuntivo. | 1. Sensibilità inferiore rispetto alla reazione indiretta della perossidasi con metodo DAB. 2. Debole resistenza al fotosbiancamento nel tempo. 3. Più costoso. | |
| Metodo di amplificazione del segnale | Complesso Avidina-Biotina (ABC) | 1. Maggiore sensibilità rispetto al metodo di rilevamento diretto e indiretto. 2. Riduci lo sfondo | 1. Passaggi aggiuntivi. 2. Più costoso che non amplificazione. |
| Streptavidina-biotina etichettata (LSAB) | 1. Maggiore sensibilità rispetto al metodo di rilevamento diretto e indiretto. 2. Penetrazione tissutale più consistente rispetto al metodo ABC. 3. Riduci lo sfondo | 1. Passaggi aggiuntivi. 2. Più costoso del metodo ABC. | |
| Metodo di amplificazione non aggiuntivo | 1. Costo inferiore. 2. Nessun passaggio aggiuntivo. 3. Ideale per bersagli ad alta abbondanza. | 1. Sensibilità inferiore: problematica senza bersagli abbondanti. |
Tabella 1: Vantaggi/svantaggi delle tecniche IHC. Questa tabella mostra i vantaggi/svantaggi per i metodi di rilevazione indiretta: Reazione della perossidasi con (3,3'-diaminobenzidina) DAB e fluorescenza; e metodi di amplificazione del segnale: complesso avidina-biotina (ABC), marcato streptavidina-biotina (LSAB) e non metodo di amplificazione aggiuntivo.
Un'immagine ad alta risoluzione è fondamentale per eseguire una corretta analisi e presentare i risultati. Esistono due approcci per migliorare la risoluzione: 1) uso di un design migliore del microscopio (ad esempio, confocale, multifotone) o 2) invertire numericamente il processo di sfocatura per migliorare le immagini usando la deconvoluzione9. Sfortunatamente, la microscopia confocale non è conveniente a causa degli alti costi delle apparecchiature e della sua manutenzione10. Un microscopio a epifluorescenza ad ampio campo e la successiva deconvoluzione delle immagini z-stack forniscono un'alternativa adeguata e a basso costo alla microscopia confocale 8,9. Come notato sopra, l'obiettivo della deconvoluzione è quello di ripristinare il segnale originale che è stato degradato dal sistema di acquisizione9, riducendo la sfocatura, la foschia fuori fuoco e la distorsione mostrata nell'immagine ottenuta da un microscopio epifluorescenza o confocale utilizzando algoritmi di rimozione matematica10. L'immagine sfocata acquisita può essere modellata matematicamente come risultato della convolgimento degli oggetti osservati con una funzione di diffusione del punto 3D (PSF). La PSF è un modello teorico di diffrazione dei punti di luce emessi dal campione di tessuto e raccolti dal microscopio. Il file PSF viene creato con le condizioni specifiche di ciascuna immagine, come la spaziatura delle celle CCD della telecamera, l'indice di rifrazione del supporto utilizzato, l'apertura numerica dell'obiettivo, la lunghezza d'onda di emissione del fluoroforo, le dimensioni dell'immagine, il numero di immagini nel metodo di elaborazione z-stack e lo spazio tra di loro (vedere le specifiche tecniche nella Tabella 2). In altre parole, il file PSF riassume gli effetti della configurazione dell'imaging sulle osservazioni del microscopio9. Tuttavia, utilizziamo il plug-in PSF 3D di diffrazione (https://imagej.net/Diffraction_PSF_3D) per creare il nostro file PSF specifico per ogni immagine z-stack. Le immagini Z-stack sono una serie di sezioni ottiche digitalizzate da profondità definite (asse z) nella stessa posizione XY della diapositiva. Un computer compila le informazioni ottenute dal piano di messa a fuoco riassegnando segnali che hanno avuto origine da oggetti situati in altri piani focali. Per creare immagini z-stack, è necessario prendere immagini da diversi livelli focalizzati delle diapositive (ad esempio, dieci immagini diverse della stessa area XY ogni 1 μm di profondità). Quindi, utilizziamo software di microscopia forniti dal produttore o dalle Figi per creare uno z-stack o un'immagine 3D. Il risultato sarà un singolo file di immagine stack (ad esempio, dieci immagini con diversi focus). Esistono diversi strumenti e soluzioni software specifici per il cliente, come il software open source per la microscopia a deconvoluzione. Mostreremo gli output del processo di deconvoluzione usando DeconvolutionLab29 che è un plugin Fiji11 (distribuzione di ImageJ12). La deconvoluzione aiuterà a migliorare la risoluzione delle micrografie finali (vedi Figura 1B,C ). Per ulteriori informazioni e istruzioni, si consiglia vivamente di leggere il riferimento13.
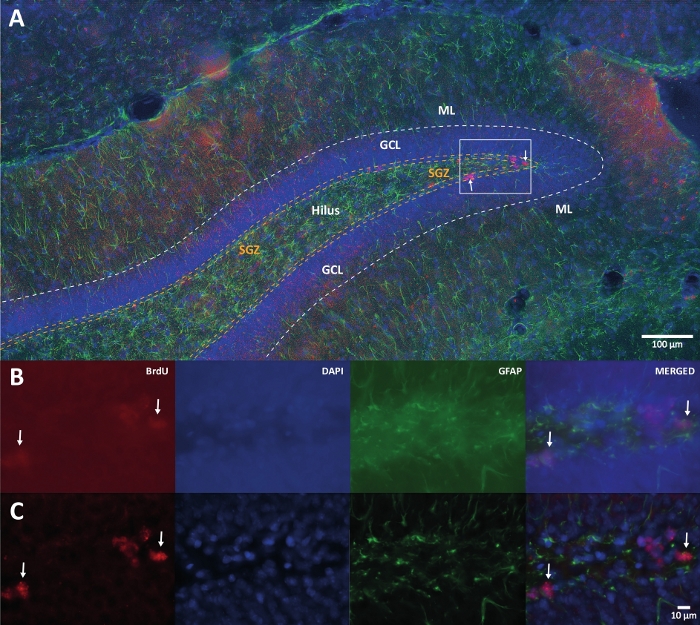
Figura 1: Immagine rappresentativa della deconvoluzione 3D per più canali di colore. (A) DG a basso ingrandimento. (B) Le immagini z-stack originali per ciascun canale e l'immagine unita. (C) Immagini z-stack 3D deconvolute per ciascun canale e l'immagine unita. Questo cervello proveniva dal ratto che faceva parte del gruppo di attività fisica. È stato utilizzato il metodo di amplificazione marcato con streptavidina-biotina (LSAB). Ha mostrato l'anticorpo coniugato con streptavidina Cy3 per indicare BrdU (rosso), DAPI come controcolorazione (blu) e proteina acida fibrillare gliale (GFAP) come marcatore astrogliale (verde). ML = strato molecolare; GCL = strato cellulare granulare; SGZ = zona subgranulare. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Lo scopo di questo lavoro è quello di fornire una descrizione dettagliata dei passaggi per ottenere risultati positivi e di successo con l'immunocolorazione e di elencare i passaggi comunemente usati negli studi basati su BrdU, senza l'uso di un microscopio confocale. La colorazione BrdU è una tecnica che richiede diversi passaggi che devono essere seguiti attentamente per ottenere una colorazione di successo. La standardizzazione di queste tecniche di colorazione richiede in genere mesi e richiede tempo e risorse. Abbiamo anticipato che questo articolo potrebbe fornire informazioni ai gruppi che iniziano in questo campo riducendo i tempi e gli errori.
Protocollo
Tutte le procedure seguono la guida del National Institutes of Health per la cura e l'uso degli animali da laboratorio (NIH Publications N°. 8023, rivista nel 1978) e le leggi locali messicane per ridurre al minimo il numero di animali utilizzati e la loro sofferenza. Il Comitato Etico dell'Universidad Iberoamericana ha approvato i protocolli sperimentali per l'utilizzo di animali in questo studio.
1. Preparazione e configurazione del reagente
NOTA: la maggior parte delle soluzioni può essere preparata giorni prima dell'uso, se non diversamente specificato.
- Soluzione BrdU
- Prelevare la soluzione di BrdU dal congelatore a -20 °C e lasciarla equilibrare a temperatura ambiente (RT).
- Calcolare la massa di BrdU necessaria per una dose di 50 mg/kg in base al peso corporeo del ratto. Calcolare il volume della soluzione salina allo 0,9% (0,9 g di NaCl in 100 ml di H2O sterile) necessaria per una soluzione di lavoro di 20 mg/ml. Preparare un eccesso per fornire almeno 0,5 ml per ratto per iniezione.
NOTA: La dose somministrata agli animali da esperimento deve essere sicura, con effetti collaterali minimi ed efficace. È stato riportato che la durata della colorazione con 100 mg/kg di BrdU non supera la tossicità potenzialmente più elevata rispetto alla dose di 50 mg/kg7. Non sono state riscontrate differenze significative nel numero di cellule marcate con BrdU/mm3 per 50 e 100 mg/kg i.p. nei ratti7. È preferibile iniettare una piccola dose per ridurre al minimo la sofferenza degli animali. - Pesare la soluzione di BrdU e aggiungerla alla soluzione salina in un tubo conico e vortice.
NOTA: Preriscaldare la soluzione salina a 45-50 °C a bagnomaria per volumi superiori a 1 ml. - Porre il tubo a bagnomaria a 50 °C per 10-15 minuti e vortice ogni 2-33 minuti fino a completa dissoluzione. Filtrare la soluzione con un filtro a siringa per iniezione sterile. Coprire il tubo con carta stagnola, raffreddarlo a temperatura ambiente e utilizzare immediatamente.
ATTENZIONE: La soluzione di BrdU è tossica e potenzialmente cancerogena. Prepararlo nella cappa aspirante. La soluzione di BrdU deve essere maneggiata con dispositivi di protezione (DPI) adeguati. Si consiglia di preparare la soluzione immediatamente prima dell'uso. Tuttavia, la soluzione è stabile per 24 ore sotto RT. Si prega di proteggerlo dalla luce.
- Per preparare 1 L di soluzione salina tamponata fosfato 0,1 M (PBS) a pH 7,4, aggiungere 240 mg di fosfato di potassio monobasico (KH 2 PO 4), 1,44 g di fosfato bibasico di sodio (Na 2 HPO4), 200 mg di cloruro di potassio (KCl) e 8 g di cloruro di sodio (NaCl) a 800 ml di acqua bidistillata (ddH2O) sotto costante agitazione. Regolare il pH a 7,4 e aggiungere H2O doppio distillato fino a un volume totale di 1 L. Conservare a 4 °C per un massimo di 1 settimana.
- Per 100 mL di PBS+, aggiungere il 3% (3 ml) di siero di cavallo normale e lo 0,3% (300 μL) di Triton X-100 a 0,1 M PBS (pH 7,4). Conservare in 20-250 ml di aliquote a -20 °C per un massimo di 3 mesi.
NOTA: in alternativa, è possibile utilizzare TBS al posto di PBS. Qualsiasi altro siero diverso dagli anticorpi dell'ospite e dal tessuto sperimentale è adatto. - Per 100 ml di PBS++, aggiungere il 10% (10 ml) di siero di cavallo normale e lo 0,3% (300 μL) di Triton X-100 a 0,1 M PBS pH 7,4. Conservare in 20-250 ml di aliquote a -20 °C per un massimo di 3 mesi.
- Per 1 L di soluzione crioprotettiva, mescolare 250 ml di glicole etilenico e 250 ml di glicerolo, mescolare costantemente fino a miscelazione. Portare lentamente a 1 L con PBS. Filtro con carta da filtro di grado 4 (20-25 μm). Conservare a 4 °C o RT per un massimo di 1 anno.
- Preparare paraformaldeide al 4% in 0,1 M PBS (soluzione PFA) come segue. Per 1 L di soluzione, aggiungere lentamente 40 g di polvere di paraformaldeide a 800 mL di 60-1265 °C 0,1 M PBS agitando costantemente. Mescolare fino a completa dissoluzione della paraformaldeide controllando la temperatura (60-65 °C). Se necessario, aggiungere alcune gocce di 1 M NaOH per chiarire la soluzione. Quando la soluzione raggiunge la temperatura ambiente, filtrare con carta da filtro di grado 4 (20-25 μm).
ATTENZIONE: La paraformaldeide è tossica ed è sospettata di essere cancerogena, preparare nella cappa aspirante. Conservare a 4 °C e preferibilmente utilizzare entro 2 giorni. La soluzione pronta all'uso PFA è disponibile in commercio. - Per 1 L di tampone citrato di sodio (SCB) da 10 mM a pH 6, aggiungere 1,204 g di citrato di sodio (diidrato) e 1,134 g di acido citrico a 800 ml di H2O bidistillato sotto costante agitazione. Regolare il pH a 6,0 e aggiungere ddH2O fino a 1 L. Conservare a 4 °C per un massimo di 6 mesi.
- Preparare 50 mL di 2 N HCl aggiungendo lentamente 8,25 mL di 12 N HCl (soluzione madre concentrata) a 41,75 mL di ddH2O sotto agitazione costante.
ATTENZIONE: Preparare nella cappa aspirante. La soluzione deve essere preparata immediatamente prima dell'uso.
NOTA: 2 N HCl saranno utilizzati per la denaturazione del DNA, un passaggio cruciale. Poiché BrdU è incorporato nel DNA, HCl viene utilizzato per aprire i legami del DNA consentendo all'anticorpo BrdU di accedere a BrdU all'interno del DNA. - Preparare la soluzione di blocco della perossidasi endogena come segue. Preparare 100 ml di perossido di idrogeno allo 0,6% mescolando 2 ml di perossido di idrogeno al 30% con 98 ml di ddH2O sotto costante agitazione.
NOTA: la soluzione deve essere preparata immediatamente prima dell'uso. Tienilo al buio poiché H2 O2 è sensibile alla luce. PBS o TBS possono essere utilizzati al posto dell'acqua. - Preparare la soluzione di complesso avidina-biotina (ABC) secondo le istruzioni del produttore. Per 5 mL di ABC in 0,1 M PBS, aggiungere 2 gocce (≈100 μL) di reagente A e miscelare, quindi aggiungere 2 gocce (≈100 μL) di reagente B e miscelare.
NOTA: La soluzione deve essere preparata e lasciata rotolare per 20-30 minuti prima dell'uso. - Preparare il substrato DAB (Diaminobenzidina) Perossidasi (HRP) utilizzando il kit seguendo le istruzioni del produttore. A 5 mL di ddH 2 O, aggiungere 2 gocce (≈ 84 μL) di reagente 1 e mescolare, aggiungere 4 gocce (≈ 100 μL) di reagente 2 e mescolare, quindi aggiungere2gocce (≈ 80 μL) di reagente 3 e mescolare. Infine, se lo si desidera, aggiungere 2 gocce (≈ 80 μL) di reagente 4 (Nichel) e mescolare.
NOTA: la soluzione deve essere preparata immediatamente prima dell'uso.
ATTENZIONE: DAB è tossico e potenzialmente cancerogeno. Devono essere maneggiati con cura e scartati secondo il regolamento sui rifiuti pericolosi in ogni istituzione. Per inattivare DAB, aggiungere diverse gocce di candeggina (ipoclorito di sodio); La soluzione diventerà nera. - Preparare 100 mL di soluzione di cresyl violet aggiungendo 100 mg di cresyl violette acetato e 250 μL di acido acetico a 80 mL di ddH2O a 55-60 °C. Regolare il volume a 100 ml, filtrare e conservare a 4 °C in un recipiente di colore scuro.
NOTA: L'utente è invitato a testare diverse concentrazioni della soluzione di cresil violetto prima di utilizzarla su preziosi campioni di tessuto. Il risultato può essere più scuro per la controcolorazione con alcuni campioni di tessuto, che può ridurre la capacità di contare accuratamente le cellule positive BrdU.
2. Somministrazione di BrdU analogo della timidina
- Trattenere l'animale da esperimento (ad esempio, ratto Wistar maschio di 90 giorni del peso di 350 g), immobilizzando la cavità addominale inferiore.
- Somministrare la soluzione di BrdU (50 mg/kg) per via intraperitoneale (i.p.) utilizzando un ago da 23 G e una siringa da 1 ml.
NOTA: Regolare il volume di iniezione in base al peso dell'animale. Utilizzare un ago da 23-27 G e una siringa da 1-5 ml per ratti adulti. Il volume massimo tollerabile di iniezione intraperitoneale nel ratto adulto è di 10 ml. È possibile utilizzare diversi percorsi per amministrare la soluzione BrdU14. Ad esempio, iniezione intraperitoneale o somministrazione orale attraverso acqua potabile.
3. Preparazione dei tessuti
NOTA: ai ratti di tre mesi è stato concesso l'accesso ad libitum all'attività fisica (ruota infinita) per sette giorni. Il giorno 6, ai ratti è stato iniettato BrdU (fase 2) 3 volte ad intervalli di 12 ore. Eseguire i passaggi del paragrafo 3 dopo 8 ore dall'ultima iniezione di BrdU.
- Iniettare pentobarbital (50 mg/kg i.p.) e attendere qualche minuto fino a quando l'animale è profondamente anestetizzato.
NOTA: Assicurarsi che l'animale sia completamente anestetizzato prima di continuare. Pizzicare con attenzione una delle gambe o la coda. Se l'animale reagisce allo stimolo, attendere qualche minuto in più. Se l'animale non reagisce al pizzico, vai al passaggio successivo. - Esporre il cuore tagliando la pelle della cavità addominale sotto lo sterno, smontando le costole e tagliando il diaframma.
- Fissazione della perfusione transcardica
- Inserire un ago nel ventricolo sinistro e fare una piccola incisione nell'atrio destro. Utilizzando una pompa o la gravità, perfondere (portata 5-min) 0,1 M PBS fino a quando il sangue intero viene drenato e la soluzione diventa limpida.
- Utilizzando una pompa o una gravità, eseguire la perfusione fredda (portata 5-min) con una soluzione di PFA per fissare il tessuto fino a quando la coda diventa rigida.
NOTA: Di solito, un ratto da 300 g richiede circa 100-150 ml di soluzione PFA. La fissazione del tessuto è facoltativa. In tal modo, il cervello può essere estratto per l'uso in vari processi per ridurre al minimo l'uso di animali negli esperimenti.
- Dissezione e post-fissazione
- Decapitare l'animale ed estrarre delicatamente il cervello dal cranio. Immergere il cervello in un tubo conico contenente una soluzione di PFA (~40 ml per un ratto da 250 mg) per 1-20122 giorni a 4 °C.
NOTA: Non fissare eccessivamente (più di 48 ore), perché questo può esaurire la colorazione del tessuto a causa dell'indisponibilità di antigeni. - Preparare 100 ml di soluzione di saccarosio al 30%, aggiungendo 30 g di saccarosio a 70 ml di soluzione PBS 0,1 M sotto costante agitazione. Aggiungere la soluzione PBS 0,1 M a 100 ml. Immergere il cervello in un tubo conico con una soluzione di saccarosio al 30% (35 ml) per circa 1-20122 giorni a 4 °C fino a quando il cervello affonda sul fondo del tubo.
- Decapitare l'animale ed estrarre delicatamente il cervello dal cranio. Immergere il cervello in un tubo conico contenente una soluzione di PFA (~40 ml per un ratto da 250 mg) per 1-20122 giorni a 4 °C.
- Taglio delle sezioni del cervello coronale
NOTA: L'uso di un microtomo criostato richiede guida e formazione. Per istruzioni dettagliate, vedere riferimento15.- Immergere l'intero cervello in iso-pentano a -80 °C e mantenerlo a -80 °C per 10 minuti. Posizionare il cervello in una matrice incorporata su una piastra criostat-microtomo.
NOTA: In determinate condizioni, il congelamento rapido del cervello a -80 °C può causare fratture o danni al tessuto. L'utente deve essere consapevole di questo problema. Se questo è il caso, utilizzare -20 °C iso-pentano per congelare il cervello. - Utilizzando un microtomo criostato (temperatura da -25 a -20 °C) tagliare sezioni coronali di 40 μm di spessore. Trasferire sequenzialmente le sezioni in una piastra di coltura cellulare a 24 pozzetti con soluzione di crioprotezione seguendo la guida in Figura 2. Conservare a -20 °C fino all'uso, per un massimo di alcuni mesi.
NOTA: Di seguito, processare tutto il tessuto in sezioni seriali fluttuanti di 40 μm in piastre a 12 pozzetti con inserti in rete in agitazione delicata e continua (10 rpm). È possibile conservare sezioni cerebrali per anni nelle giuste condizioni.
- Immergere l'intero cervello in iso-pentano a -80 °C e mantenerlo a -80 °C per 10 minuti. Posizionare il cervello in una matrice incorporata su una piastra criostat-microtomo.
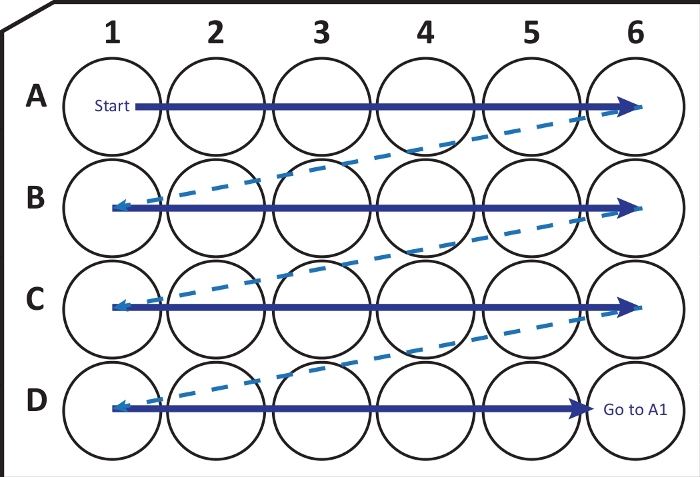
Figura 2: Illustrazione schematica del trasferimento sequenziale di sezioni dal microtomo criostatico in una piastra di coltura cellulare a 24 pozzetti con soluzione di crioprotezione. Inizia dal pozzetto A1 e posiziona le fette successive nella riga A; dopo A6-well passare alla riga successiva B, così via. Quando si arriva D6, tornare sulla A1 e continuare. Questa disposizione consente la quantificazione della sezione Nth (ad esempio, sesta per la neurogenesi, equivalente al contenuto di una colonna) di un'intera regione del cervello. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Immunocolorazione
NOTA: Vedere la tabella 1 per il riepilogo dei vantaggi e degli svantaggi di ciascuna tecnica.
- Rilevazione di BrdU mediante reazione perossidasica con DAB
NOTA: eseguire i passaggi da 4.1.1 a 4.1.5 il giorno 1.- Trasferire le fette dalla soluzione di crioprotezione a 0,1 M PBS a temperatura ambiente. Risciacquare tre volte per 10 minuti ciascuna, con 0,1 M PBS.
- Incubare le fette per 30 minuti in soluzione di blocco della perossidasi endogena per inattivare la perossidasi endogena. Risciacquare 3 volte, 10 minuti ciascuna, con 0,1 M PBS. Facoltativamente, eseguire il recupero dell'antigene (vedere paragrafo 5). Incubare le fette per 20 minuti con 2 N HCl a 37 °C. Risciacquare in tampone borato da 0,1 M (8,5 pH) per 10 minuti. Risciacquare 3 volte per 10 minuti ciascuna, con 0,1 M PBS ghiacciato.
- Incubare le fette per 2 ore a temperatura ambiente con PBS++ (soluzione bloccante). Incubare con anticorpo primario anti-BrdU (ospite di topo) alla concentrazione di 1:250 in PBS+ durante la notte a 4 °C.
- Il giorno 2, sciacquare le fette 3 volte per 10 minuti ciascuna con 0,1 M PBS.
- Incubare con 1:250 anticorpo secondario coniugato HRP (anti-topo) in PBS+ per 2-0124 ore a temperatura ambiente. Risciacquare 3 volte per 10 minuti ciascuna con 0,1 M PBS.
- Trasferire le fette alla soluzione di substrato della perossidasi DAB (HRP) e incubare per 2-10 minuti. Quando le fette diventano grigio scuro, visualizza il tessuto con una lente d'ingrandimento o un microscopio. Se sono presenti cellule positive, sciacquare 3 volte (per 15 minuti ciascuna) con acqua di rubinetto (per ridurre lo sfondo). Lavare 3 volte per 10 minuti ciascuna con 0,1 M PBS.
- Montare con cura le fette su vetrini gelatinizzati usando una spazzola morbida, asciugare all'aria per una notte a temperatura ambiente. Controcolorazione (vedere paragrafo 7.1), aggiungere un supporto di montaggio permanente e posizionare i vetrini di copertura. Conservare a 4 °C per un massimo di 6 mesi.
- Rilevazione di BrdU mediante reazione perossidasi con il complesso avidina-biotina-perossidasi
NOTA: eseguire i passaggi da 4.2.1 a 4.2.5 il giorno 1.- Trasferire le fette dalla soluzione di crioprotezione a 0,1 M PBS per portare a temperatura ambiente. Risciacquare 3 volte per 10 minuti ciascuna con 0,1 M PBS.
- Incubare per 30 minuti con soluzione di blocco della perossidasi endogena per inattivare la perossidasi endogena. Risciacquare 3 volte per 10 minuti ciascuna in 0,1 M PBS. Facoltativamente, eseguire il recupero dell'antigene (vedere paragrafo 5).
- Incubare per 20 minuti con 2 N HCl a 37 °C. Risciacquare in tampone borato da 0,1 M (pH 8,5) per 10 minuti. Lavare 3 volte per 10 minuti ciascuna con 0,1 M PBS ghiacciato.
- Incubare per 2 ore a temperatura ambiente in PBS++ (soluzione bloccante).
- Incubare con anticorpo primario anti-BrdU (ospite del topo) 1:250 in PBS+ durante la notte a 4°C.
- Il giorno 2, risciacquare 3 volte per 10 minuti ciascuna con 0,1 M PBS.
- Incubare con 1:250 anticorpo secondario biotinilato (anti-topo) in PBS+ per 2-0124 ore a temperatura ambiente. Risciacquare 3 volte per 10 minuti ciascuna con 0,1 M PBS.
- Incubare nella soluzione ABC per 1 ora a temperatura ambiente. Risciacquare 3 volte per 10 minuti ciascuna con 0,1 M PBS.
- Trasferire le fette alla soluzione di substrato della DAB perossidasi (HRP) e incubare per 2-10 minuti. Quando le fette diventano grigio scuro, visualizza il tessuto con una lente d'ingrandimento o un microscopio. Se sono presenti cellule positive, sciacquare 3 volte (15 minuti ciascuna) con acqua di rubinetto (per ridurre lo sfondo) seguita da 3 volte con 0,1 M PBS lavare per 10 minuti ciascuna.
NOTA: la soluzione deve essere preparata immediatamente prima dell'uso. Bisogna fare attenzione per evitare che le fette di cervello si attacchino l'una all'altra a causa di macchie scure irregolari nel tessuto. - Montare con cura le fette su vetrini gelatinizzati usando una spazzola morbida e poi asciugare all'aria per una notte a temperatura ambiente.
- Contromacchia se necessario (vedere punto 7.1), aggiungere un supporto di montaggio permanente e posizionare i vetrini di copertura. Conservare a 4 °C per un massimo di 6 mesi.
- Rilevazione di BrdU mediante immunofluorescenza mediante amplificazione marcata di streptavidina-biotina (LSAB)
NOTA: eseguire i passaggi da 4.3.1 a 4.3.4 il giorno 1.- Trasferire le fette dalla soluzione di crioprotezione a 0,1 M PBS a temperatura ambiente. Risciacquare 3 volte per 10 minuti ciascuna con 0,1 M PBS. Facoltativamente, eseguire il recupero dell'antigene (vedere paragrafo 5).
- Incubare per 20 minuti in 2 N HCl a 37 °C. Risciacquare in tampone borato da 0,1 M (8,5 pH) per 10 minuti. Risciacquare 3 volte per 10 minuti ciascuna in 0,1 M PBS ghiacciato.
- Incubare per 2 ore a temperatura ambiente in PBS++ (soluzione bloccante). Incubare con l'anticorpo primario 1:250 anti-BrdU (ospite del topo) in PBS+ durante la notte a 4 °C.
- Il giorno 2, risciacquare 3 volte per 10 minuti ciascuna con 0,1 M PBS.
- Incubare con 1:250 anticorpo secondario biotinilato (anti-topo) in PBS+ per 2-0124 ore a temperatura ambiente. Risciacquare 3 volte per 10 minuti ciascuna con 0,1 M PBS. Incubare con streptavidina 1:250 coniugata al fluorocromo (Cy3) in PBS (non usare siero) per 1\u20122 h a temperatura ambiente. Risciacquare 3 volte per 10 minuti ciascuna con 0,1 M PBS.
NOTA: Il siero può contenere biotina e non deve essere aggiunto ai diluenti. Utilizzare invece PBS contenente lo 0,3% di Triton X-100. - Montare con cura le fette su vetrini gelatinizzati usando una spazzola morbida, asciugare all'aria per una notte a temperatura ambiente o montare immediatamente con un supporto di montaggio appropriato. Contromacchia (vedere punto 7.2), aggiungere un supporto di montaggio permanente e posizionare i vetrini di copertura. Conservare a 4 °C per un massimo di 6 mesi.
- Rilevazione di BrdU mediante immunofluorescenza indiretta
NOTA: eseguire i passaggi da 4.4.1 a 4.4.4 del giorno 1.- Trasferire le fette dalla soluzione di crioprotezione a 0,1 M PBS fino a raggiungere la temperatura ambiente. Risciacquare 3 volte per 10 minuti ciascuna con 0,1 M PBS. Eseguire il prelievo dell'antigene se necessario (facoltativo, vedere paragrafo 5).
- Incubare per 20 minuti in 2 N HCl a 37 °C. Risciacquare in tampone borato da 0,1 M (8,5 pH) per 10 minuti. Risciacquare 3 volte per 10 minuti ciascuna con 0,1 M PBS ghiacciato. Incubare per 2 ore a temperatura ambiente con PBS++ (soluzione bloccante). Incubare con l'anticorpo primario 1:250 anti-BrdU (ospite del topo) in PBS+ durante la notte a 4 °C.
- Il giorno 2, risciacquare 3 volte per 10 minuti ciascuna con 0,1 M PBS.
- Incubare con 1:250 anticorpi secondari coniugati con fluorocromo (anti-topo) in PBS+ per 2-0124 h a temperatura ambiente. Risciacquare 3 volte per 10 minuti ciascuna con 0,1 M PBS.
- Montare con cura le fette su vetrini gelatinizzati usando una spazzola morbida, asciugare all'aria per una notte a temperatura ambiente o montare immediatamente con un supporto di montaggio appropriato. Contromacchia (vedere punto 7.2), aggiungere un supporto di montaggio permanente e posizionare i vetrini di copertura. Conservare a 4 °C per un massimo di 6 mesi.
5. Recupero dell'antigene (facoltativo)
NOTA: Il recupero dell'antigene è un passaggio facoltativo destinato a correggere la perdita di antigenicità causata dalla fissazione che modifica la struttura terziaria e quaternaria di molti antigeni, rendendoli non rilevabili dagli anticorpi. Questo passaggio può essere aggiunto al protocollo originale.
- In un forno a microonde o a bagnomaria, preriscaldare 10 mM di tampone citrato di sodio (SCB) pH 6 a 90-201295 °C (a seconda dell'altitudine, la soluzione inizia a bollire intorno a questa temperatura). Riempire l'80% di un tubo conico da 50 mL (40 mL) con SCB preriscaldato. Trasferire le fette agli inserti di rete nel tubo conico con SCB. Coprire il tubo con un tappo a vite con fori realizzati con un ago da 18-201220 G.
- Conservare le fette per 30 minuti in SCB a 80\u201285 °C alternando cicli di riscaldamento nel microonde al livello minimo di potenza. Se necessario, riempire nuovamente il tubo conico con SCB. Trasferire le fette immediatamente dopo insieme agli inserti di rete in PBS ghiacciato da 0,1 M e risciacquare 3 volte per 10 minuti ciascuna.
6. Immunocolorazione multipla (opzionale)
NOTA: vedere la sezione introduttiva per la logica alla base di questo passaggio.
- Immunocolorazioni multiple simultanee
- Preparare un cocktail con gli anticorpi primari contro il bersaglio (ad esempio, topo anti-BrdU e coniglio anti-GFAP) in PBS +. Utilizzare ospiti diversi per ogni anticorpo primario utilizzato. Incubare per una notte a 4 °C. Continuare con gli stessi passaggi successivi per ogni protocollo.
- Preparare un cocktail con gli anticorpi secondari corrispondenti per ciascun anticorpo primario utilizzato (ad esempio, FITC anti-topo di capra, TRITC anti-coniglio di capra) nella stessa soluzione di diluente per ciascun protocollo. Continuare con gli stessi passaggi successivi per ogni protocollo. Idealmente, utilizzare anticorpi secondari che provengono dagli stessi ospiti per evitare reazioni crociate.
- Immunocolorazioni multiple sequenziali.
- Seguire il protocollo per il primo bersaglio anticorpale (ad esempio, mouse anti-BrdU) e fermarsi prima di montare le fette. Incubare per 2 ore a temperatura ambiente con PBS++ (soluzione bloccante).
- Incubare il secondo anticorpo primario (ad es. coniglio anti-GFAP) in PBS+ durante la notte a 4 °C. Seguire i passaggi successivi per ciascun protocollo, compresa l'incubazione del secondo anticorpo secondario (ad esempio, TRITC anti-coniglio di capra). Continuare con i passaggi successivi per ogni protocollo fino alla fine.
7. Controcolorazione (opzionale)
- Per i protocolli che utilizzano la reazione della perossidasi, preriscaldare la soluzione di violetto cresilico a 60 °C. Idratare i vetrini con ddH2O per 1 min. Incubare i vetrini nella soluzione calda di viola cresilico per 5-20120 min.
- Risciacquare i vetrini con ddH2O per 1 min. Risciacquare i vetrini con alcool etilico al 70%, 80%, 90% e 100% per 1-3 minuti ciascuno. Risciacquare i vetrini con xilene per 1-3 minuti.
- Aggiungere un mezzo di montaggio idrofobico permanente e posizionare i coperchi.
NOTA: Conservare a 4 °C per un massimo di 6 mesi. È possibile utilizzare supporti di montaggio autocostruiti contenenti PVA (alcool polivinilico)-DABCO.
- Per i protocolli che utilizzano l'immunofluorescenza, aggiungere un piccolo volume (25-250 μL) di mezzo di montaggio idrofilo con DAPI, ioduro di propidio o simili. Sigillare attorno al perimetro con smalto per unghie o un sigillante di plastica. Conservare a 4 °C per un massimo di 6 mesi.
8. Imaging e analisi
NOTA: Vedere la Tabella 2 per le specifiche di configurazione del microscopio. Di solito, il conteggio delle nuove cellule colorate viene effettuato utilizzando le fette colorate di reazione perossidasi (metodo più economico), ma può anche essere eseguito utilizzando l'immunofluorescenza.
- Per quantificare le cellule, in primo luogo, identificare correttamente il giro dentato con la lente di ingrandimento 4x (per ulteriori istruzioni sui dettagli anatomici DG, vedi Amaral et al.16).
- Cerca nello strato cellulare granulare del giro dentato nuclei marcati con BrdU (usando la lente di ingrandimento 40x). Eseguire la ricerca delle celle in modo esaustivo lungo l'asse z poiché le nuove celle possono essere distribuite in diversi livelli (vedere Video 1).
- Selezionare una sezione di intervallo per la ricerca cellulare in tutto il giro dentato (ad esempio, ogni 6a sezione di tessuto, equivalente a ogni 240 μm).
- Contare tutte le cellule BrdU positive. La morfologia del nucleo marcato può cambiare a seconda della quantità di BrdU incorporata dalla cellula (vedere la Figura 3 come guida). Spostarsi lentamente sull'asse z per quantificare tutti i diversi nuclei che integrano un cluster (vedere Video 2).
- Moltiplicare il numero totale di celle contate con la sezione dell'intervallo selezionata (ad esempio, 6) per stimare il numero totale di nuove celle marcate con BrdU.
- Idealmente, in un esperimento regolare, contare almeno dieci sezioni per animale e almeno cinque animali per gruppo.
- Deconvoluzione dell'immagine (opzionale)
NOTA: fare riferimento alla sezione introduttiva per informazioni importanti su questo passaggio. Questa procedura richiede immagini monocromatiche (scala di grigi). Trasforma le immagini a colori in scala di grigi. Se le immagini sono composte RGB, prima dividi i canali e uniscili come un'unica immagine (non composita), quindi trasformali in scala di grigi a 8 bit.- Creare un file z-stack da micrografie.
- Creare un file PSF (Point Spread Function) aprendo il plugin Diffraction PSF 3D (https://imagej.net/Diffraction_PSF_3D) dal menu delle opzioni Plugin . Compila tutti i dati richiesti (vedi Tabella 2). Premere OK e salvare il file.
- Apri il plugin DeconvolutionLab29 dal menu Plugin (http://bigwww.epfl.ch/deconvolution/deconvolutionlab2/). Trascinare l'immagine z-stack e il file PDF corrispondenti nello slot della finestra corrispondente.
- Selezionare l'algoritmo di deconvoluzione (ad esempio, Richardson-Lucy) e il numero di iterazioni (ad esempio, 20). Premere ESEGUI.
- Combina le immagini decontorte in un'unica immagine z-stack selezionando Pile dal menu Immagine in alto. Quindi fare clic su Progetto Z. Selezionare Intensità massima dal menu a discesa Tipo di proiezione , premere OK e salvare il file.
- Crea un'immagine RGB utilizzando il singolo file immagine z-stack creato nel passaggio precedente con lo pseudocolore desiderato selezionando Colore dal menu Immagine in alto. Quindi fare clic su Unisci canali. Imposta l'immagine corrispondente sul canale di colore desiderato dal menu a discesa. Deselezionare la casella Crea composito, premere OK e salvare il file (vedere la Figura 4).
- Se è presente più di un'immagine del canale, ripetere i passaggi 8.2.1\u20128.2.5. Creare un file immagine RGB seguendo il passaggio 8.2.6, aprendo almeno due file di immagine e selezionando canali di colore diversi per ciascun file immagine (vedere la Figura 4).
Risultati
I metodi sopra descritti sono stati applicati per quantificare le cellule neonate nell'ippocampo del ratto adulto dopo attività fisica volontaria, in contrasto con un gruppo di controllo senza alcuna attività fisica extra. Abbiamo usato l'ippocampo postnatale del ratto come controllo positivo. I ratti maschi di 3 mesi di età sono stati sottoposti a un protocollo di attività fisica volontaria (ruota infinita) per sette giorni. Il giorno 6, ai ratti è stato iniettato BrdU (sezione 2) e ogni 12 ore dopo fino a tre iniezioni complete. Per completare tre divisioni del ciclo cellulare, gli animali sono stati perfusi per via transcardica (sezione 3) 8 ore dopo l'ultima iniezione di BrdU. La stessa procedura è stata utilizzata su ratti di tre mesi che non erano sottoposti a attività fisica per essere utilizzati come controllo comparativo. Come controllo positivo, cuccioli di ratto di un giorno (giorno 1 postnatale) sono stati iniettati con BrdU una volta, come descritto nel paragrafo 2 sopra. Un giorno dopo l'iniezione (giorno postnatale 2), i cuccioli sono stati sottoposti a eutanasia e le loro teste sono state immerse in una soluzione PFA, come descritto nella fase 3.4. I ratti adulti sono stati profondamente anestetizzati (fase 3.1), perfusi transcardialmente, come descritto nella fase 3.2. I cervelli sono stati sezionati e post-fissati (fase 3.4). I cervelli sono stati tagliati in sezioni coronali da 40 μm (fase 3.5). Le sezioni sono state elaborate per l'immunoistochimica BrdU, come descritto nella fase 4.
Abbiamo usato la reazione della perossidasi di rafano con DAB IHC per la colorazione (fase 4.1) e il conteggio delle cellule BrdU-positive in DG. La figura 5 mostra una sezione DG con celle marcate con BrdU. La figura 5C,D mostra una parte rappresentativa della sezione DG ad un ingrandimento maggiore. Le cellule etichettate mostravano un'intensa colorazione scura, contrassegnata da frecce. Il riquadro mostra il numero medio di cellule marcate nei gruppi sperimentali e di controllo (le cellule positive contate moltiplicate per sei come descritto nel passaggio 8.1). Il t-test di Student ha rivelato differenze di significato tra il numero di cellule BrdU-positive (t(10) = 2.704, p = 0.0222). Il gruppo di controllo che non ha subito attività fisica ha mostrato 2.040 ± 314 cellule (n = 6 ratti). In confronto, il gruppo di attività fisica ha mostrato, in media, 3.606 ± 486 (n = 6 ratti) cellule BrdU-positive. Come osservato, l'esposizione all'attività fisica aumenta le cellule BrdU-positive. Pertanto, questi risultati sono coerenti con altri risultati riportati che mostrano che l'attività fisica ha aumentato la proliferazione cellulare nel giro dentato adulto17.
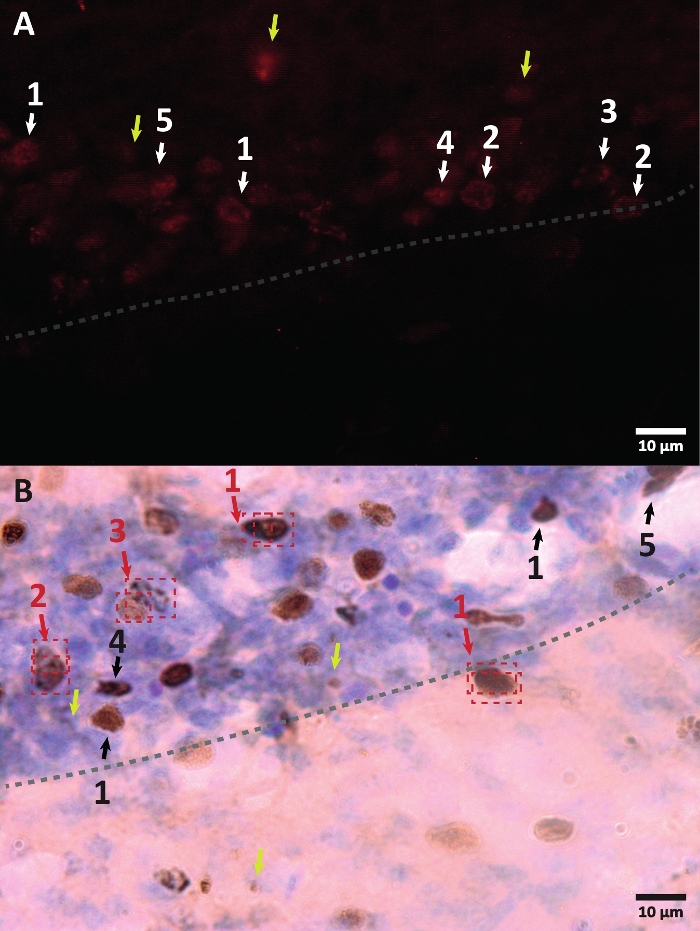
Figura 3: Esempi di diversa morfologia del nucleo cellulare marcato con BrdU. BrdU è un marcatore di sintesi del DNA che etichetta il nucleo. Nella regione dell'ippocampo, i nuclei BrdU-positivi avevano una forma semiovale situata nella zona subgranulare del giro dentato. Poiché BrdU è incorporato dalla concorrenza, la quantità incorporata per ogni cellula avrà una variazione che si rifletterà in seguito nel modo in cui il nucleo verrà visualizzato. (A) Immagine di immunofluorescenza. (B) Viene presentata un'immagine che utilizza la reazione della perossidasi senza un metodo di amplificazione aggiuntivo. Le frecce gialle mostrano artefatti e segnali non specifici. Le frecce bianche o nere mostrano le celle BrdU+. 1 – Nucleo completamente archiviato, nuclei semiovali altamente colorati. 2 – Nuclei con punti, il bordo dei nuclei è segnato e ha al suo interno diversi punti. 3 – Nuclei con pochi punti, il bordo dei nuclei è segnato e ha un piccolo numero di punti all'interno. 4 – Piccolo nucleo è possibile cellule in un diverso stadio di differenziazione ma ancora parte della nicchia. 5 – I cluster sono cellule precursori sotto divisione, quindi si possono osservare diverse cellule insieme in gruppi condensati. All'interno di questi gruppi, il conteggio deve essere fatto con particolare attenzione per evitare errori di etichettatura delle cellule positive. Le frecce rosse mostrano il nucleo sotto divisione che può essere confuso come una singola cellula. Ogni cella è racchiusa in una scatola e può essere distinta in un piano dell'asse Z in tempo reale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
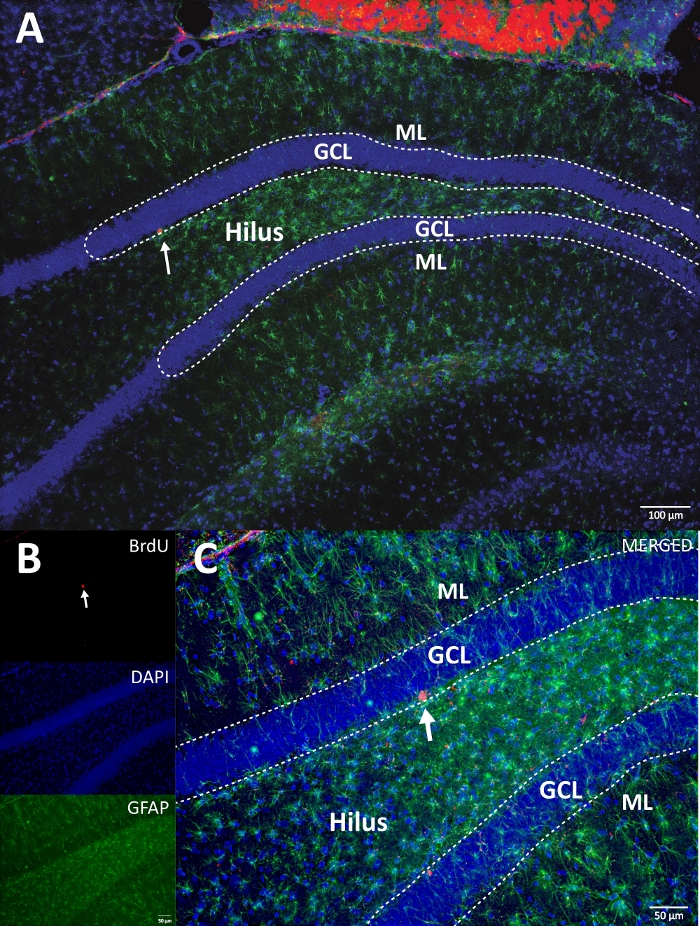
Figura 4: Immagine RGB rappresentativa per canali singoli e uniti. L'immagine superiore mostra l'immagine z-stack originale e l'immagine inferiore mostra l'immagine z-stack deconvoluta 3D. (A) Basso ingrandimento della DG. (B) immagine RGB per ciascun canale e (C) immagine RGB unita. Questo era un cervello del gruppo di controllo. L'immunofluorescenza è stata utilizzata senza un metodo di amplificazione aggiuntivo. BrdU (rosso), DAPI come controcolorazione (blu) e GFAP (proteina acida fibrillare gliale) come marcatore astrogliale (verde). ML = strato molecolare; GCL = strato cellulare granulare; SGZ = zona subgranulare. Fare clic qui per visualizzare una versione ingrandita di questa figura.
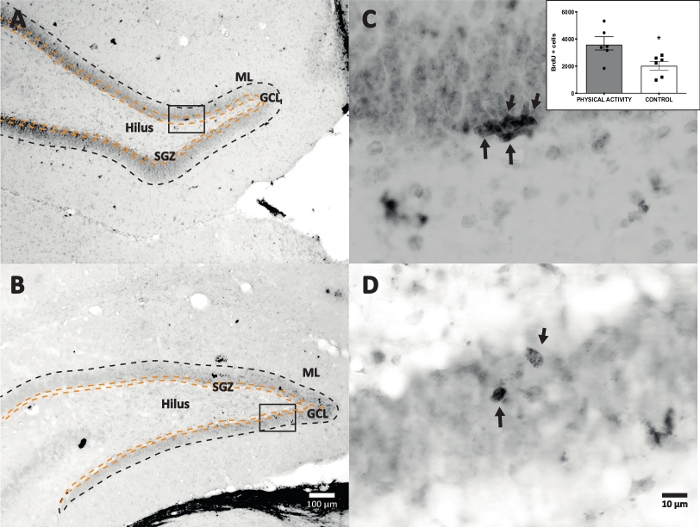
Figura 5: Sezione DG rappresentativa con cellule marcate con BrdU (scuro intenso) per ciascun gruppo sperimentale. La reazione della perossidasi è stata utilizzata con il metodo di amplificazione del complesso avidina-biotina-perossidasi. (A, B) Mostra un basso ingrandimento del DG, e (C, D) mostra l'area della scatola a un ingrandimento maggiore. I pannelli A e C sono tessuti del gruppo di attività fisica, i pannelli B e D provengono dal gruppo di controllo. Il riquadro mostra il numero medio di cellule marcate nei gruppi di attività fisica e di controllo (le cellule positive contate moltiplicate per sei come descritto nel passaggio 8.1). ML = strato molecolare; GCL = strato cellulare granulare; SGZ = zona subgranulare; le frecce indicano le celle BrdU+. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Video 1: Video che mostra un diverso fuoco delle celle positive lungo l'asse z distribuite in diversi strati. Clicca qui per scaricare questo video.
Video 2: Video che mostra un diverso focus di cluster di celle positive lungo l'asse z distribuiti in diversi strati. Spostarsi lentamente sull'asse z per quantificare tutti i diversi nuclei che integrano un cluster. Clicca qui per scaricare questo video.
| Tipo di microscopio: | Microscopio a epifluorescenza Olympus BX53 | ||||
| Sorgente luminosa: | Lampada ad arco di mercurio ad alta pressione da 130 W (U-HGLGPS) | ||||
| Software di acquisizione: | CellSens Standard | ||||
| Set di filtri: | Numero di catalogo | Gamma di eccitazione | Specchio dicromatico | Intervallo di soppressione | |
| U-FUW | 340 - 490 nm | 410 nm | 420 nm | ||
| U-FBW | 460 - 495 nm | 505 nm | 510 nm | ||
| U-FGW | 530 - 550 nm | 570 nm | 575 nm | ||
| Macchina fotografica: | Modello: | Telecamera CCD UC50 | |||
| Gamma spettrale: | 290 – 1000 nm | ||||
| Dimensione del chip CCD: | 2/3 in, 2588 (larghezza *7) x 1960 (altezza *8) pixel | ||||
| Dimensione pixel: | 3,4 X 3,4 μm | ||||
| Fluorocromo: | Nome | Lunghezza d'onda di eccitazione (nm) | Emissione *3 Lunghezza d'onda (nm) | Colore di emissione | |
| 4, 6-diamidino-2-fenil-indolo HCI (DAPI) | 345 | 455 | Blu | ||
| Tetrametilrhodamine-isotiocianato (TRITC) | 541 | 572 | Rosso | ||
| Fluoresceina-isotiocianato (FITC) | 494 | 519 | Verde | ||
| Cy3 | 552 | 565 | Rosso | ||
| Mezzo di montaggio e olio ad immersione: | Nome | Indice di rifrazione del mezzo *1 | |||
| Aria (niente tra la slitta e l'obiettivo) | 1.00029 | ||||
| Supporto di montaggio antisbiadimento con DAPI | 1.45 | ||||
| Supporto di montaggio per montaggio | 1.519 | ||||
| Olio ad immersione a bassa autofluorescenza (MOIL-30 Tipo F) | 1.518 | ||||
| Lente di ingrandimento (fluorite piano) | Ingrandimento | Apertura numerica (NA) *2 | Risoluzione (μm) | Spaziatura pixel immagine (nm) *5 | Asse Z di spaziatura delle sezioni (nm) *6 |
| 4 volte | 0.13 | 2.12 | 850 | 3000 | |
| 10 volte | 0.3 | 0.92 | 340 | 3000 | |
| 20 volte | 0.5 | 0.55 | 170 | 2000 | |
| 40 volte | 0.75 | 0.37 | 85 | 1000 | |
| 100X | 1.3 | 0.21 | 34 | 1000 | |
Tabella 2: Specifiche di configurazione del microscopio e requisiti per la creazione di file PSF (Point Spread Function). Ci sono 11 slot nella finestra del plugin PSF 3D di diffrazione per creare il file PSF. Ogni slot è descritto come segue: *1 - Indice di rifrazione del supporto: indice di rifrazione per il mezzo tra il vetrino e la lente (ad esempio, aria = 1,00029). *2 - Apertura numerica: NA dell'obiettivo utilizzato (deve essere corretto quando viene utilizzato un mezzo di immersione diverso e l'obiettivo è stato assegnato). *3 - Lunghezza d'onda: lunghezza d'onda di emissione massima (nm) del fluorocromo. *4 - Aberrazione sferica longitudinale: 0,00. *5 - Spaziatura pixel immagine: dimensione pixel CCD (nm)/ingrandimento (ad esempio, 3,4 μm e obiettivo 100X, 3400/100 = 34 nm). *6 - Distanza tra le immagini sull'asse Z. *7 - Larghezza: inserisci la larghezza dell'immagine da deconvolvare in pixel. *8 - Altezza: inserisci l'altezza dell'immagine da deconvolvare in pixel. *9 - Profondità, sezioni: il numero di immagini nello z-stack. *10 - Normalizzazione: somma dei valori dei pixel = 1. *11 - Titolo: Nome desiderato per il file PSF. Il file deve corrispondere all'immagine z-stack specificata in modo univoco.
Discussione
La neurogenesi adulta è un processo che si verifica più frequentemente in nicchie di cellule precursori neurali adulte che hanno il potenziale per generare nuovi neuroni per tutta la loro vita. L'etichettatura della bromodeossiuridina (BrdU) è ampiamente utilizzata in immunologia per caratterizzare il numero di cellule appena generate in un cervello adulto. BrdU sarà principalmente incorporato in cellule di regioni cerebrali discrete (zone neurogeniche). Queste cellule si trovano nella zona sub-ventricolare (SVZ), il giro dentato dell'ippocampo, tra l'ilo e le cellule granulari note come zona subgranulare (SGZ)1,2,18. Inoltre, ci sono diverse regioni del cervello caratterizzate da una minore capacità proliferativa in età adulta, tra cui l'ipotalamo, lo striato, la neocorteccia e l'amigdala19. Come accennato in precedenza, la colorazione BrdU è il metodo comunemente usato per la ricerca sulla neurogenesi adulta per rilevare la proliferazione cellulare. Tuttavia, l'uso di BrdU come marcatore ha limiti e insidie. Il primo è che BrdU è un marcatore del ciclo cellulare. Pertanto, deve essere eseguita una doppia o tripla colorazione per identificare il destino cellulare e includere marcatori cellulari per rilevare lo specifico stadio di sviluppo delle cellule etichettate. Un'altra preoccupazione su BrdU è che è una soluzione tossica e mutagena che modifica la stabilità del DNA può alterare la funzione cellulare e i cicli cellulari. Quando si decide di seguire un protocollo di somministrazione e di somministrare le dosi (50-000 mg/kg), devono essere prese in considerazione le informazioni precedenti. Un'altra caratteristica cruciale è che BrdU è un marcatore di sintesi del DNA, non un marcatore di proliferazione cellulare14. Pertanto, è importante distinguere la proliferazione cellulare da altri eventi come la riparazione del DNA, il rientro abortivo del ciclo cellulare e la duplicazione genica. I ricercatori devono seguire controlli appropriati per garantire l'uso appropriato di BrdU. Per una discussione più dettagliata su questi problemi e limitazioni, si consiglia di rivedere il lavoro di Taupin14. Il processo di standardizzazione di un protocollo immunoistochimico potrebbe essere lento e impegnativo. In questo lavoro, abbiamo presentato tutti i passaggi generali per gestire un protocollo IHC di successo. Tuttavia, raccomandiamo che ogni gruppo di ricerca verifichi e valuti in anticipo tessuti, anticorpi e condizioni. I test e le valutazioni devono essere effettuati con almeno tre diversi livelli di incubazione, fasi di lavaggio e dosaggi per ogni anticorpo e tessuto testato. Raccomandiamo inoltre ai ricercatori di rivedere protocolli aggiuntivi per essere in grado di scegliere il migliore che soddisfi esigenze e requisiti specifici 20,21,22,23,24,25.
Come accennato in precedenza, la procedura prevede diversi passaggi e considerazioni metodologiche che sono comunemente usati e menzionati in articoli scientifici, che saranno successivamente discussi. Raccomandiamo ai ricercatori di scegliere gli anticorpi con attenzione e correttezza in termini di tecnica, budget, attrezzature, configurazione e obiettivo principale della ricerca. Gli anticorpi devono essere testati con lo stesso tipo di tessuto che sarà successivamente testato nell'esperimento. Raccomandiamo anche l'uso di un anticorpo che è stato testato per lo stesso scopo (IHC) (cioè, non solo nelle tecniche di western blot o citometria a flusso) per testare la sua compatibilità con la tecnica di fissazione. Diverse vie potrebbero essere utilizzate per somministrare la colorazione BrdU come iniezione intraperitoneale, infusione intraperitoneale, ingestione orale o infusione intraventricolare (per una descrizione più dettagliata di ciascuna tecnica, vedere riferimento26). Se viene selezionata l'iniezione intraperitoneale, assicurarsi che BrdU sia somministrato nella cavità peritoneale evitando l'area intestinale. Poiché l'intestino ha diverse cellule in duplicazione che possono esaurire il BrdU prima che arrivi al cervello che influenzerà il numero di cellule marcate. È fondamentale ottenere sezioni sottili poiché consentono una migliore penetrazione delle soluzioni. Fette coronali di 40 μm di spessore sono state tagliate rostro-caudalmente e sono state trasferite in una piastra di coltura cellulare a 24 pozzetti, seguendo la procedura stereologica proposta da Kempermann et al.27. L'immunoistochimica può essere effettuata con tessuto montato su vetrini o come sezioni fluttuanti. Poiché BrdU si trova in profondità nei nuclei delle cellule, consente la penetrazione di soluzioni in sezioni fluttuanti che forniscono risultati migliori e un migliore accesso all'area di interesse. È importante aprire legami DNA (denaturazione del DNA) per consentire l'accesso all'anticorpo anti-BrdU primario. In questo lavoro, abbiamo eseguito queste procedure specifiche con l'uso dell'incubazione HCI. D'altra parte, il processo di blocco di epitopi non specifici ha permesso un'identificazione più accurata del segnale cellulare.
La buona permeabilizzazione della membrana consente agli anticorpi di penetrare correttamente nell'area di interesse. L'aggiunta di un permeabilizzatore come Triton X-100 alle soluzioni PBS++ e PBS+ migliora la permeabilizzazione della membrana. Entrambi i reagenti PBS e Tris-buffered saline (TBS) possono essere utilizzati in questo protocollo. In termini di budget, il TBS potrebbe essere relatività più economico del PBS. Tuttavia, il PBS potrebbe interferire con gli anticorpi anti-fosfato e inibire gli anticorpi coniugati con fosfatasi alcalina, quindi evitare l'uso di PBS se il bersaglio è modificato post-traduzionalmente dalla fosforilazione (cioè fosforilato). Abbiamo usato il PBS per questo lavoro e abbiamo scoperto che le fasi di lavaggio dei tessuti davano un segnale più specifico. Raccomandiamo inoltre ai ricercatori di eseguire almeno tre cicli di lavaggio utilizzando TBS o PBS. Le soluzioni devono essere preparate al momento. Il recupero dell'antigene (AR) è un metodo destinato a ridurre la perdita di antigenicità causata dalla fissazione che modifica la struttura degli antigeni terziari e quaternari. Questa riduzione rende gli antigeni non rilevabili dagli anticorpi28,29. Il recupero epitopico indotto dal calore (HIER) utilizzato in questo protocollo ha tentato di invertire le reazioni chimiche tra formaldeide e proteine mediante alta temperatura o forte idrolisi alcalina (con altre soluzioni tampone come EDTA pH 8,5 o Tris pH 9,5). È essenziale testare nuovi anticorpi con diversi protocolli AR per confrontare i risultati e scegliere quello migliore per il protocollo. Quest'ultimo passaggio potrebbe essere facoltativo in un protocollo regolare; Tuttavia, abbiamo trattato i tessuti con un protocollo di recupero dell'antigene per fornire risultati migliori per questo protocollo.
È fondamentale selezionare il colore di contrasto finale corretto e la tecnica della controcolorazione in considerazione del colore di colorazione primario e del metodo utilizzato per rendere visibile una struttura non colorante ed evitare di mascherare il colore di colorazione primario dalla reazione immunitaria. Per la microscopia a fluorescenza, il DAPI (4', 6-diamidino-2-fenilindolo) è una controcolorazione nucleare e cromosomica molto popolare che emette fluorescenza blu (assorbimento: 360 nm, emissione: 460 nm) quando si lega alle regioni AT del DNA. Il supporto di montaggio contenente DAPI è disponibile ed è facile da usare; Ciò fornisce un'eccellente ritenzione del segnale per l'acquisizione delle immagini. Per la reazione del perossido, IHC era disponibile in diverse opzioni come il viola cresilico, l'ematossilina, il rosso neutro o la colorazione verde metile. Per le tecniche di immunocolorazione multiple, è fondamentale scegliere un anticorpo compatibile con la tecnica di fissazione utilizzata per evitare la cross-reattività30. Quando vengono risolti problemi e complicazioni con la colorazione singola, somministrare un'altra colorazione di colore come ritenuto necessario. È fondamentale controllare il legame non specifico tra gli anticorpi secondari. Questo potrebbe essere fatto saturando gli anticorpi primari prima di utilizzare un anticorpo secondario prodotto nella stessa specie ospite degli anticorpi primari. Ad esempio, quando si utilizza anti-topo prodotto nel coniglio e anti-coniglio prodotto in anticorpi secondari di capra, l'anti-coniglio prodotto nell'anticorpo di capra deve essere utilizzato prima dell'anticorpo anti-topo prodotto nell'anticorpo del coniglio. Quando il metodo sequenziale è dominato completamente, è possibile avviare il processo di immunocolorazione simultanea. In questo metodo, è essenziale scegliere gli anticorpi secondari in modo appropriato. Idealmente, tutti questi anticorpi devono provenire dallo stesso animale ospite per evitare la cross-reattività. Si consiglia di eseguire un controllo positivo per confermare che il metodo di colorazione funzioni accuratamente nel tessuto dell'ippocampo postnatale (abbondante neurogenesi intorno a questa età). Se il tessuto di controllo positivo mostra problemi di colorazione, rivedere e rivedere la procedura, apportare correzioni e regolazioni e ripetere fino a quando non viene prodotta una buona colorazione. Quindi, eseguire un controllo negativo per verificare che l'anticorpo funzioni correttamente omettendo o sostituendo un particolare anticorpo primario con siero normale (stessa specie dell'anticorpo primario). Come accennato nell'introduzione, la deconvoluzione delle immagini è uno strumento potente e fornisce un'alternativa quando non è disponibile un microscopio confocale. Può applicare la deconvoluzione dell'immagine a tutte le immagini ottenute utilizzando la microscopia a luce luminosa trasmessa, fluorescenza a campo ampio e fluorescenza confocale. Lo scopo ultimo della deconvoluzione dell'immagine è quello di ricostruire il segnale originale che il sistema di acquisizione si deteriora10.
In sintesi, l'identificazione delle cellule appena generate visualizzate dall'immunorilevazione dell'analogo della timidina BrdU è una tecnica complicata ma potente. Questo lavoro è un tentativo di aiutare gli scienziati, in particolare nel campo della neurogenesi ippocampale adulta, a quantificare le nuove cellule in modo più accurato. Speriamo che questo sforzo sia stato utile alla comunità scientifica e renda più facile mettere a punto lo studio della proliferazione cellulare con la tecnica immunoistochimica.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il Sig. Miguel Burgos e Gustavo Lago per l'assistenza tecnica. Vogliamo anche ringraziare la Dott.ssa Clorinda Arias, la Dott.ssa Karla Hernandez e il Dott. Oscar Galicia per il loro gentile supporto nel fornire reagenti e materiale. Ringraziamo anche la División de Investigación y Posgrado dell'Universidad Iberoamericana Ciudad de México per aver fornito finanziamenti per l'esecuzione di questo lavoro e per coprire le spese di produzione video.
Materiali
| Name | Company | Catalog Number | Comments |
| REAGENT PREPARATION AND SETUP | |||
| Donor Horse Serum | BioWest | S0900 | Blocking and incubation solutions in PBS |
| Paraformaldehyde reagent grade, crystalline (PFA) | Sigma-Aldrich | P6148 | toxic, flammable |
| Potassium Chloride | Sigma-Aldrich | 746436-500G | |
| Potassium Phosphate, monobasic | J.T Bker | 3246-01 | |
| Sacarose | J.T Baker | 4072-01 | |
| Sodium Chloride | Meyer | 2365-500G | |
| Sodium Hydroxide | Sigma-Aldrich | S5881-500G | Corrisive, to calibrate pH |
| Sodium Phophate Dibasic | Sigma-Aldrich | S9763-5KG | |
| Triton-x 100 | Sigma-Aldrich | T8787 | |
| THYMIDINE ANALOGUE BRDU ADMINISTRATION | |||
| 5-Bromo-2′-deoxyuridine, BrdU | Sigma-Aldrich | B9285 | toxic (mutagenic, teratogenic) |
| 23–27G hypodermic needle | BD PrecisionGlide | ||
| Saline solution | PiSA | 30130032 | |
| Syringes 1 mL | NIPRO | ||
| TISSUE PREPARATION | |||
| 15-ml polypropylene conical tube | Thermo Scientific | 339650 | |
| 50-ml polypropylene conical tube | Thermo Scientific | 339652 | |
| Dissecting tools | |||
| Guillotine | Stoelting | ||
| Microtome Cryostat | MICROM | HM525 | |
| Netwell 15 mm polyester mesh membrane inserts | Corning | 3477 | pre-loaded in 12-well culture plates |
| Netwell plastic 12-well carrier kit | Corning | 3520 | for 15 mm polyester mesh membrane inserts |
| Netwell plastic 6-well carrier kit | Corning | 3521 | |
| Perfusion pump | Cole-Parmer | 7553-70 | |
| Shaker | IKA | ROKCER 3D Digital | |
| IMMUNOSTAINING | |||
| Cresyl violet | Sigma-Aldrich | C5042 | 1%, Light sensitive |
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | Vector Laboratories | SK-4100 | carcinogenic, light sensitive |
| Hydochloric Acid | J.T.Baker | 9535-05 | Corrosive, to calibrate pH |
| Hydrogen Peroxide, 50% | Meyer | 5375-1L | Toxic, oxidative |
| Permount Mounting Medium | Fisher Chemical | SP15-500 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | Light sensitive |
| VECTASTAIN® Elite® ABC Kit Peroxidase (HRP) | Vector Laboratories | PK-6100 | enzymatic, avidin/biotin based amplification system |
| Primary antibodies | |||
| Anti-GFAP antibody produced in rabbit | Sigma-Aldrich | HPA056030 | 1:500 |
| Monoclonal Anti-BrdU antibody produced in Mouse | Sigma-Aldrich | B2531 | 1:250 |
| Secondary antibodies | |||
| Biotin-SP (long spacer) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-065-151 | 1:250 |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, HRP | Invitrogen | G-21040 | 1:1000 |
| Goat Anti-Mouse IgG (whole molecule), TRITC | Sigma-Aldrich | T5393 | 1:250 |
| Goat Anti-Rabbit IgG (H+L) Cross-Adsorbed, FITC | Invitrogen | F-2765 | 1:250 |
| Streptavidin, Cy3 | Vector Laboratories | SA-1300 | 1:250 |
| IMAGING AND ANALYSIS | |||
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| CCD-camera | Olympus | UC50 | |
| CellSens Standard software | Olympus | cellSens Standard Edition | Acquisition Software |
| Epifluorescent microscope | Olympus | BX53 | |
| High-pressure 130 W mercury arc lamp | Olympus | U-HGLGPS | |
| low autofluorescence immersion oil | Olympus | MOIL-30 Type F | |
| Micro cover-glasses (VWR, cat no 48404 454; 24 60 mm) | |||
| Microscope slides (VWR, cat no 48323-185; 76 26 mm) | |||
| U-FBW filter cube | Olympus | U-FBW | excitation 460 - 495 nm, dichroic mirror 505 nm, suppression 510 nm |
| U-FGW filter cube | Olympus | U-FGW | excitation 530 - 550 nm, dichroic mirror 570 nm, suppression 575 nm |
| U-FUW filter cube | Olympus | U-FUW | excitation 340 - 490 nm, dichroic mirror 410 nm, suppression 420 nm |
Riferimenti
- Altman, J. Are new neurons formed in the brains of adult mammals. Science. 135 (3509), 1127-1128 (1962).
- Altman, J., Das, G. D. Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. The Journal of Comparative Neurology. 124 (3), 319-335 (1965).
- Miller, M. W., Nowakowski, R. S. Use of bromodeoxyuridine-immunohistochemistry to examine the proliferation, migration and time of origin of cells in the central nervous system. Brain Research. 457 (1), 44-52 (1988).
- Eriksson, P. S., et al. Neurogenesis in the adult human hippocampus. Nature Medicine. 4 (11), 1313-1317 (1998).
- Filippov, V., et al. Subpopulation of nestin-expressing progenitor cells in the adult murine hippocampus shows electrophysiological and morphological characteristics of astrocytes. Molecular and Cellular Neuroscience. 23 (3), 373-382 (2003).
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends in Neurosciences. 27 (8), 447-452 (2004).
- Matiašová, A., et al. Flow cytometric determination of 5-bromo-2'-deoxyuridine pharmacokinetics in blood serum after intraperitoneal administration to rats and mice. Histochemistry and Cell Biology. 142 (6), 703-712 (2014).
- Von Bohlen Und Halbach, O. Immunohistological markers for proliferative events, gliogenesis, and neurogenesis within the adult hippocampus. Cell and Tissue Research. 345 (1), 1-19 (2011).
- Sage, D., et al. DeconvolutionLab2: An open-source software for deconvolution microscopy. Methods. 115, 28-41 (2017).
- Manz, W., Arp, G., Schumann-Kindel, G., Szewzyk, U., Reitner, J. Widefield deconvolution epifluorescence microscopy combined with fluorescence in situ hybridization reveals the spatial arrangement of bacteria in sponge tissue. Journal of Microbiological Methods. 40 (2), 125-134 (2000).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with imageJ. Biophotonics International. 11 (7), 36-41 (2004).
- Giannini, A., Giannini, J. 2D and 3D Fluorescence Deconvolution Manual. , Available from: https://pages.stolaf.edu/wp-content/uploads/sites/803/2016/12/Giannini_Giannini_Deconvolution_Manual_20161215.p (2016).
- Taupin, P. BrdU immunohistochemistry for studying adult neurogenesis: Paradigms, pitfalls, limitations, and validation. Brain Research Reviews. 53 (1), 198-214 (2007).
- Revilla, V., Jones, A. Cryostat sectioning of brains. International Review of Neurobiology. 47, 61-70 (2002).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in brain research. 163, 3-22 (2007).
- Eadie, B. D., Redila, V. A., Christie, B. R. Voluntary exercise alters the cytoarchitecture of the adult dentate gyrus by increasing cellular proliferation, dendritic complexity, and spine density. Journal of Comparative Neurology. 486 (1), 39-47 (2005).
- Leal-Galicia, P., Romo-Parra, H., Rodríguez-Serrano, L. M., Buenrostro-Jáuregui, M. Regulation of adult hippocampal neurogenesis exerted by sexual, cognitive and physical activity: An update. Journal of Chemical Neuroanatomy. 101, 101667(2019).
- Gould, E. How widespread is adult neurogenesis in mammals. Nature Reviews Neuroscience. 8 (6), 481-488 (2007).
- Ngwenya, L. B., Peters, A., Rosene, D. L. Light and electron microscopic immunohistochemical detection of bromodeoxyuridine-labeled cells in the brain: Different fixation and processing protocols. Journal of Histochemistry and Cytochemistry. 53 (7), 821-832 (2005).
- Ansorg, A., Bornkessel, K., Witte, O. W., Urbach, A. Immunohistochemistry and multiple labeling with antibodies from the same host species to study adult hippocampal neurogenesis. Journal of Visualized Experiments. (98), e52551(2015).
- Tuttle, A. H., et al. Immunofluorescent detection of two thymidine analogues (CldU and IdU) in primary tissue. Journal of Visualized Experiments. (46), e2166(2010).
- Tischler, A. S. Triple immunohistochemical staining for bromodeoxyuridine and catecholamine biosynthetic enzymes using microwave antigen retrieval. Journal of Histochemistry and Cytochemistry. 43 (1), 1-4 (1995).
- Taupin, P. Protocols for studying adult neurogenesis: Insights and recent developments. Regenerative Medicine. 2 (1), 51-62 (2007).
- Leuner, B., Glasper, E. R., Gould, E. Thymidine analog methods for studies of adult neurogenesis are not equally sensitive. Biosystems. 517 (2), 123-133 (2010).
- Magavi, S. S., MacKlis, J. D. Identification of newborn cells by BrdU labeling and immunocytochemistry in vivo. Methods in Molecular Biology. 438, 335-343 (2008).
- Kempermann, G., Gast, D., Kronenberg, G., Yamaguchi, M., Gage, F. H. Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice. Development. , 391-399 (2003).
- Ramos-Vara, J. A., Beissenherz, M. E. Optimization of immunohistochemical methods using two different antigen retrieval methods on formalin-fixed, paraffin-embedded tissues: Experience with 63 markers. Journal of Veterinary Diagnostic Investigation. 12 (4), 307-311 (2000).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Wojtowicz, J. M., Kee, N. BrdU assay for neurogenesis in rodents. Nature Protocols. 1 (3), 1399-1405 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon