Method Article
チミジン類似体BrdUを用いたラットの細胞増殖と神経新生を解析するための免疫組織化学技術
* これらの著者は同等に貢献しました
要約
この論文では、ラットの成体神経新生を測定するためにBrdU陽性細胞を視覚化するための最も一般的な4つの技術を紹介します。この作業には、試薬調製、チミジンアナログ投与、経心灌流、組織調製、ペルオキシダーゼ免疫組織化学反応、免疫蛍光、シグナル増幅、対比染色、顕微鏡イメージング、および細胞分析の指示が含まれます。
要約
成体海馬神経新生(AHN)の分野で最も重要なことの1つは、新しく生成された細胞の同定です。チミジン類似体(5-ブロモ-2'-デオキシウリジン(BrdU)など)の免疫検出は、これらの新しく生成された細胞を視覚化するために使用される標準的な技術です。したがって、BrdUは通常、小動物に腹腔内に注射されるため、チミジン類似体はDNA合成中に分裂細胞に取り込まれます。検出は、脳スライスの免疫組織化学的分析によって行われる。この技術を使用しているすべての研究グループは、染色を成功させるために細部に特別な注意を払う必要があることを理解できます。たとえば、重要なステップはHClによるDNA変性であり、これにより細胞核に到達して染色することができます。しかし、既存の科学報告では、そのようなステップのほとんどが詳細に説明されていません。したがって、技術の標準化は、ポジティブで成功した結果が得られるまでに数か月かかる可能性があるため、新しいラボでは困難です。この作業の目的は、チミジン類似体BrdUを使用する場合に、免疫染色技術の肯定的で成功した結果を得るための手順を詳細に説明し、詳しく説明することです。プロトコルには、試薬の調製とセットアップ、げっ歯類へのチミジン類似体の投与、経心灌流、組織調製、ペルオキシダーゼ免疫組織化学反応、アビジン-ビオチン複合体の使用、免疫蛍光、対比染色、顕微鏡イメージング、および細胞分析が含まれます。
概要
新しいニューロンが生涯を通じて成人の脳に生成されるという考えは、何十年にもわたって科学界を魅了してきました。脳がその寿命を通じて新しいニューロンを生成するという知識は、分裂下の細胞の検出によって達成されました1,2。成人脳で新たに生成されたニューロンの検出は、ラットにトリチウム化チミジン(チミジン-H3)を頭蓋内注射し、オートラジオグラムによって細胞周期の細胞を検出することによって最初に同定されました1,2。グリアの細胞分裂と神経芽細胞の存在が報告され、これは出生後の神経新生に関する最初の有望なデータでした1。それにもかかわらず、チミジン-H3の使用と検出は放射能の使用を意味し、それはそれを管理する人々に有害である可能性があります。神経系における細胞の増殖、遊走、および起源の研究におけるBrdU免疫組織化学の適合性を調べる最初の取り組みは、1988年にMillerとNowakowskiによって登場しました3。1998年、Erikssonらが発表した論文は、5-ブロモ-2'-デオキシウリジン(BrdU)4を注射された患者のヒト成人脳の死後、新しいニューロンが視覚化されることを示しました。これらの患者は、腫瘍の成長を標識するためにBrdU注射(250 mgの静脈内投与)を受けました4。この手法は動物モデルに採用されました。これらの方法の導入は、放射性化合物を使用せずに新たに生成された細胞の検出を可能にしたため、この分野にとって画期的な出来事となりました。この手順は、この分野でのさらなる研究を促進するために、成人の脳ニッチにおける細胞増殖を測定するためのゴールドスタンダードになりました。
チミジン類似体技術の制限は、新たに生成された細胞についての細胞同一性の決定を可能にしないことである。しかし、免疫組織化学は、同じ細胞を二重または三重に標識する技術を行うことを可能にし、新しく生成された細胞の細胞運命、さらには成熟段階を検証し、分野のさらなる進化につながります。この方法は、新しく生成された細胞をグリア、未分化ニューロン、または完全に成熟した顆粒細胞に分化させ、さらにはそれらが回路に積極的に関与しているかどうかを判断することを特徴としていました。この分野におけるもう一つのブレークスルーは、ネスチンのドメイン下にある未分化細胞を同定するためのトランスジェニックモデルの使用でした。ネスチン-GFPトランスジェニックマウスは、ネスチンプロモーターの制御下にある増強された緑色蛍光タンパク質(GFP)を発現します。ネスチンは、前駆細胞5を特徴とする中間径フィラメントである。ネスチン-GFPトランスジェニックマウスにより、神経新生に関与する初期の発生ステップを確立することができました6。しかし、重要な制限は、一部の科学グループ、特に発展途上国の科学グループにとって費用効果が高くなる実験施設で、特別な条件下でネスチン-GFPトランスジェニックマウスコロニーを維持できることです。
上記の手法には長所と短所があります。しかし、免疫組織化学(IHC)による増殖細胞の同定と、細胞成熟段階または細胞運命を特定するための免疫蛍光による二重または三重標識技術を実行する可能性は、これまでのところ、成体の神経新生を測定する最も実行可能な方法です。免疫組織化学を用いた同定プロセスは、タンパク質、タンパク質ドメイン、またはヌクレオチドを、一次抗体として知られるそれらの認識を可能にする特異的抗体で標識することからなる。後者は二次抗体によって認識され、二次抗体と結合した色原体(例えば、西洋ワサビペルオキシダーゼ)または蛍光色素(例えば、FITC)でマークされる。顕微鏡は、色原体と蛍光色素の両方のシグナルを検出できます。IHCを用いて、膜タンパク質、細胞骨格タンパク質、またはBrdUなどの核成分を同定することができる。一方、BrdUは競合によってS期にDNAに取り込まれるため、細胞核に見出すことができる。したがって、重要なステップはHClによるDNA変性であり、これによりDNA結合が開き、BrdU抗体がDNA内のBrdUにアクセスできるようにします。BrdUは、腹腔内投与後、それぞれ15分および60分間、マウスおよびラット血清中に飽和濃度で存在し、その後、それぞれ60分および120分で検出不能レベルまで急速に低下することを知ることが不可欠である7。
ここでは、西洋ワサビペルオキシダーゼ(HRP)とDAB(3,3'-ジアミノベンジジン)サンシグナル増幅(ステップ4.1)を用いた発色間接検出(ステップ4.1)、アビジン-ビオチン複合体(ABC)増幅(ステップ4.1)、シグナル増幅なしの間接免疫蛍光検出(ステップ4.4)、標識ストレプトアビジン-ビオチン(LSAB)増幅(ステップ4.3)の4つの異なるが密接に関連するIHC技術について説明します。それぞれの方法には長所と短所があり、特定の組織要件に役立つ可能性があります( 表1を参照)。非結合一次抗体を使用する場合、発色検出法から蛍光検出法に変更するために、手頃な価格で簡便であるため、間接ICH法を採用することにしました。HRPアプローチは、その手頃な価格、高い安定性、高い回転率、および基質の完全な可用性のために、一般的に使用されるIHC方法です。それでも、染色法が正確に機能することを確認するためにポジティブコントロールを使用し、抗体の機能を効果的にテストするためにネガティブコントロールを使用することをお勧めします。複数の免疫染色またはマルチプレックスIHC法(ステップ6を参照)は、1回の実験で組織切片から大量のデータを取得するための強力なツールです。この手法は、サンプルの入手可能性が限られている場合に特に重要です。別の利点は、組織の完全性を維持しながら、同じ細胞空間で共発現する特定のタンパク質を同時に同定できることです。マルチプレックスは、特定の増殖段階(例えば、ネスチン、GFAP、DCX、Ki-67)の間に発現する異なるマーカーを染色することを可能にし、より詳細な増殖および分化研究に到達することを可能にする8。交差反応性を避けるために、使用される固定技術に適合する抗体を選択することが重要です。新しい抗体(BrdUを含む)を個別にテストして、メソッドを調整および改良することをお勧めします。次に、二重逐次染色を導入し、最後に、逐次法が完全に支配的になったときに同時免疫染色プロセスを開始します。この方法には、適切な二次抗体を選択することが重要です。
| 方式 | 具体的な方法 | 利点 | 欠点 |
| 間接検出方式 | DABとのペルオキシダーゼ反応 | 1.直接検出および間接蛍光法よりも高感度。 2.蛍光色素よりも光退色に対する耐性が高い。 3. 蛍光検出法よりも低コスト | 1.より少ない色の染料で多重化することは困難である。 2.同じ細胞空間で共発現したターゲットに対して複雑です。 3.同じ組織上の希少なターゲットと豊富なターゲットを同時に行うためのダイナミックレンジの縮小。 |
| 蛍光 | 1.より多くの色の染料を使用した多重化に最適で簡単です。 2.同じ細胞空間で共発現したターゲットに最適です。 3.同じ組織上の希少で豊富なターゲットを同時に行うためのより良いダイナミックレンジ。 4.追加の手順はありません。 | 1.DAB法による間接ペルオキシダーゼ反応よりも感度が低い。 2.経時的な光退色に対する耐性が弱い。 3.より高価です。 | |
| 信号増幅方式 | アビジン-ビオチン複合体(ABC) | 1.直接および間接検出方法よりも感度が高い。 2.バックグラウンドを減らす | 1. 追加手順。 2.増幅しないよりも高価です。 |
| 標識ストレプトアビジン-ビオチン(LSAB) | 1.直接および間接検出方法よりも感度が高い。 2.ABC法よりも組織浸透が大きい。 3.バックグラウンドを減らす | 1. 追加手順。 2. ABC法よりも高価です。 | |
| 追加の増幅方法ではない | 1.低コスト。 2.追加の手順はありません。 3.豊富なターゲットに最適です。 | 1.感度が低い:ターゲットが豊富で問題があります。 |
表1:IHC技術の長所と短所。 この表は、間接検出法の長所と短所を示しています:(3,3'-ジアミノベンジジン)DABとのペルオキシダーゼ反応と蛍光;シグナル増幅法:アビジン-ビオチン複合体(ABC)、標識ストレプトアビジン-ビオチン(LSAB)、および追加の増幅法ではありません。
高解像度の画像は、適切な分析を実行し、結果を提示するための基本です。解像度を向上させるには、1)より良い顕微鏡設計(共焦点、多光子など)の使用、または2)デコンボリューション9を使用して画像を強調するためにぼかしプロセスを数値的に反転させる2つのアプローチがあります。残念ながら、共焦点顕微鏡は、機器とそのサービスのコストが高いため、手頃な価格ではありません10。広視野落射蛍光顕微鏡とそれに続くzスタック画像のデコンボリューションは、共焦点顕微鏡に代わる適切で低コストの代替手段を提供します8,9。上述のように、デコンボリューション目標は、数学的除去アルゴリズム10を用いて落射蛍光または共焦点顕微鏡によって得られた画像に示されるぼやけ、焦点ずれヘイズおよび歪みを低減することによって、取得システム9によって劣化した元の信号を復元することである。取得したぼやけた画像は、観測対象物を3次元点像分布関数(PSF)で畳み込んだ結果として数学的にモデル化することができる。PSFは、組織試料によって放出され、顕微鏡によって収集された光の点の理論回折パターンである。PSFファイルは、カメラのCCDセル間隔、使用する媒体の屈折率、対物レンズの開口数、蛍光色素の発光波長、画像サイズ、zスタック処理方法の画像数、およびそれらの間のスペースなど、各画像の特定の条件で作成されます(表2の技術仕様を参照)。言い換えれば、PSFファイルは、顕微鏡観察9に対するイメージングセットアップの影響を要約する。ただし、回折PSF 3Dプラグイン(https://imagej.net/Diffraction_PSF_3D)を使用して、zスタック画像ごとに独自のPSFファイルを作成します。Zスタック画像は、スライドの同じXY位置で定義された深さ(z軸)からの一連のデジタル化された光学セクションです。コンピュータは、他の焦点面にあるオブジェクトから発信された信号を再割り当てすることによって、フォーカス面から得られた情報をコンパイルします。zスタック画像を作成するには、スライドの異なるフォーカスレイヤーから画像を取得する必要があります(たとえば、深さ1μmごとに同じXY領域の10個の異なる画像)。次に、メーカーまたはフィジーが提供する顕微鏡ソフトウェアを使用して、zスタックまたは3D画像を作成します。結果は、単一のスタック画像ファイル(たとえば、異なる焦点を持つ10個の画像)になります。デコンボリューション顕微鏡用のオープンソースソフトウェアなど、いくつかの顧客固有のツールとソフトウェアソリューションがあります。フィジー11プラグインであるDeconvolutionLab29を使用したデコンボリューションプロセスの出力を示します(ImageJ12の配布)。デコンボリューションは、最終的な顕微鏡写真の分解能を向上させるのに役立ちます(図1B、Cを参照)。詳細と手順については、参考文献13を読むことを強くお勧めします。
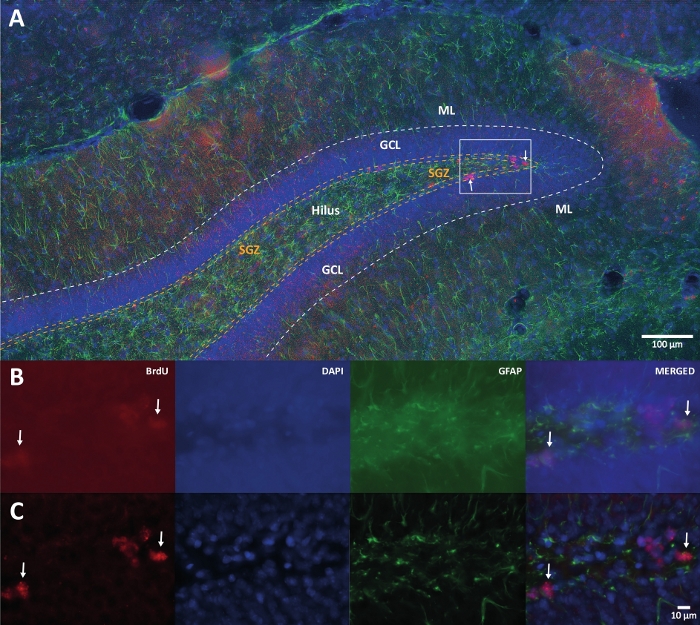
図1:複数のカラーチャンネルの3Dデコンボリューションの代表的な画像。 (a)低倍率でのDG。(B)各チャンネルの元のZスタック画像とマージされた画像。(C)各チャンネルの3DデコンボリューションZスタック画像とマージされた画像。この脳は、身体活動グループの一部であったラットからのものでした。標識ストレプトアビジン-ビオチン(LSAB)増幅法を用いた。BrdUを示すためのCy3ストレプトアビジン結合抗体(赤色)、対比染色としてDAPI(青色)、およびアストログリアマーカーとしてグリア線維性酸性タンパク質(GFAP)を示した(緑色)。ML =分子層;GCL =顆粒細胞層;SGZ =亜粒状ゾーン。 この図の拡大版を表示するには、ここをクリックしてください。
この作業の目的は、免疫染色で陽性で成功した結果を得るためのステップの詳細な説明を提供し、共焦点顕微鏡を使用せずにBrdUベースの研究で一般的に使用されるステップをリストすることです。BrdU染色は、染色を成功させるために注意深く従わなければならないいくつかのステップを必要とする技術です。これらの染色技術の標準化には、通常数か月かかり、時間とリソースを大量に消費します。この記事は、時間とエラーを減らすことで、この分野から始めるグループに情報を提供できると期待していました。
プロトコル
すべての手順は、実験動物の世話と使用に関する国立衛生研究所のガイド(NIH出版物N°.8023、1978年に改訂)およびメキシコの現地法に従って、使用する動物の数とその苦痛を最小限に抑えます。イベロアメリカーナ大学の倫理委員会は、この研究で動物を使用するための実験プロトコルを承認しました。
1. 試薬の調製とセットアップ
注意: ほとんどの溶液は、特に指定がない限り、使用の数日前に準備できます。
- BrdUソリューション
- BrdU溶液を-20°Cの冷凍庫から取り出し、室温(RT)で平衡化させます。
- ラットの体重に応じて、50 mg / kgの用量に必要なBrdUの質量を計算します。.20 mg/mLの作業溶液に必要な0.9%生理食塩水(100 mLの滅菌H2O中の0.9 g NaCl)の容量を計算します。注射ごとにラットあたり少なくとも0.5 mLを提供するために過剰を準備します。.
注:実験動物に投与される用量は、安全で、副作用が最小限で、効果的でなければなりません。.100 mg/kg BrdUによる染色期間は、50 mg/kg用量と比較して潜在的に高い毒性を上回らないことが報告されています7。ラット7では、50および100 mg / kg i.p.のBrdU標識細胞数/mm3に有意差は見られませんでした。動物の苦痛を最小限に抑えるために少量を注射することが好ましい。 - BrdU溶液を計量し、円錐形のチューブと渦の生理食塩水に加えます。
注意: 生理食塩水を水浴中で45〜50°Cで1mLを超える容量で予熱します。 - チューブを50°Cの水浴に10〜10分間置き、完全に溶解するまで2〜3分ごとにボルテックスします。滅菌注射用のシリンジフィルターで溶液をろ過します。チューブを錫箔で覆い、室温で冷却してすぐに使用します。
注意: BrdU溶液は有毒であり、発がん性の可能性があります。ドラフトで準備します。BrdU溶液は、適切な保護具(PPE)で取り扱う必要があります。使用直前に溶液を調製することをお勧めします。ただし、溶液はRT下で24時間安定です。光から保護してください。
- pH 7.4で1 Lの0.1 Mリン酸緩衝生理食塩水(PBS)を調製するために、240 mgのリン酸一塩基性カリウム(KH 2 PO 4)、1.44 gのリン酸二ナトリウム(Na 2 HPO4)、200 mgの塩化カリウム(KCl)、および8 gの塩化ナトリウム(NaCl)を800 mLの二重蒸留水(ddH2O)に加えます。pHを7.4に調整し、二重蒸留H2Oを総容量1Lまで加え、4°Cで最大1週間保存します。
- 100 mLのPBS+に対して、3%(3 mL)の正常ウマ血清と0.3%(300 μL)のトリトンX-100を0.1 M PBS(pH 7.4)に加えます。20〜50 mLのアリコートで-20°Cで最大3か月間保管します。
注: または、PBS の代わりに TBS を使用することもできます。宿主の抗体および実験組織とは異なる他の任意の血清が適している。 - 100 mLのPBS++に対して、10%(10 mL)の正常ウマ血清と0.3%(300 μL)のトリトンX-100を0.1 M PBS pH 7.4に加えます。20〜50 mLのアリコートで-20°Cで最大3か月間保管します。
- 1 Lの凍結保護剤溶液に対して、250 mLのエチレングリコールと250 mLのグリセロールを混合し、混合するまで絶えず攪拌します。PBSでゆっくりと1Lにします。グレード4(20〜25μm)のろ紙でろ過します。4°CまたはRTで最長1年間保管してください。
- 以下のように0.1M PBS(PFA溶液)中の4%パラホルムアルデヒドを調製する。1 Lの溶液に対して、40 gのパラホルムアルデヒド粉末を、絶えず攪拌しながら60〜60°C 0.1 M PBSの800 mLにゆっくりと加えます。温度(60〜65°C)を制御しながら、パラホルムアルデヒドが完全に溶解するまで攪拌します。必要に応じて、溶液を清澄化するために1 M NaOHを数滴加えます。溶液が室温に達したら、グレード4(20〜25μm)のろ紙でろ過します。
注意:パラホルムアルデヒドは有毒であり、発がん性物質であると疑われます。4°Cで保存し、好ましくは2日以内に使用する。PFAのすぐに使用できる溶液が市販されています。 - pH 6の10 mMクエン酸ナトリウム緩衝液(SCB)1 Lに対して、1.204 gのクエン酸ナトリウム(二水和物)と1.134 gのクエン酸を800 mLの二重蒸留H2Oに加えます。pHを6.0に調整し、ddH2Oを最大1 Lまで加え、4°Cで最大6か月間保管します。
- 絶えず攪拌しながら、8.25 mLの12 N HCl(濃縮ストック溶液)を41.75 mLのddH2Oにゆっくりと添加することにより、50 mLの2 N HClを調製します。
注意: ドラフトで準備してください。溶液は使用直前に調製しなければならない。
注:2 N HClは、重要なステップであるDNA変性に使用されます。BrdUがDNAに組み込まれると、HClを使用してDNA結合を開き、BrdU抗体がDNA内のBrdUにアクセスできるようにします。 - 以下のように内因性ペルオキシダーゼ遮断溶液を調製する。絶えず攪拌しながら、2 mLの30%過酸化水素と98 mLのddH2Oを混合することにより、100 mLの0.6%過酸化水素を調製します。
注意: 溶液は使用直前に調製する必要があります。H 2 O2は光に敏感なので暗所に保管してください。水の代わりにPBSまたはTBSを使用できます。 - 製造元の指示に従って、アビジン-ビオチン複合体(ABC)溶液を調製します。0.1 M PBS中の5 mLのABCに対して、試薬Aを2滴(≈100 μL)加えて混合し、次に試薬Bを2滴(≈100 μL)加えて混合します。
注意: 使用前に溶液を調製し、20〜30分間タンブルロールさせる必要があります。 - 製造元の指示に従って、キットを使用してDAB(ジアミノベンジジン)ペルオキシダーゼ(HRP)基質を調製します。5 mLのddH 2 Oに、試薬1を2滴(≈ 84 μL)加えて混合し、試薬2を4滴(≈ 100 μL)加えて混合し、次に試薬3を2滴(≈ 80 μL)加えて混合します。最後に、必要に応じて、試薬4(ニッケル)を2滴(≈80μL)加えて混合します。
注意: 溶液は使用直前に調製する必要があります。
注意: DABは有毒であり、発がん性の可能性があります。各施設の有害廃棄物規制に従って注意して取り扱い、廃棄する必要があります。DABを不活性化するには、漂白剤(次亜塩素酸ナトリウム)を数滴加えます。溶液は黒くなります。 - 55〜60°Cで80 mLのddH2Oにクレジルバイオレットアセテート100 mgと酢酸250 μLを加えて、クレジルバイオレット溶液100 mLを調製します。 容量を100 mLに調整し、ろ過し、暗色の容器に4°Cで保存します。
注意: ユーザーは、貴重な組織サンプルに使用する前に、さまざまな濃度のクレジルバイオレット溶液をテストすることをお勧めします。一部の組織サンプルでは対比染色の結果が暗くなる可能性があり、BrdU陽性細胞を正確にカウントする能力が低下する可能性があります。
2.チミジンアナログBrdU投与
- 実験動物(例えば、体重350gの90日齢雄性Wistarラット)を、下腹腔内に固定化することによって拘束する。
- BrdU溶液(50 mg / kg)を腹腔内(i.p.)に23 Gの針と1 mLのシリンジを使用して投与します。.
注意: 動物の体重に応じて注射量を調整してください。成体ラットには23〜201227 Gの針と1〜1 mLの注射器を使用します。成体ラットにおける最大耐容腹腔内注射量は10mLである。BrdU溶液14を管理するために、異なる経路を使用することができる。例えば、腹腔内注射または飲料水を介した経口投与。
3.ティッシュの準備
注:生後3か月のラットは、7日間、身体活動(エンドレスホイール)への自由アクセスを許可されました。6日目に、ラットにBrdU(ステップ2)を12時間間隔で3回注射した。最後のBrdU注射から8時間後にセクション3の手順を実行します。
- ペントバルビタール(50 mg / kg i.p.)を注射し、動物が深く麻酔されるまで数分待ちます。.
注意: 続行する前に、動物が完全に麻酔をかけられていることを確認してください。片方の足または尾を慎重につまみます。動物が刺激に反応した場合は、さらに数分待ちます。動物がピンチに反応しない場合は、次のステップに進みます。 - 胸骨の下の腹腔の皮膚を切断し、肋骨を分解し、横隔膜を切断することにより、心臓を露出させます。
- 経心灌流固定
- 左心室に針を挿入し、右心房を小さく切開します。ポンプまたは重力を使用して、全血液が排出され、溶液が透明になるまで0.1 M PBSを灌流(流量5〜分)します。
- ポンプまたは重力を使用して、PFA溶液で冷灌流(流速5〜分)を実行し、尾が硬くなるまで組織を固定します。
注:通常、300 gのラットには約100〜150 mLのPFA溶液が必要です。組織固定は任意である。これにより、実験における動物の使用を最小限に抑えるために、様々なプロセスで使用するために脳を抽出することができる。
- 解剖と固定後
- 動物を斬首し、頭蓋骨から脳をそっと抽出します。PFA溶液(ラット250 mgの場合は~40 mL)を含む円錐管に脳を4°Cで1〜2日間浸します。
注:抗原が利用できないために組織の染色が枯渇する可能性があるため、過剰固定(48時間以上)しないでください。 - 100 mLの30%スクロース溶液を調製し、30 gのスクロースを70 mLの0.1 M PBS溶液に加えます。0.1 M PBS溶液を100 mLに加えます。脳がチューブの底に沈むまで、30%ショ糖溶液(35 mL)を含む円錐形のチューブに脳を4°Cで約1〜2日間浸します。
- 動物を斬首し、頭蓋骨から脳をそっと抽出します。PFA溶液(ラット250 mgの場合は~40 mL)を含む円錐管に脳を4°Cで1〜2日間浸します。
- 冠状脳切片の切断
注意: クライオスタットミクロトームを使用するには、ガイダンスとトレーニングが必要です。詳細な手順については、参考文献15を参照してください。- 脳全体を-80°Cのイソペンタンに浸し、-80°Cで10分間保ちます。クライオスタット-ミクロトームプレート上の埋め込みマトリックスに脳を置きます。
注意: 特定の条件下では、-80°Cで脳が急速に凍結すると、組織の骨折や損傷を引き起こす可能性があります。ユーザーはこの問題に注意する必要があります。この場合、-20°Cのイソペンタンを使用して脳を凍結します。 - クライオスタットミクロトーム(-25〜-20°Cの温度)を使用して、厚さ40μmの冠状切片を切断しました。 図2のガイドに従って、凍結保護溶液を含む24ウェル細胞培養プレートに切片を順次移します。使用するまで-20°Cで数ヶ月間保管してください。
注:今後、メッシュインサートを備えた12ウェルプレートで40 μmの自由浮遊シリアルセクションのすべての組織を穏やかかつ連続的に攪拌(10 rpm)で処理します。適切な条件下で何年も脳切片を保存することが可能です。
- 脳全体を-80°Cのイソペンタンに浸し、-80°Cで10分間保ちます。クライオスタット-ミクロトームプレート上の埋め込みマトリックスに脳を置きます。
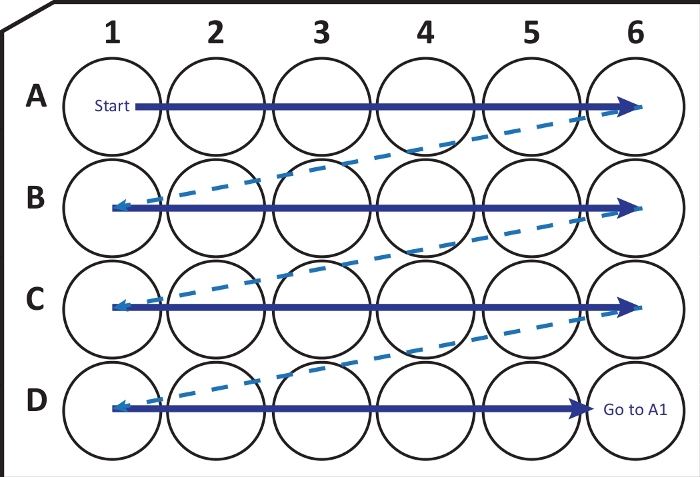
図2:凍結保護溶液を含むクライオスタットミクロトームから24ウェル細胞培養プレートに切片を順次移す模式図。 A1ウェルから始めて、次のスライスを行Aに配置します。A6ウェルの後、次の行Bに移動します。D6に到着したら、A1に戻って続行します。この配置により、脳領域全体のN番目(例えば、神経新生については第6、1列の内容に相当する)セクション定量が可能になる。この図の拡大版を表示するには、ここをクリックしてください。
4.免疫染色
メモ: 各手法の利点と欠点の概要については、 表 1 を参照してください。
- DABを用いたペルオキシダーゼ反応を用いたBrdUの検出
メモ: 1日目に手順4.1.1から4.1.5を実行します。- 凍結保護溶液から室温で0.1 M PBSにスライスを移します。0.1 M PBSでそれぞれ10分間3回すすぎます。
- 内因性ペルオキシダーゼブロッキング溶液中でスライスを30分間インキュベートして、内因性ペルオキシダーゼを不活性化します。0.1 M PBSでそれぞれ10分ずつ3回すすぎます。必要に応じて、抗原賦活化を行います(セクション5を参照)。スライスを2 N HClで37°Cで20分間インキュベートします。 0.1 Mホウ酸緩衝液(8.5 pH)で10分間すすぎます。氷冷した0.1 M PBSで、それぞれ10分間3回すすぎます。
- スライスをPBS++(ブロッキング溶液)で室温で2時間インキュベートします。抗BrdU一次抗体(マウス宿主)とともにPBS+中で1:250の濃度で4°Cで一晩インキュベートします。
- 2日目に、スライスを0.1 M PBSでそれぞれ10分間3回すすぎます。
- 1:250 HRP結合二次抗体(抗マウス)をPBS+溶液中で室温で2〜4時間インキュベートします。0.1 M PBSでそれぞれ10分間3回すすぎます。
- スライスをDABペルオキシダーゼ(HRP)基質溶液に移し、2分間インキュベートします。スライスが濃い灰色になったら、虫眼鏡または顕微鏡で組織を視覚化します。陽性細胞が存在する場合は、水道水で3回(それぞれ15分間)すすぎます(バックグラウンドを減らすため)。0.1 M PBSでそれぞれ10分間3回洗浄します。
- 柔らかいブラシを使用してゼラチン化したスライドにスライスを慎重に取り付け、室温で一晩風乾します。対比染色(セクション7.1を参照)、恒久的な封入剤を追加し、カバーガラスを配置します。4°Cで最大6ヶ月間保管してください。
- アビジン-ビオチン-ペルオキシダーゼ複合体とのペルオキシダーゼ反応を用いたBrdUの検出
メモ: 1日目に手順4.2.1から4.2.5を実行します。- 凍結保護溶液から0.1 M PBSにスライスを移し、室温にします。0.1 M PBSでそれぞれ10分間3回すすぎます。
- 内因性ペルオキシダーゼブロッキング溶液で30分間インキュベートし、内因性ペルオキシダーゼを不活性化します。0.1 M PBSでそれぞれ10分間3回すすぎます。必要に応じて、抗原賦活化を行います(セクション5を参照)。
- 2 N HClで37°Cで20分間インキュベートします。 0.1 Mホウ酸緩衝液(pH 8.5)で10分間すすぎます。氷冷した0.1 M PBSでそれぞれ10分間3回洗浄します。
- PBS++(ブロッキング溶液)中で室温で2時間インキュベートします。
- 抗BrdU一次抗体(マウス宿主)とPBS+中で1:250、4°Cで一晩インキュベートします。
- 2日目に、0.1 M PBSでそれぞれ10分間3回すすぎます。
- PBS+中の1:250ビオチン化二次抗体(抗マウス)とともに室温で2〜4時間インキュベートします。0.1 M PBSでそれぞれ10分間3回すすぎます。
- ABC溶液中で室温で1時間インキュベートする。0.1 M PBSでそれぞれ10分間3回すすぎます。
- スライスをDABペルオキシダーゼ(HRP)基質溶液に移し、2〜10分間インキュベートします。スライスが濃い灰色になったら、虫眼鏡または顕微鏡で組織を視覚化します。陽性細胞が存在する場合は、水道水で3回(各15分)すすぎ(バックグラウンドを減らすため)、続いて0.1 M PBS洗浄でそれぞれ10分間3回すすぎます。
注意: 溶液は使用直前に調製する必要があります。組織の不規則なダークスポットのために脳のスライスが互いにくっつかないように注意する必要があります。 - 柔らかいブラシを使用してゼラチン化したスライドにスライスを慎重に取り付け、室温で一晩風乾します。
- 必要に応じて対比染色し(手順7.1を参照)、恒久的な封入剤を追加し、カバーガラスを配置します。4°Cで最大6ヶ月間保管してください。
- 標識ストレプトアビジン-ビオチン(LSAB)増幅を用いた免疫蛍光法によるBrdUの検出
メモ: 1日目に手順4.3.1から4.3.4を実行します。- 凍結保護溶液から室温で0.1 M PBSにスライスを移します。0.1 M PBSでそれぞれ10分間3回すすぎます。必要に応じて、抗原賦活化を行います(セクション5を参照)。
- 37°Cで2 N HCl中で20分間インキュベートします。 0.1 Mホウ酸緩衝液(8.5 pH)で10分間すすぎます。氷冷した0.1 M PBSでそれぞれ10分間3回すすぎます。
- PBS++(ブロッキング溶液)中で室温で2時間インキュベートします。1:250抗BrdU一次抗体(マウス宿主)をPBS+中で4°Cで一晩インキュベートします。
- 2日目に、0.1 M PBSでそれぞれ10分間3回すすぎます。
- PBS+中の1:250ビオチン化二次抗体(抗マウス)とともに室温で2〜4時間インキュベートします。0.1 M PBSでそれぞれ10分間3回すすぎます。1:250蛍光色素結合ストレプトアビジン(Cy3)をPBS(血清は使用しない)で室温で1〜2時間インキュベートします。0.1 M PBSでそれぞれ10分間3回すすぎます。
注:血清にはビオチンが含まれている可能性があるため、希釈剤には添加しないでください。代わりに、トリトンX-100を0.3%含むPBSを使用してください。 - 柔らかいブラシを使用して糊化したスライドにスライスを慎重にマウントするか、室温で一晩風乾するか、適切な封入剤ですぐにマウントします。対比染色(手順7.2を参照)、恒久的な封入剤を追加し、カバーガラスを配置します。4°Cで最大6ヶ月間保管してください。
- 間接免疫蛍光法によるBrdUの検出
メモ: 1日目に手順4.4.1から4.4.4を実行します。- 凍結保護溶液から室温に達するまで0.1 M PBSにスライスを移します。0.1 M PBSでそれぞれ10分間3回すすぎます。必要に応じて抗原賦活化を実行します(オプション、セクション5を参照)。
- 37°Cで2 N HCl中で20分間インキュベートします。 0.1 Mホウ酸緩衝液(8.5 pH)で10分間すすぎます。氷冷した0.1 M PBSでそれぞれ10分間3回すすぎます。PBS++(ブロッキング溶液)で室温で2時間インキュベートします。1:250抗BrdU一次抗体(マウス宿主)をPBS+中で4°Cで一晩インキュベートします。
- 2日目に、0.1 M PBSでそれぞれ10分間3回すすぎます。
- 1:250蛍光色素結合二次抗体(抗マウス)をPBS+中で室温で2〜4時間インキュベートします。0.1 M PBSでそれぞれ10分間3回すすぎます。
- 柔らかいブラシを使用して糊化したスライドにスライスを慎重にマウントするか、室温で一晩風乾するか、適切な封入剤ですぐにマウントします。対比染色(手順7.2を参照)、恒久的な封入剤を追加し、カバーガラスを配置します。4°Cで最大6ヶ月間保管してください。
5. 抗原賦活化(オプション)
注:抗原賦活化は、多くの抗原の三次構造および四次構造を変化させ、抗体が検出できないようにする固定によって引き起こされる抗原性の喪失を是正することを目的としたオプションのステップです。この手順は、元のプロトコルに追加できます。
- 電子レンジまたは水浴中で、10 mMクエン酸ナトリウム緩衝液(SCB)pH 6溶液を90〜9°Cに予熱します(高度に応じて、溶液はこの温度付近で沸騰し始めます)。50 mLコニカルチューブ(40 mL)の80%に予熱したSCBを充填します。スライスをメッシュインサートにSCBで円錐管に転写します。18〜20 Gの針で穴を開けたスクリューキャップでチューブを覆います。
- スライスを30〜80°CのSCBで80分間保持し、最小電力レベルの電子レンジで交互に加温サイクルします。必要に応じて、円錐形のチューブにSCBを補充します。メッシュインサートと一緒にスライスを氷冷した0.1 M PBSに移し、それぞれ10分間3回すすぎます。
6.複数の免疫染色(オプション)
注: この手順の背後にある理論的根拠については、「概要」セクションを参照してください。
- 同時多重免疫染色
- PBS+でターゲットに対する一次抗体(マウス抗BrdU、ウサギ抗GFAPなど)を含むカクテルを準備します。使用する一次抗体ごとに異なる宿主を使用します。4°Cで一晩インキュベートします。 各プロトコルについて、次の手順を続行します。
- 使用する各一次抗体(例えば、ヤギ抗マウスFITC、ヤギ抗ウサギTRITC)に対応する二次抗体を、各プロトコルの同じ希釈液中でカクテルを調製する。各プロトコルについて、次の手順を続行します。理想的には、交差反応を避けるために、同じ宿主に由来する二次抗体を使用してください。
- 連続した複数の免疫染色。
- 最初の抗体標的(マウス抗BrdUなど)のプロトコルに従い、スライスをマウントする前に停止します。PBS++(ブロッキング溶液)で室温で2時間インキュベートします。
- 2番目の一次抗体(ウサギ抗GFAPなど)をPBS+中で4°Cで一晩インキュベートします。 2番目の二次抗体(ヤギ抗ウサギTRITCなど)のインキュベーションを含む、各プロトコルの次のステップに従います。各プロトコルの次のステップを最後まで続行します。
7. 対比染色(オプション)
- ペルオキシダーゼ反応を使用するプロトコルの場合は、クレジルバイオレット溶液を60°Cに予熱します。 スライドをddH2Oで1分間水和します。スライドをホットクレシルバイオレット溶液で5〜20分間インキュベートします。
- スライドをddH2Oで1分間すすぎます。スライドを70%、80%、90%、および100%エチルアルコールでそれぞれ1〜3分間すすぎます。スライドをキシレンで1〜3分間すすぎます。
- 永久的な疎水性封入剤を追加し、カバーガラスを配置します。
注意: 4°Cで最大6か月間保管してください。PVA(ポリビニルアルコール)-DABCOを含む自作封入剤が採用できます。
- 免疫蛍光を使用するプロトコルの場合は、DAPI、ヨウ化プロピジウムなどを含む少量(25〜50 μL)の親水性封入剤を追加します。マニキュアまたはプラスチックシーラントで周囲をシールします。4°Cで最大6ヶ月間保管してください。
8. イメージングと分析
注:顕微鏡のセットアップ仕様については 、表2 を参照してください。通常、染色された新しい細胞の計数は、ペルオキシダーゼ反応染色されたスライス(安価な方法)を用いて行われるが、免疫蛍光法を用いて行うこともできる。
- 細胞を定量化するには、まず、4倍の倍率レンズで歯状回を適切に特定します(DG解剖学的詳細の詳細については、Amaral et al.16を参照してください)。
- 歯状回の顆粒細胞層で、BrdUで標識された核を検索します(40倍の倍率レンズを使用)。新しいセルは異なるレイヤーに分布できるため、z軸に沿って徹底的にセル検索を実行します( ビデオ1を参照)。
- 歯状回全体を検索するための間隔セクションを選択します(たとえば、組織の6番目のセクションごと、240 μmごとに相当)。
- すべてのBrdU陽性細胞を数えます。標識された核の形態は、細胞が取り込んだBrdUの量に応じて変化する可能性があります(ガイドとして 図3 を参照)。z軸上をゆっくりと移動して、クラスターを統合するいくつかの核すべてを定量化します( ビデオ2を参照)。
- カウントされたセルの総数に、選択した間隔セクション(たとえば、6)を掛けて、BrdUで標識された新しいセルの総数を推定します。
- 理想的には、通常の実験では、動物ごとに少なくとも10個のセクション、グループごとに少なくとも5匹の動物を数えます。
- 画像のデコンボリューション(オプション)
メモ: この手順に関する重要な情報については、「概要」セクションを参照してください。この手順には、単色画像(グレースケール)が必要です。カラー画像をグレースケールに変換します。画像がRGBコンポジットの場合は、最初にチャンネルを分割して1つの画像(コンポジットではない)としてマージしてから、8ビットグレースケールに変換します。- 顕微鏡写真からzスタックファイルを作成します。
- オプションの プラグイン メニューから回折PSF 3Dプラグイン(https://imagej.net/Diffraction_PSF_3D)を開くポイントスプレッド関数(PSF)ファイルを作成します。必要なデータをすべて入力します ( 表 2 を参照)。 OK を押してファイルを保存します。
- オプションプラグインメニュー(http://bigwww.epfl.ch/deconvolution/deconvolutionlab2/)からデコンボリューションLab29プラグインを開きます。一致した Z スタック画像と PDF ファイルを対応するウィンドウスロットにドラッグします。
- デコンボリューションアルゴリズム(リチャードソン・ルーシーなど)と反復回数(20など)を選択します。 実行を押します。
- デコンボリューションされた画像を 1 つの Z スタック画像に結合し、上部の [画像] メニューから [スタック] を選択します。次に、[Z プロジェクト] をクリックします。[投影タイプ]ドロップダウンメニューから[最大強度]を選択し、OKを押してファイルを保存します。
- 上記の手順で作成した単一のzスタック画像ファイルを使用してRGB画像を作成し、上部の[画像]メニューから[色]を選択して目的の擬似色を選択します。次に、[チャネルのマージ]をクリックします。ドロップダウンメニューから対応する画像を希望のカラーチャンネルに設定します。[コンポジットの作成]チェックボックスをオフにし、[OK]を押してファイルを保存します(図4を参照)。
- 複数のチャネル画像がある場合は、手順8.2.1\u20128.2.5を繰り返します。手順8.2.6に従ってRGB画像ファイルを作成し、少なくとも2つの画像ファイルを開き、画像ファイルごとに異なるカラーチャネルを選択します( 図4を参照)。
結果
上記の方法は、余分な身体活動のない対照群とは対照的に、自発的な身体活動後の成体ラット海馬の新生細胞を定量するために適用された。ポジティブコントロールとして出生後ラット海馬を用いた。生後3ヶ月の雄ラットは、7日間、自発的な身体活動プロトコル(エンドレスホイール)の下にありました。6日目に、ラットにBrdUを注射し(セクション2)、その後12時間ごとに3回完全に注射しました。.3つの細胞周期分裂を完了するために、動物を最後のBrdU注射の8時間後に経心灌流した(セクション3)。同じ手順を、比較対照として使用する身体活動を受けなかった生後3か月のラットにも使用しました。.陽性対照として、1日齢のラットの仔(生後1日目)に、上記のセクション2で説明したように、BrdUを1回注射した。注射の1日後(生後2日目)、ステップ3.4に記載されているように、子犬を安楽死させ、頭をPFA溶液に浸しました。成体ラットを深く麻酔し(ステップ3.1)、ステップ3.2に記載されるように経心灌流した。脳を解剖し、後固定した(ステップ3.4)。脳を40μmの冠状切片に切断した(ステップ3.5)。切片を、工程4に記載されるように、BrdU免疫組織化学のために処理した。
西洋ワサビペルオキシダーゼとDAB IHCとの反応を染色(ステップ4.1)に使用し、DGのBrdU陽性細胞をカウントしました。図5は、BrdU標識細胞を用いたDG切片を示す。図5C、Dは、高倍率でのDG断面の代表部を示す。標識された細胞は強い暗色染色を示し、矢印でマークされた。挿入図は、実験群および対照群における標識細胞の平均数を示す(ステップ8.1に記載されるように陽性細胞に6を掛けたカウント)。スチューデントのt検定では、BrdU陽性細胞の数に有意差があることが明らかになりました(t(10) = 2.704、p = 0.0222)。身体活動を受けなかった対照群は、2,040±314細胞(n = 6匹のラット)を示した。比較すると、身体活動群は、平均して、3,606±486(n = 6匹のラット)BrdU陽性細胞を示した。観察されるように、身体活動曝露はBrdU陽性細胞を増加させる。したがって、これらの結果は、身体活動が成体歯状回17における細胞増殖を増加させたことを示す他の報告された結果と一致する。
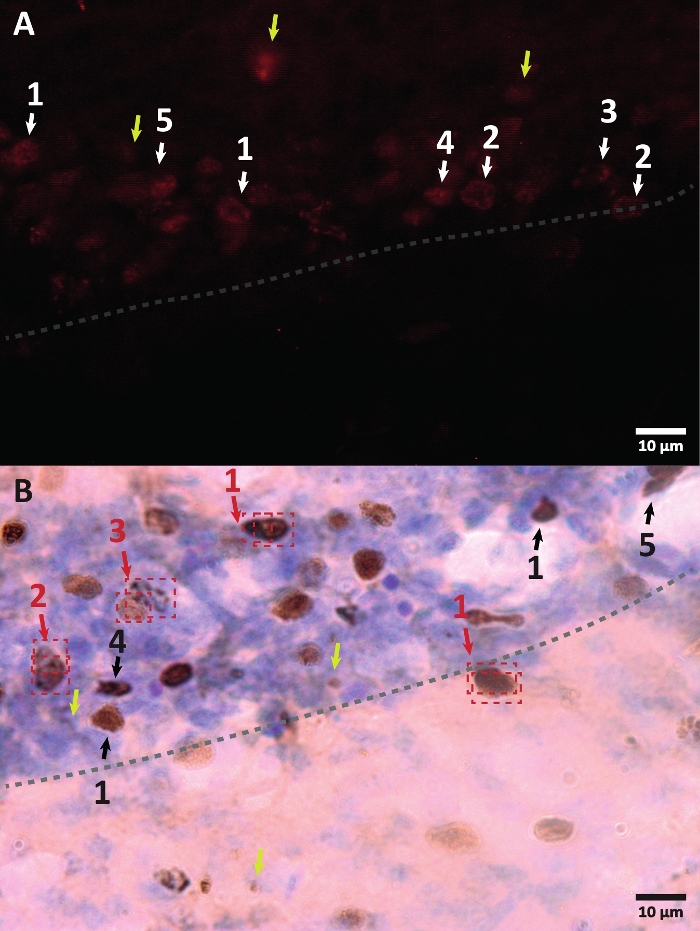
図3:BrdU標識細胞核の異なる形態の例。 BrdUは、核を標識するDNA合成マーカーです。海馬領域では、BrdU陽性核は歯状回顆粒下帯に位置する半楕円形であった。BrdUは競合によって組み込まれるため、すべての細胞に組み込まれる量には変動があり、後で核の視覚化方法に反映されます。(A)免疫蛍光画像。(B)追加の増幅法なしでペルオキシダーゼ反応を用いた画像が提示される。黄色の矢印は、アーティファクトと非特異的なシグナルを示しています。黒または白の矢印はBrdU+細胞を示す。1 –完全にファイルされた核、半楕円形の核は非常に着色されています。2 –ドットのある核、核の境界がマークされ、いくつかのドットの内側にあります。3 –ドットが少ない核、核の境界がマークされ、内部に少数のドットがあります。4 –小さな核は、異なる分化段階にある可能性のある細胞ですが、それでもニッチの一部です。5 –クラスターは分裂中の前駆細胞であるため、凝縮されたグループで一緒にいくつかの細胞を観察することができます。これらのグループ内では、陽性細胞の誤ったラベル付けを避けるために、カウントを特に慎重に行う必要があります。赤い矢印は、単一の細胞と混同される可能性のある分裂下の核を示しています。各セルはボックスに囲まれており、Z軸平面でリアルタイムで区別できます。 この図の拡大版を表示するには、ここをクリックしてください。
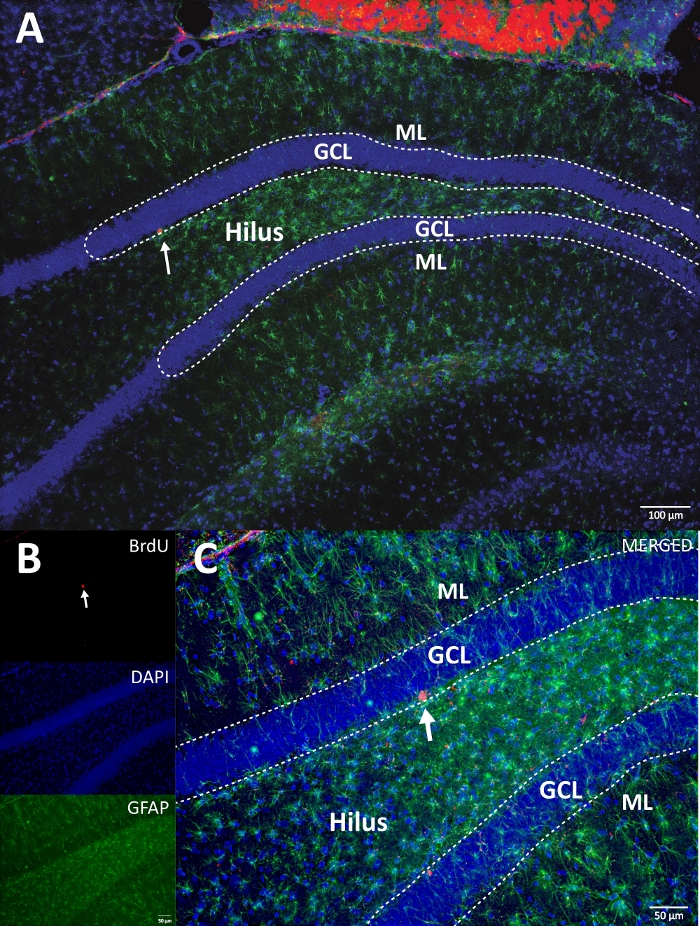
図4:シングルチャンネルとマージチャンネルの代表的なRGB画像。 上の画像は元の Z スタック画像を示し、下の画像は 3D デコンボリューション Z スタック画像を示しています。(A)DGの低倍率。(B)各チャンネルのRGB画像、および(C)RGBマージ画像。これは対照群の脳でした。免疫蛍光法は、追加の増幅法なしで使用した。BrdU(赤)、対比染色としてのDAPI(青)、およびアストログリアマーカーとしてのGFAP(グリア線維性酸性タンパク質)(緑)。ML =分子層;GCL =顆粒細胞層;SGZ =亜粒状ゾーン。 この図の拡大版を表示するには、ここをクリックしてください。
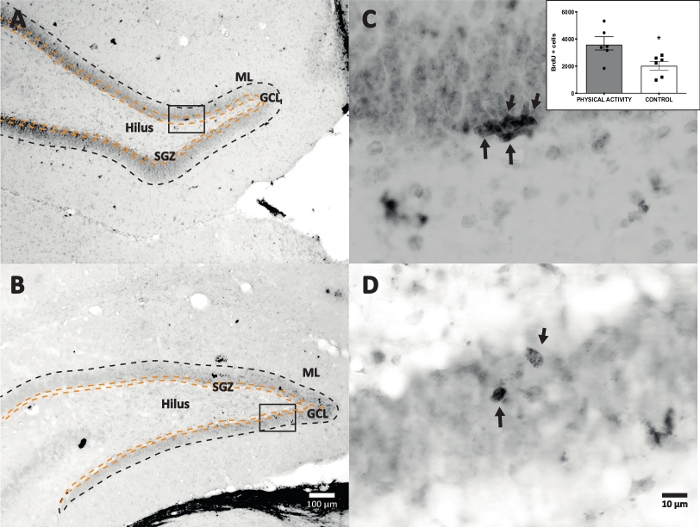
図5:各実験群のBrdU標識細胞(強烈な暗色)を用いた代表的なDG切片。 ペルオキシダーゼ反応は、アビジン-ビオチン-ペルオキシダーゼ複合体増幅法で用いた。(A、B)DGの低倍率を示し、(C、D)はボックス領域を高倍率で示す。パネルAおよびCは身体活動群からの組織であり、パネルBおよびDは対照群からの組織である。挿入図は、身体活動群および対照群における標識細胞の平均数を示す(ステップ8.1に記載されるように陽性細胞に6を掛けたカウント)。ML =分子層;GCL =顆粒細胞層;SGZ =亜粒状ゾーン;矢印はBrdU+セルを示す。 この図の拡大版を表示するには、ここをクリックしてください。
ビデオ1:異なる層に分布したz軸に沿った正の細胞の異なる焦点を示すビデオ。このビデオをダウンロードするには、ここをクリックしてください。
ビデオ2:異なる層に分布したz軸に沿った正の細胞クラスターの異なる焦点を示すビデオ。z軸上をゆっくりと移動して、クラスターを統合するいくつかの核すべてを定量化します。このビデオをダウンロードするには、ここをクリックしてください。
| 顕微鏡タイプ: | 落射蛍光顕微鏡 オリンパス BX53 | ||||
| 光源: | 高圧130W水銀アークランプ(U-HGLGPS) | ||||
| 取得ソフトウェア: | セルセンススタンダード | ||||
| フィルターセット: | カタログ番号 | 励起範囲 | 二色ミラー | 抑制範囲 | |
| ユーフー | 340 - 490 nm | 410 nm | 420 ナノメートル | ||
| U-FBW | 460 - 495 nm | 505 ナノメートル | 510 nm | ||
| U-FGW | 530 - 550 nm | 570 ナノメートル | 575 ナノメートル | ||
| カメラ: | モデル: | CCDカメラ UC50 | |||
| スペクトル範囲: | 290 – 1000 nm | ||||
| CCDチップサイズ: | 2/3インチ、2588(幅*7)×1960(高さ*8)ピクセル | ||||
| ピクセルサイズ: | 3.4 X 3.4 μm | ||||
| 蛍光色素: | 名前 | 励起波長(nm) | 発光 *3 波長(nm) | 発光色 | |
| 4 、 6- ジアミジノ -2- フェニル - インドール塩酸塩(DAPI) | 345 | 455 | 青い | ||
| テトラメチルローダミンイソチオシアン酸塩(TRITC) | 541 | 572 | 赤い | ||
| フルオレセインイソチオシアネート(FITC) | 39秒 | 519 | 緑 | ||
| Cy3 | 552 | 565 | 赤い | ||
| マウンティングメディウムとイマージョンオイル: | 名前 | メディアの屈折率 *1 | |||
| 空気(スライドとレンズの間には何もありません) | 1.00029 | ||||
| DAPIを使用した退色防止封入剤 | 1.45 | ||||
| パーマウント封入剤 | 1.519 | ||||
| 低自家蛍光浸漬オイル(MOIL-30 F型) | 1.518 | ||||
| 倍率レンズ(平面蛍石) | 拡大 | 開口数(該当なし)*2 | 分解能(μm) | 画像の画素間隔(nm)*5 | スライス間隔 Z軸(nm) *6 |
| 4倍速 | 0.13 | 2.12 | 850 | 3000 | |
| 10倍速 | 0.3 | 0.92 | 340 | 3000 | |
| 20倍速 | 0.5 | 0.55 | 170 | 2000 | |
| 40倍速 | 0.75 | 0.37 | 85 | 1000 | |
| 100倍速 | 1.3 | 0.21 | 34 | 1000 | |
表2:顕微鏡のセットアップ仕様と点像分布関数(PSF)ファイルの作成要件。 回折PSF 3Dプラグインウィンドウには、PSFファイルを作成するための11のスロットがあります。各スロットの説明は次のとおりです:*1-メディアの屈折率:スライドとレンズの間のメディアの屈折率(例:空気= 1.00029)。※2 - 絞り数:使用したレンズのNA(別の液浸媒体を使用し、レンズを割り当てた場合は補正が必要です)。※3 波長:蛍光色素の最大発光波長(nm)*4 - 縦球面収差:0.00。*5 - 画像の画素間隔:CCDの画素サイズ(nm)/倍率(例:3.4μm、100倍レンズ、3400/100=34nm)。*6 - 画像のZ軸間の距離。*7 - 幅:デコンボリューションする画像の幅をピクセル単位で入力します。*8 - 高さ:デコンボリューションする画像の高さをピクセル単位で入力します。*9 - 深度、スライス:zスタック内の画像の数。*10 - 正規化: ピクセル値の合計 = 1。*11 - タイトル:PSFファイルの希望する名前。ファイルは、一意の指定された z スタック画像と一致する必要があります。
ディスカッション
成体神経新生は、生涯を通じて新しいニューロンを生成する可能性のある成体神経前駆細胞のニッチで最も頻繁に発生するプロセスです。ブロモデオキシウリジン(BrdU)標識は、成人の脳で新たに生成された細胞の数を特徴付けるために免疫学で広く使用されています。BrdUは主に離散的な脳領域(神経原性ゾーン)の細胞に取り込まれます。これらの細胞は、海馬の歯状回である脳室下帯(SVZ)に位置し、顆粒下帯(SGZ)として知られる顆粒状細胞と顆粒状細胞の間にあります1,2,18。さらに、視床下部、線条体、新皮質、扁桃体など、成人期の増殖能力の低下を特徴とするさまざまな脳領域があります19。前述のように、BrdU染色は、細胞増殖を検出するための成人の神経新生研究に一般的に使用される方法です。ただし、BrdUをマーカーとして使用するには、制限と落とし穴があります。1つ目は、BrdUが細胞周期マーカーであるということです。したがって、細胞の運命を同定し、標識された細胞の特定の発生段階を検出するための細胞マーカーを含めるために、二重または三重染色を実行する必要があります。BrdUに関するもう1つの懸念は、DNAの安定性を改変する毒性および変異原性溶液であり、細胞機能と細胞周期を変化させる可能性があることです。投与プロトコルと投与用量(50〜600 mg / kg)に従うことを決定する際には、以前の情報を考慮する必要があります。.別の重要な特徴は、BrdUがDNA合成マーカーであり、細胞増殖マーカーではないことである14。したがって、細胞増殖を、DNA修復、中絶細胞周期の再突入、遺伝子重複などの他のイベントと区別することは重要です。研究者は、BrdUの適切な使用を確実にするために、適切な管理に従う必要があります。これらの問題と制限についてのより詳細な議論については、Taupinの研究14を確認することをお勧めします。免疫組織化学プロトコルの標準化プロセスは、時間がかかり、困難な場合があります。この作業では、IHCプロトコルを成功させるためのすべての一般的な手順を示しました。ただし、すべての研究グループが組織、抗体、および状態を事前にテストおよび評価することをお勧めします。試験と評価は、試験する抗体および組織ごとに、少なくとも3つの異なるレベルのインキュベーション、洗浄ステップ、および強度を使用して実施する必要があります。また、研究者が特定のニーズと要件を満たす最適なプロトコルを選択できるように、追加のプロトコルを確認することをお勧めします20,21,22,23,24,25。
前述のように、この手順には、科学論文で一般的に使用され言及されているいくつかのステップと方法論的考慮事項が含まれますが、これについては後で説明します。研究者は、技術、予算、機器、セットアップ、および主な研究目標の観点から、抗体を慎重かつ正確に選択することをお勧めします。抗体は、後で実験でテストするのと同じ種類の組織でテストする必要があります。また、固定技術との互換性をテストするために、同じ目的でテストされた抗体(IHC)の使用(つまり、ウェスタンブロットまたはフローサイトメトリー技術だけでなく)を使用することをお勧めします。BrdU染色を投与するために、腹腔内注射、腹腔内注入、経口摂取、または脳室内注入などの異なる経路を使用することができる(各技術のより詳細な説明については、参考文献26を参照されたい)。腹腔内注射を選択した場合は、BrdUが腸領域を避けて腹腔に投与されていることを確認してください。腸にはいくつかの細胞が重複しているため、BrdUが脳に到達する前にBrdUを使い果たす可能性があり、標識された細胞の数に影響を与えます。溶液の浸透性を高めるため、薄い切片を取得することが重要です。厚さ40μmの冠状スライスを吻側尾方向に切断し、Kempermannらによって提案された立体学的手順に従って24ウェル細胞培養プレートに移した27。免疫組織化学は、スライドに取り付けられた組織またはフリーフローティングセクションとして実行できます。BrdUは細胞核の奥深くに位置するため、浮遊切片への溶液の浸透を可能にし、より良い結果と関心領域へのより良いアクセスを提供します。一次抗BrdU抗体がアクセスできるようにするには、DNA結合を開く(DNA変性)ことが重要です。この作業では、HCIインキュベーションを使用してこれらの特定の手順を実行しました。一方、非特異的エピトープをブロックするプロセスは、細胞シグナルのより正確な同定を可能にした。
良好な膜透過処理により、抗体は関心領域に適切に浸透することができます。Triton X-100などの透過処理剤をPBS++およびPBS+溶液に添加すると、膜透過性が向上します。このプロトコルでは、PBS試薬とトリス緩衝生理食塩水(TBS)試薬の両方を使用できます。予算の面では、TBSはPBSよりも相対性理論が安い可能性があります。ただし、PBSは抗リン酸抗体を妨害し、アルカリホスファターゼ結合抗体を阻害する可能性があるため、標的がリン酸化によって翻訳後修飾(すなわち、リン酸化)される場合は、PBSの使用を避けてください。この作業にはPBSを使用し、組織洗浄ステップがより具体的なシグナルを与えることがわかりました。また、研究者はどちらかを使用して少なくとも3回の洗浄サイクルを実行することをお勧めします TBS o PBS.溶液は新たに調製する必要があります。抗原賦活化(AR)は、三次および四次抗原の構造を修飾する固定によって引き起こされる抗原性の喪失を減らすことを目的とした方法です。この減少により、抗原は抗体によって検出不可能になります28,29。このプロトコルで使用されている熱誘起エピトープ検索(HIER)は、高温または強アルカリ加水分解(EDTA pH 8.5またはTris pH 9.5などの他の緩衝液を使用)によってホルムアルデヒドとタンパク質の間の化学反応を逆転させようとしました。結果を比較し、プロトコルに最適なものを選択するために、異なるARプロトコルで新しい抗体をテストすることが不可欠です。この最後のステップは、通常のプロトコルではオプションである可能性があります。しかし、このプロトコルでより良い結果を得るために、抗原賦活化プロトコルで組織を処理しました。
一次染色色と非染色構造を可視化し、免疫反応による一次染色色をマスキングしないようにする方法を考慮して、正しい最終コントラスト色と対比染色法を選択することが重要です。蛍光顕微鏡では、DAPI(4',6-ジアミジノ-2-フェニルインドール)は非常に一般的な核および染色体の対比染色であり、DNAのAT領域に結合すると青色蛍光(吸収:360 nm、発光:460 nm)を発します。DAPI含有封入剤が利用可能で、使いやすいです。これにより、画像取得のための優れた信号保持が得られます。過酸化物反応については、IHCはクレジルバイオレット、ヘマトキシリン、ニュートラルレッド、メチルグリーン染色などのさまざまなオプションで利用可能でした。複数の免疫染色技術の場合、交差反応性を回避するために用いられる固定技術30に適合する抗体を選択することが重要である。単発染色の問題点や合併症が解決したら、必要に応じて別の色染色を行います。二次抗体間の非特異的結合を制御することが重要です。これは、一次抗体の同じ宿主種で産生された二次抗体を使用する前に一次抗体を飽和させることによって行うことができます。例えば、ウサギで産生された抗マウス抗体およびヤギで産生された抗ウサギ二次抗体を使用する場合、ヤギで産生された抗ウサギ抗体は、ウサギで産生される抗マウス抗体の前に使用しなければならない。逐次法が完全に支配的である場合、同時免疫染色プロセスを開始することができる。この方法では、二次抗体を適切に選択することが不可欠である。理想的には、交差反応性を避けるために、これらの抗体はすべて同じ宿主動物に由来する必要があります。ポジティブコントロールを実行して、染色法が出生後の海馬組織(この年齢前後の豊富な神経新生)で正確に機能することを確認することをお勧めします。陽性対照組織に染色の問題が見られる場合は、手順を確認して確認し、修正と調整を行い、良好な染色が得られるまで繰り返します。次に、陰性対照を実行して、特定の一次抗体を省略するか、正常血清(一次抗体と同じ種)に置き換えることにより、抗体が正しく機能することをテストします。冒頭で述べたように、画像デコンボリューションは強力なツールであり、共焦点顕微鏡が利用できない場合の代替手段を提供します。透過光明視野、広視野蛍光、共焦点蛍光顕微鏡を使用して得られたすべての画像に画像デコンボリューションを適用できます。画像デコンボリューションの究極の目的は、取得システムが劣化したという元の信号を再構築することです10。
要約すると、チミジン類似体BrdUの免疫検出によって視覚化された新しく生成された細胞の同定は、複雑ではあるが強力な技術である。この研究は、特に成体の海馬神経新生の分野の科学者が新しい細胞をより正確に定量化するのを助ける試みです。この取り組みが科学界に役立ち、免疫組織化学技術による細胞増殖の研究の微調整が容易になることを願っています。
開示事項
著者は開示するものは何もありません。
謝辞
技術支援を提供してくれたミゲル・ブルゴス氏とグスタボ・ラーゴ氏に感謝します。また、クロリンダ・アリアス博士、カーラ・ヘルナンデス博士、オスカー・ガリシア博士の試薬と材料の提供に親切な支援をしてくださったことに感謝します。また、この作品のパフォーマンスに資金を提供し、ビデオ制作費を賄ってくれたメキシコイベロアメリカーナ大学の調査部門にも感謝します。
資料
| Name | Company | Catalog Number | Comments |
| REAGENT PREPARATION AND SETUP | |||
| Donor Horse Serum | BioWest | S0900 | Blocking and incubation solutions in PBS |
| Paraformaldehyde reagent grade, crystalline (PFA) | Sigma-Aldrich | P6148 | toxic, flammable |
| Potassium Chloride | Sigma-Aldrich | 746436-500G | |
| Potassium Phosphate, monobasic | J.T Bker | 3246-01 | |
| Sacarose | J.T Baker | 4072-01 | |
| Sodium Chloride | Meyer | 2365-500G | |
| Sodium Hydroxide | Sigma-Aldrich | S5881-500G | Corrisive, to calibrate pH |
| Sodium Phophate Dibasic | Sigma-Aldrich | S9763-5KG | |
| Triton-x 100 | Sigma-Aldrich | T8787 | |
| THYMIDINE ANALOGUE BRDU ADMINISTRATION | |||
| 5-Bromo-2′-deoxyuridine, BrdU | Sigma-Aldrich | B9285 | toxic (mutagenic, teratogenic) |
| 23–27G hypodermic needle | BD PrecisionGlide | ||
| Saline solution | PiSA | 30130032 | |
| Syringes 1 mL | NIPRO | ||
| TISSUE PREPARATION | |||
| 15-ml polypropylene conical tube | Thermo Scientific | 339650 | |
| 50-ml polypropylene conical tube | Thermo Scientific | 339652 | |
| Dissecting tools | |||
| Guillotine | Stoelting | ||
| Microtome Cryostat | MICROM | HM525 | |
| Netwell 15 mm polyester mesh membrane inserts | Corning | 3477 | pre-loaded in 12-well culture plates |
| Netwell plastic 12-well carrier kit | Corning | 3520 | for 15 mm polyester mesh membrane inserts |
| Netwell plastic 6-well carrier kit | Corning | 3521 | |
| Perfusion pump | Cole-Parmer | 7553-70 | |
| Shaker | IKA | ROKCER 3D Digital | |
| IMMUNOSTAINING | |||
| Cresyl violet | Sigma-Aldrich | C5042 | 1%, Light sensitive |
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | Vector Laboratories | SK-4100 | carcinogenic, light sensitive |
| Hydochloric Acid | J.T.Baker | 9535-05 | Corrosive, to calibrate pH |
| Hydrogen Peroxide, 50% | Meyer | 5375-1L | Toxic, oxidative |
| Permount Mounting Medium | Fisher Chemical | SP15-500 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | Light sensitive |
| VECTASTAIN® Elite® ABC Kit Peroxidase (HRP) | Vector Laboratories | PK-6100 | enzymatic, avidin/biotin based amplification system |
| Primary antibodies | |||
| Anti-GFAP antibody produced in rabbit | Sigma-Aldrich | HPA056030 | 1:500 |
| Monoclonal Anti-BrdU antibody produced in Mouse | Sigma-Aldrich | B2531 | 1:250 |
| Secondary antibodies | |||
| Biotin-SP (long spacer) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-065-151 | 1:250 |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, HRP | Invitrogen | G-21040 | 1:1000 |
| Goat Anti-Mouse IgG (whole molecule), TRITC | Sigma-Aldrich | T5393 | 1:250 |
| Goat Anti-Rabbit IgG (H+L) Cross-Adsorbed, FITC | Invitrogen | F-2765 | 1:250 |
| Streptavidin, Cy3 | Vector Laboratories | SA-1300 | 1:250 |
| IMAGING AND ANALYSIS | |||
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| CCD-camera | Olympus | UC50 | |
| CellSens Standard software | Olympus | cellSens Standard Edition | Acquisition Software |
| Epifluorescent microscope | Olympus | BX53 | |
| High-pressure 130 W mercury arc lamp | Olympus | U-HGLGPS | |
| low autofluorescence immersion oil | Olympus | MOIL-30 Type F | |
| Micro cover-glasses (VWR, cat no 48404 454; 24 60 mm) | |||
| Microscope slides (VWR, cat no 48323-185; 76 26 mm) | |||
| U-FBW filter cube | Olympus | U-FBW | excitation 460 - 495 nm, dichroic mirror 505 nm, suppression 510 nm |
| U-FGW filter cube | Olympus | U-FGW | excitation 530 - 550 nm, dichroic mirror 570 nm, suppression 575 nm |
| U-FUW filter cube | Olympus | U-FUW | excitation 340 - 490 nm, dichroic mirror 410 nm, suppression 420 nm |
参考文献
- Altman, J. Are new neurons formed in the brains of adult mammals. Science. 135 (3509), 1127-1128 (1962).
- Altman, J., Das, G. D. Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. The Journal of Comparative Neurology. 124 (3), 319-335 (1965).
- Miller, M. W., Nowakowski, R. S. Use of bromodeoxyuridine-immunohistochemistry to examine the proliferation, migration and time of origin of cells in the central nervous system. Brain Research. 457 (1), 44-52 (1988).
- Eriksson, P. S., et al. Neurogenesis in the adult human hippocampus. Nature Medicine. 4 (11), 1313-1317 (1998).
- Filippov, V., et al. Subpopulation of nestin-expressing progenitor cells in the adult murine hippocampus shows electrophysiological and morphological characteristics of astrocytes. Molecular and Cellular Neuroscience. 23 (3), 373-382 (2003).
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends in Neurosciences. 27 (8), 447-452 (2004).
- Matiašová, A., et al. Flow cytometric determination of 5-bromo-2'-deoxyuridine pharmacokinetics in blood serum after intraperitoneal administration to rats and mice. Histochemistry and Cell Biology. 142 (6), 703-712 (2014).
- Von Bohlen Und Halbach, O. Immunohistological markers for proliferative events, gliogenesis, and neurogenesis within the adult hippocampus. Cell and Tissue Research. 345 (1), 1-19 (2011).
- Sage, D., et al. DeconvolutionLab2: An open-source software for deconvolution microscopy. Methods. 115, 28-41 (2017).
- Manz, W., Arp, G., Schumann-Kindel, G., Szewzyk, U., Reitner, J. Widefield deconvolution epifluorescence microscopy combined with fluorescence in situ hybridization reveals the spatial arrangement of bacteria in sponge tissue. Journal of Microbiological Methods. 40 (2), 125-134 (2000).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with imageJ. Biophotonics International. 11 (7), 36-41 (2004).
- . 2D and 3D Fluorescence Deconvolution Manual Available from: https://pages.stolaf.edu/wp-content/uploads/sites/803/2016/12/Giannini_Giannini_Deconvolution_Manual_20161215.p (2016)
- Taupin, P. BrdU immunohistochemistry for studying adult neurogenesis: Paradigms, pitfalls, limitations, and validation. Brain Research Reviews. 53 (1), 198-214 (2007).
- Revilla, V., Jones, A. Cryostat sectioning of brains. International Review of Neurobiology. 47, 61-70 (2002).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in brain research. 163, 3-22 (2007).
- Eadie, B. D., Redila, V. A., Christie, B. R. Voluntary exercise alters the cytoarchitecture of the adult dentate gyrus by increasing cellular proliferation, dendritic complexity, and spine density. Journal of Comparative Neurology. 486 (1), 39-47 (2005).
- Leal-Galicia, P., Romo-Parra, H., Rodríguez-Serrano, L. M., Buenrostro-Jáuregui, M. Regulation of adult hippocampal neurogenesis exerted by sexual, cognitive and physical activity: An update. Journal of Chemical Neuroanatomy. 101, 101667 (2019).
- Gould, E. How widespread is adult neurogenesis in mammals. Nature Reviews Neuroscience. 8 (6), 481-488 (2007).
- Ngwenya, L. B., Peters, A., Rosene, D. L. Light and electron microscopic immunohistochemical detection of bromodeoxyuridine-labeled cells in the brain: Different fixation and processing protocols. Journal of Histochemistry and Cytochemistry. 53 (7), 821-832 (2005).
- Ansorg, A., Bornkessel, K., Witte, O. W., Urbach, A. Immunohistochemistry and multiple labeling with antibodies from the same host species to study adult hippocampal neurogenesis. Journal of Visualized Experiments. (98), e52551 (2015).
- Tuttle, A. H., et al. Immunofluorescent detection of two thymidine analogues (CldU and IdU) in primary tissue. Journal of Visualized Experiments. (46), e2166 (2010).
- Tischler, A. S. Triple immunohistochemical staining for bromodeoxyuridine and catecholamine biosynthetic enzymes using microwave antigen retrieval. Journal of Histochemistry and Cytochemistry. 43 (1), 1-4 (1995).
- Taupin, P. Protocols for studying adult neurogenesis: Insights and recent developments. Regenerative Medicine. 2 (1), 51-62 (2007).
- Leuner, B., Glasper, E. R., Gould, E. Thymidine analog methods for studies of adult neurogenesis are not equally sensitive. Biosystems. 517 (2), 123-133 (2010).
- Magavi, S. S., MacKlis, J. D. Identification of newborn cells by BrdU labeling and immunocytochemistry in vivo. Methods in Molecular Biology. 438, 335-343 (2008).
- Kempermann, G., Gast, D., Kronenberg, G., Yamaguchi, M., Gage, F. H. Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice. Development. , 391-399 (2003).
- Ramos-Vara, J. A., Beissenherz, M. E. Optimization of immunohistochemical methods using two different antigen retrieval methods on formalin-fixed, paraffin-embedded tissues: Experience with 63 markers. Journal of Veterinary Diagnostic Investigation. 12 (4), 307-311 (2000).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Wojtowicz, J. M., Kee, N. BrdU assay for neurogenesis in rodents. Nature Protocols. 1 (3), 1399-1405 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved