Method Article
Técnicas de inmunohistoquímica para analizar la proliferación celular y la neurogénesis en ratas utilizando el análogo de timidina BrdU
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo presenta cuatro de las técnicas más comunes para visualizar células BrdU positivas para medir la neurogénesis adulta en ratas. Este trabajo incluye instrucciones para la preparación de reactivos, administración de análogos de timidina, perfusión transcárdica, preparación de tejidos, reacción inmunohistoquímica de la peroxidasa, inmunofluorescencia, amplificación de señales, contratinción, imágenes de microscopía y análisis celular.
Resumen
Una de las cosas más importantes en el campo de la neurogénesis del hipocampo adulto (AHN) es la identificación de las células recién generadas. La inmunodetección de análogos de timidina (como la 5-Bromo-2'-desoxiuridina (BrdU)) es una técnica estándar utilizada para visualizar estas células recién generadas. Por lo tanto, BrdU generalmente se inyecta en animales pequeños por vía intraperitoneal, por lo que el análogo de timidina se incorpora a las células en división durante la síntesis de ADN. La detección se realiza mediante análisis inmunohistoquímico de cortes cerebrales. Todos los grupos de investigación que han estado utilizando esta técnica pueden apreciar que requiere una atención especial a los detalles minuciosos para lograr una mancha exitosa. Por ejemplo, un paso importante es la desnaturalización del ADN con HCl, que le permite llegar al núcleo celular para teñirlo. Sin embargo, los informes científicos existentes describen muy pocos de estos pasos en detalle. Por lo tanto, estandarizar la técnica es un desafío para los nuevos laboratorios, ya que puede llevar varios meses obtener resultados positivos y exitosos. El propósito de este trabajo es describir y elaborar los pasos para obtener resultados positivos y exitosos de la técnica de inmunotinción en detalle cuando se trabaja con el análogo de timidina BrdU. El protocolo incluye la preparación y configuración del reactivo, la administración del análogo de timidina en un roedor, la perfusión transcárdica, la preparación de tejidos, la reacción inmunohistoquímica de la peroxidasa, el uso del complejo avidina-biotina, la inmunofluorescencia, la contratinción, las imágenes microscópicas y el análisis celular.
Introducción
La idea de que se generan nuevas neuronas en el cerebro humano adulto a lo largo de la vida ha fascinado a la comunidad científica durante décadas. El conocimiento de que el cerebro genera nuevas neuronas a lo largo de su vida útil se logró a través de la detección de células bajo la división 1,2. La detección de neuronas recién generadas en el cerebro adulto se identificó por primera vez mediante la inyección intracraneal de timidina tritiada (timidina-H3) en ratas y la detección de células en el ciclo celular por autoradiogramas 1,2. Se informó la división celular de la glía y la presencia de neuroblastos, que fue el primer dato prometedor sobre la neurogénesis postnatal1. Sin embargo, el uso y la detección de timidina-H3 implicó el uso de radiactividad, que puede ser perjudicial para las personas que la manejan. El primer esfuerzo que examina la idoneidad de la inmunohistoquímica BrdU en el estudio de la proliferación, migración y origen de las células en el sistema nervioso apareció en 1988 por Miller y Nowakowski3. En 1998, un artículo publicado por Eriksson y sus colegas mostró que se visualizaron nuevas neuronas postmortem en el cerebro adulto humano de pacientes inyectados con 5-Bromo-2′-desoxiuridina (BrdU)4. Estos pacientes recibieron la inyección de BrdU (250 mg por vía intravenosa) para marcar el crecimiento de tumores4. Esta técnica fue adoptada en modelos animales. La introducción de estos métodos marcó un hito para el campo, ya que esto permitió la detección de células recién generadas sin el uso de compuestos radiactivos. Este procedimiento se convirtió en el estándar de oro para medir la proliferación celular en nichos cerebrales adultos para promover una mayor investigación en el campo.
La limitación de la técnica del análogo de timidina es que no permite la determinación de la identidad celular para las células recién generadas. Sin embargo, la inmunohistoquímica nos permite llevar a cabo una técnica de doble o triple marcaje de la misma célula, que valida el destino celular de las células recién generadas e incluso sus etapas de maduración, lo que lleva a una mayor evolución del campo. Este método se caracterizó para diferenciar las células recién generadas en glía, neuronas indiferenciadas o una célula granular completamente madura, e incluso para determinar si están participando activamente en los circuitos. Otro avance en el campo fue el uso de modelos transgénicos para identificar células indiferenciadas bajo el dominio de la nestina. Los ratones transgénicos nestina-GFP expresan una proteína fluorescente verde mejorada (GFP), que está bajo el control del promotor de la nestina. La nestina es un filamento intermedio caracterizado por células progenitoras5. Los ratones transgénicos nestina-GFP permitieron establecer pasos tempranos de desarrollo involucrados en la neurogénesis6. Sin embargo, una limitación significativa es poder mantener una colonia de ratones transgénicos nestin-GFP en condiciones especiales en una instalación de laboratorio que se vuelve rentable para algunos grupos científicos, especialmente los de países en desarrollo.
Las técnicas mencionadas anteriormente tienen ventajas y desventajas. Sin embargo, la identificación de células proliferantes por inmunohistoquímica (IHC) y la posibilidad de llevar a cabo una técnica de doble o triple marcaje por inmunofluorescencia para identificar la etapa de maduración celular o el destino celular representa la forma más factible de medir la neurogénesis adulta, hasta ahora. El proceso de identificación mediante inmunohistoquímica consiste en el marcado de proteínas, dominio proteico o nucleótidos con un anticuerpo específico que permite su reconocimiento conocido como anticuerpo primario. Este último es reconocido por el anticuerpo secundario, que se marca con un cromógeno (por ejemplo, peroxidasa de rábano picante) o un fluorocromo (por ejemplo, FITC) junto con el anticuerpo secundario. Los microscopios pueden detectar señales tanto de cromógenos como de fluorocromos. Usando IHC, es posible identificar proteínas de membrana, proteínas del citoesqueleto o componentes nucleares como BrdU. Por otro lado, BrdU se puede encontrar en el núcleo celular ya que se incorpora al ADN durante la fase S por competencia. Por lo tanto, un paso crucial es la desnaturalización del ADN con HCl, que abre enlaces de ADN para permitir que el anticuerpo BrdU acceda a BrdU dentro del ADN. Es esencial saber que BrdU está presente en una concentración saturada en ratones y suero de rata durante 15 y 60 minutos respectivamente, después de la administración intraperitoneal, luego cae rápidamente a niveles indetectables a 60 y 120 min respectivamente7.
Aquí, describimos cuatro técnicas IHQ diferentes pero estrechamente relacionadas: detección indirecta cromogénica mediante reacción de peroxidasa de rábano picante (HRP) con DAB (3,3'-diaminobencidina) sin amplificación de señal (paso 4.1), amplificación del complejo avidina-biotina (ABC) (paso 4.1), detección indirecta de inmunofluorescencia sin amplificación de señal (paso 4.4) y amplificación marcada de estreptavidina-biotina (LSAB) (paso 4.3). Cada método tiene ventajas y desventajas y podría ser útil para requisitos específicos de tejidos (ver Tabla 1). Decidimos seguir los métodos de ICH indirecta debido a su asequibilidad y simplicidad para realizar cambios de métodos de detección cromogénicos a fluorescentes cuando se utilizan anticuerpos primarios no conjugados. El enfoque HRP es un método IHQ comúnmente utilizado debido a su asequibilidad, alta estabilidad, alta tasa de rotación y plena disponibilidad de sustratos. Sin embargo, recomendamos el uso de un control positivo para confirmar que el método de tinción funciona con precisión y el uso de control negativo para probar la función de anticuerpos de manera efectiva. Las inmunotinciones múltiples o los métodos de IHQ multiplex (consulte el paso 6) son herramientas potentes para adquirir grandes cantidades de datos de la sección de tejido en un solo experimento. Esta técnica es particularmente importante cuando la disponibilidad de muestras es limitada. Otra ventaja es la posibilidad de identificar simultáneamente proteínas específicas coexpresadas en el mismo espacio celular mientras se preserva la integridad del tejido. Multiplex permite teñir diferentes marcadores expresados durante etapas proliferativas específicas (por ejemplo, nestina, GFAP, DCX, Ki-67), lo que nos permite alcanzar una investigación más detallada sobre proliferación y diferenciación8. Es crucial elegir anticuerpos compatibles con la técnica de fijación utilizada para evitar la reactividad cruzada. Recomendamos probar cada nuevo anticuerpo (incluido BrdU) individualmente para ajustar y refinar el método. Luego, introduce la tinción secuencial doble y, finalmente, comienza el proceso de inmunotinción simultánea cuando el método secuencial está completamente dominado. Es crucial elegir anticuerpos secundarios apropiados para este método.
| Método | Método específico | Ventajas | Desventajas |
| Método de detección indirecta | Reacción de peroxidasa con DAB | 1. Mayor sensibilidad que el método de detección directa y fluorescencia indirecta. 2. Mayor resistencia al fotoblanqueo que los fluorocromos. 3. Menor costo que el método de detección de fluorescencia | 1. Difícil para multiplexar con menos tintes de color. 2. Complicado para objetivos coexpresados en el mismo espacio celular. 3. Rango dinámico reducido para objetivos simultáneos escasos y altamente abundantes en el mismo tejido. |
| Fluorescencia | 1. Mejor y más fácil para Multiplexar con más tintes de color. 2. Mejor para objetivos co-expresados en el mismo espacio celular. 3. Mejor rango dinámico para objetivos simultáneos escasos y altamente abundantes en el mismo tejido. 4. No hay pasos adicionales. | 1. Menor sensibilidad que la reacción indirecta de peroxidasa con el método DAB. 2. Resistencia débil al fotoblanqueo a lo largo del tiempo. 3. Más caro. | |
| Método de amplificación de señal | Complejo Avidina-Biotina (ABC) | 1. Mayor sensibilidad que el método de detección directa e indirecta. 2. Reducir el fondo | 1. Pasos adicionales. 2. Más caro que no amplificación. |
| Estreptavidina-biotina (LSAB) etiquetada | 1. Mayor sensibilidad que el método de detección directa e indirecta. 2. Penetración tisular más sustancial que el método ABC. 3. Reducir el fondo | 1. Pasos adicionales. 2. Más caro que el método ABC. | |
| No es un método de amplificación adicional | 1. Menor costo. 2. No hay pasos adicionales. 3. Ideal para objetivos muy abundantes. | 1. Baja sensibilidad: problemática sin objetivos abundantes. |
Tabla 1: Ventajas/desventajas de las técnicas de IHQ. Esta tabla muestra las ventajas/desventajas de los métodos de detección indirecta: reacción de peroxidasa con DAB (3,3'-diaminobencidina) y fluorescencia; y métodos de amplificación de señal: complejo avidina-biotina (ABC), estreptavidina-biotina marcada (LSAB), y no método de amplificación adicional.
Una imagen de alta resolución es fundamental para realizar un análisis adecuado y presentar los resultados. Hay dos enfoques para mejorar la resolución: 1) uso de un mejor diseño de microscopio (por ejemplo, confocal, multifotón) o 2) invertir numéricamente el proceso de desenfoque para mejorar las imágenes utilizando la deconvolución9. Desafortunadamente, la microscopía confocal no es asequible debido a los altos costos de los equipos y su servicio10. Un microscopio de epifluorescencia de campo amplio y la posterior deconvolución de las imágenes de la pila z proporcionan una alternativa adecuada y de bajo costo a la microscopía confocal 8,9. Como se señaló anteriormente, el objetivo de la deconvolución es restaurar la señal original que fue degradada por el sistema de adquisición9, reduciendo el desenfoque, la neblina desenfocada y la distorsión mostrada en la imagen obtenida por un microscopio de epifluorescencia o confocal utilizando algoritmos matemáticos de eliminación10. La imagen borrosa adquirida se puede modelar matemáticamente como resultado de la conformación de los objetos observados con una función de dispersión de puntos 3D (PSF). PSF es un patrón teórico de difracción de los puntos de luz emitidos por la muestra de tejido y recogidos por el microscopio. El archivo PSF se crea con las condiciones específicas de cada imagen, como el espaciado de la celda CCD de la cámara, el índice de refracción de los medios utilizados, la apertura numérica de la lente objetivo, la longitud de onda de emisión del fluoróforo, los tamaños de imagen, el número de imágenes en el método de procesamiento z-stack y el espacio entre ellas (consulte la especificación técnica en la Tabla 2). En otras palabras, el archivo PSF resume los efectos de la configuración de imágenes en las observaciones del microscopio9. Sin embargo, utilizamos el plugin de difracción PSF 3D (https://imagej.net/Diffraction_PSF_3D) para crear nuestro propio archivo PSF específico para cada imagen z-stack. Las imágenes de pila Z son una serie de secciones ópticas digitalizadas desde profundidades definidas (eje z) en la misma ubicación XY de la diapositiva. Una computadora recopila la información obtenida del plano de enfoque reasignando señales que se han originado a partir de objetos ubicados en otros planos focales. Para crear imágenes z-stack, es necesario tomar imágenes de diferentes capas enfocadas de las diapositivas (por ejemplo, diez imágenes diferentes de la misma área XY cada 1 μm de profundidad). Luego, utilizamos un software de microscopía proporcionado por el fabricante o Fiji para crear una pila z o una imagen 3D. El resultado será un archivo de imagen de pila única (por ejemplo, diez imágenes con diferentes enfoques). Existen varias herramientas y soluciones de software específicas para el cliente, como el software de código abierto para microscopía de deconvolución. Mostraremos los resultados del proceso de deconvolución utilizando DeconvolutionLab29, que es un complemento de Fiji11 (distribución de ImageJ12). La deconvolución ayudará a mejorar la resolución de las micrografías finales (ver Figura 1B,C). Para obtener más información e instrucciones, recomendamos encarecidamente leer la referencia13.
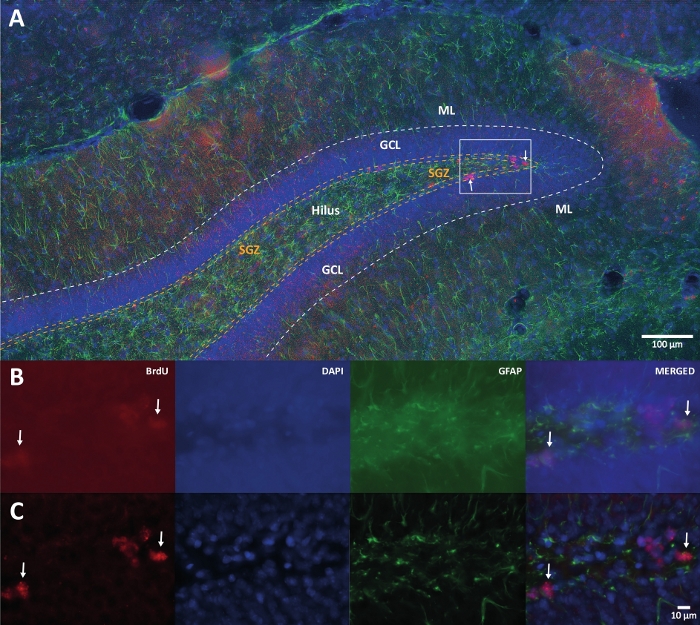
Figura 1: Imagen representativa de la deconvolución 3D para múltiples canales de color. (A) DG a baja ampliación. (B) Las imágenes originales de la pila z para cada canal y la imagen combinada. (C) Imágenes 3D deconvolucionadas z-stack para cada canal y la imagen combinada. Este cerebro era de la rata que formaba parte del grupo de actividad física. Se utilizó el método de amplificación de estreptavidina-biotina (LSAB) marcado. Mostró el anticuerpo conjugado con estreptavidina Cy3 para indicar BrdU (rojo), DAPI como contratinción (azul) y proteína ácida fibrilar glial (GFAP) como marcador astroglial (verde). ML = capa molecular; GCL = capa celular granular; SGZ = zona subgranular. Haga clic aquí para ver una versión más grande de esta figura.
El propósito de este trabajo es proporcionar una descripción detallada de los pasos para obtener resultados positivos y exitosos con inmunotinción y enumerar los pasos comúnmente utilizados en estudios basados en BrdU, sin el uso de un microscopio confocal. La tinción BrdU es una técnica que requiere varios pasos que deben seguirse cuidadosamente para lograr una tinción exitosa. La estandarización de estas técnicas de tinción generalmente lleva meses y requiere mucho tiempo y recursos. Anticipamos que este artículo podría proporcionar información a los grupos que comienzan dentro de este campo al reducir el tiempo y los errores.
Protocolo
Todos los procedimientos siguen la guía de los Institutos Nacionales de Salud para el cuidado y uso de animales de laboratorio (Publicaciones de los NIH N°. 8023, revisada en 1978) y las leyes locales mexicanas para minimizar el número de animales utilizados y su sufrimiento. El Comité de Ética de la Universidad Iberoamericana aprobó los protocolos experimentales para el uso de animales en este estudio.
1. Preparación y configuración del reactivo
NOTA: La mayoría de las soluciones se pueden preparar días antes de su uso, a menos que se especifique lo contrario.
- Solución BrdU
- Recupere la solución de BrdU del congelador a -20 °C y deje que se equilibre a temperatura ambiente (RT).
- Calcular la masa de BrdU necesaria para una dosis de 50 mg/kg según el peso corporal de la rata. Calcular el volumen de solución salina al 0,9% (0,9 g de NaCl en 100 ml deH2Oestéril) necesario para una solución de trabajo de 20 mg/ml. Prepare un exceso para proporcionar al menos 0,5 ml por rata por inyección.
NOTA: La dosis administrada a animales de experimentación debe ser segura, con efectos secundarios mínimos y eficaz. Se ha informado que la duración de la tinción con 100 mg/kg de BrdU no supera la toxicidad potencialmente mayor en comparación con la dosis de 50 mg/kg7. No se encontraron diferencias significativas en el número de células marcadas con BrdU/mm3 para 50 y 100 mg/kg i.p. en ratas7. Es preferible inyectar una pequeña dosis para minimizar el sufrimiento de los animales. - Pesar la solución de BrdU y añadirla a la solución salina en un tubo cónico y vórtice.
NOTA: Precaliente la solución salina a 45-50 °C en un baño maría para volúmenes superiores a 1 ml. - Coloque el tubo en un baño maría a 50 °C durante 10-15 min y el vórtice cada 2-0123 min hasta que se disuelva por completo. Filtrar la solución con un filtro de jeringa para inyección estéril. Cubra el tubo con papel de aluminio, enfríelo a temperatura ambiente y úselo inmediatamente.
PRECAUCIÓN: La solución de BrdU es tóxica y potencialmente cancerígena. Prepáralo en la campana extractora. La solución BrdU debe manipularse con el equipo de protección (EPP) adecuado. Se recomienda preparar la solución inmediatamente antes de su uso. Sin embargo, la solución es estable durante 24 h bajo RT. Por favor, protéjalo de la luz.
- Para preparar 1 L de solución salina tamponada con fosfato 0,1 M (PBS) a pH 7,4, añadir 240 mg de fosfato de potasio monobásico (KH2PO 4), 1,44 g de fosfato de sodio dibásico (Na2HPO4), 200 mg de cloruro de potasio (KCl) y 8 g de cloruro de sodio (NaCl) a 800 mL de agua doble destilada (ddH2O) en agitación constante. Ajustar el pH a 7,4 y añadirH2Odestilado doble hasta un volumen total de 1 L. Conservar a 4 °C durante un máximo de 1 semana.
- Para 100 ml de PBS+, añadir 3% (3 ml) de suero normal de caballo y 0,3% (300 μL) de Triton X-100 a 0,1 M PBS (pH 7,4). Conservar en alícuotas de 20 a 20 ml a -20 °C durante un máximo de 3 meses.
NOTA: Alternativamente, se puede usar TBS en lugar de PBS. Cualquier otro suero diferente de los anticuerpos del huésped y el tejido experimental es adecuado. - Para 100 ml de PBS++, añadir 10% (10 ml) de suero normal de caballo y 0,3% (300 μL) de Triton X-100 a 0,1 M PBS pH 7,4. Conservar en alícuotas de 20 a 20 ml a -20 °C durante un máximo de 3 meses.
- Para 1 L de solución crioprotectora, mezcle 250 ml de etilenglicol y 250 ml de glicerol, revuelva constantemente hasta que se mezcle. Llevar lentamente a 1 L con PBS. Filtrar con papel de filtro de grado 4 (20-201225 μm). Conservar a 4 °C o RT hasta 1 año.
- Preparar paraformaldehído al 4% en PBS 0,1 M (solución de PFA) de la siguiente manera. Para 1 L de solución, añadir 40 g de polvo de paraformaldehído lentamente a 800 ml de 60\u201265 °C 0,1 M PBS bajo agitación constante. Revuelva hasta que el paraformaldehído se disuelva completamente mientras controla la temperatura (60-601265 °C). Si es necesario, agregue unas gotas de NaOH 1 M para aclarar la solución. Cuando la solución alcance la temperatura ambiente, filtre con papel de filtro de grado 4 (20-25 μm).
PRECAUCIÓN: El paraformaldehído es tóxico y se sospecha que es un carcinógeno, preparar en la campana extractora. Conservar a 4 °C y utilizar preferiblemente en un plazo de hasta 2 días. La solución lista para usar PFA está disponible comercialmente. - Para 1 L de tampón de citrato de sodio (SCB) de 10 mM a pH 6, agregue 1.204 g de citrato de sodio (dihidrato) y 1.134 g de ácido cítrico a 800 ml deH2Odoble destilado bajo agitación constante. Ajustar el pH a 6.0 y añadirddH2Ohasta 1 L. Conservar a 4 °C durante un máximo de 6 meses.
- Preparar 50 ml de HCl 2 N añadiendo lentamente 8,25 ml de HCl 12 N (solución madre concentrada) a 41,75 ml deddH2Obajo agitación constante.
PRECAUCIÓN: Preparar en la campana extractora. La solución debe prepararse inmediatamente antes de su uso.
NOTA: 2 N HCl se utilizará para la desnaturalización del ADN, un paso crucial. Como BrdU se incorpora al ADN, HCl se utiliza para abrir los enlaces de ADN que permiten que el anticuerpo BrdU acceda a BrdU dentro del ADN. - Prepare la solución de bloqueo endógeno de la peroxidasa de la siguiente manera. Preparar 100 ml de peróxido de hidrógeno al 0,6% mezclando 2 ml de peróxido de hidrógeno al 30% con 98 ml deddH2Obajo agitación constante.
NOTA: La solución debe prepararse inmediatamente antes de su uso. Manténgalo en la oscuridad yaque H 2 O2 es sensible a la luz. Se puede usar PBS o TBS en lugar de agua. - Prepare la solución de complejo avidina-biotina (ABC) según las instrucciones del fabricante. Para 5 ml de ABC en PBS 0.1 M, agregue 2 gotas (≈100 μL) de reactivo A y mezcle, y luego agregue 2 gotas (≈100 μL) de reactivo B y mezcle.
NOTA: La solución debe prepararse y dejarse rodar durante 20\u201230 min antes de su uso. - Prepare el sustrato de DAB (diaminobencidina) peroxidasa (HRP) utilizando el kit siguiendo las instrucciones del fabricante. A 5 mL deddH2O, añadir 2 gotas (≈ 84 μL) de reactivo 1 y mezclar, añadir 4 gotas (≈ 100 μL) de reactivo 2 y mezclar, luego añadir 2 gotas (≈ 80 μL) de reactivo 3 y mezclar. Finalmente, si lo desea, agregue 2 gotas (≈ 80 μL) de reactivo 4 (níquel) y mezcle.
NOTA: La solución debe prepararse inmediatamente antes de su uso.
PRECAUCIÓN: DAB es tóxico y potencialmente cancerígeno. Debe manejarse con cuidado y desecharse según la regulación de residuos peligrosos en cada institución. Para inactivar DAB, agregue varias gotas de lejía (hipoclorito de sodio); La solución se volverá negra. - Preparar 100 ml de solución de violeta de cresilo añadiendo 100 mg de acetato de violeta de cresilo y 250 μL de ácido acético a 80 ml deddH2Oa 55-60 °C. Ajuste el volumen a 100 ml, filtre y almacene a 4 °C en un recipiente de color oscuro.
NOTA: Se recomienda al usuario que pruebe diferentes concentraciones de la solución de violeta de cresilo antes de usarla en muestras de tejido valiosas. El resultado puede ser más oscuro para la contratinción con algunas muestras de tejido, lo que puede disminuir la capacidad de contar las células BrdU positivas con precisión.
2. Administración de BrdU análogo de timidina
- Sujete al animal experimental (p. ej., rata Wistar macho de 90 días de edad que pese 350 g), inmovilizando la cavidad abdominal inferior.
- Administrar la solución de BrdU (50 mg/kg) por vía intraperitoneal (i.p.) con una aguja de 23 G y una jeringa de 1 ml.
NOTA: Ajuste el volumen de inyección según el peso del animal. Use una aguja de 23-27 G y una jeringa de 1-1-L para ratas adultas. El volumen máximo tolerable de inyección intraperitoneal en rata adulta es de 10 ml. Se pueden utilizar diferentes rutas para administrar la solución BrdU14. Por ejemplo, inyección intraperitoneal o administración oral a través del agua potable.
3. Preparación del tejido
NOTA: A las ratas de tres meses de edad se les permitió el acceso ad libitum a la actividad física (rueda sin fin) durante siete días. En el día 6, las ratas fueron inyectadas con BrdU (paso 2) 3 veces a intervalos de 12 h. Realice los pasos de la sección 3 después de 8 h desde la última inyección de BrdU.
- Inyecte pentobarbital (50 mg/kg i.p.) y espere unos minutos hasta que el animal esté profundamente anestesiado.
NOTA: Asegúrese de que el animal esté completamente anestesiado antes de continuar. Pellizque con cuidado una de las patas o la cola. Si el animal reacciona al estímulo, espere unos minutos más. Si el animal no reacciona al pellizco, vaya al siguiente paso. - Exponga el corazón cortando la piel de la cavidad abdominal debajo del esternón, separando las costillas y cortando el diafragma.
- Fijación de perfusión transcárdica
- Inserte una aguja en el ventrículo izquierdo y haga una pequeña incisión en la aurícula derecha. Usando una bomba o gravedad, perfundir (caudal de 5 a 5 ml / min) 0,1 M PBS hasta que se drene toda la sangre y la solución se vuelva clara.
- Usando una bomba o gravedad, realice la perfusión en frío (caudal de 5-5-mL/min) con solución de PFA para fijar el tejido hasta que la cola se vuelva rígida.
NOTA: Por lo general, una rata de 300 g requiere alrededor de 100-150 ml de la solución de PFA. La fijación tisular es opcional. De este modo, el cerebro puede ser extraído para su uso en diversos procesos para minimizar el uso de animales en los experimentos.
- Disección y post-fijación
- Decapitar al animal y extraer suavemente el cerebro del cráneo. Sumergir el cerebro en un tubo cónico que contenga solución de PFA (~40 ml para una rata de 250 mg) durante 1-4 días a 4 °C.
NOTA: No sobrefije (más de 48 h), ya que esto puede agotar la tinción tisular debido a la falta de disponibilidad de antígenos. - Preparar 100 ml de solución de sacarosa al 30%, añadiendo 30 g de sacarosa a 70 ml de solución de PBS 0,1 M bajo agitación constante. Agregue una solución de PBS de 0,1 M a 100 ml. Sumergir el cerebro en un tubo cónico con una solución de sacarosa al 30% (35 ml) durante aproximadamente 1-122 días a 4 °C hasta que el cerebro se hunda hasta el fondo del tubo.
- Decapitar al animal y extraer suavemente el cerebro del cráneo. Sumergir el cerebro en un tubo cónico que contenga solución de PFA (~40 ml para una rata de 250 mg) durante 1-4 días a 4 °C.
- Corte de secciones cerebrales coronales
NOTA: El uso de un criostato-micrótomo requiere orientación y capacitación. Para obtener instrucciones detalladas, consulte la referencia15.- Sumerge todo el cerebro en isopentano a -80 °C y mantenlo a -80 °C durante 10 min. Coloque el cerebro en una matriz incrustada en una placa de criostato-micrótomo.
NOTA: Bajo ciertas condiciones, la congelación rápida del cerebro a -80 °C puede causar fractura o daño al tejido. El usuario debe ser consciente de este problema. Si este es el caso, use isopentano a -20 °C para congelar el cerebro. - Utilizando un criostato-micrótomo (temperatura de -25 a -20 °C) cortar secciones coronales de 40 μm de espesor. Transfiera secuencialmente secciones a una placa de cultivo celular de 24 pocillos con solución de crioprotección siguiendo la guía de la Figura 2. Conservar a -20 °C hasta su uso, hasta unos pocos meses.
NOTA: A continuación, procese todo el tejido en secciones seriadas flotantes de 40 μm en placas de 12 pocillos con inserciones de malla en agitación suave y continua (10 rpm). Es posible almacenar secciones del cerebro durante años en las condiciones adecuadas.
- Sumerge todo el cerebro en isopentano a -80 °C y mantenlo a -80 °C durante 10 min. Coloque el cerebro en una matriz incrustada en una placa de criostato-micrótomo.
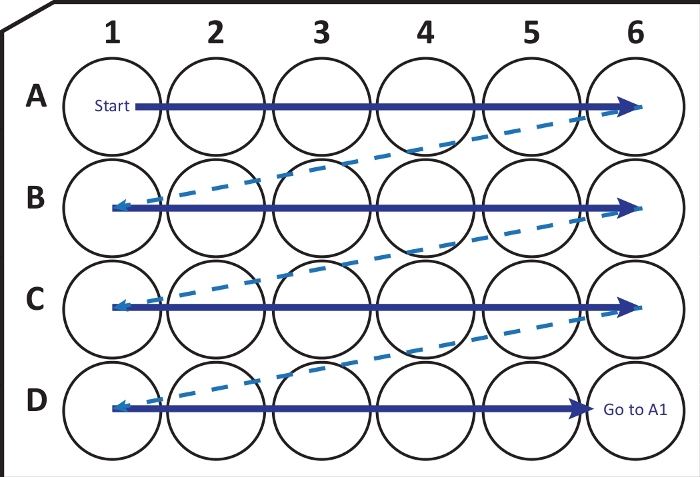
Figura 2: Ilustración esquemática de la transferencia secuencial de secciones de criostato-micrótomo a una placa de cultivo celular de 24 pocillos con solución de crioprotección. Comience en el pozo A1 y coloque las siguientes rebanadas en la fila A; después de A6-pozo, muévase a la siguiente fila B, así sucesivamente. Al llegar a D6, vuelva a la A1 y continúe. Esta disposición permite la cuantificación de la sección N-ésima (por ejemplo, sexta para la neurogénesis, equivalente al contenido de una columna) de toda una región del cerebro. Haga clic aquí para ver una versión más grande de esta figura.
4. Inmunotinción
NOTA: Ver Tabla 1 para el resumen de las ventajas y desventajas de cada técnica.
- Detección de BrdU mediante reacción de peroxidasa con DAB
NOTA: Realice los pasos 4.1.1 a 4.1.5 el día 1.- Transfiera los cortes de la solución de crioprotección a 0,1 M PBS a temperatura ambiente. Enjuague tres veces durante 10 minutos cada una, con 0.1 M PBS.
- Incubar rodajas durante 30 minutos en solución bloqueadora de peroxidasa endógena para inactivar la peroxidasa endógena. Enjuague 3 veces, 10 min cada una, con PBS de 0,1 M. Opcionalmente, realizar la recuperación de antígenos (ver sección 5). Incubar rodajas durante 20 min con 2 N HCl a 37 °C. Enjuagar en tampón de borato de 0,1 M (8,5 pH) durante 10 min. Enjuague 3 veces durante 10 minutos cada una, con PBS 0.1 M helada.
- Incubar rodajas durante 2 h a temperatura ambiente con PBS++ (solución bloqueante). Incubar con el anticuerpo primario anti-BrdU (hospedador de ratón) a una concentración de 1:250 en PBS+ durante la noche a 4 °C.
- El día 2, enjuague las rodajas 3 veces durante 10 minutos cada una con 0,1 M PBS.
- Incubar con 1:250 anticuerpos secundarios conjugados con HRP (anti-ratón) en PBS+ durante 2-0124 h a temperatura ambiente. Enjuague 3 veces durante 10 minutos cada una con 0.1 M PBS.
- Transfiera las rodajas a la solución de sustrato de DAB peroxidasa (HRP) e incube durante 2-10 min. Cuando las rodajas se vuelvan gris oscuro, visualice el tejido con una lupa o un microscopio. Si hay células positivas, enjuague 3 veces (durante 15 minutos cada una) con agua del grifo (para reducir el fondo). Lavar 3 veces durante 10 minutos cada una con 0,1 M PBS.
- Monte cuidadosamente las rodajas en portaobjetos gelatinizados con un cepillo suave, seque al aire durante la noche a temperatura ambiente. Contramanchas (ver sección 7.1), añadir soporte de montaje permanente y colocar cubreobjetos. Conservar a 4 °C durante un máximo de 6 meses.
- Detección de BrdU mediante reacción de peroxidasa con el complejo avidina-biotina-peroxidasa
NOTA: Realice los pasos 4.2.1 a 4.2.5 el día 1.- Transfiera los cortes de la solución de crioprotección a 0,1 M PBS para llevarlos a temperatura ambiente. Enjuague 3 veces durante 10 minutos cada una con 0.1 M PBS.
- Incubar durante 30 min con solución bloqueadora de peroxidasa endógena para inactivar la peroxidasa endógena. Enjuague 3 veces durante 10 minutos cada una en PBS de 0,1 M. Opcionalmente, realizar la recuperación de antígenos (ver sección 5).
- Incubar durante 20 min con 2 N HCl a 37 °C. Enjuagar en tampón de borato 0,1 M (pH 8,5) durante 10 min. Lavar 3 veces durante 10 minutos cada una con PBS 0.1 M helada.
- Incubar durante 2 h a temperatura ambiente en PBS++ (solución bloqueante).
- Incubar con el anticuerpo primario anti-BrdU (huésped de ratón) 1:250 en PBS+ durante la noche a 4°C.
- El día 2, enjuague 3 veces durante 10 minutos cada una con 0.1 M PBS.
- Incubar con 1:250 anticuerpos secundarios biotinilados (anti-ratón) en PBS+ durante 2-0124 h a temperatura ambiente. Enjuague 3 veces durante 10 minutos cada una con 0.1 M PBS.
- Incubar en la solución ABC durante 1 h a temperatura ambiente. Enjuague 3 veces durante 10 minutos cada una con 0.1 M PBS.
- Transfiera las rodajas a la solución de sustrato de la peroxidasa DAB (HRP) e incube durante 2-10 min. Cuando las rodajas se vuelvan gris oscuro, visualice el tejido con una lupa o un microscopio. Si hay células positivas, enjuague 3 veces (15 minutos cada una) con agua del grifo (para reducir el fondo) seguidas de 3 veces con un lavado de PBS de 0,1 M durante 10 minutos cada una.
NOTA: La solución debe prepararse inmediatamente antes de su uso. Se debe tener cuidado para evitar que las rebanadas cerebrales se peguen entre sí debido a manchas oscuras irregulares en el tejido. - Monte cuidadosamente las rodajas en portaobjetos gelatinizados con un cepillo suave y luego seque al aire durante la noche a temperatura ambiente.
- Contramanchas si es necesario (ver paso 7.1), añadir soporte de montaje permanente y colocar cubreobjetos. Conservar a 4 °C durante un máximo de 6 meses.
- Detección de BrdU por inmunofluorescencia mediante amplificación marcada de estreptavidina-biotina (LSAB)
NOTA: Realice los pasos 4.3.1 a 4.3.4 el día 1.- Transfiera los cortes de la solución de crioprotección a 0,1 M PBS a temperatura ambiente. Enjuague 3 veces durante 10 minutos cada una con 0.1 M PBS. Opcionalmente, realizar la recuperación de antígenos (ver sección 5).
- Incubar durante 20 min en HCl 2 N a 37 °C. Enjuagar en tampón de borato de 0,1 M (8,5 pH) durante 10 min. Enjuague 3 veces durante 10 minutos cada una en PBS de 0,1 M heladas.
- Incubar durante 2 h a temperatura ambiente en PBS++ (solución bloqueante). Incubar con 1:250 anticuerpo primario anti-BrdU (huésped de ratón) en PBS+ durante la noche a 4 °C.
- El día 2, enjuague 3 veces durante 10 minutos cada una con 0.1 M PBS.
- Incubar con 1:250 anticuerpos secundarios biotinilados (anti-ratón) en PBS+ durante 2-0124 h a temperatura ambiente. Enjuague 3 veces durante 10 minutos cada una con 0.1 M PBS. Incubar con estreptavidina (Cy3) conjugada con fluorocromo 1:250 en PBS (no usar suero) durante 1-252 h a temperatura ambiente. Enjuague 3 veces durante 10 minutos cada una con 0.1 M PBS.
NOTA: El suero puede contener biotina y no debe agregarse a los diluyentes. En su lugar, use PBS que contenga 0.3% de Triton X-100. - Monte cuidadosamente las rodajas en portaobjetos gelatinizados con un cepillo suave, seque al aire durante la noche a temperatura ambiente o monte inmediatamente con un medio de montaje apropiado. Contramanche (ver paso 7.2), añada el soporte de montaje permanente y coloque los cubreobjetos. Conservar a 4 °C durante un máximo de 6 meses.
- Detección de BrdU por inmunofluorescencia indirecta
NOTA: Realice los pasos 4.4.1 a 4.4.4 el día 1.- Transfiera los cortes de la solución de crioprotección a 0,1 M PBS hasta que alcance la temperatura ambiente. Enjuague 3 veces durante 10 minutos cada una con 0.1 M PBS. Realizar la recuperación de antígenos si es necesario (opcional, ver sección 5).
- Incubar durante 20 min en HCl 2 N a 37 °C. Enjuagar en tampón de borato de 0,1 M (8,5 pH) durante 10 min. Enjuague 3 veces durante 10 minutos cada una con PBS 0.1 M helada. Incubar durante 2 h a temperatura ambiente con PBS++ (solución de bloqueo). Incubar con 1:250 anticuerpo primario anti-BrdU (huésped de ratón) en PBS+ durante la noche a 4 °C.
- El día 2, enjuague 3 veces durante 10 minutos cada una con 0.1 M PBS.
- Incubar con 1:250 anticuerpos secundarios conjugados con fluorocromo (anti-ratón) en PBS+ durante 2-0124 h a temperatura ambiente. Enjuague 3 veces durante 10 minutos cada una con 0.1 M PBS.
- Monte cuidadosamente las rodajas en portaobjetos gelatinizados con un cepillo suave, seque al aire durante la noche a temperatura ambiente o monte inmediatamente con un medio de montaje apropiado. Contramanche (ver paso 7.2), añada el soporte de montaje permanente y coloque los cubreobjetos. Conservar a 4 °C durante un máximo de 6 meses.
5. Recuperación de antígenos (opcional)
NOTA: La recuperación de antígenos es un paso opcional destinado a corregir la pérdida de antigenicidad causada por la fijación que modifica la estructura terciaria y cuaternaria de muchos antígenos, haciéndolos indetectables por los anticuerpos. Este paso se puede agregar al protocolo original.
- En un microondas o baño maría, precaliente la solución de pH 6 de 10 mM de tampón de citrato de sodio (SCB) a 90-95 °C (dependiendo de la altitud, la solución comienza a hervir alrededor de esta temperatura). Llene el 80% de un tubo cónico de 50 ml (40 ml) con SCB precalentado. Transfiera las rebanadas a los insertos de malla en el tubo cónico con SCB. Cubra el tubo con un tapón de rosca con orificios hechos con una aguja de 18\u201220 G.
- Mantener las rodajas durante 30 min en SCB a 80-85 °C alternando ciclos de calentamiento en el microondas al nivel de potencia mínimo. Si es necesario, vuelva a llenar el tubo cónico con SCB. Transfiera las rodajas inmediatamente después junto con los insertos de malla a PBS 0.1 M heladas y enjuague 3 veces durante 10 minutos cada una.
6. Inmunotinciones múltiples (opcional)
NOTA: Consulte la sección de introducción para conocer la justificación detrás de este paso.
- Inmunotinciones múltiples simultáneas
- Prepare un cóctel con los anticuerpos primarios contra el objetivo (por ejemplo, anti-BrdU de ratón y anti-GFAP de conejo) en PBS +. Use diferentes huéspedes para cada anticuerpo primario utilizado. Incubar durante la noche a 4 °C. Continúe con los mismos pasos siguientes para cada protocolo.
- Prepare un cóctel con los anticuerpos secundarios correspondientes para cada anticuerpo primario utilizado (por ejemplo, FITC anti-ratón de cabra, TRITC anti-conejo de cabra) en la misma solución diluyente para cada protocolo. Continúe con los mismos pasos siguientes para cada protocolo. Lo ideal es usar anticuerpos secundarios que provengan de los mismos huéspedes para evitar reacciones cruzadas.
- Inmunotinciones múltiples secuenciales.
- Siga el protocolo para el primer objetivo de anticuerpos (por ejemplo, anti-BrdU de ratón) y deténgase antes de montar las rodajas. Incubar durante 2 h a temperatura ambiente con PBS++ (solución de bloqueo).
- Incubar el segundo anticuerpo primario (p. ej., anti-GFAP de conejo) en PBS+ durante la noche a 4 °C. Siga los siguientes pasos para cada protocolo, incluida la incubación del segundo anticuerpo secundario (por ejemplo, TRITC anticonejo de cabra). Continúe con los siguientes pasos para cada protocolo hasta el final.
7. Contratinción (opcional)
- Para los protocolos que utilizan la reacción de la peroxidasa, precaliente la solución de violeta de cresilo a 60 °C. Hidratar los portaobjetos conddH2Odurante 1 min. Incubar los portaobjetos en la solución caliente de violeta de cresilo durante 5-01220 min.
- Enjuague las diapositivas conddH2Odurante 1 min. Enjuague las diapositivas con alcohol etílico al 70%, 80%, 90% y 100% durante 1-min cada una. Enjuague los portaobjetos con xileno durante 1\u20123 min.
- Agregue un medio de montaje hidrófobo permanente y coloque cubreobjetos.
NOTA: Conservar a 4 °C durante un máximo de 6 meses. Se puede emplear un medio de montaje de fabricación propia que contenga PVA (alcohol polivinílico)-DABCO.
- Para los protocolos que utilizan inmunofluorescencia, añadir un pequeño volumen (25-201250 μL) de medio de montaje hidrófilo con DAPI, yoduro de propidio o similar. Selle alrededor del perímetro con esmalte de uñas o un sellador de plástico. Conservar a 4 °C durante un máximo de 6 meses.
8. Imágenes y análisis
NOTA: Consulte la Tabla 2 para conocer las especificaciones de configuración del microscopio. Por lo general, el recuento de las nuevas células teñidas se realiza utilizando las rodajas teñidas por reacción de peroxidasa (método más barato), pero también se puede realizar mediante inmunofluorescencia.
- Para cuantificar las células, primero, identifique el giro dentado correctamente con la lente de aumento 4x (para más instrucciones sobre los detalles anatómicos DG, ver Amaral et al.16).
- Busque en la capa de células granulares del giro dentado núcleos marcados con BrdU (utilizando la lente de aumento de 40x). Realice la búsqueda de celdas exhaustivamente a lo largo del eje z, ya que las nuevas celdas se pueden distribuir en diferentes capas (ver Video 1).
- Seleccione una sección de intervalo para la búsqueda de células en todo el giro dentado (por ejemplo, cada 6ª sección de tejido, equivalente a cada 240 μm).
- Cuente todas las células BrdU positivas. La morfología del núcleo marcado puede cambiar dependiendo de la cantidad de BrdU incorporada la célula (ver Figura 3 como guía). Muévase lentamente sobre el eje z para cuantificar los diversos núcleos que integran un clúster (ver Video 2).
- Multiplique el número total de celdas contadas con la sección de intervalo seleccionada (por ejemplo, 6) para estimar el número total de nuevas celdas marcadas con BrdU.
- Idealmente, en un experimento regular, cuente al menos diez secciones por animal y al menos cinco animales por grupo.
- Deconvolución de imágenes (opcional)
NOTA: Consulte la sección de introducción para obtener información importante sobre este paso. Este procedimiento necesita imágenes monocromáticas (escala de grises). Transforme imágenes en color a escala de grises. Si las imágenes son un compuesto RGB, primero divida los canales y combínelos como una sola imagen (no compuesta), luego transfórmelos a escala de grises de 8 bits.- Cree un archivo z-stack a partir de micrografías.
- Cree un archivo de función de dispersión de puntos (PSF) abriendo el plugin Diffraction PSF 3D (https://imagej.net/Diffraction_PSF_3D) desde el menú de opciones Plugins . Complete todos los datos requeridos (ver Tabla 2). Pulse OK y guarde el archivo.
- Abra el plugin DeconvolutionLab29 desde el menú de opciones Plugins (http://bigwww.epfl.ch/deconvolution/deconvolutionlab2/). Arrastre la imagen z-stack y el archivo PDF coincidentes a la ranura de ventana correspondiente.
- Seleccione el algoritmo de deconvolución (por ejemplo, Richardson-Lucy) y el número de iteraciones (por ejemplo, 20). Presione RUN.
- Combine las imágenes desenrevesadas en una sola imagen z-stack seleccionando Stacks en el menú Image (Imagen ) en la parte superior. A continuación, haga clic en Proyecto Z. Seleccione Intensidad máxima en el menú desplegable Tipo de proyección , presione OK y guarde el archivo.
- Cree una imagen RGB utilizando el único archivo de imagen z-stack creado en el paso anterior con el pseudocolor deseado seleccionando Color en el menú Imagen en la parte superior. Luego haga clic en Combinar canales. Establezca la imagen correspondiente en el canal de color deseado en el menú desplegable. Desmarque la casilla Crear compuesto, presione OK y guarde el archivo (consulte la figura 4).
- Si hay más de una imagen de canal, repite los pasos 8.2.1\u20128.2.5. Cree un archivo de imagen RGB siguiendo el paso 8.2.6, abriendo al menos dos archivos de imagen y seleccionando diferentes canales de color para cada archivo de imagen (consulte la figura 4).
Resultados
Los métodos descritos anteriormente se aplicaron para cuantificar las células recién nacidas en el hipocampo de rata adulta después de la actividad física voluntaria, en contraste con un grupo de control sin ninguna actividad física adicional. Utilizamos el hipocampo postnatal de rata como control positivo. Las ratas macho de 3 meses de edad estuvieron bajo un protocolo voluntario de actividad física (rueda sin fin) durante siete días. El día 6, a las ratas se les inyectó BrdU (sección 2), y cada 12 h después hasta tres inyecciones completas. Para completar tres divisiones del ciclo celular, los animales fueron perfundidos transcárdicamente (sección 3) 8 h después de la última inyección de BrdU. El mismo procedimiento se utilizó en ratas de tres meses de edad que no se sometieron a actividad física para ser utilizado como control comparativo. Como control positivo, las crías de rata de un día de edad (día postnatal 1) fueron inyectadas con BrdU una vez, como se describe en la sección 2 anterior. Un día después de la inyección (día 2 postnatal), los cachorros fueron sacrificados y sus cabezas fueron sumergidas en una solución de PFA, como se describe en el paso 3.4. Las ratas adultas fueron profundamente anestesiadas (paso 3.1), perfundidas transcárdicamente, como se describe en el paso 3.2. Los cerebros fueron diseccionados y post-fijados (paso 3.4). Los cerebros se cortaron en secciones coronales de 40 μm (paso 3.5). Las secciones se procesaron para la inmunohistoquímica BrdU, como se describe en el paso 4.
Se utilizó la reacción de peroxidasa de rábano picante con DAB IHC para la tinción (paso 4.1) y el recuento de células BrdU positivas en DG. La Figura 5 muestra una sección DG con celdas marcadas con BrdU. La figura 5C,D muestra una parte representativa de la sección DG con mayor aumento. Las células marcadas mostraron una intensa tinción oscura, que estaban marcadas con flechas. El recuadro muestra el número promedio de células marcadas en los grupos experimental y control (células positivas contadas multiplicadas por seis como se describe en el paso 8.1). La prueba t de Student reveló diferencias de significación entre el número de células BrdU positivas (t(10) = 2,704, p = 0,0222). El grupo control que no se sometió a actividad física mostró 2.040 ± 314 células (n = 6 ratas). En comparación, el grupo de actividad física mostró, en promedio, 3.606 ± 486 (n = 6 ratas) de células BrdU positivas. Como se observa, la exposición a la actividad física aumenta las células BrdU positivas. Por lo tanto, estos resultados son consistentes con otros resultados reportados que muestran que la actividad física aumentó la proliferación celular en el giro dentado adulto17.
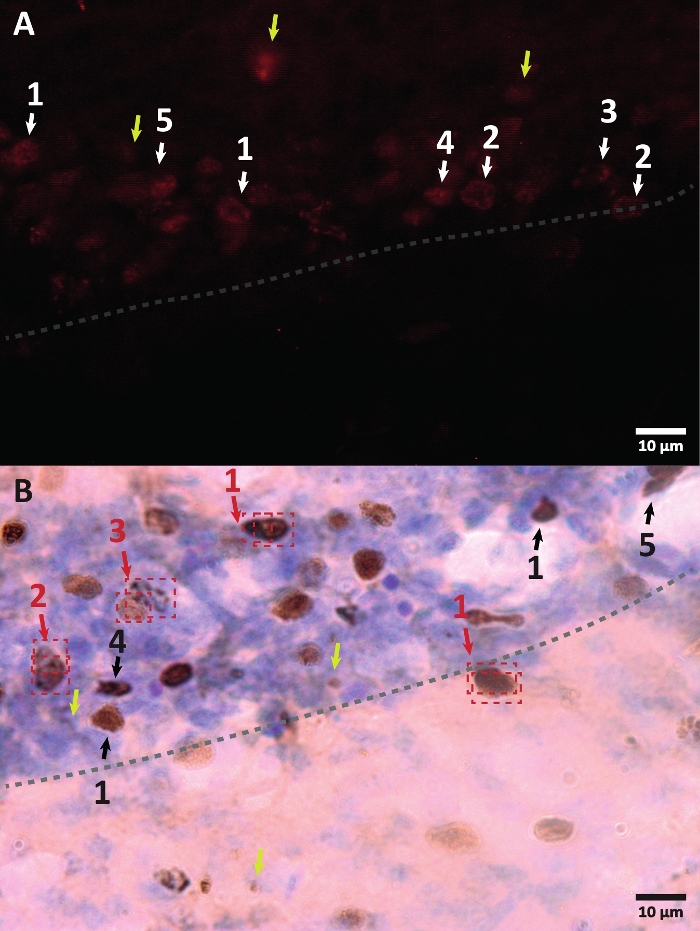
Figura 3: Ejemplos de diferentes morfologías del núcleo celular marcado con BrdU. BrdU es un marcador de síntesis de ADN que etiqueta el núcleo. En la región del hipocampo, los núcleos BrdU-positivos tenían una forma semi-ovalada localizada en la zona subgranular del giro dentado. Dado que BrdU se incorpora por competencia, la cantidad incorporada para cada célula tendrá una variación que luego se reflejará en cómo se visualizará el núcleo. (A) Imagen de inmunofluorescencia. (B) Se presenta una imagen que utiliza la reacción de la peroxidasa sin un método de amplificación adicional. Las flechas amarillas muestran artefactos y señales no específicas. Las flechas negras o blancas muestran las celdas BrdU+. 1 – Núcleo completamente limado, núcleos semiovalados altamente coloreados. 2 – Núcleos con puntos, el borde de los núcleos está marcado y tiene en su interior varios puntos. 3 – Núcleos con pocos puntos, el borde de los núcleos están marcados y tienen un pequeño número de puntos en su interior. 4 – El núcleo pequeño es posible células en una etapa de diferenciación diferente, pero aún parte del nicho. 5 – Los clusters son células precursoras en división, por lo que se pueden observar varias células juntas en grupos condensados. Dentro de estos grupos, el conteo debe hacerse con especial cuidado para evitar el etiquetado incorrecto de las células positivas. Las flechas rojas muestran el núcleo bajo división que puede confundirse con una sola célula. Cada celda está encerrada en una caja y se puede distinguir en un plano del eje Z en tiempo real. Haga clic aquí para ver una versión más grande de esta figura.
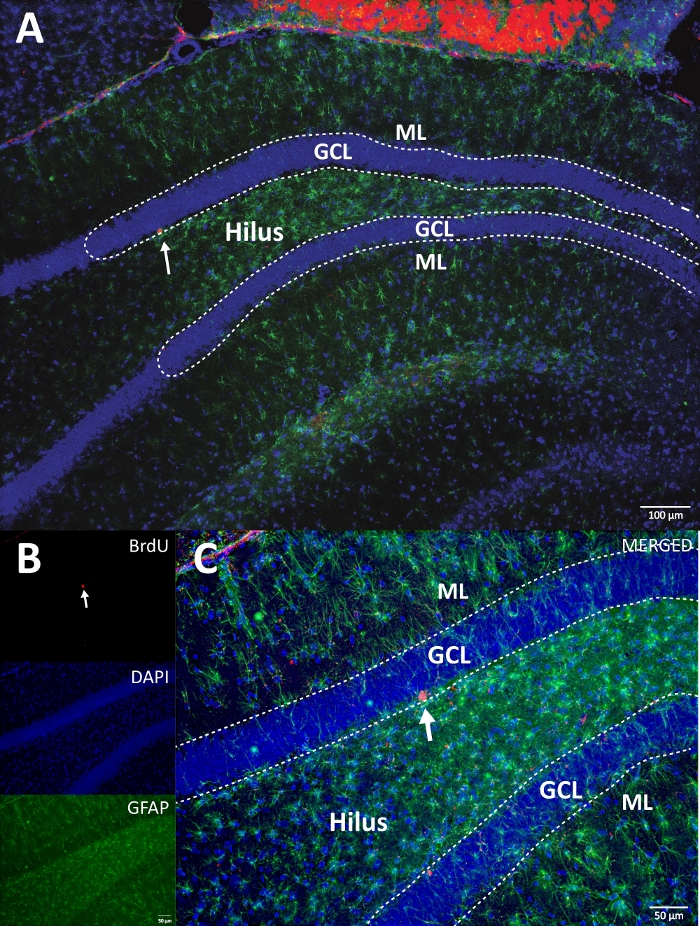
Figura 4: Imagen RGB representativa para canales únicos y combinados. La imagen superior muestra la imagen original de z-stack, y la imagen inferior muestra la imagen 3D deconwinded z-stack. (A) Bajo aumento del DG. (B) imagen RGB para cada canal y (C) imagen combinada RGB. Este era un cerebro del grupo de control. La inmunofluorescencia se utilizó sin un método de amplificación adicional. BrdU (rojo), DAPI como contratinción (azul) y GFAP (proteína ácida fibrilar glial) como marcador astroglial (verde). ML = capa molecular; GCL = capa celular granular; SGZ = zona subgranular. Haga clic aquí para ver una versión más grande de esta figura.
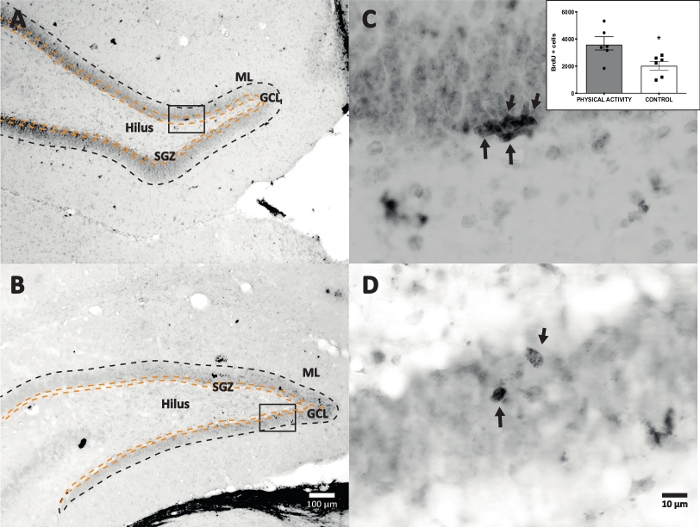
Figura 5: Sección DG representativa con células marcadas con BrdU (oscuridad intensa) para cada grupo experimental. La reacción de la peroxidasa se utilizó con el método de amplificación del complejo avidina-biotina-peroxidasa. (A, B) Mostrar un aumento bajo del DG, y (C, D) mostrar el área de la caja con un aumento mayor. Los paneles A y C son tejidos del grupo de actividad física, los paneles B y D son del grupo de control. El recuadro muestra el número promedio de células marcadas en los grupos de actividad física y control (células positivas contadas multiplicadas por seis como se describe en el paso 8.1). ML = capa molecular; GCL = capa celular granular; SGZ = zona subgranular; las flechas indican las celdas BrdU+. Haga clic aquí para ver una versión más grande de esta figura.
Video 1: Video que muestra un foco diferente de células positivas a lo largo del eje z distribuidas en diferentes capas. Haga clic aquí para descargar este video.
Video 2: Video que muestra un foco diferente de grupos de células positivas a lo largo del eje z distribuidas en diferentes capas. Muévase lentamente sobre el eje z para cuantificar los diversos núcleos que integran un clúster. Haga clic aquí para descargar este video.
| Tipo de microscopio: | Microscopio de epifluorescencia Olympus BX53 | ||||
| Fuente de luz: | Lámpara de arco de mercurio de alta presión de 130 W (U-HGLGPS) | ||||
| Software de adquisición: | CellSens Estándar | ||||
| Conjuntos de filtros: | Número de catálogo | Rango de excitación | Espejo dicromático | Rango de supresión | |
| U-FUW | 340 - 490 nm | 410 nm | 420 nm | ||
| U-FBW | 460 - 495 nm | 505 nm | 510 nm | ||
| U-FGW | 530 - 550 nm | 570 nm | 575 nm | ||
| Cámara: | Modelo: | CCD-cámara UC50 | |||
| Rango espectral: | 290 – 1000 nm | ||||
| Tamaño del chip CCD: | 2/3 in, 2588 (ancho *7) x 1960 (alto *8) píxeles | ||||
| Tamaño de píxel: | 3,4 X 3,4 μm | ||||
| Fluorocromo: | Nombre | Longitud de onda de excitación (nm) | Emisión *3 Longitud de onda (nm) | Color de emisión | |
| 4, 6-diamidino-2-fenil-indol HCI (DAPI) | 345 | 455 | Azul | ||
| Tetrametilrodamina-isotiocianato (TRITC) | 541 | 572 | Rojo | ||
| Fluoresceína-isotiocianato (FITC) | 494 | 519 | Verde | ||
| Cy3 | 552 | 565 | Rojo | ||
| Medio de montaje y aceite de inmersión: | Nombre | Índice de refracción de los medios *1 | |||
| Aire (nada entre la diapositiva y la lente) | 1.00029 | ||||
| Medio de montaje antidecoloración con DAPI | 1.45 | ||||
| Medio de montaje de montaje | 1.519 | ||||
| Aceite de inmersión de baja autofluorescencia (MOIL-30 Tipo F) | 1.518 | ||||
| Lente de aumento (Plan Fluorite) | Magnificación | Apertura numérica (NA) *2 | Resolución (μm) | Espaciado de píxeles de imagen (nm) *5 | Espaciado entre sectores Eje Z (nm) *6 |
| 4X | 0.13 | 2.12 | 850 | 3000 | |
| 10X | 0.3 | 0.92 | 340 | 3000 | |
| 20X | 0.5 | 0.55 | 170 | 2000 | |
| 40X | 0.75 | 0.37 | 85 | 1000 | |
| 100X | 1.3 | 0.21 | 34 | 1000 | |
Tabla 2: Especificaciones de configuración del microscopio y requisitos de creación de archivos de función de dispersión puntual (PSF). Hay 11 ranuras en la ventana del plugin PSF 3D de difracción para crear el archivo PSF. Cada ranura se describe de la siguiente manera: *1 - Índice de refracción del medio: índice de refracción para el medio entre la diapositiva y la lente (por ejemplo, aire = 1,00029). *2 - Apertura numérica: NA de la lente utilizada (debe corregirse cuando se usa un medio de inmersión diferente y se asignó una lente). *3 - Longitud de onda: Longitud de onda máxima de emisión del fluorocromo (nm). *4 - Aberración esférica longitudinal: 0.00. *5 - Espaciado de píxeles de imagen: tamaño de píxel CCD (nm)/ampliación (por ejemplo, lente de 3,4 μm y 100X, 3400/100 = 34 nm). *6 - Distancia entre imágenes eje Z. *7 - Ancho: Introduzca el ancho de la imagen que se va a descongirar en píxeles. *8 - Altura: Introduzca la altura de la imagen que se va a desconvolver en píxeles. *9 - Profundidad, segmentos: el número de imágenes en la pila z. *10 - Normalización: Suma de valores de píxeles = 1. *11 - Título: Nombre deseado para el archivo PSF. El archivo debe coincidir con la imagen única dada z-stack.
Discusión
La neurogénesis adulta es un proceso que ocurre con mayor frecuencia en nichos de células precursoras neurales adultas que tienen el potencial de generar nuevas neuronas a lo largo de su vida. El etiquetado de bromodeoxiuridina (BrdU) se usa ampliamente en inmunología para caracterizar el número de células recién generadas en un cerebro adulto. BrdU se incorporará principalmente en células de regiones cerebrales discretas (zonas neurogénicas). Estas células se encuentran en la zona subventricular (SVZ), el giro dentado del hipocampo, entre el hilio y las células granulares conocidas como zona subgranular (SGZ)1,2,18. Además, existen diferentes regiones cerebrales caracterizadas por una menor capacidad proliferativa en la edad adulta, incluyendo el hipotálamo, el cuerpo estriado, el neocórtex y la amígdala19. Como se mencionó anteriormente, la tinción de BrdU es el método comúnmente utilizado para la investigación de la neurogénesis adulta para detectar la proliferación celular. Sin embargo, el uso de BrdU como marcador tiene limitaciones y dificultades. La primera es que BrdU es un marcador del ciclo celular. Por lo tanto, se debe realizar una tinción doble o triple para identificar el destino celular e incluir marcadores celulares para detectar la etapa de desarrollo específica de las células marcadas. Una preocupación más sobre BrdU es que es una solución tóxica y mutagénica que modifica la estabilidad del ADN puede alterar la función celular y los ciclos celulares. Se debe tener en cuenta la información anterior al decidir seguir un protocolo de administración y dosis de administración (50-600 mg/kg). Otra característica crucial es que BrdU es un marcador de síntesis de ADN, no un marcador de proliferación celular14. Por lo tanto, es relevante distinguir la proliferación celular de otros eventos como la reparación del ADN, la reentrada abortiva del ciclo celular y la duplicación de genes. Los investigadores deben seguir los controles apropiados para garantizar el uso adecuado de BrdU. Para una discusión más detallada sobre estos problemas y limitaciones, recomendamos revisar el trabajo de Taupin14. El proceso de estandarización de un protocolo de inmunohistoquímica podría ser lento y desafiante. En este trabajo, hemos presentado todos los pasos generales para gestionar un protocolo IHQ exitoso. Sin embargo, recomendamos que cada grupo de investigación pruebe y evalúe el tejido, los anticuerpos y las condiciones con anticipación. Las pruebas y evaluaciones deben llevarse a cabo con al menos tres niveles diferentes de incubaciones, pasos de lavado y concentraciones para cada anticuerpo y tejido probado. También recomendamos que los investigadores revisen protocolos adicionales para poder elegir el mejor que satisfaga las necesidades y requisitos específicos 20,21,22,23,24,25.
Como se mencionó anteriormente, el procedimiento implica varios pasos y consideraciones metodológicas que se utilizan y mencionan comúnmente en los artículos científicos, que se discutirán más adelante. Recomendamos que los investigadores elijan los anticuerpos cuidadosa y correctamente en términos de técnica, presupuesto, equipo, configuración y objetivo principal de la investigación. Los anticuerpos deben probarse con el mismo tipo de tejido que se probará posteriormente en el experimento. También recomendamos el uso de un anticuerpo que se probó para el mismo propósito (IHC) (es decir, no solo en técnicas de western blot o citometría de flujo) para probar su compatibilidad con la técnica de fijación. Se pueden utilizar diferentes vías para administrar la tinción BrdU, como inyección intraperitoneal, infusión intraperitoneal, ingestión oral o infusión intraventricular (para una descripción más detallada de cada técnica, ver referencia26). Si se selecciona la inyección intraperitoneal, asegúrese de que BrdU se administra en la cavidad peritoneal evitando el área intestinal. Dado que el intestino tiene varias células en duplicación que pueden agotar el BrdU antes de que llegue al cerebro, lo que afectará el número de células marcadas. Es crucial obtener secciones delgadas ya que permiten una mejor penetración de las soluciones. Los cortes coronales de 40 μm de espesor se cortaron rostro-caudalmente y se transfirieron a una placa de cultivo celular de 24 pocillos, siguiendo el procedimiento estereológico propuesto por Kempermann et al.27. La inmunohistoquímica puede llevarse a cabo con tejido montado en portaobjetos o como secciones de flotación libre. Dado que BrdU se encuentra profundamente en los núcleos de las células, permite la penetración de soluciones en secciones de flotación libre, lo que proporciona mejores resultados y un mejor acceso al área de interés. Es importante abrir los enlaces de ADN (desnaturalización del ADN) para permitir el acceso primario de anticuerpos anti-BrdU. En este trabajo, llevamos a cabo estos procedimientos específicos con el uso de la incubación de HCI. Por otro lado, el proceso de bloqueo de epítopos inespecíficos permitió una identificación más precisa de la señal celular.
La buena permeabilización de la membrana permite que los anticuerpos penetren adecuadamente en el área de interés. Agregar un permeabilizador como Triton X-100 a las soluciones PBS++ y PBS+ mejora la permeabilización de la membrana. Tanto los reactivos PBS como los reactivos salinos tamponados con Tris (TBS) se pueden usar en este protocolo. En términos de presupuesto, el TBS podría ser relativamente más barato que el PBS. Sin embargo, PBS podría interferir con los anticuerpos antifosfato e inhibir los anticuerpos conjugados con fosfatasa alcalina, así que evite el uso de PBS si el objetivo se modifica postraduccionalmente por fosforilación (es decir, fosforilada). Utilizamos el PBS para este trabajo, y descubrimos que los pasos de lavado de tejidos daban una señal más específica. También recomendamos a los investigadores que lleven a cabo al menos tres ciclos de lavado utilizando TBS o PBS. Las soluciones deben estar recién preparadas. La recuperación de antígenos (RA) es un método destinado a reducir la pérdida de antigenicidad causada por la fijación que modifica la estructura de los antígenos terciarios y cuaternarios. Esta reducción hace que los antígenos sean indetectables por los anticuerpos28,29. La recuperación de epítopos inducida por calor (HIER) utilizada en este protocolo intentó revertir las reacciones químicas entre el formaldehído y las proteínas mediante hidrólisis alcalina a alta temperatura o fuerte (con otras soluciones tampón como EDTA pH 8.5 o Tris pH 9.5). Es esencial probar nuevos anticuerpos con diferentes protocolos AR para comparar resultados y elegir el mejor para el protocolo. Este último paso podría ser opcional en un protocolo regular; sin embargo, se trataron los tejidos con un protocolo de recuperación de antígenos para proporcionar mejores resultados para este protocolo.
Es crucial seleccionar el color de contraste final correcto y la técnica de contratinción teniendo en cuenta el color de tinción primaria y el método utilizado para hacer visible una estructura sin manchas y evitar enmascarar el color de tinción primario de la reacción inmune. Para la microscopía de fluorescencia, el DAPI (4', 6-diamidino-2-fenilindol) es una contratinción nuclear y cromosómica muy popular que emite fluorescencia azul (absorción: 360 nm, emisión: 460 nm) al unirse a las regiones AT del ADN. El medio de montaje que contiene DAPI está disponible y es fácil de usar; Esto proporciona una excelente retención de señal para la adquisición de imágenes. Para la reacción de peróxido, IHQ estaba disponible en diferentes opciones, como violeta de cresil, hematoxilina, rojo neutro o tinción de verde de metilo. Para múltiples técnicas de inmunotinción, es crucial elegir un anticuerpo compatible con la técnica de fijación utilizada para evitar la reactividad cruzada30. Cuando se resuelvan los problemas y complicaciones con la tinción única, administre otra tinción de color según se considere necesario. Es crucial controlar la unión no específica entre los anticuerpos secundarios. Esto podría hacerse saturando los anticuerpos primarios antes de usar un anticuerpo secundario producido en la misma especie huésped de los anticuerpos primarios. Por ejemplo, cuando se utiliza anti-ratón producido en conejo y anti-conejo producido en anticuerpos secundarios de cabra, el anti-conejo producido en anticuerpo de cabra debe usarse antes que el anti-ratón producido en anticuerpo de conejo. Cuando el método secuencial está completamente dominado, se puede iniciar el proceso de inmunotinción simultánea. En este método, es esencial elegir adecuadamente los anticuerpos secundarios. Idealmente, todos esos anticuerpos deben provenir del mismo animal huésped para evitar la reactividad cruzada. Recomendamos realizar un control positivo para confirmar que el método de tinción funciona con precisión en el tejido postnatal del hipocampo (neurogénesis abundante alrededor de esta edad). Si el tejido de control positivo muestra problemas de tinción, revise y revise el procedimiento, haga correcciones y ajustes, y repita hasta que se produzca una buena tinción. Luego, ejecute un control negativo para probar que el anticuerpo funciona correctamente omitiendo o reemplazando un anticuerpo primario particular con suero normal (la misma especie que el anticuerpo primario). Como se mencionó en la introducción, la deconvolución de imágenes es una herramienta poderosa y proporciona una alternativa cuando no se dispone de un microscopio confocal. Puede aplicar la deconvolución de la imagen a todas las imágenes obtenidas utilizando microscopía de campo brillante de luz transmitida, fluorescencia de campo amplio y fluorescencia confocal. El propósito final de la deconvolución de imágenes es reconstruir la señal original de que el sistema de adquisición se deteriora10.
En resumen, la identificación de las células recién generadas visualizadas por la inmunodetección del análogo de timidina BrdU es una técnica complicada pero poderosa. Este trabajo es un intento de ayudar a los científicos, particularmente en el campo de la neurogénesis del hipocampo adulto, a cuantificar nuevas células con mayor precisión. Esperamos que este esfuerzo haya sido útil para la comunidad científica y facilite el afinamiento del estudio de la proliferación celular mediante la técnica de inmunohistoquímica.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Queremos agradecer al Sr. Miguel Burgos y a Gustavo Lago por brindar asistencia técnica. También queremos agradecer a la Dra. Clorinda Arias, la Dra. Karla Hernández y el Dr. Oscar Galicia por su amable apoyo en el suministro de reactivos y material. También agradecemos a la División de Investigación y Posgrado de la Universidad Iberoamericana Ciudad de México por proporcionar fondos para la realización de este trabajo y por cubrir los gastos de producción de video.
Materiales
| Name | Company | Catalog Number | Comments |
| REAGENT PREPARATION AND SETUP | |||
| Donor Horse Serum | BioWest | S0900 | Blocking and incubation solutions in PBS |
| Paraformaldehyde reagent grade, crystalline (PFA) | Sigma-Aldrich | P6148 | toxic, flammable |
| Potassium Chloride | Sigma-Aldrich | 746436-500G | |
| Potassium Phosphate, monobasic | J.T Bker | 3246-01 | |
| Sacarose | J.T Baker | 4072-01 | |
| Sodium Chloride | Meyer | 2365-500G | |
| Sodium Hydroxide | Sigma-Aldrich | S5881-500G | Corrisive, to calibrate pH |
| Sodium Phophate Dibasic | Sigma-Aldrich | S9763-5KG | |
| Triton-x 100 | Sigma-Aldrich | T8787 | |
| THYMIDINE ANALOGUE BRDU ADMINISTRATION | |||
| 5-Bromo-2′-deoxyuridine, BrdU | Sigma-Aldrich | B9285 | toxic (mutagenic, teratogenic) |
| 23–27G hypodermic needle | BD PrecisionGlide | ||
| Saline solution | PiSA | 30130032 | |
| Syringes 1 mL | NIPRO | ||
| TISSUE PREPARATION | |||
| 15-ml polypropylene conical tube | Thermo Scientific | 339650 | |
| 50-ml polypropylene conical tube | Thermo Scientific | 339652 | |
| Dissecting tools | |||
| Guillotine | Stoelting | ||
| Microtome Cryostat | MICROM | HM525 | |
| Netwell 15 mm polyester mesh membrane inserts | Corning | 3477 | pre-loaded in 12-well culture plates |
| Netwell plastic 12-well carrier kit | Corning | 3520 | for 15 mm polyester mesh membrane inserts |
| Netwell plastic 6-well carrier kit | Corning | 3521 | |
| Perfusion pump | Cole-Parmer | 7553-70 | |
| Shaker | IKA | ROKCER 3D Digital | |
| IMMUNOSTAINING | |||
| Cresyl violet | Sigma-Aldrich | C5042 | 1%, Light sensitive |
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | Vector Laboratories | SK-4100 | carcinogenic, light sensitive |
| Hydochloric Acid | J.T.Baker | 9535-05 | Corrosive, to calibrate pH |
| Hydrogen Peroxide, 50% | Meyer | 5375-1L | Toxic, oxidative |
| Permount Mounting Medium | Fisher Chemical | SP15-500 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | Light sensitive |
| VECTASTAIN® Elite® ABC Kit Peroxidase (HRP) | Vector Laboratories | PK-6100 | enzymatic, avidin/biotin based amplification system |
| Primary antibodies | |||
| Anti-GFAP antibody produced in rabbit | Sigma-Aldrich | HPA056030 | 1:500 |
| Monoclonal Anti-BrdU antibody produced in Mouse | Sigma-Aldrich | B2531 | 1:250 |
| Secondary antibodies | |||
| Biotin-SP (long spacer) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-065-151 | 1:250 |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, HRP | Invitrogen | G-21040 | 1:1000 |
| Goat Anti-Mouse IgG (whole molecule), TRITC | Sigma-Aldrich | T5393 | 1:250 |
| Goat Anti-Rabbit IgG (H+L) Cross-Adsorbed, FITC | Invitrogen | F-2765 | 1:250 |
| Streptavidin, Cy3 | Vector Laboratories | SA-1300 | 1:250 |
| IMAGING AND ANALYSIS | |||
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| CCD-camera | Olympus | UC50 | |
| CellSens Standard software | Olympus | cellSens Standard Edition | Acquisition Software |
| Epifluorescent microscope | Olympus | BX53 | |
| High-pressure 130 W mercury arc lamp | Olympus | U-HGLGPS | |
| low autofluorescence immersion oil | Olympus | MOIL-30 Type F | |
| Micro cover-glasses (VWR, cat no 48404 454; 24 60 mm) | |||
| Microscope slides (VWR, cat no 48323-185; 76 26 mm) | |||
| U-FBW filter cube | Olympus | U-FBW | excitation 460 - 495 nm, dichroic mirror 505 nm, suppression 510 nm |
| U-FGW filter cube | Olympus | U-FGW | excitation 530 - 550 nm, dichroic mirror 570 nm, suppression 575 nm |
| U-FUW filter cube | Olympus | U-FUW | excitation 340 - 490 nm, dichroic mirror 410 nm, suppression 420 nm |
Referencias
- Altman, J. Are new neurons formed in the brains of adult mammals. Science. 135 (3509), 1127-1128 (1962).
- Altman, J., Das, G. D. Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. The Journal of Comparative Neurology. 124 (3), 319-335 (1965).
- Miller, M. W., Nowakowski, R. S. Use of bromodeoxyuridine-immunohistochemistry to examine the proliferation, migration and time of origin of cells in the central nervous system. Brain Research. 457 (1), 44-52 (1988).
- Eriksson, P. S., et al. Neurogenesis in the adult human hippocampus. Nature Medicine. 4 (11), 1313-1317 (1998).
- Filippov, V., et al. Subpopulation of nestin-expressing progenitor cells in the adult murine hippocampus shows electrophysiological and morphological characteristics of astrocytes. Molecular and Cellular Neuroscience. 23 (3), 373-382 (2003).
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends in Neurosciences. 27 (8), 447-452 (2004).
- Matiašová, A., et al. Flow cytometric determination of 5-bromo-2'-deoxyuridine pharmacokinetics in blood serum after intraperitoneal administration to rats and mice. Histochemistry and Cell Biology. 142 (6), 703-712 (2014).
- Von Bohlen Und Halbach, O. Immunohistological markers for proliferative events, gliogenesis, and neurogenesis within the adult hippocampus. Cell and Tissue Research. 345 (1), 1-19 (2011).
- Sage, D., et al. DeconvolutionLab2: An open-source software for deconvolution microscopy. Methods. 115, 28-41 (2017).
- Manz, W., Arp, G., Schumann-Kindel, G., Szewzyk, U., Reitner, J. Widefield deconvolution epifluorescence microscopy combined with fluorescence in situ hybridization reveals the spatial arrangement of bacteria in sponge tissue. Journal of Microbiological Methods. 40 (2), 125-134 (2000).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with imageJ. Biophotonics International. 11 (7), 36-41 (2004).
- Giannini, A., Giannini, J. 2D and 3D Fluorescence Deconvolution Manual. , Available from: https://pages.stolaf.edu/wp-content/uploads/sites/803/2016/12/Giannini_Giannini_Deconvolution_Manual_20161215.p (2016).
- Taupin, P. BrdU immunohistochemistry for studying adult neurogenesis: Paradigms, pitfalls, limitations, and validation. Brain Research Reviews. 53 (1), 198-214 (2007).
- Revilla, V., Jones, A. Cryostat sectioning of brains. International Review of Neurobiology. 47, 61-70 (2002).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in brain research. 163, 3-22 (2007).
- Eadie, B. D., Redila, V. A., Christie, B. R. Voluntary exercise alters the cytoarchitecture of the adult dentate gyrus by increasing cellular proliferation, dendritic complexity, and spine density. Journal of Comparative Neurology. 486 (1), 39-47 (2005).
- Leal-Galicia, P., Romo-Parra, H., Rodríguez-Serrano, L. M., Buenrostro-Jáuregui, M. Regulation of adult hippocampal neurogenesis exerted by sexual, cognitive and physical activity: An update. Journal of Chemical Neuroanatomy. 101, 101667(2019).
- Gould, E. How widespread is adult neurogenesis in mammals. Nature Reviews Neuroscience. 8 (6), 481-488 (2007).
- Ngwenya, L. B., Peters, A., Rosene, D. L. Light and electron microscopic immunohistochemical detection of bromodeoxyuridine-labeled cells in the brain: Different fixation and processing protocols. Journal of Histochemistry and Cytochemistry. 53 (7), 821-832 (2005).
- Ansorg, A., Bornkessel, K., Witte, O. W., Urbach, A. Immunohistochemistry and multiple labeling with antibodies from the same host species to study adult hippocampal neurogenesis. Journal of Visualized Experiments. (98), e52551(2015).
- Tuttle, A. H., et al. Immunofluorescent detection of two thymidine analogues (CldU and IdU) in primary tissue. Journal of Visualized Experiments. (46), e2166(2010).
- Tischler, A. S. Triple immunohistochemical staining for bromodeoxyuridine and catecholamine biosynthetic enzymes using microwave antigen retrieval. Journal of Histochemistry and Cytochemistry. 43 (1), 1-4 (1995).
- Taupin, P. Protocols for studying adult neurogenesis: Insights and recent developments. Regenerative Medicine. 2 (1), 51-62 (2007).
- Leuner, B., Glasper, E. R., Gould, E. Thymidine analog methods for studies of adult neurogenesis are not equally sensitive. Biosystems. 517 (2), 123-133 (2010).
- Magavi, S. S., MacKlis, J. D. Identification of newborn cells by BrdU labeling and immunocytochemistry in vivo. Methods in Molecular Biology. 438, 335-343 (2008).
- Kempermann, G., Gast, D., Kronenberg, G., Yamaguchi, M., Gage, F. H. Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice. Development. , 391-399 (2003).
- Ramos-Vara, J. A., Beissenherz, M. E. Optimization of immunohistochemical methods using two different antigen retrieval methods on formalin-fixed, paraffin-embedded tissues: Experience with 63 markers. Journal of Veterinary Diagnostic Investigation. 12 (4), 307-311 (2000).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Wojtowicz, J. M., Kee, N. BrdU assay for neurogenesis in rodents. Nature Protocols. 1 (3), 1399-1405 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados