Method Article
Técnicas de imuno-histoquímica para análise da proliferação celular e neurogênese em ratos utilizando o análogo da timidina BrdU
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este trabalho apresenta quatro das técnicas mais comuns para visualizar células BrdU positivas para medir a neurogênese adulta em ratos. Este trabalho inclui instruções para preparação de reagentes, administração análoga de timidina, perfusão transcárdica, preparação tecidual, reação imuno-histoquímica da peroxidase, imunofluorescência, amplificação de sinal, contracoloração, microscopia e análise celular.
Resumo
Uma das coisas mais importantes no campo da neurogênese hipocampal adulta (AHN) é a identificação das células recém-geradas. A imunodetecção de análogos da timidina (como a 5-Bromo-2'-desoxiuridina (BrdU)) é uma técnica padrão usada para visualizar essas células recém-geradas. Portanto, o BrdU é geralmente injetado em pequenos animais por via intraperitoneal, de modo que o análogo da timidina é incorporado às células em divisão durante a síntese de DNA. A detecção é realizada por análise imuno-histoquímica de fatias cerebrais. Todo grupo de pesquisa que tem usado essa técnica pode apreciar que ela requer atenção especial aos mínimos detalhes para alcançar uma mancha bem-sucedida. Por exemplo, um passo importante é a desnaturação do DNA com HCl, que permite que ele atinja o núcleo da célula para manchá-lo. No entanto, os relatórios científicos existentes descrevem muito poucas dessas etapas em detalhes. Portanto, padronizar a técnica é um desafio para novos laboratórios, pois pode levar vários meses para produzir resultados positivos e bem-sucedidos. O objetivo deste trabalho é descrever e elaborar os passos para a obtenção de resultados positivos e bem-sucedidos da técnica de imunocoloração em detalhes ao trabalhar com o análogo da timidina BrdU. O protocolo inclui a preparação e configuração do reagente, administração de análogo de timidina em um roedor, perfusão transcárdica, preparação tecidual, reação imuno-histoquímica da peroxidase, uso do complexo avidina-biotina, imunofluorescência, contracoloração, microscopia e análise celular.
Introdução
A ideia de que novos neurônios são gerados no cérebro humano adulto ao longo da vida tem fascinado a comunidade científica por décadas. O conhecimento de que o cérebro gera novos neurônios ao longo de sua vida útil foi alcançado por meio da detecção de células em divisão 1,2. A detecção de neurônios recém-gerados no cérebro adulto foi primeiramente identificada por injeção intracraniana de timidina tritiada (timidina-H3) em ratos e detecção de células no ciclo celular por auto-radiogramas 1,2. Foi relatada divisão celular da glia e presença de neuroblastos, o que foi o primeiro dado promissor sobre a neurogênese pós-natal1. No entanto, o uso e a detecção da timidina-H3 implicaram o uso de radioatividade, o que pode ser prejudicial para as pessoas que a gerenciam. O primeiro esforço examinando a adequação da imuno-histoquímica BrdU no estudo da proliferação, migração e origem das células no sistema nervoso apareceu em 1988 por Miller e Nowakowski3. Em 1998, um artigo publicado por Eriksson e colegas mostrou que novos neurônios foram visualizados post-mortem no cérebro adulto humano de pacientes injetados com 5-Bromo-2′-desoxiuridina (BrdU)4. Esses pacientes receberam a injeção de BrdU (250 mg por via intravenosa) para marcar o crescimento de tumores4. Essa técnica foi adotada em modelos animais. A introdução desses métodos marcou um marco para o campo, uma vez que permitiu a detecção de células recém-geradas sem o uso de compostos radioativos. Este procedimento tornou-se o padrão-ouro para medir a proliferação celular em nichos cerebrais adultos para promover mais pesquisas no campo.
A limitação da técnica analógica da timidina é que ela não permite a determinação da identidade celular para as células recém-geradas. No entanto, a imuno-histoquímica nos permite realizar a técnica de dupla ou tripla marcação de uma mesma célula, que valida o destino celular das células recém-geradas e até mesmo seus estágios de maturação, levando a uma maior evolução do campo. Este método foi caracterizado para diferenciar células recém-geradas em glia, neurônios indiferenciados ou uma célula granular totalmente madura, e até mesmo para determinar se eles estão participando ativamente do circuito. Outro avanço no campo foi o uso de modelos transgênicos para identificar células indiferenciadas sob o domínio da nestina. Os camundongos transgênicos nestina-GFP expressam uma proteína fluorescente verde (GFP) aprimorada, que está sob o controle do promotor de nestina. A nestina é um filamento intermediário caracterizado por células progenitoras5. Os camundongos transgênicos nestina-GFP permitiram estabelecer etapas iniciais de desenvolvimento envolvidas na neurogênese6. No entanto, uma limitação significativa é ser capaz de manter uma colônia de camundongos transgênicos nestina-GFP sob condições especiais em uma instalação de laboratório que se torna rentável para alguns grupos científicos, especialmente aqueles de países em desenvolvimento.
As técnicas mencionadas acima têm vantagens e desvantagens. No entanto, a identificação de células proliferantes por imuno-histoquímica (IHC) e a possibilidade de realizar a técnica de marcação dupla ou tripla por imunofluorescência para identificar o estágio de maturação celular ou o destino celular representam a maneira mais viável de medir a neurogênese adulta, até o momento. O processo de identificação usando imuno-histoquímica consiste em marcar proteínas, domínio proteico ou nucleotídeos com um anticorpo específico que permite seu reconhecimento conhecido como anticorpo primário. Este último é reconhecido pelo anticorpo secundário, que é marcado com um cromogênio (por exemplo, peroxidase de rábano) ou um fluorocromo (por exemplo, FITC) acoplado ao anticorpo secundário. Os microscópios podem detectar sinais de cromogênios e fluorocromos. Usando IHC, é possível identificar proteínas de membrana, proteínas do citoesqueleto ou componentes nucleares, como o BrdU. Por outro lado, o BrdU pode ser encontrado no núcleo celular, uma vez que é incorporado ao DNA durante a fase S por competição. Portanto, um passo crucial é a desnaturação do DNA com HCl, que abre ligações de DNA para permitir o acesso do anticorpo BrdU ao BrdU dentro do DNA. É essencial saber que a BrdU está presente em uma concentração saturada no soro de camundongos e ratos por 15 e 60 min, respectivamente, após administração intraperitoneal, e depois cai rapidamente para níveis indetectáveis em 60 e 120 min, respectivamente7.
Aqui, descrevemos quatro técnicas de IHC diferentes, mas intimamente relacionadas: detecção indireta cromogênica usando reação de peroxidase de rábano (HRP) com DAB (3,3'-diaminobenzidina) sem amplificação de sinal (etapa 4.1), amplificação do complexo avidina-biotina (ABC) (etapa 4.1), detecção de imunofluorescência indireta sem amplificação de sinal (etapa 4.4) e amplificação marcada de estreptavidina-biotina (LSAB) (etapa 4.3). Cada método tem vantagens e desvantagens e pode ser útil para necessidades teciduais específicas (ver Tabela 1). Decidimos seguir os métodos indiretos de ICH devido à sua acessibilidade e simplicidade para fazer mudanças de métodos de detecção cromogênica para fluorescente ao usar anticorpos primários não conjugados. A abordagem HRP é um método IHC comumente usado devido à sua acessibilidade, alta estabilidade, alta taxa de rotatividade e disponibilidade total dos substratos. No entanto, recomendamos o uso de um controle positivo para confirmar que o método de coloração funciona com precisão e o uso de controle negativo para testar a função do anticorpo de forma eficaz. Imunocolorações múltiplas ou métodos multiplex IHC (ver etapa 6) são ferramentas potentes para adquirir grandes quantidades de dados da seção de tecido em um único experimento. Esta técnica é particularmente importante quando a disponibilidade de amostras é limitada. Outra vantagem é a possibilidade de identificar simultaneamente proteínas específicas co-expressas no mesmo espaço celular, preservando a integridade do tecido. O Multiplex permite corar diferentes marcadores expressos durante estágios proliferativos específicos (por exemplo, nestina, GFAP, DCX, Ki-67), permitindo-nos chegar a uma pesquisa mais detalhada de proliferação e diferenciação8. É crucial escolher anticorpos compatíveis com a técnica de fixação utilizada para evitar a reatividade cruzada. Recomendamos testar cada novo anticorpo (incluindo BrdU) individualmente para ajustar e refinar o método. Em seguida, introduza a coloração sequencial dupla e, finalmente, inicie o processo de imunocoloração simultânea quando o método sequencial estiver totalmente dominado. É crucial escolher anticorpos secundários apropriados para este método.
| Método | Método específico | Vantagens | Desvantagens |
| Método de detecção indireta | Reação da peroxidase com DAB | 1. Maior sensibilidade do que o método de detecção direta e fluorescência indireta. 2. Maior resistência ao fotobranqueamento do que os fluorocromos. 3. Menor custo do que o método de detecção de fluorescência | 1. Difícil para multiplexação com menos corantes de cor. 2. Complicado para alvos co-expressos no mesmo espaço celular. 3. Faixa Dinâmica Reduzida para alvos simultâneos escassos e altamente abundantes no mesmo tecido. |
| Fluorescência | 1. Melhor e mais fácil para multiplexação com mais corantes de cor. 2. Melhor para alvos co-expressos no mesmo espaço celular. 3. Melhor Faixa Dinâmica para alvos simultâneos escassos e altamente abundantes no mesmo tecido. 4. Sem etapas adicionais. | 1. Sensibilidade inferior à reacção indirecta da peroxidase com o método DAB. 2. Resistência fraca ao fotobranqueamento ao longo do tempo. 3. Mais caro. | |
| Método de amplificação de sinal | Complexo Avidina-Biotina (ABC) | 1. Maior sensibilidade do que o método de detecção direta e indireta. 2. Reduza o plano de fundo | 1. Etapas adicionais. 2. Mais caro do que não amplificação. |
| Rotulado Streptavidin-Biotina (LSAB) | 1. Maior sensibilidade do que o método de detecção direta e indireta. 2. Penetração tecidual mais substancial do que o método ABC. 3. Reduza o plano de fundo | 1. Etapas adicionais. 2. Mais caro que o método ABC. | |
| Não método de amplificação adicional | 1. Menor custo. 2. Sem etapas adicionais. 3. Ideal para alvos altamente abundantes. | 1. Menor sensibilidade: problemático sem alvos abundantes. |
Tabela 1: Vantagens/desvantagens das técnicas de IHC. Esta tabela mostra as vantagens/desvantagens para os métodos de detecção indireta: reação da peroxidase com DAB (3,3'-diaminobenzidina) e fluorescência; e métodos de amplificação de sinal: complexo avidina-biotina (ABC), estreptavidina-biotina marcada (LSAB) e não método de amplificação adicional.
Uma imagem de alta resolução é fundamental para realizar uma análise adequada e apresentar os resultados. Existem duas abordagens para melhorar a resolução: 1) uso de um melhor design de microscópio (por exemplo, confocal, multifóton) ou 2) inversão numérica do processo de desfoque para melhorar as imagens usando a deconvolução9. Infelizmente, a microscopia confocal não é acessível devido aos altos custos do equipamento e sua manutenção10. Um microscópio de epifluorescência de campo amplo e a subsequente deconvolução das imagens z-stack fornecem uma alternativa adequada e de baixo custo à microscopia confocal 8,9. Como observado acima, o objetivo da deconvolução é restaurar o sinal original que foi degradado pelo sistema de aquisição9, reduzindo o desfoque, a neblina fora de foco e a distorção mostrada na imagem obtida por um microscópio de epifluorescência ou confocal usando algoritmos matemáticosde remoção 10. A imagem borrada adquirida pode ser modelada matematicamente como resultado da covolvição dos objetos observados com uma função de dispersão de ponto (PSF) 3D. PSF é um padrão teórico de difração dos pontos de luz emitidos pela amostra de tecido e coletados pelo microscópio. O arquivo PSF é criado com as condições específicas de cada imagem, como o espaçamento celular CCD da câmera, o índice de refração da mídia utilizada, a abertura numérica da lente objetiva, o comprimento de onda de emissão do fluoróforo, os tamanhos das imagens, o número de imagens no método de processamento z-stack e o espaço entre elas (ver especificação técnica na Tabela 2). Em outras palavras, o arquivo PSF resume os efeitos da configuração de imagem nas observações do microscópio9. No entanto, usamos o plugin PSF 3D de difração (https://imagej.net/Diffraction_PSF_3D) para criar nosso próprio arquivo PSF específico para cada imagem z-stack. As imagens Z-stack são uma série de seções ópticas digitalizadas de profundidades definidas (eixo z) no mesmo local XY do slide. Um computador compila as informações obtidas a partir do plano de foco reatribuindo sinais que se originaram de objetos localizados em outros planos focais. Para criar imagens z-stack, é necessário tirar imagens de diferentes camadas focadas dos slides (por exemplo, dez imagens diferentes da mesma área XY a cada 1 μm de profundidade). Em seguida, usamos software de microscopia fornecido pelo fabricante ou Fiji para criar uma z-stack ou imagem 3D. O resultado será um único arquivo de imagem de pilha (por exemplo, dez imagens com focos diferentes). Existem várias ferramentas e soluções de software específicas do cliente, como software de código aberto para microscopia de deconvolução. Mostraremos as saídas do processo de deconvolução usando o DeconvolutionLab29, que é um plugin Fiji11 (distribuição do ImageJ12). A deconvolução ajudará a melhorar a resolução das micrografias finais (ver Figura 1B,C). Para mais informações e instruções, recomendamos vivamente a leitura da referência13.
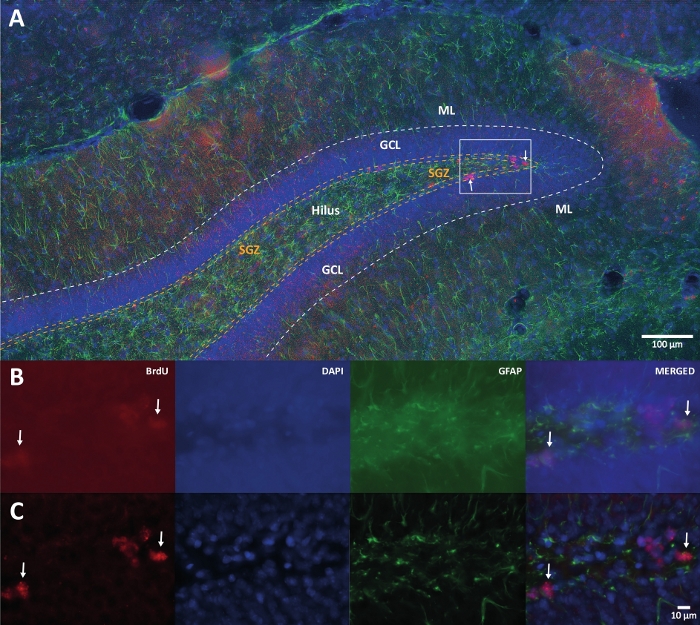
Figura 1: Imagem representativa da deconvolução 3D para vários canais de cores. (A) GD em baixa ampliação. (B) As imagens z-stack originais para cada canal e a imagem mesclada. (C) Imagens z-stack descomplicadas 3D para cada canal e a imagem mesclada. Este cérebro era do rato que fazia parte do grupo de atividade física. Utilizou-se o método de amplificação da estreptavidina-biotina (LSAB) marcado. Mostrou anticorpo conjugado com estreptavidina Cy3 para indicação de BrdU (vermelho), DAPI como contracoloração (azul) e proteína glial fibrilar ácida (GFAP) como marcador astroglial (verde). ML = camada molecular; GCL = camada de células granulares; SGZ = zona subgranular. Por favor, clique aqui para ver uma versão maior desta figura.
O objetivo deste trabalho é fornecer uma descrição detalhada das etapas para a obtenção de resultados positivos e bem-sucedidos com a imunocoloração e listar as etapas comumente utilizadas em estudos baseados em BrdU, sem o uso de um microscópio confocal. A coloração BrdU é uma técnica que requer vários passos que devem ser cuidadosamente seguidos para alcançar uma coloração bem-sucedida. A padronização dessas técnicas de coloração normalmente leva meses e consome tempo e recursos. Antecipamos que este artigo poderia fornecer informações para os grupos que estão começando dentro deste campo, reduzindo o tempo e os erros.
Protocolo
Todos os procedimentos seguem o guia dos Institutos Nacionais de Saúde para o cuidado e uso de animais de laboratório (NIH Publications N°. 8023, revisado em 1978) e as leis mexicanas locais para minimizar o número de animais usados e seu sofrimento. O Comitê de Ética da Universidad Iberoamericana aprovou os protocolos experimentais para o uso de animais neste estudo.
1. Preparação e configuração do reagente
NOTA: A maioria das soluções pode ser preparada dias antes da utilização, salvo especificação em contrário.
- Solução BrdU
- Recuperar a solução de BrdU do congelador a -20 °C e deixá-la equilibrar-se à temperatura ambiente (RT).
- Calcular a massa de BrdU necessária para uma dose de 50 mg/kg de acordo com o peso corporal do rato. Calcular o volume de solução salina a 0,9% (0,9 g de NaCl em 100 mL de H2O estéril) necessário para uma solução de trabalho de 20 mg/mL. Prepare um excesso para fornecer pelo menos 0,5 mL por rato por injeção.
NOTA: A dose administrada a animais experimentais deve ser segura, com efeitos secundários mínimos e eficaz. Foi relatado que a duração da coloração com 100 mg/kg de BrdU não supera a toxicidade potencialmente maior em comparação com a dose de 50 mg/kg7. Não foram encontradas diferenças significativas no número de células marcadas com BrdU/mm3 para 50 e 100 mg/kg i.p. em ratos7. É preferível injetar uma pequena dose para minimizar o sofrimento dos animais. - Pesar a solução de BrdU e adicioná-la à solução salina num tubo cónico e vórtice.
NOTA: Pré-aqueça a solução salina a 45\u201250 °C em banho-maria para volumes superiores a 1 ml. - Colocar o tubo em banho-maria a 50 °C durante 10 °C durante 10 a 2 minutos e vórtice a cada 2 a 2 minutos até se dissolver completamente. Filtre a solução com um filtro de seringa para injeção estéril. Cubra o tubo com papel alumínio, arrefeça-o à temperatura ambiente e utilize imediatamente.
CUIDADO: A solução de BrdU é tóxica e potencialmente cancerígena. Prepare-o no exaustor. A solução de BrdU deve ser manuseada com equipamento de proteção (EPI) adequado. Recomenda-se preparar a solução imediatamente antes do uso. No entanto, a solução é estável por 24 horas sob RT. Por favor, proteja-o da luz.
- Para preparar 1 L de solução salina tamponada com fosfato 0,1 M (PBS) em pH 7,4, adicione 240 mg de fosfato monobásico de potássio (KH 2 PO 4), 1,44 g de fosfato de sódio dibásico (Na 2 HPO4), 200 mg de cloreto de potássio (KCl) e 8 g de cloreto de sódio (NaCl) a 800 mL de água destilada dupla (ddH2O) sob agitação constante. Ajustar o pH a 7,4 e adicionar H2O duplamente destilado até ao volume total de 1 L. Conservar a 4 °C durante um período máximo de 1 semana.
- Para 100 mL de PBS+, adicione 3% (3 mL) de soro de cavalo normal e 0,3% (300 μL) de Triton X-100 a 0,1 M PBS (pH 7,4). Conservar em alíquotas de 20 a 201250 ml a -20 °C durante um período máximo de 3 meses.
Observação : alternativamente, TBS pode ser usado em vez de PBS. Qualquer outro soro diferente dos anticorpos do hospedeiro e do tecido experimental é adequado. - Para 100 mL de PBS++, adicione 10% (10 mL) de soro de cavalo normal e 0,3% (300 μL) de Triton X-100 a 0,1 M PBS pH 7,4. Conservar em alíquotas de 20 a 201250 ml a -20 °C durante um período máximo de 3 meses.
- Para 1 L de solução crioprotetora, misture 250 mL de etilenoglicol e 250 mL de glicerol, mexa constantemente até misturar. Lentamente traga para 1 L com PBS. Filtro com papel de filtro de grau 4 (20\u201225 μm). Conservar a 4 °C ou RT até 1 ano.
- Preparar paraformaldeído a 4% em pbs 0,1 M (solução de PFA) da seguinte forma. Para 1 L de solução, adicionar lentamente 40 g de pó de paraformaldeído a 800 ml de 60\u201265 °C 0,1 M PBS sob agitação constante. Mexer até que o paraformaldeído esteja completamente dissolvido enquanto controla a temperatura (60\u201265 °C). Se necessário, adicione algumas gotas de 1 M de NaOH para clarificar a solução. Quando a solução atingir a temperatura ambiente, filtre com papel de filtro de grau 4 (20-25 μm).
CUIDADO: O paraformaldeído é tóxico e é suspeito de ser um carcinógeno, prepare-se no exaustor. Conservar a 4 °C e, de preferência, utilizar no prazo de 2 dias. A solução pronta para uso de PFA está disponível comercialmente. - Para 1 L de tampão citrato de sódio (SCB) de 10 mM a pH 6, adicionar 1,204 g de citrato de sódio (di-hidratado) e 1,134 g de ácido cítrico a 800 mL de H2O duplamente destilado sob agitação constante. Ajustar o pH a 6,0 e adicionar ddH2O até 1 L. Conservar a 4 °C durante um período máximo de 6 meses.
- Preparar 50 ml de HCl 2 N adicionando lentamente 8,25 ml de HCl 12 N (solução-mãe concentrada) a 41,75 ml de ddH2O sob agitação constante.
CUIDADO: Prepare-se no exaustor. A solução deve ser preparada imediatamente antes da utilização.
NOTA: 2 N HCl será usado para desnaturação de DNA, um passo crucial. Como o BrdU é incorporado ao DNA, o HCl é usado para abrir as ligações de DNA, permitindo o acesso do anticorpo BrdU ao BrdU dentro do DNA. - Preparar a solução endógena de bloqueio da peroxidase da seguinte forma. Preparar 100 mL de peróxido de hidrogênio a 0,6% misturando 2 mL de peróxido de hidrogênio a 30% com 98 mL de ddH2O sob agitação constante.
NOTA: A solução deve ser preparada imediatamente antes da utilização. Mantenha-o no escuro, pois H2O2 é sensível à luz. PBS ou TBS podem ser usados em vez de água. - Prepare a solução de complexo avidina-biotina (ABC) de acordo com as instruções do fabricante. Para 5 mL de ABC em PBS 0,1 M, adicione 2 gotas (≈100 μL) do reagente A e misture, e depois adicione 2 gotas (≈100 μL) do reagente B e misture.
NOTA: A solução deve ser preparada e deixada rolar por 20 a 20 minutos antes do uso. - Prepare o substrato DAB (Diaminobenzidina) Peroxidase (HRP) usando o kit seguindo as instruções do fabricante. A 5 mL de ddH 2 O, adicione 2 gotas (≈ 84 μL) de reagente 1 e misture, adicione 4 gotas (≈ 100 μL) de reagente 2 e misture, depois adicione2gotas (≈ 80 μL) de reagente 3 e misture. Finalmente, se desejar, adicione 2 gotas (≈ 80 μL) do reagente 4 (níquel) e misture.
NOTA: A solução deve ser preparada imediatamente antes da utilização.
CUIDADO: DAB é tóxico e potencialmente cancerígeno. Eles devem ser manuseados com cuidado e descartados de acordo com o regulamento de resíduos perigosos de cada instituição. Para desativar o DAB, adicione várias gotas de água sanitária (hipoclorito de sódio); a solução ficará preta. - Preparar 100 ml de solução de violeta cresil adicionando 100 mg de acetato de violeta de cresilo e 250 μL de ácido acético a 80 ml de ddH2O a 55\u201260 °C. Ajustar o volume para 100 ml, filtrar e armazenar a 4 °C num recipiente de cor escura.
NOTA: O usuário é encorajado a testar diferentes concentrações da solução de violeta cresil antes de usá-lo em amostras de tecido valioso. O resultado pode ser mais escuro para contracoloração com algumas amostras de tecido, o que pode diminuir a capacidade de contar células positivas de BrdU com precisão.
2. Administração de BrdU analógica de timidina
- Restrinja o animal experimental (por exemplo, rato Wistar macho de 90 dias de idade pesando 350 g), imobilizando a cavidade abdominal inferior.
- Administrar a solução de BrdU (50 mg/kg) por via intraperitoneal (i.p.) utilizando uma agulha de 23 G e uma seringa de 1 ml.
NOTA: Ajuste o volume de injeção de acordo com o peso do animal. Use uma agulha de 23 a 201227 G e uma seringa de 1 a 1 0125 mL para ratos adultos. O volume máximo tolerável de injeção intraperitoneal no rato adulto é de 10 ml. Diferentes rotas podem ser usadas para administrar a solução BrdU14. Por exemplo, injeção intraperitoneal ou administração oral através de água potável.
3. Preparação de tecidos
NOTA: Ratos de três meses de idade tiveram acesso ad libitum à atividade física (roda sem fim) por sete dias. No dia 6, os ratos foram injetados com BrdU (passo 2) 3 vezes em intervalos de 12 h. Execute os passos na secção 3 após 8 h da última injeção de BrdU.
- Injetar pentobarbital (50 mg/kg i.p.) e aguardar alguns minutos até que o animal esteja profundamente anestesiado.
NOTA: Certifique-se de que o animal está completamente anestesiado antes de continuar. Aperte cuidadosamente uma das pernas ou a cauda. Se o animal reagir ao estímulo, aguarde mais alguns minutos. Se o animal não reagir ao beliscão, vá para a próxima etapa. - Exponha o coração cortando a pele da cavidade abdominal abaixo do esterno, desmontando as costelas e cortando o diafragma.
- Fixação da perfusão transcárdica
- Insira uma agulha no ventrículo esquerdo e faça uma pequena incisão no átrio direito. Usando uma bomba ou gravidade, perfundir (taxa de fluxo 5\u20127 mL/min.) 0,1 M PBS até que todo o sangue seja drenado e a solução se torne clara.
- Usando uma bomba ou gravidade, realize a perfusão a frio (vazão de 5 a 5 mL/min) com solução de PFA para fixar o tecido até que a cauda se torne rígida.
NOTA: Normalmente, um rato de 300 g requer cerca de 100 a 100 mL da solução de PFA. A fixação tecidual é opcional. Assim, o cérebro pode ser extraído para uso em vários processos para minimizar o uso de animais nos experimentos.
- Dissecção e pós-fixação
- Decapite o animal e extraia suavemente o cérebro do crânio. Imergir o cérebro num tubo cónico contendo solução de PFA (~40 ml para um rato de 250 mg) durante 1 a 4 °C
NOTA: Não fixe demais (mais de 48 h), pois isso pode esgotar a coloração do tecido devido à indisponibilidade de antígenos. - Preparar 100 mL de solução de sacarose a 30%, adicionando 30 g de sacarose a 70 mL de solução PBS a 0,1 M sob agitação constante. Adicionar 0,1 M de solução de PBS a 100 ml. Mergulhe o cérebro em um tubo cônico com uma solução de sacarose a 30% (35 mL) por aproximadamente 1 a 4 °C até que o cérebro afunde no fundo do tubo.
- Decapite o animal e extraia suavemente o cérebro do crânio. Imergir o cérebro num tubo cónico contendo solução de PFA (~40 ml para um rato de 250 mg) durante 1 a 4 °C
- Corte de seções cerebrais coronais
NOTA: O uso de um micrótomo criostático requer orientação e treinamento. Para obter instruções detalhadas, ver referência15.- Submerja todo o cérebro em isopentano a -80 °C e mantenha-o a -80 °C durante 10 minutos. Coloque o cérebro em uma matriz de incorporação em uma placa criostática-micrótoma.
NOTA: Sob certas condições, o congelamento rápido do cérebro a -80 °C pode causar fratura ou danos ao tecido. O usuário deve estar ciente desse problema. Se este for o caso, use -20 °C iso-pentano para congelar o cérebro. - Usando um criostato-micrótomo (temperatura a -25 a -20 °C) corte seções coronais de 40 μm de espessura. Transfira sequencialmente as seções para uma placa de cultura celular de 24 poços com solução de crioproteção seguindo a guia da Figura 2. Conservar a -20 °C até à sua utilização, até alguns meses.
NOTA: Doravante, processe todo o tecido em seções seriais flutuantes de 40 μm em placas de 12 poços com inserções de malha em agitação suave e contínua (10 rpm). É possível armazenar seções cerebrais por anos sob as condições certas.
- Submerja todo o cérebro em isopentano a -80 °C e mantenha-o a -80 °C durante 10 minutos. Coloque o cérebro em uma matriz de incorporação em uma placa criostática-micrótoma.
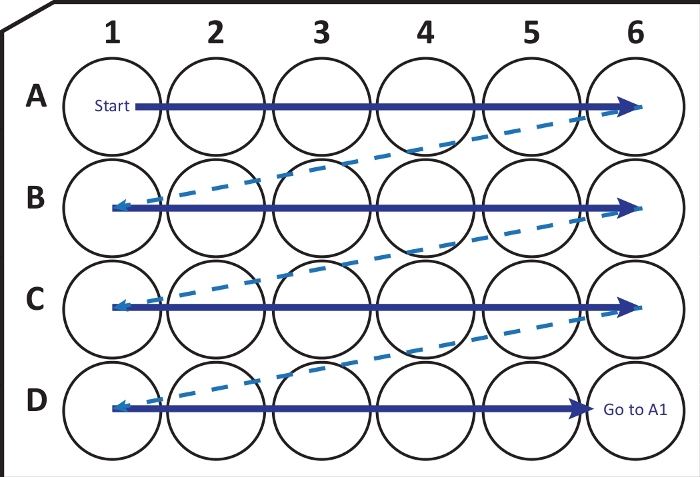
Figura 2: Ilustração esquemática da transferência sequencial de seções de criostato-micrótomo para uma placa de cultura celular de 24 poços com solução de crioproteção. Comece em A1-well e coloque as próximas fatias na linha A; depois de A6-poço passar para a próxima linha B, assim por diante. Ao chegar à D6, volte para a A1 e continue. Esse arranjo permite a quantificação da Nª (por exemplo, sexta para neurogênese, equivalente ao conteúdo de uma coluna) seção de uma região inteira do cérebro. Por favor, clique aqui para ver uma versão maior desta figura.
4. Imunocoloração
NOTA: Consulte a Tabela 1 para o resumo das vantagens e desvantagens de cada técnica.
- Detecção de BrdU utilizando reação de peroxidase com DAB
NOTA: Execute as etapas 4.1.1 a 4.1.5 no dia 1.- Transfira as fatias da solução de crioproteção para 0,1 M PBS à temperatura ambiente. Enxaguar três vezes durante 10 min cada, com 0,1 M PBS.
- Incubar fatias por 30 min em solução de bloqueio de peroxidase endógena para inativar a peroxidase endógena. Enxaguar 3 vezes, 10 min cada, com 0,1 M PBS. Opcionalmente, efetue a recuperação de antigénios (ver secção 5). Incubar fatias durante 20 min com HCl 2 N a 37 °C. Enxaguar em tampão de borato 0,1 M (8,5 pH) durante 10 min. Enxaguar 3 vezes por 10 min cada, com PBS gelado de 0,1 M.
- Incubar fatias por 2 h à temperatura ambiente com PBS++ (solução de bloqueio). Incubar com anticorpo primário anti-BrdU (hospedeiro ratinho) na concentração de 1:250 em PBS+ durante a noite a 4 °C.
- No dia 2, lave as fatias 3 vezes por 10 min cada com 0,1 M PBS.
- Incubar com anticorpo secundário conjugado com HRP 1:250 (anti-rato) em PBS+ durante 2\u20124 h à temperatura ambiente. Enxaguar 3 vezes por 10 min cada com 0,1 M PBS.
- Transfira fatias para a solução de substrato de DAB Peroxidase (HRP) e incube por 2 a 201210 min. Quando as fatias ficarem cinza escuro, visualize o tecido com uma lupa ou um microscópio. Se houver células positivas, enxágue 3 vezes (por 15 minutos cada) com água da torneira (para reduzir o fundo). Lave 3 vezes por 10 min cada com 0,1 M PBS.
- Monte cuidadosamente as fatias em lâminas gelatinizadas usando uma escova macia, seque ao ar durante a noite à temperatura ambiente. Contra-manchar (ver ponto 7.1), adicionar um meio de montagem permanente e colocar as tampas. Conservar a 4 °C durante um período máximo de 6 meses.
- Detecção de BrdU utilizando reação de peroxidase com o complexo avidina-biotina-peroxidase
NOTA: Execute as etapas 4.2.1 a 4.2.5 no dia 1.- Transfira as fatias da solução de crioproteção para 0,1 M PBS para levar à temperatura ambiente. Enxaguar 3 vezes por 10 min cada com 0,1 M PBS.
- Incubar durante 30 min com solução de bloqueio da peroxidase endógena para inactivar a peroxidase endógena. Enxaguar 3 vezes durante 10 min cada em 0,1 M PBS. Opcionalmente, efetue a recuperação de antigénios (ver secção 5).
- Incubar durante 20 min com HCl 2 N a 37 °C. Enxaguar em tampão de borato 0,1 M (pH 8,5) durante 10 min. Lave 3 vezes por 10 min cada com PBS gelado de 0,1 M.
- Incubar por 2 h à temperatura ambiente em PBS++ (solução de bloqueio).
- Incubar com anticorpo primário anti-BrdU (hospedeiro rato) 1:250 em PBS+ durante a noite a 4°C.
- No dia 2, enxágue 3 vezes por 10 min cada com 0,1 M PBS.
- Incubar com 1:250 anticorpo secundário biotinilado (anti-rato) em PBS+ durante 2\u20124 h à temperatura ambiente. Enxaguar 3 vezes por 10 min cada com 0,1 M PBS.
- Incubar na solução ABC por 1 h à temperatura ambiente. Enxaguar 3 vezes por 10 min cada com 0,1 M PBS.
- Transfira fatias para a solução de substrato de DAB peroxidase (HRP) e incube por 2 a 201210 min. Quando as fatias ficarem cinza escuro, visualize o tecido com uma lupa ou um microscópio. Se células positivas estiverem presentes, enxaguar 3 vezes (15 min cada) com água da torneira (para reduzir o fundo), seguido por 3 vezes com lavagem PBS de 0,1 M por 10 min cada.
NOTA: A solução deve ser preparada imediatamente antes da utilização. Deve-se tomar cuidado para evitar que as fatias cerebrais grudem umas nas outras devido a manchas escuras irregulares no tecido. - Monte cuidadosamente as fatias em lâminas gelatinizadas usando uma escova macia e, em seguida, seque ao ar durante a noite à temperatura ambiente.
- Se necessário, contra-manchar (ver passo 7.1), adicionar um meio de montagem permanente e colocar as tampas. Conservar a 4 °C durante um período máximo de 6 meses.
- Detecção de BrdU por imunofluorescência usando amplificação de Streptavidin-Biotina (LSAB) marcada
NOTA: Execute as etapas 4.3.1 a 4.3.4 no dia 1.- Transfira as fatias da solução de crioproteção para 0,1 M PBS à temperatura ambiente. Enxaguar 3 vezes por 10 min cada com 0,1 M PBS. Opcionalmente, efetue a recuperação de antigénios (ver secção 5).
- Incubar durante 20 min em HCl 2 N a 37 °C. Enxaguar em tampão de borato 0,1 M (8,5 pH) durante 10 min. Enxaguar 3 vezes por 10 min cada em PBS 0,1 M gelado.
- Incubar por 2 h à temperatura ambiente em PBS++ (solução de bloqueio). Incubar com 1:250 anticorpo primário anti-BrdU (hospedeiro rato) em PBS+ durante a noite a 4 °C.
- No dia 2, enxágue 3 vezes por 10 min cada com 0,1 M PBS.
- Incubar com 1:250 anticorpo secundário biotinilado (anti-rato) em PBS+ durante 2\u20124 h à temperatura ambiente. Enxaguar 3 vezes por 10 min cada com 0,1 M PBS. Incubar com estreptavidina conjugada com fluorocromo 1:250 (Cy3) em PBS (não utilize soro) durante 1\u20122 h à temperatura ambiente. Enxaguar 3 vezes por 10 min cada com 0,1 M PBS.
NOTA: O soro pode conter biotina e não deve ser adicionado aos diluentes. Em vez disso, use PBS contendo 0,3% de Triton X-100. - Monte cuidadosamente as fatias em lâminas gelatinizadas usando uma escova macia, seque ao ar durante a noite à temperatura ambiente ou monte imediatamente com um meio de montagem apropriado. Contra-manchar (ver passo 7.2), adicionar um meio de montagem permanente e colocar as tampas. Conservar a 4 °C durante um período máximo de 6 meses.
- Detecção de BrdU por imunofluorescência indireta
NOTA: Execute as etapas 4.4.1 a 4.4.4 no dia 1.- Transfira as fatias da solução de crioproteção para 0,1 M PBS até atingir a temperatura ambiente. Enxaguar 3 vezes por 10 min cada com 0,1 M PBS. Efectuar a recuperação do antigénio, se necessário (opcional, ver secção 5).
- Incubar durante 20 min em HCl 2 N a 37 °C. Enxaguar em tampão de borato 0,1 M (8,5 pH) durante 10 min. Enxaguar 3 vezes por 10 min cada com PBS gelado de 0,1 M. Incubar por 2 h à temperatura ambiente com PBS++ (solução de bloqueio). Incubar com 1:250 anticorpo primário anti-BrdU (hospedeiro rato) em PBS+ durante a noite a 4 °C.
- No dia 2, enxágue 3 vezes por 10 min cada com 0,1 M PBS.
- Incubar com anticorpo secundário conjugado com fluorocromo 1:250 (anti-rato) em PBS+ durante 2\u20124 h à temperatura ambiente. Enxaguar 3 vezes por 10 min cada com 0,1 M PBS.
- Monte cuidadosamente as fatias em lâminas gelatinizadas usando uma escova macia, seque ao ar durante a noite à temperatura ambiente ou monte imediatamente com um meio de montagem apropriado. Contra-manchar (ver passo 7.2), adicionar um meio de montagem permanente e colocar as tampas. Conservar a 4 °C durante um período máximo de 6 meses.
5. Recuperação de antígenos (opcional)
NOTA: A Recuperação de Antígenos é uma etapa opcional destinada a corrigir a perda de antigenicidade causada pela fixação que modifica a estrutura terciária e quaternária de muitos antígenos, tornando-os indetectáveis por anticorpos. Esta etapa pode ser adicionada ao protocolo original.
- Em um micro-ondas ou banho de água, pré-aqueça a solução de pH 6 do tampão de citrato de sódio (SCB) de 10 mM a 90 a 90 °C (dependendo da altitude, a solução começa a ferver em torno dessa temperatura). Encha 80% de um tubo cônico de 50 mL (40 mL) com SCB pré-aquecido. Transfira as fatias para as inserções de malha no tubo cônico com SCB. Cubra o tubo com uma tampa de rosca com orifícios feitos com uma agulha de 18 a 18 a 220 G.
- Mantenha as fatias durante 30 minutos em SCB a 80 a 801285 °C alternando ciclos de aquecimento no micro-ondas ao nível mínimo de potência. Se necessário, recarregue o tubo cónico com SCB. Transfira as fatias imediatamente após junto com as inserções de malha em PBS gelado de 0,1 M e enxágue 3 vezes por 10 min cada.
6. Imunocorantes múltiplas (opcional)
Observação : consulte a seção de introdução para a lógica por trás desta etapa.
- Imunocolorações múltiplas simultâneas
- Prepare um coquetel com os anticorpos primários para o alvo (por exemplo, anti-BrdU de camundongo e anti-GFAP de coelho) em PBS+. Use hospedeiros diferentes para cada anticorpo primário usado. Incubar durante a noite a 4 °C. Continue com as mesmas próximas etapas para cada protocolo.
- Prepare um coquetel com os anticorpos secundários correspondentes para cada anticorpo primário usado (por exemplo, FITC anti-camundongo de cabra, TRITC anti-coelho de cabra) na mesma solução diluente para cada protocolo. Continue com as mesmas próximas etapas para cada protocolo. Idealmente, use anticorpos secundários que vêm dos mesmos hospedeiros para evitar reações cruzadas.
- Imunocolorações múltiplas sequenciais.
- Siga o protocolo para o primeiro alvo de anticorpos (por exemplo, anti-BrdU de camundongo) e pare antes da montagem das fatias. Incubar por 2 h à temperatura ambiente com PBS++ (solução de bloqueio).
- Incubar o segundo anticorpo primário (por exemplo, anti-GFAP de coelho) em PBS+ durante a noite a 4 °C. Siga os próximos passos para cada protocolo, incluindo a incubação do segundo anticorpo secundário (por exemplo, TRITC anticoelho de cabra). Continue com as próximas etapas para cada protocolo até o final.
7. Contracoloração (opcional)
- Para os protocolos que utilizam a reacção à peroxidase, pré-aqueça a solução violeta cresil a 60 °C. Hidrate as lâminas com ddH2O por 1 min. Incubar as lâminas na solução quente de violeta cresil por 5\u201220 min.
- Lave as lâminas com ddH2O por 1 min. Enxaguar as lâminas com álcool etílico de 70%, 80%, 90% e 100% por 1 a 20123 min cada. Lave as lâminas com xileno por 1\u20123 min.
- Adicione o meio de montagem hidrofóbico permanente e coloque as tampas.
NOTA: Conservar a 4 °C até 6 meses. O meio de montagem self-made contendo PVA (álcool polivinílico)-DABCO pode ser empregado.
- Para protocolos que utilizam imunofluorescência, adicione um pequeno volume (25\u201250 μL) de meio de montagem hidrofílico com DAPI, iodeto de propídio ou similar. Sele ao redor do perímetro com esmalte ou um selante de plástico. Conservar a 4 °C durante um período máximo de 6 meses.
8. Imagem e análise
NOTA: Consulte a Tabela 2 para obter as especificações de configuração do microscópio. Normalmente, a contagem das novas células coradas é feita usando as fatias coradas da reação da peroxidase (método mais barato), mas também pode ser realizada usando imunofluorescência.
- Para quantificar as células, primeiro, identifique o giro dentado adequadamente com a lente de ampliação 4x (para mais instruções sobre detalhes anatômicos do DG, ver Amaral et al.16).
- Procure na camada de células granulares do giro dentado por núcleos marcados com BrdU (usando a lente de ampliação de 40x). Execute a pesquisa de células exaustivamente ao longo do eixo z, uma vez que novas células podem ser distribuídas em diferentes camadas (consulte o Vídeo 1).
- Selecione uma seção de intervalo para a busca celular em todo o giro dentado (por exemplo, cada 6ª seção de tecido, equivalente a cada 240 μm).
- Conte todas as células BrdU positivas. A morfologia do núcleo marcado pode mudar dependendo da quantidade de BrdU que a célula incorporou (ver Figura 3 como guia). Mova-se lentamente sobre o eixo z para quantificar todos os vários núcleos que integram um aglomerado (veja o Vídeo 2).
- Multiplique o número total de células contadas com a seção de intervalo selecionada (por exemplo, 6) para estimar o número total de novas células marcadas com BrdU.
- Idealmente, em um experimento regular, conte pelo menos dez seções por animal e pelo menos cinco animais por grupo.
- Deconvolução de imagem (opcional)
Observação : consulte a seção de introdução para obter informações importantes sobre esta etapa. Este procedimento necessita de imagens monocromáticas (tons de cinzento). Transforme imagens coloridas em tons de cinza. Se as imagens forem um composto RGB, primeiro divida os canais e mescle-os como uma única imagem (não composta) e, em seguida, transforme em escala de cinza de 8 bits.- Crie um arquivo z-stack a partir de micrografias.
- Crie um arquivo de função de propagação pontual (PSF) abrindo o plug-in Diffraction PSF 3D (https://imagej.net/Diffraction_PSF_3D) no menu Plug-ins de opção. Preencha todos os dados necessários (ver Tabela 2). Pressione OK e salve o arquivo.
- Abra o plugin DeconvolutionLab29 no menu de opções Plugins (http://bigwww.epfl.ch/deconvolution/deconvolutionlab2/). Arraste a imagem z-stack correspondente e o arquivo PDF para o slot de janela correspondente.
- Selecione o algoritmo de deconvolução (por exemplo, Richardson-Lucy) e o número de iterações (por exemplo, 20). Pressione RUN.
- Combine as imagens descomplicadas em uma única imagem z-stack selecionando Pilhas no menu Imagem na parte superior. Em seguida, clique em Z Project. Selecione Intensidade máxima no menu suspenso Tipo de projeção , pressione OK e salve o arquivo.
- Crie uma imagem RGB usando o único arquivo de imagem z-stack criado na etapa acima com a pseudocor desejada selecionando Cor no menu Imagem na parte superior. Em seguida, clique em Mesclar canais. Defina a imagem correspondente para o canal de cor de desejo no menu suspenso. Desmarque a caixa Create Composite, pressione OK e salve o arquivo (consulte a Figura 4).
- Se houver mais de uma imagem de canal, repita as etapas 8.2.1\u20128.2.5. Crie um arquivo de imagem RGB seguindo a etapa 8.2.6, abrindo pelo menos dois arquivos de imagem e selecionando canais de cores diferentes para cada arquivo de imagem (consulte a Figura 4).
Resultados
Os métodos descritos acima foram aplicados para quantificar células recém-nascidas no hipocampo de ratos adultos após atividade física voluntária, em contraste com um grupo controle sem qualquer atividade física extra. Utilizou-se o hipocampo pós-natal de ratos como controle positivo. Ratos machos de 3 meses de idade estavam sob um protocolo de atividade física voluntária (roda sem fim) por sete dias. No dia 6, os ratos foram injetados com BrdU (secção 2) e de 12 em 12 h após três injeções completas. Para completar três divisões do ciclo celular, os animais foram perfundidos transcardialmente (secção 3) 8 h após a última injeção de BrdU. O mesmo procedimento foi utilizado em ratos de três meses de idade que não foram submetidos à atividade física para ser utilizado como controle comparativo. Como controlo positivo, os filhotes de ratos com um dia de idade (dia 1 pós-natal) foram injetados com BrdU uma vez, conforme descrito na secção 2 acima. Um dia após a injeção (dia 2 pós-natal), os filhotes foram sacrificados e suas cabeças foram imersas em solução de PFA, conforme descrito na etapa 3.4. Os ratos adultos foram profundamente anestesiados (passo 3.1), perfundidos transcardialmente, conforme descrito no passo 3.2. Os cérebros foram dissecados e pós-fixados (etapa 3.4). Os cérebros foram cortados em cortes coronais de 40 μm (etapa 3.5). Os cortes foram processados para imuno-histoquímica de BrdU, conforme descrito na etapa 4.
Utilizou-se reação de peroxidase de rábano com DAB IHC para coloração (etapa 4.1) e contagem de células BrdU-positivas em GD. A Figura 5 mostra uma seção DG com células marcadas com BrdU. A Figura 5C,D mostra uma parte representativa da secção DG com maior ampliação. As células marcadas apresentavam coloração escura intensa, marcadas com setas. A inserção mostra o número médio de células marcadas nos grupos experimental e controle (células positivas contadas multiplicadas por seis, conforme descrito na etapa 8.1). O teste t de Student revelou diferenças de significância entre os números de células BrdU-positivas (t(10) = 2,704, p = 0,0222). O grupo controle que não realizou atividade física apresentou 2.040 ± 314 células (n = 6 ratos). Em comparação, o grupo de atividade física mostrou, em média, 3.606 ± 486 (n = 6 ratos) células BrdU-positivas. Como observado, a exposição à atividade física aumenta as células BrdU-positivas. Portanto, esses resultados são consistentes com outros resultados relatados que mostram que a atividade física aumentou a proliferação celular no giro dentado adulto17.
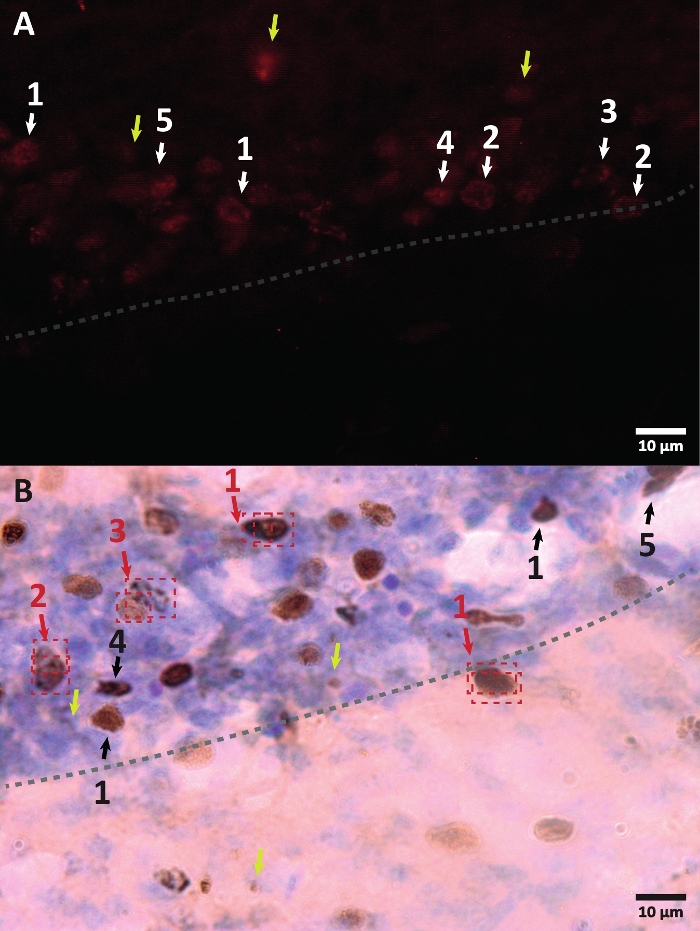
Figura 3: Exemplos de diferentes morfologias do núcleo celular marcado com BrdU. BrdU é um marcador de síntese de DNA que marca o núcleo. Na região do hipocampo, os núcleos BrdU-positivos tinham uma forma semi-oval localizada na zona subgranular do giro dentado. Como o BrdU é incorporado por competição, a quantidade incorporada para cada célula terá uma variação que mais tarde será refletida em como o núcleo será visualizado. (A) Imagem de imunofluorescência. (B) Uma imagem usando a reação da peroxidase sem um método de amplificação adicional é apresentada. Setas amarelas mostram artefatos e sinais não específicos. Setas pretas ou brancas mostram células BrdU+. 1 – Núcleo totalmente arquivado, núcleos semi-ovais altamente coloridos. 2 – Núcleos com pontos, a borda dos núcleos é marcada e tem dentro vários pontos. 3 – Núcleos com poucos pontos, a borda dos núcleos são marcados e têm um pequeno número de pontos dentro. 4 – Núcleo pequeno é possível células em um estágio de diferenciação diferente, mas ainda parte do nicho. 5 – Os aglomerados são células precursoras em divisão, pelo que podem ser observadas várias células juntas em grupos condensados. Dentro desses grupos, a contagem deve ser feita com especial cuidado para evitar a rotulagem incorreta de células positivas. As setas vermelhas mostram o núcleo sob divisão que pode ser confundido como sendo uma única célula. Cada célula é colocada em uma caixa e pode ser distinguida em um plano do eixo Z em tempo real. Por favor, clique aqui para ver uma versão maior desta figura.
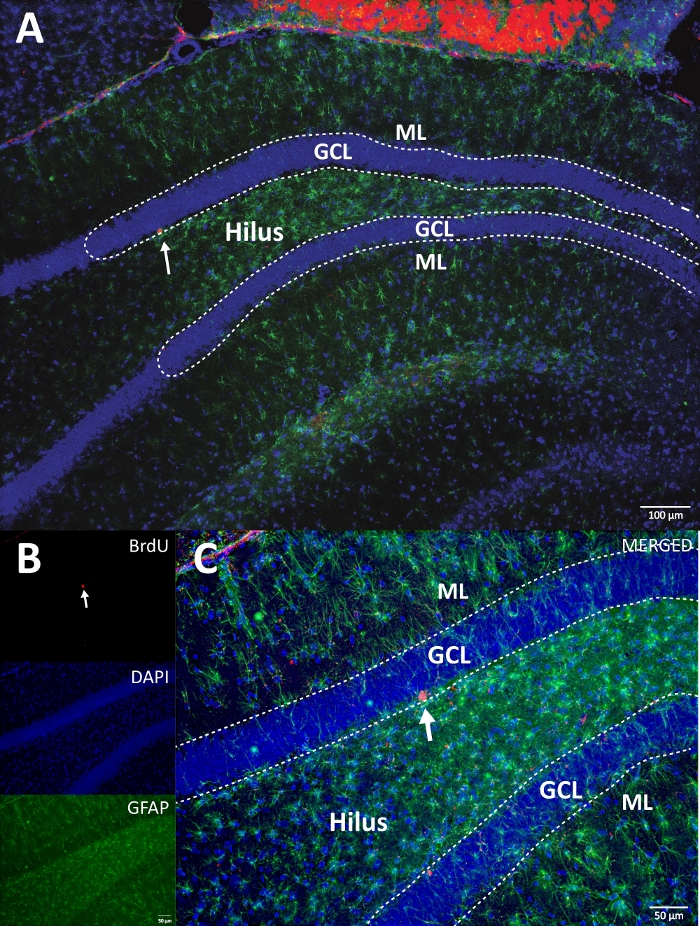
Figura 4: Imagem RGB representativa para canais únicos e mesclados. A imagem superior mostra a imagem original da pilha z e a imagem inferior mostra a imagem da pilha z descomplicada em 3D. (A) Baixa ampliação da DG. (B) imagem RGB para cada canal e (C) imagem mesclada RGB. Este era um cérebro do grupo de controle. A imunofluorescência foi utilizada sem um método de amplificação adicional. BrdU (vermelho), DAPI como contracoloração (azul) e GFAP (proteína glial fibrilar ácida) como marcador astroglial (verde). ML = camada molecular; GCL = camada de células granulares; SGZ = zona subgranular. Por favor, clique aqui para ver uma versão maior desta figura.
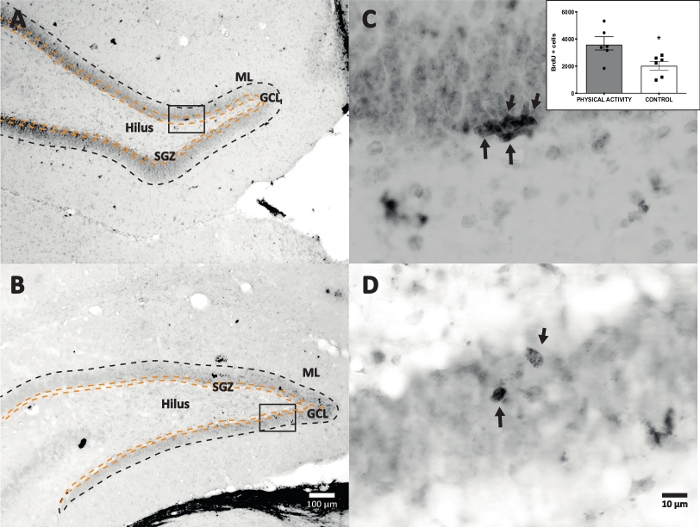
Figura 5: Seção DG representativa com células marcadas com BrdU (escuro intenso) para cada grupo experimental. A reação da peroxidase foi utilizada com o método de amplificação do complexo avidina-biotina-peroxidase. (A, B) Mostrar uma ampliação baixa do GD e (C, D) mostrar a área da caixa com ampliação mais alta. Os painéis A e C são tecidos do grupo de atividade física, os painéis B e D são do grupo controle. A inserção mostra o número médio de células marcadas nos grupos de atividade física e controle (células positivas contadas multiplicadas por seis, conforme descrito na etapa 8.1). ML = camada molecular; GCL = camada de células granulares; SGZ = zona subgranular; as setas indicam células BrdU+. Por favor, clique aqui para ver uma versão maior desta figura.
Vídeo 1: Vídeo mostrando um foco diferente de células positivas ao longo do eixo z distribuídas em diferentes camadas. Por favor, clique aqui para baixar este vídeo.
Vídeo 2: Vídeo mostrando um foco diferente de aglomerados de células positivas ao longo do eixo z distribuído em diferentes camadas. Mova-se lentamente sobre o eixo z para quantificar todos os vários núcleos que integram um aglomerado. Por favor, clique aqui para baixar este vídeo.
| Tipo de microscópio: | Microscópio de epifluorescência Olympus BX53 | ||||
| Luz: | Lâmpada de arco de mercúrio de alta pressão de 130 W (U-HGLGPS) | ||||
| Software de Aquisição: | Padrão CellSens | ||||
| Conjuntos de filtros: | Número de catálogo | Faixa de Excitação | Espelho dicromática | Intervalo de supressão | |
| U-FUW | 340 - 490 nm | 410 nm | 420 nm | ||
| U-FBW | 460 - 495 nm | 505 nm | 510 nm | ||
| U-FGW | 530 - 550 nm | 570 nanômetro | 575 nanômetro | ||
| Câmera: | Modelo: | CCD-câmera UC50 | |||
| Faixa espectral: | 290 – 1000 nm | ||||
| Tamanho do chip CCD: | 2/3 pol, 2588 (Largura *7) X 1960 (Altura *8) pixels | ||||
| Tamanho do pixel: | 3,4 X 3,4 μm | ||||
| Fluorochrome: | Nome | Comprimento de onda de excitação (nm) | Emissão *3 Comprimento de onda (nm) | Cor da emissão | |
| 4, 6-diamidino-2-fenil-indol HCI (DAPI) | 345 | 455 | Azul | ||
| Tetrametilrodamina-isotiocianato (TRITC) | 541 | 572 | Vermelho | ||
| Fluoresceína-isotiocianato (FITC) | 494 | 519 | Verde | ||
| Cy3 | 552 | 565 | Vermelho | ||
| Montagem Média e óleo de imersão: | Nome | Índice de refração do meio *1 | |||
| Ar (nada entre a lâmina e a lente) | 1.00029 | ||||
| Meio de montagem antifade com DAPI | 1.45 | ||||
| Meio de montagem Permount | 1.519 | ||||
| Óleo de imersão de baixa autofluorescência (MOIL-30 Tipo F) | 1.518 | ||||
| Lente de Ampliação (Plano de Fluorita) | Ampliação | Abertura numérica (NA) *2 | Resolução (μm) | Espaçamento de pixels de imagem (nm) *5 | Espaçamento entre fatias do eixo Z (nm) *6 |
| 4X | 0.13 | 2.12 | 850 | 3000 | |
| 10X | 0.3 | 0.92 | 340 | 3000 | |
| 20X | 0.5 | 0.55 | 170 | 2000 | |
| 40X | 0.75 | 0.37 | 85 | 1000 | |
| 100X | 1.3 | 0.21 | 34 | 1000 | |
Tabela 2: Especificações de configuração do microscópio e requisitos de criação de arquivos PSF (função de propagação pontual). Existem 11 slots na janela do plugin PSF 3D de difração para criar o arquivo PSF. Cada slot é descrito da seguinte forma: *1 - Índice de refração do meio: índice de refração para o meio entre a lâmina e a lente (por exemplo, ar = 1,00029). *2 - Abertura Numérica: NA da lente utilizada (deve ser corrigida quando uma mídia de imersão diferente é usada e a lente foi atribuída). *3 - Comprimento de onda: Comprimento de onda máximo de emissão de fluorocromo (nm). *4 - Aberração Esférica Longitudinal: 0,00. *5 - Espaçamento de pixels da imagem: tamanho do pixel CCD (nm)/Ampliação (por exemplo, lente de 3,4 μm e 100X, 3400/100 = 34 nm). *6 - Distância entre as imagens do eixo Z. *7 - Largura: Insira a largura da imagem a ser desconvolvida em pixels. *8 - Altura: Insira a altura da imagem a ser desconvolvida em pixels. *9 - Profundidade, fatias: o número de imagens na pilha z. *10 - Normalização: Soma dos valores de pixel = 1. *11 - Título: Nome desejado para o arquivo PSF. O arquivo deve corresponder à imagem z-stack exclusiva fornecida.
Discussão
A neurogênese adulta é um processo que ocorre com mais frequência em nichos de células precursoras neurais adultas que têm o potencial de gerar novos neurônios ao longo de sua vida útil. A marcação com bromodeoxiuridina (BrdU) é amplamente utilizada em imunologia para caracterizar o número de células recém-geradas em um cérebro adulto. BrdU será incorporado principalmente em células de regiões cerebrais discretas (zonas neurogênicas). Essas células estão localizadas na zona subventricular (ZSV), o giro dentado do hipocampo, entre o hilo e as células granulares conhecidas como zona subgranular (ZG)1,2,18. Além disso, existem diferentes regiões cerebrais caracterizadas por uma menor capacidade proliferativa na idade adulta, incluindo o hipotálamo, estriado, neocórtex e amígdala19. Como mencionado anteriormente, a coloração BrdU é o método comumente usado para pesquisa de neurogênese adulta para detectar a proliferação celular. No entanto, o uso de BrdU como marcador tem limitações e armadilhas. A primeira é que BrdU é um marcador de ciclo celular. Portanto, a coloração dupla ou tripla deve ser realizada para identificar o destino celular e incluir marcadores celulares para detectar o estágio específico de desenvolvimento das células marcadas. Mais uma preocupação sobre o BrdU é que é uma solução tóxica e mutagênica que modifica a estabilidade do DNA pode alterar a função celular e os ciclos celulares. Deve-se considerar as informações prévias ao decidir seguir um protocolo de administração e doses de administração (50 a 1600 mg/kg). Outra característica crucial é que o BrdU é um marcador de síntese de DNA, não um marcador de proliferação celular14. Portanto, é relevante distinguir a proliferação celular de outros eventos, como um reparo de DNA, reentrada abortiva do ciclo celular e duplicação de genes. Os pesquisadores devem seguir os controles apropriados para garantir o uso apropriado do BrdU. Para uma discussão mais detalhada sobre esses problemas e limitações, recomendamos a revisão do trabalho de Taupin14. O processo de padronização de um protocolo de imuno-histoquímica pode ser lento e desafiador. Neste trabalho, apresentamos todas as etapas gerais para gerenciar um protocolo IHC bem-sucedido. No entanto, recomendamos que todos os grupos de pesquisa testem e avaliem tecidos, anticorpos e condições com antecedência. Testes e avaliações devem ser realizados com pelo menos três níveis diferentes de incubações, etapas de lavagem e dosagens para cada anticorpo e tecido testado. Recomenda-se também que os pesquisadores revisem protocolos adicionais para poder escolher o melhor que atenda às necessidades e requisitos específicos 20,21,22,23,24,25.
Como mencionado anteriormente, o procedimento envolve várias etapas e considerações metodológicas que são comumente utilizadas e mencionadas em artigos científicos, que serão discutidas posteriormente. Recomendamos que os pesquisadores escolham os anticorpos com cuidado e corretamente em termos de técnica, orçamento, equipamento, configuração e principal objetivo de pesquisa. Os anticorpos devem ser testados com o mesmo tipo de tecido que será posteriormente testado no experimento. Também recomendamos o uso de um anticorpo que foi testado para a mesma finalidade (IHC) (ou seja, não apenas em técnicas de western blot ou citometria de fluxo) para testar sua compatibilidade com a técnica de fixação. Diferentes vias podem ser usadas para administrar a coloração BrdU, como injeção intraperitoneal, infusão intraperitoneal, ingestão oral ou infusão intraventricular (para uma descrição mais detalhada de cada técnica, ver referência26). Se a injeção intraperitoneal for selecionada, certifique-se de que o BrdU é administrado na cavidade peritoneal, evitando a área do intestino. Uma vez que o intestino tem várias células em duplicação que podem esgotar o BrdU antes de chegar ao cérebro, o que afetará o número de células marcadas. É crucial obter seções finas, uma vez que permitem uma melhor penetração das soluções. Cortes coronais de 40 μm de espessura foram cortados rostro-caudalmente e transferidos para uma placa de cultura celular de 24 poços, seguindo o procedimento estereológico proposto por Kempermann et al.27. A imuno-histoquímica pode ser realizada com tecido montado em lâminas ou como seções flutuantes. Uma vez que o BrdU está localizado profundamente nos núcleos das células, permite a penetração de soluções em secções flutuantes livres, o que proporciona melhores resultados e melhor acesso à área de interesse. É importante abrir ligações de DNA (desnaturação do DNA) para permitir o acesso primário ao anticorpo anti-BrdU. Neste trabalho, realizamos esses procedimentos específicos com o uso da incubação de IHC. Por outro lado, o processo de bloqueio de epítopos inespecíficos permitiu uma identificação mais precisa do sinal celular.
A boa permeabilização da membrana permite que os anticorpos penetrem adequadamente na área de interesse. A adição de um permeabilizador como o Triton X-100 às soluções PBS++ e PBS+ melhora a permeabilização da membrana. Ambos os reagentes PBS e Tris-buffered saline (TBS) podem ser usados neste protocolo. Em termos de orçamento, o TBS poderia ser relatividade mais barato do que o PBS. No entanto, a PBS pode interferir com anticorpos antifosfato e inibir anticorpos conjugados com fosfatase alcalina, portanto, evite o uso de PBS se o alvo for pós-translacionalmente modificado por fosforilação (ou seja, fosforilado). Utilizamos o PBS para este trabalho e descobrimos que as etapas de lavagem de tecidos davam um sinal mais específico. Também recomendamos que os pesquisadores realizem pelo menos três ciclos de lavagem usando TBS ou PBS. As soluções devem ser preparadas na hora. A recuperação de antígenos (RA) é um método destinado a reduzir a perda de antigenicidade causada pela fixação que modifica a estrutura dos antígenos terciários e quaternários. Essa redução torna os antígenos indetectáveis por anticorpos28,29. A recuperação de epítopos induzida pelo calor (HIER) utilizada neste protocolo tentou reverter as reações químicas entre formaldeído e proteínas por alta temperatura ou forte hidrólise alcalina (com outras soluções tampão como EDTA pH 8,5 ou Tris pH 9,5). É essencial testar novos anticorpos com diferentes protocolos de RA para comparar os resultados e escolher o melhor para o protocolo. Esta última etapa pode ser opcional em um protocolo regular; no entanto, tratamos tecidos com um protocolo de recuperação de antígenos para fornecer melhores resultados para este protocolo.
É crucial selecionar a cor contrastante final correta e a técnica de contracoloração em consideração à cor de coloração primária e ao método usado para tornar visível uma estrutura não corante e evitar mascarar a cor de coloração primária da reação imune. Para a microscopia de fluorescência, o DAPI (4', 6-diamidino-2-fenilindol) é uma contramancha nuclear e cromossômica muito popular que emite fluorescência azul (absorção: 360 nm, emissão: 460 nm) ao se ligar a regiões AT do DNA. O meio de montagem contendo DAPI está disponível e é fácil de usar; isso fornece excelente retenção de sinal para aquisição de imagens. Para a reação de peróxido, a IHC estava disponível em diferentes opções, como violeta cresil, hematoxilina, vermelho neutro ou coloração verde metila. Para técnicas de imunocoloração múltipla, é crucial escolher um anticorpo compatível com a técnica de fixação utilizada para evitar a reatividade cruzada30. Quando problemas e complicações com coloração única forem resolvidos, administre outra coloração de cor, conforme considerado necessário. É crucial controlar a ligação inespecífica entre os anticorpos secundários. Isso pode ser feito saturando os anticorpos primários antes de usar um anticorpo secundário produzido na mesma espécie hospedeira dos anticorpos primários. Por exemplo, ao utilizar anti-rato produzido em coelho e anti-coelho produzido em anticorpos secundários de cabra, o anti-coelho produzido em anticorpo de cabra deve ser utilizado antes do anti-rato produzido em anticorpo de coelho. Quando o método sequencial é dominado completamente, o processo de imunocoloração simultânea pode ser iniciado. Neste método, é essencial escolher anticorpos secundários adequadamente. Idealmente, todos esses anticorpos devem vir do mesmo animal hospedeiro para evitar a reatividade cruzada. Recomendamos executar um controle positivo para confirmar que o método de coloração funciona com precisão no tecido pós-natal do hipocampo (neurogênese abundante em torno dessa idade). Se o tecido de controle positivo apresentar problemas de coloração, revise e reveja o procedimento, faça correções e ajustes e repita até que uma boa coloração seja produzida. Em seguida, execute um controle negativo para testar se o anticorpo funciona corretamente, omitindo ou substituindo um anticorpo primário específico por soro normal (mesma espécie que o anticorpo primário). Como mencionado na introdução, a deconvolução de imagem é uma ferramenta poderosa e fornece uma alternativa quando um microscópio confocal não está disponível. Ele pode aplicar a deconvolução da imagem a todas as imagens obtidas usando campo brilhante de luz transmitida, fluorescência de campo largo e microscopia de fluorescência confocal. O objetivo final da deconvolução da imagem é reconstruir o sinal original de que o sistema de aquisição se deteriora10.
Em resumo, a identificação das células recém-geradas visualizadas pela imunodetecção do BrdU análogo da timidina é uma técnica complicada, mas poderosa. Este trabalho é uma tentativa de ajudar os cientistas, particularmente no campo da neurogênese hipocampal adulta, a quantificar novas células com mais precisão. Esperamos que este esforço tenha sido útil para a comunidade científica e facilite o ajuste do estudo da proliferação celular pela técnica de imuno-histoquímica.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Gostaríamos de agradecer ao Sr. Miguel Burgos e Gustavo Lago pela prestação de assistência técnica. Também queremos agradecer à Dra. Clorinda Arias, à Dra. Karla Hernandez e ao Dr. Oscar Galicia por seu apoio gentil no fornecimento de reagentes e material. Agradecemos também à División de Investigación y Posgrado da Universidad Iberoamericana Ciudad de México por fornecer financiamento para a realização deste trabalho e por cobrir as despesas de produção de vídeo.
Materiais
| Name | Company | Catalog Number | Comments |
| REAGENT PREPARATION AND SETUP | |||
| Donor Horse Serum | BioWest | S0900 | Blocking and incubation solutions in PBS |
| Paraformaldehyde reagent grade, crystalline (PFA) | Sigma-Aldrich | P6148 | toxic, flammable |
| Potassium Chloride | Sigma-Aldrich | 746436-500G | |
| Potassium Phosphate, monobasic | J.T Bker | 3246-01 | |
| Sacarose | J.T Baker | 4072-01 | |
| Sodium Chloride | Meyer | 2365-500G | |
| Sodium Hydroxide | Sigma-Aldrich | S5881-500G | Corrisive, to calibrate pH |
| Sodium Phophate Dibasic | Sigma-Aldrich | S9763-5KG | |
| Triton-x 100 | Sigma-Aldrich | T8787 | |
| THYMIDINE ANALOGUE BRDU ADMINISTRATION | |||
| 5-Bromo-2′-deoxyuridine, BrdU | Sigma-Aldrich | B9285 | toxic (mutagenic, teratogenic) |
| 23–27G hypodermic needle | BD PrecisionGlide | ||
| Saline solution | PiSA | 30130032 | |
| Syringes 1 mL | NIPRO | ||
| TISSUE PREPARATION | |||
| 15-ml polypropylene conical tube | Thermo Scientific | 339650 | |
| 50-ml polypropylene conical tube | Thermo Scientific | 339652 | |
| Dissecting tools | |||
| Guillotine | Stoelting | ||
| Microtome Cryostat | MICROM | HM525 | |
| Netwell 15 mm polyester mesh membrane inserts | Corning | 3477 | pre-loaded in 12-well culture plates |
| Netwell plastic 12-well carrier kit | Corning | 3520 | for 15 mm polyester mesh membrane inserts |
| Netwell plastic 6-well carrier kit | Corning | 3521 | |
| Perfusion pump | Cole-Parmer | 7553-70 | |
| Shaker | IKA | ROKCER 3D Digital | |
| IMMUNOSTAINING | |||
| Cresyl violet | Sigma-Aldrich | C5042 | 1%, Light sensitive |
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | Vector Laboratories | SK-4100 | carcinogenic, light sensitive |
| Hydochloric Acid | J.T.Baker | 9535-05 | Corrosive, to calibrate pH |
| Hydrogen Peroxide, 50% | Meyer | 5375-1L | Toxic, oxidative |
| Permount Mounting Medium | Fisher Chemical | SP15-500 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | Light sensitive |
| VECTASTAIN® Elite® ABC Kit Peroxidase (HRP) | Vector Laboratories | PK-6100 | enzymatic, avidin/biotin based amplification system |
| Primary antibodies | |||
| Anti-GFAP antibody produced in rabbit | Sigma-Aldrich | HPA056030 | 1:500 |
| Monoclonal Anti-BrdU antibody produced in Mouse | Sigma-Aldrich | B2531 | 1:250 |
| Secondary antibodies | |||
| Biotin-SP (long spacer) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-065-151 | 1:250 |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, HRP | Invitrogen | G-21040 | 1:1000 |
| Goat Anti-Mouse IgG (whole molecule), TRITC | Sigma-Aldrich | T5393 | 1:250 |
| Goat Anti-Rabbit IgG (H+L) Cross-Adsorbed, FITC | Invitrogen | F-2765 | 1:250 |
| Streptavidin, Cy3 | Vector Laboratories | SA-1300 | 1:250 |
| IMAGING AND ANALYSIS | |||
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| CCD-camera | Olympus | UC50 | |
| CellSens Standard software | Olympus | cellSens Standard Edition | Acquisition Software |
| Epifluorescent microscope | Olympus | BX53 | |
| High-pressure 130 W mercury arc lamp | Olympus | U-HGLGPS | |
| low autofluorescence immersion oil | Olympus | MOIL-30 Type F | |
| Micro cover-glasses (VWR, cat no 48404 454; 24 60 mm) | |||
| Microscope slides (VWR, cat no 48323-185; 76 26 mm) | |||
| U-FBW filter cube | Olympus | U-FBW | excitation 460 - 495 nm, dichroic mirror 505 nm, suppression 510 nm |
| U-FGW filter cube | Olympus | U-FGW | excitation 530 - 550 nm, dichroic mirror 570 nm, suppression 575 nm |
| U-FUW filter cube | Olympus | U-FUW | excitation 340 - 490 nm, dichroic mirror 410 nm, suppression 420 nm |
Referências
- Altman, J. Are new neurons formed in the brains of adult mammals. Science. 135 (3509), 1127-1128 (1962).
- Altman, J., Das, G. D. Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. The Journal of Comparative Neurology. 124 (3), 319-335 (1965).
- Miller, M. W., Nowakowski, R. S. Use of bromodeoxyuridine-immunohistochemistry to examine the proliferation, migration and time of origin of cells in the central nervous system. Brain Research. 457 (1), 44-52 (1988).
- Eriksson, P. S., et al. Neurogenesis in the adult human hippocampus. Nature Medicine. 4 (11), 1313-1317 (1998).
- Filippov, V., et al. Subpopulation of nestin-expressing progenitor cells in the adult murine hippocampus shows electrophysiological and morphological characteristics of astrocytes. Molecular and Cellular Neuroscience. 23 (3), 373-382 (2003).
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends in Neurosciences. 27 (8), 447-452 (2004).
- Matiašová, A., et al. Flow cytometric determination of 5-bromo-2'-deoxyuridine pharmacokinetics in blood serum after intraperitoneal administration to rats and mice. Histochemistry and Cell Biology. 142 (6), 703-712 (2014).
- Von Bohlen Und Halbach, O. Immunohistological markers for proliferative events, gliogenesis, and neurogenesis within the adult hippocampus. Cell and Tissue Research. 345 (1), 1-19 (2011).
- Sage, D., et al. DeconvolutionLab2: An open-source software for deconvolution microscopy. Methods. 115, 28-41 (2017).
- Manz, W., Arp, G., Schumann-Kindel, G., Szewzyk, U., Reitner, J. Widefield deconvolution epifluorescence microscopy combined with fluorescence in situ hybridization reveals the spatial arrangement of bacteria in sponge tissue. Journal of Microbiological Methods. 40 (2), 125-134 (2000).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with imageJ. Biophotonics International. 11 (7), 36-41 (2004).
- . 2D and 3D Fluorescence Deconvolution Manual Available from: https://pages.stolaf.edu/wp-content/uploads/sites/803/2016/12/Giannini_Giannini_Deconvolution_Manual_20161215.p (2016)
- Taupin, P. BrdU immunohistochemistry for studying adult neurogenesis: Paradigms, pitfalls, limitations, and validation. Brain Research Reviews. 53 (1), 198-214 (2007).
- Revilla, V., Jones, A. Cryostat sectioning of brains. International Review of Neurobiology. 47, 61-70 (2002).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in brain research. 163, 3-22 (2007).
- Eadie, B. D., Redila, V. A., Christie, B. R. Voluntary exercise alters the cytoarchitecture of the adult dentate gyrus by increasing cellular proliferation, dendritic complexity, and spine density. Journal of Comparative Neurology. 486 (1), 39-47 (2005).
- Leal-Galicia, P., Romo-Parra, H., Rodríguez-Serrano, L. M., Buenrostro-Jáuregui, M. Regulation of adult hippocampal neurogenesis exerted by sexual, cognitive and physical activity: An update. Journal of Chemical Neuroanatomy. 101, 101667 (2019).
- Gould, E. How widespread is adult neurogenesis in mammals. Nature Reviews Neuroscience. 8 (6), 481-488 (2007).
- Ngwenya, L. B., Peters, A., Rosene, D. L. Light and electron microscopic immunohistochemical detection of bromodeoxyuridine-labeled cells in the brain: Different fixation and processing protocols. Journal of Histochemistry and Cytochemistry. 53 (7), 821-832 (2005).
- Ansorg, A., Bornkessel, K., Witte, O. W., Urbach, A. Immunohistochemistry and multiple labeling with antibodies from the same host species to study adult hippocampal neurogenesis. Journal of Visualized Experiments. (98), e52551 (2015).
- Tuttle, A. H., et al. Immunofluorescent detection of two thymidine analogues (CldU and IdU) in primary tissue. Journal of Visualized Experiments. (46), e2166 (2010).
- Tischler, A. S. Triple immunohistochemical staining for bromodeoxyuridine and catecholamine biosynthetic enzymes using microwave antigen retrieval. Journal of Histochemistry and Cytochemistry. 43 (1), 1-4 (1995).
- Taupin, P. Protocols for studying adult neurogenesis: Insights and recent developments. Regenerative Medicine. 2 (1), 51-62 (2007).
- Leuner, B., Glasper, E. R., Gould, E. Thymidine analog methods for studies of adult neurogenesis are not equally sensitive. Biosystems. 517 (2), 123-133 (2010).
- Magavi, S. S., MacKlis, J. D. Identification of newborn cells by BrdU labeling and immunocytochemistry in vivo. Methods in Molecular Biology. 438, 335-343 (2008).
- Kempermann, G., Gast, D., Kronenberg, G., Yamaguchi, M., Gage, F. H. Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice. Development. , 391-399 (2003).
- Ramos-Vara, J. A., Beissenherz, M. E. Optimization of immunohistochemical methods using two different antigen retrieval methods on formalin-fixed, paraffin-embedded tissues: Experience with 63 markers. Journal of Veterinary Diagnostic Investigation. 12 (4), 307-311 (2000).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Wojtowicz, J. M., Kee, N. BrdU assay for neurogenesis in rodents. Nature Protocols. 1 (3), 1399-1405 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados